Method Article
Design, síntese e propriedades fotoquímicas de compostos de Caged clicáveis
Neste Artigo
Resumo
Um protocolo para a síntese e a medida das propriedades fotoquímica de compostos Caged modulares com as metades clicáveis é apresentado.
Resumo
Os compostos Caged permitem a manipulação foto-negociada da fisiologia da pilha com definição armazenamento elevada. No entanto, a limitada diversidade estrutural dos grupos de enjaulamento atualmente disponíveis e as dificuldades na modificação sintética sem sacrificar suas eficiências de fotolise são obstáculos para ampliar o repertório de compostos enjaulados para células ao vivo Aplicativos. Como a modificação química dos grupos de caging foto-tipo cumarina é uma abordagem promissora para a preparação de compostos enjaulados com diversas propriedades físicas e químicas, nós relatamos um método para a síntese de compostos Caged clicáveis que podem ser modificados facilmente com várias unidades funcionais através do cobre (I)-catalisada Huisgen ciclização. A molécula modular da plataforma contem um grupo (de 6-Bromo-7-hydroxycoumarin-4-YL) methyl (BHC) como um grupo foto-caging, que exiba uma eficiência elevada da fotolise comparada àquelas dos 2-nitrobenzyls convencionais. Os procedimentos gerais para a preparação de compostos Caged clicáveis que contêm aminas, álcoois, e carboxilatos são apresentados. As propriedades adicionais tais como a solubilidade da água e a habilidade de segmentação da pilha podem prontamente ser incorporadas em compostos Caged clicáveis. Além disso, as propriedades físicas e fotoquímicas, incluindo a produtividade quântica de fotólise, foram mensuradas e foram encontradas como superiores àquelas dos compostos Caged BHC correspondentes. O protocolo descrito poderia, portanto, ser considerado uma solução potencial para a falta de diversidade estrutural nos compostos de Caged disponíveis.
Introdução
Os compostos Caged são moléculas sintéticas projetadas cujas as funções originais são mascaradas temporally por grupos protegendo foto-removíveis covalentemente Unidos. Curiosamente, os compostos Caged de moléculas biologicamente relevantes proporcionam um método indispensável para o controle espaciotemporal da fisiologia celular1,2,3,4,5 ,6. Em 1977, Engels e Schlaeger relataram o éster 2-nitrobenzílico do acampamento como uma membrana permeável e derivado fotolábil do acampamento7. No ano seguinte, Kaplan relatou o éster etílico 1-(2-nitrofenil) de ATP (NPE-ATP) e nomeou este composto "Caged" ATP8. Desde então, uma variedade de grupos de proteção fotoquimicamente removíveis, como 2-nitrobenzyls, p-hidroxifenacyls9, 2-(2-Nitrophenyl) Ethyls10,11, 7-nitroindolin-1-YLS12, 13, e (cumarina-4-YL) os methyls14,15,16 foram usados para a preparação de compostos Caged.
A síntese de compostos Caged com propriedades adicionais desejáveis tais como a permeabilidade da membrana, a solubilidade da água, e a habilidade de segmentação celular seria esperada facilitar aplicações biológicas da pilha. Uma vez que as propriedades físicas e fotoquímicas dessas moléculas dependem principalmente da estrutura química dos grupos de proteção fotoquimicamente removíveis usados para prepará-los, um repertório diversificado de grupos de foto-caging é necessário. Entretanto, a diversidade estrutural de grupos de enjaulamento atualmente disponíveis que exibem eficiências elevadas do fotólise é limitada. Isso pode ser um obstáculo para aumentar o uso de compostos enjaulados.
Para abordar esse problema, o repertório de grupos de foto-caging foi expandido pela modificação química de grupos de proteção fotororemovable existentes ou o projeto de novos cromossomos fotolabile com propriedades fotofísicas e fotoquímicas superiores. Exemplos incluem nitrodibenzofurano (ndbf)17, [3-(4, 5-dimetoxi-2-nitrofenil)- -2-butilo] (dmnpb)18,19, umafotogaiola de 2-nitrobenzilo sensível ao cálcio20,coumarinylmethyls substituídos (DEAC45021 , Deadccm22, 7-azetidinyl-4-methylcoumarin23, e estiril cumarinas24), derivados de cianina (cyet-Pan)25, e derivados de bodipy26,27.
Além, nós desenvolvemos previamente o grupo (de 6-Bromo-7-hydroxycoumarin-4-YL) methyl (BHC) e sintetizamos com sucesso vários compostos Caged dos neurotransmissores28, segundos mensageiros29,30, e oligonucleotídeos31,32,33 exibindo grandes secções transversais de excitação de um e dois fótons. Se as propriedades adicionais podem ser instaladas facilmente nos grupos de enjaulamento sem comprometer sua fotossensibilidade, a seguir o repertório de compostos Caged pode ser expandido34,35,36, 37,38,39. Nós projetamos conseqüentemente os compostos Caged modulares que compreendem três porções, a saber o grupo de BHC como um núcleo foto-responsivo, punhos químicos para a instalação de funcionalidades adicionais, e as moléculas que devem ser mascaradas40, 41.
Assim, este artigo fornece um método prático para a preparação de compostos Caged de moléculas biologicamente relevantes. O presente protocolo descreve métodos para a elaboração de uma plataforma clicável para grupos de foto-caging, a introdução de funcionalidades adicionais para ampliar o repertório de compostos enjaulados, a mensuração de seus físicos e fotoquímicos Propriedades e a segmentação seletiva do tipo de célula de um composto de Caged clicável para um aplicativo celular adicional.
Protocolo
1. síntese do grupo de enjaulamento modular pabhc para compostos Caged clicáveis28,41
-
Preparação de (6-Bromo-7-hidroxicoumarin-4-YL) cloreto de metilo (BHC-CH2CL)
- Coloque 4-bromoresorcinol (9,742 g, 51,5 mmol) em um balão de fundo redondo de 100 mL equipado com uma barra de agitador.
- Adicionar conc. H2so4 (98%, 30 ml) ao balão e agitar a mistura para dissolver.
- Adicionar etil 4-cloracetoacetato (10 mL, 74 mmol) Dropwise.
- Continuar mexendo a mistura à temperatura ambiente durante 5 dias.
- Separadamente, Coloque cubos de gelo esmagados (~ 200 mL) num balão de 500 mL de Erlenmeyer.
- Despeje a mistura de reação no gelo e mexa vigorosamente durante 30 min até que um precipitado finamente em pó seja obtido.
- Colete o precipitado através de filtração a vácuo. Lave o precipitado castanho claro com água cinco vezes.
- Seque o precipitado vácuo durante a noite para produzir BhcCH2CL como um pó castanho claro (13,57 g, 46,9 mmol).
-
Preparação de (6-Bromo-7-hydroxycoumarin-4-YL) metanol (BhcCH2Oh)
- Coloque o BhcCH2CL preparado (1,1440 g, 3,95 mmol) e 1 M HCl (300 ml) em um balão de fundo redondo de 1 L equipado com um condensador Dimroth. Agitar a mistura a 140 ° c durante 5 dias. Após este tempo, arrefecer a mistura à temperatura ambiente.
- Retire a água da reacção por evaporação rotativa vácuo para produzir BhcCH2Oh (1) como um pó castanho claro (1, 359 g, 3,82 mmol, 97% rendimento).
Nota: o uso de 250 mL de HCl de 1 M por 1 g de BhcCH2CL dá um resultado satisfatório.
-
Preparação de paBhcCH2Oh (2) através da reação de Mannich
- Coloque paraformaldeído (446,4 mg, 14,9 mmol) num balão de fundo redondo de 50 mL. Adicionar etanol anidro (5 mL) e N-metilpropargylamina (1,25 ml, 14,8 mmol) ao balão.
- Mexa a mistura à temperatura ambiente durante 1 h uma atmosfera de ar.
- Adicionar BhcCH2Oh (1) (1,367 g, 5, 4 mmol) ao balão. Aqueça a mistura a 80 ° c com um aparelho de aquecedor de blocos e continue mexendo a mistura a 80 ° c durante 2 h uma atmosfera de ar.
- Pare o aquecedor do bloco e resfrie a mistura de reação à temperatura ambiente.
- Colete o precipitado castanho-amarelo claro resultante por filtração a vácuo. Lave o precipitado duas vezes com uma pequena quantidade de etanol anidro (1 mL cada vez).
- Retire o excesso de etanol vácuo para produzir paBhcCH2Oh (2) (1,393 g, 3,96 mmol).
2. preparação de compostos de Caged clicáveis
Nota: os seguintes procedimentos podem ser aplicados à preparação de outros compostos Caged clicáveis que contêm grupos funcionais do hydroxyl, do amino, e do carboxilato.
-
Procedimento geral 1: preparação de uma amina Caged clicável
- Coloque paBhcCH2Oh (2) (709,6 mg, 2, 2 mmol) e n,n '-carbonilo diimidazol (CDI, 397,6 mg, 2,45 mmol) em um balão de fundo redondo de 30 ml. Adicionar CH2CL2 (6 ml) e agitar a solução à temperatura ambiente durante 1 h.
- Adicionar 4-dimethylaminopyridine (4-DMAP, 324,8 mg, 2,66 mmol) e tert-butil (6-aminohexyl) carbamato (533,1 mg, 2,46 mmol). Agitar a solução à temperatura ambiente durante 3 h.
- Retire o solvente e outros materiais voláteis utilizando um evaporador rotativo vácuo. Purify o resíduo diretamente usando a cromatografia da coluna do flash do gel de silicone.
-
Procedimento geral 2: preparação de um álcool enjaulado clicável
- Coloque paclitaxel (PTX, 48,7 mg, 0, 57 mmol) num balão de fundo redondo de 30 mL equipado com uma torneira de três vias e um balão ar. Adicionar ch seco2CL2 (1 ml), 4-DMAP (17,1 mg, 0,14 mmol), e 4-Nitrophenyl cloroformato (26,0 mg, 0,13 mmol).
- Mexa a solução em temperatura ambiente para 2,5 h uma atmosfera ar.
- Adicionar 4-DMAP (15,7 mg, 0,13 mmol) e paBhcCH2Oh (2) (39,1 mg, 0,111 mmol) para a solução. Continuar mexendo a mistura à temperatura ambiente durante 17 h.
- Adicionar CHCl3 (10 ml) e 15% aquosa NaHCO3 (5 ml) para a mistura. Agitar a mistura vigorosamente durante aproximadamente 3 min. Retire a camada aquosa com uma pipeta.
- Adicionar 0,5 M de ácido cítrico (5 mL) ao frasco contendo a camada orgânica. Mexa a mistura e retire a camada aquosa como acima.
- Separe a camada orgânica usando uma coluna de separação de fase. Retire os solventes com um evaporador rotativo vácuo. Purify o produto usando a cromatografia de coluna do flash do gel de silicone padrão.
-
Procedimento geral 3: preparação de um ácido carboxílico Caged clicável
- Dissolva o ácido aracidônico (33,0 μL, 0,100 mmol), paBhcCH2Oh (2) (39,6 mg, 0,112 mmol) e 4-DMAP (14,1 mg, 0,115 mmol) em ch seco2CL2 (2 ml). Adicionar n,n ʹ-diisopropylcarbodiimide (Dipc, 17,0 μl, 0,110 mmol) e agitar a solução à temperatura ambiente durante 140 min.
- Retire o solvente vácuo. Purify o resíduo diretamente usando a cromatografia da coluna do flash do gel de silicone.
3. instalação de uma unidade funcional nos compostos Caged clicáveis
- Dissolva o sulfato de cobre (II) pentahidratado (249 mg) em água trocada de íon (IEW, 10 mL) para dar uma solução de 0,1 M CuSO4 .
- Dissolver 2 ʹ-paBhcmoc-PTX (8,0 mg, 6,5 μmol), Tris (3-hidroxipropyltriazolylmethyl) Amine (THPTA, 17,5 mg, 40,3 μmol), l-ascorbato de sódio (162,4 MGS, 0,825 mmol), e 15-chloro-3, 6, 9-trioxapentadecyl azida (3,1 MGS, 11 μmol) em um solvente misturado de 0,1 M fosfato tampão (2,5 mL, pH 7,2) e sulfóxido de dimetil (DMSO, 0,5 mL).
- Adicione a solução de 0,1 M CuSO4 (81,2 μL, 8,1 μmol) à mistura de reacção. Mexa a mistura à temperatura ambiente durante 80 min. Monitore o progresso da reação usando a cromatografia líquida de capacidade elevada (HPLC).
- Dissolva os precipitados adicionando uma solução de acetonitrila/água de 75% (3,5 mL). Aplique a solução resultante diretamente ao sistema semi-preparative da HPLC para purificar o produto desejado.
Nota: a solubilização da mistura de reacção pela adição de tert-butanol pode acelerar a progressão da reacção.
4. reação uncaging photolytic dos compostos Caged
- Preparação das soluções de ações
- Dissolva o composto Caged desejado (5 μmol) no DMSO (500 μL) para preparar uma solução de estoque de 10 mM. Dispense uma alíquota de cada solução (10 μL) num tubo de microcentrífuga de 1,5 mL e guarde-a num congelador (− 20 ° c) até um pouco antes da utilização.
- 6 mm K3[Fe (C2O4)3] (100 ml): dissolver O ferrioxalato de potássio recristalizado (0,295 g, 0,675 mmol) em 80 ml de água. Adicionar 0,5 M H2so4 (10 ml) e uma quantidade apropriada de iew para compensar o volume para 100 ml.
Nota: o ferrioxalato de potássio deve ser purificado através de recristalização a partir de água quente e armazenado no escuro. O ferrioxalato de potássio recrystallized é obtido como o trihidrato; Portanto, sua fórmula é K3[Fe (C2o4)3] · 3h2o e um peso de fórmula de 491,24 deve ser considerado durante a preparação da solução de estoque. Verifique a pureza da solução de 6 mM medindo a sua absorção a 510 nm. Se a absorvência é < 0.02, é apropriado para o uso no experimento. - 0,1% tampão-Phen (30 mL): dissolver NaOAc · 3H2O (7,35 g), 1, 10-phenanthroline (Phen) · H2O (30 MGS), e conc. h2assim4 (0,9 ml) em iew (20 ml). Adicione IEW para compensar o volume para 30 mL.
Nota: a solução contém 1,8 M NaOAc, 0,54 M H2so4e 0,1% 1, 10-phenanthroline.
- Medição do número de fótons utilizando actinometria de ferrioxalato
- Coloque 6 mM K3[Fe (C2O4)3] (V1 L) em uma cubeta de quartzo. Irradiar a solução com 350 nm de luz para 5 s.
- Transfira a solução irradiada a uma cubeta de Pyrex com um comprimento do trajeto de l [cm].
- Adicionar 0,1% tampão-Phen (V2 L) à solução de amostra irradiada e misturar bem com pipetagem. Medir a absorvância da amostra em 510 nm. Calcule a variação média de absorção por unidade de tempo (ΔA510 [s− 1]).
- Calcule o número de moles gerados FE2 + íons por unidade de tempo de acordo com a seguinte equação:
NFE2 + [mol s− 1] = ((v1 + v2) [l] × ΔA510 [s− 1])/(l [cm] × ε510 [l mol− 1 cm− 1]),
onde (v1 + v2) é o volume da amostra para a medição de absorção, l é o comprimento do trajeto óptico da cubeta, e ε510 é a absortividade molar do FE2 +- complexo de Phen em 510 nanômetro.
Nota: nas condições experimentais típicas, os valores de v1 = 2,0 × 10− 3 l, v2 = 0,33 × 10− 3 l, l = 1,0 cm e ε510 = 1,1 × 104 l mol− 1 foram utilizados cm− 1 . - Calcule o número de moles de fótons que atingem a amostra (I0) usando a seguinte fórmula:
I0 [Einstein cm− 2 s− 1] = NFE2 +/Φ350
onde Φ 350 é a eficiência quântica da fotorredução do ferrioxalate em 350 nm.
Nota: embora a eficiência quântica do actinômetro de ferrioxalato de potássio em 350 nm não seja relatada, o valor relatado de 1,2542 a 358 nm foi empregado.
- Medições de eficiência quântica a 350 nm
- Diluir a solução de amostra (DMSO, 10 μL) com tampão K-MOPS (pH 7,2, 10 mL) para dar uma solução de 10 μM em K-MOPS contendo 0,1% DMSO.
Nota: o tampão de K-MOPS consistiu no KCl de 100 milímetros e no ácido propanesulfonic de 10 milímetros 3-(N-morpholino) (MOPS) titulado ao pH 7,2 com Koh. - Transfira uma alíquota da solução (V1 L) para a mesma cubeta usada na leva do actinometer químico. Irradiar a solução de exemplo usando a mesma configuração descrita na etapa 4.2.1.
- Retire uma alíquota (50 μL) da solução irradiada periodicamente e analise o uso de HPLC.
- Determine o tempo de irradiação, em segundos, em que 90% do material inicial reagiu (t90%) por parcelas de encaixe do desaparecimento dependente do tempo do material de partida.
Nota: a absorvância da amostra irradiada deve ser mantida a < 0,1 para que a filtração interna da radiação possa ser ignorada. É desejável que o consumo fotolítico do material de partida possa ser aproximado por decaimento único-exponencial para que não haja efeito secundário indesejado que interfere no processo de fotolise. - Calcule o rendimento quântico do desaparecimento (Φdis) usando a seguinte equação28:
Φdis = 1/(t90% × I0 × σ350)
onde t90% [s] é o tempo de irradiação em que 90% do material de partida foi consumido , I0 [Einstein cm− 2 s− 1] é o número de moles de fótons, e σ350 [cm 2 mol− 1] é o coeficiente de extinção Decádico da amostra em 350 nm.
Nota: σ350 [cm2 mol− 1] = 103ε350 [M− 1 cm− 1].
- Diluir a solução de amostra (DMSO, 10 μL) com tampão K-MOPS (pH 7,2, 10 mL) para dar uma solução de 10 μM em K-MOPS contendo 0,1% DMSO.
5. segmentação de um composto de Caged clicável com um ligante halotag
Nota: antes da utilização, manter as células HeLa no meio de Eagle modificado de Dulbecco (DMEM, glicose baixa, piruvato de sódio, l-glutamina) suplementado com soro bovino fetal a 10% (FBS) contendo 1% de antibióticos (sulfato de estreptomicina, penicilina G e anfotericina) em 37 ° c e 5% CO2.
- Remova o meio e Trypsinize as pilhas tratando com o ácido do trypsin-ethylenediaminetetraacético (EDTA, 1 mL) em 37 ° c por 1 minuto. Adicionar DMEM (4 mL) às células e re-suspender as células por pipetagem suavemente. Semente aproximadamente 5 × 105 pilhas por o prato em pratos inferiores de vidro de 35 milímetros em DMEM (2 ml) 24 h antes do transfection.
- Para quatro pratos, em um tubo de microcentrífuga de 1,5 mL, diluir o DNA plasmídeo (pcDNA3-Halo-EGFR, 14 μg) no meio sérico reduzido (700 μL). Separadamente, diluir o reagente de lipofecção (5 μL) no meio sérico reduzido (150 μL) em cada um dos quatro tubos e permitir-lhes estar à temperatura ambiente durante 5 min.
- Adicione uma porção do DNA plasmídeo diluído (150 μL) a cada uma das amostras de reagente de lipofecção diluídas. Incubar à temperatura ambiente durante 5 min.
- Depois de manter as células a 37 ° c e 5% CO2 para 24 h, aspirar o DMEM e enxaguar as células com tampão fosfato salina (PBS, 2 ml). Adicione o meio sérico reduzido (1,5 mL).
- Adicione o complexo do reagente do plasmídeo-lipofection (150 μL) a cada prato. Manter as células a 37 ° c e 5% CO2 para 48 h.
- Aspirar o meio, adicionar uma porção de DMEM recém-preparados (1 mL) contendo 2 μM de paBhc-hex-FITC/Halo, e incubar as células a 37 ° c e 5% CO2 por 30 min.
- Aspirar o meio contendo o composto enjaulado e enxaguar as células duas vezes com PBS + (1 mL por enxaguamento) para remover quaisquer compostos não acoplados. Adicione o meio sérico reduzido (500 μL) e incubar as células a 37 ° c e 5% CO2 por 30 min para remover os compostos que entraram nas células.
Nota: o PBS + é soro fisiológico com tampão fosfato suplementado com 2 mM de CaCl2 e 1 mm MgCl2. - Retire o meio e enxague as células duas vezes com PBS + (1 mL). Adicione uma porção de um meio (1 mL) que não contenha fenol vermelho. Grave imagens de fluorescência por microscopia de fluorescência confocal de varredura a laser.
6. modulação fotomediada de uma localização da quinase usando um composto Caged clicável
Nota: antes da utilização, manter as células CHO-K1 no meio do presunto F-12 suplementado com 10% FBS a 37 ° c e 5% CO2.
- Prepare uma solução de trabalho de 100 × (1 mM) de paBhc-AA (5) em DMSO.
Nota: uma solução conservada em estoque de 10 milímetros do composto é preparada e armazenada em um congelador (-20 ° c). - Semente aproximadamente 5 × 105 pilhas por o prato em pratos inferiores de vidro de 35 milímetros em DMEM (2 ml) 24 h antes do transfection.
- Transfect CHO-K1 células com uma codificação plasmídeo para GFP-DGKγ 48 h antes dos experimentos uncaging.
Nota: a transfecção é realizada de acordo com as etapas 5.2 – 5.5. - Substitua o meio por um meio sérico reduzido (2 mL). Adicionar a solução de trabalho 100 × paBhc-AA (20 μL) e incubar as células a 37 ° c e 5% CO2 para entre 5 min e 1 h.
Nota: o tempo de carregamento depende do composto empregado. - Coloque as células na fase objetiva de um microscópio fluorescente invertido equipado com um iluminador de fluorescência de fonte de luz dupla.
- Tome uma imagem fluorescente cada 10 s. irradie as pilhas com a luz 330-385 nanômetro através de um objetivo do microscópio para um momento apropriado. Alternativamente, irradiar as células com luz de 405 nm usando uma lâmpada xe através de fibras de quartzo flexíveis.
- Continue a gravar imagens fluorescentes por 10 min.
Resultados
Os compostos Caged clicáveis de algumas moléculas biologicamente interessantes, incluindo o ácido araquidônico e o paclitaxel, foram sintetizados com sucesso (Figura 1)28,41. Propriedades adicionais, como a solubilidade em água e a capacidade de segmentação celular, foram introduzidas em paBhcmoc-PTX através da ciclização de Huisgen de cobre (I) catalisada (reação "click") (Figura 2). Estes ptxs enjaulados clicáveis foram então photolyzed para produzir seus ptxs do pai em cima da irradiação em 350 nanômetro (Figura 3), e as propriedades físicas e fotoquímica dos compostos Caged clicáveis são resumidas na tabela 1. Os rendimentos quânticos de compostos enjaulados clicáveis 2 ʹ-GLC-paBhcmoc-PTX (φdis 0,14) e pabhc-AA (φdis 0, 83) foram mais do dobro dos compostos convencionais de Caged BHC 2 ʹ-bhcmoc-PTX (φdis 0, 40) e BHC-AA (Φdis 0, 38)43. Além, um solubility de água melhorado foi observado para 2 ʹ-GLC-paBhcmoc-PTX, que contem uma fração da glicose.
Em experimentos de células ao vivo, o direcionamento de paBhc-hex-FITC/Halo para as células de mamíferos cultivadas transientemente expressando uma proteína de fusão de uma proteína HaloTag e receptor de fator de crescimento epidérmico (EGFR) foi conseguido com sucesso. A fluorescência verde da fração fluoresceina de paBhc-hex-FITC/Halo foi observada na membrana celular (Figura 4). A modulação foto-negociada da localização Subcellular de uma quinase foi conseguida usando um composto Caged de paBhc. O translocação do diacilglicerol quinase γ (dgkγ) foi relatado para ser ativado na presença de ácido araquidônico (AA)44. As pilhas de CHO-K1 que expressam transientemente GFP-DGKγ foram tratadas com o AA ou o paBhc-AA (5). A adição de AA causou a modulação da localização subcelular de DGKγ (Figura 5a, B). Alterações semelhantes na localização de DGKγ foram observadas para as células tratadas com paBhc-AA após exposição à luz UV (Figura 5C, D).
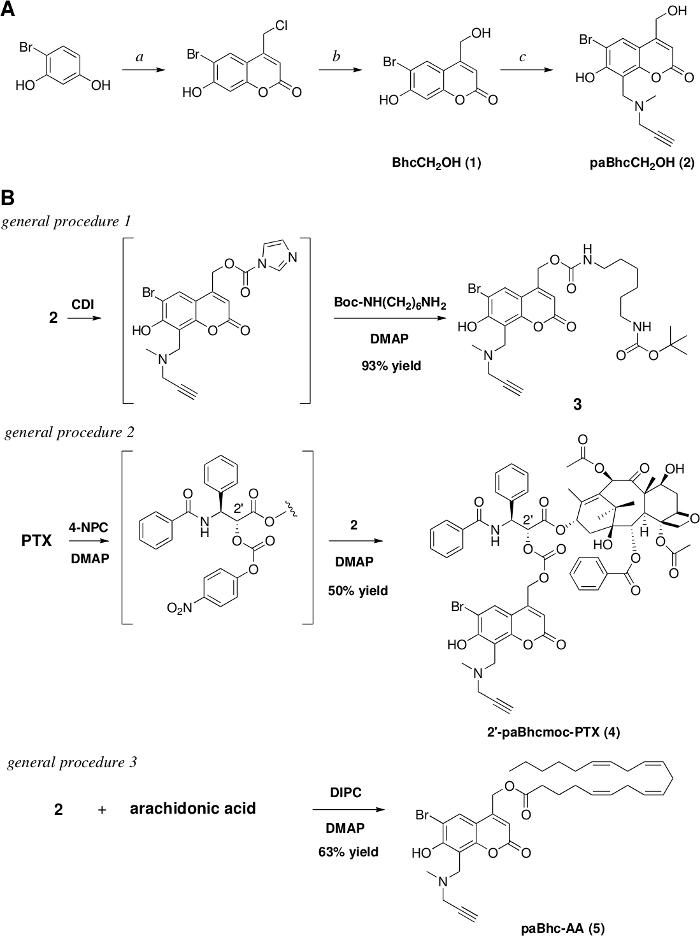
Figura 1: preparação dos compostos Caged clicáveis.
A) reagentes e condições: a. etil 4-cloracetoacetato/conc. H2assim4/RT/7 dias/91% rendimento, b. 1 M HCL/refluxo/3 dias/97% rendimento. c. N-methylpropargylamine/HCHO/EtOH, em seguida, adicione (1) e aqueça no refluxo para 17 h/79% rendimento. (B) Sínteses da amina Caged clicável, PTX e ácido araquidônico. Por favor clique aqui para ver uma versão maior desta figura.
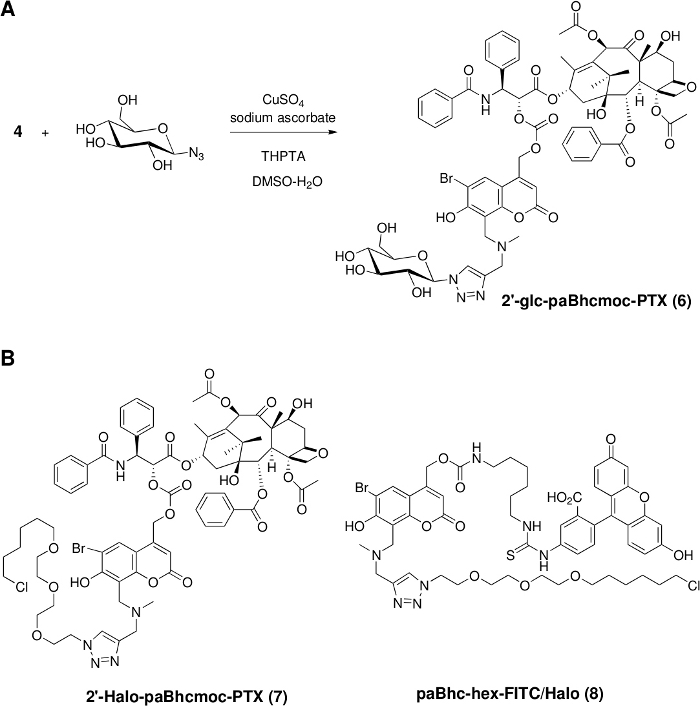
Figura 2: instalação de unidades funcionais em compostos de Caged clicáveis.
(A) síntese de um PTX Caged hidrossolúvel através da ciclização de huisgen catalisada por cobre (I). (B) estruturas de compostos enjaulados clicáveis que contenham o ligante halotag para segmentação celular. Por favor clique aqui para ver uma versão maior desta figura.
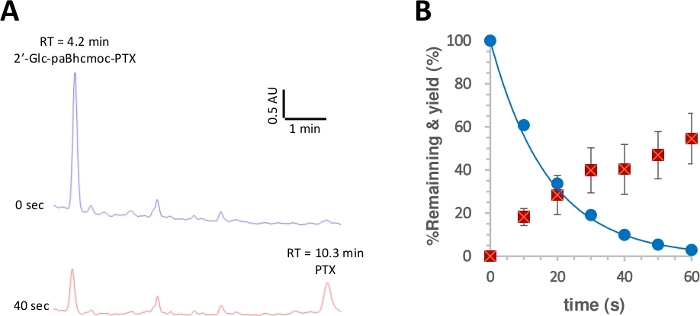
Figura 3: fotólise de 2 ʹ-GLC-paBhcmoc-PTX (6).
Amostras (10 μM) em solução de K-MOPS (pH 7,2) foram irradiadas a 350 nm. (A) traços típicos da HPLC para a fotólise de 6 (medido em 254 nanômetro). As amostras foram analisadas no tempo de irradiação especificado. (B) curso de tempo para a fotólise de 6. Círculos azuis mostram o consumo de 6. A linha sólida mostra a curva de mínimos quadrados adequada para um exponencial de decomposição simples para 6. Os quadrados vermelhos mostram o rendimento de PTX. As barras de erro representam o desvio padrão (± SD). Por favor clique aqui para ver uma versão maior desta figura.
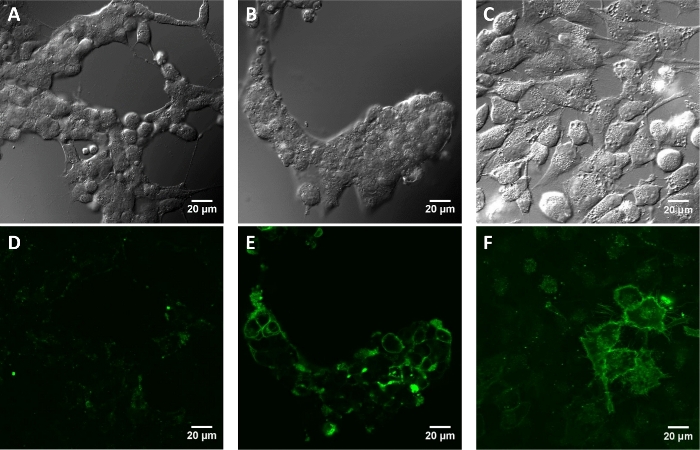
Figura 4: imagens de fluorescência de células de mamíferos cultivadas incubadas com paBhc-hex-FITC/halo (8).
As células transfectadas com pcDNA3-Halo-EGFR foram incubadas com uma solução de 2 μM de composto 8 a 37 ° c por 30 min. As imagens foram obtidas após a lavagem repetida com PBS +. Células HEK293T tratadas simuladas (A: imagem de contraste de interferência diferencial (DIC) e imagem D: fluorescência). Células HEK293T (b e e) ecélulas HeLa (c e F) que expressam transientemente Halo-EGFR(b e c: imagens DIC e e e f: imagens de fluorescência ). Por favor clique aqui para ver uma versão maior desta figura.
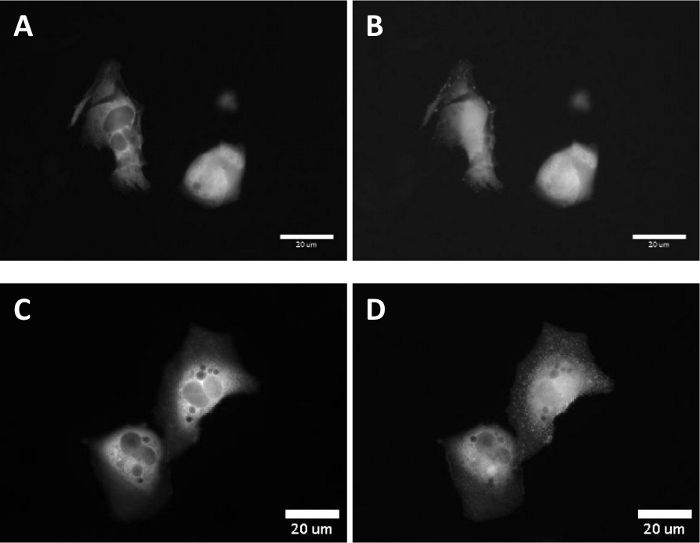
Figura 5: imagens de fluorescência após irradiação UV das células CHO-K1 incubadas com ácido araquidônico BHC Caged. As pilhas de CHO-K1 foram transfected com uma proteína de fusão DGKγ-EGFP.
(A) uma imagem de fluorescência das células transfectadas. (B) 100 s após a adição de uma solução de 10 μm de ácido aracidônico. (C) as células foram incubadas com uma solução de 10 ΜM de pabhc-AA (5) a 37 ° c por 5 min. (D) 100 s após irradiação UV de 20 s (330 – 385 nm). Por favor clique aqui para ver uma versão maior desta figura.
| Compostos | λMax (nm)um | εMax (M-1 cm-1)b | φdisc | εφdisd | Solubilidade (μM)e |
| Ptx | 1,0 | ||||
| 2 '-bhcmoc-PTX | 340 | 10500 | 0, 40 | 400 | 55 |
| 2 '-paBhcmoc-PTX | 359 | 9300 | 0, 59 | 670 | 8,3 |
| 2 '-GLC-Bhcmoc-PTX | 373 | 12300 | 0,14 | 1280 | 650 |
| BHC-AA | 341 | 10800 | 0, 38 | 390 | |
| paBhc-AA | 366 | 10300 | 0, 83 | 750 |
Tabela 1: propriedades físicas e fotoquímicas dos compostos de Caged clicáveis.
a. absorção máxima (nm), b. absortividade molar a λmáx (M− 1 cm− 1), c. Quantum rendimento do desaparecimento dos materiais de partida em 350 nm, d. O produto da absortividade molar e o rendimento quântico do desaparecimento em 350 nm, e. A concentração da solução saturada em K-MOPS (pH 7,2) (μg mL− 1).
Discussão
Nós desenvolvemos previamente os compostos Caged de BHC de várias moléculas biologicamente ativas que exibem eficiências fotolítica elevadas28,45,46,47. Com o objetivo de ampliar o repertório de grupos de enjaulamento BHC, também foram relatadas plataformas de compostos modulares com Caged que podem ser facilmente modificados pela introdução de várias unidades funcionais32,40,41. O presente protocolo, portanto, representa um método para a síntese de um precursor clicável de grupos de enjaulamento BHC que podem ser modificados através da ciclização de huisgen de cobre (I) catalisada. A síntese do precursor clicável, paBhcCH2Oh (2), foi alcançada através de uma sequência de reação de quatro etapas a partir do 4-bromoresorcinol disponível comercialmente (Figura 1a). A vantagem do presente protocolo é que não são necessárias etapas de purificação laboriosas (por exemplo, separações cromatográficas de coluna).
Como precursor clicável paBhcCH2Oh (2) pode ser usado para mascarar vários grupos funcionais, compostos Caged clicáveis de aminas, álcoois e ácidos carboxílicos foram sintetizados usando 2 como o precursor (Figura 1b). As aminas foram modificadas como seus carbamatos enquanto os álcoois foram modificados como seus carbonatos. Nos procedimentos gerais 1 e 2, o CDI foi utilizado para a preparação de carbamatos clicáveis, enquanto o cloroformato 4-nitrofenil foi utilizado para a preparação de carbonatos. Como indicado pelo mecanismo de reação, ambos os reagentes podem ser utilizados para a preparação de carbamatos e carbonatos. Deve-se notar também que o rendimento do composto Caged desejado depende da estrutura química da molécula a ser enjaulada. Outros exemplos podem ser vistos em nossos relatórios anteriores28,30,33,48.
A modificação do clique foi executada então usando uma modificação ligeira do procedimento relatado49. A adição de tris (triazolylmethyl) amina-baseou ligantes é necessário para obter os produtos desejados em bons aos rendimentos elevados. Uma vez que uma variedade de azidas estão prontamente disponíveis tanto de fontes comerciais e de procedimentos de literatura, podemos preparar vários compostos de Caged modulares com propriedades adicionais, como solubilidade em água e capacidade de segmentação celular (Figura 2).
O rendimento quântico da fotólise foi então medido de acordo com um procedimento relatado28,50. A Figura 3 mostra que o consumo fotolítico de 2 ʹ-GLC-paBhcmoc-PTX e a liberação de PTX foram aproximados por decaimento único-exponencial e aumento, respectivamente, sugerindo não haver filtração interna da radiação ou efeitos secundários indesejados. Foram observados melhores rendimentos quânticos de fotolise (φ) e eficiências de Fotolise (εφ) para os compostos de Caged de pabhc clicáveis em comparação com os compostos previamente notificados de BHC (tabela 1)41, 43. uma vez que as eficiências de fotolise (εφ) de compostos Caged BHC são mais de 100 vezes superiores às dos compostos Caged de 2-nitrobenzilo-tipo48, a melhoria acentuada devido à presença de grupos de enjaulamento de pabhc é claramente uma vantagem para este sistema.
Como um experimento de prova de conceito, uma fração hidrófila foi introduzida em 2 ʹ-pabhcmoc-PTX (4) e um ligante de segmentação celular foi introduzido no composto 3 (Figura 2). A solubilidade em água de 2 ʹ-GLC-paBhcmoc-PTX foi 650 vezes maior que a do PTX-mãe (tabela 1). A segmentação celular seletiva foi conseguida usando um sistema do Tag-Probe, e o pabhcmoc-hex-FITC/halo (8) que carrega o ligante de halotag foi alvejado com sucesso à membrana de pilha de pilhas mamífero cultivadas que expressam a proteína de fusão de halotag/EGFR ( Figura 4). A modulação foto-negociada da localização Subcellular de uma quinase foi conseguida igualmente usando um composto enjaulado clicável 5 (Figura 5).
Em conclusão, demonstramos com sucesso um método para a preparação de plataformas clicáveis para compostos foto-Caged de moléculas biologicamente interessantes que podem ser facilmente modificadas com propriedades adicionais, como solubilidade em água e um celular capacidade de segmentação. Uma vez que o grupo de enjaulamento de pabhc pode ser usado para preparar todas as moléculas com grupos funcionais modificáveis, a aplicação do protocolo atual não é limitada às moléculas descritas nisto. Usando uma plataforma modular, a saber o grupo de enjaulamento de pabhc, os compostos Caged desejados podem facilmente ser preparados, e suas propriedades físicas e químicas podem ser moduladas através da modificação do clique.
Divulgações
Não temos nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo JSPS KAKENHI Grant Number JP16H01282 (TF), um Grant-in-Aid para pesquisa científica em áreas inovadoras "dinamismo da memória", e JP19H05778 (TF), "MolMovies".
Materiais
| Name | Company | Catalog Number | Comments |
| acetonitrile, EP | Nacalai | 00404-75 | |
| acetonitrile, super dehydrated | FUJIFILM Wako | 010-22905 | |
| Antibiotic-Antimycotic, 100X | Thermo Fisher | 15240062 | |
| 4-bromoresorcinol | TCI Chemicals | B0654 | |
| N,N’-carbonyldiimidazole | FUJIFILM Wako | 034-10491 | |
| chloroform | Kanto | 07278-71 | |
| Copper (II) Sulfate Pentahydrate, 99.9% | FUJIFILM Wako | 032-12511 | |
| dichloromethane, dehydrated | Kanto | 11338-05 | |
| N,N'-Diisopropylcarbodiimide (DIPC) | TCI Chemicals | D0254 | |
| 4-dimethylaminopyridine | TCI Chemicals | D1450 | |
| dimethylsulfoxide, dehydrated -super- | Kanto | 10380-05 | |
| DMEM - Dulbecco's Modified Eagle Medium | Sigma | D6046-500ML | |
| dual light source fluorescence illuminator, IX2-RFAW | Olympus | ||
| Ethanol (99.5) | FUJIFILM Wako | 054-07225 | |
| Ethyl 4-Chloroacetoacetate | TCI Chemicals | C0911 | |
| Ham's F-12 with L-Glutamine and Phenol Red | FUJIFILM Wako | 087-08335 | |
| hydrochloric acid | FUJIFILM Wako | 087-01076 | |
| inverted fluorescent microscope IX-71 | Olympus | ||
| ISOLUTE Phase Separator, 15 mL | Biotage | 120-1906-D | |
| L-(+)-Ascorbic Acid Sodium Salt | FUJIFILM Wako | 196-01252 | |
| laser scanning fluorescence confocal microscopy, FLUOVIEW FV1200/IX-81 | Olympus | ||
| Lipofectamine 2000 Transfection Reagent | Thermo Fisher | 11668027 | lipofection reagent |
| 3-(N-morpholino)propanesulfonic acid | Dojindo | 345-01804 | MOPS |
| 4-nitrophenylchloroformate (4-NPC) | TCI Chemicals | C1400 | |
| Opti-MEM I Reduced Serum Medium, no phenol red | Thermo Fisher | 11058021 | reduced serum medium contains no phenol red |
| 1,10-Phenanthroline Monohydrate | Nacalai | 26707-02 | |
| Photochemical reactor with RPR 350 nm lamps | Rayonet | ||
| Potassium Trioxalatoferrate (III) trihydrate | FUJIFILM Wako | W01SRM19-5000 | |
| Sodium Acetate Trihydrate | Nacalai | 31115-05 | |
| Sodium Bicarbonate | FUJIFILM Wako | 199-05985 | |
| Sulfuric Acid, 96-98% | FUJIFILM Wako | 190-04675 | |
| Tris(3-hydroxypropyltriazolylmethyl)amine (THPTA) | ALDRICH | 762342-100MG | |
| tri-Sodium Citrate Dihydrate | Nacalai | 31404-15 | |
| Xenon light source, MAX-303 | Asahi Spectra |
Referências
- Mayer, G., Heckel, A. Biologically active molecules with a "light switch". Angewandte Chemistry International Edition. 45 (30), 4900-4921 (2006).
- Bort, G., Gallavardin, T., Ogden, D., Dalko, P. I. From One-Photon to Two-Photon Probes: Caged” Compounds, Actuators, and Photoswitches. Angewandte Chemistry International Edition. 52 (17), 4526-4537 (2013).
- Klan, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113 (1), 119-191 (2013).
- Abe, M., et al. Design and Synthesis of Two-Photon Responsive Chromophores for Near-Infrared Light-Induced Uncaging Reactions. Synthesis-Stuttgart. 49 (15), 3337-3346 (2017).
- Ankenbruck, N., Courtney, T., Naro, Y., Deiters, A. Optochemical Control of Biological Processes in Cells and Animals. Angewandte Chemistry International Edition. 57 (11), 2768 (2018).
- Hou, Y., Zhou, Z., Huang, K., Yang, H., Han, G. Long Wavelength Light Activated Prodrug Conjugates for Biomedical Applications. ChemPhotoChem. 2, 1005 (2018).
- Engels, J., Schlaeger, E. J. Synthesis, structure, and reactivity of adenosine cyclic 3',5'-phosphate benzyl triesters, Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell. Journal of Medicinal Chemistry. 20 (7), 907-911 (1977).
- Kaplan, J. H., Forbush, B., Hoffman, J. F. Rapid photolytic release of adenosine 5'-triphosphate from a protected analogue: utilization by the Na:K pump of human red blood cell ghosts. Biochemistry. 17 (10), 1929-1935 (1978).
- Park, C. H., Givens, R. S. New Photoactivated Protecting Groups. 6. p-Hydroxyphenacyl: A Phototrigger for Chemical and Biochemical Probes. Journal of the American Chemical Society. 119 (10), 2453-2463 (1997).
- Hasan, A., et al. Photolabile protecting groups for nucleosides: synthesis and photo-deprotection rates. Tetrahedron. 53 (12), 4247-4264 (1997).
- Heckel, A., Mayer, G. Light regulation of aptamer activity: an anti-thrombin aptamer with caged thymidine nucleobases. Journal of the American Chemical Society. 127 (3), 822-823 (2005).
- Papageorgiou, G., Corrie, J. E. T. Effects of aromatic substituents on the photocleavage of 1-acyl-7-nitroindolines. Tetrahedron. 56 (41), 8197-8205 (2000).
- Matsuzaki, M., Ellis-Davies, G. C., Nemoto, T., Miyashita, Y., Iino, M., Kasai, H. Dendritic spine geometry is critical for AMPA receptor expression in hippocampal CA1 pyramidal neurons. Nature Neuroscience. 4 (11), 1086-1092 (2001).
- Givens, R. S., Matuszewski, B. Photochemistry of phosphate esters: an efficient method for the generation of electrophiles. Journal of the American Chemical Society. 106 (22), 6860-6861 (1984).
- Furuta, T., Torigai, H., Sugimoto, M., Iwamura, M. Photochemical Properties of New Photolabile cAMP Derivatives in a Physiological Saline Solution. Journal of Organic Chemistry. 60 (13), 3953-3956 (1995).
- Hagen, V., Frings, S., Wiesner, B., Helm, S., Kaupp, U. B., Bendig, J. 7-(Dialkylamino)coumarin-4-yl]methyl-Caged Compounds as Ultrafast and Effective Long-Wavelength Phototriggers of 8-Bromo-Substituted Cyclic Nucleotides. ChemBioChem. 4 (5), 434-442 (2003).
- Momotake, A., Lindegger, N., Niggli, E., Barsotti, R. J., Ellis-Davies, G. C. The nitrodibenzofuran chromophore: a new caging group for ultra-efficient photolysis in living cells. Nature Methods. 3 (1), 35-40 (2006).
- Specht, A., et al. New photoremovable protecting groups for carboxylic acids with high photolytic efficiencies at near-UV irradiation. Application to the photocontrolled release of L-glutamate. ChemBioChem. 7 (11), 1690-1695 (2006).
- Petersen, S., Alonso, J. M., Specht, A., Duodu, P., Goeldner, M., del Campo, A. Phototriggering of cell adhesion by caged cyclic RGD peptides. Angewandte Chemistry International Edition. 47 (17), 3192-3195 (2008).
- Heckman, L. M., et al. Design and Synthesis of a Calcium-Sensitive Photocage. Angewandte Chemistry International Edition. 55 (29), 8363-8366 (2016).
- Olson, J. P., Banghart, M. R., Sabatini, B. L., Ellis-Davies, G. C. Spectral Evolution of a Photochemical Protecting Group for Orthogonal Two-Color Uncaging with Visible Light. Journal of the American Chemical Society. 135 (42), 15948-15954 (2013).
- Gandioso, A., et al. Sequential Uncaging with Green Light can be Achieved by Fine-Tuning the Structure of a Dicyanocoumarin Chromophore. ChemistryOpen. 6 (3), 375-384 (2017).
- Bassolino, G., Nancoz, C., Thiel, Z., Bois, E., Vauthey, E., Rivera-Fuentes, P. Photolabile coumarins with improved efficiency through azetidinyl substitution. Chemical Science. 9 (2), 387-391 (2018).
- Lin, Q. N., et al. Coumarin Photocaging Groups Modified with an Electron-Rich Styryl Moiety at the 3-Position: Long-Wavelength Excitation, Rapid Photolysis, and Photobleaching. Angewandte Chemistry International Edition. 57 (14), 3722-3726 (2018).
- Nani, R. R., et al. In Vivo Activation of Duocarmycin-Antibody Conjugates by Near-Infrared Light. ACS Central Science. 3 (4), 329-337 (2017).
- Umeda, N., et al. Boron Dipyrromethene As a Fluorescent Caging Group for Single-Photon Uncaging with Long-Wavelength Visible Light. ACS Chemical Biology. 9 (10), 2242-2246 (2014).
- Slanina, T., et al. In Search of the Perfect Photocage: Structure–Reactivity Relationships in meso-Methyl BODIPY Photoremovable Protecting Groups. Journal of the American Chemical Society. 139 (42), 15168-15175 (2017).
- Furuta, T., et al. Brominated 7-hydroxycoumarin-4-ylmethyls: Photolabile protecting groups with biologically useful cross-sections for two photon photolysis. Proceedings of the National Academy of Sciences of the United States of America. 96 (4), 1193-1200 (1999).
- Furuta, T., et al. Bhc-cNMPs as either water-soluble or membrane-permeant photoreleasable cyclic nucleotides for both one- and two-photon excitation. ChemBioChem. 5 (8), 1119-1128 (2004).
- Suzuki, A. Z., et al. Coumarin-4-ylmethoxycarbonyls as phototriggers for alcohols and phenols. Organic Letters. 5 (25), 4867-4870 (2003).
- Ando, H., Furuta, T., Tsien, R. Y., Okamoto, H. Photo-mediated gene activation using caged RNA/DNA in zebrafish embryos. Nature Genetics. 28 (4), 317-325 (2001).
- Teraoka, A., Murakoshi, K., Fukamauchi, K., Suzuki, A. Z., Watanabe, S., Furuta, T. Preparation and affinity-based purification of caged linear DNA for light-controlled gene expression in mammalian cells. Chemical Communications. 50 (6), 664-666 (2014).
- Watanabe, T., et al. Synthesis of nucleobase-caged peptide nucleic acids having improved photochemical properties. Organic and Biomolecular Chemistry. 12 (28), 5089-5093 (2014).
- Horinouchi, T., Nakagawa, H., Suzuki, T., Fukuhara, K., Miyata, N. A novel mitochondria-localizing nitrobenzene derivative as a donor for photo-uncaging of nitric oxide. Bioorganic & Medicinal Chemistry Letters. 21 (7), 2000-2002 (2011).
- Leonidova, A., et al. Photo-induced uncaging of a specific Re(I) organometallic complex in living cells. Chemical Science. 5 (10), 4044-4056 (2014).
- Nadler, A., et al. Exclusive photorelease of signalling lipids at the plasma membrane. Nature Communications. 6, 10056 (2015).
- Feng, S. H., et al. Mitochondria-specific photoactivation to monitor local sphingosine metabolism and function. Elife. 7, e34555 (2018).
- Wagner, N., Stephan, M., Hoglinger, D., Nadler, A. A Click Cage: Organelle-Specific Uncaging of Lipid Messengers. Angewandte Chemistry International Edition. 57 (40), 13339-13343 (2018).
- Feng, S., Harayama, T., Chang, D., Hannich, J. T., Winssinger, N., Riezman, H. Lysosome-targeted photoactivation reveals local sphingosine metabolism signatures. Chemical Science. 10 (8), 2253-2258 (2019).
- Furuta, T., Manabe, K., Teraoka, A., Murakoshi, K., Ohtsubo, A., Suzuki, A. Design, synthesis, and photochemistry of modular caging groups for photoreleasable nucleotides. Organic Letters. 14 (24), 6182-6185 (2012).
- Suzuki, A. Z., et al. A clickable caging group as a new platform for modular caged compounds with improved photochemical properties. Chemical Communications. 55 (4), 451-454 (2019).
- Hatchard, C. G., Parker, C. A. A new sensitive chemical actinometer - II. Potassium ferrioxalate as a standard chemical actinometer. Proceedings of the Royal Society A. 235 (1203), 518-536 (1956).
- Furuta, T., Nishiyama, K., Manabe, A., Fukuoka, M., Iwamura, M. Design, synthesis and photochemical properties of caged compounds of lipid mediators. Proceedings of the ISBC. , 124-125 (2003).
- Shirai, Y., Segawa, S., Kuriyama, M., Goto, K., Sakai, N., Saito, N. Subtype-specific Translocation of Diacylglycerol Kinase ? and ? and Its Correlation with Protein Kinase C. The Journal of Biological Chemistry. 275 (32), 24760-24766 (2000).
- Furuta, T., Noguchi, K. Controlling cellular systems with Bhc-caged compounds. TrAC, Trends in Analytical Chemistry. 23 (7), 511-519 (2004).
- Furuta, T. Designing caged compounds for spatiotemporal control of cellular chemistry. Journal of the Synthetic Organic Chemistry Japan. 69 (11), 1164-1169 (2012).
- Furuta, T., Goeldner, M., Givens, R. S. Coumarin-4-ylmethyl Phototriggers. Dynamic Studies in Biology: Phototriggers, Photoswitches and Caged Biomolecules. , 29-55 (2005).
- Furuta, T., Watanabe, T., Tanabe, S., Sakyo, J., Matsuba, C. Phototriggers for Nucleobases with Improved Photochemical Properties. Organic Letters. 9 (23), 4717-4720 (2007).
- Manova, R., van Beek, T. A., Zuilhof, H. Surface Functionalization by Strain-Promoted Alkyne–Azide Click Reactions. Angewandte Chemistry International Edition. 50 (24), 5428-5430 (2011).
- Adams, S. R., Kao, J. P. Y., Grynkiewicz, G., Minta, A., Tsien, R. Y. Biologically Useful Chelators That Release Ca2+ Upon Illumination. Journal of the American Chemical Society. 110 (10), 3212-3220 (1988).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados