Method Article
Imagens vitalícias de Luminescence de O2 com um sistema de câmera baseado em domínio de frequência
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Descrevemos o uso de uma nova câmera vitalícia de luminescência de domínio de frequência para mapear distribuições 2D O2 com folhas de sensor óptico. Os procedimentos de análise do sistema de câmera e de imagem são descritos juntamente com a preparação, calibração e aplicação de folhas de sensor para visualizar o microambiente O2 na rizosfera das plantas aquáticas.
Resumo
Descrevemos um método de imagem de oxigênio dissolvido (O2),em 2D em alta resolução espacial (< 50-100 μm) e temporal (< 10 s). O método emprega folhas de sensor luminescente sensíveis O2 (optodes planares) em combinação com um sistema de câmera especializado para a vida de luminescência de imagens no domínio da frequência. As optodes planares são preparadas dissolvendo o corante indicador sensível O2em um polímero e espalhando a mistura em um suporte sólido em uma espessura definida através do revestimento de faca. Após a evaporação do solvente, o optode planar é colocado em estreito contato com a amostra de interesse - aqui demonstrado com as raízes da planta aquática Littorella uniflora. A mudança o2-dependente da concentração na vida da luminescência da tintendência indicadordentro do optode planar é imaged através da parte traseira da folha transparente do portador e da parede do aquário usando uma câmera especial. Esta câmera mede a vida de luminescência (μs) através de uma mudança no ângulo de fase entre um sinal de excitação modulada e sinal de emissão. Este método é superior aos métodos de imagem de intensidade de luminescência, pois o sinal é independente da concentração ou intensidade do corante da fonte de excitação, e depende exclusivamente do tempo de decaimento de luminescência, que é um parâmetro intrinsecamente referenciado. Consequentemente, um tintendência de referência adicional ou outros meios de referência não são necessários. Demonstramos o uso do sistema para imagens macroscópicas O2 de rizoferas vegetais, mas o sistema de câmera também pode ser facilmente acoplado a um microscópio.
Introdução
A distribuição e dinâmica de gases e íons dissolvidos em sedimentos e solos fornecem informações-chave sobre processos biogeoquímicos, como respiração microbiana1,2,ou perda de oxigênio radial das raízes das plantas3,4,5,e o microambiente químico dos micróbios6,7, rizoferas vegetais5,8,9 e tocas animais10, 11,12. A atividade biológica e química em tais ambientes limitados à difusão pode criar gradientes íngremes de substratos químicos ou produtos de processos biogeoquímicos. Em particular, a disponibilidade de O2 tem um enorme impacto nos processos biogeoquímicos e, portanto, na biologia e ecologia de um sistema13. Portanto, analisar concentrações O2 em alta resolução espacial e temporal é de grande importância nas ciências aquáticas e terrestres. Primeiro, microssensores eletroquímicos e ópticos14,15 foram desenvolvidos para medir este importante análito. Posteriormente, foram introduzidas imagens tridimensionais (2D) de 2D de O2 com optodes planares12,16,17,18,19,o que possibilitou a visualização e quantificação da distribuição heterogênea O2 em solos e sedimentos.
As optodes Planar O2 consistem em um tine indicador sensível O20,que é dissolvido em um polímero adequado21. A tintendência indicadora é excitada em comprimentos de onda ópticos específicos e emite luz vermelha-deslocada em cima do abrandamento a forma da luminescência. Na presença de O2,o tinuoso indicador animado pode transferir sua energia para a molécula O2 após a colisão, que é referida como luminescência baseada em colisão quesa cificando22. Portanto, a intensidade da luminescência, bem como a vida de luminescência são reduzidas com o aumento da concentração O23 . Em um caso ideal, a mudança de intensidade e vida segue a equação Stern-Volmer (equação 1) usando a intensidade de luminescência ou a vida na ausência (I0; τ0) ou presença (I, τ) de O2 em uma determinada concentração [Q]. A constante Stern-Volmer (Ksv)é uma medida para a sensibilidade do optode em direção a O2; KSV é dependente de variáveis ambientais, como temperatura e pressão.
(1)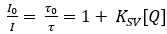
Gravar tais mudanças na luminescência sobre uma folha planar do sensor com um sistema da câmera pode ser usada para visualizar as mudanças correspondentes na distribuição o2. Inicialmente, a imagem de o2 baseada em intensidade de luminescência simples foi utilizada18. No entanto, essa metodologia é muito sensível a interferências externas, que comprometem a confiabilidade dos resultados devido à iluminação heterogênea, flutuações na fonte ou câmera de excitação, bem como distribuição desigual do orintura indicadora dentro do optode planar.
Algumas dessas limitações podem ser aliviadas usando optodes planares para imagens ratiométricas17,24,onde o corante indicador sensível O2é co-imobilizado na camada de polímero do ofotode planar com um corante de referência insensível emitindo-se em uma faixa espectral diferente do indicador O2. Com base em imagens de emissão adquiridas em duas janelas espectrais, o sinal de emissão sensível O2é dividido pelo sinal de referência, gerando uma imagem de proporção que é menos propensa às interferências acima mencionadas5,17. O método requer o uso de um segundo corante, que idealmente pode ser animado pela mesma fonte de excitação, mas emite em um comprimento de onda diferente (sem sobreposição espectral significativa), em outra janela espectral da câmera (por exemplo, em outro canal colorido de uma câmera RGB).
Alternativamente, a imagem O2 pode basear-se na quantificação da mudança dependente de O2na vida de luminescência do corante indicador, que não é afetada por iluminação desigual ou heterogeneidades na concentração do indicador25. Os primeiros sistemas de imagem O2 baseados na vida de luminescência foram baseados em medições de domínio do tempo com um sistema de câmera acoplado (CCD) capaz de portar o comando26,onde uma fonte de excitação pulsada é usada e imagens de luminescência são tiradas em intervalos de tempo definidos dentro da excitação ou emissão do indicador8,23,27. A partir dessas imagens, a vida de luminescência pode ser determinada e correlacionada com a concentração o2 correspondente em uma calibração. Posteriormente, imagens de luminescência vitalíciapara uma determinada amostra pressionada contra o optode planar podem ser convertidas em imagens da distribuição 2D correspondente da concentração O2. Este sistema tem sido usado em muitas aplicações, tanto no laboratório e in situ16,28, mas a câmera CCD essencial gate-capaz não está mais disponível comercialmente.
Recentemente, um sistema de câmera vitalício de luminescência diferente foi lançado, que adquire imagens no domínio de frequência8. O sistema depende de uma fonte de luz continuamente modulada para excitação. Esta pode ser uma onda sinusoidal ou quadrada em vez de uma excitação pulsada, que é usada para aquisição de imagem no domínio do tempo. Essa modulação resulta em uma emissão modulada de luminescência do tintura indicador O2, que é deslocado de fase por um ângulo, φ, que depende da vida de luminescência do tintura indicador (τ) (ver equação 2).
(2)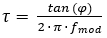
A mudança entre a amplitude de excitação e emissão (ou seja, o chamado índice de modulação ou profundidade (amplitude dividida pela parte constante da luminescência)) também depende da vida de luminescência. Assim, ao definir uma frequência de modulação conhecida, o sensor de imagem ESPECIAL CMOS dentro da câmera é capaz de medir a vida de luminescência na faixa de ns para μs, conforme descrito em detalhes em outros lugares 8,29,30. Um guia geral sobre o princípio da operação pode ser encontrado (usando o seguinte link https://www.youtube.com/watch?v=xPAB_eVWOr8).
No protocolo a seguir, demonstramos o uso do novo sistema de câmeras para a imagem da distribuição da concentração O2 em torno das raízes da planta aquática de água doce Littorella uniflora em 2D9,31. Gostaríamos de enfatizar que este método não se limita a essa aplicação. Optodes sensíveis ao oxigênio ou partículas de sensor27 em combinação com vários métodos de imagem têm sido utilizados na pesquisa médica32, na bioimpressão33, para tintas sensíveis à pressão34,35, ou para estudar sistemas fotossintéticos2,36,37, só para citar alguns outros campos de aplicação.
Protocolo
1. Fabricação de optode planar O2
- Dissolva 1,5 mg do indicador de platina luminescente O 2(II)-5,10,15,20-tetrakis-(2,3,4,5,6-pentafluorphenyl)-porfirina (PtTFPP) e 100 mg de poliestireno (PS) em 1 g de clorofórmio para obter o chamado "sensor cocktail".
NOTA: O coquetel pode ser mantido em um frasco de vidro fechado e à prova de gás por algumas horas na geladeira e na escuridão até continuar a ser útil. - Corrija uma folha de polieftalato de polietileno (PET) limpa e livre de poeira (tamanho dependente da aplicação) em uma placa de vidro limpa com a ajuda de uma água ou etanol (70%) filme (Figura 1A).
- Coloque o dispositivo de revestimento de faca limpa (120 μm) na folha e aplique uma linha do coquetel sensor na frente do dispositivo usando uma pipeta de vidro(Figura 1B). Em seguida, arraste o dispositivo de revestimento de faca lenta e uniformemente sobre a folha PET para espalhar o coquetel uniformemente.
NOTA: Todos os materiais e ferramentas têm que ser limpados completamente e a fabricação deve ser feita em um ambiente poeira-livre, tal como uma capa da fumaça, um banco de fluxo ou debaixo de um dispositivo da sucção do ponto. Para evitar heterogeneidades na folha final do sensor, as etapas que seguem a aplicação do cocktail do sensor na folha devem ser feitas rapidamente, porque o clorofórmio evapora rapidamente. - Seque o planar acabado O2-sensível optode no ar ambiente por 1 h e, em seguida, mais de noite em um armário de aquecimento em 50-60 °C, resultando em uma espessura camada final após a evaporação solvente de ~ 12 μm. Armazenar os optodes produzidos na escuridão (por exemplo, em um envelope de papel) até novo uso (Figura 1C).
NOTA: Os optodes Planar O2 podem ser armazenados secos e na escuridão por vários meses a anos antes do uso. Uma espessura de camada final que varia de 1 a 20 μm provou produzir bons resultados, com sinal de luminescência suficiente e tempos de resposta adequados.
2. Câmara de sanduíche rhizo
- Limpe duas placas de vidro (24,5 x 14 cm2,espessura: 4 mm) com 96% de etanol.
- Use adesivo instantâneo à base de luz, à base de acrílico (ver Tabela de Materiais)para colar slides de microscópio (76 x 26 mm2, espessura: 1 mm) ao longo das bordas da primeira placa de vidro (ou seja, o lado da câmara traseira), deixando uma longa borda aberta. Use um glasscutter para encurtar slides do microscópio como necessário.
CUIDADO: Corte de vidro pode causar bordas afiadas e deve ser manuseado com cuidado.
NOTA: As lâminas do microscópio funcionam como espaçadores entre a parte dianteira e a parte traseira, e dependendo da espessura das raizes e do tamanho da planta, as camadas múltiplas de corrediças do microscópio podem ser coladas sobre se. - Corte o optode planar na forma e tamanho necessários para caber no espaço entre as lâminas coladas do microscópio. Coloque-o no interior da placa de vidro frontal com o lado revestido para cima, para permitir o contato com a amostra de interesse quando pressionado contra ele.
- Fita uma borda da folha de optode para a placa de vidro e adicione algumas gotas de água da torneira entre a placa de vidro e a folha de optode (Figura 2A). Abaixe lentamente a folha nestas gotículas de água permitindo que endireitar-se para fora na superfície de vidro.
- Retire cuidadosamente as bolhas de ar presas entre o optode planar e a placa de vidro usando um tecido mole, evitando o revestimento do sensor. Limpe a placa de vidro seca e fita as bordas restantes da folha de optode para a placa de vidro(Figura 2B).
NOTA: Uma fita com adesão adequada debaixo d'água deve ser escolhida. - Peneire o sedimento usando um tamanho de malha de 0,5 mm. Coloque uma colher de sedimento molhado na primeira placa de vidro (Figura 2C).
NOTA: O tamanho da malha não deve ser maior do que a metade da espessura espaçador. - Distribua o sedimento uniformemente e ajuste-o à mesma espessura que os espaçadores da corrediça do microscópio usando uma placa de vidro lisa. Limpe cuidadosamente a superfície superior do microscópio desliza para garantir que a segunda placa de vidro sela a câmara corretamente.
- Aplique a graxa de silicone à superfície da lâmina do microscópio. Cubra o sedimento com uma película fina da água, ao com cuidado evitar a formação de bolhas de ar.
- Lave cuidadosamente um único tiro de Littorella uniflora e coloque-o sobre o sedimento, com as folhas de planta saindo do lado superior aberto (Figura 2D).
- Coloque a segunda placa de vidro, com o optode ligado a ele, sobre o sedimento e aplique uma pressão suave para trazer o optode em contato próximo com as raízes das plantas e os sedimentos circundantes.
NOTA: As bolhas de ar presas no sedimento podem ser removidas inclinando as placas de vidro enquanto as unem. - Aperte as placas de vidro juntos usando grampos (Figura 2E). Seque as bordas externas com papel de seda. Mantenha as folhas hidratadas durante toda a montagem do rizo-sanduíche (por exemplo, por adição freqüente de algumas gotas de água).
- Aperte a câmara de sanduíche de rizoma usando fita elétrica de vinil. Selar as bordas com modelagem de argila e, adicionalmente, gravá-los com fita elétrica de vinil (Figura 2F).
NOTA: Se houver muitas bolhas de ar no sedimento, ou grãos de sedimentos entre as lâminas de microscópio espaçador e a segunda placa de vidro, a câmara deve ser remontada à medida que a água dos poros pode vazar (etapas repetidas 2,4 - 2,8). - Use um plástico opaco para cobrir o rizo-sanduíche, mas deixe uma fenda na folha para que as folhas da planta se esgotem. Corte uma janela na folha de plástico, para que possa ser aberta para os experimentos desdobrando- se. Feche a janela durante os tempos de aclimatação usando elásticos(Figura 2G)para proteger o optode do branqueamento fotográfico enquanto a planta é incubada.
NOTA: Como o crescimento de algas poderia interferir com as concentrações O2 medidas, recomendamos tentar minimizá-lo, usando água filtrada, equipamentos experimentais pré-limpos e removendo algas após a formação.
3. Incubação da câmara do Rhizo-sanduíche
- Coloque a câmara de sanduíche de rizogério em um tanque de água (32 x 7 x 28 cm3)em uma posição ligeiramente inclinada para incentivar o crescimento da raiz contra o optode planar.
- Encha o tanque de água com água suficiente para submergir totalmente as folhas da planta.
- Estabeleça uma luz de 14 h, ciclo escuro de 10 h para a aclimatação da planta usando uma lâmpada tempo-controlada. Coloque uma pedra de ar ou uma bomba de água no tanque para garantir a eração e mistura da água (Figura 2H).
4. Imagem
- Configuração de imagem
- Retire a folha de plástico que cobre o optode planar na câmara rhizo-sanduíche. Posicione a câmara com a parede de vidro com o optode ereto contra a parede do aquário. Use um espaçador para pressionar a câmara de sanduíche de rizoma contra a parede do aquário.
NOTA: A espessura geral da parede do aquário, além da parede de câmara rhizo-sanduíche não deve ficar muito espessa, no entanto, espessuras de vidro para paredes de aquaria para imagens de luminescência são recomendadas com > 1 cm, a fim de reduzir a conversa cruzada espacial, aumentando a atenuação da luz dispersa. É importante, usar o mesmo material para ambas as paredes de vidro (mesmo índice refratário), a fim minimizar a dispersão clara na relação material; como isso levaria a uma imagem borrada também12. - Coloque a câmera de vida de luminescência baseada em domínio de frequência equipada com um objetivo (ver Tabela de Materiais)em frente ao aquário e à área de interesse (raízes da planta aquática Littorella uniflora,que estão em contato direto com o optode planar) (Figura 3).
NOTA: A câmera pode ser colocada em um estande de laboratório para permitir o ajuste de altura fácil da câmera. A posição do estande do laboratório deve ser marcada e mantida fixa. Além disso, a câmera pode ser gravada no estande do laboratório para evitar o movimento acidental da câmera durante o experimento. - Parafuso um filtro de emissão adequado para imagem PtTFPP como tinuoso indicador (ver Tabela de Materiais)no objetivo da câmera, para remover inferências da fonte de excitação.
NOTA: Filtros de parafuso são ideais, mas filtros quadrados também podem ser usados com um adaptador apropriado, ou gravando-os cuidadosamente ao objetivo. - Conecte uma fonte de excitação LED (ver Tabela de Materiais)à modulação e saída escura do portão da câmera.
NOTA: O primeiro entrega o sinal de modulação para a fonte de luz, enquanto o último desliga a luz durante a leitura de imagem do sensor de imagem. Conecte a fonte de excitação LED e a câmera a um computador. A luz de fundo deve ser minimizada durante a leitura da imagem, escurecendo toda a sala ou colocando um pano denso e preto sobre toda a configuração. Neste último caso, é importante garantir ventilação suficiente para evitar o aquecimento da câmera. - Corrigir o guia de luz na fonte de excitação LED e posicioná-lo para iluminar uniformemente a folha de optode planar cobrindo a área de interesse.
NOTA: Na fonte de excitação LED usada é possível alternar entre 3 LEDs diferentes (460 nm, 528 nm, 625 nm), a intensidade dos quais pode ser ajustado através do software de controle.
- Retire a folha de plástico que cobre o optode planar na câmara rhizo-sanduíche. Posicione a câmara com a parede de vidro com o optode ereto contra a parede do aquário. Use um espaçador para pressionar a câmara de sanduíche de rizoma contra a parede do aquário.
- Configurações e operação da câmera
NOTA: Para os experimentos descritos, usamos uma câmera vitalícia baseada em domínio de frequência em combinação com um módulo dedicado para imagens vitalícias em um pacote de software comercialmente disponível (veja Tabela de Materiais).- Selecione a câmera no software escolhido antes de usar.
NOTA: Os drivers de software e câmera precisam ser instalados antes de imagens seguindo as diretrizes dos fabricantes. - Abra o software de controle de LED (novamente instalado antes de iniciar o experimento) e escolha o LED adequado (aqui: 528 nm) assinalando o espera. Definir a intensidade LED, conforme necessário (aqui a 30%). Certifique-se de que o LED seja acionado pelo TTL externo; isso é feito por tique-taque analógico e sincronização para o LED.
NOTA: A intensidade led precisa ser ajustada individualmente, pois a potência laser muito alta pode levar ao branqueamento acelerado de fotos do indicador ou corante de referência. - Concentre a câmera e ajuste a abertura do objetivo manualmente (no presente estudo use f = 2,8).
NOTA: É importante concentrar a câmera no optode planar e não no vidro do aquário; isso pode ser garantido, tendo uma imagem com uma régua para a escala, e concentrando-se na sombra do governante sobre o optode, ao invés de sobre o governante real. - Defina os seguintes parâmetros dentro do painel de controle da câmera do software: fonte de modulação interna; onda de seno para a forma de onda de saída; amostragem de fase adicional (Sim); 8 amostras de fase, ordem de fase oposta, leitura tap a + B; Frequência de modulação de 5 kHz.
NOTA: Esses parâmetros afetam a qualidade da imagem e podem ser alterados se necessário. O fabricante da câmera fornece diretrizes sobre os parâmetros individuais (O fabricante da câmera está lançando diretrizes e atualizações sempre que o software é atualizado). - Pegue uma imagem de referência antes dos experimentos.
NOTA: Isso pode ser feito por imagem por imagem de um padrão de calibração (um corante luminescente com uma vida conhecida (ns ou μs)), ou usando a luz refletida do LED. Neste último caso, o filtro de passe longo de emissão precisa ser removido do objetivo e a vida útil conhecida pode ser definida como 1 ns. - Ajuste o tempo de exposição na seção de calibração do software de imagem dedicado até a leitura do ROI Statistics (na parte inferior deste painel) para a imagem de intensidade de luminescência normalizada está na faixa de 0,68 - 0,72.
NOTA: Agora a vida de referência (por exemplo, 1 ns) é dada como entrada para o software. - Referência de captura de imprensa para iniciar a aquisição de uma série de medição de referência.
NOTA: Quando terminar, os dados de referência são armazenados e as medições de lapso de tempo ou única saem ou podem ser feitas em amostras.
- Selecione a câmera no software escolhido antes de usar.
- Calibração do optode O2
- Posicione um pedaço de um optode sensível ao planar O2em um (pequeno) aquário de vidro. Corrija o optode planar na parede de vidro da câmara de calibração, conforme descrito anteriormente (ver seção 2.3). Coloque o aquário de calibração na frente da câmera. Certifique-se mesmo de iluminação pelo LED, bem como que o optode preenche todo o campo de visão.
NOTA: O optode planar deve ser do mesmo pedaço de papel alumínio ou feito a partir do mesmo cocktail sensor como a folha usada no experimento real. - Encha o aquário com o mesmo meio líquido usado nos experimentos.
NOTA: Usar diferentes mídias para calibrações e experimentos pode influenciar a medição (por exemplo, alterando a resposta do sensor e/ou a solubilidade O2). Assim, a calibração deve ser feita no mesmo meio, e na mesma temperatura que a experiência real. As flutuações na temperatura afetarão o sinal de luminescência e devem ser evitadas. No entanto, se a temperatura não puder ser mantida estável, a compensação de temperatura precisa ser feita calibrando o optode sensível ao O2(múltiplos pontos) em diferentes temperaturas (relevantes) e subsequente recálculo dos valores. - Ajuste a concentração O2 dentro do aquário de calibração, liberando a água com uma mistura de gás ar/N2 de concentração Conhecida em O2, usando um dispositivo de mistura de gás. Certifique-se de que a água é bem estabilizada com a mistura de gás usado por aremar por um tempo suficiente (depende da taxa de fluxo e tamanho do aquário).
NOTA: Recomendamos monitorar o nível O2 no aquário de calibração com um sensor O2 externo calibrado com compensação de temperatura (por exemplo, usando um sensor O2 de fibra óptica ou eletroquímica). - Tire uma série de imagens em diferentes concentrações O2 na câmara de calibração.
NOTA: Pelo menos cinco concentrações diferentes de O2 devem ser medidas a fim permitir uma curva apropriada cabida aos dados adquiridos da calibração. É importante medir a 0 hPa (condições anóxicas) e, em seguida, distribuir os outros valores sobre a faixa dinâmica do seu tintilo indicador específico. Aqui usamos o PtTFPP como o tintendência indicador sensível O2imobilizado em uma matriz de poliestireno. As imagens foram tiradas em 0, 48, 102, 156 e 207 hPa; 207 hPa corresponde a 100% de saturação do ar na salinidade e pressão dada.
- Posicione um pedaço de um optode sensível ao planar O2em um (pequeno) aquário de vidro. Corrija o optode planar na parede de vidro da câmara de calibração, conforme descrito anteriormente (ver seção 2.3). Coloque o aquário de calibração na frente da câmera. Certifique-se mesmo de iluminação pelo LED, bem como que o optode preenche todo o campo de visão.
- Imagem a amostra
- Coloque a amostra na frente da câmera e garantir até mesmo iluminação.
- Desligue a luz que fornece a irradiação à planta (e a todas fontes de luz restantes) imediatamente antes de adquirir a imagem da vida do luminescence da planta. Ajuste o tempo de aquisição com base na imagem de intensidade, garantindo que o sinal não esteja nem saturado ou fraco demais para um bom sinal para ruído (S/N) na determinação vitalícia.
- Exponha a planta a diferentes condições de luz (por exemplo, luz/ escuridão) e adquira um conjunto de imagens.
- Ligue a luz na sala para adquirir uma imagem estrutural.
NOTA: Quando a luz de fundo é ligada, a câmera não irá medir uma imagem realista vida. No entanto, a imagem de intensidade agora mostra todo o campo de visão visto através do optode semitransparente. - Pegue uma imagem com uma régua ou iguais no campo de visão para permitir a escala posterior das imagens adquiridas.
5. Análise de dados
- Exportar as imagens de vida e intensidade de fase diretamente do software de imagem dedicado, usando a macro fornecida pelo fabricante da câmera.
- Realize uma análise de imagem adicional usando um software de análise de imagem disponível gratuitamente (ver Tabela de Materiais).
- Abra as imagens de fase vitalícia da calibração no software de análise de imagem e determine a média de toda a imagem usando a função de medida. Trace as vidas medidas contra as concentrações o2 conhecidas para determinar a função de calibração(Figura 4A).
- Calcule o τ0/τ de todos os dados(o τ0 é a vida medida da fase na ausência de O2). Traçar esses valores contra as concentrações o2 conhecidas(Figura 4B).
- Determine os parâmetros Ksv e f da trama de calibração, usando o modelo simplificado de dois locais para saciamento colisia dinâmico (equação 3)38,39, onde [Q] é a concentração O2. Defina a função de ajuste no software de análise de dados, que então determina Ksv e f.
(3)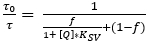
- Abra as imagens de amostra adquiridas no software de análise de imagem para converter as vidas de imagem em concentrações O2, usando os parâmetros determinados Ksv,f e τ0.
NOTA: Como uma abordagem alternativa também os valores adquiridos fase de calibração ao longo da vida(Figura 4A)pode ser usado diretamente. Neste caso, um ajuste exponencial usando a função de ajuste de curva é usado para calibração. - Abra a imagem com a régua em seguida no software de análise de imagem e medir uma distância conhecida usando a ferramenta de medição. Defina essa medida como escala global em escala definida.
Resultados
Como exemplo de aplicação para o novo sistema de imagem, mostramos imagens 2D O2 de uma amostra biológica complexa (ou seja, a rizosfera da planta aquática Littorella uniflora).
Primeiro, o método descreve a fabricação de um filme de sensor planar, um chamado optode planar. Como visto na Figura 1, tal optode é feito de uma fina camada de um indicador óptico em uma matriz de polímero que se espalha em um suporte transparente. Seguindo o protocolo descrito, uma película homogênea do sensor com uma espessura uniforme, como definido pela abertura do dispositivo de revestimento da faca, é obtida. Se o optode produzido tiver uma distribuição de material de sensor irregular (por exemplo, buracos no revestimento, mostra listras ou agregados de corante (isso pode ser avaliado visualmente e visualmente com a ajuda de uma lâmpada UV)), o protocolo precisa ser repetido e todos os materiais precisam ser completamente limpos usando acetona.
Uma vez que o optode planar é preparado, a amostra pode ser trazida em contato próximo com a camada de detecção do optode planar, como mostrado aqui com o optode planar integrado em uma câmara rhizo-sanduíche, onde as raízes de uma planta dentro de uma matriz de sedimentos circundantes podem ser posicionadas em estreito contato com o optode planar (Figura 2). Se preparado corretamente, a câmara do rizo-sanduíche deve facilmente ser móvel de um aquário (incubação) ao outro (medida). Se não for construído corretamente, a câmara rhizo-sanduíche pode ser instável, perder sedimentos ou conter bolhas de ar. O exame visual da câmara rhizo-sanduíche diretamente após a montagem é recomendado.
O protocolo dado permite a imagem de vida de luminescência baseada em domínio de frequência da amostra em contato com o optode planar usando a câmera de vida de luminescência baseada em domínio de frequência. Mais detalhes sobre este sistema de câmera, como o modo de aquisição de imagem e características científicas complementares de câmera metal-óxido-semicondutores (SCMOS) são dados em publicações recentes8,29.
A configuração em si é bastante simples e inclui apenas a câmera que controla uma fonte de luz (neste caso, uma fonte de excitação LED) e a amostra com o optode(Figura 3). Certifique-se de que todas as partes estejam corretamente conectadas e que a amostra seja iluminada de forma homogênea. A luz do fundo precisa de ser evitada ao preforming medidas.
Antes da imagem de imagem da amostra, o optode precisa ser calibrado. Como visto na Figura 4A, a vida de luminescência medida diminui com o aumento da concentração o2 após uma decadência quase exponencial. Essa relação também pode ser descrita usando o modelo simplificado de dois sites(Figura 4B e equação 3). No exemplo dado, os parâmetros necessários para calcular posteriormente a concentração O2 foram os seguidos; τ0 = 56,26 μs, Ksv = 0,032 hPa-1 e f = 0,86.
Executar uma calibração também é uma maneira ideal de testar que o sistema está funcionando corretamente. Se todos os componentes forem instalados conforme descrito aqui (ou dentro das diretrizes dos fabricantes), a vida útil medida deve mostrar a mesma dependência O2 vista na Figura 4. Além disso, para a mesma combinação de materiais de detecção O2 (polímero e tinuoso), o τ0 medido deve estar na mesma faixa (± alguns μs) medido aqui (principalmente influenciado pela temperatura experimental). Se não conseguir obter uma curva de calibração semelhante, certifique-se de que todas as etapas foram seguidas corretamente. Às vezes, o optode é acidentalmente corrigido com o lado sensível de frente para a parede de vidro, em vez da amostra, ou as imagens adquiridas são sobre ou subexpostas.
Com os parâmetros de calibração, é possível determinar a concentração O2 por imagem da vida de luminescência (τ). Isso é demonstrado na Figura 5A,B,onde a distribuição da concentração O2 na rizosfera de Littorella uniflora foi imagemda na escuridão e após exposição à luz a 500 fótons μmolm-2 s-1 para 12 h, respectivamente. Devido à atividade fotossintética da planta, a concentração O2 na rizosfera aumentou após a exposição à luz. Além das imagens da vida, também imagens estruturais podem ser adquiridas iluminação externa, mantendo a geometria de imagem fixa. Desta forma, as imagens O2 podem ser precisamente correlacionadas com a imagem estrutural (Figura 5C),seções transversais ou regiões de interesse. Como exemplo, os perfis de concentração O2 em uma única raiz foram extraídos da imagem adquirida na escuridão e na luz, respectivamente (Figura 5D).

Figura 1: Fabricação de um optode planar O2. (A)Uma folha PET é fixada em uma placa de vidro e o dispositivo de revestimento de faca é colocado na folha. (B)O coquetel de sensor preparado é espalhado na folha PET como uma linha fina na frente do dispositivo de revestimento de faca. (C) O dispositivo de revestimento de faca é movido para baixo para espalhar o coquetel de sensor como uma película fina na folha PET, que após a evaporação solvente resulta em um pronto para usar o ofereto planar. Clique aqui para ver uma versão maior deste número.

Figura 2: Montagem da câmara rhizo-sanduíche com integração de um optode planar O2. (A)O optode é fixado em uma das placas de vidro usando uma película de água. (B)O optode é colado à placa com fita elétrica. (C)Sedimento é preenchido na placa oposta com os espaçadores anexados (ou seja, slides de microscópio). (D)As raízes das plantas são colocadas sobre o sedimento uniformemente espalhados. (E)A câmara de sanduíche de rizoérsio é fechada e temporariamente fixada com grampos. (F)Câmara totalmente fechada e montada de sanduíche de rizo. (G)Para proteger o optode da exposição à luz pela lâmpada de incubação e para evitar o crescimento de algas, uma capa de plástico é colocada sobre a câmara de rizo-sanduíche montada. Acâmara de sanduíche de rizoma incubada em um aquário. Clique aqui para ver uma versão maior deste número.

Figura 3: Configuração de imagem contendo a câmera de vida de luminescência baseada em domínio de frequência, com o objetivo focado na amostra com o optode por trás através do aquário transparente e paredes de câmara de sanduíche de rizo-sanduíche. O guia de luz da fonte de excitação LED é posicionado para iluminar a amostra uniformemente. Clique aqui para ver uma versão maior deste número.
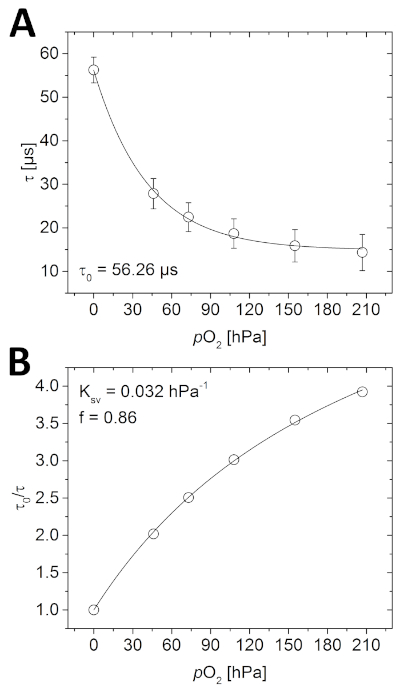
Figura 4: Curvas de calibração para o optode planar O2. (A) Diferentes vidas de fosforescência medidas nas respectivas concentrações O2 na câmara de calibração cheia de água. (B) Stern-Volmer enredo dos dados de calibração instalados usando o modelo simplificado de dois sites para saciamento colisio dinâmico (equação 3). Clique aqui para ver uma versão maior deste número.
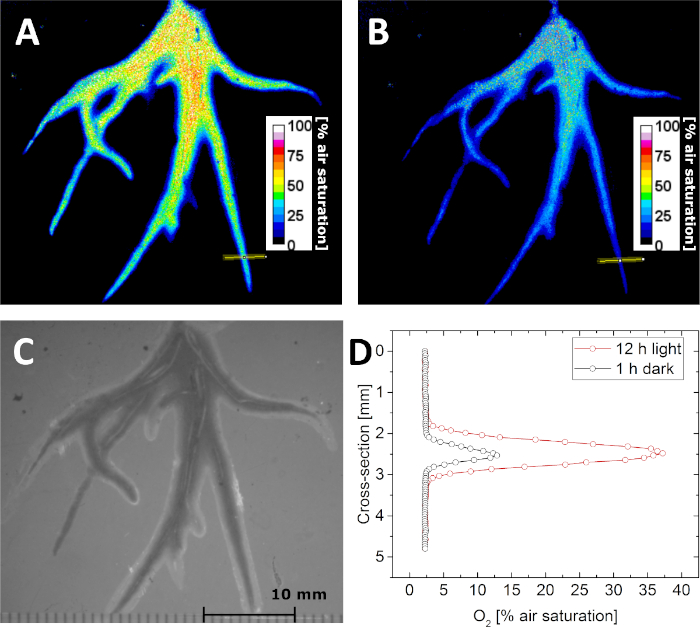
Figura 5: Imagem vitalícia da distribuição O2 na rizosfera da planta aquática Littorella uniflora. (A)O2 distribuição depois de manter a planta luz por 12 h em aproximadamente 500 fótons μmol m-2 s-1. (B) O2 distribuição depois de manter a planta na escuridão por 1 h. (C)Imagem estrutural das raízes da planta, como visto através do optode planar. (D)Perfil de concentração o2 transversal (o local é indicado pela linha amarela no painel A e B) após 12 h de luz (vermelho) e 1 h na escuridão (preto). Adaptado com permissão de (Koren, K., Moßhammer, M., Scholz, V. V., Borisov, S.M., Holst, G., Kühl, M. Luminescence Lifetime Imaging of Chemical Sensors - A Comparison between Time-Domain and Frequency-Domain Based Camera Systems. Química Analítica. 91 (5), 3233-3238, doi: 10.1021/acs.analchem.8b05869 (2019)). Direitos autorais (2019) American Chemical Society. Clique aqui para ver uma versão maior deste número.
Discussão
Neste protocolo, todo o fluxo de trabalho da preparação para a preparação do optode para a análise de imagem O2 é coberto. Seguindo este protocolo, as imagens químicas podem ser obtidas usando a câmera nova da vida da luminescência freqüência-baseada do domínio. Dependendo da aplicação, os optodes planares podem ser fabricados em vários tamanhos e espessura de camada da camada do sensor que varia de robusto 50-100 μm de espessura planar optodes de vários décimos de centímetro quadrado para deslizamentos de cobertura de microscópio com <1 μm camadas de sensor de espessura6,40. O potencial deste método foi demonstrado com uma aplicação particular, mas não só se limita à imagem o2 em rizoferas vegetais12,28.
Este método tem vários benefícios quando comparado aos métodos de imagem química baseados em intensidade de luminescência pura. Luminescência imagem vitalícia não é, ou pelo menos muito menos, afetados por iluminação desigual, espessura desigual optode, e clareamento fotográfico25. Além disso, este método evita o uso de um tine de referência adicional comum em imagens ratiométricas17,37. Em comparação com outros sistemas de câmera supérdia, comocâmerasde domínio do tempo8,26,o novo sistema de câmeras e protocolo apresentado aqui podem produzir resultados comparáveis. Em uma publicação recente, as características analíticas desses dois sistemas foram comparadas e verificou-se que o sistema de câmera de vida de luminescência baseado em domínio de freqüência é pelo menos comparável aoantecessor8 baseado em domínio de tempo descontinuado .
Apresentamos o opaco O2 mais simples, consistindo apenas de um indicador em uma matriz de polímeros. Além de vários outros possíveis indicadores O2 20 que podem ser utilizados aditivos podem ser incluídos, ou seja, agentes de dispersão, como TiO2 ou pó de diamante2 para aumentar o sinal do sensor, reduzindo a transparência do optode. Também corantes adicionais podem ser usados para aumentar a intensidade do sinal através da transferência de energia41.
Para a fabricação planar do optode, recomendamos o uso de uma lacuna no dispositivo de revestimento de faca de 75 - 120 μm para produzir uma espessura de camada de sensor final de cerca de 7,5 a 12 μm após a evaporação solvente (cerca de 10% da lacuna usada), ao usar a composição do coquetel de sensor descrito. Este é um bom compromisso entre a intensidade do sinal, que pode ser modificado por maior carregamento de corante, ou escolhendo indicador e corantes de referência de maior brilho, e tempo de resposta. Um aumento na espessura da camada resulta em um aumento no tempo de resposta, como o período de tempo necessário para o anályte para alcançar um equilíbrio termodinâmico na camada de detecção com a mídia circundante aumenta12.
Optodes, como descrito aqui, reagem às mudanças na concentração o2 dentro de alguns segundos17, enquanto ainda tem um sinal de luminescência suficientemente forte. Revestimentos de sensorultrafino com tempos de resposta sub-segundo podem ser realizados com revestimento de rotação6. Se o suporte ou o dispositivo de revestimento de faca não estiverem bem limpos, isso pode resultar em camadas de sensores inhomogêneas. Além disso, quando o coquetel não é completamente homogêneo ou aplicado muito rapidamente depois de se espalhar na frente do dispositivo de revestimento, um resultado indesejado pode ser observado. Portanto, ele pode precisar de alguma prática para preparar optodes ideais.
O método pode ser usado para amostras de imagem que podem ser colocadas em contato próximo ao optode, como certos animais marinhos42,biofilmes6 e solos31 só para citar alguns. Apresentamos uma configuração autônoma usando um objetivo, no entanto, a câmera pode ser facilmente acoplado a um microscópio para imagens químicas de alta resolução43.
Enquanto o domínio do tempo baseado luminescência imagem ao longo da vida permitiu a supressão da fluorescência de fundo26,este é um problema ao usar o novo sistema de câmera baseada em domínio de freqüência8. Devido à aquisição contínua de imagem, esta câmera gravará qualquer fluorescência de fundo da amostra que possa ser excitada pelo LED selecionado e emita na janela espectral selecionada, conforme definido pelo filtro de emissão no objetivo da câmera. Isso resultará em uma vida aparentemente menor e, conseqüentemente, em leituras falsas. Caso você trabalhe com amostras com uma fluorescência intrínseca significativa sobreposta com a excitação e emissão do sensor O2, é essencial aplicar um isolamento óptico extra em cima do optode, revestindo uma camada adicional contendo carbono preto2,17. Assim, apenas a luminescência emitida a partir do optode planar chegará à câmera. A fim de verificar se há luminescência de fundo uma imagem sem o optode pode ser tomada, que então mostraria exclusivamente luminescência intrínseca da amostra. Também é possível adicionar agentes de dispersão, como TiO2 ou pó de diamante2,44,ao coquetel sensor, para aumentar a intensidade da luminescência do corante indicador. No entanto, isso também pode levar a clareamento de fotos mais rápido e TiO2 é um conhecido foto-catalisador, que pode prejudicar a fotostabilidade de um corante41. Um aspecto mais adicional a considerar é luz do fundo. Quando a luminescência de imagens ao longo da vida, a luz de fundo precisa ser evitada da forma mais eficiente possível. Portanto, esse método de imagem exige que a configuração seja colocada em um ambiente escuro e qualquer fonte de luz externa precisa ser temporariamente desativada durante a aquisição de imagem.
Em resumo, a imagem de vida da luminescência é um método de imagem química robusto que possa ser adaptado a muitas aplicações diferentes. Este protocolo (ver seção 1-5) abrange todas as etapas essenciais para gerar uma imagem O2 e usa o sistema de imagem de vida de luminescência de domínio de frequência atualmente mais flexível, que pode substituir a câmera de domínio do tempo fechada descontinuada por imagens 2D O2 com optodes planares.
Divulgações
O autor Gerhard Holst é um funcionário da PCO AG que fabrica o sistema de câmera usado neste artigo. A PCO AG contribuiu financeiramente para a publicação e os custos de acesso aberto deste artigo.
Agradecimentos
Agradecemos a Sofie Lindegaard Jakobsen (Universidade de Copenhague) e Lars Borregaard Pedersen (Universidade de Aarhus) por assistência técnica. O financiamento para este estudo foi obtido a partir de uma subvenção Avançada Sapere-Aude do Fundo Independente de Investigação dinamarca (DFF-1323-00065B; MK), subvenções de projeto do Fundo Independente de Investigação Dinamarca | Ciências Naturais (DFF-8021-00308B; MK) e Ciências Técnicas e de Produção (DFF-8022-00301B e DFF-4184-00515B; MK), a Danish National Research Foundation (DNRF136) e a Poul Due Jensen Foundation (KK).
Materiais
| Name | Company | Catalog Number | Comments |
| Air pump with air stone and water pump | Local aquarium store | ||
| Chloroform | Sigma Aldrich | 67-66-3 | |
| DC4 silicone compound | Dow Corning GmbH | 2793695 | |
| Gas mixer | Vögtlin Instruments GmbH | red-y compact meter GCM | This is just one possible instrument. Several companies offer gas mixing devices |
| Glass plates and aquaria | Local aquarium or hardware store | ||
| ImageJ Software | ImageJ | Freely available imaging software (imagej.nih.gov/ij/index.html) | |
| Knife-coating device | BYK-GARDNER GMBH byk.com | 2021 | This is a four sided film applicator enabling easy variation of the film thickness. Other versions are also available. We recommend a thickness of the applied film between 75-120 µm, which yields a final sensor layer thickness of ~10% of the applied thickness before solvent evaporation. |
| LED lamp, Reflector PAR38 | Megaman | MM17572 | |
| LED LEDHUB | Omicon Laserage, Germany | Can be configured with a variety of LEDs. For the presented example, the green LED (528 nm) is essential | |
| LOCTITE AA 3494 | Henkel AG & Co. KGaA | NA | Acrylic-based instant adhesive |
| NIS Elements AR Software | Nikon Inc | Software package used for image acquisition | |
| pco.flim | PCO AG, Germany | Frequency domain based luminescence lifetime camera | |
| platinum(II)-5,10,15,20-tetrakis-(2,3,4,5,6-pentafluorphenyl)-porphyrin (PtTFPP) | Frontier Scientific | PtT975 | O2 indicator |
| polyethylene terephthalate (PET) foil | Goodfellow | 320-992-72 | Such foils might also be found from other providers and serve as solid support |
| Polystyrene (PS) | Sigma Aldrich | 9003-53-6 | Polymer matrix |
| Schott RG610 filter | www.uviroptics.com | Here 52mm screw on Filters can obtained. Other sources offer square glass filters from Schott glass that can be fixed in front of the objective | |
| Vinyl electrical tape | Scotch, Super 33+ | NA | |
| Zeiss Makro Planar 2/100 with Hama C for Nikon adaptor | delivered with the camera | Here any other objective might also be used in combination with an adaptor if the objective does not have a C-mount |
Referências
- Glud, R. N., Kühl, M., Kohls, O., Ramsing, N. B. Heterogeneity of oxygen production and consumption in a photosynthetic microbial mat as studied by planar optodes. Journal of Phycology. 35 (2), 270-279 (1999).
- Moßhammer, M., Strobl, M., Kühl, M., Klimant, I., Borisov, S. M., Koren, K. Design and Application of an Optical Sensor for Simultaneous Imaging of pH and Dissolved O2 with Low Cross-Talk. ACS Sensors. 1 (6), 681-687 (2016).
- Jensen, S. I., Kühl, M., Glud, R. N., Jørgensen, L. B., Priemé, A. Oxic microzones and radial oxygen loss from roots of Zostera marina. Marine Ecology Progress Series. , 49-58 (2005).
- Larsen, M., Santner, J., Oburger, E., Wenzel, W. W., Glud, R. N. O2 dynamics in the rhizosphere of young rice plants (Oryza sativa L.) as studied by planar optodes. Plant and Soil. 390 (1-2), 279-292 (2015).
- Brodersen, K. E., Koren, K., Moßhammer, M., Ralph, P. J., Kühl, M., Santner, J. Seagrass-Mediated Phosphorus and Iron Solubilization in Tropical Sediments. Environmental Science and Technology. 51, 14155-14163 (2017).
- Kühl, M., Rickelt, L. F., Thar, R. Combined imaging of bacteria and oxygen in biofilms. Applied and Environmental Microbiology. 73 (19), 6289-6295 (2007).
- Sønderholm, M., et al. Tools for studying growth patterns and chemical dynamics of aggregated Pseudomonas aeruginosa exposed to different electron acceptors in an alginate bead model. npj Biofilms and Microbiomes. 3, 1-11 (2018).
- Koren, K., Moßhammer, M., Scholz, V. V., Borisov, S. M., Holst, G., Kühl, M. Luminescence Lifetime Imaging of Chemical Sensors - A Comparison between Time-Domain and Frequency-Domain Based Camera Systems. Analytical Chemistry. 91 (5), 3233-3238 (2019).
- Brodersen, K. E., Koren, K., Lichtenberg, M., Kühl, M. Nanoparticle-based measurements of pH and O2 dynamics in the rhizosphere of Zostera marina L.: effects of temperature elevation and light-dark transitions. Plant, Cell & Environment. 39 (7), 1619-1630 (2016).
- Zhu, Q., Aller, R. C., Fan, Y. High-Performance Planar pH Fluorosensor for Two-Dimensional pH Measurements. in Marine Sediment and Water. Environmental Science & Technology. 39, 8906-8911 (2005).
- Murniati, E., Gross, D., Herlina, H., Hancke, K., Glud, R. N., Lorke, A. Oxygen imaging at the sediment-water interface using lifetime-based laser induced fluorescence (τLIF) of nano-sized particles. Limnology and Oceanography: Methods. 14 (8), 506-517 (2016).
- Santner, J., Larsen, M., Kreuzeder, A., Glud, R. N. Two decades of chemical imaging of solutes in sediments and soils - a review. Analytica Chimica Acta. , 9-42 (2015).
- Glud, R. N. Oxygen dynamics of marine sediments. Marine Biology Research. 4 (4), 243-289 (2008).
- Revsbech, N. P., Jorgensen, B. B., Blackburn, T. H. Oxygen in the Sea Bottom Measured with a Microelectrode. Science. 207 (4437), 1355-1356 (1980).
- Klimant, I., Meyer, V., Kuhl, M. Fiberoptic oxygen microsensors, a new tool in aquatic biology. Limnology and Oceanography. 40 (6), 1159-1165 (1995).
- Glud, R. N., Tengberg, A., Kühl, M., Hall, P. O. J., Klimant, I., Holst, G. An in situ instrument for planar O2 optode measurements at benthic interfaces. Limnology and Oceanography. 46 (8), 2073-2080 (2001).
- Larsen, M., Borisov, S. M., Grunwald, B., Klimant, I., Glud, R. N. A simple and inexpensive high resolution color ratiometric planar optode imaging approach: application to oxygen and pH sensing. Limnology and Oceanography: Methods. 9, 348-360 (2011).
- Glud, R., Ramsing, N., Gundersen, J., Klimant, I. Planar optrodes:a new tool for fine scale measurements of two-dimensional O2 distribution in benthic communities. Marine Ecology Progress Series. 140, 217-226 (1996).
- Frederiksen, M. S., Glud, R. N. Oxygen dynamics in the rhizosphere of Zostera marina: A two-dimensional planar optode study. Limnology and Oceanography. 51 (2), 1072-1083 (2006).
- Quaranta, M., Borisov, S. M., Klimant, I. Indicators for optical oxygen sensors. Bioanalytical Reviews. 4, 115-157 (2012).
- Koren, K., Hutter, L., Enko, B., Pein, A., Borisov, S. M., Klimant, I. Tuning the dynamic range and sensitivity of optical oxygen-sensors by employing differently substituted polystyrene-derivatives. Sensors and Actuators B: Chemical. 176 (100), 344-350 (2013).
- Borisov, S. M. Fundamentals of Quenched Phosphorescence O2 Sensing and Rational Design of Sensor Materials. Quenched-phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. , 1-18 (2018).
- Wang, X., Wolfbeis, O. S. Optical methods for sensing and imaging oxygen: materials, spectroscopies and applications. Chemical Society Reviews. 43, 3666-3761 (2014).
- Ehgartner, J., Wiltsche, H., Borisov, S. M., Mayr, T. Low cost referenced luminescent imaging of oxygen and pH with a 2-CCD colour near infrared camera. The Analyst. 139 (19), 4924 (2014).
- Meier, R. J., Fischer, L. H., Wolfbeis, O. S., Schäferling, M. Referenced luminescent sensing and imaging with digital color cameras: A comparative study. Sensors and Actuators B: Chemical. 177, 500-506 (2013).
- Holst, G., Kohls, O., Klimant, I., König, B., Kühl, M., Richter, T. A modular luminescence lifetime imaging system for mapping oxygen distribution in biological samples. Sensors and Actuators B. 51, 163-170 (1998).
- Moßhammer, M., Brodersen, K. E., Kühl, M., Koren, K. Nanoparticle- and microparticle-based luminescence imaging of chemical species and temperature in aquatic systems: a review. Microchimical Acta. , 1-28 (2019).
- Koren, K., Kühl, M. CHAPTER 7. Optical O2 Sensing in Aquatic Systems and Organisms. Quenched-phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. 1, 145-174 (2018).
- Chen, H., Holst, G., Gratton, E. Modulated CMOS camera for fluorescence lifetime microscopy. Microscopy Research and Technique. 78, 1075-1081 (2015).
- Franke, R., Holst, G. A. Frequency-domain fluorescence lifetime imaging system (pco.flim) based on a in-pixel dual tap control CMOS image sensor. Proceedings of SPIE 93281, Imaging, Manipulation, and Analysis of Biomolecules, Cells, and Tissues XIII. , 1-19 (2015).
- Williams, P. N., et al. Localized flux maxima of arsenic, lead, and iron around root apices in flooded lowland rice. Environmental Science and Technology. 48 (15), 8498-8506 (2014).
- Schreml, S., et al. 2D luminescence imaging of physiological wound oxygenation. Experimental dermatology. 20 (7), 550-554 (2011).
- Trampe, E., et al. Functionalized Bioink with Optical Sensor Nanoparticles for O2 Imaging in 3D-Bioprinted Constructs. Advanced Functional Materials. 1804411, 1804411 (2018).
- Gouterman, M. Oxygen Quenching of Luminescence of Pressure Sensitive Paint for Wind Tunnel Research. Journal of Chemical Education. 74 (6), 697 (1997).
- Fischer, L. H., et al. Referenced dual pressure- and temperature-sensitive paint for digital color camera read out. Chemistry. 18 (49), 15706-15713 (2012).
- Fabricius-Dyg, J., Mistlberger, G., Staal, M., Borisov, S. M., Klimant, I., Kühl, M. Imaging of surface O2 dynamics in corals with magnetic micro optode particles. Marine Biology. 159 (7), 1621-1631 (2012).
- Koren, K., Jakobsen, S. L., Kühl, M. In-vivo imaging of O2 dynamics on coral surfaces spray-painted with sensor nanoparticles. Sensors and Actuators B: Chemical. 237, 1095-1101 (2016).
- Carraway, E. R., Demas, J. N., DeGraff, B. A., Bacon, J. R. Photophysics and Photochemistry of Oxygen Sensors Based on Luminescent Transition-Metal Complexes. Analytical Chemistry. 63 (4), 337-342 (1991).
- Klimant, I., Ruckruh, F., Liebsch, G., Stangelmayer, A., Wolfbeis, O. S. Fast response oxygen micro-optodes based on novel soluble ormosil glasses. Mikrochimica Acta. 131, 35-46 (1999).
- Askaer, L., Elberling, B., Glud, R. N., Kühl, M., Lauritsen, F. R., Joensen, H. P. Soil heterogeneity effects on O2 distribution and CH4 emissions from wetlands: In situ and mesocosm studies with planar O2 optodes and membrane inlet mass spectrometry. Soil Biology and Biochemistry. 42 (12), 2254-2265 (2010).
- Mayr, T., Borisov, S. M., Abel, T., Enko, B., Waich, K. Light Harvesting as a Simple and Versatile Way to Enhance Brightness of Luminescent Sensors. Analytical Chemistry. 81, 6541-6545 (2009).
- Kühl, M., et al. Microenvironmental Ecology of the Chlorophyll b-Containing Symbiotic Cyanobacterium Prochloron in the Didemnid Ascidian Lissoclinum patella. Frontiers in microbiology. 3, 1-18 (2012).
- Dalfen, I., Dmitriev, R. I., Holst, G., Klimant, I., Borisov, S. M. Background-Free Fluorescence-Decay-Time Sensing and Imaging of pH with Highly Photostable Diazaoxotriangulenium Dyes. Analytical Chemistry. 91 (1), 808-816 (2019).
- Chatni, M. R., Maier, D. E., Porterfield, D. M. Evaluation of microparticle materials for enhancing the performance of fluorescence lifetime based optrodes. Sensors and Actuators B: Chemical. 141, 471-477 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados