Method Article
Avaliando a capacidade de diferenciação das células epitelias da próstata do camundongo usando a cultura organóide
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os organóides da próstata do rato representam um contexto prometedor para avaliar os mecanismos que regulam a diferenciação. Este artigo descreve uma abordagem melhorada para estabelecer organóides da próstata e introduz métodos para (1) coletar lysato de proteína de organóides e (2) corrigir e manchar organóides para microscopia confocal de montagem inteira.
Resumo
O epitélio da próstata é composto predominantemente de células basais e luminais. O rastreamento de linhagem in vivo tem sido utilizado para definir a capacidade de diferenciação das células basais e luminais da próstata do camundongo durante o desenvolvimento, regeneração de tecidos e transformação. No entanto, avaliar os reguladores intrínsecos e extrínsecos da capacidade de diferenciação epitelia da próstata usando uma abordagem de rastreamento de linhagem muitas vezes requer reprodução extensa e pode ser proibitivo de custos. No ensaio organóide da próstata, as células basais e luminais geram epitélio prostático ex vivo. Importante, as pilhas epiteliais preliminares podem ser isoladas dos ratos de todo o fundo genético ou dos ratos tratados com todo o número de moléculas pequenas antes, ou depois, chapeando na cultura tridimensional (3D). Material suficiente para avaliação da capacidade de diferenciação é gerado após 7-10 dias. A coleta de organóides derivados de basais e derivados de luminal para (1) análise de proteína sofrível ocidental e (2) análise imunohistoquímica de organóides intactos por microscopia confocal de montagem inteira permite aos pesquisadores avaliar a diferenciação ex vivo capacidade de células epiteliais da próstata. Quando usadas em combinação, essas duas abordagens fornecem informações complementares sobre a capacidade de diferenciação das células basais e luminais da próstata em resposta à manipulação genética ou farmacológica.
Introdução
As células basais e luminais compõem a maioria do epitélio da próstata1. Estudos de rastreamento de linhagem revelaram que esses tipos de células são predominantemente auto-sustentados por progenitores distintos no rato adulto2; no entanto, a diferenciação luminal dos progenitores basais tem sido observada em vários contextos, incluindo o desenvolvimento3,4,regeneração detecidos 5,inflamação6,7 e iniciação ao câncer de próstata2,8. Além disso, os dados emergentes suportam a existência de progenitores luminais multipotentes, bem como progenitores comprometidos com lumina9. No câncer de próstata metastático, a diferenciação de uma linhagem luminal dependente da RA para uma linhagem indiferente à AR com características basais e neuroendócrinas representa um mecanismo cada vez mais apreciado de resistência aos inibidores da via andrógena10,11,12. Portanto, como a diferenciação está implicada na fisiologia normal, iniciação do câncer e resistência à terapia, elucidar os principais reguladores moleculares da diferenciação de células epiteliais da próstata é fundamental.
O modelo organóide da próstata do rato emergiu como um contexto exvivo elegante para estudar a diferenciação epitelial da pilha da próstata9,13,14. Neste ensaio, as células epiteliais individuais são banhadas em uma matriz 3D onde geram estruturas glandulares contendo células basais e luminais dentro de 1 semana. Embora as abordagens existentes para revestimento de células na cultura organóide possam ser usadas para gerar organóides de forma eficiente, essas abordagens exigem mais otimização14. Os desafios notáveis associados ao cultivo de organóides da próstata incluem (1) excluindo colônias bidimensionais (2D) que se formam o Matrigel (gel de matriz) da análise, (2) mantendo a integridade do gel de matriz durante as mudanças na mídia e (3) contando organóides com precisão. Este artigo descreve uma abordagem para gerar organóides a partir de células epiteliais isoladas da próstata do rato. A abordagem descrita envolve placas de revestimento com poli (2-hidroxyethyl methacrylate) (Poly-HEMA) para evitar a ocorrência de colônias 2D. Além disso, as células são banhadas em um anel de gel matriz, ao invés de um disco de gel matriz, o que torna a mudança da mídia e contando organóides menos desafiador. Essas técnicas permitem que os pesquisadores investiguem mais facilmente como alterações genéticas ou pequenas moléculas introduzidas antes ou durante a formação organóide alteram processos-chave, como diferenciação.
A colheita de organóides da próstata para a mancha ocidental ou análise imunohistoquímica por microscopia confocal de montagem inteira pode fornecer uma visão mecanicista valiosa sobre diferenciação13,mas protocolos bem estabelecidos para preparar organóides para tais técnicas estão faltando. Este manuscrito descreve abordagens para colher organóides para (1) coleta de lysato de proteína, ou (2) fixação e coloração para microscopia confocal. É importante ressaltar que a abordagem descrita para a fixação e coloração de organóides da próstata é consideravelmente melhorada em relação aos métodos existentes. Embora estes dependem de organóides seccionados15, o método descrito neste manuscrito utiliza organóides intactos, o que ajuda a proteger contra danos organóides durante a preparação da amostra. Quando usado em combinação, mancha ocidental e microscopia confocal pode fornecer informações valiosas sobre os reguladores moleculares da diferenciação. Alternativamente, essas abordagens podem ser usadas para modelar outros processos, como desenvolvimento e transformação.
Protocolo
Todos os métodos descritos aqui foram aprovados pelo Institutional Review Board da Universidade da Califórnia, Los Angeles.
Nota: Um esquema que ilustra as abordagens descritas no artigo é fornecido na Figura 1.
1. Isolando células epiteliais do mouse Basal e luminal da próstata usando classificação celular ativada por fluorescência (FACS) - TIMING: 30 Min
Nota: Executar passos 1.3-1.5 no escuro.
- Depois de dissociar as células da próstata total do camundongo, conforme descrito em Lawson et al.16,transfira as células para tubos FACS e resuspenda 0,1-5 x 106 células em 100 μL de mídia de dissociação (Tabela 1).
- Adicione o volume apropriado dos seguintes anticorpos primários diretamente conjugados: CD45, CD31, Ter-119, EpCAM e CD49f.
- Incubar no gelo, protegido da luz, por 20 min.
Nota: Recomenda-se utilizar 10% do total de células dissociadas para controles não manchados e manchados. Esses controles são necessários para definir a compensação correta e a tensão para a classificação. - Saciar o coquetel de anticorpos adicionando 1 mL de mídia de dissociação a cada amostra. Pelotas as células por centrífuga em 800 x g para 5 min à temperatura ambiente (RT) e remover o supernatant por aspiração.
- Resuspenda as células em volume adequado (250 μL por 1 x 106 células) de meios de dissociação contendo 1 μg/mL 4',6-diamidino-2-fenillindole (DAPI). Vá para a FACS. Parcelas de citometria de fluxo demonstrando isolamento de células epiteliais basais e luminais da próstata são ilustradas na Figura 2.
2. Chapeamento classificados células epitelia da próstata em cultura organóide do rato primário - TIMING: 2-3 H (excluindo Poly-HEMA-revestido de preparação da placa)
Nota: As placas são revestidas com Poly-HEMA para evitar a formação de colônias 2D na superfície do poço abaixo do gel de matriz. Prepare placas revestidas de Poli-HEMA 1 dia antes do revestimento classificado samária ou células epiteliais da próstata luminal na cultura organóide do rato. Descongele 1 mL alíquotas de gel de matriz de fator de crescimento reduzido, posteriormente referido como gel de matriz, no gelo 2 h antes do passo 2.1. Y-27632 (inibidor de ROCHA) deve ser adicionado aos meios organoid do rato imediatamente antes da etapa 2.1. Executar etapas 2.1-2.8 no gelo.
- Pelotas as células em 5 mL tubos de fundo redondo por centrífuga a 800 x g para 5 min a 4 °C e aspirar o supernatant.
- Lave a pelota celular em 500 μL de mídia organóide do rato (Tabela 2)14.
- Pelotas as células por centrífuga a 800 x g por 5 min a 4 °C e aspiram o supernatant.
- Resuspenda na mídia organóide do camundongo em uma densidade celular de 1.000 células/μL.
- Para preparar misturas mestras, misture células epiteliais suspensas na mídia organóide do mouse com gel de matriz para gerar uma mistura final que contém 25% de células/mídia e gel de matriz de 75%. As células basais são tipicamente banhadas a uma concentração de 100-2.000 células/80 μL, enquanto as células luminais são tipicamente banhadas a uma concentração de 2.000-10.000 células/80 μL. A densidade de células banhadas varia dependendo do dia da coleta de material antecipada e da aplicação a jusante desejada.
Nota: Chill tubo de tamanho adequado (s) para o volume de mistura mestre esperado 5 min antes da preparação mix mestre. Para garantir que o gel de matriz não endureça durante o manuseio, é fundamental para esfriar a ponta da pipeta, pipetting o gel matriz 3-4 vezes antes de transferi-lo para um novo tubo. - Adicione 80 μL da mistura de gel/célula de matriz por poço de uma placa de 24 poços. Pipetting uma gota na metade inferior da parede do poço, evitando o contato direto com o revestimento Poly-HEMA é recomendado. Depois de adicionar o gel de matriz, redemoinho da placa para permitir que a matriz de gel / mistura de células para formar um anel em torno da borda do poço.
- Coloque a placa de 24 poços em uma incubadora de CO2 de 37 °C 5% para 10 min para permitir que o gel de matriz endureça parcialmente.
Nota: Comece a aquecer a mídia organóide do rato a 37 °C imediatamente após colocar a placa de 24 poços na incubadora. - Depois de incubar por 10 min, vire a placa de 24 poços de cabeça para baixo e incubar por um adicional de 50 min para permitir que o gel matriz para endurecer completamente.
- Adicione 350 μL de mídia organóide de camundongo pré-aquecido dropwise para o centro de cada poço.
Nota: Para manter a integridade do gel da matriz, é crítico evitar o anel do gel da matriz ao adicionar meios. - Depois de adicionar a mídia, devolva a placa de 24 poços para a incubadora de CO2 de 37 °C 5%.
3. Reabastecendo Mouse Organoid Media - TIMING: 10-15 Min Por placa de 24 poços
Nota: Os meios de comunicação existentes devem ser substituídos por novos meios de comunicação a cada 48 h. Antes de cada mudança de mídia, mídia organóide pré-quente do mouse. Não é necessário adicionar inibidor de ROCHA aos meios usados para reabastecer.
- Incline a placa de 24 poços em um ângulo de 45° e remova delicadamente os meios existentes do centro de cada poço usando uma pipeta p1000, ao evitar o anel do gel da matriz.
- Adicione 350 μL de mídia organóide de camundongo pré-aquecido como no passo 2.9. Recomenda-se adicionar um volume maior de meios de comunicação (até 1 mL) aos organóides cultivados por mais de 5 dias, a fim de evitar o esgotamento rápido dos principais nutrientes e fatores de crescimento.
4. Extraindo a proteína Lysate dos Organoids da próstata para a análise ocidental do borrão - SINCRONISMO: 2.5-4 H
Nota: Antes de coletar organóides para extração de lysato de proteína, preparar e pré-quente dispase contendo mídia(Tabela 1).
- Retire a mídia de cada um bem como no passo 3.1.
- Para coletar organóides, repetidamente explodir o gel matriz por pipetting 1 mL de dispase contendo mídia diretamente para o anel de gel matriz até que todo o anel é desalojado, e transferir para um tubo de microcentrífuga de 1,5 mL.
Nota: É fundamental evitar o contato direto com os poços revestidos de Poli-HEMA. O contato direto pode causar contaminação do material coletado com Poly-HEMA, o que pode afetar negativamente a sobrevivência celular. - Coloque o tubo de microcentrífuga de 1,5 mL (s) em uma incubadora de CO2 de 37 °C 5% por 30 min a 1 h para permitir a digestão completa do gel de matriz por dispase.
- Organóides de pelotas por centrífuga a 800 x g por 5 min na RT e remover o supernatant usando uma micropipette.
- Adicione soro lógico tampão de fosfato (PBS) para a pelota organóide e resuspender suavemente flicking.
Nota: A falta de resuspendência suficiente da pelota organóide pode resultar na contaminação de material organóide com dispase residual ou gel de matriz. - Pelotas os organóides por centrífuga a 800 x g por 5 min em RT e remover o supernatant usando uma micropipette.
- Congele rapidamente as pelotas organóides, colocando cada tubo em uma solução contendo gelo seco e metanol. Guarde o tubo (s) até uso futuro em -80 °C. Alternativamente, extraa a lysate da proteína imediatamente depois da etapa 4.6.
- Resuspenda as pelotas organóides em 100 μL de tampão de lyse de proteína (Tabela 1)por 10 μL de volume de células embaladas. Flick para resuspender.
Nota: Se retomar após o congelamento rápido, assegure que o amortecedor de licisse de proteína seja descongelado antes de remover amostras de -80 °C, uma vez que o amortecedor de lyse deve ser adicionado às amostras imediatamente, a fim de evitar a atividade de fosfatase e protease. - Incubar as amostras no amortecedor da lyse da proteína no gelo para pelo menos 45 min.
Nota: Recomenda-se sonicate antes da incubação no gelo para aumentar a eficiência da recuperação da proteína nuclear; no entanto, a sonorização não é necessária. Se a sonorização não for realizada, prossiga para o passo 4.10.- Para sonicate, submergir tubos no gelo molhado e aplicar delicadamente a ponta do dismembrator sónico à parte externa do tubo do microcentrídigio. Sonicate para 40 s em 20 kHz.
- Siga para a mancha ocidental seguindo protocolos estabelecidos.
5. Fixação e coloração organóides da próstata para análise imunohistoquímica por toda a montagem Confocal Microscopy
-
Coleta de organóides da próstata a partir de placas de 24 poços - TIMING: 45-60 min
Nota: Ao coletar organóides da próstata para processar a microscopia confocal, é fundamental para lidar com eles com cuidado, a fim de manter sua estrutura. O protocolo de coleta abaixo é projetado para reduzir a interrupção da estrutura organóide durante o isolamento.- Retire a mídia de cada um bem como no passo 3.1.
- Diigerem o gel de matriz incubando com 500 μL de mídia contendo dispase(Tabela 1)por 30 min em uma incubadora de CO2 de 37 °C 5%.
- Coletar suspensão organóide digerida em um tubo de microcentrífuga e pelotas os organóides por centrífuga a 800 x g por 3 min em RT. Remova o supernatant.
-
Coloração imunofluorescente de montagem inteira de organóides da próstata - TIMING: 3-4 dias (1-5 h/dia)
- Adicione 500 μL de paraformaldeído de 4% na PBS e incubar por 2 h no RT com agitação suave.
- Pelotas os organóides por centrífuga a 800 x g por 3 min em RT, remover o supernatant, e lavar a pelota com 1 mL de PBS por 15 min com agitação suave.
- Lave a pelota como no passo 5.2.2 para mais duas vezes.
- Pelotas os organóides por centrífuga a 800 x g por 3 min em RT e remover o supernatant. Adicionar 1 μg/mL DAPI na solução de bloqueio(Tabela 1). Incubar por 2 h em RT ou, alternativamente, durante a noite em 4 ° C com agitação suave.
- Pelotas os organóides por centrífuga a 800 x g por 3 min em RT e remover o supernatant. Adicione o anticorpo primário (coelho anti-p63, rato anti-citoqueratina 8) na solução de bloqueio e incubar durante a noite em 4 °C com agitação suave.
- Pelotas os organóides por centrífuga a 800 x g por 3 min em RT e remover o supernatant. Lave a pelota com 1 mL de PBS por 15 min com agitação suave.
- Lave a pelota como no passo 5.2.6 para mais duas vezes.
- Pelotas os organóides por centrífuga a 800 x g por 3 min em RT e remover o supernatant. Adicione o anticorpo secundário (cabra anti-coelho IgG-Alexa Fluor 594, cabra anti-mouse IgG-Alexa Fluor 488) na solução de bloqueio e incubar durante a noite em 4 °C com agitação suave.
- Pelotas os organóides por centrífuga a 800 x g por 3 min em RT, remover o supernatant, e lavar a pelota com 1 mL de PBS por 15 min com agitação suave.
- Lave a pelota como no passo 5.2.9 para mais duas vezes.
6. Limpeza de tecidos e montagem dos organóides da próstata manchada para whole-mount Confocal Microscopy - TIMING: 7 H
- Pelotas os organóides por centrífuga a 800 x g por 3 min em RT e remover o supernatant.
- Adicionar 1 mL de 30% de sacarose na PBS com 1% Triton X-100 e incubar por 2 h no RT com agitação suave.
- Pelotas os organóides por centrífuga a 800 x g por 3 min em RT e remover o supernatant.
- Adicionar 1 mL de 45% de sacarose na PBS com 1% Triton X-100 e incubar por 2 h no RT com agitação suave.
- Pelotas os organóides por centrífuga a 800 x g por 3 min em RT e remover o supernatant.
- Adicionar 1 mL de 60% de sacarose na PBS com 1% Triton X-100 e incubar por 2 h no RT com agitação suave.
- Pelotas os organóides por centrífuga a 800 x g por 3 min em RT e remover 95% do supernatant.
Nota: A pelota torna-se mais frouxa enquanto a concentração da sacarose se torna mais elevada. Recomenda-se observar os organóides manchados de DAPI a luz UV para confirmar que não foram perdidos durante a remoção do supernatant. - Transfira uma gota de 10-20 μL da suspensão restante para um coverslip com câmara e prossiga para microscopia confocal.
Nota: Fragmentos de deslizamento de capa podem ser colocados em ambos os lados da gotícula para serem usados como espaçadores (Figura 4C). Estes impedem que os organóides colapsem quando um coverslip é coloc sobre a gota.
Resultados
As células epiteliais da próstata são banhadas na cultura organóide do rato, onde formam organóides, que são colhidos antes da preparação para a análise a jusante (Figura 1).
As células epiteliais basais e luminais são isoladas usando FACS. Depois de excluir dapi+ células e esgotar lin+ células (CD45, CD31, Ter119), as células basais e luminais são distinguidas com base na expressão diferencial de EpCAM e CD49f (Figura 2). A abordagem descrita para placa de células basais e luminais da próstata na cultura organóide implica: (1) células de revestimento em anéis de gel matriz, e (2) poços de revestimento com Poly-HEMA. Revestimento em anéis foi descrito previamente em Agarwal eoutros9. A utilização dessa abordagem(Figura 3A)permite que os pesquisadores evitem mais facilmente o gel de matriz enquanto reabastecem a mídia (Passo 3), e mais facilmente contam organóides seguindo a circunferência do poço. Poços de revestimento com Poli-HEMA tem sido mostrado para evitar a formação de colônias 2D em organóides da retina17; no entanto, essa abordagem não tem sido utilizada no modelo organóide da próstata. É importante ressaltar que poços de revestimento com Poly-HEMA(Tabela 3)eliminam a ocorrência de colônias 2D sem interferir na formação organóide (Figura 3B). Estas modificações expandem as capacidades do ensaio organóide da próstata.
As células basais e luminais formam organóides com morfologias distintas (Figura 4A). Enquanto a maioria dos organóides derivados da basana são semelhantes em tamanho (100-300 μm de diâmetro) após 7 dias na cultura, organóides derivados da luminal apresentam heterogeneidade significativa (30-450 μm de diâmetro). Além disso, a maioria dos organóides derivados da basana contêm lumens cercados por epitélio multicamadas (Figura 4A, superior),enquanto organóides derivados de lumina variam em morfologia de oco, com epitélio de camada única a sólido, com cabos de várias camadas de células que não canalizam (Figura 4A, inferior). As abordagens descritas acima para preparar organóides para análise a jusante (Passos 4, 5), foram usadas para investigar se essas diferenças pofonípicas refletem as diferenças na expressão do marcador de linhagem. A análise ocidental da mancha revelou que os organóides basais e lumina-derivados retêm as características associadas com as pilhas preliminares basais e luminal. Organóides derivados de basais expressam níveis mais elevados do marcador basalista citoqueratina 5 (K5), enquanto organóides derivados da lumina expressam níveis mais elevados do marcador luminal citoqueratina 8 (K8) (Figura 4B). Marcadores basais e luminais foram detectados em organóides basais e derivados da luminal na população a granel, talvez sugestivos de diferenciação (Figura 4B).
Procuramos caracterizar a expressão do marcador de linhagem em organóides derivados da basadura e determinar se organóides derivados da luminal morfologicamente distintos apresentam diferenças na expressão do marcador, manchando organóides intactos e realizando microscopia confocal (Figura 4D). Organóides derivados de basais continham epitélio em várias camadas com camadas externas expressando altos níveis do marcador basal p63 e níveis moderados do marcador luminal K8 (p63hi,K8mid), e camadas internas sem níveis detectáveis de p63 e altos níveis de K8 (p63lo,K8hi) (Figura 4D, superior). Enquanto todas as células em organóides derivados de luminal de camadaúnica manchadapositivamente para K8, apenas células selecionadas continham p63 nuclear (Figura 4D, inferior). Esses dados validam as abordagens de colheita e preparação de organóides para análise por borrão ocidental ou microscopia confocal e, assim, expandem a capacidade do ensaio organóide para estudar os principais processos celulares, incluindo a diferenciação.
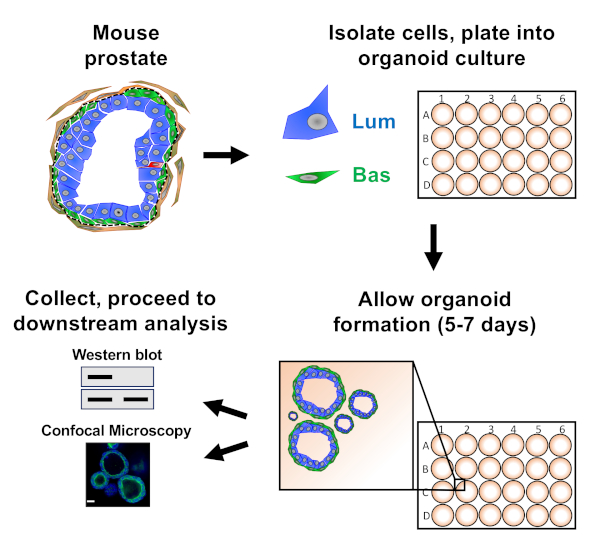
Figura 1: Esquemático ilustrando fluxo de trabalho para gerar organóides da próstata para coleta e análise. A próstata total do camundongo é dissociada e as células epiteliais da próstata bauminal e luminal são isoladas pela triagem celular ativada por fluorescência através de protocolos estabelecidos18,19. Células basais ou luminais suspensas em uma mistura de mídia organóide do mouse e gel de matriz são banhadas em anéis de gel de matriz. Após 5 a 7 dias de cultura, organóides são colhidos para análise por borrão ocidental ou microscopia confocal. Clique aqui para ver uma versão maior deste número.
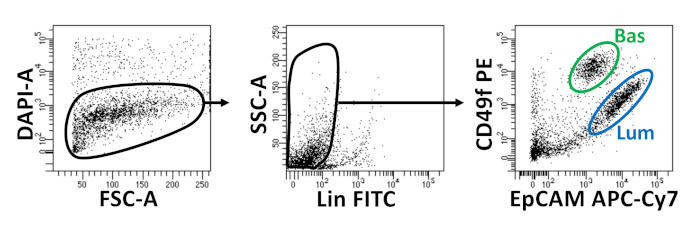
Figura 2: Isolamento de células epiteliais basais e luminais da próstata com triagem de células ativadas por fluorescência (FACS). Células dissociadas da próstata do rato são manchadas com DAPI, para distinguir ao vivo de células mortas e anticorpos superficiais, para distinguir basais das células luminais, antes da FACS. Esquerda = Fechado em células DAPI. FSC-A = dispersão para a frente. Centro = Fechado em Lin- células (CD45lo,CD31lo, Ter119lo). SSC-A = dispersão lateral. Direita = Células Basal (Bas) (EpCAMoi,CD49foi),células luminais (Lum) (EpCAMoi,CD49fmeados). Clique aqui para ver uma versão maior deste número.
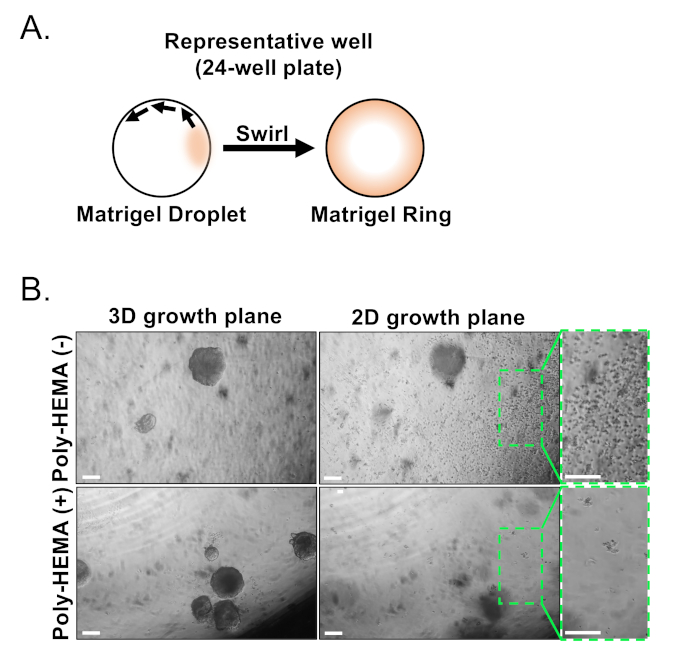
Figura 3: Estabelecimento de organóides da próstata do rato. (A)Esquemática ilustrando abordagem para gerar um anel de gel matriz em um poço de uma placa de 24 poços. (B) Imagens representativas de contraste de fase de organóides (plano de crescimento 3D) e colônias bidimensionais (plano de crescimento 2D) formadas 7 dias após o revestimento de células epiteliais da próstata em placas não revestidas (Poli-HEMA (-)) ou revestidas (Poly-HEMA (+)) 24-bem. Regiões encaixotadas dentro do plano de crescimento 2D são ampliadas à direita. Barras de escala = 200 μm. Por favor, clique aqui para ver uma versão maior deste número.
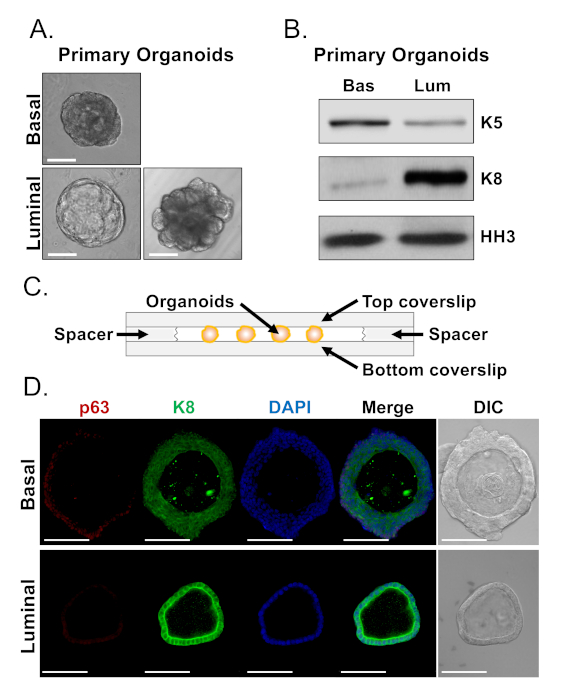
Figura 4: Análise da expressão do marcador da linhagem em organóides da próstata pela mancha ocidental e pela microscopia confocal da inteiro-montagem. (A)As imagens representativas do contraste da fase de organóides basal-derivados (superior) e luminal-derivados (inferior) após 7 dias da cultura. Barra de escala = 100 μm. (B)Análise ocidental da mancha de organóides basal-derivados (Bas) e luminal-derivados (Lum) após 5 dias da cultura. Coloração para o marcador basal, citoqueratina 5 (K5), e o marcador luminal, citoqueratina 8 (K8), e um controle de carga, histone H3 (HH3). (C)Esquemático ilustrando coverslip com câmara. (D)Contraste representativo de interferência diferencial (DIC) e imagens imunofluorescentes de organóides derivados de basais (superior) e derivados de luminal (inferior) após 7 dias de cultura. Coloração para p63 (vermelho), K8 (verde) e DAPI (azul) individualmente e fundiu. Barras de escala = 100 μm. Por favor, clique aqui para ver uma versão maior deste número.
| Receitas | |
| Mídia contendo Dispase | 1 mg/mL dispase + 10 μM inibidor de ROCHA em DMEM F12 avançado. Filtrar esterilizar usando filtro de 0,22 μm. |
| Mídia de dissociação | 10% FBS + 1x Penicilina-Estreptomicina em RPMI 1640. Filtrar esterilizar usando filtro de 0,22 μm. |
| Tampão da lyse da proteína | RIPA buffer + inibidores da fosfatase + inibidores da protease |
| Solução de bloqueio | 10% FBS em PBS com 0,2% Triton X-100 |
Tabela 1: Instruções para a preparação de soluções-chave.
| Componente | Concentração |
| B-27 B-27 | 1x (diluir a partir de 50x concentrado) |
| GlutaMAX GlutaMAX | 1x (diluir a partir de 100x concentrado) |
| N-acetil-L-cisteína | 1,25 mM |
| Normocin Normocin | 50 μg/mL |
| EGF humano recombinante, animal-livre | 50 ng/mL 50 ng/mL |
| Nóggin humano recombinante | 100 ng/mL 100 ng/mL |
| R-spondin 1-condicionado mídia | 10% de mídia condicionada |
| A83-01 A83-01 | 200 nM |
| Dht | 1 nM 1 nM |
| Dicloreto Y-27632 (inibidor de ROCHA) | 10 μM 10 μM |
| DMEM avançado/F-12 | Mídia de base |
| R-spondin 1-condicionado mídia é gerada como descrito em Drost, et al.13. Após a adição de todos os componentes, o filtro esteriliza a mídia organóide do mouse usando filtro de 0,22 μm. O inibidor da ROCHA só é adicionado durante o estabelecimento da cultura e da passagem de organóides. | |
Tabela 2: Instruções para a preparação da mídia organóide do mouse.
| Protocolo para preparar placas revestidas de Poli-HEMA | |
| 1 | Adicione 0,25 g de Poly-HEMA a 50 mL 98% EtOH. Dissolva Poly-HEMA a 37 °C em uma coqueteleira. Este processo leva pelo menos 4 h. |
| 2 | Filtro esterilizar Poly-HEMA usando filtro de 0,22 μm. |
| 3 | Adicione 200 μl de solução Poly-HEMA por poço de uma placa de 24 poços (s). |
| 4 | Retire a tampa (s) de placa de 24 poços (s) depois de adicionar Poly-HEMA e permitir que a solução evapore durante a noite. |
| 5 | Lave cada poço duas vezes com PBS e certifique-se que os poços estejam completamente secos antes do armazenamento após a lavagem final. NOTA: Interromper o revestimento Poly-HEMA durante a lavagem pode contribuir para o crescimento bidimensional após o revestimento de células epiteliais na cultura organóide. Para evitar danos aos poços revestidos de Poli-HEMA, evite o contato direto com a ponta da pipeta durante a lavagem. A integridade dos poços revestidos de Poli-HEMA permanecerá intacta a menos que o Poly-HEMA seja raspado pela ponta da pipeta. |
| 6 | Placas revestidas de Poli-HEMA podem ser armazenadas a 4 °C por até duas semanas. NOTA: As placas de envolvimento em parafilme antes do armazenamento reduzirão o risco de contaminação. |
Tabela 3: Protocolo para preparação de placas revestidas de Poli-HEMA.
Discussão
A diferenciação epitelial da pilha da próstata foi implicada na biologia normaldapróstata2,3,4,5,6,6,7 e biologia da doença8,10,11,12; no entanto, os reguladores mestres deste processo permanecem indefinidos. Identificar os principais reguladores da diferenciação de células epiteliais da próstata tem sido difícil, em parte, devido à ausência de contextos bem estabelecidos para modelá-la. Enquanto a cultura monocamada 2D pode ser usada para modelar a diferenciação11,12,esse contexto não consegue recapitular o complexo microambiente da próstata. Além disso, os contextos in vivo para modelar a diferenciação não se prestam aos estudos mecanicistas, pois são desafiadores para manipular. Portanto, a identificação de um contexto fácil de manipular, mas fisiologicamente relevante, para estudar a diferenciação é crítica.
O modelo organóide da próstata representa um contexto elegante ex vivo onde a diferenciação basal à luminal é relatada para ocorrer. Métodos para estabelecer organóides da próstata estão bem estabelecidos14; no entanto, é necessária uma otimização adicional desses métodos. Além disso, as abordagens para colher e preparar organóides da próstata para análise não são claramente descritas. Este artigo descreve uma abordagem para as células epitelia da próstata de placa isoladas da próstata do rato na cultura organóide. Essa abordagem permite que os pesquisadores (1) impeçam a ocorrência de colônias 2D durante a formação organóide(2) reduzem o risco de ruptura do gel de matriz durante o reabastecimento de mídia e (3) contam organóides de forma mais eficaz. Além disso, este manuscrito descreve abordagens para a colheita de organóides para preparação para a análise de borrões ocidentais, ou microscopia confocal de montagem inteira. É importante ressaltar que a abordagem utilizada para preparar organóides para microscopia confocal mantém a estrutura intacta dos organóides através de sua duração, o que reduz os danos organóides antes da aquisição de imagem. Ao todo, as abordagens descritas expandem as capacidades do ensaio organóide da próstata.
Notavelmente, a capacidade organóide de células basais e luminais pode ser alterada tanto por métodos utilizados para isolar as respectivas populações quanto pelas condições culturais. As condições de cultura organóide utilizadas neste ensaio foram descritas pela primeira vez por Karthaus et al.13. Considerando que Karthaus et al. relataram que as células basais têm uma maior capacidade de formação organóide (15%) than luminal cells (1%)13, Chua et al., usando métodos distintos de isolamento e condições culturais, relataram que as células luminais (0,2-0,3%) têm uma maior capacidade organóide do que as células basais (0,03%)20. Em geral, métodos descritos por Karthaus et al. levam a maiores taxas organóides para células basais e luminais, provavelmente refletindo diferenças na abordagem usada para isolar as células basais e luminais13,em oposição às condições culturais que se bias contra a formação organóide das células luminais. Ainda não está claro se o protocolo descrito neste manuscrito favorece a formação de organóides luminados de progenitores luminais multipotentes, ou progenitores cometidos-luminais9. Embora estudos de rastreamento de linhagem oportuna e custo-proibitivos, os estudos de rastreamento de linhagem in vivo podem ser usados para validar características progenitoras associadas a linhagens epiteliais distintas da próstata elucidadas no ensaio organóide.
Processos como desenvolvimento, diferenciação e transformação não são apenas relevantes para a biologia da próstata, mas também relevantes para a biologia de outros tecidos, incluindo o cérebro, pulmão, intestino, pâncreas e fígado. Os métodos descritos facilitam a utilização do modelo organóide para estudar esses processos não apenas na próstata, mas também em uma ampla gama de tecidos.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
PDC e JMG são apoiados pelo Ruth L. Kirschstein National Research Service Award GM007185. Jad é apoiado pelo Instituto Nacional de Ciências Médicas Gerais dos Institutos Nacionais de Saúde (R25GM055052) concedido a T. Hasson e a Saul Martinez Scholarship. A ASG é apoiada pelo Spitzer Family Foundation Fund Fund e pelo Gill Endowment. Este trabalho foi apoiado pela American Cancer Society (RSG-17-068-01-TBG), Departamento de Defesa (W81XWH-13-1-0470), Margaret E. Early Medical Research Trust, NIH/NCI (P50CA092131/UCLA SPORE in Prostate Cancer), Rose Hills Foundation, and support from UCLA's Jonsson Comprehensive Cancer Center, Broad Stem Cell Research Center, Clinical and Translational Science Institute, and Institute of Urologic Oncology.
Materiais
| Name | Company | Catalog Number | Comments |
| µ-Dish 35 mm, high | ibidi | 81156 | |
| 16% Paraformaldehyde | Thermo Fisher Scientific | 50-980-487 | |
| 4’,6-diamidino-2-phenylindole (DAPI) | Thermo Fisher Scientific | D1306 | |
| A83-01 | Tocris | 2939 | |
| Advanced DMEM/F-12 | Thermo Fisher Scientific | 12634010 | |
| APC/Cy7 anti-mouse CD326 (Ep-CAM) Antibody, 100 μg | BioLegend | 118218 | |
| B-27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| Complete Protease Inhibitor Cocktail | Sigma | 11836145001 | |
| (DiHydro)testosterone (5α-Androstan-17β-ol-3-one) | Sigma | A-8380 | |
| Dispase II, Powder | Thermo Fisher Scientific | 17-105-041 | |
| Fetal Bovine Serum (FBS) | Sigma | F8667 | |
| FITC anti-mouse CD31 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 102405 | |
| FITC anti-mouse CD45 Antibody (0.5 mg/mL, 50 μg) | BioLegend | 103107 | |
| FITC anti-mouse TER-119/Erythroid Cells Antibody (0.5 mg/mL, 50 μg) | BioLegend | 116205 | |
| Goat anti-mouse IgG-Alexa Fluor 488 | Invitrogen | A28175 | |
| Goat anti-rabbit IgG-Alexa Fluor 594 | Invitrogen | A11012 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Halt Phosphatase Inhibitor | Thermo Fisher Scientific | 78428 | |
| Matrigel GFR Membrane Matrix | Corning | CB-40230C | |
| Mouse anti-cytokeratin 8 | BioLegend | 904804 | |
| N-acetyl-L-cysteine | Sigma | A9165 | |
| Normocin | Thermo Fisher Scientific | ant-nr-1 | |
| PE anti-human/mouse CD49f Antibody | BioLegend | 313612 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15-140-122 | |
| Poly(2-hydroxyethyl methacrylate) (Poly-HEMA) | Sigma | P3932-25G | |
| Rabbit anti-p63 | BioLegend | 619002 | |
| Radioimmunoprecipitation assay (RIPA) | Thermo Fisher Scientific | PI89901 | |
| Recombinant Human EGF, Animal-Free | PeproTech | AF-100-15 | |
| Recombinant Human Noggin | PeproTech | 120-10C | |
| RPMI 1640 Medium, HEPES (cs of 10) | Thermo Fisher Scientific | 22400105 | |
| Sonic Dismembrator | Thermo Fisher Scientific | FB120 | |
| Sucrose | Sigma | S0389-500G | |
| Triton X-100 | Sigma | X100-5ML | |
| Y-27632 dihydrochloride (ROCK inhibitor) | Selleck Chemical | S1049-50MG |
Referências
- Kwon, O. J., Xin, L. Prostate epithelial stem and progenitor cells. American Journal of Clinical and Experimental Urology. 2 (3), 209-218 (2014).
- Choi, N., Zhang, B., Zhang, L., Ittmann, M., Xin, L. Adult Murine Prostate Basal and Luminal Cells Are Self-Sustained Lineages that Can Both Serve as Targets for Prostate Cancer Initiation. Cancer Cell. 21 (2), 253-265 (2012).
- Ousset, M., Van Keymeulen, A., et al. Multipotent and unipotent progenitors contribute to prostate postnatal development. Nature Cell Biology. 14 (11), 1131-1138 (2012).
- Wang, J., et al. Symmetrical and asymmetrical division analysis provides evidence for a hierarchy of prostate epithelial cell lineages. Nature Communications. 5, 1-13 (2014).
- Wang, Z. A., Mitrofanova, A., et al. Lineage analysis of basal epithelial cells reveals their unexpected plasticity and supports a cell-of-origin model for prostate cancer heterogeneity. Nature Cell Biology. 15 (3), 274-283 (2013).
- Kwon, O. J., Zhang, B., Zhang, L., Xin, L. High fat diet promotes prostatic basal-to-luminal differentiation and accelerates initiation of prostate epithelial hyperplasia originated from basal cells. Stem Cell Research. 16 (3), 682-691 (2016).
- Kwon, O. J., Zhang, L., Ittmann, M. M., Xin, L. Prostatic inflammation enhances basal-to-luminal differentiation and accelerates initiation of prostate cancer with a basal cell origin. Proceedings of the National Academy of Sciences. 192 (3), 997-999 (2014).
- Stoyanova, T., et al. Prostate cancer originating in basal cells progresses to adenocarcinoma propagated by luminal-like cells. Proceedings of the National Academy of Sciences. 110 (50), 20111-20116 (2013).
- Agarwal, S., Hynes, P. G., et al. Identification of Different Classes of Luminal Progenitor Cells within Prostate Tumors. Cell Reports. 13 (10), 2147-2158 (2015).
- Ku, S. Y., et al. Rb1 and Trp53 cooperate to suppress prostate cancer lineage plasticity, metastasis, and antiandrogen resistance. Science. 355 (6320), 78-83 (2017).
- Mu, P., et al. SOX2 promotes lineage plasticity and antiandrogen resistance in TP53- and RB1-deficient prostate cancer. Science. 355 (6320), 84-88 (2017).
- Bishop, J. L., et al. The Master Neural Transcription Factor BRN2 Is an Androgen Receptor-Suppressed Driver of Neuroendocrine Differentiation in Prostate Cancer. Cancer Discovery. 7 (1), 54-71 (2016).
- Karthaus, W. R., et al. Identification of multipotent luminal progenitor cells in human prostate organoid cultures. Cell. 159 (1), 163-175 (2014).
- Drost, J., Karthaus, W. R., et al. Organoid culture systems for prostate epithelial and cancer tissue. Nature Protocols. 11 (2), 347-358 (2016).
- McCray, T., Richards, Z., Marsili, J., Prins, G. S., Nonn, L. Handling and Assessment of Human Primary Prostate Organoid Culture. Journal of Visualized Experiments. (143), e59051(2019).
- Lawson, D. A., Xin, L., Lukacs, R. U., Cheng, D., Witte, O. N. Isolation and functional characterization of murine prostate stem cells. Proceedings of the National Academy of Sciences of the United States of America. 104 (1), 181-186 (2007).
- Chen, H. Y., Kaya, K. D., Dong, L., Swaroop, A. Three-dimensional retinal organoids from mouse pluripotent stem cells mimic in vivo development with enhanced stratification and rod photoreceptor differentiation. Molecular vision. 22, 1077-1094 (2016).
- Liu, X., et al. Low CD38 Identifies Progenitor-like Inflammation-Associated Luminal Cells that Can Initiate Human Prostate Cancer and Predict Poor Outcome. Cell Reports. 17 (10), 2596-2606 (2016).
- Lukacs, R. U., Goldstein, A. S., Lawson, D. A., Cheng, D., Witte, O. N. Isolation, cultivation and characterization of adult murine prostate stem cells. Nature protocols. 5 (4), 702-713 (2010).
- Chua, C. W., Shibata, M., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nature Cell Biology. 16 (10), 951-961 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados