Method Article
Métodos de Cultura para determinar o limite de detecção e sobrevivência em mídia de transporte de Campylobacter Jejuni em espécimes fecais humanos
Neste Artigo
Resumo
Embora a cultura das fezes para Campylobacter seja imprecisa, ela ainda é considerada o padrão-ouro para identificação. Métodos para determinar o limite de detecção e sobrevivência em meios de transporte de C. jejuni em fezes humanas são descritos e comparados com um novo imunoensaio com melhor precisão.
Resumo
Uma cultura de fezes humanas para o diagnóstico de doença intestinal baseada em Campylobacterleva vários dias, uma espera que tributa a fortaleza do médico e do paciente. Uma cultura também é propensa a resultados falsos negativos da perda aleatória de viabilidade durante o manuseio de amostras, crescimento excessivo de outras flora fecal, e baixo crescimento de várias espécies patogênicas de Campylobacter na mídia tradicional. Esses problemas podem confundir decisões clínicas sobre o tratamento do paciente e limitar ambulatos de responder a questões fundamentais sobre o crescimento e infecções de Campylobacter. Descrevemos um procedimento que estima o limite inferior de números bacterianos que podem ser detectados por uma cultura e um método para quantificar a sobrevivência de C. jejuni em mídia utilizada para o transporte deste organismo frágil. Conhecendo essas informações, torna-se possível estabelecer limiares de detecção clinicamente relevantes para testes diagnósticos e abordar questões não estudadas sobre se a colonização não sintomática é prevalente, se a coinfecção com outros patógenos entéricos é comum ou se a carga bacteriana se correlaciona com sintomas ou sequelas graves. O estudo também incluiu testes de 1.552 amostras diarelanas diarelais prospectivas que foram inicialmente classificadas pela cultura convencional e posteriormente testadas por um novo imunoensaio enzimático. Amostras positivas e discrepantes foram então examinadas por quatro métodos moleculares para atribuir status verdadeiro-positivo ou verdadeiro-negativo. Os 5 métodos não culturais mostraram total concordância em todos os 48 espécimes positivos e discrepantes, enquanto a cultura identificou mal 14 (28%). Os espécimes que foram incorretamente identificados pela cultura incluíram 13 amostras falsas negativas e 1 falsa amostra positiva. Este protocolo básico pode ser usado com vários Campylobacter spp. e permitirá que os números de bactérias Campylobacter que produzem sintomas de gastroenterite em humanos sejam determinados e que as taxas de prevalência sejam atualizadas.
Introdução
O Centro de Controle de Doenças dos Estados Unidos (CDC) publicou recentemente que o programa de vigilância da Foodborne Diseases Active Surveillance Network (FoodNet) relatou 9.723 casos de infecções por Campylobacter diagnosticadas em laboratório em 20181. Isso representa um aumento de 12% nos relatos de casos de Campylobacter ao longo de 2015-20171. Em todo o mundo, campylobacter spp. estão entre as infecções intestinais bacterianas mais comuns2. No entanto, suspeita-se que os números de doenças intestinais baseadas em Campylobacterque ocorrem a cada ano sejam subnotificados3. Essa subestimação é previsível porque a maioria dos pacientes pode se recuperar apenas com desconforto moderado e sem tratamento médico. No entanto, para pacientes com sintomas mais graves ou que apresentam maior risco para doenças graves e que, em seguida, procuram atendimento médico, a cultura das fezes é o método mais comum para avaliar se campylobacter é o patógeno que está causando seu sofrimento4.
Para Campylobacter spp., a cultura das fezes é particularmente problemática. Os organismos patogênicos mais comuns, C. jejuni, C. coli, C. upsaliensis e C. lari, são microaerofilic5. Isso significa que as bactérias morrerão aleatoriamente, taxas desconhecidas uma vez expostas ao ar. O tempo entre a coleta de espécimes e a configuração da cultura torna-se, assim, uma variável descontrolada na capacidade de detectar Campylobacter viável spp. por cultura.
Para a cultura direta de espécimes fecais, o crescimento lento de Campylobacter também é um problema. As colônias de campylobacter são muito pequenas mesmo após 48 h de incubação e podem ser facilmente cobertas por organismos concorrentes na matriz fecal. Placas que contêm antibióticos aos quais a maioria das cepas de C. jejuni e C. coli são amplamente utilizadas são amplamente utilizadas, pois os antibióticos inibem o crescimento de muitas (mas não todas) bactérias fecais concorrentes, permitindo melhor visualização das colônias de Campylobacter 6. No entanto, outras espécies de Campylobacter, como C. lari e C. upsaliensis são sensíveis a alguns desses antibióticos, e ou crescem mal ou não. Isso contribui para a subnotificação de infecções por Campylobacter a partir dessas espécies sensíveis a antibióticos7.
Há uma terceira razão pela qual uma cultura para Campylobacter pode ser imprecisa. As bactérias, quando estressadas, podem permanecer viáveis, mas podem se tornar "não culturaveis"8. Isso, por definição, significa que a cultura não detectará as bactérias presentes na amostra. Quantas vezes isso ocorre não é conhecido8.
Dadas essas questões potenciais com a cultura, usamos múltiplos métodos de referência de comparação para que os resultados de cultura defeituosos não fizessem com que um único ensaio comparador parecesse impreciso9. Os métodos de cultura utilizados (por exemplo, placas seletivas de Campylobacter,meio de transporte, sachês geradores de gás) foram escolhidos por serem amplamente utilizados em laboratórios clínicos para a cultura de amostras de fezes10.
Os protocolos de cultura descritos aqui foram desenvolvidos porque o menor número de Campylobacter jejuni que poderia ser detectado pela cultura em fezes humanas não era conhecido. Embora tenham sido publicadas estimativas para números de unidades formadoras de colônias (UFC) presentes nas fezes de aves11,esses resultados não podem ser equiparados a fezes humanas, pois Campylobacter spp. são commensalidades em galinhas, e não causam diarreia. Essas informações fundamentais são necessárias para estabelecer o número de bactérias Campylobacter que produzirão sintomas de gastroenterite em humanos e para comparar a virulência entre cepas ou espécies.
Protocolo
1. Enumeração de Campylobacter em Espécimes Fecais Humanos Inventados
NOTA: Todas as etapas são realizadas utilizando técnica estéril e materiais em uma folha de proteção descartável dentro de uma capa de segurança de fluxo laminar desinfetada.
ATENÇÃO: Campylobacter vivo são infecciosos e podem causar doenças, incluindo diarreia. Use luvas, um jaleco e óculos de segurança sempre que manusear bactérias. Não faça pipeta bucal. Descarte todo o material que tenha contatado bactérias em recipientes de risco biológico adequados.
- Crescimento da cultura de estoque de bactérias
- Obtenha cepas de C. jejuni (ATCC-33560) ou C. coli (ATCC 33559) (Tabela de Materiais) como culturas secas ou congeladas e reidratar ou descongelar bactérias de acordo com as instruções do fabricante. Estique as bactérias rehidratadas em uma placa de ágar específica de Campylobacterpara iniciar a cultura. Incubar a placa de 48h a 37 °C em um frasco anaeróbico contendo um sachê microenabico gerador de gás.
- No dia seguinte, prepare 100 mL de caldo de crescimento de infusão cérebro-coração (IBH) contendo 0,5% de triptíbio, 0,5% de peptona protease, 0,0125% de piruvato de sódio e 0,0125% de bisulfite de sódio.
- Pré-reduza o caldo BHI cobrindo o frasco livremente e colocando-o em um frasco anaeróbico com um sachê que produzirá um ambiente microaerofílico. Deixe o caldo pré-reduzir durante a noite a 37 °C. Da mesma forma, pré-reduzir placas específicas de Campylobacterpara serem usadas para contagem de colônias nas etapas 1.1.10 e 1.2.2.
- Como campylobacter são sensíveis ao ar, reúna todos os materiais antes de inocular o caldo e não se desvie enquanto manuseia culturas. Quando estiver pronto para vacinar, adicione o soro bovino fetal (FBS) ao caldo pré-reduzido a 4% do volume total. Retenha 1 mL de caldo pré-reduzido para servir em branco nas medidas de densidade óptica a 600 nm (OD600).
- Remova 3 mL de caldo pré-reduzido contendo FBS e use caldo para raspar a placa de partida que contém a cultura Campylobacter. Raspe suavemente a placa com um laço de inoculação e, em seguida, transfira o chorume bacteriano para um tubo estéril.
- Inocule os 100 mL de caldo pré-reduzido com aproximadamente 3 mL de chorume bacteriano e incuba com agitação moderada a 115 rpm a 37 °C em um frasco anaeróbico contendo um sachê gerador de gás.
- Monitore o crescimento das bactérias espectrofotometricamente por turbidez emOD 600. Use o caldo reservado como um branco. Se o frasco anaeróbico for aberto, substitua o sachê gerador de gás.
- Pare a incubação do caldo após 48-72 h ou antes que o valor deOD 600 atinja ~0,4.
NOTA: Este OD600 normalmente equivale a 107 a 108 UFC/mL. Consulte a Tabela 1 para obter resultados típicos. - Para estabelecer o número de bactérias na cultura de estoque puro, realize oito séries de diluição de 10 vezes de 100 μL de caldo em 900 μL de tampão de diluição(Tabela de Materiais). Depois que o caldo de 100 μL tiver sido removido para a primeira diluição, retorne o frasco para o frasco anaeróbico com sachê de geração de gás fresco para aguardar o uso na piscina fecal.
- Use contas de chapeamento estéreis para espalhar 100 μL das diluições de 10-5 a 10-7 em placas específicas de Campylobacterpré-reduzidas duplicadas da etapa 1.1.3. Etiquetar placas com diluição utilizada, coloque-as em um segundo frasco anaeróbico com sachê gerador de gás e incubar a 37 °C por 48-72 h.
NOTA: Consulte as Figuras 1 e Figura 2 para esquema de diluição e fotografias de colônias. - Após o crescimento, escolha a placa com entre 30-300 colônias para contar. Utilize as contagens para determinar a CFU/mL da cultura do caldo de estoque usando a Equação 1:
FU/mL em estoque = Média # de colônias em placas analíticas escolhidas (duplicadas) ◗ (mL banhado x diluição da placa) [Equação 1]
- Preparação e enumeração de espécimes fecais clínicos inventados
- Imediatamente após as placas para contagem analítica são preparadas na etapa 1.1.10, faça um segundo conjunto de diluições de caldo de estoque preparando 10 diluições em série 2 vezes do caldo de estoque e uma piscina fecal negativa de Campylobacter(NFP). Por exemplo, prepare a primeira diluição misturando volumes iguais de caldo e NFP (por exemplo, 0,1 mL cada) e faça diluições subseqüentes transferindo um volume designado de caldo e mistura de NFP em um tubo com um volume igualmente designado NFP. Adicione uma placa de controle com caldo contendo nenhum Campylobacter adicionado à piscina fecal para ajudar a identificar colôniasnão-Campylobacter.
- Faça o NFP a partir de amostras de vigilância de pacientes desidentificados, diarreicos ou fezes de doadores saudáveis que foram previamente testados e encontrados como Campylobacter-negativo por métodos como um imunoensaio da enzima Campylobacter e por 16S rRNA qPCR.
- T-streak 10 μL de cada diluição campylobacter/fezes em placas de ágarpré-reduzidas duplicadas pré-reduzidas. Coloque as placas no frasco anaeróbico com um sachê gerador de gás e incubar a 37 °C por 48 ± 2 h.
- Examine as placas com listras visualmente para colônias semelhantes às de culturas de Campylobacter puras.
NOTA: O terceiro quadrante é tipicamente onde estes serão encontrados. Consulte a Figura 1 e a Figura 2 para esquema de diluição e imagens do tamanho da colônia, cor e morfologia. - Selecione várias colônias semelhantes a Campylobactere mancha de Gram. Usando microscopia com uma lente de imersão de óleo, examine uma área finamente lisida para pequenas bactérias curvas, espiral ou em forma de charuto.
NOTA: Campylobacter são Gram-negativos e requerem fúcsina básica como contra-mancha (em vez da safranina típica) para ser visualizado com precisão. Bactérias clássicas com asas de gaivota podem ser vistas, mas não são um requisito. Consulte a Figura 2 para micrografia representativa. - Se uma das placas duplicadas em uma diluição específica tiver 1 ou mais colônias de Campylobacter presentes, considere essa diluição da cultura fecal positiva.
- Considere a última diluição que contém uma colônia visível como gram-negativo,como gram-negativo, o limite da detecção de cultura. Use a Equação 2 para calcular o CFU/mL da diluição positiva em espécime fecal clínico inventado:
FU/mL na amostra fecal = CFU Analítico/mL ◗ Diluição com última colônia positiva [Equação 2]
NOTA: Consulte a Tabela 2 para obter resultados típicos.
- Imediatamente após as placas para contagem analítica são preparadas na etapa 1.1.10, faça um segundo conjunto de diluições de caldo de estoque preparando 10 diluições em série 2 vezes do caldo de estoque e uma piscina fecal negativa de Campylobacter(NFP). Por exemplo, prepare a primeira diluição misturando volumes iguais de caldo e NFP (por exemplo, 0,1 mL cada) e faça diluições subseqüentes transferindo um volume designado de caldo e mistura de NFP em um tubo com um volume igualmente designado NFP. Adicione uma placa de controle com caldo contendo nenhum Campylobacter adicionado à piscina fecal para ajudar a identificar colôniasnão-Campylobacter.
2. Determinação de viabilidade do Campylobacter Armazenado em Mídia de Transporte
- Misture 1 mL de cultura de caldo de Campylobacter (passo 1.1.8) com 1 mL de NFP e prepare 10 diluições em série duplicadas em NFP. Diluir ainda mais cada diluição um adicional de 1:4 na mídia Cary-Blair, assim como um espécime clínico preparado na mídia de transporte é tratado.
- Armazene os 20 tubos de diluição e um controle negativo no meio Cary-Blair em tubos tampados a 2-8 °C por 96 h e conte colônias de cada diluição que ocorra no tempo zero e a cada 24 h. Para a contagem da colônia, aprove o caldo:tubos fecais e a cultura fecal de configuração para contagem de colônias de cada diluição, em duplicata.
- Placa diária 10 μL de porções das diluições fecais em ágar seletivo de Campylobactere incubar a 37 °C por 48 h, conforme descrito acima nas etapas 1.1.9-1.2.7.
- Realizar uma contagem simultânea de placas analíticas do estoque bacteriano original (a partir da etapa 1.1.8 ou de um caldo recém-cultivado) conforme descrito acima (passos 1.1.9-1.1.11). Calcular o CFU/mL do estoque bacteriano original(Equação 1)para calcular a concentração de bactérias na amostra fecal da mídia de transporte e suas diluições(Equação 2).
3. Ensaios não culturais para verificar resultados de cultura
- Use um imunoensaio enzimático (EIA) que dê resultados falsos positivos mínimos12 e realize de acordo com as instruções de inserção da embalagem para verificar os resultados da cultura.
- Use um ensaio molecular que possa detectar o gene 16S rRNA ou outro gene de uma ampla gama de espécies de Campylobacter 13. Confirme que o ensaio molecular reage com espécies como C. upsaliensis ou C. lari que crescem mal no ágar padrão contendo antibióticos14. Siga as instruções do fabricante para extração de DNA de amostras fecais e realização do teste.
NOTA: O sequenciamento bidirecional do DNA 16S pode ser usado para confirmar a espécie de Campylobacter em um espécime positivo. PcR específico da espécie (ver Tabela 3 para genes-alvo) também pode ser usado para identificar espécies presentes em espécimes discrepantes ou positivos15.
Resultados
Identificar colônias de Campylobacter spp. entre a flora fecal concorrente requer visão aguçada e julgamento considerável. O menor número de colônias que podem ser detectadas pela cultura não foi estudado, embora os espécimes de pacientes tenham sido estimados para abrigar 106-109 UFC/mL16,17. No entanto, as amostras dos pacientes não podem ser utilizadas quantitativamente, pois não há um método independente para estabelecer números bacterianos precisos. Para superar essa limitação, duas medidas simultâneas são feitas com um estoque bacteriano. Um teste é usado para detecção visual de colônias de Campylobacter a partir de diluições seriais das bactérias de estoque em uma matriz fecal, simulando amostras clínicas; o outro é usado analiticamente para quantificar o CFU/mL presente na cultura de estoque bacteriano utilizada para espiar(Figura 2A).
Os limiares de detecção de Campylobacter não serão definidos. Isso é de se esperar porque cada matriz fecal é complexa e única, e o crescimento de bactérias é variável. Um parâmetro-chave para o sucesso é identificar as colônias de tamanho sumido entre a flora fecal concorrente. Uma placa representativa de cultura de fezes cravadas é mostrada na Figura 2C e Figura 2D. A placa de controle negativa sem adição de Campylobacter é importante para ajudar a identificar outras flora fecal. Coloração de gram muitos candidatos também treina o olho para distinguir as colônias brilhantes corretas e a cor rosa intermediária de bactérias gram-negativas manchadas de fúcsina e confirma a morfologia das bactérias nas colônias selecionadas(Figura 2B). Foram realizados sete experimentos independentes, utilizando 5 caldos C. jejuni e 2 C. coli, e deram limiares que se sobrepuseram e se estenderam de 0,3-5 x 106 CFU/mL. Consulte a Tabela 2 para obter dados típicos. Os limites de detecção foram em média 2 x 106 para C. jejuni e 1,2 x 106 UFC/mL para C. coli. Isso indica que a cultura pode provavelmente detectar ~1−2 x 106C. jejuni ou C. coli por grama de espécime fecal em análo específico de Campylobacterpadrão contendo antibióticos usados por muitos laboratórios clínicos. Existem vários ágaros especializados com antibióticos diferentes que podem dar diferentes limiares para detecção de colônias. Os métodos aqui descritos devem incentivar estudos mais quantitativos e comparativos para melhorar a precisão da cultura e ampliar a versatilidade das novas mídias. Por exemplo, 152 colônias foram contadas nas primeiras 10-5 placas e 144 colônias na segunda placa10-5. A média entre as duas placas é de 148 colônias. As placas foram inoculadas com 0,1 mL (100 μL) de 10-5 diluição, que pela Equação 1 equivale a 148 x 106 (14,8 x 107) UFC/mL no estoque de cultura pura. Quando as diluições fecais foram feitas, a cultura foi cravada em piscina fecal negativa a uma proporção de 1:1. Portanto, pela Equação 2, o primeiro ponto (placa "a") na curva fecal corresponde a 14,8 x 107 dividido por 2 e equivale a 7,4 x 107 UFC/mL. Este tubo "a" é usado para fazer 9 diluições adicionais. Na Figura 1,a última diluição com uma colônia grama-negativa visível com morfologia semelhante a Campylobacterestá na placa "g". Isso equivale a 1,1 x 106 UFC/mL para o limiar de cultura fecal de detecção neste exemplo.
Embora a viabilidade sustentada seja fundamental para a precisão da cultura, a retenção da viabilidade do Campylobacter spp. durante o manuseio e envio de espécimes de pacientes para clínicas para laboratórios de referência é problemática. O armazenamento típico é refrigerar espécimes em tubos com tampa comum com exposição ao ar e sem atmosfera especial. Acredita-se que os espécimes em meios de transporte (também conhecidos como amostras preservadas) tenham melhor sobrevida, mas há poucos relatórios que fornecem dados quantitativos18.
A combinação de métodos amostrais analíticos e inventados mostrados acima foi novamente utilizada para obter estimativas de viabilidade e tempo de sobrevivência de C. jejuni em meios de transporte. Um caldo de estoque bacteriano foi usado para preparar dez diluições de amostras duplicadas de duas a 1024 vezes em matriz fecal. O caldo inicial foi encontrado pelas contagens analíticas com concentração de 4,8 x 107 UFC/mL. Nas placas feitas no dia 0, C. jejuni foi detectado (2 dias depois) na placa com a diluição de 32 vezes, equivalente a 1,5 x 106 UFC/mL. No entanto, nas placas feitas após a refrigeração da amostra fecal de Cary Blair por 24 horas, apenas a diluição de duas vezes (equivalente a 2,4 x 107 UFC/mL) cresceu colônias visíveis. Nenhuma perda adicional de viabilidade foi observada até 96 horas, quando o estudo foi interrompido. Essa perda de viabilidade equivale a 16 vezes (94%) perda de organismos culturais em menos de 24 horas e indica que, mesmo com refrigeração, fezes no meio Cary Blair com menos de 107 UFC/mL C. jejuni podem ser perdidos pela cultura.
Em contraste com os resultados da cultura, o EIA detectou a presença de C. jejuni na diluição de 256 vezes no ponto de tempo inicial e durante o período de teste de 4 dias. O limiar de detecção de C. jejuni para este EIA utilizando amostras fecais cravadas é de 8,4 x 104 UFC/mL. Este limiar está abaixo do da cultura fecal e permite uma detecção mais sensível e estável de C. jejuni.
Para testar a capacidade da cultura de detectar Campylobacter spp. em um ambiente clínico real, 1.552 amostras de fezes clínicas foram caracterizadas por 6 procedimentos: cultura fecal, um novo imunoensaio para Campylobacter spp., e 4 métodos moleculares. Todas as amostras foram coletadas prospectivamente e inicialmente classificadas pela cultura convencional em 3 laboratórios nos Estados Unidos, e depois cruzadas pelo EIA. Quaisquer espécimes culturais positivos ou EIA/cultura-discrepante foram então examinados pelos métodos moleculares12. Os espécimes foram atribuídos um status verdadeiro-positivo ou verdadeiro-negativo com base nos resultados dos 5 métodos não culturais. Os 5 métodos não culturais mostraram total concordância em todos os 48 espécimes positivos e discrepantes, enquanto a cultura identificou erroneamente 14 (28%). Os espécimes que foram incorretamente identificados pela cultura incluíram 13 amostras falsas negativas e 1 falsa amostra positiva.

Figura 1: Esquema para preparação simultânea de amostras fecais analíticas e cravadas. Clique aqui para ver uma versão maior desta figura.
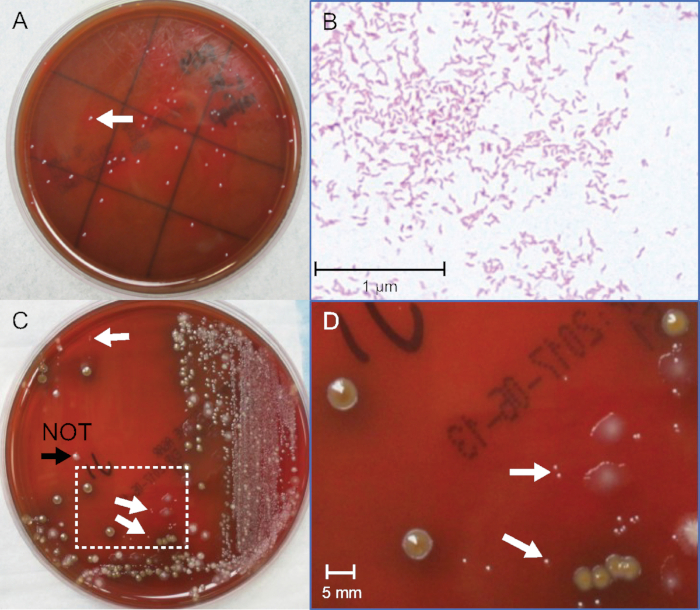
Figura 2: Identificação de colônias C. jejuni de culturas puras e fecais. (A)Fotografia de colônias C. jejuni de cultura bacteriana pura após 72 horas de incubação. (B) Mancha grama de C. jejuni de cultura bacteriana pura, ampliação 400x de imersão de óleo. (C) Fotografia de C. jejuni-cultura fecal positiva cravada após 48h de incubação. (D) Área ampliada em caixa em (C), ampliação de 10x. As setas brancas indicam o tamanho do ponto de pino gram-negativo c. jejuni colônias. A ponta da seta preta indica uma colônia ligeiramente maior, gram-positiva, e não C. jejuni. Clique aqui para ver uma versão maior desta figura.
| Culturas | OD600 @ T0 | OD600 @ T Final1 | Final CFU/mL |
| C. jejuni | 0.146 | 0.321 | 1.28 x 107 |
| C. coli | 0.245 | 0.508 | 4,50 x 108 |
Tabela 1: Crescimento típico e CFU/mL dos estoques C. jejuni e C. coli. 1C. a cultura jejuni foi interrompida após 48h de incubação. A cultura c. coli foi interrompida após 54 h de incubação.
| Tubo de diluição para amostra fecal cravada | Número de colônias semelhantes a Campylobacter | Número de colônias gram-negativas1 | Cultura positiva? | CFU/mL calculado de amostra cravada | |
| C. jejuni (1,28 x 108 ações de UFC/mL) | (2 vezes) a | Densa | dia2 | Sim | 6.40 x 107 |
| (4 vezes) b | 20+ | Nd | Sim | 3.20 x 107 | |
| (8 vezes) c | 4-10 | Nd | Sim | 1,60 x 107 | |
| (16 vezes) d | Nd | Sim | 8,00 x 106 | ||
| (32 vezes) e | Nd | Sim | 4,00 x 106 | ||
| (64 vezes) f | 1-3 | 1 de 2 | Sim | 2,00 x 106 | |
| (128 vezes) g | 2 de 3 | Sim | 1,00 x 106 | ||
| 3(256 vezes) h | 1 de 2 | Sim | 5,00 x 105 | ||
| (512 vezes) i | 0 de 1 | Não | 2,50 x 105 | ||
| (1024 vezes) j | 0 | Nd | Não | Nfp | |
| C. coli (4,50 x 108 estoque de UFC/mL) | (2 vezes) a | Densa | Nd | Sim | 2.25 x 108 |
| (4 vezes) b | Nd | Sim | 1.13 x 108 | ||
| (8 vezes) c | Mais de 50 anos | Nd | Sim | 5.63 x 107 | |
| (16 vezes) d | 30+ | Nd | Sim | 2,81 x 107 | |
| (32 vezes) e | 10+ | Nd | Sim | 1.41 x 107 | |
| (64 vezes) f | 3-8 | Nd | Sim | 7.03 x 106 | |
| (128 vezes) g | Nd | Sim | 3,52 x 106 | ||
| 3(256 vezes) h | 1-3 | 1 de 3 | Sim | 1,76 x 106 | |
| (512 vezes) i | 0 de 1 | Não | 8.79 x 105 | ||
| (1024 vezes) j | 0 | Nd | Não | Nfp |
Tabela 2: Números típicos de colônias em placas de amostras fecais cravadas. 1 Gramas colônias negativas entre colônias semelhantes a Campylobacter, 2nd = não determinadas, 3Dados em negrito indicam a última diluição positiva.
| Espécie | Alvo genético |
| C. jejuni | hipO |
| C. coli | cadF |
| C. upsaliensis | cpn60 |
| Lari | cpn60 |
| C. helveticus | cpn60 |
| C. feto | cpn60 |
| C. hyointestinalis | cpn60 |
| C. concisus | cpn60 |
Tabela 3: Genes úteis para detecção de espécies individuais de Campylobacter qPCR.
Discussão
Os métodos de cultura descritos aqui são construídos em técnicas e materiais simples e amplamente utilizados disponíveis na maioria dos laboratórios10. É a combinação de amostras analíticas e inventadas que fornecem novas informações de um limiar de detecção clinicamente relevante para culturas fecais. Além disso, o julgamento dos resultados culturais com 5 ensaios separados reforça as conclusões de que a cultura fecal de Campylobacter identifica mal uma parcela significativa dos espécimes dos pacientes. O EIA e os ensaios moleculares são úteis como controles porque cada um deles é baseado em um princípio diferente (interação de antígenos com amplificação de anticorpos versus DNA) e, importante, não dependem da viabilidade das bactérias. Note que o ensaio EIA utilizado para esses estudos é bem validado e mostrou-se plenamente condizente com 4 testes moleculares12.
A cultura de Campylobacter spp. é particularmente problemática, com sensibilidade relatada para variar de 60-76%19,20, e como evidente a partir de sua taxa de ~30% de falha para detectar espécimes verdadeiro-positivos aqui. O pessoal pode esperar que o controle do EIA e os testes moleculares frequentemente produzam resultados positivos quando os dados da cultura são negativos.
O passo mais crítico do protocolo é a identificação de colônias de pin-point entre a flora fecal concorrente. Não é incomum, como diluições próximas ao limiar de detecção, ter estimativas alternadas de contagem de colônias zero e não zero (por exemplo, 2, 0, 1, 0, 0). É importante reconhecer que os limiares de cultura serão uma gama de concentrações, não uma CFU/mL específica. No entanto, a estimativa de ~1 x 106 fezes de UFC/mL como um limite inferior para detecção de cultura se compara bem com os relatos de que os humanos infectados derramaram 106 a 109Campylobacter por grama de fezes21. Alterações em antibióticos ou placas de ágar e variações inevitáveis em amostras fecais individuais, sem dúvida, mudarão os valores limiares. Este protocolo deve permitir melhorias na mídia de crescimento.
Esta primeira informação sobre um limite para detecção de cultura permite estabelecer limiares clinicamente relevantes para testes diagnósticos, e estabelece a base microbiológica que é necessária para abordar questões não estudadas do transporte não sintomático22,23 por Campylobacter,ou se a carga bacteriana se correlaciona com sintomas ou sequelas graves.
Divulgações
Os autores são funcionários da TECHLAB, Inc. que produz o quik chek™ kit usado como comparador neste artigo.
Agradecimentos
Esses estudos foram financiados pela TECHLAB, Inc.
Materiais
| Name | Company | Catalog Number | Comments |
| Anaerobic 3.5L Jar | Thermo Fisher | HP0031A | |
| AnaeroGRO Campylobacter Selective Agar | Hardy Diagnostics | AG701 | |
| Bacto Brain Heart Infusion | BD Biosciences | 237500 | |
| Bacto Protease Peptone | Life Technologies Corp | 211684 | |
| Basic Fuchsin | Fisher Scientific | B12544 | |
| BBL Trypticase Peptone | Life Technologies Corp | 211921 | |
| C. coli Type strain | ATCC | 33559 | |
| C. jejuni Type strain | ATCC | 33560 | |
| CampyGen gas generating system sachet | Thermo Fisher | CN0025A | |
| Campylobacter QUIK CHEK | TechLab, Inc. | T5047 / T31025 | |
| Cary-Blair transport medium | Fisher Scientific | 23-005-47 | |
| Coli Roller Sterile plating beads | Millipore Sigma | 71013 | |
| Dilution Buffer | Anaerobe Systems | AS-908 | |
| Fetal bovine serum | Equitech-Bio, Inc | SFBM30 | |
| Sodium bisulfite | Sigma-Aldrich | 243973 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| Spectrophotometer cuvettes | USA Scientific | 9090-0460 |
Referências
- CDC. Annual Summaries of Foodborne Outbreaks. , Available from: https://www.cdc.gov/fdoss/annual-reports/index.html (2018).
- Kaakoush, N. O., Castaño-Rodríguez, N., Mitchell, H. M., Man, S. M. Global Epidemiology of Campylobacter Infection. Clinical Microbiology Reviews. 28 (3), 687-720 (2015).
- Pitkanen, T. a, H, M. L. Global Water Pathogen Project. Rose, J. B., Jimenez-Cisneros, B. , UNESCO (2017).
- Fitzgerald, C., et al. Multicenter Evaluation of Clinical Diagnostic Methods for Detection and Isolation of Campylobacter spp. from Stool. Journal of Clinical Microbiology. 54 (5), 1209-1215 (2016).
- Kirkpatrick, B. D., Tribble, D. R. Update on human Campylobacter jejuni infections. Current Opinion in Gastroenterology. 27 (1), 1-7 (2011).
- CDC. Incidence and Trends of Infection with Pathogens Transmitted Commonly Through Food - Foodborne Diseases Active Surveillance Network, 10 U.S. Sites, 2006-2013. Morbidity and Mortality Weekly Report. 63, 328-332 (2014).
- Jaime, A. L., et al. Campylobacter upsaliensis: Another Pathogen for Consideration in the United States. Clinical Infectious Diseases. 34 (11), 59-60 (2002).
- Bullman, S., O'Leary, J., Corcoran, D., Sleator, R., Lucey, B. Molecular-based detection of non-culturable and emerging campylobacteria in patients preseting with gastroenteritis. Epidemiology and Infection. 140, 684-688 (2012).
- Giltner, C. L., Saeki, S., Bobenchik, A. M., Humphries, R. M. Rapid Detection of Campylobacter Antigen by Enzyme Immunoassay Leads to Increased Positivity Rates. Journal of Clinical Microbiology. 51 (2), 618-620 (2013).
- M'ikanatha, N. M., et al. Culturing stool specimens for Campylobacter spp., Pennsylvania, USA. Emerging Infectious Disease. 18, 484-487 (2012).
- Al Amri, A., Senok, A. C., Ismaeel, A. Y., Al-Mahmeed, A. E., Botta, G. A. Multiplex PCR for direct identification of Campylobacter spp. in human and chicken stools. Journal of Medical Microbiology. 56 (10), 1350-1355 (2007).
- Buss, J. E., et al. Campylobacter culture fails to correctly detect Campylobacter in 30% of positive patient stool specimens compared to non-cultural methods. European Journal of Clinical Microbiology & Infectious Diseases. 38, 1087-1093 (2019).
- Wohlwend, N., Tiermann, S., Risch, L., Risch, M., Bodmer, T. Evaluation of a Multiplex Real-Time PCR Assay for Detecting Major Bacterial Enteric Pathogens in Fecal Specimens: Intestinal Inflammation and Bacterial Load Are Correlated in Campylobacter Infections. Journal of Clinical Microbiology. 54 (9), 2262-2266 (2016).
- Couturier, B. A., Hale, D. C., Couturier, M. R. Association of Campylobacter upsaliensis with Persistent Bloody Diarrhea. Journal of Clinical Microbiology. 50 (11), 3792-3794 (2012).
- Chaban, B., Musil, K. M., Himsworth, C. G., Hill, A. K. Development of cpn60-Based Real-Time Quantitative PCR Assays for the Detection of 14 Campylobacter Species and Application to Screening of Canine Fecal Samples. Applied and Environmental Microbiology. 75, 3055-3061 (2009).
- Allos, B., Blaser, M. J. Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases, 7th ed. Mandell, G. L., Bennett, J. E., Dolin, R. , Churchill Livingstone. 2793-2802 (2009).
- Anderson, N. W., Buchan, B. W., Ledeboer, N. A. Comparison of the BD MAX Enteric Bacterial Panel to Routine Culture Methods for Detection of Campylobacter, Enterohemorrhagic Escherichia coli (O157), Salmonella, and Shigella Isolates in Preserved Stool Specimens. Journal of Clinical Microbiology. 52 (4), 1222-1224 (2014).
- Wasfy, M., Oyofo, B., Elgindy, A., Churilla, A. Comparison of preservation media for storage of stool samples. Journal of Clinical Microbiology. 33 (8), 2176-2178 (1995).
- Bessède, E., Delcamp, A., Sifre, E., Buissonniere, A., Mégraud, F. New Methods for Detection of Campylobacters in Stool Samples in Comparison to Culture. Journal of Clinical Microbiology. 49 (3), 941-944 (2011).
- Bessède, E., et al. Evaluation of the Diagnostic Accuracy of Two Immunochromatographic Tests Detecting Campylobacter in Stools and Their Role in Campylobacter Infection Diagnosis. Journal of Clinical Microbiology. 56 (4), (2018).
- Shane, A. L., et al. Infectious Diseases Society of America Clinical Practice Guidelines for the Diagnosis and Management of Infectious Diarrhea. Clinical Infectious Diseases. 65 (12), 1963-1973 (2017).
- Toledo, Z., Simaluiza, R. J., Astudillo, X., Fernández, H. Occurrence and antimicrobial susceptibility of thermophilic Campylobacter species isolated from healthy children attending municipal care centers in Southern Ecuador. Revista do Instituto de Medicina Tropical de Sao Paulo. 59, 77-77 (2017).
- Lee, G., et al. Symptomatic and asymptomatic Campylobacter infections associated with reduced growth in Peruvian children. PLoS Neglected Tropical Diseases. 7 (1), 2036(2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados