É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Otimização de processos usando micro-bioreatores automatizados de alto throughput no cultivo de células de ovário de hamster chinês
Neste Artigo
Resumo
Aqui, apresentamos um procedimento detalhado para executar um Projeto de Experimento em um micro-bioreator automatizado seguido de colheita celular e quantificação de proteínas usando uma coluna de Proteína A.
Resumo
A otimização de bioprocessos para aumentar o rendimento dos produtos desejados é de importância na indústria biofarmacêutica. Isso pode ser alcançado através da seleção de cepas e do desenvolvimento de parâmetros de bioprocesso. Frascos de agitação foram usados para este fim. Eles, no entanto, não têm a capacidade de controlar os parâmetros do processo, como pH e oxigênio dissolvido (DO). Essa limitação pode ser superada com a ajuda de um micro-bioreator automatizado. Estes bioreatores imitam o cultivo em uma escala maior. Uma das principais vantagens deste sistema é a integração do Design of Experiment (DOE) no software. Essa integração permite estabelecer um projeto onde vários parâmetros de processo podem ser variados simultaneamente. Os parâmetros críticos do processo e as condições ideais de bioprocesso podem ser analisados dentro do software. O foco do trabalho aqui apresentado é introduzir o usuário às etapas envolvidas na concepção do processo no software e incorporação do DOE dentro da corrida de cultivo.
Introdução
O mercado biofarmacêutico global valia mais de US$ 250 bilhões em 2018 e vem continuamente expandindo1. As empresas farmacêuticas estão se afastando da produção de pequenos fármacos moleculares para terapêuticas biotecnológicas, como proteínas recombinantes. Só estes são responsáveis por uma receita de mais de US $ 150 bilhões1. As células dos mamíferos são agora amplamente utilizadas para a produção dessas proteínas farmacêuticas recombinantes. No período atual, dos 68 produtos aprovados produzidos por células de mamíferos, 57 são produzidos por células chinesas de ovário hamster (CHO)2. As células CHO são especificamente utilizadas para a produção de proteínas recombinantes que requerem modificações pós-translacionais. Estas células são preferidas à medida que crescem em uma suspensão e, assim, permitem resultados reprodutíveis em um meio quimicamente definido quimicamentelivre 3,4. A outra vantagem do uso de células CHO é que a estrutura glicana do produto se assemelha à do anticorpo monoclonal humano (mAb) e resulta em maior rendimento de proteína recombinante e produtividade específica devido à amplificação genética5.
O rendimento da cultura celular recombinante CHO (rCHO) aumentou cem vezes nas últimas duas décadas. Essa melhora é atribuída à otimização dos parâmetros do processo, à estratégia de alimentação e ao desenvolvimento do meio quimicamente definido quimicamente6. Com o aumento das exigências dos produtos farmacêuticos, a pressão aumenta sobre o custo e a eficiência de tempo para o desenvolvimento do processo produtivo7. Reduzir a pressão e, ao mesmo tempo, garantir a qualidade do produto redirecionou o foco da indústria farmacêutica em Qualidade por Design (QbD). O QbD é usado para entender a produção do produto, bem como o processo. Uma ferramenta vital usada no ObD é o Design of Experiment (DOE). Ele ajuda a aumentar a compreensão do processo, revelando a relação entre várias variáveis de entrada e dados de saída resultantes. A aplicação da abordagem do DOE para otimizar o bioprocesso é benéfica durante os estágios iniciais do projeto na assimilação das condições do processo e aumento da quantidade e qualidade do título. Essa abordagem é benéfica quando comparada com a estratégia antiquada: um fator de cada vez (OFAT). As abordagens estatísticas do DOE usando Classic, Shainin ou Taguchi são muito superiores ao OFAT8.
O processo e a otimização da mídia podem ser realizados em frascos de shake. Os frascos são relativamente baratos. No entanto, não é possível controlar parâmetros como temperatura, pH e oxigênio dissolvido (DO). Para superar essas desvantagens, podem ser utilizados bioreatores multiuso de bancada que variam de volume de trabalho de 0,5 L a 5 L. Os reatores fornecem um extenso monitoramento on-line e controle de processos. No entanto, o uso do bioreator multiuso é de tempo e trabalho intensivo. Para superar essas desvantagens, um novo bioreator de uso único que combina o processo abrangente de monitoramento do bioreator de bancada e fácil manuseio do frasco de shake é usado. O sistema de triagem de alto rendimento e a tecnologia de uso único contribuíram para aumentar a eficiência do desempenho e desenvolvimento do processo9.
Neste artigo, estão listadas as diretrizes para carregar a receita no software automatizado de micro-bioreator (AMBR). A influência de diferentes velocidades de agitador e pH na concentração celular viável (VCC) e título é estudada durante este experimento. O resultado experimental e a análise são realizados com o projeto do software de experimento MODDE 12. A análise do produto é realizada em um sistema de cromatografia líquida de alta pressão (HPLC) com uma coluna de proteína A. Baseia-se no princípio de que a região Fc do mAb se liga à proteína A com alta afinidade10,11. Com este método, é possível identificar e quantificar o mAb. A quantificação é realizada sobre as áreas de pico de elução medidos em 280 nm.
Protocolo
1. Procedimento de pré-cultura
NOTA: Células COD44 recombinantes com uma concentração celular viável de 1 x 107 células/mL são usadas para este protocolo.
- Descongele o frasco contendo 1,2 mL de células à temperatura ambiente e transfira imediatamente a suspensão celular para um tubo de centrífuga cônica de 15 mL contendo 10 mL de meio de semente sinuosa.
- Centrifugar o tubo cônico de centrífuga por 5 minutos a 190 x g e temperatura ambiente e descartar o sobrenadante.
- Pré-calor 150 mL do meio de sementes em um frasco de shake de 500 mL a 36,8 °C.
- Refira suavemente a pelota celular em 10 mL de meio de semente pré-aquecido e transfira as células para o frasco de shake.
- Use 1 mL da amostra do frasco para medir o VCC inicial e a viabilidade usando um contador celular.
NOTA: A viabilidade deve ser superior a 70% após o descongelamento para o cultivo bem sucedido. - Incubar o frasco de shake em um agitador orbital (diâmetro do agitador de 19 mm) a 36,8 °C e 7,5% de CO2 com uma taxa de agitação de 120 rpm.
NOTA: Essas condições variam dependendo da tensão celular e do meio. - Três dias depois de passar pelas células, remova o frasco de shake do agitador e coloque-o sob o armário de fluxo laminar. Tome 1 mL de amostra para medir a concentração celular final. Calcule o volume a ser transferido para o meio de sementes pré-aquecidas frescos de tal forma que a concentração celular inicial na nova passagem seja de 2 x 105 células/mL.
- Passe as células 5 vezes no total antes de transferir para o bioreator para o cultivo principal.
2. Cultivo principal
- Meça a concentração celular final da pré-cultura. Calcule o volume a ser transferido para o bioreator de forma que a concentração celular inicial no reator seja de 3 x 105 células/mL.
- Encha o reator com meio de produção um dia antes da inoculação para equilibrar o reator e defina os parâmetros do processo, como temperatura, pH e DO.
NOTA: As condições de cultivo são de 36,8 °C e 60% de concentração de oxigênio dissolvido (DO). Testamos velocidades de agitação de 1050 rpm e 1300 rpm, juntamente com pHs de 6,9, 7,1 e 7,3. A duração total do cultivo é de 12 dias até que as células sejam colhidas. O processo de lote dura 72 horas após o qual o meio de alimentação é adicionado a cada 24 horas. O protocolo a ser utilizado para o cultivo está listado detalhadamente no próximo segmento.
3. Escrever a Receita no Software Automatizado de Micro-bioreator
NOTA: Existem duas maneiras de escrever uma receita no software de cultura celular AMBR: ele é criado usando um assistente ou adicionando cada passo manualmente. Para o propósito deste protocolo, as etapas que usam o assistente são mostradas.
- Criando um novo experimento
- Abra o software de cultura de células AMBR e na guia Introdução clique em Criar novo experimento.
- Carregando a receita
- Na guia Novo Experimento, digite o nome do experimento junto com a data em que será realizado.
- Ative o ponto de verificação para que a estação de cultura e os vasos sejam utilizados durante o cultivo. As Tags DoE do Auto Add também serão ativadas para uma transição fácil durante a programação do experimento DOE. Clique em Next para mudar para a próxima guia.
- Defina informações sobre a adição de mídia no vaso juntamente com antiespuma, inóculo, ração e glicose.
- Ative o ponto de verificação Adicionar placa de mídia. Defina o tipo de placa, nome e localização da placa que contém o meio.
ATENÇÃO: Dependendo do tipo de placa e se a placa contiver uma tampa, ative a verificação em Is Lidded para garantir o bom funcionamento do manipulador líquido - Clique em Adicionar mídia aos vasos. Digite o volume da mídia a ser adicionada aos vasos. Defina o mapeamento da transferência da mídia da placa para os vasos. Clique em Next para mudar para a próxima guia.
- Ative o ponto de verificação Adicionar placa de mídia. Defina o tipo de placa, nome e localização da placa que contém o meio.
- Defina as condições de cultivo no reator.
- Depois que as informações da mídia forem alimentadas no software, atribua as condições de cultivo. Clique em Condition Media e preencha a temperatura, target DO, limite superior de pH e RPM de agitação (Up stirring ou Down stirando).
- Coloque adição de inóculos nos vasos.
- Ativar adicionar placa de célula. Defina o tipo de placa, nome e localização da placa que contém o meio.
- Clique em Adicionar células aos vasos. Digite o tempo de inoculação e o volume da mídia a ser adicionada aos vasos.
- Defina o caminho percorrido pelo manipulador líquido para a transferência da célula da placa para os vasos. Clique em Next para mudar para a próxima guia.
NOTA: Certifique-se de que as pontas da pipeta de reutilização estão desativadas para evitar contaminação cruzada e concentração incorreta de células viáveis inativas.
- Defina adição de ração, glicose e antiespuma.
NOTA: O procedimento para adição de ração, glicose e antiespuma é semelhante ao outro. Para o bem deste protocolo, o procedimento está listado para "Feed". Isto pode ser replicado para glicose e antiespuma.- Ative a placa de alimentação de adicionar e defina o tipo, nome e local da placa. Clique em Adicionar alimentação aos vasos e digite o volume da alimentação a ser adicionada aos vasos. Defina o mapeamento da transferência da alimentação da placa para os vasos.
- Dependendo do cultivo, adicione o número de adição de ração. Para este cultivo, o reator é alimentado após 72 horas para cada 24 horas.
- Adicione manualmente o atraso de tempo entre a alimentação inserindo os dados em Atraso das células adicionadas. O primeiro dia de alimentação é depois de 72 horas de inoculação e o próximo é depois de 96 horas e assim por diante.
NOTA: A adição de antiespuma é programada para ser adicionada todos os dias para evitar espuma durante o cultivo.
- Defina a amostragem durante o cultivo.
- Ative a placa de amostra adicionar e defina o tipo, nome e local da placa.
- Verifique a Amostra de Vasos e insira o volume da amostra a ser removida dos vasos. Defina o mapeamento da transferência da amostra dos vasos para a placa. Certifique-se de que o volume não diminua abaixo de 10 mL durante todo o período de cultivo.
- Adicione o número de amostras a serem colhidas durante o cultivo. Semelhante à alimentação, adicione o tempo da amostra a ser removida do vaso para cada ponto de amostra de entrada.
- Salve o processo. Agora está pronto para execução.
NOTA: Para garantir o bom funcionamento do protocolo, mude para a guia Passos do processo no software de cultura de células AMBR e selecione A exibição passo de processo para visualizar o fluxo da receita.
- Na guia Novo Experimento, digite o nome do experimento junto com a data em que será realizado.
- Projeto de experimento no micro-bioreator automatizado
- Para executar o software DOE do bioreator, certifique-se de que a receita no software principal esteja salva e pronta para uso.
- Abra o software AMBR 15 DOE e clique em Investigação e selecione Novo.
- Digite o nome da nova investigação do DOE na caixa de diálogo Criar investigação.
- Para atribuir um experimento à investigação do DOE, abra a receita criada para estudar os diferentes parâmetros. Clique em Procurar e selecione o respectivo experimento.
- Defina o fator DOE.
- As etiquetas da nave já estão alistadas na coluna. Para definir o fator DOE desejado, selecione o parâmetro e clique na coluna rotulada fator DOE. Selecione Novo e adicione as unidades, abreviação, limite inferior e superior dos fatores (por exemplo, temperatura, DO, pH).
- Defina o fator de resposta.
- Uma vez definidos os fatores do DOE, defina a resposta com base na qual a análise experimental seria estruturada.
- Na guia Respostas, defina os valores a serem considerados para a análise dos dados.
- Clique em Editar respostas do doe e definir o nome da resposta, abreviação, unidades, limites mínimos e máximos (por exemplo, título, concentração celular viável).
- Uma vez definidas as respostas, selecione a variável AMBR para cada resposta e defina a variável. Uma resposta pode ser automaticamente associada a uma variável micro-bioreator, escolha a variável necessária na lista de queda.
- Altere a equação para cada uma das respostas dependendo do requisito. A escolha é entre os dados mínimo, máximo, primeiro, último e médio.
- Crie um projeto.
- Use o Assistente de Design inicial para selecionar o tipo de design experimental, para adicionar ou remover o número de réplicas e pontos centrais.
- Selecione o objetivo, que determina a escolha dos designs e modelos:
Triagem: Utiliza modelos lineares e de interação para encontrar os fatores importantes
Otimização (RSM), utiliza modelos quadráticos e cúbicos para modelagem e otimização detalhadas
Objetivo dividido: Modelos para formulação e fatores de processo podem ser escolhidos separadamente - Uma vez decidido o objetivo, selecione o modelo e o design, juntamente com o número de pontos centrais e réplicas.
- Clique em Terminar e mude para a próxima guia.
- Defina o experimento.
NOTA: Os fatores DOE estão listados na coluna direita do software. Ao selecionar os fatores desejados, os vasos que executam esse experimento com o parâmetro desejado seriam destacados. Os vasos dentro da estação de cultura podem ser movidos clicando com o botão direito do mouse sobre o vaso e movendo-o para o local desejado.- Crie pacotes de trabalho que podem ser importados no software de cultura de células AMBR. Dependendo do número de experimentos, os diferentes pacotes de trabalho são criados e armazenados para posterior implementação
- Execução do experimento nos pacotes de trabalho criados no laptop de controle AMBR
- Na guia Experimento, clique em Criar experimento dodo e navegue pelo pacote de trabalho criado usando o software DOE.
- Inicialize o processo clicando em Iniciar.
- Análise de resultados experimentais
- Uma vez executado o experimento, exporte os dados usando resultados do DOE de exportação. A janela Resultados do DOE de Exportação abre e as linhas que indicam o navio de cultura e a estação estão listadas na tabela.
- Selecione as linhas desejadas e clique em Linhas selecionadas exportadas ou exportar dados experimentais para armazenar todos os resultados e salvar o arquivo para análise suplementar.
- Importe os dados para o módulo AMBR DOE, alternando para a guia Resultados e selecionando Resultados de Importação.
- Procure o arquivo de dados desejado e clique nos resultados de análise.
- Analise os resultados ainda mais no MODDE.
4. Execução do Cultivo no Micro-bioreator Automatizado
NOTA: As etapas a seguir são executadas pelo usuário com a ajuda do protocolo escrito no software acima mencionado. As etapas são realizadas pelo usuário, a menos que seja mencionado o contrário.
- Carregando os navios
- Abra os vasos de cultura esterilizados gama sob um armário de fluxo laminar e oriente na estação de cultura como retratado na Figura 2.
- Limpe a placa de grampo com 70% de etanol e água destilada dupla. Em seguida, autoclave a placa e coloque em cima do vaso.
- Monte a placa de fixação com uma placa de agitador, garantindo que cada pino esteja fixado firmemente.
- Aperte a placa do agitador e a placa de fixação no conjunto de agitação.
- Executando o software de micro-bioreator
- Use o programa escrito na Seção 3 para executar o cultivo.
- Visualize as etapas do processo agendadas ou concluídas na guia Processo. Altere as etapas de cultivo durante o processo executado conforme necessário, primeiro pausando o manipulador líquido e, em seguida, editando a receita do processo.
- Adicione antiespuma aos vasos antes que o agitador seja iniciado para garantir que não haja espuma excessiva durante o cultivo. A antiespuma será adicionada regularmente, e a espuma detectada visualmente.
- Adição de mídia no navio
- Encha a placa de 24 poços fornecida com os micro-bioreatores manualmente com mídia estéril e coloque no convés designado do sistema. Certifique-se de que a placa está colocada no convés designado pelo programa escrito (seção 3). O enchimento do vaso ocorrerá conforme projetado na seção 3.2.2.
NOTA: A temperatura e o agitador começam imediatamente após a adição da mídia e da antiespuma. O leitor de sensores é ativado 1 hora após o preenchimento do vaso (passo start monitor). O gaseamento para cada nave começa assim que o leitor for ativado. A mídia é deixada para equilibrar por um mínimo de 6 horas antes da recalibração e inoculação do pH. Os parâmetros do processo podem ser alterados no software, conforme mencionado na seção 3.2.3.
- Encha a placa de 24 poços fornecida com os micro-bioreatores manualmente com mídia estéril e coloque no convés designado do sistema. Certifique-se de que a placa está colocada no convés designado pelo programa escrito (seção 3). O enchimento do vaso ocorrerá conforme projetado na seção 3.2.2.
- Inoculação
- Meça a concentração celular viável após a5ª passagem. Calcule o número de células a serem transferidas para os vasos para garantir que a concentração celular inicial em todos os vasos seja de 3 x 105 células/mL.
- Transfira as células para uma placa de poço de 24 profundidades de tal forma que o volume da suspensão seja pelo menos 1,6 vezes o volume necessário. Para um volume necessário de 2 mL do inóculo, transfira 3,2 mL de suspensão celular para cada poço na placa.
- Coloque a placa de 24 poços no convés designado. Os vasos serão inoculados como na seção 3.2.4.
- Amostragem e análise diárias
- Remova uma amostra de 460 μL dos vasos todos os dias usando o manipulador líquido. Diluir 200 μL da amostra com 800 μL de tampão 1x PBS filtrado (diluição 5x) e, em seguida, colocar no contador celular.
- Centrifugar a amostra restante para 5 minutos a 190 x g e temperatura ambiente e armazenar o sobrenadante para análise posterior (glicose, lactato, glutamina e glutamato).
- Congele 100 μL do sobrenadante a -20 °C até o final do cultivo para quantificação de proteínas.
- Fim do cultivo
- Quando o controle do parâmetro do processo (ou seja, temperatura, agitação, pH e DO) tiver terminado, interrompa o monitoramento do processo.
- Desaparafusar a placa do agitador e a placa do grampo.
- Remova os vasos de cultura e limpe as estações de cultura. Coloque as placas de secagem nas estações de cultura e enrosque-as.
- Enquanto isso, limpe bem as placas de grampo com 70% de etanol e água destilada dupla.
- Clique em Parar no software do bioreator assim que o ciclo de secagem estiver concluído.
- Colheita de cultura celular
- Colher células no dia 12 do cultivo, removendo manualmente o conteúdo dos vasos em tubos de centrífuga de 50 mL. Centrifugar o caldo celular a 190 x g por 30 min.
- Descarte a pelota de célula e armazene o sobrenadante a -20 °C.
5. Medição da concentração de mAb
- Use uma coluna de proteína A de 1,7 mL para a quantificação da proteína durante a corrida de cultivo.
-
Prepare o tampão de equilíbrio e elução antes de descongelar as amostras.
- Utilize uma solução de 0,5 M Na2HPO4 contendo 0,5 M NaCl com um pH de 7.9 como tampão de equilíbrio e uma solução de glicina de 100 mM contendo 0,5 M NaCl com um pH de 2 como tampão de elução.
- Filtrar ambos os buffers através de uma membrana de 0,2 μm e degas antes de serem colocados para análise.
- Expurifique o sistema de cromatografia líquida de alto desempenho (HPLC) com tampão de equilíbrio recém-preparado.
- Carregue a coluna de proteína A no sistema HPLC.
- Realize cromatografia com vazão de 1 mL/min. Coloque a temperatura do forno da coluna a 30 °C e a temperatura do autosampler a 10 °C
- Descongele as amostras congeladas à temperatura ambiente e filtre 225 μL de cada amostra através de uma membrana PVDF de 0,22 μm. Diluir as amostras com maior concentração da proteína desejada estão em uma razão de 1:20 com tampão de equilíbrio e filtrar através da membrana antes de colocar no autosampler.
- Coloque as amostras no amostrador automático. Carregue o método e a seqüência no software e inicie a seqüência.
NOTA: O método é composto por três fases (ver Figura 1): injeção da amostra na coluna durante os dois primeiros minutos; seguido por tampão de elução para 8 min e regeneração de coluna com tampão de equilíbrio por 10 min.
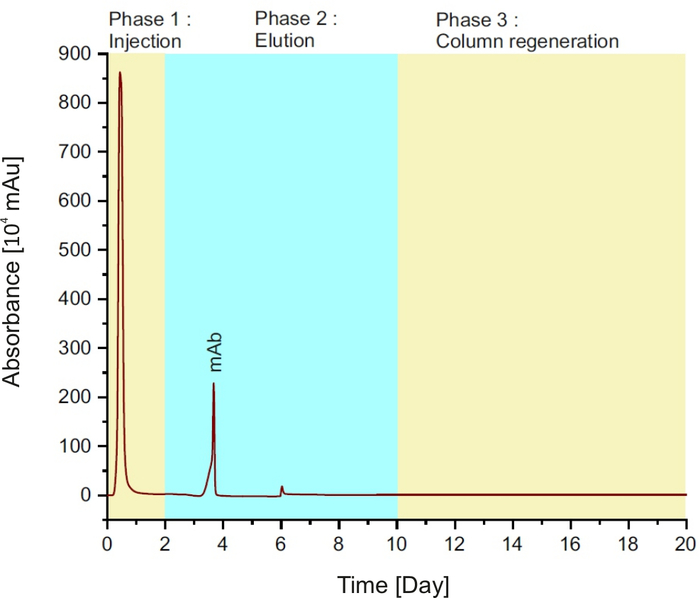
Figura 1: Cromatograma proteino A, representando as diferentes fases durante uma única corrida. Clique aqui para ver uma versão maior desta figura.
Resultados
Uma visão geral do cultivo realizado neste estudo é apresentada na Figura 2.
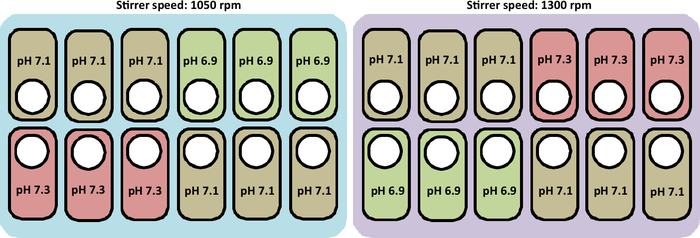
Figura 2: Representação esquemática das condições experimentais para testar perfis de pH e velocidade de agitador nas estações de cultura. A figura também representa o layout correto para colocar os vasos.
Discussão
A otimização do processo para aumentar o rendimento é de fundamental importância na indústria biofarmacêutica. Frascos de agitação poderiam potencialmente ser usados para a triagem da cepa; no entanto, o monitoramento dos parâmetros do processo, como pH e DO, não está disponível nos frascos. Os micro-bioreatores têm uma vantagem, pois permitem o monitoramento contínuo e o controle do processo. Esses laços de controle no micro-bioreator também fornecem uma condição semelhante àquelas em maior escala e, ...
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Os autores agradecem ao Bundesministerium für Bildung und Forschung (BMBF), ao Ministério Federal de Educação e Pesquisa, alemanha, e à equipe de BioProcessamento da Sartorius Stedim Biotech GmbH, Alemanha, pelo apoio.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0040 | |
| 200 mM L-glutamine | Corning, Merck | 25-005-CV | |
| 24 Well deep well plates | Sartorius Stedim Biotech GmbH | A-0038 | |
| 5 mL disposable pipette tips, sterilized | Sartorius Stedim Biotech GmbH | A-0039 | |
| ambr 15 automated microbioreactor system | Sartorius Stedim Biotech GmbH | 001-2804 | |
| ambr 15 Cell Culture 24 Disposable Bioreactors - Sparged | Sartorius Stedim Biotech GmbH | 001-1B86 | |
| Antifoam C Emulsion | Sigma-Aldrich, Merck | A8011 | |
| Bottle Top Sterile filter | Corning, Merck | CLS431474 | 0.1 μm pore size |
| CEDEX Detergent (3% Mucosol) | Roche Innovatis AG | 05-650-658-001 | |
| Cell counter | Roche Innovatis AG | 05-650-216-001 | CEDEX HiRes |
| CHO DG44 cell line | Cellca, Sartorius Stedim Biotech GmbH | ||
| CHOKO Feed Media A (FMA) | Sigma-Aldrich, Merck | CR80025 | |
| CHOKO Feed Media B (FMB) | Sigma-Aldrich, Merck | CR80026 | |
| CHOKO Production Medium | Sigma-Aldrich, Merck | CR80027 | |
| CHOKO Stock Culture Meium | Sigma-Aldrich, Merck | CR80028 | |
| Chromaster high pressure liquid chromatography system | VWR International | ||
| Conical Centrifuge tube | Corning, Merck | SIAL0790 | |
| Ethanol | Merck | 1070179026 | |
| Glycine | Carl Roth | 56-40-6 | |
| HPLC Vials | VWR International | SUPLSU860181 | |
| PBS | Sigma-Aldrich,Merck | P4417 | |
| Protein A Column | Thermo Fisher Scientific | 1502226 | POROS™ A 1.7 mL |
| Sodium chloride | Sigma-Aldrich,Merck | 7647-14-5 | |
| Sodium phosphate dibasic anhydrous | Sigma-Aldrich,Merck | 7558-79-4 | |
| Trypan Blue | VWR International | VWRVK940 | |
| YSI | YSI Inc | 2900D | YSI 2900 Select |
Referências
- Walsh, G. Biopharmaceutical benchmarks 2018. Nature Biotechnology. 36, 1136 (2018).
- Kim, J. Y., Kim, Y., Lee, G. M. CHO cells in biotechnology for production of recombinant proteins: current state and further potential. Applied Microbiology and Biotechnology. 93 (3), 917-930 (2012).
- Lai, T., Yang, Y., Ng, S. K. Advances in Mammalian cell line development technologies for recombinant protein production. Pharmaceuticals (Basel). 6 (5), 579-603 (2013).
- Carlage, T., et al. Analysis of dynamic changes in the proteome of a Bcl-XL overexpressing Chinese hamster ovary cell culture during exponential and stationary phases. Biotechnology Progress. 28 (3), 814-823 (2012).
- Hacker, D. L., de Jesus, M., Wurm, F. M. 25 years of recombinant proteins from reactor-grown cells - where do we go from here. Biotechnology Advances. 27 (6), 1023-1027 (2009).
- Shukla, A. A., Gottschalk, U. Single-use disposable technologies for biopharmaceutical manufacturing. Trends in Biotechnology. 31 (3), 147-154 (2013).
- Ao, S., Gelman, L. . Advances in electrical engineering and computational science. Lecture notes in electrical engineering. 39, (2009).
- Bareither, R., et al. Automated disposable small scale reactor for high throughput bioprocess development: a proof of concept study. Biotechnology and Bioengineering. 110 (12), 3126-3138 (2013).
- Kang, Y., Ludwig, D. L., Balderes, P. What can cell culture flocculation offer for antibody purification processes. Pharmaceutical Bioprocessing. 2 (6), 483-485 (2014).
- Choe, W., Durgannavar, T. A., Chung, S. J. Fc-Binding Ligands of Immunoglobulin G: An Overview of High Affinity Proteins and Peptides. Materials (Basel). 9 (12), (2016).
- Schäpper, D., et al. Application of microbioreactors in fermentation process development: a review. Analytical and Bioanalytical Chemistry. 395 (3), 679-695 (2009).
- Zhang, Z., et al. Microbioreactors for Bioprocess Development. Journal of the Association for Laboratory Automation. 12 (3), 143-151 (2007).
- Claßen, J., et al. Spectroscopic sensors for in-line bioprocess monitoring in research and pharmaceutical industrial application. Analytical and Bioanalytical Chemistry. 409 (3), 651-666 (2017).
- Janoschek, S., et al. A protocol to transfer a fed-batch platform process into semi-perfusion mode: The benefit of automated small-scale bioreactors compared to shake flasks as scale-down model. Biotechnology Progress. 35 (2), 2757 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados