É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Produção microfluida de liposomos sensíveis à temperatura contendo lisolipóides
Neste Artigo
Resumo
O protocolo apresenta os parâmetros otimizados para a preparação de liposomos termosensíveis usando o dispositivo microfluido de microfluidos de micromixer herringbone escalonado. Isso também permite o coencapsulamento de doxorubicina e verde indocianina nos liposomos e a liberação fototérmica de doxorubicina para liberação controlada/desencadeada de drogas.
Resumo
O protocolo apresentado permite uma preparação contínua de alto desempenho de liposomos sensíveis à baixa temperatura (LTSLs), capazes de carregar drogas quimioterapêuticas, como a doxorubicina (DOX). Para isso, uma mistura lipídica imócida e uma solução de sulfato de amônio são injetadas em um microfluido microfluido de micromisturador de arenque escalonado (SHM). As soluções são rapidamente misturadas pelo SHM, fornecendo um ambiente solvente homogêneo para a auto-montagem dos liposomos. Os liposós coletados são primeiro amassados, depois marcados para remover o etanol residual. Um fato de amônio pH-gradiente é estabelecido através da troca tampão da solução externa usando cromatografia de exclusão de tamanho. O DOX é então carregado remotamente nos liposomos com alta eficiência de encapsulamento (> 80%). Os liposós obtidos são homogêneos em tamanho com diâmetro médio Z de 100 nm. Eles são capazes de liberação de explosão desencadeada pela temperatura do DOX encapsulado na presença de hipertermia leve (42 °C). O verde indocianina (ICG) também pode ser co-carregado nos liposomos para liberação DOX quase infravermelha. A abordagem microfluida garante uma preparação de alto nível, reprodutível e escalável das LTSLs.
Introdução
A formulação ltsl é um produto lipossômico clinicamente relevante que foi desenvolvido para fornecer a droga quimioterapêutica doxorubicina (DOX) e permite uma liberação eficiente de medicamentos estourados em hipertermia leve clinicamente alcançável (T ◗ 41 °C)1. A formulação LTSL consiste em 1,2-dipalmitoyl-sn-glicero-3-fosphocholine (DPPC), o lisolipide 1-stearoyl-2-hidroxi-sn -glicero-3-fosfatidylcholine (MSPC; M significa "mono") e lipídio PEGylated 1,2-distearoyl-sn -glicero-3-phosphoetanolamina-N-[methoxy(polietileno glicol)-2000] (DSPE-PEG2000). Ao atingir a temperatura de transição de fase (Tm ◗ 41 °C), o lisolipide e o DSPE-PEG2000 juntos facilitam a formação de poros de membrana, resultando em uma liberação estourada da droga2. A preparação das LTSLs usa principalmente uma abordagem de cima para baixo em massa, ou seja, hidratação de filme lipídico e extrusão. Continua sendo desafiador preparar reprodutivelmente grandes lotes com propriedades idênticas e em quantidades suficientes para aplicações clínicas3.
Microfluidoé uma técnica emergente para preparar liposomos, oferecendo tamanho de nanopartículas não capazes, reprodutibilidade e escalabilidade3. Uma vez otimizados os parâmetros de fabricação, o throughput poderá ser ampliado pela paralefila, com propriedades idênticas às preparadas na escala de banco3,4,5. Uma grande vantagem dos microfluidos em relação às técnicas convencionais de granel é a capacidade de lidar com pequenos volumes líquidos com alta controladorabilidade no espaço e no tempo através da miniaturização, permitindo uma otimização mais rápida, enquanto opera de forma contínua e automatizada6. A produção de liposós com dispositivos microfluidos é alcançada por uma abordagem de nanoprecipitação inferior, que é mais tempo e eficiência energética porque processos de homogeneização como extrusão e sonsonação são desnecessários7. Normalmente, uma solução orgânica (por exemplo, etanol) de lipídios (e carga hidrofóbica) é misturada com um não solvente insustentável (por exemplo, água e carga hidrofilônica). À medida que o solvente orgânico se mistura com o não solvente, a solubilidade para os lipídios é reduzida. A concentração lipídica eventualmente atinge uma concentração crítica na qual o processo de precipitação é acionado7. Nanoprecipitados de lipídios eventualmente crescem em tamanho e se fecham em um liposós. Os principais fatores que regem o tamanho e a homogeneidade dos liposomos são a razão entre o não solvente e o solvente (ou seja, relação de fluxo aquoso-orgânico; FRR) e a homogeneidade do ambiente solvente durante a automontagem dos lipídios em liposomos8.
A mistura eficiente de fluidos em microfluidos é, portanto, essencial para a preparação de liposomos homogêneos, e vários designs de misturadores foram empregados em diferentes aplicações9. O micromixer de arenque escalonado (SHM) representa uma das novas gerações de misturadores passivos, o que permite um alto rendimento (na faixa de mL/min) com um fator de diluição baixa. Isso é superior aos dispositivos tradicionais de mistura hidrodinâmica microfluida8,10. O SHM tem ranhuras de arenque padronizadas, que rapidamente misturam fluidos por advection caótico9,11. A pequena escala de tempo de mistura de SHM (< 5 ms, menos do que a escala típica de tempo de agregação de 10-100 ms) permite que a auto-montagem lipídica ocorra em um ambiente solvente homogêneo, produzindo nanopartículas com distribuição uniforme de tamanho3,12.
A preparação de LTSLs com microfluidos não é, no entanto, tão simples em relação às formulações liposômicas convencionais devido à falta de colesterol8, sem as quais as bicamadas lipídicas são suscetíveis à interdigitação induzida pelo etanol13,14,15. Até agora, o efeito do etanol residual apresenta durante a produção microfluida de liposomos não foi bem compreendido. A maioria das formulações relatadas são inerentemente resistentes à interdigitação (contendo colesterol ou lipídios insaturados)16, que ao contrário das LTSLs são saturadas e sem colesterol.
O protocolo aqui apresentado usa o SHM para preparar LTSLs para a entrega de medicamentos de liberação desencadeada pela temperatura. No método apresentado, garantimos que os LTSLs preparados microfluidos são nano-size (100 nm) e uniforme (dispersidade < 0,2) por dispersão dinâmica de luz (DLS). Além disso, encapsulamos o DOX usando o método de gradiente de sulfato de amônio transmembrana (também conhecido como carregamento remoto)17 como uma validação da integridade do bicamada lipídico LTSL. O carregamento remoto do DOX requer o liposome para manter um gradiente pH para alcançar alta eficiência de encapsulamento (EE), o que é improvável que aconteça sem um bicamada lipídico intacto. Neste método apresentado, distinto a partir de protocolos típicos de preparação liposófica microfluida, é necessário um passo de annealing antes que o etanol seja removido para habilitar a capacidade de carregamento remoto; ou seja, para restaurar a integridade do bicamada lipídico.
Como mencionado anteriormente, cargas hidrofoficas e hidrofóbicas também podem ser introduzidas às soluções iniciais para o encapsulamento simultâneo de cargas durante a formação de LTSLs. Como prova de conceito, o verde indocianina (ICG), um corante fluorescente quase infravermelho aprovado pela FDA, que também é um agente fototérmico promissor, é introduzido na mistura lipídica inicial e co-carregado com sucesso nas LTSLs. Um laser de 808 nm é usado para irradiar as LTSLs carregadas do DOX/ICG e induzir com sucesso a liberação de explosão fototérmica desencadeada pelo aquecimento do DOX dentro de 5 minutos.
Todos os instrumentos e materiais estão disponíveis comercialmente, prontos para uso e sem a necessidade de personalização. Uma vez que todos os parâmetros para formulação de LTSLs foram otimizados, seguindo este protocolo, pesquisadores sem conhecimento prévio de microfluidos também poderiam preparar as LTSLs, que servem como base de um sistema de entrega de drogas termosensíveis.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Configuração de equipamento
- Monte as bombas de seringa e shm da seguinte forma.
- Conecte a porta "To Computer" da bomba de seringa secundária (Bomba 02, para solução aquosa) à porta "To Network" da bomba de seringa mestre (Bomba 01, para solução lipídica de etanol) usando o cabo da rede Pump to Pump(Figura 1,amarelo).
- Conecte a porta "To Computer" da bomba master à porta "RS232 Serial" do computador usando PC para bombear cabo de rede(Figura 1,azul).
- Conecte o tubo a cada uma das inletas e tomadas do SHM usando uma porca e uma regra ferrule. Converta o terminal da tubulação para ambas as inletas para luer fêmea usando outra porca e ferrule e uma assembleia sindical. Tubos mais longos das entradas permitem fácil apego às seringas(Figura 2).
- Configure o software de controle da bomba.
- Atribua o endereço da bomba de seringa mestre e da bomba de seringa secundária para "Ad:01" e "Ad:02", respectivamente, usando o botão "Configuração" da bomba de seringa. Isso só precisa ser feito pela primeira vez.
- Abra o software de controle da bomba no computador. As duas bombas de seringa devem ser detectadas automaticamente, seguidas por um som de bipe. Caso contrário, clique em Pumps e Procure bombas para atualizar a conexão. (Figura 3).
- Atribuir diâmetro a 12,45 (mm) escolhendo "HSW Norm-Ject 5 cc (Dia=12,45)".
- Taxa de atribuição para 0,25 mL/min para bomba 01 (solução lipídica de etanol) e 0,75 mL/min para bomba 02 (solução aquosa). As taxas de fluxo correspondem a uma taxa de fluxo total (TFR) de 1 mL/min e razão de vazão aquosa-etanol (FRR) de 3.
- Atribuir volume a quaisquer valores acima de 5 mL.
NOTA: O volume de infusão direcionado é definido maior do que o volume líquido carregado considerando o volume vazio da tubulação. - Selecione o modo INF (infusão) para ambas as bombas.
- Pressione set para confirmar as configurações.
2. Prepare as LTSLs
- Prepare uma mistura lipídica LTSL10 ou LTSL10-ICG (ver Tabela 1).
- Retire 1 mL de mistura lipídica e pelo menos 3 mL de (NH4)2Solução SO4 usando duas seringas de bloqueio Luer de 5 mL.
- Instale as duas seringas nas bombas de seringa na posição vertical deslizando a flange do barril da seringa para o retentor de seringa da bomba, e a flange deêmo da seringa até o bloco de empurra dor da bomba(Figura 4).
- Enrole a extremidade da fita de aquecimento para a seringa com a solução aquosa. Enrole a outra extremidade da fita de aquecimento e a sonda de temperatura do termostato ao redor da seringa com a solução lipídica. É útil praticar essa etapa com seringas vazias no local, a fim de facilitar o processo de montagem (Figura 5A).
- Conecte as duas seringas aos adaptadores luer fêmeas das inletas correspondentes do SHM. Certifique-se de que as seringas contendo a mistura lipídica e (NH4)2Soluções SO4 estão conectadas de dentro de etanol e inlet aquosa, respectivamente. Ajuste a posição do êmbolo para remover bolhas de ar das seringas(Figura 5B).
NOTA: Certifique-se de que as seringas ainda estejam posicionadas com segurança sobre o retentor de seringa das bombas. - Aqueça as seringas acima de 51 °C usando a fita de aquecimento usando uma sessão de aquecimento de 10 s. Deixe o termostato atualizar a temperatura das seringas. Repita esta etapa nos seguintes passos para manter a temperatura durante a infusão.
ATENÇÃO: Desligue a fita de aquecimento após 10 s para evitar o excesso de temperatura e deixe o termostato atualizar a temperatura real. A fita de aquecimento também deve ser tratada com cuidado à medida que sua temperatura sobe muito rapidamente. O aquecimento continuamente pode danificar o equipamento e as seringas, devido ao atraso de tempo do termostato para atualizar a temperatura medida. - Uma vez que a temperatura esteja acima de 51 °C, execute as bombas de seringa pressionando Run All no software de controle da bomba(Figura 3).
- Certifique-se de que o fluxo de fluidos esteja livre de bolhas de ar e qualquer vazamento. Descarte o volume inicial (em torno de 0,5 mL) de líquido da tomada como resíduo.
NOTA: Este volume inicial de resíduos não é definitivo e depende do volume interno da configuração, que é o volume para o fluido viajar das seringas através da tubulação e SHM para a tomada. - Colete o resto do líquido como amostras liposomeemem em um tubo de microcentrífuga ou frasco bijou.
- Pausa/pare a infusão quando o líquido em qualquer uma das seringas está quase vazio.
NOTA: As bombas devem ser paradas manualmente, uma vez que as bombas podem não detectar com precisão a posição quando as seringas estão vazias. - Coloque as soluções liposome coletadas em um banho de água de 60 °C para a narnea por 1,5 h.
NOTA: Este passo é essencial para permitir o carregamento de drogas nos liposomos. - Transfira as soluções para tubos de diálise. Dilere as soluções contra 1 L de 240 mM (NH4)2SO4 a 37 °C por pelo menos 4h para obter liposós purificados.
NOTA: O protocolo pode ser pausado aqui. Os liposós nesta etapa estão a 5 mM de fosfolipide. Liposomos purificados podem ser armazenados a 4 °C. - Para limpar o SHM para uso repetido, lave o SHM sequencialmente com água desionizada, etanol e seco com gás nitrogênio.
3. Carregamento remoto do DOX em LTSLs por gradiente pH transmembrana
- Troque o buffer externo de LTSLs para soro fisiológico tampão hepes (HBS) usando cromatografia de exclusão de tamanho (SEC) para estabelecer um gradiente pH transmembrana.
- Adicione um total de 25 mL de HBS ao topo de uma coluna da SEC para preparar a coluna. Deixe que todos os eluentes lutem pela coluna e descarte o eluate.
- Adicione 1 mL de liposós dialos, preparado a partir da etapa 2.12, à coluna e descarte a elute.
- Adicione 1,5 mL de HBS à coluna e descarte a elute.
- Adicione 3 mL de HBS à coluna e colete os 3 mL de elute.
NOTA: O protocolo pode ser pausado aqui. Os liposós são coletados nesta etapa e estão a 1,67 mM de fosfolipida. Liposomos trocados por tampão podem ser armazenados a 4 °C.
- Incubam LTSLs com doxorubicina (DOX) e purificam LTSLs.
- Adicione a solução DOX em 1:20 RELAÇÃO molar DOX-to-fosholipid em 1 mL de solução liposós (1,67 mmol) contida em um frasco bijou. Isso pode ser alcançado adicionando 48,4 μL de 1 mg/mL DAX (83,4 μmol).
- Coloque o frasco bijou em um banho de água de 37 °C por 1,5 h para permitir que o DOX carrege nos liposós.
- Misture 10 μL dos liposóis com 170 μL de HBS e 20 μL de 1% (v/v) Solução Triton X-100 em uma placa preta de 96 poços. Repita para três poços. Esses poços correspondem ao conteúdo DOX "antes da purificação".
- Em caso de preparação LTSL10-ICG, misture 40 μL dos liposóis com 160 μL de DMSO em uma placa clara de 96 poços. Repita para três poços. Esses poços correspondem ao conteúdo de ICG "antes da purificação".
- Purificar a solução liposome como descrito na etapa 3.1.
NOTA: Para reutilizar a coluna para futura purificação, limpe a coluna do DOX livre adicionando primeiro 1 mL de solução NaOH diluída de 0,5 M antes de realizar a etapa 3.1.1. DoX livre em vermelho vai ficar violeta-azul e elute através da coluna rapidamente. - Misture 30 μL da solução liposósia purificada com 150 μL de HBS e 20 μL de 1% (v/v) Solução Triton X-100 em uma placa preta de 96 poços. Repita para três poços. Esses poços correspondem ao conteúdo DOX "após a purificação".
- No caso do LTSL10-ICG, misture 40 μL da solução liposósia purificada com 160 μL de DMSO em uma placa clara de 96 poços. Repita para três poços. Esses poços correspondem ao conteúdo de ICG "após a purificação".
- Meça a intensidade de fluorescência do DOX dos poços antes (passo 3.2.3) e depois (passo 3.2.5) purificação, utilizando um leitor de microplaca (λex = 485 nm, λem = 590 nm).
- Calcule a eficiência de encapsulamento do DOX (DOX EE) tomando a proporção das intensidades de fluorescência antes e depois da purificação.
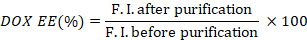
- Meça a absorção de ICG dos poços antes e depois da purificação, utilizando um leitor de microplacas (600 a 1000 nm).
- Calcule a eficiência de encapsulamento do ICG (ICG EE) levando a proporção da absorção em 792 nm antes e depois da purificação, levando em conta o fator de diluição (3 vezes) durante a purificação.

4. Dispersão dinâmica de luz (DLS)
- Adicione 50 μL de solução liposós (passo 2.12) a 450 μL de água desionizada.
- Coloque o cuvette dentro do instrumento DLS e execute a medição de acordo com as instruções do fabricante.
- Record the mean Z-average diameter and dispersity of three measurements for each sample.
5. Calorimetria de varredura diferencial (DSC)
- Concentre 1 mL das amostras de liposós (etapa 2.12) com uma unidade de filtro centrífuga para 0,5 mL (concentração lipídica final de 10 mM). Usando um rotor de ângulo fixo, gire a 7500 x g por aproximadamente 15 min.
- Transfira 20 μL de (NH4)2Amostras desolução E liposomos para duas respectivas panelas DSC. Sele as panelas com tampas herméticas DSC usando o kit de prensa de amostra DSC.
- Meça a amostra de 30 °C a 60 °C a uma taxa de aquecimento de 1 °C/min utilizando um calómetro diferencial de varredura.
- Analise os dados com software apropriado. Tome a temperatura de transição de fase (Tm)como o início da transição de fase (pico de derretimento), que é medido pela interceptação x da tangente do ponto de inclinação máxima.
6. Lançamento dodoxorubicina
- Pré-aqueça o HBS a temperatura designada (37 ou 42 °C) usando um banho de água. Prepare um banho de água gelada para saciar as amostras.
- Adicione 100 μL de liposós purificados carregados do DOX (passo 3.2.5) em 1,9 mL de HBS em um tubo de microcentrífuga. Coloque o tubo no banho de água da temperatura designada.
- Retire imediatamente 200 μL de amostras do tubo e coloque-o rapidamente no banho de água gelada para saciar qualquer liberação subsequente de drogas. Esta amostra corresponde ao ponto de tempo inicial (t = 0).
- Retire 200 μL de amostras nos pontos de ponto subsequentes (t = 5, 10, 15, 30, 60 min) e coloque-a rapidamente no banho de água gelada para saciar qualquer liberação de drogas.
- Misture 50 μL de amostra de cada ponto de tempo com 150 μL de HBS em uma placa preta de 96 poços. Meça a intensidade de fluorescência do DOX usando um leitor de placa.
- Adicione 20 μL de 1% (v/v) Triton X-100 em poços selecionados aleatórios preparados na etapa 6.5. Meça a intensidade de fluorescência DOX desses poços usando um leitor de placas. Esses valores correspondem ao ponto de tempo totalmente liberado (t = ¥; 100% de liberação).
- Calcule e lote a porcentagem do DOX liberada interpolando a intensidade da fluorescência de cada ponto de tempo (I(t)), em comparação com o valor inicial (I(0),e totalmente liberado (I(⁄)), valor.
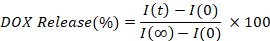
7. Aquecimento a laser e liberação acionada
- Afina a temperatura do banho de água para 37 °C e deixe a temperatura estabilizar.
- Adicione 200 μL de LTSL10-ICG carregado do DOX ([ICG] = 10 μg/mL) a uma placa clara de 96 poços, em seguida, coloque-o no banho de água, mantenha o fundo imerso na água.
- Coloque a corrente do sistema laser para 2,27 A. Coloque o collimator do sistema laser a 5 cm verticalmente acima da superfície da placa de 96 poços, o que corresponde a um fluxo de energia de 0,5 W/cm2 [Figura 6].
ATENÇÃO: O sistema a laser deve ser operado em conformidade com as medidas relevantes de segurança a laser. - Ligue o laser e monitore a temperatura a cada minuto usando uma sonda de temperatura de fibra óptica.
- Aos 5 e 10 min, retire 10 μL de liposós irradiados a laser da placa clara de 96 poços e misture com 190 μL de HBS para três poços em uma placa preta de 96 poços.
- Misture 10 μL dos liposóis com 170 μL de HBS e 20 μL de 1% (v/v) Solução Triton X-100 para três poços em uma placa preta de 96 poços. Esses poços correspondem ao conteúdo DOX "100% lançado". Meça a intensidade fluorescente do DOX e calcule a liberação do DOX conforme descrito na etapa 6.7.
Access restricted. Please log in or start a trial to view this content.
Resultados
A preparação de LTSLs por microfluidos requer a composição lipídica do DPPC/MSPC/DSPE-PEG2000 (80/10/10, relação molar; LTSL10). A Figura 7A (à esquerda) mostra o aparecimento do LTSL10 tão preparado a partir da etapa 2.9, como um líquido claro e não viscoso. A formulação LTSL10 é desenvolvida a partir da formulação convencional, LTSL4 (DPPC/MSPC/DSPE-PEG2000, 86/10/4, relação molar) uma vez que o LTSL4...
Access restricted. Please log in or start a trial to view this content.
Discussão
O protocolo apresentado descreve a preparação de liposós sensíveis à temperatura baixa (LTSLs) usando um micromixer de arenque escalonado (SHM). A formulação LTSL10 permite a liberação de rajadas desencadeadas pela temperatura da doxorubicina dentro de 5 minutos a uma temperatura hipertermrmica clinicamente atingível de 42 °C. O verde indocianina (ICG) também pode ser co-carregado para aquecimento fototérmico desencadeado pela liberação do DOX. O método se baseia em: (i) auto-montagem de fosfolipidas em l...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos ao Prostate Cancer UK (CDF-12-002 Fellowship) e ao Conselho de Pesquisa em Engenharia e Ciências Físicas (EPSRC) (EP/M008657/1) pelo financiamento.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Lipoid | PC 16:0/16:0 (DPPC) | |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000) | Lipoid | PE 18:0/18:0-PEG 2000 (MPEG 2000-DSPE) | |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine (MSPC) | Avanti Polar Lipid | 855775P-500MG | Distributed by Sigma-Adrich; also known as Lyso 16:0 PC (Not to be confused with 14:0/18:0 PC, which is also termed MSPC) |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375-100G | |
| Adapters, Female Luer Lock to 1/4"-28UNF | IDEX Health & Science | P-624 | Requires 2 units. For the inlets |
| Adapters, Union Assembly, 1/4"-28UNF | IDEX Health & Science | P-630 | Requires 2 units. (One unit included 2 nuts and 2 ferrules) |
| Ammonium Sulfate ((NH4)2SO4) | Sigma-Aldrich | 31119-1KG-M | |
| Bijou vial | VWR | 216-0980 | 7 mL, clear, polystyrene vial |
| Centrifugal Filter Unit | Sigma-Aldrich | UFC801008 | 10 kDa MWCO, Amicon Ultra-4 Centrifugal Filter Unit |
| Centrifuge | ThermoFisher Scientific | Heraeus Megafuge 8R | With HIGHConic III Fixed Angle Rotor |
| Cuvette | Fisher Scientific | 11602609 | Disposable polystyrene cuvette, low volume, for DLS measurement |
| Dialysis Kit - Pur-A-Lyzer Maxi | Sigma-Aldrich | PURX12015-1KT | 12-14 kDa MWCO |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 34943-1L-M | |
| DLS Instrument | Malvern Panalytical | Zetasizer Nano ZS90 | |
| Doxorubicin Hydrochloride (DOX) | Apollo Scientific | BID0120 | |
| DSC Instrument | TA Instruments | TA Q200 DSC | |
| DSC Tzero Hermetic Lids | TA Instruments | 901684.901 | For DSC measurement |
| DSC Tzero Pans | TA Instruments | 901683.901 | For DSC measurement |
| DSC Tzero Sample Press Kit | TA Instruments | 901600.901 | For DSC measurement |
| Ethanol | VWR | 20821.330 | Absolute, ≥99.8% |
| FC-808 Fibre Coupled Laser System | CNI Optoelectronics Tech | FC-808-8W-181315 | FOC-01-B Fiber Collimator included. |
| Ferrule, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-200 | For the outlet |
| Fibre Optic Temperature Probe | Osensa | PRB-G40 | |
| Glass Staggered Herringbone Micromixer (SHM) | Darwin Microfluidics | Herringbone Mixer - Glass Chip | |
| Heating Tape | Omega | DHT052020LD | Can be replaced by other syringe heater such as "HTC" or "SRT series" for slower heating. Manual wiring to a 3-pin plug required for 240V models |
| Indocyanine Green | Adooq | A10473-100 | Distributed by Bioquote Limited (U.K.) |
| Luer-lock Syringe, 5 mL | VWR | 613-2043 | Hanke Sass Wolf SOFT-JECT 3-piece syringes, O.D. 12.45 mm |
| Microplate Reader | BMG Labtech | FLUOstar Omega | Installed with 485 nm (exictation) and 590 nm (emission) filters |
| Microplate, 96-well, Black, Flat-bottom | ThermoFisher Scientific | 611F96BK | For fluorescence measurement in microplate reader |
| Microplate, 96-well, Clear, Flat-bottom | Grenier | 655101 | For absorbance measurement microplate reader |
| Nut, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-245 | For the outlet |
| PC to Pump Network Cable for Aladdin, 7ft | World Precision Instruments | NE-PC7 | Optional: Syringe pumps can be operated manually |
| Pump control software - SyringePumpPro Software License for 2 | World Precision Instruments | SYRINGE-PUMP-PRO-02 | Optional: Syringe pumps can be operated manually |
| Pump to Pump Network Cable for Aladdin, 7 ft | World Precision Instruments | NE-NET7 | Optional: Syringe pumps can be operated manually |
| Size exclusion chromatography (SEC) column | GE Life Science | 17085101 | Sephadex G-25 resin in PD-10 Desalting Columns |
| Sodium chloride (NaCl) | Sigma-Aldrich | 31434-1KG-M | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S5881-500G | |
| Syringe Pumps & Cable (DUAL-PUMP-NE-1000) | World Precision Instruments | ALADDIN2-220/AL1000-220 | |
| Thermostat Temperature Controller | Inkbird | ITC-308 | Can be replaced by other syringe heater kit/thermostat |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Tubing, ETFE (1/16" OD) | IDEX Health & Science | 1516 | |
| USB To RS-232 Converter | World Precision Instruments | CBL-USB-232 | Optional: For computer without RS-232 port |
| Water Bath | Grant Instruments Ltd. | JB Nova 12 |
Referências
- Needham, D., Park, J., Wright, A. M., Tong, J. Materials characterization of the low temperature sensitive liposome (LTSL): effects of the lipid composition (lysolipid and DSPE-PEG2000) on the thermal transition and release of doxorubicin. Faraday Discussions. 161, 515-534 (2013).
- Ickenstein, L. M., Arfvidsson, M. C., Needham, D., Mayer, L. D., Edwards, K. Disc formation in cholesterol-free liposomes during phase transition. Biochimica et Biophysica Acta - Biomembranes. 1614 (2), 135-138 (2003).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Chen, D., et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation. Journal of the American Chemical Society. 134 (16), 6948-6951 (2012).
- Forbes, N., et al. Rapid and scale-independent microfluidic manufacture of liposomes entrapping protein incorporating in-line purification and at-line size monitoring. International Journal of Pharmaceutics. 556, 68-81 (2019).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: microfluidics in drug discovery. Nature Reviews Drug Discovery. 5 (3), 210-218 (2006).
- Capretto, L., Carugo, D., Mazzitelli, S., Nastruzzi, C., Zhang, X. Microfluidic and lab-on-a-chip preparation routes for organic nanoparticles and vesicular systems for nanomedicine applications. Advanced Drug Delivery Reviews. 65 (11-12), 1496-1532 (2013).
- Cheung, C. C. L., Al-Jamal, W. T. Sterically stabilized liposomes production using staggered herringbone micromixer: Effect of lipid composition and PEG-lipid content. International Journal of Pharmaceutics. 566, 687-696 (2019).
- Suh, Y. K., Kang, S. A. Review on Mixing in Microfluidics. Micromachines. 1 (3), 82-111 (2010).
- Jahn, A., Vreeland, W. N., Gaitan, M., Locascio, L. E. Controlled Vesicle Self-Assembly in Microfluidic Channels with Hydrodynamic Focusing. Journal of the American Chemical Society. 126 (9), 2674-2675 (2004).
- Stroock, A. D. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Belliveau, N. M., et al. Microfluidic Synthesis of Highly Potent Limit-size Lipid Nanoparticles for In Vivo Delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37(2012).
- Patra, M., et al. Under the influence of alcohol: The effect of ethanol and methanol on lipid bilayers. Biophysical Journal. 90 (4), 1121-1135 (2006).
- Komatsu, H., Rowe, E. S., Rowe, E. S. Effect of Cholesterol on the Ethanol-Induced Interdigitated Gel Phase in Phosphatidylcholine: Use of Fluorophore Pyrene-Labeled Phosphatidylcholine. Biochemistry. 30 (9), 2463-2470 (1991).
- Lu, J., Hao, Y., Chen, J. Effect of Cholesterol on the in Lysophosphatidylcholine Formation of an Interdigitated Gel Phase and Phosphatidylcholine Binary. Journal of Biochemistry. 129 (6), 891-898 (2001).
- Vanegas, J. M., Contreras, M. F., Faller, R., Longo, M. L. Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes. Biophysical Journal. 102 (3), 507-516 (2012).
- Haran, G., Cohen, R., Bar, L. K., Barenholz, Y. Transmembrane ammonium sulfate gradients in liposomes produce efficient and stable entrapment of amphipathic weak bases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1151 (2), 201-215 (1993).
- Sadeghi, N., et al. Influence of cholesterol inclusion on the doxorubicin release characteristics of lysolipid-based thermosensitive liposomes. International Journal of Pharmaceutics. 548 (2), 778-782 (2018).
- Lawaczeck, R., Kainosho, M., Chan, S. I. The formation and annealing of structural defects in lipid bilayer vesicles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 443 (3), 313-330 (1976).
- Komatsu, H., Okada, S. Ethanol-induced aggregation and fusion of small phosphatidylcholine liposome: participation of interdigitated membrane formation in their processes. BBA - Biomembranes. 1235 (2), 270-280 (1995).
- Marsh, D., Bartucci, R., Sportelli, L. Lipid membranes with grafted polymers: physicochemical aspects. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1615 (1-2), 33-59 (2003).
- Hood, R. R., Vreeland, W. N., DeVoe, D. L. Microfluidic remote loading for rapid single-step liposomal drug preparation. Lab on a Chip. 14 (17), 3359-3367 (2014).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of diafiltration and tangential flow filtration for purification of nanoparticle suspensions. Pharmaceutical Research. , (2005).
- Roces, C., Kastner, E., Stone, P., Lowry, D., Perrie, Y. Rapid Quantification and Validation of Lipid Concentrations within Liposomes. Pharmaceutics. 8 (3), 29(2016).
- Kim, S. -H., Kim, J. W., Kim, D. -H., Han, S. -H., Weitz, D. A. Enhanced-throughput production of polymersomes using a parallelized capillary microfluidic device. Microfluidics and Nanofluidics. 14 (3-4), 509-514 (2013).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados