É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um modelo de punção de folheto de válvula mitral transapical guiada por imagem de sobrecarga de volume controlada da regurgitação mitral no rato
Neste Artigo
Resumo
Um modelo de roedor de sobrecarga de volume do coração esquerdo da regurgitação mitral é relatado. A regurgitação mitral da gravidade controlada é induzida pelo avanço de uma agulha de dimensões definidas no folheto anterior da válvula mitral, em um coração pulsante, com orientação de ultrassom.
Resumo
A regurgitação mitral (Mr) é uma lesão de válvula cardíaca amplamente prevalente, que causa remodelagem cardíaca e leva à insuficiência cardíaca congestiva. Embora os riscos de RM não corrigido e seu prognóstico ruim sejam conhecidos, as alterações longitudinais na função cardíaca, estrutura e remodelação são incompletamente compreendidas. Essa lacuna de conhecimento limitou nossa compreensão do tempo ideal para a correção da RM, e o benefício que a correção precoce versus tardia da RM pode ter no ventrículo esquerdo. Para investigar os mecanismos moleculares que estão por trás da remodelação ventricular esquerda no cenário da RM, modelos animais são necessários. Tradicionalmente, o modelo de fístula aorto-caval tem sido usado para induzir a sobrecarga de volume, que difere de lesões clinicamente relevantes, como mr. Mr. representa um estressor hemodinâmico de baixo volume de pressão, que requer modelos animais que imitam essa condição. Aqui, descrevemos um modelo de roedor de RM grave em que o folheto anterior da válvula mitral de rato é perfurado com uma agulha 23G, em um coração batendo, com orientação de imagem ecocardiográfica. A gravidade da RM é avaliada e confirmada com ecocardiografia, e a reprodutibilidade do modelo é relatada.
Introdução
A regurgitação mitral (RM) é uma lesão comum da válvula cardíaca, diagnosticada em 1,7% da população geral dos EUA e em 9% da população idosa maior que 65 anos1. Nesta lesão da válvula cardíaca, o fechamento inadequado dos folhetos da válvula mitral em sístole, causa regurgitação de sangue do ventrículo esquerdo no átrio esquerdo. A RM pode ocorrer devido a várias etiologias; no entanto, as lesões primárias da válvula mitral (RM primária) são diagnosticadas e tratadas com maior freqüência em comparação com a RM secundária2. A RM primária isolada é frequentemente resultado da degeneração miomatosa da válvula mitral, resultando em alongamento dos folhetos ou chordae tendineae, ou ruptura de alguns chordae, que contribuem para a perda de coaptação sistólica da válvula.
A RMr resultante dessas lesões da válvula eleva o volume sanguíneo preenchendo o ventrículo esquerdo em cada batimento cardíaco, aumentando o estresse da parede diastólica final e fornecendo um estressor hemodinâmico que incita a adaptação cardíaca e a remodelagem. A remodelagem cardíaca nesta lesão é frequentemente caracterizada por um alargamento significativo da câmara3,4, hipertrofia de parede leve, com função contratativa preservada por períodos prolongados de tempo. Uma vez que a fração de ejeção é frequentemente preservada, a correção da RM usando meios cirúrgicos ou transcateter é muitas vezes retardada, até o início de sintomas como dispnéia, insuficiência cardíaca e arritmias. No entanto, a RM não corrigida está associada a altos riscos de eventos adversos cardíacos, embora atualmente o conhecimento sobre as mudanças ultraestruturais subjacentes a esses eventos seja desconhecido.
Os modelos animais de RM fornecem um modelo valioso para investigar tais alterações ultraestruturais no coração, e estudar a progressão longitudinal da doença. Anteriormente, os pesquisadores induziram a RM em animais de grande porte, incluindo suínos, cães e ovelhas, criando um shunt ventriculo-atrial externo5, ruptura intracardíaca do acorde6, ou perforação defolheto7. Embora as técnicas cirúrgicas sejam mais fáceis em animais de grande porte, esses estudos têm sido limitados ao acompanhamento subcrônico em um pequeno tamanho amostral, devido aos altos custos de realização desses estudos em animais de grande porte. Além disso, a análise molecular dos tecidos desses modelos é muitas vezes desafiadora devido a anticorpos específicos de espécies limitadas e bibliotecas de genomas anotados para alinhamento.
Pequenos modelos animais de RM podem fornecer uma alternativa adequada para estudar esta lesão valvar e seu impacto na remodelagem cardíaca. Historicamente, o modelo de rato de fístula aorto-caval (ACF) de sobrecarga de volume cardíaco tem sido usado. Descrita pela primeira vez em 1973 por Stumpe et al.8, uma fístula arterio-venosa é cirurgicamente criada para contornar o sangue arterial de alta pressão da aorta descendente para a veia cava inferior de baixa pressão. A alta taxa de fluxo na fístula induz uma drástica sobrecarga de volume em ambos os lados do coração, causando hipertrofia ventricular direita e esquerda significativa e disfunção ocorrida dentro de dias após a criação do ACF9. Apesar de seu sucesso, a ACF não imita a hemodinâmica da RM, uma sobrecarga de volume de baixa pressão, que eleva a pré-carga, mas também reduz a pós-carga. Devido a tais limitações do modelo ACF, buscou-se desenvolver e caracterizar um modelo de RM que imitasse melhor a sobrecarga de volume de baixa pressão.
Aqui descrevemos o protocolo para um modelo de punção de folheto de válvula mitral para criar RM grave em ratos10,11. Uma agulha hipodérmica foi introduzida no coração de rato batendo, e avançou para o folheto da válvula mitral anterior sob orientação ecocardiográfica em tempo real. A técnica é altamente reproduzível e um modelo relativamente bom que imita a RM como visto em pacientes. A gravidade da RM é controlada pelo tamanho da agulha usada para perfurar o folheto mitral e a gravidade da RM pode ser avaliada utilizando-se a ecocardiografia transesofágica (TEE).
Protocolo
Os procedimentos foram aprovados pelo Programa de Cuidados e Uso de Animais da Universidade Emory sob o protocolo número EM63Rr, data de aprovação 06/06/2017.
1. Preparação pré-cirúrgica
- O vapor esteriliza os instrumentos cirúrgicos antes do procedimento.
- No dia do procedimento, transfira ratos da casa para a cirurgia, e pese-os.
- Desenhe medicamentos pré-operatórios e pós-operatórios de acordo com o peso: duas doses de Carprofen (2,5 mg/kg cada), uma dose de Gentamicina (6 mg/kg) e uma dose de Buprenorfina (0,02 mg/kg).
- Assegure-se de volume adequado de isoflurano na batedeira de gás e oxigênio nos tanques estão disponíveis para a cirurgia. Um tanque cheio de oxigênio (24 pés3) é muitas vezes adequado.
2. Preparação animal
NOTA: Foram utilizados neste estudo ratos machos adultos Sprague-Dawley pesando 350-400 g. As técnicas cirúrgicas são passíveis de animais ligeiramente menores ou maiores, se desejarem.
- Sede o rato em uma câmara de indução com 5% de isoflurano misturado em 1 LPM (litro por minuto) de 100% de oxigênio. Determine o nível adequado de sedação a partir de uma taxa respiratória mais lenta sob observação visual, e perda de contração ao beliscar o dedo do rato.
- Entubar o rato com um angiocath de 16 G, equipado para uso como tubo endotraqueal.
- Visualize a traqueia e as cordas vocais usando um otoscópio, e use um aplicador de ponta de algodão para limpar secreções faríngeas.
- Introduza o tubo endotraqueal em um fio guia de 0,034 polegadas, nas cordas vocais. Uma vez que o tubo esteja devidamente colocado na traqueia, empurre o tubo para dentro e retire o fio(Figura1).
- Coloque o rato sobre a almofada cirúrgica aquecida mantida a 37 °C e conecte o tubo endotraqueal a um ventilador mecânico. Insira o peso do rato no software de controle do ventilador, que calcula a taxa de ventilação e o volume da maré. Foram utilizadas 66 respirações por minuto com volume de maré de 1 mL/100 g de peso corporal (Figura 1D).
- Use 100% de oxigênio (1 LPM) misturado com 2-2,5% isoflurano como anestésico inalador e confirme o nível de anestesia com perda do tom da mandíbula e perda de resposta ao toe pinch.
- Observe que, se devidamente entubado, o movimento do peito deve sincronizar com o ventilador.
- Se indevidamente entubado, o movimento do peito não sincronizará com o ventilador. Para testar a intubação inadequada, comprima o abdômen do rato, o que cria pressão de fundo no ventilador, gerando um alarme de sobrepressão. Nesse cenário, retraia o angiocath suavemente e devolva o rato à câmara de indução com 5% de isoflurano por alguns minutos para garantir que o rato esteja suficientemente anestesiado e re-entubar o rato.
- Uma vez devidamente entubado, fixe o tubo endotraqueal suturando a extremidade proximal do tubo na bochecha do rato com uma sutura de seda 4-0 para evitar a extubação durante o procedimento.
- Insira uma sonda de temperatura retal para monitorar a temperatura corporal e um eletrocardiograma de quatro terminais para monitorar o ECG durante todo o procedimento.
- Use uma lâmpada de aquecimento aérea se o calor da plataforma cirúrgica for insuficiente. Desligue a lâmpada se a temperatura do corpo subir acima de 37 °C.
- Avalie visualmente o eletrocardiograma para qualquer arritmia ou sinais de isquemia miocárdica. Se nenhum estiver presente, registre o eletrocardiograma da linha de base.
- Realizar ecocardiografia transtorácica (TTE) para função cardíaca de linha de base(Figura 2A).
- Vire o rato para uma posição supina e raspe o lado esquerdo do tórax. Para obter vistas claras do eco, remova o cabelo usando um creme depilatório.
- Use qualquer sistema de ultrassom com freqüência adequada para imagens de alta freqüência cardíaca. Neste estudo foram utilizados o sistema Visualsonics 2100 com uma sonda de 21 MHz, que é apropriada para imagens cardíacas em ratos.
- Obtenha imagens do modo B no plano de eixo longo parasternal, para calcular os volumes ventriculares esquerdos. No mesmo plano, obtenha imagens do modo M para medir as dimensões da parede.
- Gire a sonda em 90°, e obtenha vistas de eixo curto parasternal do modo B e M no nível médio papilar para medir as dimensões da parede transversal.
- Realizar ecocardiografia transesofágica (TEE) para imagem de linha de base(Figura 2B).
- Coloque o rato na posição de decúbito direito e insira uma sonda de ultrassom intracardíaco de 8 Fr (8 MHz) no esôfago do rato com uma pequena quantidade de gel aplicada na ponta. A freqüência da sonda ICE (ecocardiografia intracardíaca) é suficiente para obter 4-6 quadros por batimento cardíaco, que são adequados para visualizar o movimento da válvula.
NOTA: Um sistema prime GE Vivid I ou Siemens SC2000 pode ser usado para imagens de GELO. - Obtenha uma visão esofágica alta para obter uma visão de duas câmaras do lado esquerdo do coração. Esta visão é ideal para visualizar o átrio esquerdo, a válvula mitral e o ventrículo esquerdo. Posicione a sonda de forma que folhetos anteriores e posteriores sejam visualizados e a coaptação seja central. Este ângulo também permite medições do Doppler através da válvula mitral, sem correção de ângulo.
- Medir as dimensões de anulo da área atrial esquerda e da válvula mitral nesta visão.
- Realize imagens do doppler de cor para confirmar a competência da válvula e a falta de RM na linha de base. Realize ondas pulsadas e imagens contínuas de Doppler de onda para quantificar o fluxo mitral e confirmar a falta de fluxo regurgitante.
- Realize o modo B e a imagem do doppler de onda pulsada da aorta para medir o diâmetro da raiz aórtica e calcular o fluxo aórtico.
- Realize a imagem do doppler de onda pulsada da veia pulmonar para medir o fluxo venoso pulmonar.
- Coloque o rato na posição de decúbito direito e insira uma sonda de ultrassom intracardíaco de 8 Fr (8 MHz) no esôfago do rato com uma pequena quantidade de gel aplicada na ponta. A freqüência da sonda ICE (ecocardiografia intracardíaca) é suficiente para obter 4-6 quadros por batimento cardíaco, que são adequados para visualizar o movimento da válvula.
- Injete uma única dose de Carprofen (2,5 mg/kg, SQ, anti-inflamatório não esteróide), gentamicina (6 mg/kg, QS, antibiótico) e soro ciana estéril (1 mL, SQ) para compensar preventivamente a perda de sangue durante o procedimento.
- Raspe o lado esquerdo do tórax conforme necessário para remover qualquer cabelo restante do campo cirúrgico. A barba da região inferior do pescoço para o xifóide, e do braço esquerdo até o meio do esterno deve ser suficiente para garantir um campo desprovido de cabelo e reduzir o risco de contaminação do local cirúrgico.
- Esfregue a área cirúrgica com uma gaze encharcada em Betadine, seguida por uma gaze encharcada em 70% de etanol. Esfregue a área em movimentos circulares na pele, de forma que a gaze não entre em contato com uma área previamente esfregada.
- Repita este passo três vezes para alcançar um campo adequadamente estéril para a cirurgia.
- Cubra o animal com tampas estéreis, abrindo uma janela para acessar a área cirúrgica estéril.
3. Toracotomia esquerda
- Realizar todo o procedimento cirúrgico utilizando técnicas assépticas, com isoflurano mantido em 2-2,5% em 1 LPM de oxigênio. Coloque todos os instrumentos em uma bandeja estéril e coloque de volta na bandeja após cada uso.
- Use luvas estéreis, uma máscara e uma touca cirúrgica pelo cirurgião durante todo o procedimento. Um vestido cirúrgico estéril também pode ser usado, mas é opcional, a menos que seja esperado contaminação.
- Use um bisturi cirúrgico com uma lâmina sem #15 para fazer uma incisão cutânea no lado esquerdo do tórax, aproximadamente 1 cm proximal ao xifoida. Use uma tesoura de ponta de dissecação sem cortes para separar a camada da pele da camada muscular e fazer uma incisão longitudinal.
- Disseque as camadas musculares da mesma forma até que as costelas sejam expostas.
- Faça cuidadosamente uma incisão longitudinal de 2-3 cm no quinto espaço intercostal, adequada para inserir retráteis e expor o coração.
- Use fórceps de ponta fina para levantar o pericárdio, e micro tesouras para extirpar na região ao redor do ápice do coração. Esta etapa ajuda a evitar adesões pós-cirúrgicas do coração nas paredes do peito e diafragma.
NOTA: Evite incisões cirúrgicas próximas ao esterno para minimizar o sangramento. Transcção nas artérias mamárias internas que correm ao longo do esterno, pode causar sangramento excessivo. Se for encontrado com tal sangramento, identifique o sangramento e cauterize-o.
4. Procedimento de Mr guiado por Eco(Figura 3 e Figura 4)
- Use uma sutura de prolene 6-0 e um suporte de microagulha, para colocar uma sutura de corda de bolsa no ápice do ventrículo esquerdo. Se necessário, use fórceps micro para estabilizar o coração.
- Amarre suavemente a sutura apical para estabilizar o ápice e insira uma agulha de 23 G (lavada com soro fisiológico, e com uma torneira na extremidade distal) no centro da sutura da corda da bolsa, na cavidade ventricular esquerda.
- Use uma mão para segurar e guiar a agulha, e a outra mão para manipular simultaneamente a sonda de eco transesofágica para obter uma visão de eco ideal para visualizar a agulha, como descrito acima.
- Com orientação de ultrassom em tempo real, avance a agulha em direção ao lado ventricular do folheto mitral anterior. Uma vez confirmada a posição da agulha no ultrassom, avance a agulha em um movimento fino através do folheto da válvula. Se uma resistência for sentida, torça a agulha à medida que ela é avançada no folheto para perforá-la.
NOTA: Avançar a agulha muito longe no átrio esquerdo pode resultar em perfuração atrial esquerda, causando sangramento excessivo e morte animal. A agulha deve ser visualizada no ultrassom o tempo todo. - Retraia a agulha para dentro da câmara ventricular esquerda, longe da válvula mitral, e confirme a ressonância magnética ligando a imagem do Doppler colorida.
- Se a Ressonância Magnética não for vista na imagem do Doppler colorida, repita as etapas 4.4 e 4.5. Ajuste a sonda de eco, se necessário, para obter uma melhor visualização. Após a prática em poucos ratos, é possível induzir uma punção de folheto em um movimento da agulha, induzindo um orifício que é do tamanho do diâmetro externo da agulha. Isso foi confirmado após necropsia dos corações dos ratos.
- Uma vez que a Ressonância Magnética seja confirmada, retire a agulha da cavidade ventricular esquerda e amarre suavemente a sutura da corda da bolsa.
- Use uma gaze estéril para absorver qualquer sangue no ápice e na cavidade torácica.
NOTA: Tocar a sonda de eco com as luvas cirúrgicas pode resultar em contaminação do ambiente estéril. Borrife suas luvas com 70% de etanol ou substitua as luvas por novas, apropriadamente.
5. Recuperação animal e cuidados pós-operatórios
- Após 5-10 minutos de função cardíaca estável (ECG normal e freqüência cardíaca), feche a toracotomia em camadas com vicryl 4-0, enquanto reduz o isoflurano em etapas.
- Use uma sutura interrompida para aproximar as costelas, com isoflurano mantido em 2%. Insira um tubo torácico no sexto espaço intercostal e fixe-o nas cortinas estéreis para evitar o avanço inadvertido do tubo na cavidade torácica.
- Use uma sutura contínua para fechar a camada muscular com isoflurano mantido em 1,5%.
- Use uma sutura contínua para fechar a camada cutânea com isoflurano mantido em 1%.
- Conecte uma seringa de 10 mL luer-lock com ponta supressora ao tubo torácico e drene 10-12 mL de ar da cavidade torácica e, em seguida, remova o tubo torácico.
- Administre uma dose final de Carprofen (2,5 mg/kg, SQ) e desligue o isoflurano.
- Continue a ventilação mecânica enquanto desmamem os ratos da anestesia, monitorando sinais vitais (SpO2 e freqüência cardíaca). No início da respiração espontânea, desligue a ventilação para testar a capacidade do rato de manter tal respiração e boa SpO2.
- Se os níveis de SpO2 começarem a cair abaixo de 90%, ligue o ventilador. Uma vez que o rato é capaz de manter os níveis de SpO2 sem ventilação, a sutura de ancoragem para o tubo endotraqueal é cortada, e o animal é preparado para extubação.
- Uma vez que o rato mostre sinais de alerta, incluindo movimentos de bigode ou olhos, extubar o animal.
- Coloque um cone de nariz com 100% de oxigênio até que o rato esteja ambulatorial.
- Transfira o rato para uma gaiola limpa com roupa de cama mínima e continue monitorando sinais vitais usando um monitor SpO2 portátil, colocado no pé ou na cauda do rato, até que o rato seja ambulatorial.
NOTA: Se os efeitos adversos da cirurgia forem observados, os animais podem ter um tempo de recuperação mais longo e podem levar mais tempo para manter altos níveis de SpO2. Se isso ocorrer, um cone de nariz com 100% de oxigênio pode ser aplicado até que os níveis de SpO2 estejam estáveis. - Para reduzir o risco de lesão no local cirúrgico e evitar o risco de infecção, ratos solteiros após a cirurgia.
- Administre buprenorfina dentro de 3 h após o rato acordar e ambulatorial suficientemente. A buprenorfina pode causar problemas respiratórios quando administrada no início do período de recuperação perioperatória, atrasá-la até que o rato esteja respirando sem dificuldade.
- Após a cirurgia, todos os animais recebem os seguintes medicamentos: gentamicina (6 mg/kg, SQ, SID POD 1-3) e rimadyl (5 mg/kg, SQ, SID POD 1-3). Todos os animais são observados uma vez por dia durante cinco dias após a cirurgia para exame de locais de incisão, e uma vez por dia nas duas primeiras semanas após a cirurgia para avaliação da dor.
6. Validação da gravidade da RM com ecocardiografia (Figura 5)
- Repita o TEE duas semanas após a cirurgia, utilizando as mesmas etapas especificadas na seção 2.7. Duas semanas após a cirurgia é tempo adequado para a hemodinâmica estabilizar.
- Obtenha imagens do doppler coloridas em uma visão de 2 câmaras usando imagens de ultrassom transesofágico, visualizando o ventrículo esquerdo e o átrio esquerdo. Meça a área do átrio esquerdo e do jato MR. Calcular a fração da área do jato MR usando
 (1)
(1)
A RM grave é definida como área de jato MR ≥ 30%. - Aproxime-se da área do orifício regurgitante calculando a área da agulha de 23 G, utilizando o diâmetro externo da agulha. Esta equação pressupõe que a área do orifício regurgitante é igual à área da agulha 23G.
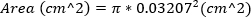 (2)
(2) - Obtenha imagens do Doppler de onda contínua com o portão Doppler no orifício do jato regurgitante. Rastreie a forma de onda para calcular o VTI do jato regurgitante. O volume de Mr pode ser estimado usando
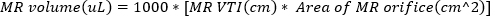 (3)
(3)
A RM grave é definida como volume mr ≥ 95 μL. - Obtenha a imagem do doppler de onda de pulso da veia pulmonar girando a sonda de eco lateralmente, no sentido horário. Meça as velocidades de onda sistólica e diastólica e use a seguinte equação para calcular a razão.
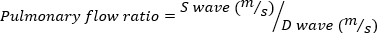 (4)
(4)
Uma razão de fluxo pulmonar negativo indica rM grave.
7. Cirurgia sham
- Executar as seções 1-3 conforme descrito.
- Modificar a seção 4 foi modificada de forma que a agulha de 23 G seja inserida na câmara ventricular esquerda, através de uma sutura de corda de bolsa no ápice ventricular esquerdo, mas não avançada na válvula mitral para criar MR. Insira a agulha na câmara ventricular esquerda e retraia imediatamente, seguindo pelo aperto e fechamento do ápice ventricular.
- Executar a seção 5 como descrito.
- Realizar a avaliação da válvula mitral conforme descrito na seção 6. No entanto, a RM não deve estar presente em nenhum dos animais, portanto, a quantificação descrita não é necessária.
Resultados
Viabilidade e reprodutibilidade
O modelo de RM proposto é altamente reproduzível, com um orifício bem definido no folheto mitral alcançado em 100% dos ratos utilizados neste estudo. A Figura 6A retrata a direção da agulha como ela é inserida na válvula mitral. A Figura 6B retrata um furo no folheto da válvula mitral de um rato representativo explantado 2 semanas após...
Discussão
É relatado um modelo de roedor reprodutível de RM grave com boa sobrevida (93,75% de sobrevivência após a cirurgia) e sem complicações pós-operatórias significativas. Imagens em tempo real com ecocardiografia transesofágica e introdução de uma agulha no coração pulsante para perfurar o folheto mitral são viáveis e podem ser ensinadas. A RM grave foi produzida com o tamanho da agulha de 23 G neste estudo, que pode ser variado conforme desejado usando uma agulha menor ou maior. A RM induzida neste modelo cri...
Divulgações
M.P é conselheiro da Heart Repair Technologies (HRT), para a qual recebeu taxas de consultoria. A HRT não teve qualquer papel neste estudo, nem forneceu qualquer financiamento para apoiar este trabalho.
Agradecimentos
Este trabalho foi financiado pela subvenção 19PRE34380625 e 14SDG20380081 da American Heart Association to D. Corporan e M. Padala, respectivamente, concede HL135145, HL133667 e HL140325 dos Institutos Nacionais de Saúde para M. Padala, e financiamento de infra-estrutura do Centro Cardíaco Carlyle Fraser no Emory University Hospital Midtown para M. Padala.
Materiais
| Name | Company | Catalog Number | Comments |
| 23G needle | Mckesson | 16-N231 | |
| 25G needle, 5/8 inch | McKesson | 1031797 | |
| 4-0 vicryl | Ethicon | J496H | |
| 6-0 prolene | Ethicon | 8307H | |
| 70% ethanol | McKesson | 350600 | |
| ACE Light Source | Schott | A20500 | |
| ACUSON AcuNav Ultrasound probe | Biosense Webster | 10135936 | 8Fr Intracardiac echo probe |
| ACUSON PRIME Ultrasound System | Siemens | SC2000 | |
| Betadine | McKesson | 1073829 | |
| Blunted microdissecting scissors | Roboz | RS5990 | |
| Buprenorphine | Patterson Veterinary | 99628 | |
| Carprofen | Patterson Veterinary | 7847425 | |
| Chest tube (16G angiocath) | Terumo | SR-OX1651CA | |
| Disposable Surgical drapes | Med-Vet | SMS40 | |
| Electric Razor | Oster | 78400-XXX | |
| Gentamycin | Patterson Veterinary | 78057791 | |
| Heat lamp with table clamp | Braintree Scientific | HL-1 120V | |
| Hemostatic forceps, curved | Roboz | RS7341 | |
| Hemostatic forceps, straight | Roboz | RS7110 | |
| Induction chamber | Braintree Scientific | EZ-1785 | |
| Injection Plug, Cap, Luer Lock | Exel | 26539 | |
| Isoflurane | Patterson Veterinary | 6679401725 | |
| Mechanical ventilator | Harvard Apparatus | Inspira ASV | |
| Microdissecting forceps | Roboz | RS5135 | |
| Microdissecting spring scissors | Roboz | RS5603 | |
| Needle holder | Roboz | RS6417 | |
| No. 15 surgical blade | McKesson | 1642 | |
| Non-woven sponges | McKesson | 446036 | |
| Otoscope | Welch Allyn | 23862 | |
| Oxygen | Airgas Healthcare | UN1072 | |
| Pulse Oximeter | Nonin Medical | 2500A VET | |
| Retractor, Blunt 4x4 | Roboz | RS6524 | |
| Rodent Surgical Monitor | Indus Instruments | 113970 | The integrated platform allows for monitoring of vital signs and surgical warming |
| Scale | Salter Brecknell | LPS 150 | |
| Scalpel Handle | Roboz | RS9843 | |
| Silk suture 3-0 | McKesson | 220263 | |
| Small Animal Anesthesia System | Ohio Medical | AKDL03882 | |
| Sterile saline (0.9%) | Baxter | 281322 | |
| Sugical Mask | McKesson | 188696 | |
| Surgical cap | McKesson | 852952 | |
| Surgical gloves | McKesson | 854486 | |
| Syringe 10mL | McKesson | 1031801 | |
| Syringe 1mL | McKesson | 1031817 | |
| Ultra-high frequency probe | Fujifilm Visualsonics | MS250 | |
| Ultrasound gel | McKesson | 150690 | |
| VEVO Ultrasound System | Fujifilm Visualsonics | VEVO 2100 |
Referências
- Nkomo, V. T., et al. Burden of valvular heart diseases: a population-based study. Lancet. 368 (9540), 1005-1011 (2006).
- Zamorano, J. L., et al. Mechanism and Severity of Mitral Regurgitation: Are There any Differences Between Primary and Secondary Mitral Regurgitation?. The Journal of Heart Valve Disease. 25 (6), 724-729 (2016).
- Grossman, W., Jones, D., McLaurin, L. P. Wall stress and patterns of hypertrophy in the human left ventricle. Journal of Clinical Investigation. 56 (1), 56-64 (1975).
- Carabello, B. A. Concentric versus eccentric remodeling. Journal of Cardiac Failure. 8 (6), S258-S263 (2002).
- Braunwald, E., Welch, G. H., Sarnoff, S. J. Hemodynamic effects of quantitatively varied experimental mitral regurgitation. Circulation Research. 5 (5), 539-545 (1957).
- Sasayama, S., Kubo, S., Kusukawa, R. Hemodynamic and angiocardiographic studies on cardiodynamics: experimental mitral insufficiency. Japanese Circulation Journal. 34 (6), 513-530 (1970).
- Hennein, H., Jones, M., Stone, C., Clark, R. Left ventricular function in experimental mitral regurgitation with intact chordae tendineae. Journal of Thoracic and Cardiovascular Surgery. 105 (4), 624-632 (1993).
- Stumpe, K. O., Sölle, H., Klein, H., Krück, F. Mechanism of sodium and water retention in rats with experimental heart failure. Kidney International. 4 (5), 309-317 (1973).
- Abassi, Z., Goltsman, I., Karram, T., Winaver, J., Hoffman, A. Aortocaval fistula in rat: A unique model of volume-overload congestive heart failure and cardiac hypertrophy. Journal of Biomedicine and Biotechnology. 2011 (January), 1-13 (2011).
- Corporan, D., Onohara, D., Hernandez-Merlo, R., Sielicka, A., Padala, M. Temporal changes in myocardial collagen, matrix metalloproteinases, and their tissue inhibitors in the left ventricular myocardium in experimental chronic mitral regurgitation in rodents. American Journal of Physiology - Heart and Circulatory Physiology. 315 (5), H1269-H1278 (2018).
- Onohara, D., Corporan, D., Hernandez-Merlo, R., Guyton, R. A., Padala, M. Mitral Regurgitation Worsens Cardiac Remodeling in Ischemic Cardiomyopathy in an Experimental Model. The Journal of Thoracic and Cardiovascular Surgery. , (2019).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovascular Research. 24 (5), 430-432 (1990).
- Brower, G. L., Janicki, J. S. Contribution of ventricular remodeling to pathogenesis of heart failure in rats. American Journal of Physiology-Heart and Circulatory Physiology. 280 (2), H674-H683 (2001).
- McCutcheon, K., et al. Dynamic changes in the molecular signature of adverse left ventricular remodeling in patients with compensated and decompensated chronic primary mitral regurgitation. Circulation Heart Failure. 12 (9), (2019).
- McCutcheon, K., Manga, P. Left ventricular remodeling in chronic primary mitral regurgitation. Cardiovascular Journal of Africa. 29 (1), 51-64 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados