Method Article
Preparação de fatias hipocampais humanas agudas para gravações eletrofisiológicas
Neste Artigo
Erratum Notice
Resumo
O protocolo apresentado descreve o transporte e a preparação de tecido hipocampal humano ressecado com o objetivo final de usar fatias cerebrais vitais como uma ferramenta de avaliação pré-clínico para potenciais substâncias antiepilépticas.
Resumo
A epilepsia afeta cerca de 1% da população mundial e leva a uma grave diminuição da qualidade de vida devido a convulsões em curso, bem como alto risco de morte súbita. Apesar da abundância de opções de tratamento disponíveis, cerca de 30% dos pacientes são resistentes a medicamentos. Várias novas terapêuticas foram desenvolvidas usando modelos animais, embora a taxa de pacientes resistentes a medicamentos permaneça sem vida. Uma das razões prováveis é a falta de tradução entre modelos de roedores e humanos, como uma fraca representação da farmacoesistância humana em modelos animais. Tecido cerebral humano ressectado como uma ferramenta de avaliação pré-clínica tem a vantagem de preencher essa lacuna translacional. Descrito aqui é um método para preparação de alta qualidade de fatias cerebrais hipocampais humanas e subsequente indução estável da atividade epilépforme. O protocolo descreve a indução da atividade de estouro durante a aplicação de 8 mM KCl e 4-aminopyridin. Esta atividade é sensível a lacosamida AED estabelecida ou novos candidatos antiepilépticos, como dimetiletanolamina (DMEA). Além disso, o método descreve a indução de eventos semelhantes a convulsões em CA1 de fatias cerebrais hipocampais humanas por redução de Mg2+ extracelular e aplicação de bicucullina, um bloqueador receptor GABAA. A configuração experimental pode ser usada para testar potenciais substâncias antiepilépticas para seus efeitos na atividade epiléptica. Além disso, mecanismos de ação postulados para compostos específicos podem ser validados usando essa abordagem no tecido humano (por exemplo, usando gravações de grampo de remendo). Para concluir, a investigação do tecido cerebral humano vital ex vivo (aqui, hipocampo ressecado de pacientes que sofrem de epilepsia do lobo temporal) melhorará o conhecimento atual de mecanismos fisiológicos e patológicos no cérebro humano.
Introdução
A epilepsia é uma das doenças neurológicas mais comuns, afetando 1% da população mundial, e está associada ao aumento da morbidade e mortalidade1,2. Infelizmente, um terço dos pacientes que sofrem de epilepsia são resistentes a medicamentos, apesar de uma abundância de opções de tratamento disponíveis, incluindo mais de 20 medicamentos antiepilépticos aprovados (AEDs)3. A não tradução dos resultados da pesquisa em animais pré-clínicos para os ensaios clínicos é uma das razões pelas quais estratégias promissoras de tratamento não são eficazes em muitos pacientes4. Recentemente, neuropeptídeos Y (NPY) e galanin mostraram ter efeitos antiepilépticos em modelos animais; porém, quando testado em tecido cerebral humano ressecado, apenas o NPY foi eficaz5.
A maioria dos conhecimentos existentes sobre mecanismos neurológicos básicos e abordagens terapêuticas de doenças provém de modelos animais e experimentos de cultura celular. Embora informativos, esses modelos representam apenas aspectos únicos de doenças humanas complexas e da rede cerebral humana adulta. Alternativamente, o tecido cerebral humano tem o potencial de preencher a lacuna translacional, mas raramente está disponível para estudos funcionais. Por exemplo, o tecido cerebral pós-morte tem sido uma ferramenta valiosa na investigação da expressão proteica, morfologia cerebral ou conexões anatômicas, embora a atividade neuronal seja frequentemente comprometida é este tecido6,,7,,8,,9,,10,11.
Em contraste, o tecido cerebral humano ressecado vivo tem sido investigado em relação à avaliação de medicamentos pré-clínicos, funções neuronais básicas e padrões de expressão genética12,,13,,14,,15,,16,17. Uma grande vantagem das fatias cerebrais humanas em comparação com as fatias de roedores é a longa viabilidade do tecido neuronal após a ressecção e preparação. Em comparação com as fatias cerebrais de roedores, que normalmente podem ser registradas por até 8h após a preparação, as fatias cerebrais humanas mostram atividade neuronal estável por até 72 h, permitindo uma investigação minuciosa dessas amostras raras e valiosas12,,18.
Vários estudos têm investigado propriedades da atividade epiléptica em várias áreas de tecido humano cortical e hipocampal ressecado e utilizaram diferentes métodos para indução da atividade epiléptica. Em fatias de roedores, a atividade epilépcida pode ser induzida por vários métodos: estimulação elétrica de células DG hilar, aumento de K + extracelular+ (8-12 mM KCl), bloqueio de receptores GABAA por bicucullina (BIC), bloqueio de canais de potássio por 4-aminopirridina (4-AP), e remoção ou redução de Mg2+ em solução extracelular19. No entanto, a indução da atividade epiepcitiforme no tecido humano requer a combinação de pelo menos dois dos métodos acima mencionados20,21,22.
Apresentado aqui é um método para a preparação de fatias cerebrais hipocampais humanas, que são viáveis por até 20 h e mostram indução de atividade epilépcida mediante aplicação de alto K+ (8 mM) e 4-AP ou baixo Mg2+ e BIC.
Protocolo
Os pacientes devem dar consentimento por escrito informado antes da operação, e os acordos éticos necessários devem estar em vigor antes do experimento. Quanto aos resultados representativos, todos os estudos envolvendo participantes humanos foram revisados e aprovados pela Charité-Universitätsmedizin, Berlim (EA2/111/14).
1. Preparação de soluções 10x
NOTA: Devido às dificuldades no planejamento do acesso ao tecido cerebral humano, recomenda-se preparar soluções 10x conforme descrito aqui. Alternativamente, as soluções 1x finais podem ser preparadas de forma fresca adicionando substâncias individuais na concentração final à água duplamente destilada (ddH2O).
- Para soluções individuais de 10x, adicione substâncias ao ddH2O de acordo com a Tabela 1 e mexa até dissolver.
- Use soluções 10x até 1 mês após a preparação (até 1 ano para aCSF de colina congelada de 10x).
- Para 10x de colina aCSF, prepare 50 mL aliquots de 10x 1.1 colina aCSF(Tabela 1) e congele a -20 °C ou -80 °C até usar mais.
NOTA: Não adicione glicose e CaCl2 a 10x 1.1 colina aCSF para evitar contaminação com bactérias e precipitação de carbonato de cálcio. - A solução 10x 2 pode ser usada para todas as soluções finais 1x, enquanto as soluções 10x 1.1-1.4 são personalizadas e nomeadas em conformidade(Tabela 1).
2. Preparação de soluções finais 1x
NOTA: As soluções finais 1x devem ser preparadas frescas ou o mais cedo possível no dia anterior ao uso. Todas as soluções finais devem ser carbogenadas com 5% de CO2 e 95% O2 utilizando um dispersor de gás de vidro para enriquecer soluções com oxigênio, e ajustar o pH para 7,4 (máx = 7,4 ± 0,2).
- Colina aCSF para transporte e preparação
- Para a solução final de 500 mL, descongele uma alíquota de 50 mL da solução 10x 1.1 aliquot para aCSF de colina em banho-maria de 37 °C.
- Adicione a alíquota descongelada de 50 mL da solução 10x 1.1 e 50 mL de solução 10x 2 a aproximadamente 300 mL de ddH2O.
- Adicione as concentrações finais de glicose e CaCl2, depois mexa até dissolver(Tabela 1, solução 1.1).
- Adicione ddH2O a um volume final de 500 mL e meça osmolaridade (300 mOsm ± 10 mOsm).
- Opcionalmente, use um filtro para esterilizar a solução (consulte discussão sobre viabilidade prolongada de fatias em condições estéreis).
- Encha uma garrafa separada com aproximadamente 100 mL de 1x de colina aCSF para transporte da sala de operação para o laboratório.
- Opcional: dependendo do tempo de transporte da sala de operação para o laboratório, considere usar tampas de garrafa apertadas a gás para garantir pH estável de aCSF durante períodos de transporte mais longos.
- Armazene a solução final a 4-8°C até que seja mais útil.
- No dia da operação, esfrie 1x de colina aCSF no gelo e carbogenato por pelo menos 10-15 min usando um dispersor de gás de vidro conectado ao gás carbógeno (5% CO2, 95% O2).
NOTA: Considere manter um botijão de gás acessível à sala de operação em caso de tempos de espera mais longos, o que exigirá a re-carbogenação da solução de transporte. No entanto, transportamos tecido hipocampal sem re-carbogenação em tempos longos e curtos de transporte (15 min vs. 60 min) e não observamos diferenças na indução da atividade epidepiliforme.
- aCSF para armazenamento e gravação
- Para uma solução final de 2 L, adicione 200 mL de solução 10x 1.2 (aCSF) e 200 mL de solução 2 e glicose(Tabela 1) a ~1500 mL de ddH2O.
NOTA: Os volumes das soluções finais dependem de experimentos aplicados e do tipo de câmara usada para armazenamento e gravação. - Adicione ddH2O a um volume final de 2 L e meça osmolaridade (300 mOsm ±10 mOsm).
- Pré-aquecimento da solução para 35 °C e carbogenate por pelo menos 10-15 minutos antes de usar.
- Para uma solução final de 2 L, adicione 200 mL de solução 10x 1.2 (aCSF) e 200 mL de solução 2 e glicose(Tabela 1) a ~1500 mL de ddH2O.
- HighK++4-AP aCSF para indução de atividade de estouro
- Para uma solução final de 1 L, adicione 100 mL de solução 10x 1.3 (highK++4-AP aCSF) e 100 mL de solução de 10x 2 a ~700 mL de ddH2O.
- Adicionar glicose e 4-AP (concentração final = 100 μM) de acordo com a Tabela 1.
- Adicione ddH2O ao volume final de 1 L e meça osmolaridade (300 mOsm ±10 mOsm).
- Pré-aquecimento da solução para 35 °C e carbogenate por pelo menos 10-15 minutos antes de usar.
- LowMg2++BIC aCSF para indução de eventos semelhantes a convulsões (SLEs)
- Para uma solução final de 1 L, adicione 100 mL de solução 10x 1.4 (lowMg2++BIC aCSF) e 100 mL de solução de 10x 2 a ~700 mL de ddH2O.
- Adicionar glicose e BIC (concentração final = 10 μM) de acordo com a Tabela 1.
- Adicione ddH2O ao volume final de 1 L e meça osmolaridade (300 mOsm ± 10 mOsm).
- Pré-aquecimento da solução para 35 °C e carbogenate por pelo menos 10-15 minutos antes de usar.
3. Preparação da câmara de interface
- Em uma câmara de interface, as fatias repousam sobre três camadas de papel filtro para garantir quantidade suficiente de solução abaixo da fatia. Para isso, corte dois pedaços de papel filtro de ~4 cm x ~2 cm para cada compartimento de retenção de fatias (a câmara de interface descrita consiste em dois compartimentos) e coloque-os em cima um do outro.
- Coloque cordas finas de algodão ao redor dos papéis de filtro de 4 cm x 2 cm dentro dos compartimentos para quebrar a tensão da solução. Certifique-se de um fluxo uniforme (aqui, as meias de nylon pretas cortadas em cordas de corte fino ~10 cm de comprimento são usadas; para colocação, ver Figura 1).
- Coloque pequenos pedaços de papel filtro em cima dos papéis de filtro maiores dentro dos compartimentos de retenção de fatias. Pequenos pedaços de tecido de filtro devem ser aproximadamente do tamanho de uma fatia cerebral (~1,5 cm x ~1,0 cm) e permitirão um manuseio adicional de fatias individuais. Coloque de três a quatro pequenos pedaços de papel filtro em cada compartimento.
- Certifique-se de uma vazão aCSF de 1,8 mL/min com uma bomba peristáltica.
- Carbogenate e pré-aquecimento da câmara de interface para ~35 °C (a temperatura final da fatia deve ser ~32 °C).
4. Configuração da área de preparação
NOTA: A preparação pode ser realizada em condições estéreis para evitar contaminação e alongar a sobrevivência das fatias. No entanto, nem todas as vibratomes se encaixam sob um capô estéril, e outras medidas são necessárias para reduzir a contaminação durante a preparação. Esta seção descreve algumas dessas medidas.
- Limpe a área de preparação com 70% de EtOH e coloque papel alumínio ou tampas estéreis no topo da área.
- Prepare super cola, duas pinças afiadas, uma espátula, um bisturi com lâminas, e uma lâmina para corte áspero do tecido cerebral. As ferramentas podem ser esterilizadas antes do procedimento para reduzir a contaminação.
- Limpe a bandeja tampão e a placa do espécime do vibratome com 70% de EtOH. Uma vez que a bandeja de tampão esteja totalmente seca, cubra-a com papel alumínio e coloque a bandeja no banho de gelo. Encha o banho de gelo com gelo esmagado e mantenha a -20 °C até a preparação.
- Limpe o vibratome e a lâmina com 70% de EtOH e calibrar o vibratome para minimizar vibrações verticais e danos teciduais durante o procedimento de corte.
5. Corte e armazenamento de tecidos
- Logo após a ressecção, coloque o tecido imediatamente em aCSF frio e carbogenado e transporte rapidamente para o laboratório.
ATENÇÃO: Use luvas e uma máscara facial o tempo todo durante a preparação, já que o tecido cerebral humano pode conter patógenos potenciais. Além disso, usar uma máscara facial quando não está trabalhando sob um capô estéril reduzirá muito a contaminação de soluções e tecido cerebral. - Remova o tecido da aCSF da colina e corte todas as porções queimadas do tecido.
- Corte uma superfície uniforme para colar a peça de tecido na placa do espécime, considerando o ângulo de corte e as camadas teciduais. Idealmente, uma fatia hipocampal contém DG, CA1-4 e (se possível) subiculum.
- Corte o tecido cerebral em fatias de 400 μm de espessura e ajuste a amplitude e velocidade durante o corte. Devido a possível remanescente pia mater, o tecido cerebral humano mostra mais resistência e pode exigir cortes mais lentos.
NOTA: A espessura da fatia afeta muito a rede disponível (mais neurônios em fatias mais grossas) ou a viabilidade da fatia (penetração da solução na fatia). Utilizamos fatias de 500 μm para aumentar a micro-rede potencialmente disponível, e não pudemos observar diferenças na indução da atividade epilépforme. As fatias de 300 μm são comumente usadas para experimentos com grampos de remendo, embora a indução da atividade epilépforme nestas fatias ainda não tenha sido testada aqui. Usamos 400 μm como uma espessura de fatia padrão, embora fatias de 300-500 μm possam ser suficientes. - Antes de coletar, use um bisturi para reduzir os tamanhos de fatias cerebrais para caber na câmara de gravação. Para o uso da câmara de membrana (ver seção 6), as fatias devem ser máximas de 1,5 cm x 1 cm. Ao reduzir, considere as camadas e conexões específicas necessárias para serem intactas para gravação (por exemplo, para gravação no CA1 e DG, corte o subículo e o tecido branco circundante).
- Usando uma espátula e pequenas fórceps, coloque cuidadosamente fatias na câmara de interface em pequenos papéis de filtro e deixe descansar por ~1 h em aCSF até gravar.
- As fatias podem ser registradas por até 20 h (ainda mais tempo quando em condições estéreis).
6. Registro de atividade epilépforme
- Na câmara de membrana (câmara de gravação do tipo submerso), coloque a fatia cerebral em uma membrana semipermeável transparente, que é colada a um anel plástico24. Para isso, use super cola para prender o anel plástico à membrana de uma inserção de cultura celular.
- Use um bisturi para remover qualquer membrana na parte externa do anel plástico. Certifique-se de que a membrana está uniforme e totalmente ligada ao anel antes de colocar a membrana na câmara.
NOTA: A membrana pode ser armazenada em ddH2O a 4-8 °C e reutilizada por até 1 mês. Mantenha a membrana molhada o tempo todo. - Tanto a entrada quanto o fluxo da câmara de membrana estão conectados a tubos para fornecimento de soluções. Coloque os tubos em uma bomba peristáltica para que a entrada e a saída se movam em direções opostas.
- Coloque o tubo de entrada e saída em aCSF carbogenado e pré-equipado até que todos os tubos e a câmara estejam cheios de solução. Ajuste a velocidade da bomba peristáltica para atingir uma taxa de fluxo uniforme de 10-13 mL/min.
NOTA: A câmara de membrana usada aqui é uma câmara de gravação de tipo submerso de alta vazão permitindo um fluxo de solução de até 14 mL/min24. No caso de usar uma câmara de gravação tipo submerso diferente, as taxas de fluxo precisam ser ajustadas. No entanto, para a indução da atividade epilépforme, é altamente recomendável o uso da câmara de membrana. - Use um elemento de aquecimento conectado ao fluxo próximo à câmara de membrana para garantir uma temperatura estável de 32 °C.
- Prepare pipetas de vidro de 1 a 2 MΩ usando um puxador vertical. Encha as pipetas com solução naCl de 154 mM e coloque-as em um suporte de eletrodos.
- Usando pinças e uma espátula, remova uma fatia hipocampal da câmara de interface, pegando a fatia com o pequeno papel filtro e colocando ambos em uma placa de Petri cheia de aCSF carbogenado. Remova o pequeno papel filtro da fatia hipocampal e (se necessário) aplique alguma força usando uma pipeta para separar a fatia do papel do filtro. Tenha cuidado para não virar a fatia.
- Coloque a fatia na câmara de gravação e segure-a no lugar usando malha de fatia.
NOTA: Devido ao princípio de Bernoulli, na câmara de membrana tipo submersa usada, as fatias são geralmente estáveis sem o uso de uma malha de fatia adicional. - Coloque eletrodos na região e camada de interesse (aqui, CA1) e comece a gravar.
- Registre a atividade potencial de campo no modo de fixação atual com uma taxa de amostragem de 10-20 kHz e baixa passagem filtrada a 2 kHz.
- Registo basal recorde em aCSF por até 5 min.
- Troque os tubos de entrada de aCSF para highK++4AP ou lowMg2++BIC aCSF e o tubo de saída para um recipiente de resíduos para evitar a mistura de soluções. Após 2 min, coloque o tubo de saída na mesma solução que o fluxo de entrada para conservar a solução.
- A atividade de estouro induzida por highK++4-AP deve ser visível 2-5 min após a lavagem. No entanto, a indução de SLEs por baixoMg2++BIC pode levar até 30 min. Se necessário, altere cuidadosamente as posições dos eletrodos para obter resultados ideais.
- Uma vez na posição final, recorde atividade de linha de base por pelo menos 20 minutos. Se você gravar SLEs, considere gravações mais longas da linha de base devido à baixa frequência de SLEs.
- No caso de a atividade de base ser estável (planto de frequência de eventos), lave na droga desejada. Note que devido à alta vazão da lavagem de medicamentos leva apenas 2-5 minutos, permitindo uma troca rápida de soluções.
- Atividade recorde durante a aplicação de drogas de pelo menos 20 min, após lavagem. A atividade deve ser estável por pelo menos 60-90 min, permitindo gravações mais longas.
7. Análise
- A análise da frequência e amplitude pode ser realizada com qualquer software disponível. Até agora, não conseguimos estabelecer uma análise automática confiável de SLEs ou atividade de estouro, e em vez disso usamos uma análise semi-automatizada com confirmação visual da atividade identificada.
- A atividade de estouro é caracterizada por deflexão bifásica, positiva e negativa e uma duração de ≥100 ms. Todos os eventos identificados visualmente como atividade de estouro (por exemplo, semi-automaticamente por análise de limiar) devem ser indicados manualmente para análise posterior da frequência de eventos (intervalo interestálico, IEI), amplitude e número total de eventos durante o período analisado.
NOTA: Devido à alta frequência de atividade de estouro, os últimos 5 minutos de cada fase de aplicação são tipicamente analisados20. - As SLEs podem ser analisadas conforme descrito em Heuzeroth et al. As SLEs identificadas podem ser analisadas para duração, amplitude, frequência de pico e duração da duração da fase tônica (spiking de alta frequência) versus clonic (spiking de baixa frequência). As SLEs que têm duração <10 s devem ser excluídas da análise.
NOTA: Para avaliação pré-clínica de possíveis substâncias antiepilépticas, estão sendo investigados efeitos sobre a atividade de ruptura (induzida por highK++4AP), devido à indução estabelecida no tecido hipocampal ressecado. Resultados preliminares sobre a indução de SLEs utilizando lowMg2++BIC foram relatados (Figura 2),embora a análise desses dados não esteja incluída aqui.
Resultados
A atividade epilépforme foi registrada com sucesso no tecido hipocampal humano ressecado originário de até 15 pacientes. Estabelecer procedimentos estáveis de transporte e preparação é fundamental para a indução bem sucedida da atividade epiepiforme no tecido cerebral humano. Resultados publicados recentemente mostraram 1) indução estável da atividade epiléptica em tecido ressecado de diferentes pacientes, bem como 2) o uso de tecido cerebral humano ressecado como ferramenta pré-clínico para avaliação de novos mecanismos antiepilépticos14,,20.
Aplicação de atividade epilépforma induzida highK++4-AP em forma de atividade de estouro em poucos minutos(Figura 2A, B,C,D). Devido à baixa distribuição neuronal no tecido hipocampal humano ou à alta perda de células neuronais devido à epilepsia do lobo temporal (TLE), a colocação de eletrodos pode ser ajustada no início do registro. Nos casos em que a atividade de estouro de fatias não é visível na área ca1 após 10 min (independente da colocação de eletrodos), a viabilidade da fatia pode ser comprometida, e a fatia precisará ser substituída.
Os SLEs, com duração de >10 s, podem ser induzidos com aplicação de lowMg2++BIC (Figura 2E,F). A Figura 2E mostra indução estável de SLEs após alguns minutos e frequência estável durante toda a gravação. Aqui, a atividade de SLE foi induzida com sucesso em duas das quatro fatias do paciente investigado. Uma fatia mostrou apenas atividade de estouro após 15 minutos de atividade de SLE, enquanto a outra fatia não mostrou SLEs mesmo após 40 min.
Para avaliação pré-clínica dos efeitos da substância, foi investigado um potencial efeito antiepiléptico na atividade de explosão induzida por highK++4-AP. Foram testadas substâncias antiepilépticas conhecidas e potenciais (lacosamida, DMEA, dynorfina14),e exemplos são mostrados aqui para a lacosamida AED convencional (bloqueador de canal de sódio), bem como dmea (uma nova substância antiepiléptica potencial)20. O número de eventos e o intervalo inter-evento (IEI) de eventos de explosão diminuíram tanto durante a aplicação de lacosamida quanto DMEA (Figura 3C),embora as amplitudes não tenham sido afetadas(Figura 3D). Em um subconjunto de fatias, embora a indução de eventos de estouro tenha sido alcançada nos primeiros minutos, a frequência de atividade não se recuperou durante a lavagem de AEDs aplicados (dados não mostrados aqui, ver Kraus et al.20). Aqui, as drogas aplicadas foram consideradas para induzir efeitos; no entanto, a diminuição da atividade de estouro pode ter sido afetada pela decadência gradual da atividade durante gravações longas. Assim, os resultados devem ser interpretados cuidadosamente.
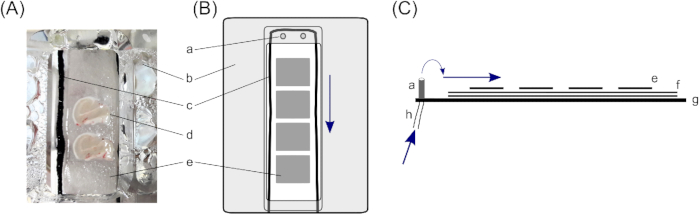
Figura 1: Câmara de interface. Para armazenar fatias cerebrais hipocampais humanas, é utilizada uma câmara de interface com dois compartimentos de retenção de fatias cerebrais(A); especificamente, uma câmara de interface tipo Haas23. Aqui, as fatias cerebrais hipocampais repousam sobre(d)três camadas de papel filtro, (e) pedaços menores para permitir o manuseio de fatias cerebrais individuais, e (f)pedaços de papel filtro maiores para garantir uma camada suficiente de solução abaixo da fatia. (c) Uma corda de algodão ao redor das fatias cerebrais, em cima dos papéis do filtro, garante mesmo o fluxo de solução das entradas na(a ) parte superior do compartimento. (b) Uma tampa direciona o oxigênio de baixo do compartimento para a fatia. (B) Vista superior de um compartimento de retenção de fatias. (C) Visão lateral para ilustrar as camadas dos papéis do filtro. (g)Parte inferior da câmara. (h) Tubo para entrada de solução, que está conectado a uma bomba peristáltica (setas azuis marcam a direção do fluxo da solução). Clique aqui para ver uma versão maior desta figura.
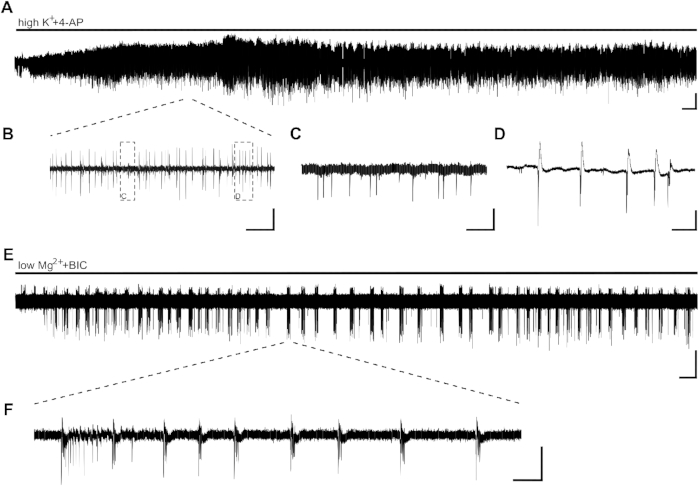
Figura 2: Atividade epilépforme em fatias de hipocampal humanos induzidas por highK++4-AP e lowMg2++BIC. Gravações de exemplo CA1 e trechos de aplicação de highK+ (8 mM)+4-AP (100 μM) (A, B,C,D) e lowMg2++BIC (10 μM) (E,F). (A) A aplicação do banho de highK++4-AP induz a atividade epilépforme em poucos minutos, e a atividade é estável por pelo menos 60 minutos. Detalhes de (A) podem ser vistos em (B). Dois tipos diferentes de atividade são induzidos na área ca1 de fatias hipocampais humanas: picos intericital (C, detalhes de [B]) e atividade de estouro (D, detalhes de [B]). A atividade de estouro mostrou-se sensível a drogas antiepilépticas e, portanto, analisada para efeito de potenciais substâncias antiepilépticas(Figura 3). (E,F) A aplicação do lowMg2++BIC induz SLEs a uma duração de >10 s(F)em CA1 em poucos minutos. No entanto, a indução de SLEs pode levar até 30 min em outras fatias. Barras de escala = 0,2 mV, 2 min (A,E), 5 s (B), 500 ms (C,D), 5 min (E) e 2 s (F). Este número foi adaptado de Kraus et al.20. Clique aqui para ver uma versão maior desta figura.
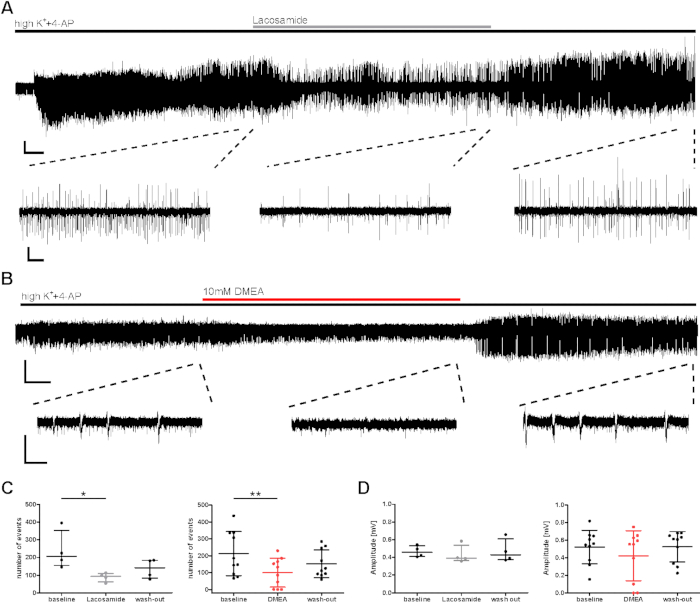
Figura 3: Diminuição da atividade de explosão epiléptica de fatias humanas durante a aplicação de lacosamida ou DMEA. A atividade de explosão diminuiu durante a aplicação de (A) lacosamida e (B) DMEA, uma molécula potencial nova e epiléptica. (A) e (B) mostram gravações exemplares da área ca1 com trechos de regiões utilizadas para análise em (C) e (D). A atividade de estouro diminuiu durante a aplicação de lacosamida (100 μM) e DMEA (10 mM), como visto por trechos médios e aumenta novamente durante a lavagem. (C,D) O número e a amplitude da atividade de estouro foram analisados nos últimos 5 minutos de cada fase de aplicação (linha de base, lacosamida/DMEA, lavagem) e mostrados como resultados resumidos para todos os pacientes (número de eventos, C; amplitude, D) como média ± SD. Cada ponto indica um paciente. Os asteriscos marcam diferenças significativas avaliadas pelo teste de Friedman e pós-hoc com a comparação múltipla de grupos de Dunnett para análise de aplicação de lacosamida (*p < 0,05, n = 4) ou por medição repetida ANOVA e pós-hoc com comparação de Tukey para análise da aplicação DMEA (**p < 0,01, n = 10). Barras de escala = 0,2 mV, 2 min (gravação completa, A), 5 s (trechos, A), 3 min (gravação completa, B) e 1 s (trechos, B). Este número foi adaptado de Kraus et al.20. Clique aqui para ver uma versão maior desta figura.
| Solução 1.1 colina aCSF | |||
| Substância | Concentração de 10x (mM) | Concentração 1x (mM) | Nota |
| colina Cl | 1100 | 110 | |
| (+)-Na L-ascorbate | 116 | 11.6 | |
| MgCl2x6H2O | 70 | 7 | |
| Na piruvato | 31 | 3.1 | |
| Kcl | 25 | 2.5 | |
| NaH2PO4 | 12.5 | 1.25 | |
| NaHCO3 | 260 | 26 | |
| CaCl2 | - | 0.5 | adicionar à solução final |
| Glicose | - | 10 | adicionar à solução final |
| Solução 1.2 aCSF | |||
| Substância | Concentração de 10x (mM) | Concentração 1x (mM) | Nota |
| Nacl | 1290 | 129 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| MgSO4 | 18 | 1.8 | |
| Glicose | - | 10 | adicionar à solução final |
| Solução 1.3 highK++4-AP aCSF | |||
| Substância | Concentração de 10x (mM) | Concentração 1x (mM) | Nota |
| Nacl | 1240 | 124 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 80 | 8 | |
| MgSO4 | 18 | 1.8 | |
| Glicose | - | 10 | adicionar à solução final |
| 4-AP | - | 0.1 | adicionar à solução final |
| Solução 1.4 lowMg2++BIC aCSF | |||
| Substância | Concentração de 10x (mM) | Concentração 1x (mM) | Nota |
| Nacl | 1300 | 130 | |
| NaH2PO4 | 12.5 | 1.25 | |
| CaCl2 | 16 | 1.6 | |
| Kcl | 30 | 3 | |
| Glicose | - | 10 | adicionar à solução final |
| Bic | - | 0.01 | adicionar à solução final |
| Solução 2 | |||
| Substância | Concentração de 10x (mM) | Concentração 1x (mM) | Nota |
| NaHCO3 | 210 | 21 | |
Tabela 1: Preparação de soluções 10x e 1x finais para transporte, preparação e gravação.
Discussão
O tecido cerebral humano ressecado vivo é uma ferramenta altamente valiosa na avaliação pré-clínica dos AEDs, pois representa adequadamente uma micro-rede cerebral humana intacta. O protocolo apresentado descreve um método de transporte e preparação de tecidos, que garante fatias hipocampais de alta qualidade, bem como um método de indução estável para atividade epilépforme crítico para avaliação de AED.
A investigação da atividade epilépforme, bem como métodos de indução química ou elétrica em fatias cerebrais humanas foram previamente demonstradas por outros grupos17,,20,21,22. Este protocolo descreve a indução de atividade de estouro estável em fatias de diferentes pacientes através da aplicação de K++4-AP elevado, bem como indução de SLEs na área de CA1 através da aplicação de baixo Mg2++BIC. Verificou-se que a indução da atividade de estouro é mais consistente (80% das fatias testadas em 15 pacientes) do que a indução de SLEs (50% das fatias testadas em um paciente). No entanto, até agora, a indução de SLEs só foi testada em um paciente. No entanto, recomenda-se a indução de SLEs por Mg2++BIC baixo, pois as SLEs ainda não foram capazes de ser induzidas usando K++4-AP elevados.
Vários estudos introduziram métodos de transporte e preparação do tecido cerebral humano e muitas vezes destacam três fatores críticos à sobrevivência neuronal: tempo de transporte, soluções de transporte usadas e condições de armazenamento.
Para a viabilidade da fatia ideal, alguns grupos sugerem que o transporte de tecido cerebral ressecado seja o mais curto possível. No entanto, salas de operação e laboratórios raramente estão próximos, o que significa que a qualidade da fatia pode ser comprometida devido ao longo transporte. Alguns grupos superaram esse obstáculo aplicando O2 constante à solução durante o transporte12. Transportamos tecido cerebral para períodos curtos (máximos = 15 min) e longos (até 1h) sem fornecimento adicional constante de O2 durante o transporte, semelhante a outros grupos18,25. Nesses casos, não foram observadas diferenças na qualidade do tecido durante as gravações epiléptias. Em comunicação com outros grupos do nosso instituto, a qualidade da fatia também não mudou para experimentos com grampos de correção. Em contraste, a variância na qualidade do tecido possivelmente decorre de danos durante as operações, ressecção prolongada e procedimento de corte.
No que diz respeito à solução de transporte e corte, todos os métodos publicados omitem a NaCl de soluções para reduzir o inchaço celular devido à pressão osmótica, semelhante ao procedimento padrão para experimentos com grampos de roedores. No entanto, vários substitutos foram introduzidos até agora (ou seja, a CSF13,22, aCSF12,,26e aCSF27baseada em colina). Ting e colegas introduziram o ACSF baseado em NMDG para preparação de fatias em 201426 e mais tarde adicionaram um protocolo de recuperação, que lentamente reintroduz o NaCl às fatias28. No entanto, como descrito por Ting et al., os neurônios do tecido cerebral preparados no ACSF baseado em NMDG mostram maior resistência à membrana, afetando assim a vedação de células inteiras durante os experimentos de grampo de remendo26. Portanto, passamos da ACSF baseada em NMDG para o uso de aCSF20à base de colina, que produz fatias de alta qualidade tanto para o potencial de campo quanto para gravações de grampo de correção.
Quanto ao armazenamento de fatias, geralmente é aceito que as condições de interface fornecem oxigenação ideal crítica para a sobrevivência de fatias longas18. No entanto, outros grupos mostram a sobrevivência de fatias por até 72 h sob condições submersas12. Ao contrário da hipótese anterior, as fatias cerebrais humanas parecem ser mais resistentes à baixa oxigenação ou estresse oxidativo em comparação com as fatias de roedores. Principalmente, as câmaras de interface têm sido usadas anteriormente para armazenar fatias de hipocampal humanos, embora condições submersas sejam recomendadas para a manutenção de fatias cerebrais humanas em experimentos de grampo de remendo.
Como discutido por outros grupos, um passo crítico adicional para a sobrevivência de fatias longas (interface para <48 h18, submerso para <72 h12) é a prevenção da contaminação bacteriana. As fatias cerebrais de roedores são tipicamente usadas em gravações eletrofisiológicas por até 8 h, e a contaminação bacteriana não é considerada para afetar a viabilidade da fatia durante este período. O alto número de fatias preparadas a partir de uma ressecção e a incomum disponibilidade de tecido cerebral humano destaca a necessidade de prolongar a viabilidade das fatias cerebrais humanas. Este método descreve com sucesso a preparação de fatias cerebrais hipocampais humanas vivas, que podem ser facilmente adaptadas a condições estéreis. No entanto, para as gravações realizadas aqui, a sobrevida de fatias que se estende 20h não era prioridade.
A gravação em câmaras de interface também tem se mostrado essencial para a indução de atividades epilépformas como as SLEs22. Condições submersas, devido à baixa oxigenação, raramente são utilizadas para registro de SLEs; no entanto, eles são necessários para alta resolução óptica necessária para experimentos de patch-clamp. O uso de uma câmara de gravação de tipo submerso otimizada permite o registro de atividade epilépfica (campo extracelular ou neurônio único) em fatias cerebrais humanas, devido à alta oxigenação e rápida aplicação de drogas29. Aqui, métodos e resultados para gravações potenciais de campo são descritos, mas deve-se enfatizar que gravações de grampo de remendo foram realizadas com sucesso em fatias cerebrais de camundongos e humanos usando esta câmara de gravação modificada (dados não mostrados).
Tecido cerebral humano ressectado tem um valor translacional mais elevado em comparação com modelos de roedores. Representa uma rede neuronal adulta e doente que não pode ser reproduzida por iPSCs. No entanto, como em qualquer sistema in vitro, as fatias cerebrais humanas não representam um cérebro humano intacto. Além disso, as redes neuronais registradas do tecido cerebral ressecado podem sofrer alterações moleculares e funcionais substanciais devido a danos durante a operação ou preparação. Os procedimentos de corte têm sido demonstrados para afetar a função GABAergic e podem afetar a indução da atividade epilépcida30. Essas limitações devem ser consideradas ao formular uma hipótese. Ao testar possíveis drogas antiepilépticas, o uso de diferentes áreas cerebrais deve ser considerado, uma vez que alvos de drogas podem não ser expressos em todas as regiões cerebrais humanas ou em todos os pacientes. Em particular, o hipocampo dos pacientes da TLE frequentemente mostra sinais de esclerose hipocampal acompanhada de perda severa de células neuronais. Recomenda-se obter informações do paciente sobre alterações patológicas e histórico da doença, como potencial refratário em relação aos medicamentos, e considerá-lo durante a interpretação dos dados.
Em conclusão, este método descreve com sucesso a preparação de fatias cerebrais hipocampais humanas vivas e técnicas de indução para o registro de dois tipos diferentes de atividade epilépforme. Uma vez que a disponibilidade de tecido cerebral humano vivo é rara, as condições de transporte e registro otimizadas devem ser usadas para garantir a máxima saída de experimentos usando fatias cerebrais humanas. Sugere-se que o tecido cerebral humano ressecado pode ser usado como uma ferramenta de validação pré-clínica, além de modelos de roedores e experimentos de cultura celular.
Divulgações
Os autores não declaram conflito de interesses.
Agradecimentos
Agradecemos a Mandy Marbler-Pötter (Charite-Unversitätsmedizin, Berlim) pela excelente assistência técnica. A P.F. foi financiada pela German Research Foundation (DFG, Deutsche Forschungsgemeinschaft) sob a Estratégia de Excelência da Alemanha-EXC-2049-390688087. Este trabalho foi apoiado pelo CENTRO QUEST de Pesquisa Biomédica Transformadora do Instituto de Saúde de Berlim.
Materiais
| Name | Company | Catalog Number | Comments |
| (+)-Na L-ascorbate | Sigma Aldrich | A4034 | |
| 4-AP | Sigma Aldrich | 275875-5G | |
| Blades | eliteSERVE GmbH | HW3 | used for the vibratome |
| CaCl2 | Merck | 102382 | |
| Choline Cl | Sigma Aldrich | C1879 | |
| Filter paper | Tiffen | EK1546027T | |
| Gas-tight bottle caps | Carl Roth GmbH+Co.KG | E694.1 | |
| Glass filaments | Science Products | GB150F-8P | for recording electrodes |
| Glass gas disperser | DWK Life Sciences GmbH | 258573309 | |
| Glucose | Sigma Aldrich | G7528 | |
| Interface Chamber | inhouse made | - | see Haas et al., 1979 |
| KCl | AppliChem | 131494.1210 | |
| Membrane (Cell culture inserts) | Merck | PICM030050 | |
| Membrane chamber | inhouse made | - | see Hill and Greenfield, 2011 |
| MgCl2?6H2O | Carl Roth | HNO3.2 | |
| MgSO4 | Sigma Aldrich | M7506 | |
| Na pyruvate | Sigma Aldrich | P8574 | |
| NaCl | Carl Roth | 3957.1 | |
| NaH2PO4 | Merck | 106346 | |
| NaHCO3 | Carl Roth | HNO1.2 | |
| Peristaltic pump | Gilson | Minipuls 3 | |
| Slice holder | Warner instruments | SHD-41/15 | |
| Vertical puller | Narishige | PC-10 | |
| Vibratome | Leica | VT1200S |
Referências
- Hirtz, D., et al. How common are the "common" neurologic disorders. Neurology. 68 (5), 326-337 (2007).
- Ngugi, A. K., Bottomley, C., Kleinschmidt, I., Sander, J. W., Newton, C. R. Estimation of the burden of active and life-time epilepsy: a meta-analytic approach. Epilepsia. 51 (5), 883-890 (2010).
- Kwan, P., Brodie, M. J. Early Identification of Refractory Epilepsy. New England Journal of Medicine. 342 (5), 314-319 (2000).
- Löscher, W. Critical review of current animal models of seizures and epilepsy used in the discovery and development of new antiepileptic drugs. Seizure. 20 (5), 359-368 (2011).
- Ledri, M., et al. Differential Effect of Neuropeptides on Excitatory Synaptic Transmission in Human Epileptic Hippocampus. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 35 (26), 9622-9631 (2015).
- Qi, X. R., et al. Alterations in the steroid biosynthetic pathways in the human prefrontal cortex in mood disorders: A post-mortem study. Brain Pathology. 28 (4), 536-547 (2018).
- Verwer, R. W. H., et al. Post-mortem brain tissue cultures from elderly control subjects and patients with a neurodegenerative disease. Experimental Gerontology. 38 (1-2), 167-172 (2003).
- Verwer, R. W. H., et al. Cells in human postmortem brain tissue slices remain alive for several weeks in culture. FASEB journal official publication of the Federation of American Societies for Experimental Biology. 16 (1), 54-60 (2002).
- Le Maître, T. W., Dhanabalan, G., Bogdanovic, N., Alkass, K., Druid, H. Effects of Alcohol Abuse on Proliferating Cells, Stem/Progenitor Cells, and Immature Neurons in the Adult Human Hippocampus. Neuropsychopharmacology. 43 (4), 690-699 (2018).
- Dennis, C. V., Suh, L. S., Rodriguez, M. L., Kril, J. J., Sutherland, G. T. Human adult neurogenesis across the ages: An immunohistochemical study. Neuropathology and Applied Neurobiology. 42 (7), 621-638 (2016).
- Verwer, R. W. H., et al. Mature astrocytes in the adult human neocortex express the early neuronal marker doublecortin. Brain. 130 (12), 3321-3335 (2007).
- Ting, J. T., et al. A robust ex vivo experimental platform for molecular-genetic dissection of adult human neocortical cell types and circuits. Scientific Reports. 8 (1), 8407 (2018).
- Le Duigou, C., et al. Imaging pathological activities of human brain tissue in organotypic culture. Journal of Neuroscience Methods. 298, 33-44 (2018).
- Agostinho, A. S., et al. Dynorphin-based "release on demand" gene therapy for drug-resistant temporal lobe epilepsy. EMBO molecular medicine. 11 (10), 9963 (2019).
- Hodge, R. D., et al. Conserved cell types with divergent features in human versus mouse cortex. Nature. 573 (7772), 61-68 (2019).
- Beaulieu-Laroche, L., et al. Enhanced Dendritic Compartmentalization in Human Cortical Neurons. Cell. 175 (3), 643-651 (2018).
- Sandow, N., et al. Drug resistance in cortical and hippocampal slices from resected tissue of epilepsy patients: no significant impact of p-glycoprotein and multidrug resistance-associated proteins. Frontiers in Neurology. 6, 30 (2015).
- Wickham, J., et al. Prolonged life of human acute hippocampal slices from temporal lobe epilepsy surgery. Scientific Reports. 8 (1), (2018).
- Avoli, M., Jefferys, J. G. R. Models of drug-induced epileptiform synchronization in vitro. Journal of Neuroscience Methods. , (2015).
- Kraus, L., et al. Dimethylethanolamine Decreases Epileptiform Activity in Acute Human Hippocampal Slices in vitro. Frontiers in Molecular Neuroscience. 12, 209 (2019).
- Antonio, L. L., et al. In vitro seizure like events and changes in ionic concentration. Journal of Neuroscience Methods. , (2016).
- Gabriel, S., et al. Stimulus and Potassium-Induced Epileptiform Activity in the Human Dentate Gyrus from Patients with and without Hippocampal Sclerosis. Journal of Neuroscience. 24 (46), 10416-10430 (2004).
- Haas, H. L., Schaerer, B., Vosmansky, M. A simple perfusion chamber for the study of nervous tissue slices in vitro. Journal of Neuroscience Methods. 1 (4), 323-325 (1979).
- Hill, M. R. H., Greenfield, S. A. The membrane chamber: a new type of in vitro recording chamber. Journal of neuroscience methods. 195 (1), 15-23 (2011).
- Andersson, M., et al. Optogenetic control of human neurons in organotypic brain cultures. Scientific Reports. 6, 24818 (2016).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods in molecular biology. 1183, 221-242 (2014).
- Testa-Silva, G., et al. Human synapses show a wide temporal window for spike-timing-dependent plasticity. Frontiers in Synaptic Neuroscience. 2, 12 (2010).
- Ting, J. T., et al. Preparation of Acute Brain Slices Using an Optimized N-Methyl-D-glucamine Protective Recovery Method. Journal of Visualized Experiments. (132), (2018).
- Morris, G., Jiruska, P., Jefferys, J. G. R., Powell, A. D. A New Approach of Modified Submerged Patch Clamp Recording Reveals Interneuronal Dynamics during Epileptiform Oscillations. Frontiers in Neuroscience. 10, 519 (2016).
- Valeeva, G., Valiullina, F., Khazipov, R. Excitatory actions of GABA in the intact neonatal rodent hippocampus in vitro. Frontiers in Cellular Neuroscience. , (2013).
Erratum
Formal Correction: Erratum: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings
Posted by JoVE Editors on 7/13/2020. Citeable Link.
An erratum was issued for: Preparation of Acute Human Hippocampal Slices for Electrophysiological Recordings. Step 2.1.3 in the Protocol was corrected.
Step 2.1.3 in the Protocol was updated from:
Add final concentrations of glucose and MgCl, then stir until dissolved (Table 1, solution 1.1).
to:
Add final concentrations of glucose and CaCl2, then stir until dissolved (Table 1, solution 1.1).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados