É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cultura de Pericytes Capilares Cerebrais para Medições citosóicas de cálcio e estudos de imagem de cálcio
Neste Artigo
Resumo
Pericytes capilares cerebrais são atores essenciais na regulação das propriedades da barreira hemencefálica e do fluxo sanguíneo. Este protocolo descreve como pericytos capilares cerebrais podem ser isolados, cultivados, caracterizados em relação ao tipo celular e aplicados para investigações de sinalização intracelular de cálcio com sondas fluorescentes.
Resumo
Os pericítos estão associados com células endoteliais e pés de extremidade astrócito em uma estrutura conhecida como unidade neurovascular (NVU). A função de pericyte capilar cerebral não é totalmente conhecida. Os pericítos têm sido sugeridos para estarem envolvidos no desenvolvimento capilar, regulação do aperto da barreira endotelial e da atividade de trancostose, regulação do tom capilar e para desempenhar papéis cruciais em certas patologias cerebrais.
Os pericítos são desafiadores para investigar no cérebro intacto devido às dificuldades em visualizar processos no parenchyma cerebral, bem como a proximidade com as outras células da NVU. O presente protocolo descreve um método de isolamento e cultura de pericytes capilares cerebrais bovinos primários e seu uso seguinte em estudos de imagem de cálcio, onde os efeitos de agonistas envolvidos na sinalização cerebral e patologias podem ser investigados. Fragmentos capilares corticais são permitidos a anexar-se ao fundo dos frascos de cultura e, após 6 dias, células endoteliais e pericítos cresceram a partir dos fragmentos capilares. As células endoteliais são removidas por trippsinização suave e os pericítos são cultivados por 5 dias adicionais antes da passagem.
Pericítos isolados são semeados em placas de cultura de 96 poços e carregados com o corante indicador de cálcio (Fura-2 acetoximethyl (AM)) para permitir medidas de níveis intracelulares de cálcio em uma configuração de leitor de placas. Alternativamente, os pericílitos são semeados em tampas e montados em câmaras de células. Após o carregamento com o indicador de cálcio (Cal-520 AM), a imagem viva de cálcio pode ser realizada usando microscopia confocal em um comprimento de onda de excitação de 488 nm e comprimento de onda de emissão de 510-520 nm.
O método descrito aqui tem sido usado para obter as primeiras medidas intracelulares de cálcio a partir de pericytes capilares cerebrais primários, demonstrando que os pericítos são estimulados via ATP e são capazes de contrair in vitro.
Introdução
Pericytes capilares cerebrais, juntamente com células endoteliais e astrócitos, constituem a NVU1,2,3. As células endoteliais, que formam a base estrutural dos capilares, formam tubos cilíndricos longos com diâmetro de 5-8 μm. As células endoteliais são esporadicamente cobertas com pericitos e cercadas por saliências de astrócitos; o astrócito endfee.
A barreira hemencefálica (BBB), situada nos capilares cerebrais, é o principal local de troca de nutrientes, gases e resíduos entre o cérebro e o sangue. O BBB também protege o cérebro de neurotoxinas endógenas e exógenas e serve como uma barreira para a entrega de um grande número de compostos medicamentosos. A função barreira é uma área de foco, bem como um obstáculo, para as empresas farmacêuticas que desenvolvem medicamentos do Sistema Nervoso Central (SNC). Isso estimulou um grande interesse em investigar as células da NVU na cultura4. Astrócitos cerebrais e células endoteliais foram cultivados e caracterizados em uma série de estudos, enquanto os estudos e protocolos para a cultura pericíte são escassos.
Protocolos publicados anteriormente descreveram a geração de culturas de pericíte capilares cerebrais até certo ponto, usando uma gama de diferentes abordagens, como imunopanning5,mídia de alta e baixa glicose6,classificação celular ativada por fluorescentes7,centrifugação gradiente de densidade8,etc. Embora esses métodos pareçam suficientes para obter culturas de pericítos, alguns são demorados, custam caro e os pericítos obtidos podem não ser ideais devido ao número de passagens culturais que podem deseleg diferenciar os pericítes9. Além disso, o potencial de pericítos cultivados em estudos de sinalização in vitro tem sido bastante inexplorado até agora.
O presente trabalho se concentra na geração de culturas pericíte de capilares cerebrais bovinos isolados e na configuração subsequente para medições e estudos de imagem de alterações no cálcio intracelular, um importante mensageiro intracelular. Descrevemos brevemente o isolamento dos capilares da matéria cinzenta cortical (para detalhes ver Helms et al.10) e o isolamento e cultura de pericílitos em monocultura pura sem contaminação com células endoteliais ou gliais. Em seguida, fornecemos um protocolo para semeadura de pericítos em placas de 96 poços e protocolos de carregamento para a sonda de cálcio Fura-2 AM. Finalmente, mostramos como os pericítos podem ser usados em imagens confocal em tempo real em câmaras de cultura de microscópio e descrevemos os protocolos para isso.
Protocolo
1. Preparação de buffers e soluções para cultivo de células
- Prepare a solução de estoque de colágeno dissolvendo 5 mg de colágeno IV da placenta humana em 50 mL de PBS durante a noite a 4 °C. Aliquot a solução de estoque em porções de 5 mL e armazene a -20 °C.
- Prepare a solução de estoque de fibronectina dissolvendo 5 mg de fibronectina em 5 mL de água estéril durante a noite. Armazene os estoques de fibronectina em alíquotas de 500 μL a -20 °C. Ao descongelar, adicione PBS a um volume final de 50 mL para preparar a solução de trabalho e armazená-la a 4 °C.
- Prepare o meio completo de águia modificada (DMEM) de Dulbecco adicionando 50 mL de soro bovino fetal (FBS), 5 mL de aminoácidos não essenciais MEM e 5 mL de penicilina/estreptomicina (0,1 g/L sulfato de estreptomicina e 100.000 U/L penicilina G sódio) a 500 mL de DMEM.
- Prepare a solução de estoque de heparina de 5 mg/mL dissolvendo o sal de sódio heparina na PBS e passe-o através de um filtro de 0,2 μm para esterilização. Armazene a solução de estoque a 4 °C.
- Preparar o meio de crescimento (GM) imediatamente antes do uso; misturar 10 mL de DMEM-comp e 250 μL de solução de estoque de heparina por frasco T75.
2. Isolamento de capilares do cérebro bovino fresco
NOTA: Os capilares cerebrais bovinos são isolados e cultivados como descrito anteriormente (Helms et al.10).
- Recolher cérebros de bezerros, não com mais de 12 meses de idade, de um matadouro e levar diretamente para o laboratório no gelo.
- Remova as meninges e colete toda a matéria cinzenta do cérebro usando um bisturi. Identifique as meninges como o filme que cobre o cérebro e a matéria cinzenta pela cor cinza.
- Use um moedor de tecido Dounce de 40 mL para homogeneizar a matéria cinzenta no DMEM (Modified Eagle Medium, meio de águia modificada) de Dulbecco. Encha a parte fina do moedor de tecido 1/5 com suspensão de matéria cinza e adicione DMEM até que a parte fina esteja cheia.
- Separe os capilares de células livres e pedaços de tecido menores por filtragem do homogeneizar através de um filtro de rede de nylon de 160 μm. Lave os filtros com DMEM-comp. Recupere os capilares e acumule as suspensões em tubos de centrifugação de 50 mL.
- Resuspenque os capilares em DMEM-comp e adicione uma mistura enzimápica de DNase I (170 U/mL), colagenase tipo III (200 U/mL) e trypsin (90 U/mL). Deixe a suspensão por 1h em um banho de água de 37 °C para digestão dos capilares.
- Execute a suspensão através de um filtro de malha de 200 μm e resuspend em FBS com sulfóxido de dimetil de 10% (DMSO). Congele os capilares durante a noite a -80 °C e mova-os para nitrogênio líquido no dia seguinte para armazenamento a longo prazo.
NOTA: O protocolo pode ser pausado aqui.
3. Semeadura e cultivo de capilares bovinos
- Dia 0: Misture 0,7 mL de colágeno IV com 6,3 mL de PBS. Adicione a solução a um frasco T75 e deixe o frasco por 2h à temperatura ambiente (RT) ou deixe-o durante a noite a 4 °C.
- Remova a solução de colágeno do frasco e lave três vezes com PBS.
- Adicione 7 mL de solução de trabalho de fibronectina e deixe o frasco por 30 min no RT. Em seguida, remova a solução de fibronectina e semee os capilares imediatamente depois.
- Durante o tempo de espera de 30 minutos, descongele um frasco de capilares em um banho de água de 37 °C.
- Quando os capilares forem descongelados, transfira imediatamente para um tubo de centrifugação com 30 mL de DMEM-comp e centrífuga por 5 min a 500 x g e RT. Remova o DMEM-comp do tubo e suspenda a pelota capilar em 10 mL de DMEM-comp fresco.
- Transfira a suspensão de 10 mL para o frasco T75 revestido e deixe os capilares aderirem à parte inferior do frasco por 4-6 h em uma incubadora de 37 °C a 10% de CO2.
NOTA: A taxa de crescimento celular é maior em 10% de CO2 em vez do CO2convencional de 5%. - Após 4-6 h de incubação inspecione o frasco sob um microscópio leve. Frações de capilares devem agora ser anexadas ao fundo do frasco(Figura 1, dia 0).
- Prepare a GM e aspire o meio DMEN-comp muito cuidadoso dos capilares e substitua-o por 10 mL de GM recém-fabricado.
- Dia 2: Remova a GM dos capilares e substitua por 10 mL de GM recém-fabricado. O crescimento celular dos capilares deve ser visível sob um microscópio de luz neste momento(Figura 1, dia 2-3).
4. Isolamento de pericítos primários de capilares cerebrais bovinos
-
Dia 4: Inspecione os capilares sob um microscópio leve.
NOTA: O frasco deve agora ser aproximadamente 60-70% confluente para fornecer uma quantidade adequada de pericítos(Figura 1, dia 4). Se este não for o caso; substitua a GM por 10 mL de meio fresco e deixe o frasco na incubadora por mais um dia. - Aspire o meio e lave as células suavemente em PBS.
- Adicione 2 mL de Trypsin-EDTA descongelado para células endoteliais e deixe o frasco na incubadora por 1-3 min. Tire o frasco com frequência e observe com o microscópio durante este período de tempo.
NOTA: As células endoteliais devem arredondar e se soltar do frasco; os pericítos devem ser visíveis como células com uma morfologia "fantasma" e ainda estar ligados à superfície do frasco. Este é um passo complicado e importante. É essencial remover a maioria das células endoteliais para evitar a contaminação da monocultura pericíte, mas a trippsinização prolongada também pode desapegar os periciosos. O tempo de trippsinização pode variar ligeiramente de tempos em tempos, e, portanto, é de extrema importância observar o frasco com frequência com o microscópio durante o tratamento. - Bata suavemente no frasco, quando as células endoteliais começarem a arredondar, para separar as células endoteliais soltas.
- Para parar a trippsinização, adicione 10 mL de DMEM-comp ao frasco. Lave o frasco cuidadosamente algumas vezes com o meio para remover as células endoteliais. Aspire a suspensão da célula endotelial do frasco. As células endoteliais agora podem ser usadas para outros fins.
- Adicione 10 mL de DMEM-comp ao frasco. Olhe sob o microscópio de luz para garantir que os pericítos ainda estejam presentes e presos à parte inferior. Coloque o frasco de volta na incubadora para permitir que a cultura enriquecida com pericítos cresça.
NOTA: É importante observar a cultura durante os dias seguintes. Se ainda houver uma boa quantidade de células endoteliais crescendo outro tratamento de trippsina pode ser realizado. - Permita que a monocultura pericíte cresça com a mudança do DMEM-comp. meio a cada segundo dia. Verifique o crescimento das células sob o microscópio de luz(Figura 1, dia 5-8).
5. Geração e armazenamento de uma monocultura de pericítos bovinos primários
-
Dia 8-9: Inspecione os capilares sob um microscópio leve
NOTA: Os pericílitos devem agora ter atingido 70-80% de confluência e crescer em ilhas no frasco(Figura 1, dia 9). Se a confluência dos pericítos for inferior a 70%, permita que as células cresçam por mais um dia. Os pericítos não formarão uma monocamada completa como as células endoteliais formariam. - Aspire DMEM-comp e lave os pericítos com 7 mL de PBS.
- Adicione 2 mL de trippsin-EDTA ao frasco e deixe-o na incubadora por 2-3 min. Coloque o frasco frequentemente sob o microscópio de luz para observar quando os pericítes se reunirem e se desprenderem do frasco. Quando os pericítos começaram a arredondar, o frasco pode ser gentilmente tocado para desprender as células.
- Bata suavemente no frasco, quando os pericítes começarem a arredondar, para desprender as células.
- Adicione 10 mL de DMEM-comp ao frasco para parar o processo de trypsinização. Lave o frasco algumas vezes com o meio para ajudar a desprender os últimos pericílitos.
- Transfira a suspensão celular de 12 mL para um tubo de centrifugação de 50 mL e encha até 30 mL com DMEM-comp.
- Centrifugar a suspensão da célula por 5 min a 500 x g e RT. Aspire o DMEM-comp. cuidadosamente sem tocar na pelota celular. Resuspense a pelota de célula em 3 mL de FBS com 10% de DMSO.
- Transferir a suspensão da célula para criovials; adicionar 1 mL a cada um, de modo que haverá um total de 3 frascos por frasco T75 de pericytes. Congele os pericítos a -80 °C durante a noite e mova-os para nitrogênio líquido no dia seguinte para armazenamento a longo prazo.
NOTA: As células podem ser contadas antes de congelar para uma estimativa posterior da porcentagem de sobrevivência. O protocolo pode ser pausado aqui.
6. Configuração de uma monocultura pericíte para experimentos
- Cubra um frasco T75 com colágeno IV e fibronectina usando o mesmo procedimento mencionado na seção 3.1-3.4.
- Enquanto o frasco está sendo revestido com fibronectina, descongele um frasco de pericítos em um banho de água de 37 °C.
- Transfira os pericítos agora descongelados do criovial para um tubo de centrifugação com 30 mL de DMEM-comp. Centrifugar a suspensão celular por 5 min a 500 x g, RT.
- Aspire cuidadosamente o meio, deixando a pelota de célula na parte inferior do tubo. Suspenda a pelota em 10 mL DMEM-comp.
- Colete e transfira a suspensão do celular para o frasco revestido. Deixe o frasco com pericitos para crescer em uma incubadora de 37 °C a 10% de CO2.
- A cada dois dias, refresque o meio com 10 mL de DMEM-comp fresco.
NOTA: Após 5 dias de crescimento, os pericítos devem ter atingido aproximadamente 80% de confluência. Se a confluência for menor, deixe as células crescerem por mais um dia ou dois. As células devem estar prontas para semeadura para mais experimentos.
7. Semeadura de pericytes em uma placa revestida de 96 poços
- Colágeno diluído IV como descrito na etapa 3.1. Adicione 100 μL a cada poço em uma placa de 96 poços e incubar por 2 h no RT ou durante a noite a 4 °C.
- Aspire a solução e lave os poços três vezes com PBS.
- Adicione 100 μL de fibronectina diluída a cada poço e incubar em RT por 30 min. Remova a solução de fibronectina e use a placa imediatamente.
NOTA: Dependendo do quão bem o lote de pericyte está crescendo, deve haver células suficientes para semear duas placas. - Retire os pericítos da incubadora e aspire o meio. Lave as células com PBS.
- Adicione 2 mL de trippsina-EDTA aos pericítos e siga o mesmo procedimento da etapa 5.3-5.6.
- Aspire o meio, sem danificar a pelota celular e suspenda a pelota em 1 mL de DMEM-comp fresco.
- Tire 12 μL de suspensão celular e adicione a uma câmara de contagem. Sob o microscópio de luz, conte pelo menos 3 das grades 3x3 e use a contagem média de células por grade.
- Use a equação abaixo para calcular o volume de suspensão celular que deve ser adicionado a cada poço a sementes de 10.000 células por poço, na placa de 96 poços.
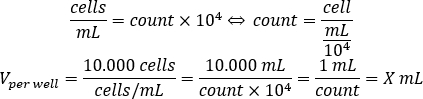
- Adicione DMEM-comp e o volume calculado de suspensão celular em cada poço para atingir um volume final de 200 μL.
- Coloque a placa de 96 poços em uma incubadora de 37 °C a 10% de CO2. Deixe as células crescerem por 4 dias com uma mudança de meio após 2 dias.
8. Preparação de buffers e soluções para ca2+-imagem
- Autoclave cobre câmaras celulares de deslizamento e tampas.
- Tampão de ensaio: Adicione 1,19 g de HEPES a 500 mL de tampão HBSS para uma concentração final de 10 mM HEPES. Ajuste o pH para 7,4.
- Prepare 20% (c/v) Pluronic F127 + 1% (v/v) solução de óleo de mamtração polietiloxilada dissolvendo 0,5 g de solução Pluronic F127 em 2,5 mL de DMSO anidro em um frasco de vidro. Aqueça a 40 °C por aproximadamente 30 minutos ou até dissolver e vórtice. Adicione 25 μL de óleo de mostração polietoxilatado e armazene na RT. Não congele.
- Prepare 2 mM Fura-2 AM estoque dissolvendo 1 mg em 500 μL de DMSO anidro. Armazene em alíquotas de 20 μL a -20 °C protegidas contra luz.
- Prepare 5 solução de carregamento Fura-2 AM misturando 20 μL de 20% Pluronic F-127 + 1% solução de óleo de pulça polietoxilada com a alíquota de 20 μL de 2 mM Fura-2 AM. Adicione 500 μL de tampão de ensaio e vórtice. Adicione o tampão de ensaio a um volume final de 8 mL. A solução deve ser preparada imediatamente antes do uso e protegida da luz.
- Prepare 4 mM Cal-520 AM dissolvendo 1 mg em 226,7 μL de DMSO anidro. Armazene em alíquotas de 20 μL a -20 °C protegidas contra luz.
- Prepare 20 μM Solução de carregamento Cal-520 AM misturando 20 μL de 20% Pluronic F-127 + 1% solução de óleo de pulxor polietoxilada com a alíquota de 20 μL 4 mM Cal-520. Adicione 500 μL de tampão de ensaio e vórtice. Adicione o tampão de ensaio a um volume final de 4 mL. A solução deve ser preparada imediatamente antes do uso e protegida da luz.
9. Carregamento de pericítos com corante indicador de cálcio Fura-2 AM em uma configuração de leitor de placas
NOTA: Todas as soluções devem estar no RT antes do início do experimento.
- Retire a placa de 96 poços com células da incubadora e aspire o meio dos poços. Lave as células duas vezes com tampão de ensaio.
- Adicione 100 μL de solução de carregamento a cada poço e enrole a placa com papel alumínio, para evitar branqueamento fotográfico. Incubar por 45 min com 30 rpm tremendo no RT.
NOTA: Não carregue Fura-2 AM a 37 °C, pois pode carregar compartimentos internos. Lembre-se de deixar poços com células no tampão de ensaio em vez de carregar tampão; estes são os "espaços em branco" usados para medir fluorescência de fundo. - Aspire o tampão de carga e lave as células com tampão de ensaio duas vezes. Adicione 100 μL de tampão de ensaio fresco e deixe as células incubadas por 30 minutos no RT; isso permite o decote contínuo do am-éster e, assim, aprisionando Fura-2 AM dentro das células.
- Antes da imagem ca2+,lave e substitua o buffer por 100 μL de tampão de ensaio fresco.
10. Leitura de fluorescência de placas de pé de pericytes em uma configuração de leitor de placas
- Ajuste a temperatura do leitor de placas para 37 °C e transfira a placa de 96 poços com células para a posição da placa de amostra. Coloque a placa de reagente com agonista na posição da placa de reagente.
- Comece medindo o carregamento das células para garantir o carregamento igual de Fura-2 AM em todos os poços.
- Realize as medições com comprimento de onda de fluorescência de excitação a 340 nm/380 nm e o comprimento de onda de emissão a 510 nm. Adicione 50 μL de agonista a velocidade de 150 μL/s da placa de reagente a cada poço com células na posição da placa de amostra.
- Salve os dados e exporte como arquivos xlsx para análise suplementar. A Figura 2 mostra a resposta citosolic Ca2+medida como a razão entre os dois comprimentos de onda de excitação ao longo do tempo, onde a fluorescência de fundo é subtraída.
NOTA: O leitor de placas precisa ser um leitor de microplaca dupla com espaço para uma "bandeja de celular" e uma "bandeja de amostra" e um sistema de pipettor integrado.
11. Semeadura de pericítos em uma câmara de células revestidas para imagem ao vivo
NOTA: Os deslizamentos também podem ser colocados na parte inferior dos poços de cultura, revestidos e semeados com pericítos descritos acima, e então montados na câmara antes dos experimentos.
- Monte uma mancha na câmara da cela e torne-a apertada para evitar vazamentos.
- Colágeno diluído IV como descrito na etapa 3.1. Adicione 500 μL a cada câmara celular e incubar por 2 h em RT ou durante a noite a 4 °C.
- Aspire a solução de colágeno e lave as câmaras três vezes com 500 μL de PBS.
- Adicione 500 μL de fibronectina diluída a cada poço e incubar em RT por 30 min. Remova a solução de fibronectina e use a câmara celular logo em seguida.
- Enquanto isso, tire o frasco com pericitos confluentes e lave com 7 mL de PBS.
- Adicione 2 mL de trippsina-EDTA aos pericítos e siga o mesmo procedimento da etapa 5.3-5.6.
- Prossiga seguindo os mesmos passos da etapa 8.6-8.7.
- Use a equação abaixo para calcular o volume de suspensão celular, que deve ser adicionado a cada câmara a sementes de 90.000 células por câmara.
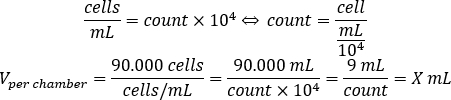
- Adicione DMEM-comp e o volume calculado de suspensão celular em cada câmara para atingir um volume final de 500 μL.
- Coloque as câmaras celulares na incubadora a 37 °C, 10% DE CO2. Deixe as células crescerem por 6 dias (ou até confluentes).
NOTA: Os pericitos crescem mais lentamente em lâminas de vidro em comparação com o plástico; mais dias de crescimento são necessários.
12. Carregamento de pericitos com corante indicador de cálcio Cal-520 AM para imagem ao vivo
NOTA: Todas as soluções devem estar no RT antes do início do experimento.
- Prepare o tampão de carga de 20 μM Cal-520 AM: Misture 20 μL de 20% Pluronic F-127 + 1% de solução de óleo de pulxônico com a alíquota de 20 μL 4 mM Cal-520. Adicione 500 de tampão de ensaio μL e vórtice. Adicione o tampão de ensaio a um volume final de 4 mL. A solução deve ser preparada imediatamente antes do uso e protegida da luz.
NOTA: Proteja as soluções que contenham Cal-520 AM contra exposição à luz. - Retire as câmaras celulares da incubadora e aspire o meio. Lave as células duas vezes com tampão de ensaio.
- Adicione 500 μL de tampão de carga a cada câmara e incubar em RT por 45 min.
- Aspire o tampão de carga e lave as células duas vezes com tampão de ensaio.
- Adicione 500 μL de tampão de ensaio fresco a cada câmara e incubar por 30 minutos no RT para permitir o decote do am-éster.
- Substitua o buffer por 500 μL de tampão de ensaio fresco antes de realizar a imagem ao vivo em um microscópio confocal.
13. Imagem ao vivo dos níveis intracelulares ca2+
NOTA: Uma variedade de tipos de microscópio pode ser usado para a imagem. Podem ser utilizados microscópios de fluorescência convencional eretos ou invertidos, bem como microscópios de varredura a laser confocal eretos ou invertidos com fonte de excitação apropriada (488 nm) e filtros de emissão (510-520 nm). Os objetivos devem ser adequados para fluorescência e ser de alta qualidade e com alta abertura numérica (NA).
- Monte a câmara celular no palco do microscópio confocal o mais suave possível, a fim de evitar a perturbação das células.
- Selecione um comprimento de onda de excitação de 488 nm, emissão a 515 nm, aquisição de imagem sequencial com intervalos de 5 segundos, um tamanho de imagem XY de 512 x 512 pixels e meça por 2 min para medir sinais de cálcio na linha de base.
- Adicione 3 μL de 100 mM ATP à câmara celular com uma pipeta e continue a aquisição de imagem sequencial. Realize a adição devagar e suavemente para não perturbar a preparação e mover as células fora de foco.
- Observe o grau de alterações e aumente o intervalo de tempo ao longo do tempo conforme necessário por aproximadamente 18 minutos até que não seja observada mais alterações morfológicas(Figura 3).
- Salve imagens com lapso de tempo e exporte-as como arquivos TIFF e/ou AVI para análise suplementar.
NOTA: Um frasco de pericítos deve dar células suficientes para semeadura em placas de 1-2 96-well e várias tampas, o que significa que você pode preparar células para ambos os tipos de medidas de cálcio.
Resultados
Capilares cerebrais bovinos foram isolados do tecido cerebral fresco e a Figura 1 apresenta a semeadura capilar e o crescimento celular ao longo dos dias e posterior purificação de pericítos. Os capilares estão totalmente ligados ao frasco no primeiro dia e no dia 2 o broto endotelial tornou-se visível(Figura 1, dia 2). Após 4 dias, o crescimento celular é altamente distinto(Figura 1, dia 4a) ...
Discussão
Neste estudo, apresentamos um método para isolar pericítos primários de cérebros bovinos. O protocolo descrito permite a cultura desse tipo de célula bastante inacessível. A cultura celular posteriormente obtida foi uma população quase homogênea de pericítos, com pouca ou nenhuma contaminação com células endoteliais e células gliais baseadas na morfologia celular e expressão proteica12. Além disso, demonstramos um método simples e simples para carregar os pericítos com corantes d...
Divulgações
Os autores declaram não haver interesses financeiros concorrentes.
Agradecimentos
Os autores desejam reconhecer o financiamento da iniciativa de Pesquisa da Fundação Lundbeck sobre Barreiras Cerebrais e Entrega de Drogas (RIBBDD) e da Fundação Da Família Simon Hougners.
Materiais
| Name | Company | Catalog Number | Comments |
| ATP | Tocris | 3245 | |
| Cal-520 AM | AAT Bioquest | 21130 | |
| Cell incubator | Thermo Fisher | ||
| Centrifuge | Thermo Fisher | Heraeus Multifuge 3SR+ | Standard large volume centrifuge for spinning down cells |
| Collagen IV | Sigma Aldrich | C5533 | |
| Confocal laser scanning microscope | Carl Zeiss | Zeiss LSM 510 | Inverted microscope |
| Counting chamber | FastRead | 102 | |
| Coverslip cell chamber | Airekacells | SC15022 | |
| Cremophor EL | Sigma Aldrich | C5135 | Formerly known as Kolliphor EL |
| DMSO | Sigma Aldrich | 471267 | |
| Dulbecco's Modified Eagles Medium | Sigma Aldrich | D0819 | |
| Fetal bovine serum (FBS) | PAA/GE Healthcare | A15-101 | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Fura-2 AM | Thermo Fisher | F1201 | |
| Glass coverslips 22x22 mm | VWR International | 631-0123 | |
| HBSS | Gibco | 14065-049 | |
| Heparin | Sigma Aldrich | H3149 | |
| HEPES | AppliChem Panreac | A1069 | |
| Light microscope | Olympus | Olympus CK2 | Upright light microscope with phase contrast |
| MEM nonessential amino acids | Sigma Aldrich | M7145 | |
| Microplate Reader | BMG LabTech | NOVOstar | |
| PBS | Sigma Aldrich | D8537 | Phosphate-buffered saline |
| penicillin G sodium/streptomycin sulfate | Sigma Aldrich | P0781 | |
| Pluronic F127 | Sigma Aldrich | P2443 | |
| Trypsin-EDTA | Sigma Aldrich | T4299 | |
| T-75 flask | Sigma Aldrich | CLS3972 | |
| 96-well plate | Corning incorporated | 3603 |
Referências
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: Developmental, Physiological, and Pathological Perspectives, Problems, and Promises. Developmental Cell. 21 (2), 193-215 (2011).
- Abbott, N. J., Ronnback, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Mathiisen, T. M., Lehre, K. P., Danbolt, N. C., Ottersen, O. P. The Perivascular Astroglial Sheath Provides a Complete Covering of the Brain Microvessels: An Electron Microscopic 3D Reconstruction. Glia. 58 (9), 1094-1103 (2010).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Zhou, L., Sohet, F., Daneman, R. Purification of Pericytes from Rodent Optic Nerve by Immunopanning. Cold Spring Harbor Protocols. , 608-617 (2014).
- Liu, G. H., et al. Isolation, Purification, and Cultivation of Primary Retinal Microvascular Pericytes: A Novel Model Using Rats. Microcirculation. 21 (6), 478-489 (2014).
- Nayak, R. C., Herman, I. M. Bovine retinal microvascular pericytes: isolation, propagation, and identification. Methods In Molecular Medicine. 46, 247-263 (2001).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology-Heart and Circulatory Physiology. 302 (1), H69-H84 (2012).
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Helms, H. C., Brodin, B., Milner, R. Methods in Molecular Biology. Cerebral Angiogenesis: Methods and Protocols. 1135, 365-382 (2014).
- Abbracchio, M. P., Burnstock, G., Verkhratsky, A., Zimmermann, H. Purinergic signalling in the nervous system: an overview. Trends in Neurosciences. 32 (1), 19-29 (2009).
- Cai, C., et al. Stimulation-induced rises in cerebral blood flow and local capillary vasoconstriction depend on conducted vascular responses in brain capillaries. PNAS. , (2018).
- Tigges, U., Welser-Alves, J. V., Boroujerdi, A., Milner, R. A novel and simple method for culturing pericytes from mouse brain. Microvascular Research. 84 (1), 74-80 (2012).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant Outgrowth, Propagation and Characterization of Human Pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Orlidge, A., Damore, P. A. Cell specific effects of glycosaminoglycans on the attachment and proliferation of vascular wall components. Microvascular Research. 31 (1), 41-53 (1986).
- Rhinehart, K., Zhang, Z., Pallone, T. L. Ca2+ signaling and membrane potential in descending vasa recta pericytes and endothelia. American Journal of Physiology-Renal Physiology. 283, F852-F860 (2002).
- Bintig, W., et al. Purine receptors and Ca2+ signalling in the human blood-brain barrier endothelial cell line hCMEC/D3. Purinergic Signalling. 8 (1), 71-80 (2012).
- Neuhaus, A. A., Couch, Y., Sutherland, B. A., Buchan, A. M. Novel method to study pericyte contractility and responses to ischaemia in vitro using electrical impedance. Journal of Cerebral Blood Flow and Metabolism. 37 (6), 2013-2024 (2017).
- Kamouchi, M., et al. Calcium influx pathways in rat CNS pericytes. Molecular Brain Research. 126 (2), 114-120 (2004).
- Das, A., et al. ATP Causes Retinal Pericytes to Contract In vitro. Experimental Eye Research. 46, 349-362 (1988).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados