É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cultura do tecido do córtex ovariano bovino
Neste Artigo
Resumo
Na cultura in vitro do córtex ovariano bovino e o efeito da dieta nutricional passo da escada no microambiente ovariano é apresentado. As peças do córtex ovariano foram cultivadas por sete dias e foram avaliados esteroides, citocinas e fases folículos. O tratamento da dieta Stair-Step teve aumento da esterogênese, resultando na progressão do folículo na cultura.
Resumo
O desenvolvimento folículo do estágio primordial para o antral é um processo dinâmico dentro do córtex ovariano, que inclui fatores endócrinos e paracrinos de células somáticas e comunicação cumulus cell-oocyte. Pouco se sabe sobre o microambiente ovariano e como as citocinas e esteroides produzidos no meio circundante afetam a progressão ou prisão do folículo. A cultura in vitro do córtex ovariano permite que os folículos se desenvolvam em um ambiente normalizado que permanece apoiado pelo estroma adjacente. Nosso objetivo era determinar o efeito da dieta nutricional stair-step no microambiente ovariano (desenvolvimento de folículos, esteroides e citocinas) através da cultura in vitro do córtex ovariano bovino. Para isso, foram removidas as peças cortical ovarianas das novilhas submetidas a dois esquemas nutricionalmente desenvolvidos nutricionalmente diferentes antes da puberdade: Controle (desenvolvimento nutricional tradicional) e Stair-Step (alimentação e restrição durante o desenvolvimento) que foram cortadas em aproximadamente 0,5-1 mm3 peças. Essas peças foram posteriormente passadas através de uma série de lavagens e posicionadas em uma inserção de cultura tecidual que é colocada em um poço que contém o meio de cultura de Waymouth. O córtex ovariano foi cultivado por 7 dias com mudanças diárias na mídia da cultura. A secção histológica foi realizada para determinar mudanças no estágio folículo antes e depois da cultura para determinar os efeitos da nutrição e do impacto da cultura sem tratamento adicional. O meio de cultura cortex foi agrupado ao longo de dias para medir esteroides, metabólitos de esteroides e citocinas. Havia tendências para o aumento de hormônios esteroides no microambiente ovariano que permitiam a progressão do folículo nas culturas do córtex ovariano Stair-Step versus Control. A técnica de cultura do córtex ovariano permite uma melhor compreensão do microambiente ovariano, e como alterações na secreção endócrina podem afetar a progressão e o crescimento do folículo tanto de tratamentos in vivo quanto in vitro. Este método de cultura também pode ser benéfico para testar potenciais terapêuticas que podem melhorar a progressão do folículo em mulheres para promover a fertilidade.
Introdução
O córtex ovariano representa a camada externa do ovário onde ocorre o desenvolvimento do folículo1. Folículos primordiais, inicialmente presos em desenvolvimento, serão ativados para se tornarem folículos primários, secundários e, em seguida, folículos antral ou terciários baseados nos insumos paracrino e gonadotropina1,2,3,4. Para entender melhor os processos fisiológicos dentro do ovário, a cultura tecidual pode ser usada como modelo in vitro, permitindo assim que um ambiente controlado realize experimentos. Muitos estudos têm utilizado a cultura do tecido ovariano para pesquisas em tecnologia reprodutiva assistida, preservação da fertilidade e câncer de ovário5,6,7. A cultura do tecido ovariano também serviu como modelo para investigar toxinas reprodutivas que prejudicam a saúde ovariana e a etiologia de distúrbios reprodutivos como a Síndrome do Ovário Policístico (SPC)8,9,10,11. Assim, este sistema de cultura é aplicável a uma ampla gama de especialidades.
Em roedores, gônados fetais ou perinatais inteiros têm sido usados em experimentos de biologia reprodutiva12,13,14,15. No entanto, gôngas de animais domésticos maiores não podem ser cultivadas como órgãos inteiros devido ao seu grande tamanho e potencial degeneração. Portanto, o córtex ovariano de primatas bovinos e não humanos é cortado em pedaços menores16,17,18. Muitos estudos têm cultivado pequenos córtex ovariano para estudar vários fatores de crescimento na iniciação do folículo primordial na pecuária doméstica e primatas não humanos1,17,18,19. O uso da cultura do córtex ovariano também demonstrou iniciação primordial do folículo na ausência de soro para peças cortical bovina e primata cultivadas durante 7 diase 20. Yang e Fortune em 2006 trataram o meio de cultura do córtex ovariano fetal com uma gama de doses de testosterona ao longo de 10 dias e observaram que a concentração de10-7 M de testosterona aumentou o recrutamento de folículos, a sobrevivência e o aumento da progressão dos folículos em estágio inicial19. Em 2007, usando culturas de córtex ovariano de fetos bovinos (5-8 meses de gestação), Yang e Fortune relataram um papel para o Fator de Crescimento Endotelial Vascular A (VEGFA) na transição folículo primário para secundário21. Além disso, nosso laboratório tem utilizado culturas de córtex ovariano para demonstrar como os isoformes VEGFA (angiogênicos, antiangiogênicos e uma combinação) podem regular diferentes vias de transdução de sinal através do receptor de domínio Kinase (KDR), que é o principal receptor de transdução de sinal que a VEGFA liga16. Essas informações permitiram uma melhor compreensão de como diferentes isoformas da VEGFA afetam caminhos de sinalização para provocar progressão ou prisão do folículo. Juntos, a colheita de peças de córtex ovariano in vitro com diferentes esteroides ou fatores de crescimento pode ser um ensaio valioso para determinar efeitos sobre mecanismos que regulam a foliculogênese. Da mesma forma, animais desenvolvidos em diferentes regimes nutricionais podem ter alterado os microambientes ovarianos, que podem promover ou inibir a foliculogênese que afeta a maturidade reprodutiva feminina. Assim, nosso objetivo no manuscrito atual é relatar a técnica de cultura do córtex bovino e determinar se há diferenças nos microambientes ovarianos após a cultura in vitro do córtex bovino das novilhas alimentadas por dietas Control ou Stair-Step coletadas aos 13 meses de idade, conforme descrito anteriormente16.
Portanto, nosso próximo passo foi determinar o microambiente ovariano nessas novilhas que foram desenvolvidas com diferentes dietas nutricionais. Avaliamos o córtex ovariano de novilhas alimentadas com uma dieta Stair-Step ou Control. Foram oferecidas novilhas de controles uma dieta de manutenção de 97,9 g/kg0,75 por 84 dias. A dieta Stair-Step foi iniciada aos 8 meses contendo uma dieta alimentada restrita de 67,4 g/kg0,75 por 84 dias. Após os primeiros 84 dias, enquanto as novilhas de controle continuaram a receber 97,9 g/kg0,75, as hevilhas de carne de stair-Step foram oferecidas 118,9 g/kg0,75 por mais 68 dias, após as quais foram ovariectomizadas aos 13 meses deidade 16 para estudar mudanças em estágios foliculares e morfologia antes e depois da cultura. Também avaliamos diferenças em esteroides, metabólitos de esteroides, quimiocinas e citocinas secretadas em mídia córtex. Esteroides e outros metabólitos foram medidos para determinar se houve efeitos diretos dos tratamentos realizados in vivo e/ou in vitro na viabilidade e produtividade do tecido. Mudanças no microambiente ovariano antes e depois da cultura forneceram um instantâneo do meio endócrino e da foliculogênese antes da cultura e como a cultura ou o tratamento durante a cultura afeta a progressão ou prisão do folículo.
Os ovários foram coletados após a realização de ovariectomias nos EUA. O Meat Animal Research Center (USMARC) de acordo com seus procedimentos de IACUC de hevilhas Control and Stair-Step aos13 mesesde idade 16 anos, limpo com soro fisiológico tampão de fosfato estéril (PBS) lava com antibiótico de 0,1% para remover sangue e outros contaminantes, tecido em excesso aparado e transportado para o laboratório de fisiologia de fisiologia da Universidade de Nebraska-Lincoln (UNL) unl em 37°C23 . Na UNL, os pedaços do córtex ovariano foram cortados em pequenos pedaços quadrados (~0,5-1 mm3; Figura 1) e cultivada por 7 dias(Figura 2). A histologia foi conduzida nos slides da cultura do córtex antes e depois da cultura para determinar os folículosfases 16,24 ( Figura3 e Figura 4), e proteínas de matriz extracelular que podem indicar fibrose (Picro-Sirus Red, PSR; Figura 5). Isso permitiu a determinação do efeito dos regimes nutricionais in vivo em estágios folículos e permitiu a comparação de 7 dias de córtex ovariano em estágios folículos e progressão do folículo. Ao longo da cultura, o meio foi coletado e alterado diariamente (aproximadamente 70% das mídias foram coletadas todos os dias; 250 μL/well) para que os hormônios diários/citocinas/quimioterapias possam ser avaliados ou agrupados ao longo dos dias para obter concentrações médias. Esteroides como androstenedione (A4) e estrogênio (E2) podem ser agrupados ao longo de 3 dias e avaliados através de radioimunessay (RIA; Figura 6) e agrupado ao longo de 4 dias por animal e testado via Espectrometria de Massa Líquida de Alto Desempenho (HPLC-MS)24,25 (Tabela 1). Foram utilizadas matrizes de citocinas para avaliar as concentrações de citocina e quimiocina no meio da cultura do córtex ovariano26 (Tabela 2). As placas de ensaio de ensaio de polimerase em tempo real (RT-PCR) foram conduzidas para determinar a expressão genética para vias específicas de transdução de sinal, como demonstrado anteriormente16. Todos os esteroides, citocinas, fase folículo e marcadores histológicos fornecem um instantâneo do microambiente ovariano e pistas sobre a capacidade desse microambiente de promover foligenese "normal" ou "anormal".
Protocolo
Os ovários foram obtidos do Centro de Pesquisa animal de carne dos EUA16. Como ditoanteriormente, 16, todos os procedimentos foram aprovados pelo Comitê de Cuidados e Uso de Animais de Carne dos EUA (USMARC), de acordo com o guia de Cuidado e Uso de Animais Agrícolas em Pesquisa e Ensino Agrícola. Os ovários foram levados para o Laboratório Reprodutivo da Universidade de Nebraska-Lincoln, onde foram processados e cultivados.
1. Preparação de mídia necessária
-
Waymouth MB 752/1 médio
- Encha uma garrafa de cultura de tecido 1 L com 900 mL de água estéril. Enquanto a água estiver mexendo suavemente em uma placa de mexida, adicione gradualmente o meio em pó. Uma vez que o meio em pó é dissolvido, adicione 2,24 g de bicarbonato de sódio seguido por 1,25 g de albumina de soro bovino (BSA). Use um medidor de pH e ajuste o pH para 7,25-7,35. Adicione água estéril adicional para levar o volume final a 1 L.
- Mova-se para um gabinete de segurança biológica e adicione sulfato de penicilina-estreptomicina a uma concentração de 0,1% v/v do meio. Filtre o meio com um poro de 0,22 μm 33,2 cm2 500 mL de garrafa.
- Despeje o meio filtrado em vários tubos cônicos de 50 mL. Adicione 0,5 mL de insulina-transferrin-selênio por 50 mL de meio aliquoted.
- Enrole os tubos cônicos e a garrafa de caldo do meio em papel alumínio e armazene a 4 °C. Este meio é sensível à luz.
NOTA: O waymouth médio pode ser armazenado por até 1 mês.
-
Meio L-15 de Leibovitz (LB-15)
NOTA: O meio LB-15 é usado para limpar tecidos na preparação para a cultura.- Encha uma garrafa de cultura de tecido 1 L com 900 mL de água estéril. Enquanto a água estéril está mexendo suavemente em uma placa de agitação, adicione gradualmente o meio em pó preparado. Use um medidor de pH e ajuste o pH para 7,25-7,35. Adicione água estéril adicional para levar o volume final a 1 L.
- Vá para o gabinete de segurança biológica. Faça 1 L de LB-15 com antibiótico de 0,1% (ver Tabela de Materiais). Filtre o meio em duas garrafas de cultura de tecido de 500 mL usando um filtro superior de garrafa de 0,22 μm poros de 33,2 cm2 500 mL. Enrole garrafas em papel alumínio como o meio LB-15 é sensível à luz e armazenar a 4 °C.
NOTA: O meio LB-15 pode ser armazenado por até 1 mês.
-
Salina Tamponada fosfato (PBS)
- Faça PBS no laboratório ou compre PBS estéril sem cálcio ou magnésio(Tabela de Materiais). Para fazer PBS no laboratório, comece com 800 mL de água destilada e adicione 8 g de cloreto de sódio (NaCl) a ele. Em seguida, adicione 0,2 g de cloreto de potássio (KCl), 1,44 g de dibásico fosfato de sódio (Na2HPO4), e 0,24 g de fosfato de potássio dibasic (KH2PO4). Ajuste o pH para ~7.4 e ajuste o volume total para 1 L. Esterilize a solução autoclaving.
- Faça 1 L PBS com antibiótico de 0,1% (ver Tabela de Materiais) enquanto em um armário de segurança biológica.
2. Protocolo de cultura cortical ovariana
NOTA: Os ovários foram obtidos a partir de heíferas usmarc nascidas na primavera aos 13 meses de idade. Os ovários foram completamente enxaguados, e todo o sangue e outros fluidos foram removidos com PBS contendo antibiótico (0,1%) e transportados a 37° C23 para o Laboratório de Reprodução da Universidade de Nebraska-Lincoln UNL (1,5 h de distância). (Para comentários sobre a temperatura dos ovários durante o transporte, consulte Discussion)
- Prepare o tecido ovariano em um banco limpo(Figura 1).
- Desinfete o banco limpo com 70% de etanol. Coloque uma almofada absorvente fresca no banco. Certifique-se de que o soprador de banco limpo esteja ligado meia hora antes da dissecção, juntamente com a luz UV para esterilizar qualquer coisa no banco limpo, incluindo almofada absorvente e certificar-se de que o EPI apropriado seja usado.
- Disponha as placas de Petri (60 x 15 mm) para lavar tecidos. São necessárias três placas de Petri para lavagem de PBS, três para PBS com antibiótico e três para lavagem LB-15. Uma placa de Petri contendo LB-15 adicional com tampa de acompanhamento será utilizada para a colocação final de peças após lavagens.
- Encha cada placa de Petri com aproximadamente 10 mL de fluidos apropriados, seja PBS ou LB-15.
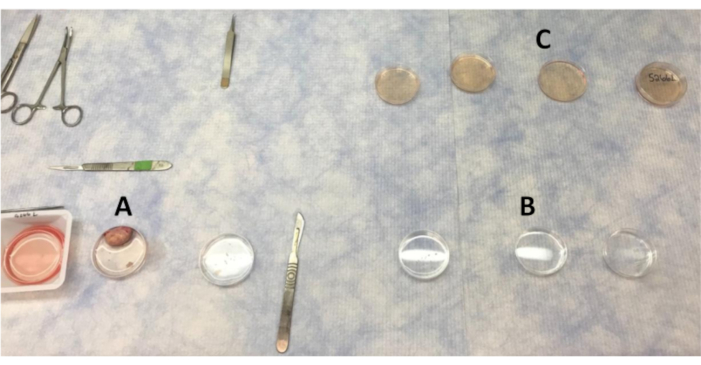
Figura 1:Layoutdas placas para lavar as peças de ovário e córtex no banco limpo. (A) PBS usado para lavar o ovário à medida que seções do córtex são removidos. (B) PBS com lavagens de antibióticos que as peças do córtex são movidas. (C) As peças do córtex ovariano são lavadas quatro vezes em LB-15 antes de se mudarem para o armário de biossegurança para lavagem final em LB-15. Clique aqui para ver uma versão maior desta figura.
- Remova o waymouth preparado e o meio LB-15 da geladeira e aqueça até a temperatura ambiente.
- Autoclave todas as ferramentas para garantir a esterilização antes do uso.
- Mantenha os ovários a 37 °C até que o córtex ovariano esteja pronto para ser coletado.
- Usando fórceps com mandíbulas serrilhadas, pegue o ovário e lave minuciosamente na primeira placa de Petri cheia de PBS. Transfira o ovário para a segunda lavagem pbs e limpe completamente mais uma vez.
NOTA: O ovário permanecerá na segunda lavagem pbs enquanto as tiras corticais ovarianas são removidas. - Usando fórceps serrilhados, proteja o ovário e corte ao meio. Neste momento, o córtex ovariano vai cortar da medula. Usando uma régua, certifique-se de que não mais do que 1-2 mm de profundidade de superfície do ovário seja removido da medula16. Remova seções transversais do córtex ovariano da medula, corte 3-4 tiras finas de córtex ovariano(Figura 2) com um bisturi (lâmina de bisturi#11; alça #3), e coloque as tiras na terceira placa de Petri cheia de PBS.
NOTA: Neste momento, pode-se coletar tecido cortical ovariano adicional para extração de RNA ou fixado e coletado para histologia de peças iniciais não cultivadas do córtex. Ao remover tiras de córtex ovariano, evite áreas com folículos antral visíveis ou lutea corpora. Além disso, evite coletar tecido medular. A histologia da medula é muito diferente como mostrado anteriormente16. Se o córtex ovariano não for cortado a mais de 1-2 mm de profundidade, então a medula não deve ser obtida. A histologia distinta permite marcos entre o córtex e a medula. - Corte as tiras do córtex ovariano na terceira lavagem PBS em pequenos pedaços quadrados (~0,5-1 mm3) com uma lâmina de bisturi #21. Use uma régua por baixo das placas de Petri para garantir que as peças sejam de tamanho e espessura semelhantes para fazer peças consistentes de córtex ovariano. Use fórceps para fixar as tiras enquanto corta as peças com um bisturi.
NOTA: O número de peças de tecido cortadas depende do experimento. Quatro pedaços de córtex ovariano é a quantidade mínima de tecido necessária para a cultura. Outros métodos para garantir o comprimento e a profundidade apropriados incluem o uso de fatiadores especiais26 ou peças de plástico pré-cortadas como modelos27. - Lave pedaços cortical ovarianos através de todos os três PBS com placas de Petri cheias de antibióticos. Use uma asseps de ponta curva para mover peças entre as lavagens.
- Mova peças de córtex através da série de lavagens LB-15 e coloque na placa final de Petri com preenchimento LB-15. Rotule a tampa com Y animal e lado do ovário (esquerda ou direita).
NOTA: Submergir totalmente as peças do córtex ovariano em cada lavagem para limpeza completa. - Colete quatro pedaços de córtex ovariano por ovário e fixe para histologia do dia zero. Peças adicionais também podem ser congeladas para RNA. As peças de tecido restantes serão usadas para a cultura. Limpe as ferramentas de dissecação com 70% de etanol após cada coleta de tecido.
- Prepare um gabinete de segurança biológica para a lavagem final de tecidos e preparação da cultura. Higienize o fornecimento com 70% de etanol antes de colocar no armário de segurança biológica. Use a técnica asséptica ao trabalhar no gabinete de segurança biológica.
- Mova todo o córtex ovariano destinado à cultura para o armário de segurança biológica e lave mais uma vez em uma placa de Petri cheia de LB-15.
- Em uma placa de cultura de tecido de 24 poços, pipeta 350 μL de waymouth médio por poço.
- Coloque a cultura não revestida bem inseridas em cada poço usando fórceps. Certifique-se de que nenhuma bolha seja formada sob a base da inserção, pois isso resultaria na secagem do tecido. O meio deve estar tocando as pastilhas para permitir que o meio seja absorvido e cerque as peças do córtex ovariano.
- Posicione cuidadosamente quatro peças de córtex ovariano na malha de cada inserção(Figura 2). Os fórceps podem perfurar a malha se os pedaços de tecido não forem delicadamente colocados. As peças de tecido não devem estar se tocando ou o lado da pastilha.
- Incubar o tecido a 37 °C com 5% de CO216.
NOTA: Outros utilizaram 38,8 °C28. No entanto, não foi observada diferença na integridade do tecido nem na capacidade dos folículos de progredir em tecido de 37 °C nem ter outros39,30. Assim, neste ponto qualquer uma dessas temperaturas deve ser propícia para o sucesso do experimento. Outros usaram 400 μL de meio. Qualquer quantidade é boa, desde que seja consistente, e o tecido esteja parcialmente submerso permitindo uma tensão superficial adequada para permitir a hidratação do tecido (mídia ao redor de pedaços de córtex ovariano). Encha poços vazios com 500 μL de água estéril para ajudar a reduzir a evaporação de outros poços.

Figura 2: Peças de córtex ovariano e placa de cultura. (A) Uma tira ovariana sendo cortada do córtex do ovário. (B) Peça de régua e córtex mostrada lado a lado. (C) Quatro peças de córtex (~0,5-1 mm3) repousando na inserção no meio de cultura na placa. (D) Levantamento da pastilha para coletar o meio de cultura do poço. Recolher e substituir todo o meio cultural diariamente (250 μL) para manter o pH adequado.Aproximadamente 250 μL é obtido de cada poço a cada dia (cerca de 70% do meio de cultura inicial). Clique aqui para ver uma versão maior desta figura.
3. Coleção de mídia
- Mude a cultura do córtex ovariano diariamente por 7 dias. As alterações médias devem ser o mais próximo possível de 24h para evitar grandes alterações de pH e cor no meio. Temperatura quente média a 37 °C antes de alteração média. Aproximadamente 250 μL são obtidos de cada poço a cada dia (cerca de 70% do meio de cultura inicial).
- Durante as alterações médias, use fórceps para retirar suavemente a pastilha do poço. Colete o meio Waymouth cultivado em tubos de 0,5 mL (aproximadamente 250 μL /dia). Coloque a inserção de volta bem e adicione 350 μL de meio de cultura fresca, dispensando o meio entre o lado da inserção e bem.
NOTA: Mude a maioria da mídia diariamente para obter mídia suficiente para medir todos os esteroides, citocinas e quimioterapias necessárias para determinar o microambiente ovariano. Além disso, mudanças diárias no meio são importantes para evitar grandes alterações de pH (indicadas por mudança de cor) no meio. Gotas de meio foram retidas ao redor das peças do córtex ovariano para garantir que as peças permanecessem molhadas. Não foram observados problemas com tecido culto devido à mudança de 70% da mídia. - Armazene o meio coletado da cultura tecidual a -20 °C.
4. Imagem e processamento a jusante
- Após 7 dias de cultura a 37 °C com 5% de CO2,imagem as peças do córtex ovariano usando um microscópio de dissecção com uma câmera conectada e um programa de software de imagem de computador.
NOTA: Uma sala escura geralmente é melhor para alcançar a melhor qualidade de imagem para imagens. - Após a imagem, fixe dois pedaços de córtex ovariano por poço em Bouins para histologia e congele dois pedaços de córtex ovariano em nitrogênio líquido para obter RNA para cDNA. Repita este passo para todos os poços com tecido. Pegue o meio a partir do dia 7 e armazene a -20 °C.
- Deixe que as peças do córtex ovariano permaneçam imersas em Bouins (ácido picrico 750 mL, ácido acético glacial de 50 mL e 37%-40% formalina 250 mL) por aproximadamente 1,5 h antes de ser lavado com 70% de etanol três vezes. O tecido permanecerá em 70% de etanol e será limpo diariamente até que a solução não seja mais amarela.
NOTA: Podem ser utilizados fixativos que não sejam Bouins e paraformaldeído. Nesta experiência, Bouins é usado, pois é o fixador para alcançar a morfologia ideal. Se mais tecido for necessário para outras análises, poços adicionais de mídia e pedaços de córtex ovariano podem ser obtidos de cada animal.
Resultados
Este procedimento de cultura do córtex bovino pode ser usado para determinar uma grande variedade de dados hormonais, citocinas e histologia de pequenos pedaços do ovário. A coloração, como hematoxilina e eosina (H&E), pode ser usada para determinar a morfologia ovariana através do folículo16,23,31 (Figura 3). Resumidamente, os folículos foram classificados como primordiais, que é um oócit...
Discussão
O benefício da cultura do córtex ovariano in vitro, como descrito neste manuscrito, é que os folículos se desenvolvem em um ambiente normalizado com estroma adjacente ao redor dos folículos. As células somáticas e oócito permanecem intactos, e há comunicação célula-celular apropriada como modelo in vivo. Nosso laboratório descobriu que um sistema de cultura de 7 dias fornece dados representativos de foliculogênese e esteróideogênese para o tratamento do córtex ovariano. Outros protocolos de cultura de te...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Esta pesquisa foi apoiada pelo Instituto Nacional de Alimentos e Agricultura 2013-67015-20965 para a ASC, Universidade de Nebraska Food for Health Competitive Grants to ASC. O Escotilha do Departamento de Agricultura dos Estados Unidos concede a 8ª adesão do NEB26-202/W3112 #1011127 à ASC, Hatch-NEB ANHL Accession #1002234 à ASC. Quantitative Life Sciences Initiative Summer Postdoctoral Scholar Support – COVID-19 Award for summer funding for CMS.
Os autores gostariam de estender sua apreciação ao Dr. Robert Cushman, Centro de Pesquisa animal de carne dos EUA, Clay Center, NE para agradecê-lo por fornecer os ovários em uma publicação anterior, que foram então usados no artigo atual como prova de conceito na validação desta técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| #11 Scapel Blade | Swann-Morton | 303 | Scaple Blade |
| #21 Scapel Blade | Swann-Morton | 307 | Scaple Blade |
| 500mL Bottle Top Filter | Corning | 430514 | Bottle Top Filter 0.22 µm pore for filtering medium |
| AbsoluteIDQ Sterol17 Assay | Biocrates | Sterol17 Kit | Samples are sent off to Biocrates and steroid panels are run and results are returned |
| Androstenedione Double Antibody RIA Kit | MPBio | 7109202 | RIA to determine androstenedione from culture medium |
| Belgium A4 Assay Kit | DIA Source | KIP0451 | RIA to determine androstenedione from culture medium |
| Bovine Cytokine Array Q3 | RayBiotech | QAB-CYT-3-1 | Cytokine kit to determine cytokines from culture medium |
| cellSens Software Standard 1.3 | Olympus | 7790 | Imaging Software |
| Insulin-Transferrin-Selenium-X | Gibco ThermoFisher Scientific | 5150056 | Addative to the culture medium |
| Leibovitz's L-15 Medium | Gibco ThermoFisher Scientific | 4130039 | Used for tissue washing on clean bench, and in the biosafety cabniet |
| Microscope | Olympus | SZX16 | Disection microscope used for imaging tissue culture pieces |
| Microscope Camera | Olympus | DP71 | Microscope cameraused for imaging tissue culture pieces |
| Millicell Cell Culture Inserts 0.4µm, 12,mm Diameter | Millipore Sigma | PICM01250 | Inserts that allow the tissue to rest against the medium without being submerged in it |
| Multiwell 24 well plate | Falcon | 353047 | Plate used to hold meduim, inserts, and tissues |
| Petri dish 60 x 15 mm | Falcon | 351007 | Petri dish used for washing steps prior to culture |
| Phosphate-Buffered Saline (PBS 1X) | Corning | 21-040-CV | Used for tissue washing |
| SAS Version 9.3 | SAS Institute | 9.3 TS1M2 | Statistical analysis software |
| Thomas Stadie-Riggs Tissue Slicer | Thomas Scientific | 6727C10 | Tissue slicer for preperation of thin uniform sections of fresh tissue |
| Waymouth MB 752/1 Medium | Sigma-Aldrich | W1625 | Medium used for tissue cultures |
Referências
- Braw-Tal, R., Yossefi, S. Studies in vivo and in vitro on the initiation of follicle growth in the bovine ovary. Journal of Reproduction and Fertility. 109, 165-171 (1997).
- Nilsson anEdson, M. A., Nagaraja, A. K., Matzuk, M. M. The mammalian ovary from genesis to revelation. Endocrine Reviews. 30 (6), 624-712 (2009).
- Fortune, J. E., Cushman, R. A., Wahl, C. M., Kito, S. The primordial to primary follicle transition. Molecular and Cellular Endocrinology. 163, 53-60 (2000).
- Ireland, J. J. Control of follicular growth and development. Journal of Reproduction and Fertility. 34, 39-54 (1987).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Ramezani, M., Salehnia, M., Jafarabadi, M. Short term culture of vitrified human ovarian cortical tissue to assess the cryopreservation outcome: molecular and morphological analysis. Journal of Reproduction & Infertility. 18 (1), 162-171 (2017).
- McLaughlin, M., Telfer, E. Oocyte development in bovine primordial follicles is promoted by activin and FSH within a two-step serum-free culture system. Reproduction. 139 (6), 971-978 (2010).
- Stefansdottir, A., Fowler, P. A., Powles-Glover, N., Anderson, R. A., Spears, N. Use of ovary culture techniques in reproductive toxicology. Reproductive Toxicology. 49, 117-135 (2014).
- Bromfield, J. J., Sheldon, I. M. Lipopolysaccharide reduces the primordial follicle pool in the bovine ovarian cortex ex vivo and in the murine ovary in vivo. Biology of Reproduction. 88 (4), 1-9 (2013).
- Franks, S., Stark, J., Hardy, K. Follicle dynamics and anovulation in polycystic ovary syndrome. Humane Reproduction Update. 14 (4), 367-378 (2008).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicological Sciences. 90 (2), 500-509 (2006).
- Bott, R. C., McFee, R. M., Clopton, D. T., Toombs, C., Cupp, A. S. Vascular endothelial growth factor and kinase domain region receptor are involved in both seminiferous cord formation and vascular development during testis morphogenesis in the rat. Biology of Reproduction. 75, 56-67 (2006).
- Baltes-Breitwisch, M. M., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms or administration of proangiogenic isoforms stimulates vascular development in the rat testis. Reproduction. 140 (2), 319-329 (2010).
- McFee, R. M., et al. Inhibition of vascular endothelial growth factor receptor signal transduction blocks follicle progression but does not necessarily disrupt vascular development in perinatal rat ovaries. Biology of Reproduction. 81, 966-977 (2009).
- Artac, R. A., et al. Neutralization of vascular endothelial growth factor antiangiogenic isoforms is more effective than treatment with proangiogenic isoforms in stimulating vascular development and follicle progression in the perinatal rat ovary. Biology of Reproduction. 81, 978-988 (2009).
- Abedal-Majed, M. A., et al. Vascular endothelial growth factor A isoforms modulate follicle development in peripbertal heifers independent of diet through diverse signal transduction pathways. Biology of Reproduction. 102 (3), 680-692 (2020).
- Wandji, S. A., Srsen, V., Voss, A. K., Eppig, J. J., Fortune, J. E. Initiation in vitro of bovine primordial follicles. Biology of Reproduction. 55, 942-948 (1996).
- Wandji, S. A., Srsen, V., Nathanielsz, P. W., Eppig, J. J., Fortune, J. E. Initiation of growth of baboon primordial follicles in vitro. Human Reproduction. 12 (9), 1993-2001 (1993).
- Yang, M. Y., Fortune, J. E. Testosterone stimulates the primary to secondary follicle transition in bovine follicles in vitro. Biology of Reproduction. 75, 924-932 (2006).
- Fortune, J. E., Kito, S., Wandji, S. A., Srsen, V. Activation of bovine and baboon primordial follicles in vitro. Theriogenology. 49, 441-449 (1998).
- Yang, M. Y., Fortune, J. E. Vascular endothelial growth factor stimulates the primary to secondary follicle transition in bovine follicles in vitro. Molecular Reproduction and Development. 74, 1095-1104 (2007).
- Barberino, R. S., Silva, J. R. V., Figueiredo, J. R., Matos, M. H. T. Transport of domestic and wild animal ovaries: a review of the effects of medium, temperature, and periods of storage on follicular viability. Biopreservation and Biobanking. 17 (1), 84-90 (2019).
- Summers, A. F., et al. Altered theca and cumulus oocyte complex gene expression, follicular arrest and reduced fertility in cows with dominant follicle follicular fluid androgen excess. PLoS One. 9 (10), e110683 (2014).
- Koal, T., Schmiederer, D., Pham-Tuan, H., Rohring, C., Rauh, M. Standardized LC-MS/MS based steroid hormone profile analysis. The Journal of Steroid Biochemistry and Molecular Biology. 129, 129-138 (2012).
- Poole, R. K., Brown, A. R., Pore, M. H., Pickworth, C. L., Poole, D. H. Effects of endophyte-infected tall fescue seed and protein supplementation on stocker steers: II. Adaptive and innate immune function. Journal of Animal Science. 97 (10), 4160-4170 (2019).
- Laronda, M., et al. Alginate encapsulation supports the growth and differentiation of human primordial follicles within ovarian cortical tissue. Journal of Assisted Reproduction and Genetics. 31 (8), 1013-1028 (2014).
- Silber, S. J., et al. A series of monozygotic twins discordant for ovarian failure: ovary transplantation (cortical versus microvascular) and cryopreservation. Human Reproduction. 23 (7), 1531-1537 (2008).
- Wiedemann, C., Zahmel, J., Jewgenow, K. Short-term culture of ovarian cortex pieces to assess the cryopreservation outcome in wild fields for genome conservation. BMC Veterinary Research. 9 (37), (2013).
- Baufeld, A., Vanselow, J. Increasing cell plating density mimics an early post-LH stage in cultured bovine granulosa cells. Cell and Tissue Research. 354 (3), 869-880 (2013).
- Shimizu, T., Miyamoto, A. Progesterone induces the expression of vascular endothelial growth factor (VEGF) 120 and Flk-1, its receptor, in bovine granulosa cells. Animal Reproduction Science. 102 (3-4), 228-237 (2007).
- Tepekoy, F., Akkoyunlu, G. The effect of FSH and activin A on Akt and MAPK1/3 phosphorylation in cultured bovine ovarian cortical strips. Journal of Ovarian Research. 9 (13), 1-9 (2016).
- Beck, K., Singh, J., Arshud Dar, M., Anzar, M. Short-term culture of adult bovine ovarian tissues: chorioallantoic membrane (CAM) vs. traditional in vitro culture systems. Reproductive Biology and Endocrinology. 16 (1), 21 (2018).
- Eppig, J. J. Oocyte control of ovarian follicular development and function in mammals. Reproduction. 122 (6), 829-838 (2001).
- Paczkowski, M., Silva, E., Schoolcraft, W. B., Krisher, R. L. Comparative importance of fatty acid beta-oxidation to nuclear maturation, gene expression, and glucose metabolism in mouse, bovine, and porcine cumulus oocyte complexes. Biology of Reproduction. 88 (5), 1-11 (2013).
- Raffel, N., et al. Is ovarian tissue transport at supra-zero temperatures compared to body temperature optimal for follicle survival?. In Vivo. 34 (2), 533-541 (2020).
- Duncan, F., et al. Ovarian tissue transport to expand access to fertility preservation: from animals to clinical practice. Reproduction (Cambridge, England). 152 (6), R201-R210 (2016).
- Liebenthron, J., et al. Overnight ovarian tissue transportation for centralized cryobanking: a feasible option. Reproductive BioMedicine Online. 38 (5), 740-749 (2019).
- Mohammed, B. T., Donadeu, F. X. Bovine granulosa cell culture. Epithelial Cell Culture: Methods and Protocols. , 79-87 (2018).
- Langbeen, A., et al. Effects of neutral red assisted viability assessment on the cryotolerance of isolated bovine preantral follicles. Journal of Assisted Reproduction Genetics. 31, 1727-1736 (2014).
- Higuchi, C. M., Maeda, Y., Horiuchi, T., Yamazaki, Y. A simplified method for three-dimensional (3-D) ovarian tissue culture yielding oocytes competent to produce full-term offspring in mice. PLoS One. 10 (11), e0143114 (2015).
- Yang, M. Y., Fortune, J. E. Changes in the transcriptome of bovine ovarian cortex during follicle activation in vitro. Physiological Genomics. 47, 600-611 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados