Method Article
Comissionamento irradiador e dosimetria para avaliação de parâmetros de α e β de LQ, esquema de dosagem de radiação e depoimento de dose in vivo
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A dosimetria de radiação fornece uma técnica para aumentar a precisão dos experimentos pré-clínicos e garantir que as doses de radiação fornecidas estejam intimamente relacionadas aos parâmetros clínicos. Este protocolo descreve medidas a serem tomadas em cada fase durante experimentos de radiação pré-clínico para garantir o design experimental adequado.
Resumo
A dosimetria de radiação é fundamental na entrega precisa e reprodutibilidade de esquemas de radiação em modelos pré-clínicos de alta relevância translacional. Antes de realizar quaisquer experimentos in vitro ou in vivo, deve-se avaliar a saída específica de dose para os desenhos experimentais do irradiador e individual. Utilizando uma câmara de ionização, eletrometro e instalação de água sólida, a saída de dose de campos largos no isocentro pode ser determinada. Usando uma configuração semelhante com filmes radiocrômicos no lugar da câmara de ionização, também podem ser determinadas taxas de dose para campos menores em diferentes profundidades. Ensaios de sobrevivência clonogênica in vitro de células cancerosas em resposta ao tratamento de radiação são experimentos baratos que fornecem uma medida de radio-sensibilidade inerente das linhas celulares, encaixando esses dados com o modelo linear-quadrático tradicional. Os parâmetros de modelo estimados a partir desses ensaios, combinados com os princípios das doses biológicas eficazes, permitem desenvolver horários de fracionamento variados para o tratamento de radiação que fornecem doses eficazes equivalentes em experimentos animais portadores de tumores. Este é um fator importante a considerar e corrigir na comparação dos horários da radioterapia in vivo para eliminar a potencial confusão dos resultados devido à variância nas doses efetivas entregues. Em conjunto, este artigo fornece um método geral para verificação de saída de doses de irradiadores de animais e armários pré-clínicos, avaliação in vitro de radio-sensibilidade e verificação da entrega de radiação em pequenos organismos vivos.
Introdução
Os cânceres representam coletivamente a segunda principal causa de morte nos EUA e em muitos países ao redor do mundo1. A radioterapia é uma pedra angular do tratamento para muitos subtipos tumorais e é administrada a cerca de metade de todos os pacientes com câncer2,3. Os desfechos dos pacientes para quase todos os cânceres melhoraram ao longo do tempo, pois os equipamentos usados para fornecer doses de radiação têm avançado constantemente e algumas abordagens terapêuticas multimodais eficazes foram desenvolvidas4,5,6, mas as taxas de recidiva e mortalidade para pacientes com certos tipos de tumores permanecem elevadas7,8,9. Assim, a radioterapia para o câncer continua sendo uma área ativa de pesquisa básica e clínica. Muitos estudos pré-clínicos de radioterapia empregam o uso de irradiadores de pequena escala para fornecer doses de radiação para modelos in vitro ou animais de câncer. Com uma infinidade de experimentos potenciais para conduzir a exploração de detalhes de radiobiologia mecanicista ou novos tratamentos, podem ser encontradas armadilhas comuns que levam a conclusões incorretas, baixa reprodutibilidade e recursos desperdiçados. Essas armadilhas se enquadram em três áreas importantes: dosimetria irradiadora, caracterização in vitro de linhas celulares modelos e cronograma de dosagem de irradiação in vivo. Resultados precisos e reprodutíveis de experimentos mais avançados são difíceis de alcançar sem atenção prévia a esses aspectos fundamentais da pesquisa de radioterapia.
O protocolo aqui detalhado descreve uma estratégia generalizada para evitar ou mitigar essas questões e se baseia em várias metodologias previamente desenvolvidas destinadas ao uso independente. Esses métodos distintos foram mesclados para que um pesquisador interessado em iniciar ou melhorar experimentos de radioterapia pré-clínicos pudesse usá-lo como um layout experimental robusto. O quadro sugerido inclui a metodologia para o comissionamento de irradiadores animais de pequena escala, para determinar propriedades radiobiológicas básicas das linhas celulares do modelo e para projetar e administrar adequadamente um cronograma de dosagem e fracionamento para modelos de tumor in vivo.
Protocolo
Todas as etapas deste protocolo envolvendo o uso de animais de laboratório, incluindo manuseio e procedimentos, foram aprovadas pelo Comitê Institucional de Cuidados e Uso de Animais na Universidade da Virgínia Ocidental em Morgantown, Virgínia Ocidental (Número do Protocolo: 1604001894).
1. Determinação da saída de dose
- Use este protocolo, baseado no protocolo "Método In-fantasma" da Associação Americana de Físicos em Grupo de Tarefas de Medicina (AAPM TG) 6110 e semelhante ao protocolo de comissionamento estabelecido por Xstrahl, para determinar a saída do feixe do pequeno irradiador animal em relação a uma geometria específica sob as seguintes condições de configuração.
- Ajuste o irradiador para fornecer radiação a 220 kVp e 13 mA, com um campo aberto (17 cm por 17 cm) posicionado no isocentro, ou 35 cm da fonte. Além disso, filtre o feixe com um filtro de 0,15 mm com um foco amplo. Alguns irradiadores celulares contêm apenas uma fonte radioativa, este protocolo só pode ser usado para irradiadores de raios-X.
- Alinhe os fantasmas de água sólida na seguinte ordem: laje de 1 cm, laje de 2 cm com ranhura de câmara de ionização, laje de 2 cm, laje de 1 cm. Empilhar os fantasmas de água sólida nesta ordem posiciona a câmara de ionização a uma profundidade de 2 cm, permitindo 4 cm também para backscatter. Consulte a Figura 1 para obter um retrato gráfico da configuração da dosimetria.
NOTA: Para acomodar a grande e bastante pesada pilha de água sólida, os autores recomendam a aquisição de um sofá impresso 3D personalizado com suporte variável para garantir que a pilha fantasma esteja nivelada e à distância correta da fonte através da superfície do material, não apenas no centro.
- Utilize o equipamento de medição (ou seja, câmara de ionização calibrada ADCL, eletrometro) e uma explicação dos fatores de correção utilizados podem ser encontrados na Tabela de Materiais e na Tabela 1, respectivamente.
NOTA: Que o ADCL forneça valores de Nk em alguns pontos para diferentes Camadas de Meio Valor (HVL, medida da qualidade do feixe). O valor de Nk a ser utilizado no protocolo deve ser baseado em uma interpolação dos valores ADCL para o HVL medido da unidade. O fabricante mediu o HVL da nossa unidade e usamos isso em nossa determinação de saída de taxa de dose. - Configure a pilha fantasma e insira a câmara de ionização no fantasma conforme especificado na etapa 1.1.2.
- Ajuste a pilha fantasma de tal forma que a fonte à distância superficial (SSD), ou a distância da fonte de radiação até a primeira superfície, seja de 33 cm quando adequadamente nivelada.
NOTA: Os autores sugerem a criação de um sofá impresso 3D personalizado, grande o suficiente para suportar as dimensões das lajes de água sólida. Além disso, o utilizado neste protocolo tem um componente ajustável para nivelar a pilha fantasma.
- Ajuste a pilha fantasma de tal forma que a fonte à distância superficial (SSD), ou a distância da fonte de radiação até a primeira superfície, seja de 33 cm quando adequadamente nivelada.
- Pegue a média de três exposições separadas de raios-X, leituras de um minuto com o conjunto de tensão de viés eletrometro a 300 V. O resultado será denominado M+.
NOTA: As irradiações são realizadas com o instrumento definido para fornecer radiação a 220 kVp e 13 mA. Isso é o mesmo para os próximos dois passos (etapas 1.5-1.6). Para a segurança do usuário, certifique-se de que as portas permaneçam fechadas durante os tratamentos. - Realize outro conjunto de três exposições separadas de raios-X, 1 min de leituras com o conjunto de tensão de viés eletrometro em -150 V. O resultado será denominado ML.
- Realize outro conjunto de três exposições separadas de raios-X, 1 min de leituras com o conjunto de tensão de viés eletrometro a -300 V. O resultado será denominado MH, ou também M-.
- Calcule Ppol e Pion usando a Equação 1 e a Equação 2, respectivamente, conforme descrito abaixo:
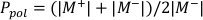 (Equação 1)
(Equação 1)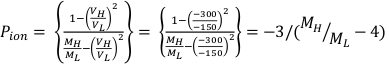 (Equação 2)
(Equação 2) - Meça a temperatura, em Celsius, e a pressão, no kPa, dentro do irradiador usando um termômetro digital calibrado e barômetro. Em seguida, calcule PTP como indicado abaixo na Equação 3.
NOTA: Este cálculo pressupõe que o ADCL usou valores padrão de temperatura e pressão de 22 °C e 101,33 kPa ao indicar seu valor para o fator de calibração do kerma de ar.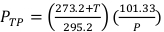 (Equação 3)
(Equação 3) - Calcule a leitura de câmara corrigida, M, multiplicando a leitura bruta da câmara, MH,por Pelec,Ppol,Pione PTP. Esta equação pode ser encontrada abaixo na Equação 4.
NOTA: Este cálculo pressupõe que a ADCL realizou sua calibração com o conjunto de tensão de viés para -300V, o que é uma prática bastante comum.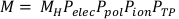 (Equação 4).
(Equação 4). - Multiplique ainda mais a leitura de câmara corrigida por Nk, [(μen/p)war]água, PQ, cham, ebaia P. Pbaia é necessário apenas para medições obtidas na água. Portanto, para este protocolo Pbaia é apenas 1.
NOTA: Utilizando as condições deste protocolo, os três últimos itens dão um valor de 1,0731. Este valor depende da qualidade do feixe, por isso o HVL deve ser conhecido para determiná-lo. O valor de 1,0731 é específico para nossa unidade e é dado como exemplo. Para determinar os valores de PQ,cham e [(μen/p)wair]água específica para sua unidade, use o HVL medido e interpolar da Tabela VII, e Tabela VIII, e corrija para o tamanho do campo de referência de acordo com a Figura 3 e Figura 4 do protocolo AAPM TG6110. No nosso caso, multiplicar Nk por 1,0731 fornece a dose para a água, Dw, em Gy por um tempo nominal de 1 minuto, assumindo que o valor ADCL Nk é dado em Gy/Coulumbs. - Determine o efeito final do irradiador que está sendo usado. Quando os raios-X são gerados pela primeira vez, a saída sobe para seu valor total ao longo de algum tempo finito. Da mesma forma, quando a fonte de raio-x é desligada, a saída diminui para zero ao longo de algum tempo finito.
- Conta o tempo para essa transição, ou o efeito final. Isso pode ser feito tomando a média de três leituras com o conjunto de tensão de viés eletrometro em -300 V, para uma variedade de configurações de tempo. Faça isso por 6, 12, 18, 24, 30 e 60 segundos.
- Plote as leituras de eletrometro contra o tempo e encontre a melhor linha reta. O tempo total, t, para um tratamento de 1 minuto pode ser calculado pela equação 5:
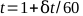 (Equação 5).
(Equação 5).
- Calcule a taxa de dose de um irradiador dado pela equação 6:
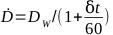 (Equação 6)
(Equação 6)
2. Criando uma curva de calibração de filme radiocrômico
- Para obter uma lista de materiais necessários, consulte Tabela de Materiais.
- Usando uma configuração quase idêntica como o protocolo anterior, coloque o filme em uma profundidade de 2 cm na pilha fantasma de água sólida. A ordem dos fantasmas de água sólida é insignificante desde que haja 2 cm de água sólida acima e 4 cm de água sólida abaixo para efeitos de acúmulo e backscatter.
- Utilizando a dose determinada encomendada no protocolo 1, determine os tempos de tratamento para as doses listadas na Tabela 2 usando a equação 7:
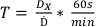 (Equação 7)
(Equação 7) - Prepare várias peças de filme garantindo que cada filme seja do mesmo tamanho e permaneça na mesma orientação desde o tratamento até a aquisição de digitalização. Isso pode ser feito colocando um pequeno corte diagonal no canto inferior esquerdo. Cada filme deste ponto em diante deve ser do mesmo lote de filme.
NOTA: Prepare 3 réplicas separadas para que cada ponto de dose seja avaliado. - Escaneie as peças cortadas usando um scanner de fotos colorido de 48 bits com todas as correções desligadas. Certifique-se de que cada filme seja colocado no centro exato da cama de varredura. Os valores obtidos são os exames de pré-exposição utilizados para determinar a densidade óptica não exposta11,12. Salve todas as imagens no . Formato de arquivo Tiff para evitar a compressão dos dados-chave.
NOTA: Os autores recomendam digitalizar os filmes três vezes e usar a média obtida como o único valor para um determinado filme. - Comece a irradiação dos filmes colocando um pedaço de filme em cima de 4 cm de água sólida e posicione os 2 cm restantes de água sólida acima, como descrito anteriormente nesta seção.
- Ajuste o conjunto fantasma para que o filme esteja a mesma distância da fonte que a câmara de ionização foi ao determinar a saída da dose. Este é o ponto isocêntrico do irradiador.
- Programe o tempo de tratamento calculado na etapa 2.3 acima para uma dose prescrita.
- Repetir o tratamento para cada uma das doses listadas na Tabela 2.
- Deixe os filmes descansarem por 24 horas protegidos contra a luz.
- Adquira os filmes pós-exposição da mesma maneira que acima.
- Importe imagens para o software de análise ImageJ e realize todas as medições no canal vermelho.
- Arraste a imagem para dentro . Formato de arquivo Tiff em ImageJ.
- Clique no menu de queda de imagem. Selecione O menu de queda de imagem. Selecione canais divididos na opção Color.
- Usando apenas o canal de imagem vermelho, desenhe uma região de interesse usando a ferramenta retângulo. Pressione Ctrl+M. Transcreva o valor médio da janela de resultados.
- Repetir as etapas 2.12.1-2.12.4 para todos os filmes digitalizados.
- Obtenha o valor do pixel em um quadrado de 1 cm por 1 cm quadrado localizado centralmente para os filmes não expostos e expostos. Esses valores serão denotados como PVU(D) e PV(D) respectivamente, e podem ser usados para calcular a densidade óptica líquida conforme descrito na Equação 8.
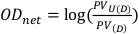 (Equação 8) 13
(Equação 8) 13
- Repita o passo 2.13 para cada par de imagens de filme, tanto pré-exposição quanto pós-exposição.
- Plote um gráfico da dose versus a densidade óptica líquida e encaixe a curva em um polinômial cúbico no formato de y = ax3 + bx2 + cx + d. Um exemplo pode ser encontrado na Figura 2B.
3. Determinação de α/β valor para linhas específicas de células cancerosas via ensaio clonogênico
NOTA: O protocolo a seguir é uma versão modificada dos métodos descritos por Franken et al14 e pode ser visto na Figura 3.
- Cresça células para ~80% de confluência. Evite o uso de fontes excessivamente confluentes de células para este experimento, pois é necessário que as células estejam na fase de registro do crescimento celular. Para os resultados representativos de ensaio clonogênico exibidos na Figura 3C,as células cancerígenas de mama MDA-MB-231 foram cultivadas no Médio Águia Modificada (DMEM) de Dulbecco, complementadas com soro bovino fetal de 10% e penicilina/estreptomicina e incubadas a 37 °C e 5% de dióxido de carbono em uma incubadora umidificada.
- Seme as células na densidade desejada para o ensaio da colônia. Diluições precisas durante a semeadura são cruciais para determinar a eficiência do revestimento do ensaio. Certifique-se de emplacar várias réplicas.
- Proceda com esta etapa se o tratamento de radiação preceder o revestimento celular(Figura 3A). Alternativamente, prossiga para a etapa 3.4 se o revestimento celular preceder o tratamento de radiação.
- Realize o tratamento de radiação desejado em frascos de cultura. Quaisquer tratamentos adicionais (ou seja, tratamentos medicamentosos) podem ser realizados em qualquer momento antes ou depois disso. Para os resultados representativos na Figura 3C,o tratamento de radiação ocorreu após as células de chapeamento, detalhadas na etapa 3.4.
- Extrair as células usando o método preferencial de trippsinização e criar uma única suspensão celular. Remova a mídia cultural e adicione enzima recombinante (por exemplo, TrypLE Express) para desprender células do frasco. Incubar células com a enzima por aproximadamente 3 minutos até que as células fossem separadas como detectadas usando um microscópio de luz. Neutralizar a enzima usando um volume igual de mídia de cultura celular. Centrífugas a 300 x g por 10 min e resuspendam à concentração desejada no meio da cultura.
- Aplaque as células em densidades desejadas em múltiplas réplicas.
- Substitua por mídia fresca após as primeiras 24 horas.
- Continue a substituir a mídia a cada 2-3 dias.
- Continue aculturar células até que as colônias de controle excedam 50 células por colônia, ~9-14 dias. Colônias de controle são aqueles grupos de tratamento que não recebem doses de radiação. Para experimentos que utilizam tratamentos medicamentosos também, outro grupo controle com dosagem de drogas, mas nenhum tratamento de radiação também será necessário.
- Proceda com essa etapa ao semear células antes do tratamento de radiação (Figura 3B).
- Extrair células usando método preferencial de trippsinização e criar uma única suspensão celular.
- Coloque células em densidades desejadas em múltiplas réplicas.
- Permita que as células aderam à placa durante a noite.
- Realize doses de radiação desejadas. Tratamentos adicionais, como a dosagem de medicamentos, podem ser realizados em qualquer momento antes ou depois desta etapa, desde que as células tenham se ligado às suas placas de tratamento. Para os resultados representativos na Figura 3C,1250 células MDA-MB-231 cérebro-trópico foram emplacados antes do tratamento (etapa 3.4). Em seguida, as células foram tratadas com doxorubicina de 15 nM 3 horas antes da irradiação com 3 raios-X.
- Substitua a mídia após as 24 horas iniciais.
- Substitua a mídia a cada 2-3 dias.
- Cultura as células tratadas até que as colônias do grupo controle excedam 50 células, ~9-14 dias. Colônias de controle são aqueles grupos de tratamento que não recebem doses de radiação. Para experimentos que utilizam tratamentos medicamentosos também, outro grupo controle com dosagem de drogas, mas nenhum tratamento de radiação também será necessário.
- Remova a mídia cultural de poços ou pratos e lave com PBS.
- Fixar células por 15 minutos em uma solução de 1:7 (v:v) de ácido acético glacial e metanol.
- Remova a solução de fixação.
- Após a fixação, as células de coloração por 30 minutos, ou 2h, se houver tempo disponível, em temperatura ambiente com uma solução de 2,5-5,0 mg/mL de cristal violeta em uma solução de 4:1 (v:v) de água destilada e metanol.
- Remova a solução de coloração e lave as células em um grande banho de água de temperatura ambiente.
NOTA: Não lave em água corrente. - Conte o número resultante de colônias em cada grupo de tratamento e calcule a fração de sobrevivência de cada placa.
- Plote a fração de sobrevivência contra a dose correspondente entregue, e ajuste a curva com um ajuste exponencial.
- Para estimar o valor α/β, use um ajuste exponencial da trama acima para estimar os valores para cada um dos parâmetros ajustáveis na equação linear-quadrática encontrada abaixo:
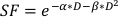 (Equação 9)
(Equação 9)
NOTA: A irradiação de células normalmente pode ser feita no isocentro sem qualquer colagem, desde que o tamanho do campo seja grande o suficiente para acomodar placas de poço ou placas de petri. As armadilhas potenciais neste protocolo podem incluir rendimentos como nenhuma formação de colônias, migração celular significativa com crescimento celular claro, mas sem colônias verdadeiras, ou contaminação devido ao tratamento em uma câmara irradiadora não estéril.
4. Determinação da saída de dose específica para desenhos experimentais variáveis
- Decida sobre o tamanho do campo desejado e distância da fonte.
NOTA: A colisão alterará a taxa de dose, não importa o tamanho ou distância do colisimador da fonte de raios-X. - Usando fantasmas de água sólida para fornecer acúmulo e backscatter, posicione um pedaço de filme na orientação correta que melhor retrata o design experimental.
NOTA: Para qualquer instalação experimental, a água sólida pode não fornecer a representação mais precisa de um determinado projeto. Em vez disso, recomendamos o uso dos vasos do experimento real (ou seja, placa de Petri, placas de bem, pequenos fantasmas animais, etc.). - Irradiar filmes para 1 (N=3) e 2 (N=3) minutos.
- Deixe os filmes descansarem por 24 horas protegidos contra a luz.
- Determine a densidade óptica líquida de cada um dos filmes seguindo os procedimentos da Seção 2. Use a curva de calibração do filme para determinar a dose da densidade óptica líquida.
- Determine a dose em 1 minuto, D1, como a taxa de dose de saída, Ḋ, para esta configuração experimental definida pela Equação 10 da seguinte forma:
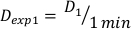 (Equação 10)
(Equação 10) - Da mesma forma, caluclate a dose em 2 minutos pela Equação 11 da seguinte forma:
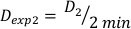 (Equação 11)
(Equação 11) - Devido ao efeito final, a taxa de dose para os cálculos acima pode ser ligeiramente diferente. Para este motivo para calcular Dexp para o design experimental desejado, use uma média doexp D individual como indicado na Equação 12:
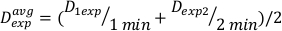 (Equação 12)
(Equação 12) - Usando esta média, defina o tempo para tratar qualquer dose desejada para esta configuração específica na Equação 13:
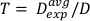 (Equação 13)
(Equação 13)
5. Tratar camundongos com tumores em local anatômico de interesse
- Anestesize o rato com técnicas seguras e humanas de anestesia aprovadas pela IACUC da instituição.
- Coloque o animal anestesiado em contenção conforme indicado no projeto experimental desejado.
- Esta etapa é opcional, se não estiver disponível proceda à etapa 5.6. Obtenha um radiograma, usando uma câmera de portal a bordo, do mouse sem colisão usando um filtro de alumínio.
- Obtenha um segundo radiograma com collimação no lugar.
- Sobreposição de radiogramas no ImageJ para demonstrar posicionamento do feixe.
- Usando o valor de α/β pré-determinado, determine o esquema de dose que fornece a abordagem mais razoável para responder a uma pergunta de pesquisa (ou seja, se quiser modelar os efeitos de uma dose de 30Gy entregue em 10 frações de 3 Gy, mas só deseja dar quatro frações). Utilizando a equação 14, com um valor presumido α/β de 10 (este valor pode ser determinado para linhas de células cancerígenas individuais no protocolo 3) e um LEITO semelhante ao de 30 Gy/10 F, tratar com 24 Gy em 4 frações de 6 Gy.
- Trate o animal pelo tempo prescrito dado para a dose desejada.
6. Confirmação histológica de deposição de dose in vivo
- Seguindo o protocolo 5,recolher tecido de interesse dentro de 1 hora após o tratamento15,16. Após a colheita de tecidos, prossiga com o protocolo de imunohistoquímica preferido. Um exemplo é dado abaixo.
- Perfuse animal com gelo frio 4% paraformaldeído (PFA).
- Pós-correção em PFA a 4 °C.
- Após a fixação, fixar o tecido sequencialmente em 10%, 20% e 30% de sacarose por 24 horas cada a temperatura ambiente.
- Incorpore tecido em gelatina e fixação sequencial em 4% pfa e novamente em 10-30% sacarose por 24 horas cada a temperatura ambiente.
- Corte o bloco e coloque a -80 °C por 30 minutos.
- Corte tecido em seções de 20-30 μm.
- Deslizamentos de imunostain como seções flutuantes livres em uma placa de seispoços 17,18.
- Lave três vezes e permeabiliza por 30 minutos em um shaker com 1,83% de lise em 1% Tritão, e 4% de soro de cabra inativado pelo calor.
- Incubar seções com anticorpo anti-γH2AX por 24 horas, seguida de uma incubação de 2 horas com anticorpo secundário desejado.
- Slides de deslizamento de tampa com tampas de vidro usando mídia de montagem preferida.
- Imagem em um microscópio fluorescente.
Resultados
Seguindo o protocolo 1 fornecerá uma taxa de dose em Gy/min, que é específica para o irradiador que está sendo usado. No entanto, independentemente do tipo de irradiador, com uma taxa de dose conhecida uma curva de calibração pode ser gerada usando o protocolo 2 produzindo filmes semelhantes e uma curva de calibração semelhante à da Figura 2A-B. Um ensaio bem sucedido do protocolo 3 produzirá colônias distintas e bem demarcadas de células que mancham homogêneamente violeta. A estimativa de α/β pode ser comparada a valores da literatura ou outros grupos de tratamento para interpretar a radiocessibilidade da determinada linha celular. Utilizando a curva de calibração desenvolvida seguindo o protocolo 2 e exibida na Figura 2B,o protocolo 4 produzirá duas amostras de filme semelhantes à Figura 2A que podem ser usadas para estimar os tempos de irradiação experimental necessários. Se uma câmera de imagem do portal a bordo estiver disponível para o irradiador que está sendo usado, radiogramas de pequenos animais podem ser obtidos com e sem colisão. A sobreposição dessas imagens demonstrará o posicionamento exato do feixe de radiação colidido em relação ao pequeno animal que está sendo tratado como descrito na Figura 4A. O depoimento bem-sucedido no protocolo 5 pode ser confirmado seguindo o protocolo 6. Uma indicação de que a radiação está sendo depositada em sistemas in vivo ou in vitro é através da detecção de quebras duplas de DNA encalhado. Ilustrado na Figura 4B, o mesmo rato tratado exclusivamente pelo hemisfério direito na Figura 4A,demonstra manchas positivas de γH2AX apenas no hemisfério tratado. Nesta figura, os núcleos são manchados com DAPI para mostrar duas coisas; 1) o todo é do cérebro a que o anticorpo anti γH2AX foi aplicado durante a análise histológica, e 2) o hemisfério não tratado do cérebro permanece sem manutenção.
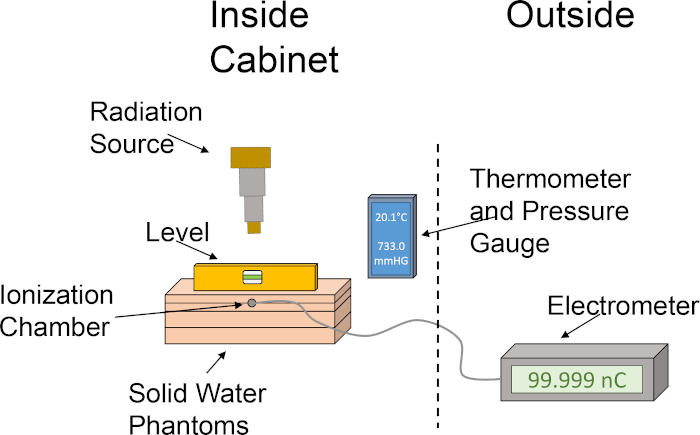
Figura 1: Configuração áspera da câmara de ionização e do fantasma da água configurado para determinação da saída de dose. O pictograma ilustra uma configuração básica utilizando os vários componentes necessários para a dosimetria usando uma câmara de ionização e fantasmas de água sólida dentro do armário do irradiador. Clique aqui para ver uma versão maior desta figura.

Figura 2: Geração de uma curva de calibração usando filme radiocrômico. (A) Mudança de cor representativa do filme radiocrômico com dose crescente. Canto superior esquerdo (0 cGy); inferior direito (2000 cGy). (B) Curva potencial de calibração de filme radiocrômico comparando densidade óptica líquida e dose. Clique aqui para ver uma versão maior desta figura.
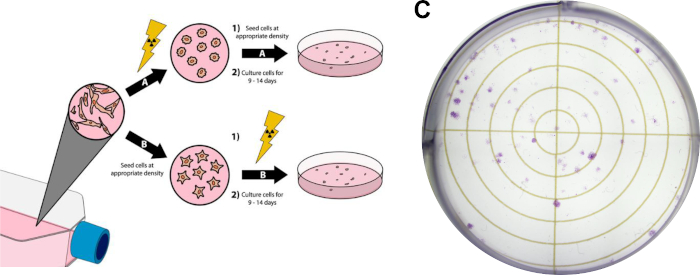
Figura 3: Ensaio clonogênico de células cancerosas. O tratamento de radiação das células pode ser feito antes do revestimento em seis placas de poço/placas de petri(A),ou depois(B). No painel(C),uma imagem representativa é exibida de um ensaio clonogênico bem sucedido com células cancerígenas de mama MDA-MB-231 após seguir a Seção de Protocolo 3. Clique aqui para ver uma versão maior desta figura.
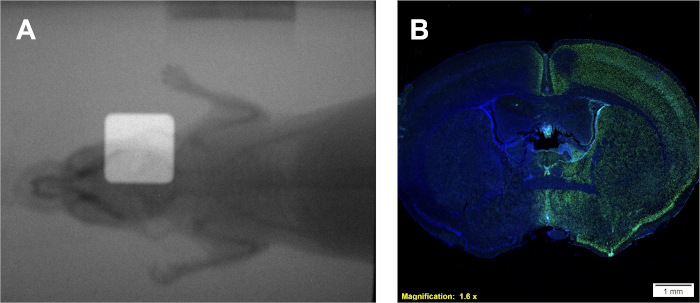
Figura 4: Utilização de radiogramas sobrepostos duplos para posicionamento (se disponível) e coloração imunohistoquímica γH2AX positiva para confirmação da deposição da dose. (A) O representante sobrepõe radiogramas representando a colocação do feixe de radiação. (B) Resultados representativos indicando deposição de dose para o hemisfério direito, como demonstrado pelo aumento da intensidade γH2AX. Clique aqui para ver uma versão maior desta figura.
| Fator de Correção | Explicação | |
| Nκ | Fator de calibração do kerma de ar | |
| [(μen/ρ)War] água | Ração dos coeficientes de absorção de energia de massa da água para o ar; aproximadamente 1,05 | |
| Pq,Cham | Correção contábil para tronco de câmara afetando perterbtação de fluência de fótons por câmara; aproximadamente 1.022 | |
| Baása p | Correção contábil para câmara de proteção de baia; valor de 1, como câmara é impermeável | |
| Ppol | Fator de correção contabilizando a polaridade; determinado no Protocolo 1 | |
| Pion | Fator de correção contabilizando a recombinação de íons; determinado no Protocolo 1 | |
| PTp | Fator de correção acocunting para temerpature e pressão no dia do experimento; determinado no Protocolo 1 | |
Tabela 1: Fatores de correção necessários para a determinação da taxa de dose no Protocolo 1.
| Dose | N |
| 0.5 | 3 |
| 1 | 3 |
| 2 | 3 |
| 3 | 3 |
| 4 | 3 |
| 6 | 3 |
| 8 | 3 |
| 10 | 3 |
| 12* | 3 |
| 15* | 3 |
| 20* | 3 |
| * Apenas necessário para doses superiores a 10 para experimentos individuais. | |
Tabela 2: Doses a serem utilizadas na geração de curva de calibração de filme radiocrômico.
Discussão
O protocolo acima descreve uma abordagem fácil de usar para a dosimetria de radiação, determinação de valores α/β em linhas de células cancerosas, e um breve exemplo de uma abordagem para irradiação em um modelo pré-clínico de metástase cerebral do câncer de mama. Esses métodos podem ser usados para estudar qualquer modelo de câncer e não se limitam apenas à metástase cerebral do câncer de mama. Nesta seção discutiremos as complexidades relevantes subjacentes aos experimentos de radioterapia pré-clínicos.
A dosimetria envolve duas partes: 1) calibrar a saída com uma câmara de agricultores, de modo que a taxa de dose da unidade de raio-x seja estabelecida, e 2) preparar um sistema prático de medição de dosimetria usando filme radiocrômico. No que diz respeito à calibração da saída, o TG-61 fornece um método reprodutível na água. O protocolo aqui utiliza água sólida Gammex RMI 457, conforme recomendado pela XStrahl, fabricante do irradiador. Embora a dosimetria relativa (perfis ou curvas de dose de profundidade normalizada para dose máxima) analise com água sólida, concorda em melhor que 1% com a da água, há uma diferença de cerca de 3 a 4% em dose absoluta devido a um maior coeficiente de absorção de energia de massa para água sólida em comparação com a água. No entanto, como todas as instalações do sistema XStrahl utilizam o protocolo de água sólida para calibração de saída, não corrigimos essas diferenças. Conhecer a saída permite o cálculo do tempo de exposição necessário para entregar uma dose desejada. Colocar o filme na mesma configuração que a câmara do fazendeiro nos permite entregar doses conhecidas para o filme. A varredura do filme fornece densidades ópticas. A dose para o filme pode então ser grafada contra a densidade óptica líquida correspondente (diferença na densidade óptica após e antes da exposição). Isso produz uma curva de calibração de filme. Quando mudamos as configurações experimentais, a taxa de dose nessa situação pode mudar, uma vez que a taxa de dose depende do tamanho do campo, profundidade e do material irradiado. Expor o filme com a configuração experimental nos fornece uma densidade óptica líquida, e usando a curva de calibração do filme, podemos então determinar a dose correspondente. Dividindo esta dose quando o filme foi irradiado, nós temos a taxa de dose. Esta taxa de dose pode então ser usada para calcular o tempo de exposição para fornecer uma dose desejada para a configuração experimental dada. O protocolo descrito acima lida com várias nuances associadas à dosimetria do filme. Por exemplo, após a exposição, o filme requer aproximadamente 24 horas para que as reações químicas na camada ativa do filme sejam virtualmente completas. Não esperar por esse tempo levará a uma densidade óptica menor.
Para que qualquer estudo tenha dosimetria reprodutível é importante conhecer e entender vários dos elementos-chave de um determinado irradiador. Em particular, é fundamental conhecer e detalhar para outros pesquisadores a make e o modelo do irradiador utilizado, o tipo de origem (raio-x, radioativo, etc.), energia, camada de meio valor, tamanho do campo, fonte à superfície e fonte para distâncias isocentrais, tamanho do material irradiado, atenuação antes e backscatter após o material irradiado, taxa de dose específica do experimento, esquema de fração, equipamento de dosimetria exato utilizado, e o protocolo de dostry utilizado. Todos esses pontos de informação são o que descrevem coesivamente a qualidade do feixe de um determinado irradiador antes de entregar uma dose a qualquer animal ou célula19. Outro ponto de informação pertinente deste protocolo e outros é que a taxa de dose alcançada no Protocolo 1 é simplesmente a saída do irradiador que está sendo utilizado. Para qualquer experimento, é importante definir a taxa de dose para essa configuração específica(Protocolo 4)em comparação com uma curva de calibração de filme radiocrômico gerada(Protocolo 2).
A experimentação in vitro fornece detalhes importantes sobre o comportamento radiobiológico das linhas celulares cancerosas. Ensaios de sobrevivência de células clonogênicas in vitro estimam e quantificam com precisão a radiosensibilidade inerente de uma linhacelular 20,auxiliando no desenho de cronogramas de fracionamento em experimentos celulares ou pequenos21subsequentes . Especificamente, esses ensaios aproximam valores para os parâmetros α e β que são usados no modelo linear-quadrático para prever a morte celular em resposta à radioterapia de acordo com a equação:
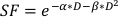 (Equação 9)
(Equação 9)
onde sf é a fração sobrevivente de células clonogenicamente viáveis, D é dose de radiação em Gy, e α e β são parâmetros instalados22. A razão α/β fornece uma medida inerente à radiocessibilidade celular, com valores mais elevados correlacionando-se com o aumento da sensibilidade de uma linhacelular 22. Como essa relação funcional não é linear em relação à dose, os efeitos biológicos de um esquema de fracionamento de radioterapia não estão apenas relacionados com a dose total entregue, mas também com o número e tamanho das frações23. A dose biológica efetiva (BED) é uma medida da verdadeira dose biológica entregue a um tecido e permite a comparação direta de diferentes regimes fracionados24,25. A equação BED requer apenas uma estimativa de α/β, e é exibida abaixo:
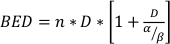 (Equação 14)
(Equação 14)
onde n é o número de frações de dose D. Ensaios de sobrevivência celular clonogênica estimam α/β e facilitam a comparação direta dos esquemas de fracionamento de radioterapia através da equação BED. Conclusões incorretas podem ser tiradas em relação a uma resposta de tecido ou órgão à radioterapia (ou combinações de radioterapia com outras modalidades) se o LEIto nos grupos de tratamento não for equitativo dentro ou entre experimentos. Por exemplo, 2 frações de 10 Gy em comparação com 4 frações de 5 Gy não produzem o mesmo BED, e assim esses esquemas de dosagem não podem ser diretamente comparados em termos de resposta biológica. A equação bed, embora imperfeita devido a limitações inerentes ao modelo linear-quadrático, estima de forma confiável efeitos equitativos para uma ampla gama de condições experimentais de tratamento24,25.
Os ensaios de sobrevivência de células clonogênicas desempenham claramente um papel importante no estudo dos efeitos da radioterapia em modelos de câncer, mas a experimentação in vitro oferece uma série de opções adicionais para explorar ainda mais detalhes mecanicistas da radiobiologia celular cancerosa. Modificações simples do ensaio de sobrevivência celular clonogênica foram utilizadas para determinar os modos de ação para algumas quimioterapias radiosensibilizantes, como paclitaxel ou etoposide26,27. Outras opções experimentais in vitro incluem estudos de imunocitoquímica para examinar vias específicas de reparo celular, como γ-H2AX e/ou coloração de 53BP1 para reparo de quebra de DNA de dupla laba28. Esses experimentos podem ser de particular interesse ao comparar a radioterapia como uma única modalidade com terapias combinadas, especialmente quando se sonda detalhes mecanicistas para uma determinada linha celular. Outras opções experimentais incluem medidas de citocina para examinar o papel inato da resposta inflamatória de uma célula à irradiação ou análises do modo de morte celular (ou seja, apoptose, necrose, catástrofe mitótica, etc.) sob diferentes condições terapêuticas29,30,31. Esse tipo de experimentação pode complementar ou substituir a experimentação animal e fornecer uma compreensão mais completa da radiobiologia de uma linha de células cancerosas. Independentemente da escolha de experimentos adicionais para realizar, um ensaio padrão de sobrevivência celular clonogênica, conforme descrito no protocolo 3, é uma importante avaliação radiobiológica inicial de uma linha celular.
Ensaios clonogênicos e dosimetria de radiação fornecem ao pesquisador um meio de planejar precisamente experimentos para se assemelhar mais diretamente a cenários clínicos. Com a adição de pequenos modelos de roedores pré-clínicos, é possível estudar a resposta apenas à radiação ou no contexto de um plano de tratamento in vivo. Antes do uso de animais, é importante determinar a saída relativa da dose da configuração específica se ela difere da configuração utilizada para determinação da saída da dose32,33. Quando se trata de determinar uma taxa de dose para tamanhos de campo de <10 mm, o uso de uma câmara de ionização torna-se menos preciso devido ao alinhamento dentro de um campo pequeno e efeitos parciais de média de volume33. O uso de filme radiocrômico para determinar a saída em combinação com experimentos imunohistoquímicos in vivo tem sido usado para determinar a saída e a deposição de doses nos últimos16,34,35,36,37,38.
Divulgações
Os autores não têm revelações para fazer.
Agradecimentos
Os autores gostariam de agradecer às Instalações de Imagem de Microscópio e Modelos Animais da WVU pelo uso de seus equipamentos apoiados pelo número de subvenção P20GM103434. Além disso, este trabalho foi apoiado pelo número de subvenção P20GM121322 do Instituto Nacional de Ciências Médicas Gerais, pelo número de subvenção do Instituto Nacional de Câncer F99CA25376801, e pelo Mylan Chair Endowment Fund.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetic acid, glacial | Sigma-Aldrich | A6283 | This or comparable glacial acetic acid products are acceptable. |
| Crystal Violet | Sigma-Aldrich | C6158 | This or comparable crystal violet products are acceptable. |
| Digital Baraometer | Fisher Scientific | 14-650-118 | For pressure and temperature measurements. |
| Electrometer | Standard Imaging | CDX 2000B | Calibrated by an ADCL; Need correction factor, Pelec |
| Film | Gafchromic | EBT3 Film | Comes in sheets of 25; calibration films and experimental films must come from same set |
| Ionization Chamber | Farmer | PTW TN30013 | Calibrated by an ADCL @ two calibration points |
| Methanol | Sigma-Aldrich | 34860 | This or comparable methanol products are acceptable. |
| Photo Scanner | Epson | Perfection V700 | Equivalent scanners are V800, V10000, V11000, V12000 |
| XenX | Xstrahl | NA | Irradiator used. |
Referências
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA: A Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Allen, C., Her, S., Jaffray, D. A. Radiotherapy for Cancer: Present and Future. Advanced Drug Delivery Reviews. 109, 1-2 (2017).
- Delaney, G., Jacob, S., Featherstone, C., Barton, M. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines. Cancer. 104 (6), 1129-1137 (2005).
- Chen, H. H. W., Kuo, M. T. Improving radiotherapy in cancer treatment: Promises and challenges. Oncotarget. 8 (37), 62742-62758 (2017).
- Le, Q. T., Shirato, H., Giaccia, A. J., Koong, A. C. Emerging Treatment Paradigms in Radiation Oncology. Clinical Cancer Research. 21 (15), 3393-3401 (2015).
- Baumann, M., et al. Radiation oncology in the era of precision medicine. Nature Reviews Cancer. 16 (4), 234-249 (2016).
- Leeman, J. E., et al. Patterns of Treatment Failure and Postrecurrence Outcomes Among Patients With Locally Advanced Head and Neck Squamous Cell Carcinoma After Chemoradiotherapy Using Modern Radiation Techniques. JAMA Oncology. 3 (11), 1487-1494 (2017).
- Coy, P., et al. Patterns of failure following loco-regional radiotherapy in the treatment of limited stage small cell lung cancer. International Journal of Radiation Oncology - Biology - Physics. 28 (2), 355-362 (1994).
- Achrol, A. S., et al. Brain metastases. Nature Reviews Disease Primers. 5 (1), 5(2019).
- Ma, C. M., et al. AAPM protocol for 40-300 kV x-ray beam dosimetry in radiotherapy and radiobiology. Medical Physics. 28 (6), 868-893 (2001).
- Wang, Y. F., Lin, S. C., Na, Y. H., Black, P. J., Wuu, C. S. Dosimetric verification and commissioning for a small animal image-guided irradiator. Physics in Medicine and Biology. 63 (14), 145001(2018).
- Wack, L., et al. High throughput film dosimetry in homogeneous and heterogeneous media for a small animal irradiator. Physical Medicine. 30 (1), 36-46 (2014).
- Devic, S. Radiochromic film dosimetry: past, present, and future. Physical Medicine. 27 (3), 122-134 (2011).
- Franken, N. A., Rodermond, H. M., Stap, J., Haveman, J., van Bree, C. Clonogenic assay of cells in vitro. Nature Protocols. 1 (5), 2315-2319 (2006).
- Ford, E. C., et al. Localized CT-guided irradiation inhibits neurogenesis in specific regions of the adult mouse brain. Radiation Research. 175 (6), 774-783 (2011).
- Zarghami, N., et al. Half brain irradiation in a murine model of breast cancer brain metastasis: magnetic resonance imaging and histological assessments of dose-response. Radiation Oncology. 13 (1), 104(2018).
- Nwafor, D. C., et al. Loss of tissue-nonspecific alkaline phosphatase (TNAP) enzyme activity in cerebral microvessels is coupled to persistent neuroinflammation and behavioral deficits in late sepsis. Brain, Behavior, and Immunity. , (2019).
- Amtul, Z., Hepburn, J. D. Protein markers of cerebrovascular disruption of neurovascular unit: immunohistochemical and imaging approaches. Reviews in Neuroscience. 25 (4), 481-507 (2014).
- Draeger, E., et al. A Dose of Reality: How 20 Years of Incomplete Physics and Dosimetry Reporting in Radiobiology Studies May Have Contributed to the Reproducibility Crisis. International Journal of Radiation Oncology - Biology - Physics. 106 (2), 243-252 (2020).
- Dunne, A. L., et al. Relationship between clonogenic radiosensitivity, radiation-induced apoptosis and DNA damage/repair in human colon cancer cells. British Journal of Cancer. 89 (12), 2277-2283 (2003).
- Yang, Y., Xing, L. Optimization of radiotherapy dose-time fractionation with consideration of tumor specific biology. Medical Physics. 32 (12), 3666-3677 (2005).
- Hall, E. J., Giaccia, A. J. Radiobiology for the radiologist. Eighth edition. , Wolters Kluwer. (2019).
- van Leeuwen, C. M., et al. The alfa and beta of tumours: a review of parameters of the linear-quadratic model, derived from clinical radiotherapy studies. Radiation Oncology. 13 (1), 96(2018).
- Fowler, J. F. 21 years of biologically effective dose. British Institute of Radiology. 83 (991), 554-568 (2010).
- Jones, B., Dale, R. G., Deehan, C., Hopkins, K. I., Morgan, D. A. The role of biologically effective dose (BED) in clinical oncology. Clinical Oncology journal | The Royal College of Radiologists. 13 (2), 71-81 (2001).
- Choy, H., Rodriguez, F. F., Koester, S., Hilsenbeck, S., Von Hoff, D. D. Investigation of taxol as a potential radiation sensitizer. Cancer. 71 (11), 3774-3778 (1993).
- Ng, C. E., Bussey, A. M., Raaphorst, G. P. Inhibition of potentially lethal and sublethal damage repair by camptothecin and etoposide in human melanoma cell lines. International Journal of Radiation Biology. 66 (1), 49-57 (1994).
- Kurashige, T., Shimamura, M., Nagayama, Y. Differences in quantification of DNA double-strand breaks assessed by 53BP1/gammaH2AX focus formation assays and the comet assay in mammalian cells treated with irradiation and N-acetyl-L-cysteine. Journal of Radiation Research. 57 (3), 312-317 (2016).
- Schaue, D., Kachikwu, E. L., McBride, W. H. Cytokines in radiobiological responses: a review. Radiation Research. 178 (6), 505-523 (2012).
- Mery, B., et al. In Vitro Cell Death Determination for Drug Discovery: A Landscape Review of Real Issues. Journal of Cell Death. 10, 1179670717691251(2017).
- Galluzzi, L., et al. Molecular mechanisms of cell death recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death & Differentiation. 25 (3), 486-541 (2018).
- Felix, M. C., et al. Collimator optimization for small animal radiation therapy at a micro-CT. Z Medical Physics. 27 (1), 56-64 (2017).
- Newton, J., et al. Commissioning a small-field biological irradiator using point, 2D, and 3D dosimetry techniques. Medical Physics. 38 (12), 6754-6762 (2011).
- Wong, J., et al. High-resolution, small animal radiation research platform with x-ray tomographic guidance capabilities. International Journal of Radiation Oncology - Biology - Physics. 71 (5), 1591-1599 (2008).
- Ghita, M., et al. Small field dosimetry for the small animal radiotherapy research platform (SARRP). Radiation Oncology. 12 (1), 204(2017).
- Biglin, E. R., et al. Preclinical dosimetry: exploring the use of small animal phantoms. Radiation Oncology. 14 (1), 134(2019).
- Munoz Arango, E. T., Peixoto, J. G., de Almeida, C. E. Small field dosimetry with a high-resolution 3D scanning water phantom system for the small animal radiation research platform SARRP: a geometrical and quantitative study. Physics in Medicine and Biology. , (2019).
- Murrell, D. H., et al. Evaluating Changes to Blood-Brain Barrier Integrity in Brain Metastasis over Time and after Radiation Treatment. Translational Oncology. 9 (3), 219-227 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados