É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo de oclusão traqueal fetal transuterina em camundongos
Neste Artigo
Resumo
Diversos modelos animais de hérnia diafragmática congênita e oclusão traqueal fetal apresentam vantagens e desvantagens em relação a questões éticas, custo, dificuldade cirúrgica, tamanho, taxas de sobrevivência e disponibilidade de ferramentas genéticas. Este modelo fornece uma nova ferramenta para estudar o impacto da oclusão traqueal e do aumento da pressão luminal no desenvolvimento pulmonar.
Resumo
A oclusão traqueal fetal (TO), modalidade de tratamento estabelecida, promove o crescimento pulmonar fetal e a sobrevivência em hérnia diafragmática congênita grave (CDH). Após to, a retenção do fluido epitelial secretado aumenta a pressão luminal e induz o crescimento pulmonar. Vários modelos animais foram definidos para entender a fisiopatologia do CDH e to. Todos têm suas próprias vantagens e desvantagens, como a dificuldade da técnica, o tamanho do animal, o custo, altas taxas de mortalidade e a disponibilidade de ferramentas genéticas. Aqui, um novo modelo transuterino de murine fetal TO é descrito. Camundongos gestantes foram anestesiados, e o útero exposto através de uma laparotomia midline. A traqueia dos fetos selecionados foi amarrada com uma única sutura transuterina colocada atrás da traqueia, uma artéria carótida e uma veia jugular. A barragem foi fechada e autorizada a se recuperar. Fetos foram coletados pouco antes da parturição. A relação peso pulmonar e corporal em TO fetos foi maior do que na relação controle dos fetos. Este modelo fornece aos pesquisadores uma nova ferramenta para estudar o impacto tanto do TO quanto do aumento da pressão luminal no desenvolvimento pulmonar.
Introdução
A hérnia diafragmática congênita (CDH) ocorre em 1:2500 gestações e resulta em hipoplasia pulmonar e hipertensão pulmonar neonatal1,2,3,4,5,6. A oclusão traqueal fetal (TO) é uma terapia pré-natal estabelecida em pacientes graves de CDH envolvendo fetoscopia na 26-30ª semana gestacional em que um balão é colocado logo acima da carina e depois removido na 32ª semana gestacional. Este TO temporário induz o crescimento pulmonar fetal e melhora a sobrevivência. A Síndrome congênita da obstrução das vias aéreas altas é uma condição letal associada à hiperplasia pulmonar, que inspirou os cirurgiões a realizar a oclusão artificial da traqueia para promover a retenção do fluido epitelial secretado. Esta oclusão aumentou a pressão luminal e induziu o crescimento pulmonar7. No entanto, a oclusão deve ser revertida para permitir a maturação das células epiteliais.
Vários modelos animais de CDH e TO - ovino, coelho, rato e rato - foram desenvolvidos para entender a fisiopatologia do CDH e to. Todos têm suas próprias vantagens e desvantagens, como a dificuldade da técnica, o tamanho do animal, o custo, altas taxas de mortalidade e a disponibilidade de ferramentas genéticas. Embora a técnica cirúrgica utilizada para o modelo de ovino seja muito semelhante à usada em humanos e possa ser revertida, as principais desvantagens deste modelo são as despesas do animal, o longo período gestacional e o número limitado de cirurgias possíveis. O modelo coelho tem um período gestacional mais curto e é mais barato que o modelo de ovelhas. No entanto, o modelo coelho é irreversível8,9. O modelo murino tem o menor custo, o maior número de fetos por gravidez, o genoma mais caracterizado e ferramentas amplamente disponíveis para análises celulares e moleculares. No entanto, uma desvantagem fundamental é a falta de reversibilidade do TO, impedindo a compreensão completa do impacto do TO. Aqui, é apresentado um método que combina todas as vantagens dos modelos mencionados anteriormente e cria um modelo fácil, potencialmente reversível e minimamente invasivo de roedor TO.
Protocolo
Todos os experimentos foram cumpridos com o Guia Nacional de Atenção e Uso de Animais de Laboratório (NIH Publications No. 80023, revisado em 1978). O procedimento foi aprovado com o protocolo IACUC #2016-0068 pelo Comitê Institucional de Cuidados e Uso de Animais da Fundação de Pesquisa Infantil de Cincinnati.
1. Preparação
- Para acasalar os ratos C57BL/6 (C57BL/6) com idade, coloque-os na mesma gaiola às 18:00.m. e separe-os às 9:00 da .m. no dia seguinte.
- Para determinar o dia 0 (E0), olhe para o plugue vaginal, que tem uma zona externa homogênea ligada à parede vaginal e uma zona interna que é fibrosa e inclui alguns espermatozoides que formam massas emaranhadas misturadas com as fibras do material plugue.
- Regissuor dos ratos no momento do acasalamento.
- Repesar os camundongos no E10 para garantir a gravidez contínua.
- Realizar a cirurgia em E16,5 (estágio canalicular precoce).
- Esterilize os instrumentos que serão utilizados durante a cirurgia: tesoura, porta agulha, fórceps, grampos e facas cirúrgicas e alças.
- Pré-aqueça a plataforma de cirurgia a 24 °C e prepare soro fisiológico quente (24 °C) antes da cirurgia.
- Crie um ambiente quente para recuperação e deixe comida molhada dentro da gaiola para a alimentação precoce.
- Fique com os animais operados até que eles possam se alimentar sozinhos.
- Mantenha os ratos operados sozinhos em suas gaiolas individuais após a cirurgia.
2. Anestesia
- Aplique 0,1 mg/kg de buprenorfina nas barragens grávidas 1h antes do procedimento.
- Use inalado 5 mL/h de isoflurane para indução e 2 mL/h continuamente durante o procedimento para anestesia.
- Monitore os movimentos dos queixos dos camundongos grávidas.
3. Laparotomia
- Limpe a superfície abdominal com álcool e povidone-iodo. Mantenha condições estéreis durante toda a operação.
- Realize uma incisão vertical para a laparotomia de barragens grávidas. Corte todas as camadas separadamente.
- Identifique chifres uterinos de cada lado.
- Determine os fetos candidatos para a cirurgia.
NOTA: Não opere os fetos mais próximos da vagina. - Opere em dois fetos em cada chifre uterino se houver um número par de fetos em cada lado (4 na maior parte do tempo), e em 1 feto em cada chifre uterino se houver um número ímpar do útero (3 na maioria das vezes).
4. Oclusão traqueal
- Use óculos de ampliação de 2,5x para visualização.
- Posicione o chifre uterino de forma transversal.
- Leve os filhotes, voltados para cima, entre dois dedos usando os olhos dos filhotes e a cauda como guia para posicionar o feto.
- Aplique pressão suave na cabeça do filhote para permitir a extensão da cabeça e, portanto, visualização do pescoço.
- Use uma sutura de polipropileno 6.0 com uma agulha atraumática para realizar TO (Figura 1). Mantenha a placenta ao lado e longe dos pontos de entrada e saída da agulha.
- Insira a agulha transversalmente através do lado do útero longe da placenta através da parte 1/3 anterior do pescoço.
- Mova a agulha suavemente até a linha média do pescoço e direcione-a para a parte anterior, em seguida, saia do pescoço entre a traqueia e em frente à bainha carótida e no útero.
- Ateie a sutura, tomando o cuidado de manter a integridade das membranas e da parede uterina, e mantenha o cordão umbilical seguro durante o nó.
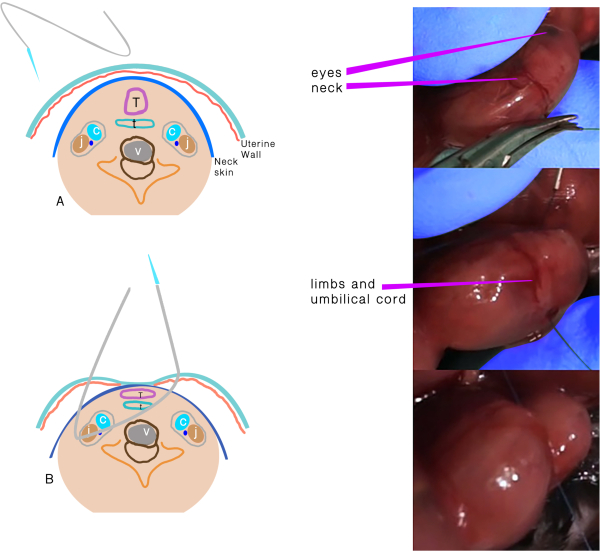
Figura 1: Oclusão traqueal. (A) A sutura transuterina que passa pelo pescoço. (B) Representação esquemática das estruturas após a sutura passar e antes do nó. Abreviaturas: C = Artéria carótida; J = Veia jugular; T =Traquea; E = Esôfago; V = Vértebra. Clique aqui para ver uma versão maior desta figura.
5. Fechamento da parede abdominal
- Substitua o chifre uterino no abdômen.
- Injete 2 mL de soro estéril quente na cavidade peritoneal antes do fechamento.
- Coloque uma sutura de poliglactina de 5/0 para fechar a parede abdominal e feche a pele com uma sutura de seda não funcionando.
- Aplique 0,1 mg/kg de buprenorfina intraperitonealmente para analgesia, e permita a recuperação da barragem em uma incubadora quente.
6. Colheita
- Aplique anestesia na represa grávida e colde todos os fetos em E18,5 por cesariana.
- Verifique a viabilidade dos fetos observando os movimentos dos fetos.
- Use pelo menos duas técnicas diferentes para a eutanásia: insuflar dióxido de carbono e luxação cervical.
- Remova os corpos de acordo com a regulação do laboratório veterinário.
- Pesar todos os fetos.
- Realize uma incisão vertical no tórax para toracotomia para remover os pulmões.
- Dissecar os pulmões dos embriões e pesá-los para calcular a razão total de peso pulmonar/corporal (LBWR = (peso pulmonar esquerdo + peso pulmonar direito)/peso corporal x100).
7. Histologia
- Congele os tecidos em nitrogênio líquido, composto de temperatura de corte ideal e gelo seco.
- Corte as amostras em seções de 10 μm usando um criostat e monte-as em lâminas revestidas de poli-lise.
- Asse os slides a 60 °C durante a noite, e manche os slides assados com hematoxilina e eosina antes de montá-los para aquisição de imagem em ampliação de 10-20x usando um microscópio widefield.
8. Processamento de tecidos para análises de proteínas e DNA
- Congele os pulmões fetais dissecados e homogeneize-os em 300 μL de tampão de ensaio radioimunoprecipitação. Centrífuga a 4 °C por 5 min a 18.000 × g.
- Extrair e quantificar proteína, DNA e RNA10,12.
Resultados
Este estudo analisou 37 fetos: 20 (54,1%) como TO vs. 17 (45,9%) como controle. Como a traqueia não poderia ser ocluída em 4 fetos do grupo TO, elas foram excluídas do estudo. Não houve diferença significativa na mortalidade em ambos os grupos: 4 fetos (25%) no grupo TO e 2 fetos (12%) no grupo controle (p=0,334, razão de odds (OR) 2,5, intervalo de confiança de 95% (IC) 0,39-16,05). A relação peso corporal médio, peso pulmonar e peso pulmonar/corporal (LBWR) foi maior no grupo ...
Discussão
Este método descreve um procedimento cirúrgico de oclusão traqueal fetal em camundongos e seu impacto no desenvolvimento pulmonar. Existem algumas etapas críticas no protocolo que devem ser cuidadosamente realizadas para o sucesso da TO. O calor da plataforma em que a cirurgia ocorre e o soro fisiológico introduzido na cavidade peritoneal é crucial para a progressão da gravidez. Além disso, uma leve pressão deve ser aplicada na cabeça dos filhotes para garantir a exposição do pescoço.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Esta pesquisa não recebeu nenhuma subvenção específica de agências de fomentamento nos setores público, comercial ou sem fins lucrativos. Todos os autores fizeram contribuições substanciais para a concepção e elaboração do estudo, aquisição, análise e interpretação dos dados, elaboração do artigo e revisão para conteúdo intelectual importante e aprovação final da versão a ser submetida. Os autores agradecem a Can Sabuncuoğlu por seus esforços gentis na produção da obra de arte da técnica cirúrgica.
Materiais
| Name | Company | Catalog Number | Comments |
| Buprenorphine | Par Pharmaceutical | NDC 42023-179-05 | For regional anesthesia |
| Isoflurane | Halocarbon Life Sciences | NDC 66794-017-25 | For general anesthesia |
| Magnification glasses | USA Medical-Surgical | SLR-250LBLK | At least 2.5x |
| Nikon 90i microscope | Nikon | 3417 | Motorized Fluorescence |
| Nucleospin Tissue Kit | Macherey-Nagel, Düren, Germany | 740952.5 | DNA isolation |
| Pierce BCA Protein Assay Kit | Thermo Fisher, IL, USA | 23225 | Protein quantification |
| Polyglactin suture | Ethicon | VCP451H | 4-0, 24 mm, cutting |
| Polylysine slides | VWR | 48382-117 | Microscope adhesion slides |
| Polypropylene suture | Ethicon | Y432H | 6-0, 13 mm 1/2c Taperpoint |
| RIPA buffer | Sigma-Aldrich, Missouri, USA | R0278-50ml | Protein isolation |
| Silk suture | Ethicon | VCP682G | 4-0, 24 mm, cutting |
| Trizol | Invitrogen | 15596026 | RNA isolation |
Referências
- Wright, N. J. Global PaedSurg Research Collaboration. Management and outcomes of gastrointestinal congenital anomalies in low, middle and high income countries: protocol for a multicentre, international, prospective cohort study. BMJ Open. 9, 030452 (2019).
- Aydin, E. Current approach for prenatally diagnosed congenital anomalies that requires surgery. Turkish Clinics Journal of Gynecology and Obstetrics. 27, 193-199 (2016).
- Nolan, H., et al. Hemorrhage after on-ECMO repair of CDH is equivalent for muscle flap and prosthetic patch. Journal of Pediatric Surgery. 54 (10), 2044-2047 (2019).
- Aydin, E., et al. Congenital diaphragmatic hernia: the good, the bad, and the tough. Pediatric Surgery International. 35 (3), 303-313 (2019).
- Aydın, E., Özler, O., Burns, P., Lim, F. Y., Peiró, J. L. Left congenital diaphragmatic hernia-associated musculoskeletal deformities. Pediatric Surgery International. 35 (11), 1265-1270 (2019).
- Aydın, E., et al. When primary repair is not enough: a comparison of synthetic patch and muscle flap closure in congenital diaphragmatic hernia. Pediatric Surgery International. 36 (4), 485-491 (2020).
- Wilson, M., Difiore, J. W., Peters, C. A. Experimental fetal tracheal ligation prevents the pulmonary hypoplasia associated with fetal nephrectomy: Possible application for congenital diaphragmatic hernia. Journal of Pediatric Surgery. 28 (11), 1433-1440 (1993).
- Mudri, M., et al. The effects of tracheal occlusion on Wnt signaling in a rabbit model of congenital diaphragmatic hernia. Journal of Pediatric Surgery. 54 (5), 937-944 (2019).
- Khan, P. A., Cloutier, M., Piedboeuf, B. Tracheal occlusion: a review of obstructing fetal lungs to make them grow and mature. American Journal of Medical Genetics. Part C, Seminars in Medical Genetics. 145 (2), 125-138 (2007).
- Chomczynski, P. A reagent for the single-step simultaneous isolation of RNA, DNA and proteins from cell and tissue samples. Biotechniques. 15 (3), 532-537 (1993).
- Beurskens, N., Klaassens, M., Rottier, R., De Klein, A., Tibboel, D. Linking animal models to human congenital diaphragmatic hernia. Birth Defects Research Part A: Clinical and Molecular Teratology. 79 (8), 565-572 (2007).
- Varisco, B. M., et al. Excessive reversal of epidermal growth factor receptor and ephrin signaling following tracheal occlusion in rabbit model of congenital diaphragmatic hernia. Molecular Medicine. 22, 398-411 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados