É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliando interações proteicas em células vivas com emissão sensibilizada por FRET
Neste Artigo
Erratum Notice
Resumo
A Transferência de Energia de Ressonância de Förster (FRET) entre duas moléculas de fluoróforo pode ser usada para estudar as interações proteicas na célula viva. Aqui, um protocolo é fornecido sobre como medir o FRET em células vivas, detectando a emissão sensibilizada do aceptor e a têmpera da molécula doadora usando microscopia confocal de varredura a laser.
Resumo
Förster Resonance Energy Transfer (FRET) é a transferência de energia sem radiação de um doador excitado para uma molécula aceitadora e depende da distância e orientação das moléculas, bem como da extensão da sobreposição entre os espectros de emissão do doador e absorção do aceitador. FRET permite estudar a interação de proteínas na célula viva ao longo do tempo e em diferentes compartimentos subcelulares. Diferentes algoritmos baseados em intensidade para medir FRET usando microscopia têm sido descritos na literatura. Aqui, um protocolo e um algoritmo são fornecidos para quantificar a eficiência do FRET com base na medição da emissão sensibilizada do aceptor e da têmpera da molécula doadora. A quantificação do FRET ratiométrico na célula viva não requer apenas a determinação do crosstalk (transbordamento espectral ou sangria) das proteínas fluorescentes, mas também a eficiência de detecção da configuração microscópica. O protocolo fornecido aqui detalha como avaliar esses parâmetros críticos.
Introdução
A análise baseada em microscopia da Transferência de Energia por Ressonância de Förster (FRET) permite a avaliação das interações entre proteínas em células vivas. Ele fornece informações espaciais e temporais, incluindo informações sobre onde na célula e em qual compartimento subcelular a interação ocorre e se essa interação muda ao longo do tempo.
Theodor Förster lançou as bases teóricas do FRET em 19481. FRET é uma transferência de energia sem radiação de um doador excitado para uma molécula aceitadora e depende da distância das moléculas e da orientação relativa de seus dipolos de transição, bem como da sobreposição entre os espectros de emissão e absorção do doador e do aceitador. A taxa de transferência de energia é inversamente proporcional à sexta potência da distância doador-aceitador. Assim, o FRET pode ser usado para medir a proximidade molecular na faixa de 1-10 nm.
O FRET compete com outros processos de desexcitação da molécula doadora e resulta na chamada extinção do doador e na emissão sensibilizada do aceitador. A têmpera de doadores é uma redução do número de fótons de doadores emitidos, enquanto a emissão sensibilizada é um aumento nos fótons aceptores emitidos. Muitas análises microscópicas de FRET usam medidas de intensidade de fluorescência, incluindo fotobranqueamento do aceitador 2, fotobranqueamento do doador2 ou fotobranqueamento sensibilizado pelo FRET do aceitador3.
Aqui, um protocolo experimental passo-a-passo e um algoritmo matemático são apresentados para quantificar o FRET usando a têmpera do doador e a emissão sensibilizada pelo aceitador4,5, um método muitas vezes referido como FRET ratiométrico. Muitos protocolos sobre como aproximar a emissão sensibilizada têm sido publicados, poucos quantificaram a eficiência absoluta do FRET 6,7,8,9. A quantificação das eficiências de FRET na célula viva requer a determinação (i) do crosstalk (transbordamento espectral ou sangria) das proteínas fluorescentes e, também (ii) da eficiência de detecção da configuração microscópica. Embora o crosstalk possa ser avaliado por células de imagem que expressam apenas um dos fluoróforos, a avaliação da eficiência relativa de detecção da fluorescência do doador e do aceitador é mais complicada. Requer o conhecimento de, pelo menos, a razão entre o número de moléculas doadoras e aceitadoras que dão origem aos sinais medidos. O número de fluoróforos expressos em células vivas varia, no entanto, de célula para célula e é desconhecido. O chamado fator de α caracteriza as forças relativas do sinal de uma única molécula excitado doador e aceitador. O conhecimento do fator é um pré-requisito para medições quantitativas de FRET ratiométrico em amostras com proporções variáveis de moléculas aceitador-doador, conforme encontrado durante imagens de células vivas com proteínas fluorescentes. O uso de uma proteína de fusão doador-aceptor 1 para 1 como sonda de calibração permite a determinação do fator α e também serve como um controle positivo. Esta sonda geneticamente acoplada é expressa por células em quantidades totais desconhecidas, mas em uma quantidade relativa fixa e conhecida de um-para-um. O protocolo a seguir estabelece como construir a sonda 1 para 1 e como usá-la para quantificação da eficiência do FET. Uma planilha que inclui todas as fórmulas pode ser encontrada no suplemento e pode ser usada pelos leitores para inserir suas próprias medidas nas respectivas colunas, conforme descrito abaixo.
Embora o protocolo utilize o par doador/aceitador GFP-Cherry, a abordagem apresentada pode ser realizada com qualquer outro par FET. O Arquivo Suplementar 1 fornece detalhes sobre pares ciano-amarelo.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Construção do plasmídeo
- Para gerar a sonda de fusão eGFP-mCherry1, use um vetor de expressão de células de mamíferos N1 (ver Tabela de Materiais) com mCherry110 inserido usando os locais de restrição AgeI e BsrGI.
- Utilizar os seguintes oligonucleótidos para amplificar a eGFP11 sem um códon de paragem como fragmento de SalI-BamHI : N-terminal primer 5'-AAT TAA CAG TCG ACG ATG GTG AGC AAG GGC GAG G 3' e C-terminal primer 5'-AAT ATA TGG ATC CCG CTT GTA CAG CTC GTC CAT GC 3'.
- Insira este fragmento de SalI-BamHI no local de clonagem múltipla do vetor N1 para introduzir o ligador RNPPV (cinco aminoácidos) entre a proteína fluorescente verde e vermelha.
NOTA: Este ligador produz uma eficiência média de FRET para o par doador-aceitador GFP-Cherry de cerca de 0,25 -0,3 (Figura 1A). A escolha de ligadores rígidos12 e helicoidais13 de comprimentos variados para escalar as eficiências de FRET medidas foi discutida em outro lugar, mas não é necessária para o nosso propósito da proteína de fusão. Daqui para frente, para simplificar, chamaremos as proteínas fluorescentes de "GFP" e "Cherry".
2. Cultura celular e transfecção
- Use qualquer linhagem celular, por exemplo, células NRK, para experimentos de FRET em meios, por exemplo, o meio de águia modificado de Dulbecco (DMEM), sem vermelho fenol, para reduzir a fluorescência de fundo. Pela mesma razão, o uso de tripsina livre de vermelho fenol é aconselhável.
- Uma vez que as células são 80% confluentes, desprenda as células com 1 mL de tripsina-EDTA a 0,05%, conte o número de células em suspensão usando uma câmara de Neubauer e semeie cerca de 10.000 células por poço de um vidro de cobertura com câmara de 8 poços; alternativamente, a partir de uma cultura de células confluentes cultivadas em balão T25, utilizar 1 gota de suspensão celular de uma pipeta de 2 ml ou 3 gotas de uma suspensão celular de 5 ml de uma cultura confluente cultivada num balão de cultura de 12,5 células T.
- Cultivar células em câmaras de 8 poços (0,8 cm 2 / poço) com vidro de cobertura #1.0 para microscopia de células vivas de fluorescência em condições padrão de cultura celular (37°C e 5% de CO2).
- 24 h após o chapeamento transfectar as células usando um meio de transfecção apropriado comercialmente disponível (ver Tabela de Materiais), com GFP, Cereja, GFP / mistura de cereja (mistura 1:1, ou seja, 0,8 μg e 0,8 μg de GFP e DNA plasmídico de cereja) e a quimera GFP-Cherry.
- Para transfecção, use 5 μL do reagente de transfecção em 45 μL de DMEM e 1,6 μg de DNA plasmídico. Mexa mexendo suavemente o tubo de microcentrífuga.
- Após 15 min de incubação da mistura à temperatura ambiente, adicionar 1-2 μL da mistura de reagente de transfecção a cada poço da lâmina de câmara de 8 poços. Devolva o vidro da tampa com câmara à incubadora.
- Deixe transcorrer 20 h após a transfecção antes da imagem de células vivas, para permitir a expressão adequada de proteínas fluorescentes, enovelamento e maturação, especialmente do fluoróforo vermelho.
3. Imagem FRET
- Imagem de células transfectadas numa câmara ambiente humidificada e aquecida a 37 °C. Para tamponar o meio celular em pH fisiológico, use o gás CO 2 ajustado para 5% de fluxo ou adicione 20 mM de HEPES para tornar o meio celular independente de CO2.
- Use um microscópio de varredura a laser confocal. Defina a excitação e a emissão da seguinte forma para otimizar o sinal e minimizar a conversa cruzada.
- Use a linha de 488 nm do laser de íons de argônio para excitar a GFP e o laser de estado sólido bombeado por diodo de 561 nm (ou laser de néon de hélio de 543 nm, dependendo das linhas de laser disponíveis) para excitar Cherry.
- Defina o seguinte no software de um microscópio confocal comercial. Defina o espelho dicroico como 488 / 561 clicando no botão usando o menu suspenso. Coletar fluorescência usando luz laser de 488 nm para excitação no canal 1 através de uma banda de emissão de 505 - 530 nm (ou 505 - 550 nm) e no canal 2 com um filtro de passagem longa >585 nm e use a luz laser de 561 nm para excitação no canal 3 com um filtro de passagem longa > 585 nm (tipo em comprimentos de onda). Filtros passa-fita, por exemplo, 590 - 650 nm ou similares também podem ser usados, que têm a vantagem de excluir o espalhamento Raman.
- Excite com os dois lasers sequencialmente e defina o modo de imagem para Switch após cada linha para que a excitação da imagem de 512 x 512 pixels se alterne após cada linha (e não após cada quadro, o que revogaria a capacidade de detectar FRET devido à difusão das proteínas rotuladas durante a gravação das imagens com excitações diferentes; clique no botão).
- Configure uma mini-série temporal de três imagens com cliques de botão para detectar se ocorre um fotobranqueamento significativo e, potencialmente, reduzir a potência do laser. O fotobranqueamento de menos de 1% é o ideal. A alta intensidade do laser também pode levar à saturação por absorção, reduzindo a eficiência aparente do FRET14. A potência do laser, até 10-20 μW medida na lente objetiva é segura de usar.
- Primeiro, células de imagem expressando a construção de fusão GFP-Cherry. Defina os parâmetros que definem a intensidade do laser integrada ao tempo por pixel em uma imagem confocal, ou seja, o tempo de permanência do pixel em microssegundos, a transmissão do filtro ajustável acousto-óptico (AOTF) em porcentagem e o zoom.
- Células de imagem usando uma objetiva de óleo de 63x e Zoom definido como 3x. Isso fornece ampliação e resolução suficientes para as células de imagem em sua totalidade. Aponte para um tamanho de pixel de 70-80 nm.
- Defina o tempo de permanência do pixel para 2-4 μs e a transmissão AOTF para o laser de 488 nm e 561 nm, de modo que as imagens tenham uma boa relação sinal-ruído sem branqueamento e sem pixels mostrando saturação de intensidade de fluorescência. É vantajoso ajustar a potência do laser de 488 e 561 de tal forma que os níveis de sinal no canal 1 e no canal 3 sejam semelhantes.
- Defina o ganho do Fotomultiplicador (modo de média) para 600-800.
- Imagem com estas configurações 15-20 células expressando a proteína de fusão GFP-Cherry. 15-20 células fornecem boas estatísticas, mantendo o tempo total de uma sessão de medição FRET limitado a algumas horas para ajudar a garantir a estabilidade da configuração microscópica.
- Imagem com as mesmas células de configurações expressando GFP, Cherry, GFP e Cherry e células não transfectadas. Procure células expressas no canal verde ou no canal vermelho, respectivamente.
- Em seguida, imagem de 15-20 células co-expressando proteínas de interesse acopladas à GFP e Cherry, respectivamente. Procurando células expressivas, evite a longa exposição das células, a fim de não branquear as proteínas fluorescentes. A cereja tem uma fotoestabilidade menor do que a GFP, e o branqueamento da cereja, o aceptor compromete a análise FRET.
NOTA: Os espectros de absorção e emissão de GFP e Cherry são apresentados na figura suplementar 1. Após a medição por 5-6 h, é aconselhável repetir a imagem de algumas células que expressam a quimera GFP-Cherry no final da sessão de imagem para documentar que a configuração permaneceu estável e as eficiências de FRET detectadas da proteína de fusão GFP-Cherry não mudaram significativamente durante o curso de uma sessão de imagem.
4. Análise de imagem para detectar eficiências absolutas de FRET usando têmpera de doadores e emissão sensibilizada
NOTA: Aqui, um guia prático passo-a-passo sobre como determinar a eficiência do FRET com o uso da planilha anexa (Arquivo Suplementar 2) é fornecido. A teoria e a derivação das equações apresentadas podem ser encontradas em detalhes em publicações anteriores 4,15,16,17. Com as configurações descritas, as seguintes intensidades de fluorescência são coletadas.
- Meça o sinal do doador I 1 no canal 1, o canal doador, com excitação de 488 nm e uma banda de emissão de 505-530 nm.
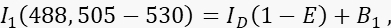
onde ID é o sinal de doador não apagado no canal 1 que seria medido na ausência de um aceitador, é a eficiência média do FRET, e B 1 o sinal de fundo médio no canal 1. - Meça o sinal aceitador I 3 no canal 3, o canal aceitador, com excitação e emissão de 561 nm a >585 nm.
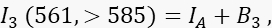
onde IA é o sinal do aceitador e B 3 o fundo no canal 3. - Meça o sinal FRET no canal 2, o canal de transferência, com excitação e emissão de 488 nm a >585 nm.
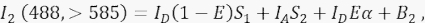
Onde, o sinal no canal 2 é uma soma de quatro componentes diferentes: (i) I D(1 - E)S 1 é o transbordamento espectral do sinal doador apagado para o canal de detecção >585 (com o fator de cross-talk S 1), (ii) IA S 2 é o sinal aceptor da excitação direta pela luz de 488 nm (com o fator de cross-talk S2), (iii) IDEα é a emissão sensibilizada do aceptor por FRET a partir da molécula doadora excitada (α será detalhada mais detalhadamente em 4.8. - 4.10.), e (iv) B2 é o sinal de fundo. - Medir as intensidades médias de fundo nos canais 1, 2, 3 em células não transfectadas ou simuladas; qualquer um deles está bem com uma diferença insignificante. Para todas as medições celulares, use a ferramenta de mão livre para delinear regiões de interesse e evitar vesículas perinucleares com aumento da autofluorescência. É importante evitar a autofluorescência significativa dessas vesículas perinucleares.
- Insira as medidas nas colunas X, Y e Z da planilha fornecida. As intensidades médias de fundo nos 3 canais são inseridas em A2, B2 e C2 da planilha do Excel (Arquivo Suplementar 2).
- Meça as intensidades médias nos canais 1, 2, 3 de células que expressam GFP ou Cherry isoladamente e insira as medições nas colunas C, D, E e N, O, P. As respectivas intensidades de fundo são subtraídas (em F, G, H e Q, R, S).
- Para calcular E, a eficiência do FET, determine os fatores de cross-talk S 1 e S2. O fator de cross-talk espectral S1 é calculado a partir de células que expressam apenas GFP
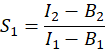
na coluna I. Insira o valor médio de S1 na célula D2 da planilha do Excel. - Calcular o fator de cross-talk espectral S2 a partir de células que expressam apenas Cherry
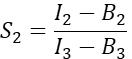
na coluna T. Insira a média de S2 na célula E2 da planilha do Excel. - Certifique-se de que o fator de α relaciona o sinal de qualquer número dado de moléculas de GFP excitadas no canal 1 com o sinal de um número igual de moléculas de cereja excitadas no canal 2, e é definido por
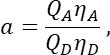

onde Q A e QD são os rendimentos quânticos de fluorescência de Cherry e GFP; ηA e ηD as eficiências de detecção da fluorescência do aceitador e do doador nos canais 2 e 1, respectivamente.
NOTA: O factor de α pode ser determinado a partir de duas amostras que expressam quantidades absolutas conhecidas de GFP e Cherry. No entanto, é impossível saber a quantidade exata de GFP e Cherry expressa em uma célula. Portanto, calculamos o fator usando células que expressam a proteína de fusão GFP-Cherry. Aqui, enquanto a quantidade absoluta ainda é desconhecida, a proporção de moléculas doadoras e aceitadoras é conhecida por ser uma. - Meça as intensidades médias nos canais 1, 2, 3 das células que expressam a proteína de fusão GFP-Cherry e insira as medições nas colunas AE, AF, AG. As intensidades de fundo são subtraídas (em AH, AI, AJ).
- Calcular o factor de α (coluna AJ) a partir das intensidades de fluorescência nos canais 1, 2 e 3 da proteína de fusão GFP-Cherry da seguinte forma:
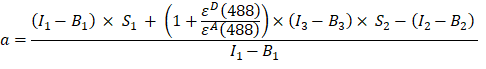
- As intensidades corrigidas pelo fundo medidas no canal 1 (I 1 - B 1), 2 (I 2 - B 2) e 3 (I 3 - B3), respectivamente, são medidas usando a quimera GFP-Cherry. O fator de conversação cruzada espectral S1 foi determinado usando apenas células que expressam GFP (ver 4.7.). εD e ε A são os coeficientes de extinção da GFP, do doador, e da Cherry, a aceitadora, a 488 nm, e podem ser determinados a partir da literatura (ε GFP = 53.000 M-1 cm-1)18 e da curva de absorção da Cherry (εCherry ≈ 5560 M-1cm 1). A proporção
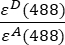 foi inserida na célula G2 da planilha do Excel. Insira o valor médio do fator α em J2.
foi inserida na célula G2 da planilha do Excel. Insira o valor médio do fator α em J2. - Utilizar o factor de α determinado para o cálculo da eficiência do FRET, E, do seguinte modo (coluna AK):
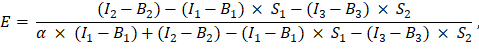
- Alternativamente, determine a eficiência do FET, E, para os controles negativos, ou seja, a co-expressão de GFP e Cherry e a expressão de GFP sozinha, adicionando as medidas dos canais 1, 2 e 3 na folha de excel na coluna AD, AE e AF sob as medições da proteína de fusão GFP-Cherry. Determine as eficiências de FRET entre as proteínas GFP e Cherry marcadas de interesse da mesma maneira.
- Determinar a intensidade do doador não extinguido, I D como (I 1 - B 1)/(1 - E), e a intensidade do aceitador como I A = I 3 - B3; esses valores são proporcionais aos níveis de expressão das proteínas marcadas.
- Determinar a razão de intensidade (Q) aceptor-doador corrigida da proteína de fusão GFP-Cherry da seguinte forma (coluna AL):

- Para outras células co-transfectadas, calcule a relação molecular aceptor-doador N A/ND da seguinte forma:
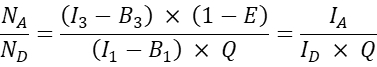
NOTA: A lógica para determinar a relação N A/N D e plotar a eficiência média do FRET celular E versus N A/N D, é que uma molécula doadora pode transferir energia para múltiplos aceitadores, enquanto uma molécula aceitadora só pode receber energia de um doador em um determinado momento. Mesmo que apenas um aceitador possa interagir com um doador por causa da estequiometria da interação, espera-se que um aumento da concentração do aceptor aumente a fração de doadores em complexo com o aceitador por causa da lei da ação de massa. Assim, para uma faixa fixa (ou estreita de) expressão do doador, a eficiência do FRET deve aumentar com o aumento de N A / ND. Ao plotar a eficiência FRET E versus N A/N D para a co-expressão de GFP e Cherry, ou seja, a sonda negativa, no entanto, um aumento em N A/N D não deve resultar em um aumento na eficiência FRET (pelo menos em concentrações de aceitador suficientemente baixas onde FRET aleatório devido à proximidade de corantes aceptores para corantes doadores não ocorre).
Access restricted. Please log in or start a trial to view this content.
Resultados
A Figura 1 mostra as imagens obtidas no canal doador, canal 1 (488, 505-530 nm), canal de transferência, canal 2 (488, >585 nm) e canal aceitador, canal 3 (561, >585 nm), respectivamente. Imagens representativas de células expressando apenas GFP, somente Cherry, co-expressando GFP e Cherry e expressando a proteína de fusão GFP-Cherry. As eficiências celulares médias de FRET calculadas em células NRK que expressam a proteína de fusão GFP-Cherry (contr...
Access restricted. Please log in or start a trial to view this content.
Discussão
O protocolo apresentado detalha o uso da sonda de calibração de proteínas fluorescentes um-para-um acoplada geneticamente para quantificação do FRET utilizando a detecção de emissão sensibilizada do aceptor e têmpera da molécula doadora por microscopia confocal. Este método pode ser aplicado para avaliar as interações proteicas no contexto fisiológico da célula viva em diferentes compartimentos subcelulares. A resolução espacial pode ser melhorada ainda mais aplicando o algoritmo apresentado para calcula...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer ao Serviço de Imagem de Neurociência da Escola de Medicina da Universidade de Stanford por fornecer equipamentos e espaço para este projeto. Esta pesquisa foi apoiada pelo financiamento intramural do Stanford Cancer Institute e da Gynecologic Oncology Division Stanford, bem como pelo GINOP-2.3.2-15-2016-00026, GINOP-2.3.3-15-2016-00030, NN129371, ANN135107 do Escritório Nacional de Pesquisa, Desenvolvimento e Inovação, Hungria.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5% Trypsin-EDTA without phenol red (10x) | Thermo Fisher Scientific | 15400054 | |
| Clontech mCherry N1 vector | Addgene | 3553 | |
| DMEM without phenol red | Thermo Fisher Scientific | 11054020 | |
| Fugene 6 | Promega | E2691 | |
| HEPES | Thermo Fisher Scientific | 15630080 | |
| LabTek 8-well chambers #1.0 | Thermo Fisher Scientific | 12565470 | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 |
Referências
- Förster, T. Zwischenmolekulare Energiewanderung und Fluoreszenz. Annal der Physik. 437, 55-75 (1948).
- Jovin, T. M., Arndt-Jovin, D. J. Luminescence digital imaging microscopy. Annual Review of Biophysics and Biophysical Chemistry. 18, 271-308 (1989).
- Mekler, V. M. A photochemical technique to enhance sensitivity of detection of fluorescence resonance energy transfer. Photochemistry and Photobiology. 59, 615-620 (1994).
- Vamosi, G., et al. Conformation of the c-Fos/c-Jun complex in vivo: A combined FRET, FCCS, and MD-modeling study. Biophysical Journal. 94 (7), 2859-2868 (2008).
- Renz, M., Daniels, B. R., Vamosi, G., Arias, I. M., Lippincott-Schwartz, J. Plasticity of the asialoglycoprotein receptor deciphered by ensemble FRET imaging and single-molecule counting PALM imaging. Proceedings of the National Academy of Science U. S. A. 109 (44), 2989-2997 (2012).
- van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86 (4), 2517-2529 (2004).
- Muller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Forster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Sciences. 4, 413(2013).
- Gates, E. M., LaCroix, A. S., Rothenberg, K. E., Hoffman, B. D. Improving quality, reproducibility, and usability of FRET-based tension sensors. Cytometry Part A. 95 (2), 201-213 (2019).
- Menaesse, A., et al. Simplified instrument calibration for wide-field fluorescence resonance energy transfer (FRET) measured by the sensitized emission method. Cytometry Part A. , 24194(2020).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nature Biotechnology. 22 (12), 1567-1572 (2004).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173, 1 Spec No 33-38 (1996).
- Nagy, P., et al. Novel calibration method for flow cytometric fluorescence resonance energy transfer measurements between visible fluorescent proteins. Cytometry Part A. 67 (2), 86-96 (2005).
- Arai, R., Ueda, H., Kitayama, A., Kamiya, N., Nagamune, T. Design of the linkers which effectively separate domains of a bifunctional fusion protein. Protein Engineering. 14 (8), 529-532 (2001).
- Szendi-Szatmari, T., Szabo, A., Szollosi, J., Nagy, P. Reducing the detrimental effects of saturation phenomena in FRET microscopy. Analytical Chemistry. 91 (9), 6378-6382 (2019).
- Tron, L., et al. Flow cytometric measurement of fluorescence resonance energy transfer on cell surfaces. Quantitative evaluation of the transfer efficiency on a cell-by-cell basis. Biophysical Journal. 45 (5), 939-946 (1984).
- Sebestyen, Z., et al. Long wavelength fluorophores and cell-by-cell correction for autofluorescence significantly improves the accuracy of flow cytometric energy transfer measurements on a dual-laser benchtop flow cytometer. Cytometry. 48 (3), 124-135 (2002).
- Szaloki, N., et al. High throughput FRET analysis of protein-protein interactions by slide-based imaging laser scanning cytometry. Cytometry Part A. 83 (9), 818-829 (2013).
- McRae, S. R., Brown, C. L., Bushell, G. R. Rapid purification of EGFP, EYFP, and ECFP with high yield and purity. Protein Expression and Purification. 41 (1), 121-127 (2005).
- Kremers, G. J., Goedhart, J., van Munster, E. B., Gadella, T. W. Cyan and yellow super fluorescent proteins with improved brightness, protein folding, and FRET Forster radius. Biochemistry. 45 (21), 6570-6580 (2006).
- Bajar, B. T., Wang, E. S., Zhang, S., Lin, M. Z., Chu, J. A Guide to Fluorescent Protein FRET Pairs. Sensors (Basel). 16 (9), (2016).
- Scott, B. L., Hoppe, A. D. Optimizing fluorescent protein trios for 3-Way FRET imaging of protein interactions in living cells. Science Reports. 5, 10270(2015).
- Chen, Y. C., Spring, B. Q., Clegg, R. M. Fluorescence lifetime imaging comes of age how to do it and how to interpret it. Methods Molecular Biology. 875, 1-22 (2012).
- King, C., Sarabipour, S., Byrne, P., Leahy, D. J., Hristova, K. The FRET signatures of noninteracting proteins in membranes: Simulations and experiments. Biophysical Journal. 106 (6), 1309-1317 (2014).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission
Posted by JoVE Editors on 3/14/2023. Citeable Link.
An erratum was issued for: Assessing Protein Interactions in Live-Cells with FRET-Sensitized Emission. The Authors section was updated from:
György Vámosi1
Sarah Miller2
Molika Sinha2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
to:
György Vámosi1
Sarah Miller2
Molika Sinha2
Maria Kristha Fernandez2
Gabor Mocsár1
Malte Renz2
1Department of Biophysics and Cell Biology, Faculty of Medicine, University of Debrecen
2Gynecologic Oncology Division, Stanford University School of Medicine
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados