É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Montagem controlada por temperatura e caracterização de um Bilayer de interface de gotícula
Neste Artigo
Resumo
Este protocolo detalha o uso de um sistema de aquecimento controlado pela temperatura para promover a montagem de monocamadas lipídicas e a formação de bicamadas de interface de gotícula para lipídios com temperaturas elevadas de fusão e medidas de capacitância para caracterizar mudanças orientadas pela temperatura na membrana.
Resumo
O método de bicamadas de interface de gota (DIB) para a montagem de bicamadas lipídicas (ou seja, DIBs) entre gotículas aquosas revestidas de lipídios no óleo oferece benefícios importantes em relação a outros métodos: os DIBs são estáveis e, muitas vezes, a área bicamada de longa duração pode ser reversivelmente ajustada, a assimetria de folhetos é facilmente controlada através de composições de gotículas, e redes semelhantes a tecidos de bicamadas podem ser obtidas por muitas gotículas adjacentes. A formação de DIBs requer montagem espontânea de lipídios em monocamadas lipídicas de alta densidade nas superfícies das gotículas. Embora isso ocorra prontamente à temperatura ambiente para lipídios sintéticos comuns, uma monocamide ou bicamadas estáveis suficientes não se formam em condições semelhantes para lipídios com pontos de fusão acima da temperatura ambiente, incluindo alguns extratos lipídes celulares. Esse comportamento provavelmente limitou as composições — e talvez a relevância biológica — dos DIBs em estudos de membrana modelo. Para resolver esse problema, um protocolo experimental é apresentado para aquecer cuidadosamente o reservatório de óleo que hospeda gotículas DIB e caracterizar os efeitos da temperatura na membrana lipídica. Especificamente, este protocolo mostra como usar uma luminária de alumínio termicamente condutora e elementos de aquecimento resistivos controlados por um loop de feedback para prescrever temperaturas elevadas, o que melhora a montagem de monocamadas e a formação de bicamadas para um conjunto mais amplo de tipos lipídes. Características estruturais da membrana, bem como as transições de fase termotrópica dos lipídios que compõem a bicamada, são quantificadas medindo as alterações na capacitância elétrica do DIB. Em conjunto, este procedimento pode auxiliar na avaliação de fenômenos biofísicos em membranas modelo sobre várias temperaturas, incluindo a determinação de uma temperatura de fusão eficaz (TM) para misturas lipídicas multicomponidais. Essa capacidade permitirá, assim, uma replicação mais próxima das transições de fases naturais nas membranas do modelo e incentivará a formação e o uso de membranas modelo a partir de uma faixa mais ampla de constituintes de membrana, incluindo aquelas que melhor captam a heterogeneidade de suas contrapartes celulares.
Introdução
As membranas celulares são barreiras seletivamente permeáveis compostas por milhares de lipídiostipos 1,proteínas, carboidratos e esteróis que encapsulam e subdividem todas as células vivas. Entender como suas composições afetam suas funções e revelar como moléculas naturais e sintéticas interagem, aderem, interrompem e translocam membranas celulares são, portanto, áreas importantes da pesquisa com implicações de grande alcance na biologia, medicina, química, física e engenharia de materiais.
Esses objetivos para a descoberta se beneficiam diretamente de técnicas comprovadas para montar, manipular e estudar membranas modelo — incluindo bicamadas lipídicas montadas a partir de lipídios sintéticos ou de ocorrência natural — que imitam as propriedades de composição, estrutura e transporte de suas contrapartes celulares. Nos últimos anos, o método bilayer de interface de gotícula (DIB)2,3,4 para a construção de um bicamado lipídeca planar entre gotículas de água revestidas de lipídios no óleo recebeu atenção significativa5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23, e demonstrou vantagens práticas sobre outras abordagens para a formação de membrana modelo: o método DIB é simples de realizar, não requer fabricação ou preparação sofisticada (por exemplo, "pintura") de um substrato para suportar a membrana, consistentemente produz membranas com superior longevidade, permite medições de eletrofisiologia padrão, e simplifica a formação de membranas modelo com composições de folhetos assimétricos3. Como o bicamado se forma espontaneamente entre gotículas e cada gota pode ser adaptada em posição e maquiagem, a técnica DIB também atraiu considerável interesse no desenvolvimento de sistemas materiais inspirados em células que se baseiam no uso de membranas responsivas a estímulos18,24,25,26,27,28,2829, compartimentação e transporteequilibrados 14,30,31, e materiais semelhantes a tecidos17,23,32,33,34,35,36.
A maioria dos experimentos publicados em membranas de modelo, incluindo aqueles com DIBs, foram realizados à temperatura ambiente (RT, ~20-25 °C) e com um punhado de lipídios sintéticos (por exemplo, DOPC, DPhPC, etc.). Essa prática limita o escopo de questões biofísicas que podem ser estudadas em membranas modelo e, com base na observação, também pode restringir os tipos de lipídios que podem ser usados para montar DIBs. Por exemplo, um lipídio sintético como o DPPC, que tem uma temperatura de fusão de 42 °C, não monta monocamadas bem embaladas ou forma DIBs na RT37. A formação de DIB à temperatura ambiente também tem se mostrado difícil para extratos naturais, como os de mamíferos (por exemplo, extrato lipídico total cerebral, BTLE)38 ou bactérias (por exemplo, extrato lipídico total de Escherichia coli, ETLE)37, que contêm muitos tipos diferentes de lipídios e se originam de células que residem a temperaturas elevadas (37 °C). Viabilizar o estudo de diversas composições proporciona, assim, oportunidades de compreender processos mediados por membrana em condições biologicamente relevantes.
Elevar a temperatura do óleo pode servir a dois propósitos: aumenta a cinética da montagem de monocamadas e pode fazer com que os lipídios sejam submetidos a uma transição de fusão para chegar a uma fase desordenada líquida. Ambas as consequências auxiliam na montagem de monocamadas39, um pré-requisito para um DIB. Além do aquecimento para a formação de bicamadas, o resfriamento da membrana após a formação pode ser usado para identificar transições termotrópicas em bicamadas lipídicassimples 38, incluindo aquelas em misturas lipídicas naturais (por exemplo, BTLE) que podem ser difíceis de detectar usando a calorimetria. Além de avaliar transições termotrópicas de lipídios, precisamente variando a temperatura do DIB pode ser usado para estudar alterações induzidas pela temperatura na estrutura da membrana38 e examinar como a composição lipídica e a fluidez afetam a cinética de espécies ativas de membrana (por exemplo, peptídeos formadores de poros e proteínas transmembranas37),incluindo membranas de modelos mamíferos e bacterianos a uma temperatura fisiologicamente relevante (37 °C).
Aqui, uma descrição de como montar um reservatório de óleo DIB modificado e operar um controlador de temperatura de feedback para permitir a montagem de monocamadas e a formação de bicamadas a temperaturas mais altas que a RT será explicada. Distinguido de um protocolo anterior40,é incluído detalhe explícito em relação à integração da instrumentação necessária para medir e controlar a temperatura paralelamente à montagem e caracterização do DIB no reservatório de petróleo. O procedimento permitirá, assim, que o usuário aplique este método para formar e estudar DIBs em uma variedade de temperaturas em uma variedade de contextos científicos. Além disso, os resultados representativos fornecem exemplos específicos para os tipos de alterações mensuráveis tanto na estrutura da membrana quanto no transporte de íons que podem ocorrer à medida que a temperatura é variada. Essas técnicas são importantes adições aos muitos estudos biofísicos que podem ser projetados e realizados efetivamente em DIBs, inclusive estudando a cinética de espécies membrana-ativas em diferentes composições de membrana.
Protocolo
1. Preparação aquecida da luminária
- Reúna 2 peças de borracha isolante de 1 mm de espessura aparadas a 25 mm x 40 mm de largura e comprimento, respectivamente, 2 peças de borracha de 6 mm de espessura que também são de 25 mm x 40 mm, um conjunto de luminárias de alumínio preparadas e um reservatório de óleo acrílico que se encaixa na janela de visualização da luminária base de alumínio (ver Figuras S1, S2 e S3 para detalhes sobre a fabricação e uma visão explodida de montagem). Prepare a luminária de alumínio primeiro anexando ao fundo da luminária uma janela de visualização de tampas de vidro com adesivo curável UV e aderindo 1 elemento de aquecimento resistivo ao topo de cada flange lateral de 25 mm x 25 mm da luminária.
- Coloque as peças de borracha mais finas sobre o palco do microscópio de tal forma que a borda longa de cada peça seja tangencial à abertura do palco como mostrado(Figura 1).
- Posicione a luminária de base de alumínio em cima das almofadas isolantes com a janela de visualização da luminária centrada acima da lente objetiva. O alinhamento adequado é necessário para a imagem das gotículas conectadas.
- Coloque um pedaço de borracha mais grosso em cima de cada elemento de aquecimento resistivo e use um clipe de estágio de microscópio para mantê-lo no lugar. Essas peças protegem os elementos de aquecimento dos danos causados pelos clipes do palco e isolam-se contra o curto-circuito elétrico acidental entre os elementos de aquecimento e a luminária de alumínio e o estágio do microscópio.
- Dobre cuidadosamente a extremidade de medição de um termopar para alcançar um ângulo de 90° a ~4 mm da extremidade.
- Insira a ponta dobrada do termopar no canto inferior esquerdo da luminária de alumínio e fixe-a suavemente com o parafuso de travamento.
- Coloque o reservatório de acrílico no poço da luminária de alumínio. Isso é feito antes de adicionar óleo de hexadecano ao poço (passo 1.8) da luminária de alumínio para minimizar o risco de aprisionamento de bolhas de ar entre a janela de visualização e o fundo do reservatório acrílico, o que pode obstruir a visão das gotículas.
NOTA: O óleo adicionado ao compartimento de visualização da luminária de alumínio é usado para combinar com os índices de refração do acrílico e do vidro para uma imagem mais clara das gotículas contidas no reservatório acrílico. Assim, vale ressaltar que o óleo no poço da luminária de alumínio não entra em contato com o conteúdo do reservatório acrílico e não é necessária uma limpeza rigorosa da luminária de alumínio. - Dispense ~1.000 μL de óleo de hexadecano no poço de luminária de alumínio (ou seja, entre as paredes do reservatório acrílico e luminária de alumínio), tomando cuidado para não encher demais. O nível de óleo no poço da luminária de alumínio deve ser tão alto quanto permitido maximizar a área da superfície para transferência de calor, ao mesmo tempo em que não permite que o óleo derrame sobre as bordas da luminária no estágio do microscópio ou lente objetiva.
- Dispense ~1.000 μL de óleo de hexadecano no reservatório acrílico, mantendo-se atento para não encher demais.
NOTA: O reservatório de acrílico deve ser sempre completamente limpo entre os experimentos. O usuário deve empregar um regimento composto por enxágues sucessivos com álcool etílico e água desionizada seguida de secagem em uma tigela de dessecador por mais de 12 h.

Figura 1: Montagem de palco aquecida. As imagens mostram a montagem da luminária termicamente condutora e do reservatório de óleo para formação de DIB; números abaixo de cada imagem identificam a etapa correspondente do protocolo. Clique aqui para ver uma versão maior desta figura.
2. Instrumentação para controle simultâneo de temperatura de feedback e caracterização elétrica de um DIB
NOTA: Este protocolo integra os seguintes instrumentos para permitir o controle de temperatura de feedback e a caracterização elétrica simultânea de um DIB: um computador pessoal (PC) com duas conexões de barramento serial universal (USB) disponíveis, um amplificador de grampo de remendo emparelhado a um sistema dedicado de aquisição de dados (DAQ-1), um gerador de forma de onda, um segundo DAQ programável (DAQ-2) com módulos de saída e entrada de temperatura de tensão e um amplificador de fornecimento de energia.. As etapas a seguir descrevem as conexões necessárias desses instrumentos (conforme ilustrado na Figura 2a) necessárias para isolar a medição e o controle da temperatura a partir da eletrofisiologia simultânea de um DIB. Substituições por instrumentos equivalentes podem ser feitas conforme necessário.
- Estabeleça conexões de saída e entrada nos módulos DAQ-2.
- Selecione dois pares de terminais de parafuso no módulo de saída de tensão para conexões diferenciais de tensão e conecte os fios a esses locais. Terminais numéricas ímpares são conexões terrestres comuns, e os terminais numéricas uniformes são saídas não fundamentadas, como mostrado na(Figura 2c). Conecte cada um desses dois pares de fios de chumbo a adaptadores BNC separados do terminal de parafusos e, em seguida, conecte cada adaptador a um cabo BNC separado usado para rotear sinais de tensão para outros instrumentos.
NOTA: Nesta configuração, conexões diferenciais nos terminais 0 e 1 são atribuídas para a saída de controle de temperatura ao amplificador de potência, enquanto outro par de conexões nos terminais 6 e 7 são designados para que a saída de tensão seja enviada às gotículas através do amplificador de remendo. - Referindo-se à(Figura 2c),selecione um conjunto de terminais termopar (por exemplo, os terminais 2 e 3 são designados como o par TC1) no módulo de entrada termopar e conecte-se a ele os fios termopar.
- Selecione dois pares de terminais de parafuso no módulo de saída de tensão para conexões diferenciais de tensão e conecte os fios a esses locais. Terminais numéricas ímpares são conexões terrestres comuns, e os terminais numéricas uniformes são saídas não fundamentadas, como mostrado na(Figura 2c). Conecte cada um desses dois pares de fios de chumbo a adaptadores BNC separados do terminal de parafusos e, em seguida, conecte cada adaptador a um cabo BNC separado usado para rotear sinais de tensão para outros instrumentos.
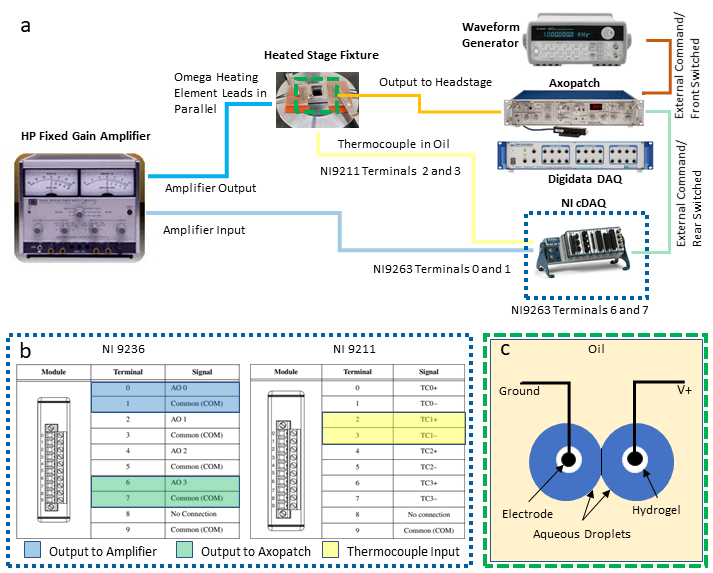
Figura 2: Conexões de fiação do sistema. Um esquema dos dispositivos e fiação necessários para o sistema é mostrado em (a), enquanto um olhar detalhado sobre as conexões DAQ-2 é fornecido em (b). A ilustração em (c) mostra gotículas aquosas em eletrodos revestidos de hidrogel submersos em óleo para formação de DIB. Os dois eletrodos estão conectados às conexões aterradas e não fundidas (V+), respectivamente, na unidade de headstage do amplificador de remendo. Clique aqui para ver uma versão maior desta figura.
- Depois que foram feitas conexões elétricas aos módulos DAQ-2, conecte o chassi DAQ-2 a um PC através de uma conexão USB e conecte-se a uma fonte de energia elétrica. Em seguida, confirme a instalação bem-sucedida do driver e do software antes de usar com um software comercial.
- Configure e conecte um amplificador de energia entre o DAQ-2 e os elementos de aquecimento resistivos.
- Configure o amplificador para operar no modo de amplificação de ganho fixo com um ganho de 10X.
- Utilizando um adaptador jack-BNC de banana, conecte o cabo BNC originário dos terminais 0 e 1 no módulo de saída de tensão(Figura 2b) às conexões de entrada do amplificador de energia.
- Utilizando adaptadores e cabeamentos BNC adicionais, conecte os terminais de saída do amplificador de energia a ambos os conjuntos de elementos de aquecimento, que são conectados em paralelo entre si e ao amplificador para garantir que ambos os elementos mantenham a mesma queda de tensão durante o uso.
- Estabelecer conexões necessárias para o equipamento de eletrofisiologia.
- Conecte um cabo BNC originário dos terminais 6 e 7 no módulo de saída de tensão(Figura 2b) aos conectores BNC de comando externo comutados traseiros na parte traseira do amplificador de remendo.
- Conecte um segundo cabo BNC entre a saída do gerador de forma de onda e a conexão comando externo do interruptor frontal na parte traseira do amplificador de remendo.
NOTA: Estas duas conexões fornecem métodos alternativos para gerar formas de onda de tensão que são aplicadas aos eletrodos de gotícula através do amplificador de grampo de remendo. O gerador de forma de onda é especialmente útil para gerar tensões triangulares de forma de onda usadas para medir a capacitância da membrana. O usuário pode decidir qual, se houver, é necessário para sua própria aplicação. - Com um terceiro cabo BNC, conecte a saída da corrente medida localizada no painel frontal do amplificador de remendo a um conector BNC de entrada analógica disponível na parte frontal do DAQ-1.
- Com um quarto cabo BNC, conecte a saída da tensão de membrana medida (na parte traseira do amplificador de grampo de remendo) a um conector de entrada analógico separado no DAQ-1. Isso permite a digitalização da tensão aplicada nos eletrodos.
- Com os dois eletrodos de gotícula preparados e suportados em micromanipuladores, conforme descrito nas etapas 7-9 no ref.40,conecte os condutores do eletrodo ao headstage do grampo de remendo, que é o fixado via cabo ao amplificador de grampo de remendo.
NOTA: O papel do headstage é controlar a tensão entre os eletrodos e medir a corrente resultante, que é convertida em uma tensão proporcional que obtém saída pelo amplificador de remendo para DAQ-1. - Conecte o DAQ-1 a um PC através de uma conexão USB e conecte os cabos de alimentação correspondentes ao amplificador de remendo e ao DAQ-1.
- Energia em todos os equipamentos de medição.
NOTA: Talvez o detalhe mais importante nesta configuração seja garantir que as conexões de saída do amplificador de energia (mA-A) sejam isoladas eletricamente da unidade de headstage do amplificador de remendo, que usa um circuito sensível para medir as correntes de nível pA-nA em um DIB.
3. Controle de temperatura de feedback de bicamadas de interface de gotícula
NOTA: As seguintes etapas para operar o sistema de controle de temperatura de feedback baseiam-se em uma interface de usuário gráfica personalizada (GUI) criada para implementar o controle de temperatura de feedback proporcional-integral (PI)40,41 (ver Arquivos de Codificação Suplementar). Outros algoritmos de software e controle podem ser usados em vez disso. Uma cópia deste programa é fornecida ao leitor com as informações complementares para o papel, porém o usuário é responsável por configurá-lo para seus próprios equipamentos e necessidades.
- Inicie o software DAQ-2 no PC e abra o arquivo do programa de controle de temperatura. Uma vez que a GUI abra, abra o programa novamente clicando no ícone da pasta no canto inferior esquerdo da GUI e selecionando o programa de controle de temperatura(Figura 3).
- Digite valores numéricos adequados para o ganho de controle proporcional(KP) e ganho de controle integral(KI).
NOTA: Os valores KP e KI de 0,598 e 0,00445, respectivamente, foram encontrados para funcionar bem na configuração. Esses valores foram determinados iterativamente por meio de simulação utilizando um modelo de sistema que incorpora parâmetros obtidos a partir de respostas de aquecimento de loop aberto medidos (ver Figura 4). Durante o aquecimento em loop aberto,a potência de aquecimento prescrita é independente da temperatura medida. Em contraste, o aquecimento em loop fechado consiste em ajustar continuamente a potência aplicada aos aquecedores de uma maneira que ajude a direcionar a temperatura medida para perto da temperatura desejada. Isso é conseguido aqui usando um esquema de controle pi. - Para testar o esquema de controle de temperatura, digite uma temperatura de set point desejada (acima da temperatura ambiente) e, em seguida, ligue o controle de temperatura de feedback dentro da GUI. Observe o sinal de temperatura medido sob controle de feedback (laço fechado), que é exibido na GUI durante os próximos minutos. Se a temperatura medida do óleo ultrapassar muito a temperatura desejada, reagir muito lentamente às mudanças ou não convergir para o ponto de ajuste desejado, o usuário precisará ajustar os ganhos de controle para alcançar o desempenho desejado em loop fechado.
NOTA: O programa define um limite de saturação para a potência (e, portanto, tensão) fornecida aos elementos de aquecimento resistivos. Por exemplo, dois elementos aqui relatados consomem até 5 W de potência cada. Fiação-los em paralelo significa que o consumo total de energia não deve exceder 10 W. O usuário é aconselhado a considerar a quantidade máxima de energia que deve ser fornecida aos dispositivos e saber que esse limite pode afetar a velocidade com que o sistema de loop fechado responderá às mudanças de temperatura desejadas. Elementos de aquecimento mais elevados permitem um aquecimento mais rápido e temperaturas de set point mais altas, mas requerem correntes mais altas para aquecimento. - Com o sistema sintonizado com o desempenho aceitável em loop fechado, insira a temperatura desejada do óleo para a formação de DIB como o ponto de ajuste na GUI.
NOTA: Por exemplo, uma temperatura de set point de 60 °C rendeu bons resultados em experimentos com lipossomos BTLE nas gotículas aquosas37. O usuário é encaminhado para outro lugar2,40 para protocolos que explicam o conjunto DIB entre gotículas penduradas em eletrodos do tipo fio e configuração de equipamentos de eletrofisiologia usando o amplificador de grampo de remendo, DAQ-1 e software de medição de eletrofisiologia. Especificamente, o protocolo de Najem, et al.40 pode ser acompanhado de perto até o Passo 13. Além desse passo, uma abordagem ligeiramente diferente é empregada para a formação bem sucedida de monocamadas e bicamadas ao usar lipídios que requerem aquecimento para promover a formação de monocamadas ou bicamadas. - Abaixe as pontas dos eletrodos de cloreto de prata/prata (Ag/AgCl) no óleo até que eles quase toquem o fundo do reservatório acrílico. Esse posicionamento das pontas do eletrodo é crucial para manter a gotícula no eletrodo em óleo aquecido, onde correntes convectivas no óleo têm sido observadas para separar gotículas dos eletrodos revestidos de hidrogel(Figura 2c).
- Pipeta uma gota de 250 nL de solução lipídica aquosa contendo 2 mg/mL de BTLE, cloreto de potássio de 100 mM (KCl) e 10 mM 3-(N-morpholino) ácido propanossulfônico (MOPS) em cada ponta de eletrodo e deixá-los incubar no óleo aquecido por um mínimo de 10 minutos para promover a formação de monocamadas.
- Cubra o palco e aqueça o palco com uma gaiola de Faraday aterrada.
- Traga as gotículas em contato suave lentamente
manipulando as posições horizontais dos eletrodos até que o usuário veja as gotículas se deformarem do contato ou comecem a deslocar-se e esperar alguns minutos até que a formação da bicamada comece. Se depois de vários minutos uma bicamada não se formou, as gotículas podem ser coagidas mais para facilitar a formação de bicamadas. A formação de um bicamado interfacial diluído pode ser confirmada através de inspeção visual (Figura 5a) ou medindo o aumento da amplitude de uma corrente capacitiva de forma de onda quadrada induzida por um gerador de forma de onda que produz uma tensão triangular de 10 mV, 10 Hz22. Permita que o bicamado se equilibre por um mínimo de 10 minutos para atingir uma área interfacial estável, após a formação inicial e antes da caracterização subsequente no set point inicial.
NOTA: O tipo de óleo pode ter um impacto significativo no afinamento de bicamadas, espessura da membrana e ângulo de contato entre gotículas. Em geral, quanto menor a molécula de óleo, mais facilmente ela pode permanecer no núcleo hidrofóbico da bicamada ocupada por correntes lipídicas de aciila. A retenção de óleo aumenta as tensões e a espessura da monocamada e diminui a área e o ângulo de contato entre gotículas. Essas métricas significam um estado mais fraco de adesão. Moléculas maiores e volumosas exercem o efeito oposto. Por exemplo, o escaeno é uma molécula mais volumosa do que os alcanos, como o hexadecano, o que permite que ele seja prontamente excluído entre as monocamadas durante o afinamento de bicamadas. Como tal, os DIBs formados em esqualene são mais finos, exibem áreas e ângulos de contato mais elevados, e exibem maiores energias livres de formação22,42 (uma medida de adesão gotícula-gotícula).
4. Caracterização de comportamentos dependentes de temperatura em DIBs
NOTA: Muitos processos físicos podem ser estudados em membranas de modelo baseadas em DIB, incluindo como as mudanças de temperatura afetam a estrutura e as propriedades de transporte da membrana. As etapas a seguir devem ser realizadas após a formação de bicamadas bem sucedidas a uma temperatura desejada.
- Meça a capacitância nominal da membrana enquanto reduz a temperatura do banho de óleo a partir de um ponto de partida que permite a formação de bicamadas para identificar transições de fase termotrópico dos lipídios na membrana38.
- Clique com o botão direito do mouse no gráfico de temperatura na GUI e limpe os dados exibidos. Isso garante que o espaço suficiente no buffer esteja disponível para gravações subsequentes.
- Utilizando o gerador de forma de onda conectado ao amplificador de remendo, aplique uma forma de onda de tensão triangular (por exemplo, 10 mV, 10 Hz) através dos eletrodos DIB e registe a resposta corrente induzida através da bicamada.
- Esfrie a bicamada reduzindo a temperatura do ponto de set em incrementos de 5 °C e esperando um mínimo de 5 minutos na nova temperatura de estado estável entre as mudanças de temperatura até que a temperatura desejada seja alcançada. Alternativamente, tente resfriar passivamente o bicamado, desligando o sistema de controle de feedback. Esteja ciente, no entanto, de que experimentos implementando resfriamento passivo de 50-60 °C resultaram em maiores taxas de coalescência.
- Depois que o banho de óleo e o bicamado esfriarem à temperatura mínima desejada, clique com o botão direito do mouse no gráfico de temperatura na GUI novamente e exporte os dados de temperatura versus tempo para um software de planilha. Pare a gravação atual.
- A partir da corrente medida, calcule a capacitância nominal da resposta de corrente de onda quadrada versus o tempo durante o período de resfriamento.
- Plote a capacitância nominal(C) versus temperatura(T)para observar como a capacitância da membrana mudou. Localize alterações não não mnotônicas em C versus T para identificar TM.
NOTA: A capacitância nominal pode ser calculada a partir da amplitude da corrente de onda quadrada43 (| Eu |) usando a relação | Eu | = C dv/dt, onde dv/dt é igual a quatro vezes o produto da amplitude de tensão (| V|) e frequência (f) da tensão triangular aplicada. A partir dessas equações, C = | Eu |/(4| V|f).
- Da mesma forma, avalie a capacidade específica quase estática(Cm)da bicamada a temperaturas fixas, aumentando sucessivamente a temperatura do banho de óleo e da área de bicamadas.
- Altere a temperatura do ponto de partida em incrementos de 10 °C usando a GUI e permita que o sistema se equilibre à nova temperatura.
- Execute a Etapa 4.1.2 para iniciar a medição da corrente capacitiva e do registro.
- Altere a área da bicamadas ajustando cuidadosamente as posições dos eletrodos usando os micro-manipuladores (ou seja, separar os eletrodos reduz a área da bicamadas). Permita que a corrente de onda quadrada atinja uma amplitude de estado estável e colete imagens do DIB para permitir o cálculo da área da membrana versus o tempo usando uma câmera montada no microscópio para imagem do bicamadorão, como visto a partir da abertura do estágio do microscópio. Simultaneamente, adicione uma tag digital no software de gravação atual para marcar o ponto de tempo correspondente para a coleta de imagens.
NOTA: Os micromudores permitem o controle preciso dos eletrodos e, portanto, o contato suave entre gotículas. A manipulação grosseira das gotículas pode levar a um experimento fracassado por coalescência das gotículas ou fazendo com que uma gota caia do eletrodo. Como discutido em outros lugares22,a área de bicamadas é calculada a partir do comprimento de contato entre gotículas, que aparecem como círculos sobrepostos em uma imagem de vista inferior. As posições e dimensões das gotículas e o comprimento da linha de contato podem ser calculadas usando um software de processamento de imagens ou com outras ferramentas de programação científica. - Repita o Passo 4.2.1.2 um mínimo de 4 vezes para obter um total de 5 imagens DIB e regiões de estado estável de corrente bicamadas.
- Repita o passo 4.2.1 em cada temperatura desejada.
- Nos pontos de tempo marcados correspondentes às áreas de bicamadas de estado estável para imagens adquiridas, analise as gravações atuais e as imagens DIB para extrair dados C e A para cada temperatura.
- Plot C versus A dados para cada temperatura e calcular a inclinação de uma regressão de primeira ordem, que representa o Cm da bicamadas a cada temperatura22.
- Valores da parcela de Cm obtidos a partir da Etapa 4.2.4 contra T.
- Examine os dados Cm versus T para variações não monótônicas para identificar temperaturas de fusão, TM.
- Altere a temperatura do ponto de partida em incrementos de 10 °C usando a GUI e permita que o sistema se equilibre à nova temperatura.
- Avalie a dinâmica da formação do canal de íons dependentes da tensão gerando uma entrada de passo de tensão dc através da bicamada.
- Defina tensão inicial ao valor de passo desejado em mV (por exemplo,100 mV).
- Defina tensão final e tamanho da etapa em um valor superior ao passo desejado (por exemplo, tensão final de 110 mV e tamanho de passo de 110 mV).
- Defina o tempo de duração desejado para a entrada da etapa em segundos (por exemplo, 90 s).
- Escolha a polaridade desejada para a entrada de passo (por exemplo, positiva).
- Alterne o amplificador do grampo de remendo para enviar ao headstage a tensão de comando originária do módulo de saída gui/tensão.
- Inicie gravações atuais.
- Ligue a tensão e regisse a resposta de corrente induzida, que deve exibir uma resposta em forma de S a uma tensão crítica (por exemplo, ~70 mV para 1 μg/mL Mz em 2 mg/mL BTLE).
- Separadamente, as relações dinâmicas de corrente-tensão para uma membrana podem ser obtidas a temperaturas desejadas para revelar relações dependentes de tensão, como comportamentos de canais de íons.
- Alterne o amplificador do grampo de remendo para enviar ao headstage a tensão de comando originária do gerador de forma de onda e inicie gravações de corrente.
- No gerador de forma de onda, exaia uma forma de onda sinusoidal contínua com amplitude, deslocamento e frequência desejadas.
- Regisso da resposta corrente induzida em um ou vários ciclos.
- Repita como desejado para diferentes amplitudes de ondas senoidais e frequências e temperaturas.
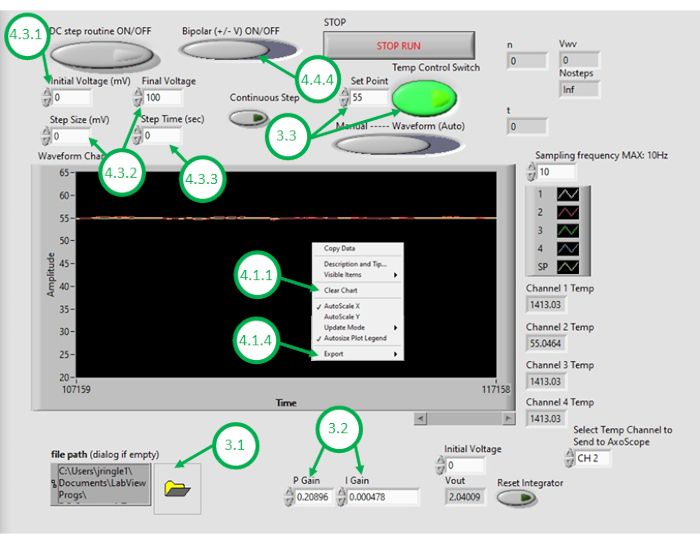
Figura 3: Gui de controle de temperatura. Esta figura destaca e rotula as etapas críticas necessárias para usar a GUI do programa para controlar a temperatura do banho de óleo. Clique aqui para ver uma versão maior desta figura.
Resultados
A Figura 1 mostra como a luminária de alumínio e o reservatório de óleo acrílico são preparados no estágio do microscópio para a formação de DIB. As etapas de montagem 1.2-1.4 servem para isolar termicamente a luminária do palco para um aquecimento mais eficiente. As etapas 1.5-1.7 mostram como fixar adequadamente o termopar à luminária e posicionar o reservatório de óleo, e as etapas 1.8 -1.9 mostram locais recomendados para a distribuição de óleo nessas peças.
Discussão
O protocolo aqui descrito fornece instruções para a montagem e operação de um sistema experimental para controlar a temperatura do óleo e gotículas usadas para formar DIBs. É especialmente benéfico para permitir a formação de DIB usando lipídios que têm temperaturas de fusão acima de RT. Além disso, variando precisamente a temperatura do reservatório de óleo, a temperatura bicamada pode ser manipulada para estudar os efeitos das temperaturas elevadas em várias propriedades e características da membrana,...
Divulgações
Os autores não têm conflitos de interesses.
Agradecimentos
O apoio financeiro foi fornecido pela National Science Foundation Grant CBET-1752197 e pelo Escritório de Pesquisa Científica da Força Aérea, Grant FA9550-19-1-0213.
Materiais
| Name | Company | Catalog Number | Comments |
| 25 mm x 40 mm x 1 mm insulative rubber (x2) | Any | Insulates the bottom of the aluminum fixture from the stage of the microscope | |
| 25 mm x 40 mm x 6 mm insulative rubber (x2) | Any | Protects heating elements from being damaged by the microscope stage clips and insulates the top of the heating elements. | |
| 3-(N-morpholino) propanesulfonic acid | Sigma Aldrich | M3183 | Buffering agent for lipid solution |
| Acrylic substrate | Fabricated in house | HTD_STG_2 | ~1000 uL acrylic well with a poka-yoke exterior profile to fix orientation |
| Aluminum fixture | Fabricated in house | HTD_STG_1 | Base fixture with an oil well that holds the acylic fixture and includes two flat pads adjacent to the oil well for the heating elements |
| Brain Total Lipid Extract | Avanti | 131101C-100mg | 25 mg/mL porcine lipid extract |
| Compact DAQ Chassis (cDAQ) | National Instruments | cDAQ-9174 | Chassis to house multiple types of sensor measurement or output modules |
| Data Acquisition System (DAQ) | Molecular Devices | Digidata 1440A | High resolution analog to digital converter |
| Fixed gain amplifier/power supply | Hewlitt Packard | HP 6826A | Amplifies DC voltage output from the voltage output module |
| Glass Cover Slip | Corning | CLS284525 | Seals bottom of aluminum base and allows for optical characterization of the bilayer |
| Heating element (x2) | Omega | KHLV-101/5 | 25 mm x 25 mm polymide film kapton heating element with a 5 watt power limit. |
| M3 Stainless Steel Screw | McMaster Carr | 90116A150 | Secures thermocouple to aluminum fixture |
| Patch clamp amplifier | Molecular Devices | AxoPatch 200B | Measures current and outputs voltage to the headstage |
| Personal computer | Any | Computer with mulitiple high speed usb ports and a minimum of 6 Gb of ram | |
| Potassium Chloride | Sigma Aldrich | P3911 | Electrolyte solution of dissociated ions |
| Temperature input module | National Instruments | NI 9211 | Enables open and cold junction thermocouple measurements for the cDAQ chassis |
| Thermocouple | Omega | JMTSS-020U-6 | U-type thermocouple with a diameter of 0.02 inches and 6 inches in length |
| UV Curable Adhesive | Loctite | 19739 | Secures glass coverslip to aluminum base fixture |
| Voltage output module | National Instruments | NI 9263 | Analog voltage output module for use with the cDAQ chassis |
| Waveform generator | Agilent | 33210A | Used to output a 10 mV 10 Hz sinusoidal waveform |
Referências
- van Meer, G., de Kroon, A. I. P. M. Lipid map of the mammalian cell. Journal of Cell Science. 124 (1), 5-8 (2011).
- Bayley, H., et al. Droplet interface bilayers. Molecular BioSystems. 4 (12), 1191-1208 (2008).
- Hwang, W. L., Chen, M., Cronin, B., Holden, M. A., Bayley, H. Asymmetric droplet interface bilayers. Journal of the American Chemical Society. 130 (18), 5878-5879 (2008).
- Holden, M. A., Needham, D., Bayley, H. Functional bionetworks from nanoliter water droplets. Journal of the American Chemical Society. 129 (27), 8650-8655 (2007).
- Sarles, S. A., Leo, D. J. Physical encapsulation of droplet interface bilayers for durable, portable biomolecular networks. Lab on a Chip. 10 (6), 710-717 (2010).
- Stanley, C. E., et al. A microfluidic approach for high-throughput droplet interface bilayer (DIB) formation. Chemical Communications. 46 (10), 1620-1622 (2010).
- Gross, L. C. M., Heron, A. J., Baca, S. C., Wallace, M. I. Determining membrane capacitance by dynamic control of droplet interface bilayer area. Langmuir. 27 (23), 14335-14342 (2011).
- Huang, J., Lein, M., Gunderson, C., Holden, M. A. Direct quantitation of peptide-mediated protein transport across a droplet, interface bilayer. Journal of the American Chemical Society. 133 (40), 15818-15821 (2011).
- Leptihn, S., Thompson, J. R., Ellory, J. C., Tucker, S. J., Wallace, M. I. In vitro reconstitution of eukaryotic ion channels using droplet interface bilayers. Journal of the American Chemical Society. 133 (24), 9370-9375 (2011).
- Castell, O. K., Berridge, J., Wallace, M. I. Quantification of membrane protein inhibition by optical ion flux in a droplet interface bilayer array. Angewandte Chemie International Edition. 51 (13), 3134-3138 (2012).
- Dixit, S. S., Pincus, A., Guo, B., Faris, G. W. Droplet shape analysis and permeability studies in droplet lipid bilayers. Langmuir. 28 (19), 7442-7451 (2012).
- Elani, Y., deMello, A. J., Niu, X., Ces, O. Novel technologies for the formation of 2-D and 3-D droplet interface bilayer networks. Lab on a Chip. 12 (18), 3514-3520 (2012).
- Michalak, Z., Fartash, D., Haque, N., Lee, S. Tunable crystallization via osmosis-driven transport across a droplet interface bilayer. CrystEngComm. 14 (23), 7865-7868 (2012).
- Punnamaraju, S., You, H., Steckl, A. J. Triggered release of molecules across droplet interface bilayer lipid membranes using photopolymerizable lipids. Langmuir. 28 (20), 7657-7664 (2012).
- Boreyko, J. B., Mruetusatorn, P., Sarles, S. A., Retterer, S. T., Collier, C. P. Evaporation-induced buckling and fission of microscale droplet interface bilayers. Journal of the American Chemical Society. 135 (15), 5545-5548 (2013).
- Leptihn, S., et al. Constructing droplet interface bilayers from the contact of aqueous droplets in oil. Nature Protocols. 8 (6), 1048-1057 (2013).
- Villar, G., Graham, A. D., Bayley, H. A Tissue-like printed material. Science. 340 (6128), 48-52 (2013).
- Barriga, H. M. G., et al. Droplet interface bilayer reconstitution and activity measurement of the mechanosensitive channel of large conductance from Escherichia coli. Journal of The Royal Society Interface. 11 (98), (2014).
- Boreyko, J. B., Polizos, G., Datskos, P. G., Sarles, S. A., Collier, C. P. Air-stable droplet interface bilayers on oil-infused surfaces. Proceedings of the National Academy of Sciences. 111 (21), 7588-7593 (2014).
- Mruetusatorn, P., et al. Dynamic morphologies of microscale droplet interface bilayers. Soft Matter. 10 (15), 2530-2538 (2014).
- Najem, J., Dunlap, M., Sukharev, S., Leo, D. J. The gating mechanism of mechanosensitive channels in droplet interface bilayers. MRS Proceedings. , 1755 (2015).
- Taylor, G. J., Venkatesan, G. A., Collier, C. P., Sarles, S. A. Direct in situ measurement of specific capacitance, monolayer tension, and bilayer tension in a droplet interface bilayer. Soft Matter. 11 (38), 7592-7605 (2015).
- Bayley, H., Cazimoglu, I., Hoskin, C. E. G. Synthetic tissues. Emerging Topics in Life Sciences. 3 (5), 615-622 (2019).
- Oliver, A. E., et al. Protecting, patterning, and scaffolding supported lipid membranes using carbohydrate glasses. Lab on a Chip. 8 (6), 892-897 (2008).
- Maglia, G., et al. Droplet networks with incorporated protein diodes show collective properties. Nature Nanotechnology. 4 (7), 437-440 (2009).
- Najem, J. S., et al. Activation of bacterial channel MscL in mechanically stimulated droplet interface bilayers. Scientific Reports. 5, 13726 (2015).
- Freeman, E. C., Najem, J. S., Sukharev, S., Philen, M. K., Leo, D. J. The mechanoelectrical response of droplet interface bilayer membranes. Soft Matter. 12 (12), 3021-3031 (2016).
- Tamaddoni, N., Sarles, S. A. Toward cell-inspired materials that feel: measurements and modeling of mechanotransduction in droplet-based, multi-membrane arrays. Bioinspiration & Biomimetics. 11 (3), 036008 (2016).
- Restrepo Schild, V., et al. Light-patterned current generation in a droplet bilayer array. Scientific Reports. 7, 46585 (2017).
- Milianta, P. J., Muzzio, M., Denver, J., Cawley, G., Lee, S. Water permeability across symmetric and asymmetric droplet interface bilayers: Interaction of cholesterol sulfate with DPhPC. Langmuir. 31 (44), 12187-12196 (2015).
- Mruetusatorn, P., et al. Control of membrane permeability in air-stable droplet interface bilayers. Langmuir. 31 (14), 4224-4231 (2015).
- Wauer, T., et al. Construction and manipulation of functional three-dimensional droplet networks. ACS Nano. 8 (1), 771-779 (2013).
- Bayley, H. Building blocks for cells and tissues: Beyond a game. Emerging Topics in Life Sciences. 3 (5), 433-434 (2019).
- Booth, M., Restrepo Schild, V., Downs, F., Bayley, J. Droplet network, from lipid bilayer to synthetic tissues. Encyclopedia of Biophysics. , (2019).
- Booth, M. J., Cazimoglu, I., Bayley, H. Controlled deprotection and release of a small molecule from a compartmented synthetic tissue module. Communications Chemistry. 2 (1), 142 (2019).
- Gobbo, P., et al. Programmed assembly of synthetic protocells into thermoresponsive prototissues. Nature Materials. 17 (12), 1145-1153 (2018).
- Taylor, G. J., Sarles, S. A. Heating-enabled formation of droplet interface bilayers using escherichia coli total lipid extract. Langmuir. 31 (1), 325-337 (2015).
- Taylor, G. J., et al. Capacitive detection of low-enthalpy, higher-order phase transitions in synthetic and natural composition lipid membranes. Langmuir. 33 (38), 10016-10026 (2017).
- Lee, S., Kim, D. H., Needham, D. Equilibrium and dynamic interfacial tension measurements at microscopic interfaces using a micropipet technique. 2. Dynamics of phospholipid monolayer formation and equilibrium tensions at the water-air interface. Langmuir. 17 (18), 5544-5550 (2001).
- Najem, J. S., et al. Assembly and characterization of biomolecular memristors consisting of ion channel-doped lipid membranes. Journal of Visualized Experiments. (145), e58998 (2019).
- Wang, Y. G., Shao, H. H. Optimal tuning for PI controller. Automatica. 36 (1), 147-152 (2000).
- Needham, D., Haydon, D. A. Tensions and free energies of formation of "solventless" lipid bilayers. Measurement of high contact angles. Biophysical Journal. 41 (3), 251-257 (1983).
- Sarles, S. A., Leo, D. J. Physical Encapsulation of Interface Bilayers for durable portable biolayer network. Lab on a Chip. 10 (6), 710-717 (2010).
- Muller, R. U., Peskin, C. S. The kinetics of monazomycin-induced voltage-dependent conductance. II. Theory and a demonstration of a form of memory. The Journal of General Physiology. 78 (2), 201-229 (1981).
- Nenninger, A., et al. Independent mobility of proteins and lipids in the plasma membrane of Escherichia coli. Molecular Microbiology. 92 (5), 1142-1153 (2014).
- Venkatesan, G. A., et al. Adsorption kinetics dictate monolayer self-assembly for both lipid-in and lipid-out approaches to droplet interface bilayer formation. Langmuir. 31 (47), 12883-12893 (2015).
- Najem, J. S., et al. Memristive ion channel-doped biomembranes as synaptic mimics. ACS Nano. 12 (5), 4702-4711 (2018).
- Tamaddoni, N., Taylor, G., Hepburn, T., Michael Kilbey, S., Sarles, S. A. Reversible, voltage-activated formation of biomimetic membranes between triblock copolymer-coated aqueous droplets in good solvents. Soft Matter. 12, 5096-5109 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados