Method Article
Proteínas de carregamento de contas e ácidos nucleicos em células humanas aderentes
Neste Artigo
Resumo
O carregamento de contas introduz proteínas, plasmídeos e partículas em células de mamíferos aderentes. Esta técnica de carregamento celular é barata, rápida e não afeta substancialmente a saúde celular. É mais adequado para imagens de células vivas.
Resumo
Muitos experimentos de imagem de células vivas usam partículas exógenas (por exemplo, peptídeos, anticorpos, contas) para rotular ou funcionar dentro das células. No entanto, introduzir proteínas em uma célula através de sua membrana é difícil. A seleção limitada de métodos atuais luta com baixa eficiência, requer equipamentos caros e tecnicamente exigentes, ou funções dentro de parâmetros estreitos. Aqui, descrevemos uma técnica relativamente simples e econômica para carregar DNA, RNA e proteínas em células humanas vivas. O carregamento de contas induz uma interrupção mecânica temporária na membrana celular, permitindo que macromoléculas entrem células de mamíferos vivos e aderentes. A menos de 0,01 USD por experimento, o carregamento de contas é o método de carregamento de células mais barato disponível. Além disso, o carregamento de contas não estressa substancialmente as células nem impacta sua viabilidade ou proliferação. Este manuscrito descreve as etapas do procedimento de carregamento de contas, adaptações, variações e limitações técnicas. Esta metodologia é especialmente adequada para imagens de células vivas, mas fornece uma solução prática para outras aplicações que requerem a introdução de proteínas, contas, RNA ou plasmídeos em células de mamíferos vivos e aderentes.
Introdução
Carregar macromoléculas em células mamíferas requer metodologia que lhes permita atravessar a membrana plasmática da célula1. Vários métodos podem introduzir plasmídeos em células de mamíferos através da transfecção, incluindo transfecção liposômica2 e transfecção dietaminoetil-dextran3. No entanto, os métodos de carregamento de proteínas ou partículas impermeáveis por membrana em células são mais limitados.
Várias técnicas contornaram esse obstáculo difícil usando várias estratégias. Primeiro, a microinjeção fornece partículas através de uma micropipette em células vivas sob um microscópio4. Embora indiscutivelmente o método mais controlado e menos invasivo, esta técnica é relativamente baixa de rendimento, porque as células devem ser carregadas uma a uma. Além disso, a microinjeção requer equipamentos especializados e é tecnicamente exigente.
Em segundo lugar, a eletroporação é uma forma de eletro-injetar proteínas nas células através da interrupção da membrana induzida pela tensão5,6,7. No entanto, este método requer novamente equipamentos especializados e caros, e o choque pode causar estresse celular e mortalidade. Além disso, as células devem ser experimentadas antes da eletroporação e, posteriormente, repladas, limitando o prazo em que as células podem ser investigadas após a eletroporação.
Em terceiro lugar, as membranas celulares podem ser quimicamente modificadas para permeabilização temporária e reversível8,9. O carregamento de estreptolise-O insere uma endotoxina nas membranas celulares, que forma poros temporários, permitindo que partículas exógenas impermeáveis da membrana, incluindo proteínas e plasmídeos de DNA, entrem nas células10. Após uma recuperação de 2h, cerca de metade das células reparam esses poros e param de internalizar partículas da solução. No entanto, essa técnica requer um longo tempo de recuperação e é incompatível com tipos celulares que não toleram endotoxinas.
Em quarto lugar, a interrupção mecânica carrega partículas em células através da perturbação física da membranacelular 11. Isso pode ser feito de várias maneiras, incluindo arranhões, raspagens e contas de rolamento em cima das células12,13. Já em 1987, as contas têm sido usadas para carregar proteínas em células mecanicamente14. Mais recentemente, a técnica de carregamento de contas foi otimizada e adaptada além das proteínas para incluir o carregamento de plasmídeos e RNA, conforme descrito aqui.
O carregamento de contas é um método fácil, barato e rápido para carregar proteínas e plasmídeos em células humanas aderentes. Contas de vidro são brevemente enroladas em cima de células, interrompendo temporariamente sua membrana celular. Isso permite que partículas em solução entrem. Como o carregamento de contas tem baixa eficiência, é mais adequado para experimentos de microscopia de molécula única ou unicelular. O carregamento de contas pode introduzir uma grande variedade de proteínas, incluindo anticorpos fragmentados (Fab),15,16 proteínas purificadas como scFvs,17 intrabodies,18,19, ou proteínas de casaco mRNA, por exemplo, proteína de casaco MS2 (PCM)20,21. Vetores de expressão plasmid também podem ser adicionados à solução proteica e carregados simultaneamente22,23,24,25.
Além de proteínas e plasmídeos, moléculas de até 250 nm de contas de poliestireno foram introduzidas nas células através do carregamento de contas (comunicação pessoal). O carregamento de contas é incrivelmente barato, custando menos de 0,01 USD por experimento em materiais e não necessitando de equipamentos caros adicionais. O custo é ainda reduzido minimizando a quantidade de sondas usadas por experimento porque apenas as células da micro-habit central de 14 mm de diâmetro de uma câmara de imagem são carregadas. Deve-se notar que a área de carregamento limitada significa que o carregamento de contas não é ideal para o carregamento de células a granel.
Este manuscrito apresenta o processo de carregamento de contas, incluindo como construir o aparelho de carregamento de contas e realizar um experimento. Ele mostra que proteínas, RNA e DNA podem ser carregados em vários tipos de células e que duas proteínas diferentes, simultaneamente carregadas de contas, têm concentrações celulares altamente correlacionadas e variância relativamente baixa. Também são discutidas variações no protocolo baseadas no tipo celular e carregamento de proteína, plasmídeo ou RNA. Embora as contas sejam pensadas para perfurar e interromper a membrana celular, quando apropriadamente realizadas, o processo de carregamento de contas desaloja apenas um pequeno número de células da parte inferior da câmara de imagem. Após um curto período de recuperação, as células continuam a crescer e se dividir. Essa metodologia é ideal para experimentos de microscopia de células vivas, incluindo rastreamento de proteína de molécula única e RNA, detecção de modificações pós-translacionais, observação de mecanismos celulares dinâmicos ou monitoramento de localização subcelular15,16,22,26,27.
Protocolo
1. Limpe, esterilize e seque as contas de vidro para evitar a aglomeração e garantir mesmo a propagação em cima das células.
- Esterilizar aproximadamente 5 mL de contas de vidro em hidróxido de sódio (NaOH). Meça as contas em um tubo cônico de 50 mL. Adicione 25 mL de 2 M NaOH e misture delicadamente usando um agitador ou rotador por 2 h.
- Decantar o NaOH, retendo o máximo de contas possível. Se as contas estiverem suspensas, gire o tubo de contas brevemente em uma centrífuga (1 min a ~1000 × g, temperatura ambiente).
- Lave as contas cuidadosamente com água de grau de cultura celular até que o pH seja neutro (use uma tira de teste de pH no eluent para confirmar um pH neutro). Decante a água de lavagem cada vez, como antes.
- Lave bem as contas com 100% de etanol 2-3x. Decante o etanol todas as vezes, como antes.
- Seque as contas. Polvilhe as contas para formar uma camada fina dentro de um recipiente estéril (como uma placa de Petri de 10 cm). Deixando o recipiente aberto, deixe as contas secarem em um armário de biossegurança durante a noite. Certifique-se de que as contas estão completamente secas batendo ou sacudindo suavemente o recipiente e verificando se as contas têm uma textura arenosa sem aglomeração ou descamação.
- Esterilizar as contas secas por 15 minutos.
2. Monte o aparelho de carregador de contas.
- Fixar um pedaço de malha (polipropileno ou material equivalente, aberturas de 105 μm para permitir que as contas passem) para cobrir toda a abertura da câmara de retenção de contas com fita ou fixação da malha entre as extremidades masculina e feminina de uma câmara de imagem reutilizável metálica(Figura 1A).
- Esterilizar o aparelho por 15 minutos. Adicione as contas ao aparelho e sele-as firmemente com o filme ceroso.
NOTA: É essencial que as contas estejam completamente limpas e secas nesta etapa. Eles devem estar soltos e olhar arenoso sem aglomerados. Se eles não aparecerem assim, lave-se e seque completamente as contas. - Armazene o aparelho em um recipiente seco e lacrado por gel de sílica ou outro meio dessecante. Se as contas ficarem úmidas, o que será aparente por agrupamento de contas, seque completamente e esterilize o carregador de contas e substitua por contas frescas.
NOTA: Todas essas precauções impedirão que qualquer mofo ou bactéria cresça sobre ou ao redor das contas dentro do carregador de contas. O aparelho de carregador de contas pode ser feito de diferentes maneiras. Veja os detalhes da discussão.
3. Prepare câmaras de fundo de vidro de células aderentes.
- Sementes células de mamíferos adeptos em uma câmara de fundo de vidro de 35 mm. Certifique-se de que as células são aproximadamente 80% confluentes no momento do carregamento de contas. (Consulte a Tabela 1 para obter mais informações sobre vários tipos de células e notas sobre a eficácia do carregamento de contas em diferentes tipos de células.)
NOTA: As células podem ser semeadas apenas no microwell no centro da câmara para conservar quantas células são usadas. - Incubar as células em condições normais até que elas sejam completamente aderentes ao vidro.
NOTA: É essencial que a densidade celular seja alta o suficiente e que as células sejam seguramente aderidas ao vidro. Se esses requisitos não forem atendidos, as células provavelmente se descascarão durante o carregamento de contas. A linha do tempo entre a semeadura celular e o carregamento de contas pode ser alongada para garantir a adesão e a confluência adequada das células.
4. Células de carregamento de contas
NOTA: Se necessário, lave as células brevemente com soro fisiológico tamponado de fosfato (PBS) e, em seguida, adicione 2 mL do meio ideal. Incubar por pelo menos 30 min.
- Faça uma solução de 3-8 μL contendo os plasmídeos, proteínas e/ou partículas desejadas. Use ~1 μg (0,1-1 pmol) de cada tipo de plasmídeo e ~0,5 μg (0,01 nmol) de proteína, dependendo dos requisitos experimentais. Use um tubo de baixa retenção para proteínas para que não sejam deixadas para trás nas paredes do tubo. Leve a solução até um mínimo de 3 μL com PBS, e ajuste o volume da solução para revestir toda a área das células a serem carregadas (ou seja, a microwell da câmara, Figura 1B).
- Misture bem a solução, encanar para cima e para baixo e/ou mexer o tubo. Gire brevemente a solução até a parte inferior do tubo em um microfuge de mesa.
- Transfira a solução de carregamento de contas e a câmara de células para uma capa de cultura tecidual. Realize as etapas restantes na capa da cultura tecidual usando técnica estéril.
- Remova o meio das células e armazene-o temporariamente em um tubo estéril. Aspire suavemente todos os meios ao redor das bordas da câmara, e incline a câmara em aproximadamente um ângulo de 45° e remova a gota restante de mídia no microwell central. Durante a remoção média, certifique-se de evitar deixar a ponta da pipeta tocar no vidro, o que pode resultar em descascamento e perda de células. Mova-se rapidamente para o próximo passo para que as células não fiquem secas por muito tempo.
- Pipeta suavemente a solução de carregamento de contas no microwell de vidro no centro da câmara. Opcional: Incubar com balanço suave por ~30 s sem permitir que a câmara seque completamente.
- Disperse suavemente uma monocamada de contas de vidro em cima das células, de preferência usando um aparelho de carregamento de contas(Figura 1A). Certifique-se de que as contas cobrem as células do microwell fundo de vidro completamente.
- Beliscando a câmara com dois dedos, bata-a contra a superfície do capô levantando-a ~2 polegadas e derrubando-a firmemente. Use uma força aproximadamente equivalente a deixar cair o prato dessa altura. Repita para um total de ~10 toques.
NOTA: Certifique-se de que as torneiras não descasquem substancialmente as células. O toque pode ser otimizado para o tipo de célula. Se as células carregarem mal, toque mais forte; no entanto, se muitas células se descascam, toque mais levemente. - Adicione suavemente o meio de volta na câmara, em pipetando lentamente no lado plástico da câmara. Tente aspirar quaisquer contas flutuantes sem perturbar as células. Adicione mais mídia pré-aquecida nesta etapa se muito for removido. Incubar as células por 0,5-2 h na incubadora.
- Esterilizar o carregador de contas por 15 minutos antes de devolvê-lo ao armazenamento em condições de dessecação.
- Adicione corante (por exemplo, mancha de ligante DAPI ou HaloTag, se necessário pelo experimento) às células de acordo com o protocolo recomendado pelo fabricante.
- Lave as células 3x com meio antes da imagem para remover as contas e o excesso de componentes de carregamento na solução. Evite a tubulação diretamente nas células para evitar que elas descasquem.
5. Imagem das células carregadas de contas
- Imagem as células imediatamente ou quando necessário pelo experimento. Use um microscópio capaz de capturar fluorescência (lasers ou fonte de luz monocromática). Certifique-se de que os comprimentos de onda de excitação sejam apropriados para o fluorohore ou corante escolhido (por exemplo, luz de comprimento de onda de 488 nm para proteína de fluorescência verde (GFP)).
NOTA: As proteínas carregadas de contas podem ser imagens assim que as células se recuperarem (assim que 30 min de carregamento pós para as linhas celulares descritas aqui). A expressão plasmid leva ≥2 h dependendo dos elementos vetoriais de expressão(Figura 1C, e de maior explicação na discussão). A imagem de células carregadas de contas pode ser realizada em qualquer microscópio equipado com as fontes fluorescentes apropriadas associadas a sondas carregadas, uma câmera capaz de capturar imagens de fluorescência, como um dispositivo acoplado a cargas multiplicadora de elétrons (EMCCD) ou câmera de semicondutor de óxido de metal (sCMOS) complementar científica, e uma incubadora para controlar temperatura, umidade e dióxido de carbono. Para um guia para microscopia de fluorescência, consulte 27.
Resultados
A aplicação mais comum de carregamento de contas é introduzir um ou mais tipos de proteína em células humanas aderentes. Para ilustrar isso, as células foram carregadas com uma solução de uma proteína Fab conjugada cy3 e Alexa488. Embora nem todas as células da microwell fossem carregadas de contas, as células que eram carregadas quase sempre tinham proteínas rotuladas cy3 e alexa488 juntas(Figura 2A). De acordo com uma estimativa anterior, quando 0,5 micrograma de Fab diluído em 4 microliters é carregado de contas29, como na Figura 2A, cada célula é carregada com cerca de 106 moléculas Fab.
Codificação de DNA plasmid GFP (1 μg de DNA plasmídeo, 1,8 μL de uma solução de 557 ng/μL) e 0,5 μg de Fab com rótulo Cy3 também foi introduzido nas células via carregamento de contas e posteriormente expresso e visualizado(Figura 2B). A fluorescência GFP indicou que o plasmídeo de codificação GFP não foi apenas carregado em células como também expresso. Assim, na mesma célula, o carregamento de contas pode introduzir uma sonda proteica (por exemplo, Fab com rótulo Cy3) e plasmid repórter (por exemplo, GFP), como realizado neste laboratório anteriormente22,23,24. Determinamos que 40% das células eram carregadas com proteína Fab e 21% das células carregadas de contas expressavam o plasmídeo co-carregado, como mostrado nos campos de visão representativos da Figura 2B. Normalmente, cada câmara é carregada com 1-2 μg de plasmídeo, aproximadamente a mesma quantidade que a lipofecção.
As células carregadas de contas expressam níveis amplamente variados de plasmídeos(Figura 2C,D). Para medir especificamente isso, utilizamos o teste de Razão de Pescador para comparar as distribuições de dados de proteína e intensidade plasmida. Os resultados mostraram que, embora as proteínas 1 e 2 tivessem distribuições de intensidade semelhantes (p = ~1), cada proteína tinha uma distribuição significativamente menor do que o plasmídeo (p = 3,2e-6 e 1,8e-5). Embora isso possa ser devido à variabilidade em quantos plasmídeos são carregados por célula, a maior fonte de variabilidade pode surgir das muitas etapas necessárias para a expressão plasmida que provavelmente variam muito entre as células, incluindo ser importada para o núcleo celular, transcrição e tradução. Em contraste, os níveis de proteínas carregadas de contas apresentaram leve variância celular-celular, e os níveis de duas proteínas carregadas simultaneamente foram altamente correlacionados entre si(Figura 2D,E).
A expressão plasmid pode ser vista tão cedo quanto o carregamento pós-contas de 2-4 h, mas pode ocorrer mais tarde, dependendo de quando a expressão plasmida ideal é obtida. Recomendamos a realização de um curso de tempo para determinar a melhor janela de expressão para um plasmídeo específico que abrange 2-24 h de carregamento pós-contas. Isso pode ser feito em uma câmara com imagens de longo prazo ou por carregamento de contas e câmaras cambaleantes. As células carregadas de contas permanecem aderentes e são saudáveis o suficiente para crescer e dividir. As células U2OS humanas carregadas de contas foram imagens diretamente antes, logo depois, e 24 horas após o carregamento de contas. O carregamento adequado de contas não teve quase nenhum efeito perceptível no número de células ou em sua morfologia, como mostrado na Figura 3A (esquerda, meio).
Em contraste, o carregamento de contas pobres com muitas contas e força de toque excessiva é retratado na Figura 3B. Isso causou muita perda celular (grandes manchas do vidro de cobertura sem células e células separadas, flutuantes, fora de foco), morfologia celular ruim (células aparecendo arredondadas e mal aderidas), e aglomerados de contas restantes no vidro de cobertura após o carregamento das contas. Embora as células sejam consideradas com danos mecânicos durante o carregamento de contas, as células cresceram e proliferaram na câmara devidamente carregada de contas, como evidenciado pelo aumento do número de células 24h após o carregamento de contas(Figura 3A, à direita). O efeito sobre a viabilidade celular pode ser avaliado através de uma variedade de ensaios, como um ensaio de 3-(4,5-dimetilthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT), para comparar as células carregadas de contas com células falsas30. Além disso, este e o trabalho anterior mostram que as células carregadas de contas passam por divisão celular (Figura 3C e Vídeo Suplementar 1), e o tempo de mitose não é afetado pelo carregamento de contas31, o que serve como mais uma evidência para a saúde celular sustentada após o carregamento das contas.
O carregamento de contas é uma técnica versátil, acomodando várias linhas celulares aderentes e várias macromoléculas. Aqui, essa variedade foi demonstrada carregando linhas celulares RPE1 e HeLa com Fab (Figura 4A, B). A Tabela 1 fornece mais exemplos de carregamento de contas em diferentes linhas celulares, neste laboratório e além, e aponta algumas das diferenças nuances entre protocolos de carregamento de contas de outros laboratórios. Note-se que o diâmetro das contas de vidro utilizadas para o carregamento varia muito entre os laboratórios, embora o carregamento mais eficiente tenha sido encontrado para pequenas contas de 75 μm de diâmetro em várias linhascelulares 14. Além disso, este laboratório começou a carregar contas RNA também (dados não mostrados). A Figura 4C exibe uma célula U2OS representativa carregada com um Cy5-RNA 9mer e Cy3-DNA 28mer juntos.
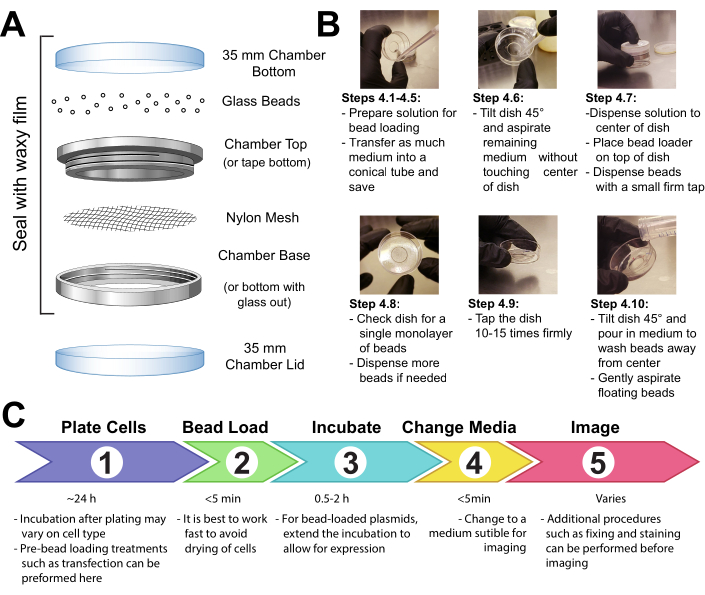
Figura 1: Aparelho de carregamento de contas, técnica e linha do tempo Clique aqui para ver uma versão maior desta figura.
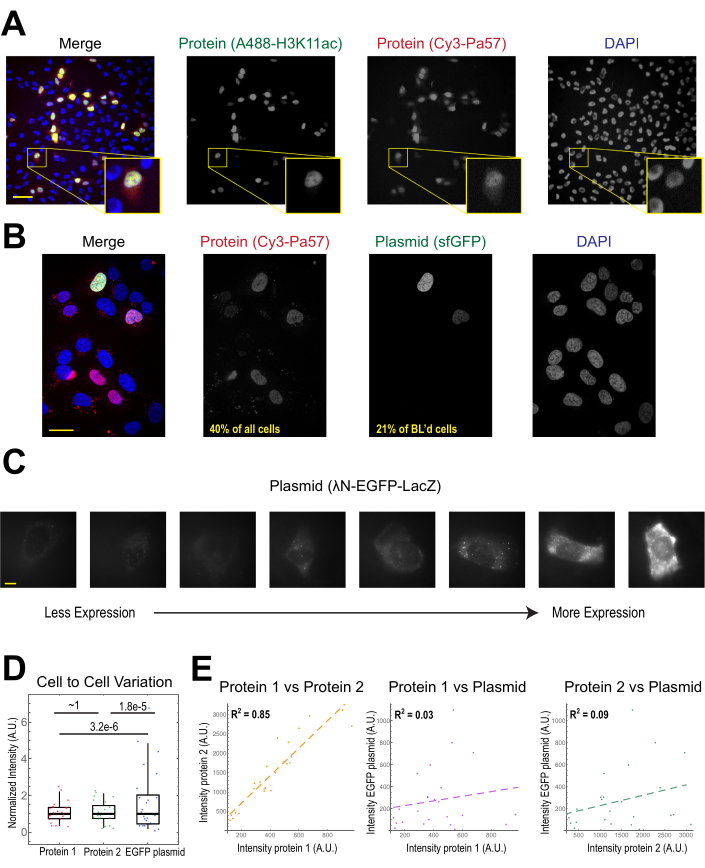
Figura 2. O carregamento de contas introduz baixa variabilidade na concentração de proteínas, mas alta variabilidade na expressão plasmida. (A) As células foram carregadas com 0,5 μg de cada um dos fab anti-H3K27 conjugados Alexa488 (verde) e cy3-conjugado anti-RNAPII-Serine 5-phosphorylated Fab (vermelho) em 4 μL de solução de carregamento de contas. As células foram manchadas de DAPI (azul) e, em seguida, imagens ao vivo imediatamente. Barras de escala = 20 μm. (B) As células foram carregadas com 0,5 μg de proteína Fab (Cy3-conjugada anti-RNAPII-Serina 5-fosfoilto, vermelho) e 1 μg de superpatos de codificação plasmid GFP-H2B (verde) em 4 μL de solução de carregamento de contas. Após 24 horas, as células foram manchadas de DAPI (azul) e imagens ao vivo. Barras de escala = 30 μm. (C-E) Proteína 1 (JF646-HaloLigand-rotulado HaloTag-MCP), proteína 2 (Cy3-conjugado anti-FLAG Fab) e uma codificação plasmida EGFP (λN-EGFP-LacZ) foram carregadas juntas em células. A intensidade total em cada canal fluorescente foi medida em um patch de 1,3 x 1,3 μm no citoplasma de cada célula. N = 25 células. (C) Células representativas expressando o plasmídeo carregado de contas, λN-EGFP-LacZ. As mesmas condições e intensidades de imagem foram utilizadas para todas as células. As manchas são agregados da proteína expressa. Barras de escala = 10 μm. (D) O gráfico mostra a intensidade total de cada célula de proteína 1, proteína 2 ou EGFP expressa a partir do plasmídeo. Cada canal foi normalizado para a mediana. Os valores P corrigidos por Bonferroni foram calculados pelo teste da Razão de Pescador para determinar se a distribuição de dados de proteína ou intensidade plasmida tem a mesma variabilidade. Cada ponto representa uma célula. (E) As intensidades totais para ambas as proteínas, proteínas 1 e plasmídeos, ou proteína 2 e plasmid, são traçadas umas contra as outras. Os valores calculados de R2 são exibidos. Cada ponto representa uma célula. Abreviaturas: DAPI = 4′,6-diamidino-2-fenilôdole; EGFP = proteína fluorescente verde aprimorada; A.U. = unidades arbitrárias; MCP = Proteína do casaco MS2; RNAPII = RNA polymerase II. Clique aqui para ver uma versão maior desta figura.
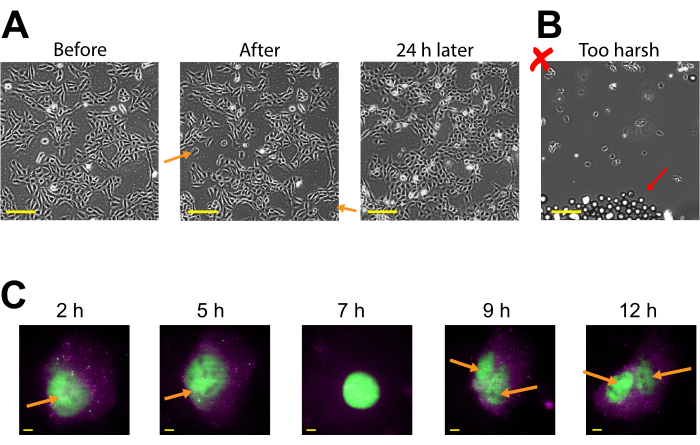
Figura 3: As células carregadas de contas permanecem aderentes e são saudáveis o suficiente para crescer e dividir. (A) As células U2OS foram carregadas com 0,5 μg de Cy3-conjugado anti-FLAG Fab em 4 μL de solução de carregamento de contas. As células foram imagens diretamente antes, logo após o carregamento das contas, e 24 horas após o carregamento das contas. As setas laranjas identificam áreas onde as células descascadas durante o carregamento de contas. Barras de escala = 2 mm. (B) Imagem representativa de células U2OS carregadas com componentes de (A) mas com toques ásperos e muitas contas. A seta vermelha identifica contas de vidro extras. Barra de escala = 2 mm. (C) As células U2OS foram carregadas com 1,5 μg do pládide de 14,4 kbp smFLAG-KDM5B-15xBoxB-24xMS2, 0,5 μg de Cy3-conjugado anti-FLAG Fab (verde), 130 ng de HaloTag-MCP (magenta) em 8 μL de solução de carregamento de contas. Logo antes da imagem, o HaloTag estava manchado com JF646-HaloLigand. Os loops-tronco MS2 do mRNA transcrito do plasmídeo repórter são rotulados por PCM (pontos magenta), e a proteína de repórter traduzida marcada pela BANDEIRA é rotulada por anti-FLAG Fab (colocalização verde para mRNA). Proteínas maduras rotuladas por Fab localizados ao núcleo. Esta célula foi imagem 4-15 h após o carregamento de contas. Setas amarelas identificam o núcleo celular antes e os núcleos após a divisão celular. Barras de escala = 5 μm. Abreviação: McP = Proteína do casaco MS2. Clique aqui para ver uma versão maior desta figura.
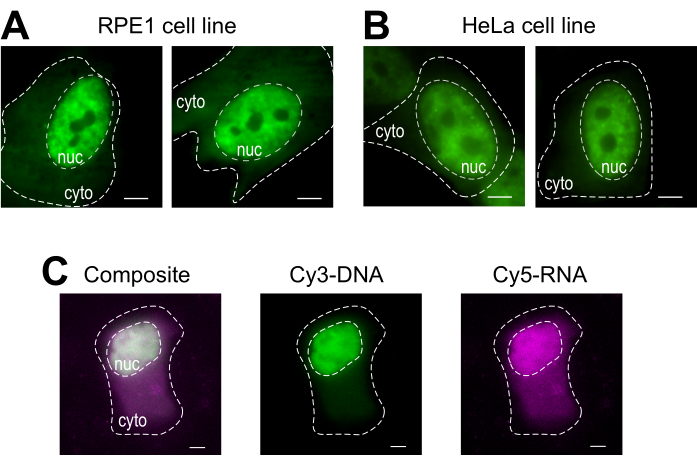
Figura 4: Variações no material de carregamento do tipo celular do protocolo de carregamento de contas. (A-B) As células RPE1 (A) e HeLa(B)foram carregadas com 1,5 μg de uma proteína fab nuclear (anti-RNAPII-Serine 5-fosforilação) em 4 μL de solução de carregamento. O núcleo de cada célula (nuc) e citoplasma (cito) estão marcados. As células foram imagens 6h depois de serem carregadas. Barras de escala = 5 μm. (C) As células Humanas U2OS foram carregadas com cy5-RNA 9mer (magenta) e oligos Cy3-DNA 28mer (verde), 10 picomoles de cada, em 4 μL de solução de carregamento de contas. As células foram imagens 4h depois de serem carregadas. Todos os núcleos celulares são destacados por uma linha tracejada. Barras de escala = 5 μm. Abreviaturas: RNAPII = RNA polymerase II. Clique aqui para ver uma versão maior desta figura.
| Linha celular | Tipo de célula | Eficácia do carregamento de contas | Notas/referência |
| Células-tronco (humanas) | Células-tronco embrionárias | Difícil | * Muitas células descascam durante o carregamento de contas se banhadas em placas revestidas de gelatina |
| HEK 293 | Células renais embrionárias humanas | Difícil | *Necessidade de estabelecer uma matriz de gel para a superfície da câmara de imagem antes do carregamento de contas. Toque suavemente quando o carregamento de contas no início. |
| Neurônios (rato) | Neurônios embrionários primários (e-18), dissociados | Muito ineficiente | *O carregamento eficiente de neurônios não foi observado usando este protocolo padrão de carregamento de contas. Isso pode ser devido à natureza não aderente dos neurônios ou de danos consequentes aos processos neurais. |
| MDCK (canino) | Células renais caninas madin-darby | Ver McNeil and Warder (1987)14 | *Carregamento de contas de baixa eficiência14 |
| U2OS (humano) | Osteossarcoma | Protocolo padrão de carregamento de contas | |
| HeLa (humano) | Cancro cervical | Protocolo padrão de carregamento de contas | |
| RPE1 (humano) | Células epiteliais imortalizadas com hTERT | Protocolo padrão de carregamento de contas | |
| HFF (humano) | Fibroblastos primários de prepúcio | Ver Besteiro et al. (2009)31 | *Protocolo modificado de inclinação em vez de tocar31 |
| BALB/c 3T3, NIH 3T3 e Swiss 3T3 (mouse) | Fibroblastos embrionários | Veja Gilmore e Romer (1996)32, Emerson et al. (2014)33 e McNeil e Warder (1987)14 | *425-600 contas de vidro relatadas32 |
| *Usado 200-300 μm contas de vidro33 | |||
| *75 contas de vidro μm deram melhores resultados do que 400 μm14 | |||
| DM (muntjac indiano) | Fibroblastos de pele | Veja Manders, Kimura e Cook (1999)34 | |
| CHO (hamster) | Células de ovário semelhantes a epiteliais | Ver Memedula e Belmont (2003)35 | *Usado 425-600 μm contas de vidro35 |
| BAE (bovino) | Células endoteliais aórticas bovinas (BAEC-11) | Ver McNeil and Warder (1987)14 | *75 contas de vidro μm deram melhores resultados do que 400 μm14 |
| PtK-2 (Potomus tridaclylis) | Células renais epiteliais | Ver McNeil and Warder (1987)14 | *75 contas de vidro μm deram melhores resultados do que 400 μm14 |
| HUVEC (humano) | Células endoteliais veias umbilicais | Ver Gilmore e Romer (1996)32 | *Usado 425-600 μm contas de vidro32 |
| J774 e J774.2 (mouse) | células de macrófago monócito | Veja Becker et al. (2005)36 e McNeil and Warder (1987)14 | *Agitação suave (em vez de tocar) e 425-600 contas de vidro36 |
| MS-5 (mouse) | células estrômicas de medula óssea | Ver Molenaar et al. (2003)37 | |
| WPE1-NB11 (humano) | células epiteliais da próstata | Ver Gilmore e Romer (1996)32 e | *Usado 425-600 μm contas de vidro32 |
| Emerson et al. (2014)33 | *Usado 200-300 μm contas de vidro33 |
Tabela 1: Carregamento de contas em diferentes linhas celulares. Para as linhas celulares que ainda não foram carregadas neste laboratório, são fornecidas referências e anotações sobre variações no protocolo.
Vídeo suplementar 1: Exemplo de uma célula carregada de contas em divisão celular. As células U2OS foram carregadas com 1,5 μg do 14,4 kbp plasmid smFLAG-KDM5B-15xBoxB-24xMS2, 0,5 μg de Cy3-conjugado anti-FLAG Fab (verde), 130 ng de HaloTag-MCP (magenta) em 8 μL de solução de carga de adálado conjugado. Logo antes da imagem, o HaloTag estava manchado com JF646-HaloLigand. Os loops-tronco MS2 do mRNA transcrito do plasmídeo repórter são rotulados por MCP (pontos magenta), e a proteína de repórter traduzida marcada por BANDEIRA é rotulada via anti-FLAG Fab (colocalização verde para mRNA). Proteínas maduras rotuladas por Fab localizados ao núcleo. Esta célula foi imagem 4-15 h após o carregamento de contas. Barra de escala = 10 μm. Abreviação: McP = Proteína do casaco MS2. Clique aqui para baixar este vídeo.
Discussão
A técnica de carregamento de contas descrita aqui é um método econômico e com eficiência temporal para introduzir macromoléculas e outras partículas em células aderentes. Este processo versátil pode carregar proteínas (Figura 2A)15,16,26,27, uma combinação de proteínas e plasmídeos(Figura 2B,C)22,25, RNA ( Figura4C), 100 e 250 nm contas poliestireno (correspondência pessoal), corantes sintéticos39 ou pontos quânticos34,40 . O carregamento de contas pode ter a capacidade de carregar outros tipos de partículas impermeáveis de membrana também. Sua aplicação mais usada é para carregar anticorpos ou Fabs para direcionar epítopos endógenos, como modificações pós-translacionais (PTMs), em células vivas. Metas, como PTMs, são frequentemente difíceis de rotular em células vivas sem sondas específicas de PTM estabelecidas e geneticamente codificadas41,42. Em contraste, o carregamento de contas pode introduzir vários tipos de sondas, repórteres ou outras ferramentas moleculares juntos na mesma célula para monitorar múltiplas leituras simultaneamente. Prevemos que o carregamento de contas será uma técnica útil para carregar uma variedade de macromoléculas ou partículas.
Uma grande vantagem do carregamento de contas é o baixo custo: cada experimento custa menos de 0,01 USD. Um aparelho de carregador de contas pode ser feito facilmente usando materiais baratos que custam no total ~$150, que é significativamente mais barato do que qualquer outro método de carregamento de células. O custo de um aparelho de carregador de contas pode ser reduzido para menos de US $ 10, substituindo a câmara de metal reutilizável por um plástico. Para isso, faça um furo em uma câmara de 35 mm ou remova o vidro de uma câmara de fundo de vidro de 35 mm e, em seguida, aperte firmemente a malha no lugar com fita. Em vez de um aparelho, o carregamento de contas pode até mesmo ser realizado usando uma ponta de pipeta de 1000 μL larga para colher e polvilhar contas nas células, embora essa variação dificulte polvilhar uma monocamada de contas sobre as células (passo 4.6).
Outro benefício do carregamento de contas é que as células podem reter a morfologia global normal, recuperar rapidamente e continuar a crescer e dividir, pelo menos para as células U2OS, RPE1 e HeLa estudadas aqui e para as outras linhas celulares estudadas em outros lugares(Figura 3; Figura 4A, B; Vídeo suplementar 1; e Tabela 1)31. Durante o carregamento de contas, as células sofrem estresse físico e, por vezes, desalojadas e descascam (~5% das células descascam em condições ideais, mas uma maior perda celular pode acontecer se o carregamento de contas for realizado com muita força ou muitas contas de vidro forem carregadas em cima das células, como descrito na Figura 3B). No entanto, as células carregadas de contas que permanecem presas ao deslizamento de cobertura geralmente parecem saudáveis e podem ser imagens logo após o carregamento de contas(Figura 3A). Geralmente permitimos às células um período de recuperação de 30 minutos, mas antecipamos que o carregamento pós-contas mais cedo é viável.
Uma grande desvantagem desta técnica é que as células precisam ser capazes de suportar um pequeno estresse físico durante o carregamento e permanecer seguramente aderentes ao deslizamento de tampas. Linhas celulares mal/não aderentes ou células cultivadas em placas revestidas (por exemplo, HEK e células-tronco) frequentemente se desprendem em toques suaves durante o carregamento de contas. Além disso, a experiência mostrou que os neurônios primários são muito sensíveis para o carregamento de contas.
O carregamento de contas é mais adequado para experimentos de células únicas ou de moléculas únicas. Em nossa experiência, o carregamento de contas tem uma eficiência de carregamento de proteínas de cerca de 20-40%, e ~20% das células carregadas de contas também expressaram um plasmídeo co-carregado(Figura 2A, B). Assim, plasmídeos de carregamento de contas podem ser menos eficientes para a expressão proteica do que o carregamento de contas de proteínas purificadas, porque os plasmídeos não devem apenas entrar nas células, mas também serem expressos (o que envolve, entre outras coisas, importação nuclear, transcrição e tradução, cada um dos quais pode diminuir a eficiência da expressão). A baixa eficiência da expressão plasmida carregada de contas pode ser contornada usando protocolos alternativos de transfecção, como lipofecção, antes de carregar proteínas ou sondas16,27. Além disso, incubar células em mídia ideal por 30 minutos antes do carregamento de contas pode ajudar a expressão plasmida. Devido à baixa expressão plasmida, o carregamento de contas não tem sido frequentemente usado como alternativa à transfecção à base de lipofecção neste laboratório. A única exceção é quando uma proteína purificada, como fab, deve ser co-carregada, nesse caso é bastante conveniente carregar a proteína e plasmídeo ao mesmo tempo. Além disso, para células que não são ressarcidas ou intolerantes à lipofecção, o carregamento de contas pode fornecer um método alternativo, embora de baixa eficiência, para expressão plasmida transitória.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Somos gratos aos membros do laboratório Stasevich por inúmeras conversas que ajudaram a melhorar e desenvolver este protocolo. Especificamente, Dr. Linda Forero e Dr. Phil Fox para conselhos sobre o carregamento de diferentes tipos de células. Gostaríamos de agradecer sinceramente a Dra. Somos muito gratos ao Dr. Ashok Prasad e ao Dr. Diego Krapf por compartilharem generosamente seus protocolos de carregamento de contas para introduzir partículas inorgânicas nas células. Somos gratos ao Dr. Travis Sanders, Craig Marshall e Dr. Thomas Santangelo por compartilharem generosamente seu reagente RNA rotulado. ALK, MNS, CAC, GG e TJS foram apoiados pela concessão do Instituto Nacional de Saúde (NIH) R35GM119728 e da Fundação Nacional de Ciência (NSF) BOLSA DE CARREIRA MCB-1845761, ambas para o TJS. A CAC também foi apoiada pelo prêmio NSF NRT DGE-1450032.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 cm cell culture dishes | VWR | 82050-916 | Use to culture cells |
| 35 mm cell culture dishes | Falcon | 353001 | Use to construct bead loader |
| Attofluor Cell Chamber | Thermo Fisher Scientific | A7816 | Use to construct the custom bead loader |
| DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960069 | Use in general cell culture |
| Drierite Indicating Absorbents | Thermo Fisher Scientific | 07-578-3B | Store the bead loader in a desiccator with these absorbent pellets |
| Fetal Bovine Serum | Atlas Biologics | F-0050-A | Use in general cell culture and as a supplement before bead loading |
| Glass beads, acid washed, ≤106 µm* | Millipore Sigma | G4649 | Sprinkle on cells to bead load plasmid DNA and proteins |
| Glass bottom dishes, 35 mm, #1.5, 14 mm glass | MatTek Corporation | P35G-1.5-14-C | Seed cells onto these chambers for imaging |
| L-Glutamine-200 mM | Thermo Fisher Scientific | 25030081 | Use to make DMEM + media |
| Opti-MEM, Reduced Serum Medium | Thermo Fisher Scientific | 31985070 | Optimal media for incubating cells before bead loading (optional step) |
| Parafilm | VWR | 52858-032 | waxy film used to construct bead loader |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140-122 | Use to make DMEM + media |
| Phenol-free DMEM | Thermo Fisher Scientific | 31053036 | Use on cells before imaging |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9625 | Working stock of sterile 1X PBS |
| Sodium Hydroxide (NaOH) | Thermo Fisher Scientific | S318-500 | Use 2 M solution to wash glass beads |
| Spectra Mesh Woven Filters, Polypropylene, 105 µm opening | Spectrum Labs | 148496 | Use to construct bead loader |
| Trypsin | Thermo Fisher Scientific | 25300062 | Use in general cell culture |
Referências
- Stewart, M. P., et al. In vitro and ex vivo strategies for intracellular delivery. Nature. 538 (7624), 183-192 (2016).
- Felgner, P. L., et al. Lipofection: a highly efficient, lipid-mediated DNA-transfection procedure. Proceedings of the National Academy of Sciences of the United States of America. 84 (21), 7413-7417 (1987).
- Schenborn, E. T., Goiffon, V. DEAE-dextran tansfection of mammalian cultured cells. Methods in Molecular Biology. 130, 147-153 (2000).
- Celis, J. E. Microinjection of somatic cells with micropipettes: comparison with other transfer techniques. Biochemical Journal. 223 (2), 281-291 (1984).
- Chakrabarti, R., Wylie, D. E., Schuster, S. M. Transfer of monoclonal antibodies into mammalian cells by electroporation. Journal of Biological Chemistry. 264 (26), 15494-15500 (1989).
- Wilson, A. K., Horwitz, J., De Lanerolle, P. Evaluation of the electroinjection method for introducing proteins into living cells. American Journal of Physiology. 260 (2), 355-363 (1991).
- Potter, H. Transfection by electroporation. Current Protocols in Molecular Biology. 62 (1), 1-6 (2003).
- Fawell, S., et al. Tat-mediated delivery of heterologous proteins into cells. Proceedings of the National Academy of Sciences of the United States of America. 91 (2), 664-668 (1994).
- Prior, T. I., FitzGerald, D. J., Pastan, I. Translocation mediated by domain II of Pseudomonas exotoxin A: transport of barnase into the cytosol. Biochemistry. 31 (14), 3555-3559 (1992).
- Walev, I., et al. Delivery of proteins into living cells by reversible membrane permeabilization with streptolysin-O. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3185-3190 (2001).
- Pitchiaya, S., Androsavich, J. R., Walter, N. G. Intracellular single molecule microscopy reveals two kinetically distinct pathways for microRNA assembly. EMBO Reports. 13 (8), 709-715 (2012).
- McNeil, P. L., Murphy, R. F., Lanni, F., Taylor, D. L. A method for incorporating macromolecules into adherent cells. The Journal of Cell Biology. 98 (4), 1556-1564 (1984).
- Ortiz, D., Baldwin, M. M., Lucas, J. J. Transient correction of genetic defects in cultured animal cells by introduction of functional proteins. Molecular and Cellular Biology. 7 (8), 3012-3017 (1987).
- McNeil, P. L., Warder, E. Glass beads load macromolecules into living cells. Journal of Cell Science. 88 (5), 669-678 (1987).
- Hayashi-Takanaka, Y., et al. Tracking epigenetic histone modifications in single cells using Fab-based live endogenous modification labeling. Nucleic Acids Research. 39 (15), 6475-6488 (2011).
- Morisaki, T., et al. Real-time quantification of single RNA translation dynamics in living cells. Science. 352 (6292), 1425-1429 (2016).
- Tanenbaum, M. E., Gilbert, L. A., Qi, L. S., Weissman, J. S., Vale, R. D. A protein-tagging system for signal amplification in gene expression and fluorescence imaging. Cell. 159 (3), 635-646 (2014).
- Zhao, N., et al. A genetically encoded probe for imaging nascent and mature HA-tagged proteins in vivo. Nature Communications. 10 (1), 2947(2019).
- Jedlitzke, B., Mootz, H. D. Photocaged nanobodies delivered into cells for light activation of biological processes. ChemPhotoChem. 5 (1), 22-25 (2021).
- Coulon, A., et al. Kinetic competition during the transcription cycle results in stochastic RNA processing. eLife. 3, 03939(2014).
- Pichon, X., Robert, M. -C., Bertrand, E., Singer, R. H., Tutucci, E. New generations of MS2 variants and MCP fusions to detect single mRNAs in living eukaryotic cells. Methods in Molecular Biology. 2166, 121-144 (2020).
- Koch, A., et al. Quantifying the dynamics of IRES and cap translation with single-molecule resolution in live cells. Nature Structural & Molecular Biology. 27, 1095-1104 (2020).
- Moon, S. L., et al. Multicolor single-molecule tracking of mRNA interactions with RNP granules. Nature cell biology. 21 (2), 162-168 (2019).
- Moon, S. L. Coupling of translation quality control and mRNA targeting to stress granules. Journal of Cell Biology. 219 (8), 202004120(2020).
- Cialek, C. A., et al. Imaging translational control by Argonaute with single-molecule resolution in live cells. bioRxiv. , (2021).
- Forero-Quintero, L. S., et al. Live-cell imaging reveals the spatiotemporal organization of endogenous RNA polymerase II phosphorylation at a single gene. bioRxiv. , (2020).
- Lyon, K., Aguilera, L. U., Morisaki, T., Munsky, B., Stasevich, T. J. Live-cell single RNA imaging reveals bursts of translational frameshifting. Molecular Cell. 75 (1), 172-183 (2019).
- JoVE. Introduction to Fluorescence Microscopy. General Laboratory Techniques. JoVE Science Education Database. , JoVE. Cambridge, MA. (2021).
- Hayashi-Takanaka, Y., Yamagata, K., Nozaki, N., Kimura, H. Visualizing histone modifications in living cells: spatiotemporal dynamics of H3 phosphorylation during interphase. Journal of Cell Biology. 187 (6), 781-790 (2009).
- Kumar, P., Nagarajan, A., Uchil, P. D. Analysis of cell viability by the MTT assay. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Stasevich, T. J., et al. Regulation of RNA polymerase II activation by histone acetylation in single living cells. Nature. 516 (7530), 272-275 (2014).
- Besteiro, S., Michelin, A., Poncet, J., Dubremetz, J. -F., Lebrun, M. Export of a Toxoplasma gondii rhoptry neck protein complex at the host cell membrane to form the moving junction during invasion. PLOS Pathogens. 5 (2), 1000309(2009).
- Gilmore, A. P., Romer, L. H. Inhibition of focal adhesion kinase (FAK) signaling in focal adhesions decreases cell motility and proliferation. Molecular Biology of the Cell. 7 (8), 1209-1224 (1996).
- Emerson, N. T., Hsia, C. -H., Rafalska-Metcalf, I. U., Yang, H. Mechanodelivery of nanoparticles to the cytoplasm of living cells. Nanoscale. 6 (9), 4538-4543 (2014).
- Manders, E. M. M., Kimura, H., Cook, P. R. Direct imaging of DNA in living cells reveals the dynamics of chromosome formation. Journal of Cell Biology. 144 (5), 813-822 (1999).
- Memedula, S., Belmont, A. S. Sequential recruitment of HAT and SWI/SNF components to condensed chromatin by VP16. Current Biology. 13 (3), 241-246 (2003).
- Becker, T., Volchuk, A., Rothman, J. E. Differential use of endoplasmic reticulum membrane for phagocytosis in J774 macrophages. Proceedings of the National Academy of Sciences of the United States of America. 102 (11), 4022-4026 (2005).
- Molenaar, C., et al. Visualizing telomere dynamics in living mammalian cells using PNA probes. The EMBO Journal. 22 (24), 6631-6641 (2003).
- Jones, S. A., Shim, S. -H., He, J., Zhuang, X. Fast, three-dimensional super-resolution imaging of live cells. Nature Methods. 8 (6), 499-505 (2011).
- Sabri, A., Xu, X., Krapf, W. M. Elucidating the origin of heterogeneous anomalous diffusion in the cytoplasm of mammalian cells. Physical Review Letters. 125 (5), 053901(2020).
- Sato, Y., et al. Genetically encoded system to track histone modification in vivo. Scientific Reports. 3, 2436(2013).
- Sato, Y., Stasevich, T. J., Kimura, H. Visualizing the dynamics of inactive X chromosomes in living cells using antibody-based fluorescent probes. X-Chromosome Inactivation. Methods in Molecular Biology. 1861, Humana. New York, NY, USA. 91-102 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados