É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microscopia de Fluorescência para Internalização ATP Mediada por Macropinocistose em Células tumorais humanas e camundongos tumorais-xenorgrafados
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Desenvolvemos um método reprodutível para visualizar a internalização do triphosfato fluorescente nãohydrolyzável (ATP), um substituto da ATP, com alta resolução celular. Validamos nosso método usando linhas celulares tumorais in vitro e in vivo e camundongos imunodeficentes xenoenxerados com tecido tumoral humano.
Resumo
O triphosfato de adenosina (ATP), incluindo o ATP extracelular (eATP), tem mostrado desempenhar papéis significativos em vários aspectos da tumorigênese, como resistência a medicamentos, transição epitelial-mesenquimal (EMT) e metástase. O eATP intratumoral é 103 a 104 vezes maior em concentração do que em tecidos normais. Enquanto o eATP funciona como um mensageiro para ativar a sinalização purinérgica para indução de EMT, ele também é internalizado por células cancerígenas através de macropinocose regulamentada, um tipo específico de endocitose, para executar uma grande variedade de funções biológicas. Essas funções incluem fornecer energia para reações bioquímicas que requerem ATP, doar grupos de fosfato durante a transdução de sinal e facilitar ou acelerar a expressão genética como um cofator transcricional. A ATP está prontamente disponível, e seu estudo sobre câncer e outros campos, sem dúvida, aumentará. No entanto, o estudo eATP permanece em um estágio inicial, e questões não resolvidas permanecem sem resposta antes que as atividades importantes e versáteis desempenhadas pelo eATP e atp intracelular internalizada possam ser totalmente desvendadas.
As contribuições desses laboratórios para esses estudos iniciais do EATP incluem imagens microscópicas de ATP fluorescentes não hidrogáveis, juntamente com dextrans fluorescentes de alto e baixo peso molecular, que servem como rastreadores de macropinocose e endocitose, bem como vários inibidores de endocitose, para monitorar e caracterizar o processo de internalização eATP. Essa modalidade de imagem foi aplicada às linhas de células tumorais e a camundongos imunodeficentes, xenoengrafados com tumores de câncer humano, para estudar a internalização eATP in vitro e in vivo. Este artigo descreve esses protocolos in vitro e in vivo, com ênfase em modificar e afinar as condições de ensaio para que os ensaios de internalização eATP mediados pela macropinocis-/endocitose possam ser realizados com sucesso em diferentes sistemas.
Introdução
A absorção oportunista de nutrientes extracelulares intratumorais (ou seja) foi recentemente nomeada uma marca fundamental para o metabolismo do câncer1. Um desses nutrientes importantes é o ATP, pois a concentração de ieATP é 103 e 104 vezes maior do que a encontrada em tecidos normais, na faixa de várias centenas de μM a baixo mM2,3,4,5. Como uma molécula chave de energia e sinalização, a ATP desempenha um papel central no metabolismo celular em células cancerosas e saudáveis6,7,8. A ATP extracelular não está apenas envolvida no crescimento de células cancerosas, mas também promove a resistência a medicamentos9. Funções não reconhecidas anteriormente da ATP, como a atividade hidrotrópica, foram recentemente identificadas, implicando assim o envolvimento da ATP em doenças como o Alzheimer10. De fato, parece que nossa compreensão da ATP e suas funções em células cancerosas, células saudáveis e outras células doentes está longe de ser completa. No entanto, devido à instabilidade da ATP e às altas taxas de rotatividade nas células, é tecnicamente desafiador monitorar o movimento da ATP através da membrana celular e para a célula.
Para enfrentar esse problema e suprir a necessidade desta área de pesquisa, foi desenvolvido um método no qual o ATP fluorescente não higdrolyzável (NHF-ATP) (Figura 1) foi utilizado como substituto para visualizar a internalização da ATP e observar a localização espacial intracelular da ATP internalizada, tanto in vitro quanto in vivo11,12 . A NHF-ATP foi demonstrada para substituir o ATP endógeno para investigar o movimento da ATP em membranas celulares animais, tanto em linhas de células cancerosas quanto em tecido tumoral humano xenoenxerado em camundongos imunodeficentes11,12. Além disso, a administração de inibidores de macropinocise às células bloqueadas da internalização eATP, sugerindo que a absorção intracelular do eATP envolve um mecanismo macropinocistótico9,11,12. Este protocolo permite a colação imunobasada contra proteínas específicas de células e, portanto, a identificação de qual tipo de célula internaliza o NHF-ATP. Usando xenoenxertos de tumor in vivo e microscopia de alta resolução, o NHF-ATP pode ser visualizado espacialmente através da amostra de tecido e até mesmo dentro de uma única célula. Esses métodos também permitem análise quantitativa, como o percentual de captação celular, número de vesículas macropinocitóticas e cinética de internalização. Este artigo descreve em detalhes como o NHF-ATP, trabalhando sozinho ou em conjunto com o dextrans fluorescente endocitose-tracer13,14,15,16, pode ser usado em diferentes ambientes experimentais para estudar a internalização e localização intracelular da ATP, após a internalização nas células.

Figura 1: Estruturas de ATP fluorescente não-higrobrizável e tetrametilrhodamina rotuladas dextran fluorescente de alto peso molecular. (A) Estrutura de NHF-ATP. (B) Representação esquemática de HMWFD. Abreviaturas: ATP = triphosfato de adenosina; NHF-ATP = ATP fluorescente nãohydroable; TMR = tetrametilarhodamina; HMWFD = dextran fluorescente de alto peso molecular. Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos os procedimentos aqui relatados foram realizados de acordo com o IACUC da Universidade de Ohio e com o NIH.
1. Seleção de ATP fluorescente não higdrolyzável (NHF-ATP) e dextrans
- Selecione um NHF-ATP conjugado fluoróforo (Figura 1A) e rastreadores de endocitose, dextrans fluorescentes de alto e baixo peso molecular (TMR-HMWFD e TMR-LMWFD)(Figura 1B),com base nos comprimentos de onda de emissão preferidos (por exemplo, sistema de imagem equipado com filtros apropriados) e no processo de endocitose específica a ser estudado.
2. Estudos de localização de ATP, in vitro (Figura 2)
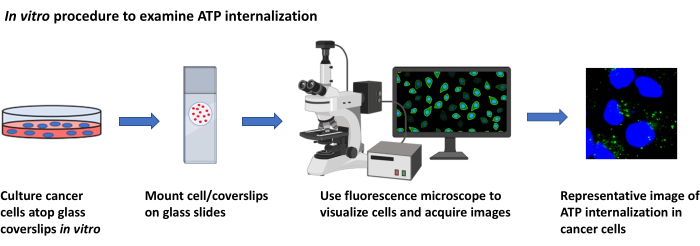
Figura 2: Procedimento in vitro para examinar a internalização da ATP. Representação esquemática do protocolo para visualizar a internalização da ATP extracelular em células cancerígenas cultivadas usando microscopia de fluorescência. Clique aqui para ver uma versão maior desta figura.
- Cultura celular e preparação de células
NOTA: Realize a cultura celular em condições estéreis em uma capa de cultura tecidual.- Prepare o Mdum de Águia Modificada (DMEM) de Dulbecco, contendo 10% (v/v) soro bovino fetal (FBS) e penicilina/estreptomicina de 1% (v/v) (doravante chamado D MEM/FBS), soro fisiológico estéril tamponado (PBS) e 0,25% de trippsina/etilenodiaminetetraactic ácido (EDTA), em um banho de água de 37 °C.
- Cultura células cancerígenas humanas em DMEM/FBS em um prato de cultura de tecido de 100 mm. Mantenha as células em uma incubadora definida a 37 °C com uma atmosfera de CO2 de 5%.
- Quando as células atingem a confluência, passagem as células pela primeira vez removendo o meio de cultura. Em seguida, enxágue o prato com 5 mL de PBS estéril, retire o PBS e adicione 3 mL de trippsina de 0,25%. Incubar a 37 °C em uma atmosfera de 5% de CO2 por 5 min.
- Recupere o prato e adicione 6 mL de DMEM/FBS para parar a experimentação. Transfira as células em suspensão para um tubo cônico de 15 mL e centrífuga a 800 × g por 5 min para pelotar as células.
- Após a centrifugação, aspire o supernaente e use 10 mL de DMEM/FBS para resuspensar a pelota da célula por pipetação.
- Conte a densidade celular e viabilidade usando um hemótmetro. Use DMEM/FBS para diluir a suspensão celular a uma densidade de ~7,5 × 104 células/mL.
- Preparação de tampas e células de semeadura
- Lave as tampas de 12 mm com 70% de etanol e limpe-as cuidadosamente com lenços de tarefa delicados. Esterilize as tampas e um par de fórceps através de autoclavagem.
- Em uma capa de cultura de tecido, use fórceps para colocar uma mancha em cada poço de uma placa de cultura de tecido de 24 poços.
NOTA: Mais tarde, o deslizamento de cobertura, com células, será montado diretamente em um slide de microscópio para imagem. - Dispense 300 μL da suspensão celular (células em DMEM/FBS), a uma densidade de semeadura de ~2,5 × 104 células por poço, na placa de 24 poços contendo as tampas esterilizadas. Incubar em condições estéreis a 37 °C com 5% de fluxo de CO2.
- Fome de células
- Vinte e quatro horas após a semeadura, remova o DMEM/FBS de cada poço. Adicione imediatamente 300 μL de DMEM sem soro pré-armado em cada poço para matar as células por 15-18 h para induzir a absorção de nutrientes extracelulares.
NOTA: O período de fome de 15-18 h é um parâmetro crítico.
- Vinte e quatro horas após a semeadura, remova o DMEM/FBS de cada poço. Adicione imediatamente 300 μL de DMEM sem soro pré-armado em cada poço para matar as células por 15-18 h para induzir a absorção de nutrientes extracelulares.
- Preparação de soluções NHF-ATP e HMWFD/LMWFD
- Use um equilíbrio analítico para pesar TMR-dextran fluorescente de alto peso molecular (70 kDa) fluorescente (TMR-HMWFD, 1 mg/mL), um rastreador para visualizar macropinossomos, ou NHF-ATP (10 μmol/L) em DMEM sem soro em um tubo de microcentrífuso de 1,5 mL. Coloque os tubos, protegidos da luz, em um banho de água de 37 °C por 15 minutos.
- Centrifugar a 12.000 × g por 5 min a temperatura ambiente. Transfira cuidadosamente o supernatante claro para um novo tubo de microcentrifusagem de 1,5 mL, deixando qualquer pelota ou detritos intactos para remover cristais indissolúveis.
- Adicione as soluções da etapa 2.4.1 às células em cada poço, e incuba as células por 30 min a 37 °C.
NOTA: Se as soluções HMWFD e NHF-ATP forem misturadas para co-incubação com as células, prepare ambas as soluções em 2x as concentrações finais. As soluções serão misturadas mais tarde a uma proporção de 1:1 para alcançar as concentrações de trabalho precisas finais. Evite a luz, pois os reagentes são sensíveis à luz.
- Tratamento de células e fixação
- Em uma placa fresca de 24 poços, dispense 500 μL de PBS pré-armado em cada um dos cinco poços.
- Após a incubação celular, pegue cuidadosamente cada mancha de cobertura usando fórceps. Enxágüe cada deslizamento mergulhando-o em 500 μL de PBS pré-armado. Repita cinco vezes usando os cinco poços cheios de PBS.
NOTA: A lavagem suave de clipes de células-sobre-tampas é fundamental para o sucesso deste experimento. - Após a lavagem final do PBS, toque na tampa em uma delicada limpeza de tarefa para absorver PBS extra e transfira o deslizamento de tampa imediatamente para frio (4 °C) 3,7% de formaldeído, pré-carregado em uma placa de 24 poços. Conserte as células por 15 minutos em temperatura ambiente.
- Enquanto as células estão sendo fixadas, o microscópio pré-limpo desliza com 70% de etanol. Remova as tampas dos poços e monte-as nos slides, utilizando 5 μL de meio de montagem aquoso contendo a mancha nuclear 4′,6-diamidino-2-fenilndole (DAPI), por deslizamento de cobertura. Limpe suavemente o excesso de PBS com uma toalha de papel ou uma limpeza de tarefa delicada.
- Microscopia de fluorescência e aquisição de imagens
- Duas a 24 horas após as etapas acima, capture imagens de células e HMWFD internalizado e/ou NHF-ATP usando um sistema de imagem de epifluorescência e software de aquisição de dados.
NOTA: Esta sub seção descreve etapas para adquirir imagens usando um microscópio Nikon NiU, equipado com capacidade de imagem de epifluorescência, e software Nikon NIS Elements. No entanto, outros sistemas de imagem comparáveis e software de aquisição podem ser usados. Siga as instruções de operação do fabricante.- Coloque o slide no palco de um microscópio de epifluorescência vertical no modo binocular. Acesse o programa de imagem.
- Selecione o objetivo de 10x, ajuste o estágio para definir o foco e escaneie o slide da esquerda para a direita de forma serpentina para identificar as regiões de interesse.
NOTA: As regiões de interesse da identificação variam entre os tipos de células, com algumas linhas celulares/tipos de câncer exibindo graus diversos e distintos de absorção TMR-HMWFD e/ou NHF-ATP. - Selecione o objetivo de 40x e mude do modo binóculo para o modo de captura de imagem, usando o alternador no microscópio.
- Clique no ícone Qualidade Ao Vivo no programa de imagem para visualizar e, posteriormente, adquirir imagens.
- Utilizando o Painel OC na barra de ferramentas Anotações e Medidas, defina os parâmetros de exposição para cada cubo de filtro ou canal fluorescente.
NOTA: Selecione o tempo de exposição adequado para cada canal, pois as intensidades do sinal são diferentes. Por exemplo, selecione um tempo de exposição de 200 ms para DAPI, 2 s para HMWFD e 4 s para NHF-ATP. Uma vez determinado o tempo de exposição por canal, use esta configuração para todas as imagens, por canal, com diferentes tratamentos ou condições. - Uma vez definidas as configurações de exposição para cada canal, use a barra de ferramentas de aquisição multicanal para adquirir uma imagem de 3 canais com as configurações de exposição definidas.
NOTA: A aquisição de imagens através do modo de aquisição multicanal ND permite a captura automática de imagens para cada canal do mesmo campo de visão. O obturador é fechado automaticamente entre as mudanças da torre. - Alternativamente, adquira imagens multicanais manualmente, inclinando-se entre cubos de filtro, definindo o tempo de exposição, fechando/abrindo obturador entre a aquisição de imagem para cada canal e sobrepondo cada imagem tirada para canais individuais.
NOTA: O modo de aquisição da ND automatiza esse processo e fornece imagens mescladas. - Salve a imagem como arquivo .nd2 (o formato Nikon Elements salva metadados). Salvar arquivos TIF, incluindo a imagem do canal mesclado e imagens individuais do canal.
NOTA: Os arquivos TIF podem ser usados com uma seleção mais ampla de aplicativos de software. - Use o recurso Contagem de objetos na barra de ferramentas De análise para contar o número de células nhf-ATP-, TMR-HMWFD-e/ou TMR-LMWFD-positive em um arquivo de imagem .nd2 salvo.
- Exporte os dados para uma planilha através do programa de análise.
- Duas a 24 horas após as etapas acima, capture imagens de células e HMWFD internalizado e/ou NHF-ATP usando um sistema de imagem de epifluorescência e software de aquisição de dados.
- Quantificação e análise de dados
- Para cada condição avaliada, imagem de 50 a 100 células para quantificação. Usando o software de análise de dados (software incluído no sistema de imagem de epifluorescência ou outro software), conte e calcule o número médio de vesículas fluorescentes por célula.
- Utilize métodos estatísticos apropriados para analisar os resultados quantificados.
3. Internalização ATP em tumores, ex vivo (Figura 3)

Figura 3: Procedimento in vivo para examinar a internalização da ATP. Representação esquemática do protocolo para visualizar a internalização de ATP extracelular em xenoenxertos tumorais usando criosectioning e microscopia de fluorescência. Clique aqui para ver uma versão maior desta figura.
- Preparação de culturas celulares para implantação
- Cresça células cancerígenas a 80% de confluência a 37 °C em um frasco de 225 cm2, utilizando DMEM complementado com FBS, até uma concentração final de 10% (v/v) e penicilina/estreptomicina a 1% (v/v).
- Lave as células duas vezes com 10 mL de PBS. Pré-aqueça 0,25% trypsin/EDTA a 37 °C. Adicione 8 mL de trippsina/EDTA e incubar a 37 °C por 2 min.
- Uma vez que as células comecem a se desprender da parte inferior do frasco, use uma pipeta serológica estéril de 10 mL para adicionar 8 mL de DMEM/FBS. Aspire duas vezes para desalojar qualquer célula aderente. Use a pipeta para transferir as células separadas do frasco para um tubo cônico de 50 mL.
- Adicione 10 mL de DMEM/FBS usando uma pipeta de 10 mL e colete todas as células flutuantes restantes no mesmo tubo cônico de 50 mL.
- Centrifugar a suspensão da célula a 600 × g, 4 °C por 4 min. Remova o supernasce e resuspense as células em 1 mL de PBS gelado.
- Conte a densidade celular usando um hemócito. Mantenha a suspensão da célula no gelo enquanto conta.
- Centrifugar a suspensão da célula a 600 × g, 4 °C por 4 min. Remova o supernasce e suspenda as células em PBS gelado de tal forma que a densidade celular se torne 5 × 106 células por 100 μL de PBS. Transfira a suspensão celular para um tubo de microcentrífuga de 1,5 mL.
- Injeção subcutânea de células cancerígenas para desenvolvimento de tumor xenoenxerto
- Use uma seringa sem látex (1 mL) com uma agulha deslizante de precisão (agulha de 27 G) para injeção de células cancerosas.
- Transfira a suspensão celular (5 × 106 em 100 μL de PBS) para um tubo de microcentrifuge de 1,5mL. Desenhe as células para dentro da seringa.
- Selecione um local de injeção no flanco de um rato imunodeficente (nu) e limpe suavemente a pele usando 75% de etanol. Limpe o excesso de etanol com uma delicada limpeza de tarefas.
- Para injeção subcutânea, segure a agulha em um ângulo de aproximadamente 10° para a pele. Insira a ponta da agulha, lado bevel para cima, logo abaixo da pele, de modo que apenas 1-2 mm da agulha seja visível fora da pele. Dispense as células da seringa lentamente ao longo de aproximadamente 10 s.
- Depois de injetar todo o volume, continue a segurar a agulha no lugar por 3-5 s, depois retire a agulha e use um dedo para aplicar pressão suave, mas firme no local da injeção por mais 3-5 segundos para evitar o vazamento do conteúdo injetado.
- Monitore e meça o crescimento do tumor usando pinças vernier até que os tumores atinjam um volume de 200-500 mm3.
- Preparação de soluções HMWFD e NHF-ATP para serem usadas ressecção pós-tumor
- Dissolver 300 μL de 16 mg/mL HMWFD em DMEM livre de soro (meio de cultura), incubar em um banho de água de 37 °C por 30 min e centrífuga a 12.000 × g por 5 min como descrito acima. Transfira a solução para um tubo de microcentrifuuge de 1,5 mL.
- Adicione 40 μL de ações analógicas NHF-ATP (1 mM) a 160 μL de DMEM sem soro para preparar uma solução NHF-ATP de 0,2 mM.
- Preparação de poços experimentais
NOTA: Este projeto experimental irá avaliar a internalização intracelular do HMWFD + NHF-ATP, indicativo de absorção por macropinossomos.- Prepare os poços da seguinte forma: Bem #1, Controle: 200 μL de DMEM sem soro; Bem #2, Controle: 100 μL de 16 mg/mL LMWFD + 100 μL de DMEM sem soro = 200 μL de 8 mg/mL LMWFD; Bem #3, Controle: 100 μL de 0,2 mM NHF-ATP + 100 μL de DMEM sem soro = 200 μL de 0,1 mM NHF-ATP; Bem #4; Experimental: 100 μL de 16 mg/mL HMWFD + 100 μL de 0,2mM NHF-ATP = 200 μL de 0,1 mM NHF-ATP e 8 mg/mL HMWFD.
- Preparação de tecidos tumorais
- Eutanize o rato por deslocamento cervical ou de acordo com o protocolo aprovado pela IACUC.
- Use um bisturi tamanho 10 para cortar os tumores isolados a uma espessura de ~500-1.000 μm.
- Incubar as fatias tumorais em DMEM sem soro suplementadas com 100 μM NHF-ATP e/ou 8 mg/mL H/LMWFD em tubos de microcentrifuuge por 40 min a 37 °C com 5% de fluxo de CO2.
NOTA: Após a incubação, o metabolismo do tecido tumoral faz com que a cor do meio mude. - Enxágüe os tecidos em PBS pré-ensacado de 37 °C (2 mL para cada lavagem em uma placa de 24 poços).
- Transfira o tecido para uma nova placa de 24 poços com PBS fresco pré-armado, enxágue e repita quatro vezes com agitação suave.
- Incorporação crio-embedante (preparação de blocos de tecido congelado)
- Prepare os rótulos de identificação para cada tumor a ser colhido. Corte um pedaço de 2 cm de fita de laboratório e dobre ao meio, lados adesivos juntos, longitudinalmente. Use uma caneta de marcação para rotular a etiqueta, por exemplo, com um número de identificação de mouse/tumor.
- Prepare os moldes de incorporação colocando moldes de tecido de aço inoxidável diretamente no gelo seco.
NOTA: O gelo seco pode causar queimaduras, queimaduras e asfixia. Use luvas isoladas ao manusear gelo seco. Use gelo seco em uma área bem ventilada. Não guarde gelo seco em um recipiente bem selado. Em vez disso, armazene em um recipiente (como um refrigerador de isopor) que permite que o gás escape. - Enquanto o molde esfria, coloque uma pequena piscina de meio de congelamento de tecido em uma placa de cultura de tecido de 10 mm. Certifique-se de que o volume é suficiente para submergir o tecido tumoral que será colhido.
- Use uma colher perfurada para colher o tecido tumoral ressecado e coloque imediatamente o tecido em um meio de congelamento, garantindo que o tecido esteja submerso. Usando a colher perfurada, role suavemente o tecido no meio de congelamento, garantindo que o meio esteja banhando todas as superfícies teciduais.
- Mova cuidadosamente o tecido para o molde de incorporação contendo o meio de congelamento. Coloque a etiqueta correspondente verticalmente no meio/molde de congelamento para congelar no lugar. Certifique-se de que o rótulo escrito esteja visível fora do meio.
- Quando o congelamento estiver completo (o meio congelante fica opaco-branco), retire o bloco de tecido do molde, coloque-o em gelo seco e repita para cada tumor. Armazene os blocos de tecido a -80 °C por vários meses antes do procedimento de criosecção.
- Preparação de slides de amostras de tecidos
- Para maximizar a chance de encontrar células internalizadas positivas e ter regiões teciduais mais representativas, colete crioseções seriais a -18 a -20 °C usando um criostat.
- Ferramentas de criostat (lâmina, lâmina, lâmina de barbear, placa anti-rolo, suporte para mandril de tecido, pincel) e equilibram os blocos de tecido tumoral colocando-os em uma câmara criostat em -18 a -20 °C. Coloque o ângulo do suporte da lâmina em 5-10°. Corte cuidadosamente o bloco de tecido, conforme necessário, com uma lâmina de barbear, e monte-o no porta-mandril usando o meio de congelamento de tecido como "cola".
- Coloque o suporte de mandril na posição vertical da unidade de microtome, que avança para a distância definida (por exemplo, 10 μm) a cada volta da manivela manual. Posicione a placa anti-rolo para descansar um pouco acima da altura da lâmina. Para evitar que o tecido se enrole antes de avançar o microtómeo, deslize cuidadosamente o polegar sobre a borda inferior do bloco tecidual.
- À medida que o microtoma avança e a seção de tecido cai sobre a placa de metal, use um pincel para guiar a seção tecidual e desenrolar o tecido, se necessário.
- Passe o microscópio sobre a seção tecidual sem tocar para que a seção seja atraída para o slide.
NOTA: As lâminas criostat (de alto perfil, descartáveis) são extremamente afiadas e podem causar ferimentos graves. Tenha cuidado ao manusear lâminas e operar o criostat. Use um protetor de lâmina, se disponível. Treinamento adequado é necessário. - Corte o tumor em seções de 10 μm de espessura. Transfira imediatamente as seções fatiadas para um slide de microscópio de vidro carregado positivamente.
NOTA: Para seções seriais, primeiro colete uma seção de 10 μm de espessura no canto superior esquerdo de cada um dos oito slides carregados positivamente. Avance o criostat através de 100-200 μm subsequentes de tecido, e descarte o tecido. Transfira imediatamente todas as seções fatiadas em lâminas de microscópio de vidro. - Em seguida, colete outra seção de 10 μm de espessura, ao lado da seção de tecido previamente colocada, para cada um dos oito slides. Repita este processo de coleta serial até que cada um dos oito slides contenha oito seções de tecido, cada 100-200 μm de distância. Mantenha as seções de tecido no escuro para preservar a fluorescência.
NOTA: As seções de tecido em lâminas podem ser armazenadas em uma caixa de slides a -80 °C por vários meses.
- Para maximizar a chance de encontrar células internalizadas positivas e ter regiões teciduais mais representativas, colete crioseções seriais a -18 a -20 °C usando um criostat.
- Fixação de lâminas de tecido
- PASSO CRÍTICO: Fixar as seções teciduais em 95% de etanol a -18 a -20 °C por 5 min.
- Lave a seção fixa por 5 minutos com PBS de temperatura ambiente e, em seguida, monte as seções de tumor fixo sob uma mancha de vidro usando 10 μL de um meio de montagem aquoso com DAPI.
- Doze a 24 horas após a montagem, examine as seções fixas do tumor por microscopia de fluorescência e adquira imagens, como descrito para as células cultivadas acima.
- Microscopia de fluorescência e aquisição de imagens
- Identifique regiões de interesse e adquira imagens, conforme descrito na seção 2.6.
- Quantificação e análise de dados
- Quantifique as células e aplique análises estatísticas adequadas, conforme a seção 2.7.
4. Internalização atp em tumores, in vivo
- Prepare culturas celulares para implantação conforme descrito na seção 3.1.
- Injeção subcutânea de células cancerígenas para desenvolvimento de tumor xenoenxerto
- Gerar tumores xenoenxerados como descrito na seção 3.2.
- Injeção de ATP e/ou dextran em tumores de xenoenxerto
- Prepare as soluções de tratamento de DMEM (veículo) ou 8 mg/mL HMWFD ou LMWFD, com ou sem NHF-ATP (100 μM) no DMEM, conforme descrito acima.
- Use uma seringa de 1 mL para coletar 50 μL de uma solução de tratamento e injete a solução diretamente em cada tumor de xenoenxerto. Repita o procedimento para quatro réplicas biológicas de cada tratamento.
- Colheita de tecidos e incorporação de crio-insípndo
- Prepare os rótulos de identificação para cada tumor a ser colhido. Corte um pedaço de 2 cm de fita de laboratório e dobre ao meio, lados adesivos juntos, longitudinalmente. Use uma caneta de marcação para rotular a etiqueta, por exemplo, com um número de identificação de mouse/tumor.
- Aproximadamente 5 min após a injeção, eutanize o rato por luxação cervical ou de acordo com o protocolo aprovado pela IACUC.
- Usando um bisturi tamanho 10, faça uma incisão adjacente ao tumor e aproximadamente perpendicular à direção da injeção da agulha. Use fórceps e tesouras cirúrgicas para ressecção do tecido tumoral do tecido circundante.
- Divida o tumor em dois a quatro pedaços de 1 cm2, dependendo do tamanho total do tumor.
- Prepare os moldes de incorporação e incorpore o tecido, conforme descrito acima na seção 3.6. Certifique-se de que o tempo de colheita, desde a injeção intratumoral de dextran até a incorporação de crio,.
- Preparação de slides de amostras de tecidos
- Coletar seções de tumores seriais, conforme descrito na seção 3.7.
- Fixação de lâminas de tecido
- Conserte o tecido, conforme descrito na seção 3.8.
- Microscopia de fluorescência e aquisição de imagens
- Identifique as regiões de interesse e adquira imagens, conforme descrito na seção 2.6.
- Quantificação e análise de dados
- Quantifique as células e aplique análises estatísticas adequadas, conforme descrito na seção 2.7.
Access restricted. Please log in or start a trial to view this content.
Resultados
Estudo in vitro
A internalização intracelular do NHF-ATP foi demonstrada pela co-localização do NHF-ATP com HMWFD ou LMWFD (Figura 4). O sucesso deste procedimento depende principalmente do uso de concentrações adequadas de NHF-ATP e dextrans e na determinação do tipo apropriado de dextrans (poli-lysina vs. neutro). Por exemplo, para investigar a macropinocisse, o HMWFD foi escolhido por ser internalizado apenas pelos macropinossomos
Access restricted. Please log in or start a trial to view this content.
Discussão
Desenvolveu-se um método para análise espacial, temporal e quantitativa da internalização celular de ATP não higdrozável. Este método é amplamente aplicável para uso em diversos sistemas biológicos, incluindo vários modelos tumorigênicos, para os quais fornecemos instruções técnicas e dados representativos. Para adquirir dados interpretáveis durante estudos de internalização in vivo ATP (seção 4 do protocolo), é fundamental limitar o tempo experimental decorrido da injeção de dextran intra...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não declaram interesses concorrentes.
Agradecimentos
Cryosectioning foi realizado no local no Núcleo histopatologia da Universidade de Ohio. Este trabalho foi apoiado em parte por fundos de start-up (Ohio University College of Arts & Sciences) para C Nielsen; NIH concede R15 CA242177-01 e prêmio RSAC para X Chen.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker - orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical - sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
Referências
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008(2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101(2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg's contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154(2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados