Method Article
Um ensaio alimentador de microplaco de alta produtividade para quantificação do consumo em Drosophila
Neste Artigo
Resumo
O ensaio alimentador de microplacos oferece um método econômico de alta produtividade para quantificar o consumo de alimentos líquidos em Drosophila. Um dispositivo impresso em 3D conecta uma microplaca de 96 poços na qual as moscas estão alojadas em uma microplaca de 1536 poços da qual as moscas consomem uma solução de alimentação com um corante rastreador. O declínio do volume da solução é medido espectrofotometricamente.
Resumo
Quantificar a ingestão alimentar em Drosophila é usado para estudar os fundamentos genéticos e fisiológicos dos traços associados ao consumo, seus fatores ambientais e os efeitos toxicológicos e farmacológicos de inúmeras substâncias. Poucos métodos implementados atualmente são favoráveis à medição de alto rendimento. O Microplate Feeder Assay (MFA) foi desenvolvido para quantificar o consumo de alimentos líquidos para moscas individuais utilizando absorvância. Neste ensaio, as moscas consomem meio de alimentos líquidos de poços selecionados de uma microplaca de 1536 poços. Ao incorporar um corante de rastreador diluído no meio de alimentos líquidos e carregar um volume conhecido em cada poço, as medidas de absorção do poço adquirido antes e depois do consumo refletem a consequente mudança de volume (ou seja, volume consumido). Para permitir uma análise de alto rendimento com este método, um acoplador impresso em 3D foi projetado que permite que as moscas sejam classificadas individualmente em microplacas de 96 poços. Este dispositivo orienta precisamente microplacos de 96 e 1536 poços para dar a cada mosca acesso a até 4 poços para consumo, permitindo assim quantificação da preferência alimentar, além do consumo regular. Além disso, o dispositivo possui faixas de barreira que alternam entre posições abertas e fechadas para permitir a contenção controlada e a liberação de uma coluna de amostras por vez. Este método permite medições de alto rendimento do consumo de soluções aquosas por muitas moscas simultaneamente. Também tem o potencial de ser adaptado a outros insetos e ao consumo de nutrientes, toxinas ou produtos farmacêuticos.
Introdução
Drosophila melanogaster tem visto amplo uso como organismo modelo genético para estudar os fundamentos biológicos da ingestão alimentar e características associadas ao consumo1. Estima-se que 65% dos genes causadores de doenças humanas tenham homólogos funcionais em moscas, com uma proporção significativa daqueles que estão sendo expressos em tecidos funcionalmente equivalentes entre moscas e humanos2. Além disso, o tamanho de D. melanogaster, o curto tempo intergeracional, a manutenção simples e a tratobilidade genética tornam-no um modelo atraente para estudos sobre o consumo de nutrientes3,4 e efeitos toxicológicos e farmacológicos de uma variedade de substâncias, incluindo inseticidas5, poluentes6,farmacêuticos7, e medicamentos de abuso8,9,10.
Em muitos casos, o estudo de tais características requer uma quantificação precisa do consumo. Os métodos de quantificação do consumo são diversos e incluem o ensaio CApillary FEeder (CAFE)11, o ensaio MAnual FEeding (MAFE)12,oensaio de Resposta à Extensão Proboscis (PER), a extração de corante rastreador14,15, extração do rastreador oligonucleotídeo16e extração de radio-isótopos5,17. Os esforços recentes têm se concentrado em aumentar o rendimento desses ensaios, como no ensaio Expresso18 ou no sistema Whole Animal Feeding FLat (WAFFL) baseado emplacas 19. Apesar de sua utilidade, esses ensaios podem ser complicados, caros ou intensivos em mão-de-obra, dificultando seu uso em estudos de alto rendimento.
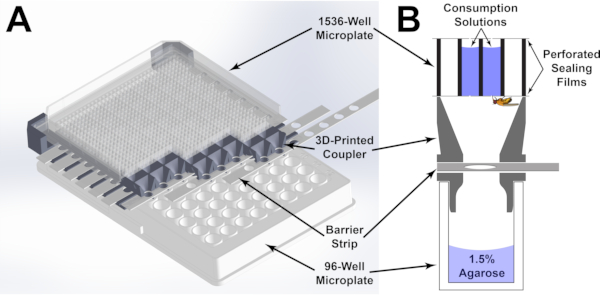
Figura 1: Componentes do ensaio do alimentador de microplacar. (A) renderização 3D do ensaio alimentador de microplato montado. A microplacão de 1536 poços é orientada pelo acoplador impresso em 3D de tal forma que cada poço da microplacão inferior de 96 poços tenha acesso a quatro poços da microplato superior de 1536 poços. O acesso aos poços pode ser controlado ajustando a posição das faixas de barreira ranqueadas através do acoalador. (B) Uma representação gráfica de cada poço do ensaio alimentador de microplacar. As soluções de consumo são retidas em cada poço usando uma haste de vedação que foi perfurada para permitir o acesso pela mosca. Clique aqui para ver uma versão maior desta figura.
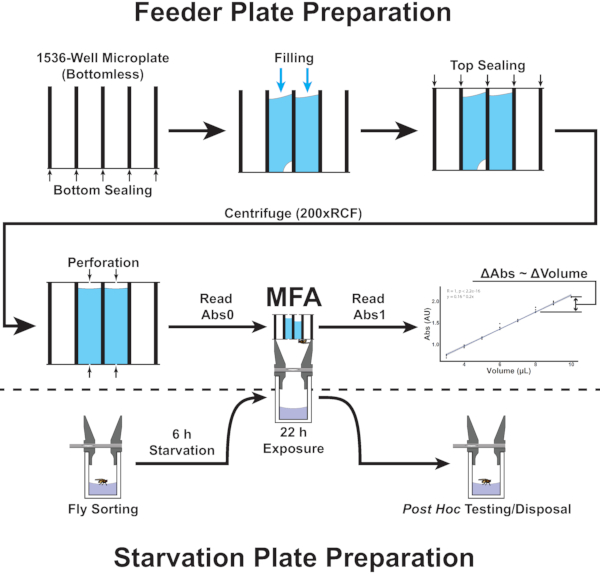
Figura 2: Visão geral dos procedimentos no Ensaio do Alimentador de Microplatos. A figura mostra um diagrama de fluxo que corresponde às etapas 4.1-5.8 do protocolo. Clique aqui para ver uma versão maior desta figura.
Para superar esses obstáculos, o Microplate Feeder Assay (MFA; Figura 1) foi desenvolvido. Neste ensaio, as moscas são alojadas individualmente em microplacas de 96 poços. Cada microplato é acoplado a uma microplacão de 1536 poços usando um dispositivo personalizado impresso em 3D. O dispositivo orienta precisamente as duas placas de tal forma que cada uma voe em seu respectivo poço da placa de 96 poços tem acesso a 4 poços da microplacão de 1536 poços. Usando uma placa sem fundo de 1536 poços e filmes de vedação, as soluções são distribuídas em poços selecionados e perfuradas com agulhas precisas de 0,25 mm de diâmetro para fornecer acesso às moscas. Criticamente, permitir o consumo diretamente de uma microplacão permite medições imediatas baseadas em absorvância usando um leitor de microplacão. Um corante rastreador diluído é incorporado ao meio de consumo, e a mudança na absorção após a exposição é usada para determinar o volume consumido(Figura 2 e Figura 3). Uma vez que o líquido em cada poço se aproxima de uma coluna de fluido, as diferenças volumosas se manifestarão como diferenças na altura da coluna. (Figura 3A) De acordo com a lei Beer-Lambert20:
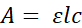
onde A é a absorvância, ε é o coeficiente de absorção molar para o analito atenuante, l é o comprimento óptico do caminho, e c é a concentração do analito atenuante. Assim, com o coeficiente e concentração constante de absorção molar, as alterações na absorção devem-se unicamente a alterações no caminho da luz óptica, ou seja, o nível de fluido dentro de um dado poço. Medindo a absorvência antes e depois da exposição, a variação proporcional da absorvância reflete a variação proporcional do volume (Figura 3B).
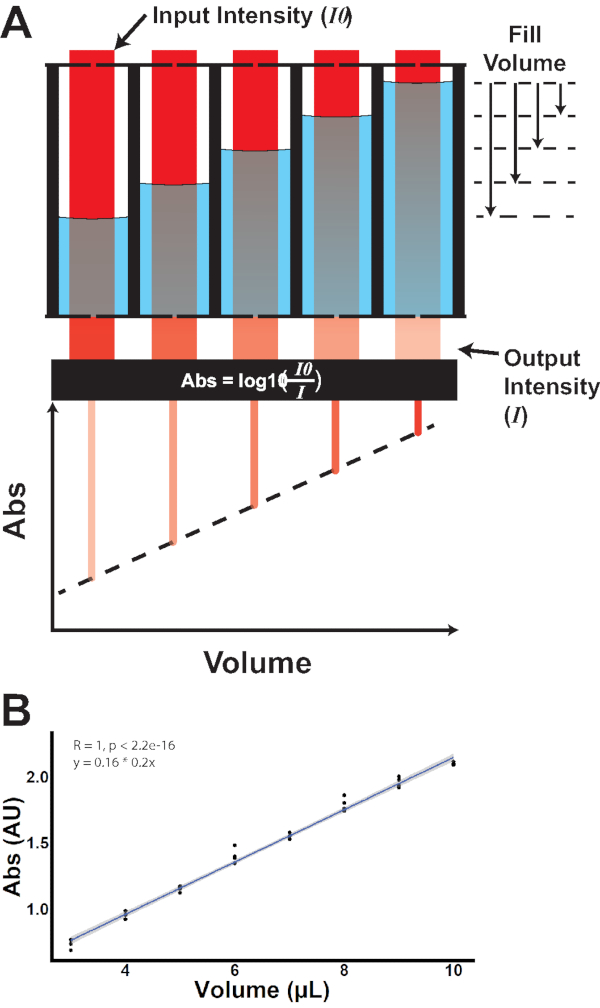
Figura 3: Quantificação baseada em absorvência de volume de poço. (A) A luz incidente da intensidade de entrada conhecida (I0) atravessa cada poço. Atenuação da luz em diferentes volumes de enchimento produz diferentes intensidades de saída(I),exibindo uma relação linear entre volume e absorvância. (B) Medição empírica da absorvância versus volume. Clique aqui para ver uma versão maior desta figura.
Com base na mudança de volume, a quantidade de qualquer composto ingerido pode ser calculada a partir de sua concentração conhecida na solução de alimentação. As peças necessárias para o ensaio são de baixo custo e têm um alto grau de reutilização, reduzindo substancialmente o custo recorrente do ensaio. Assim, este procedimento oferece um método acessível e de alto rendimento de quantificar precisamente o consumo.
Protocolo
1. Preparação da placa de fome
- Pesar 1,5 g de agarose em um copo de vidro de 250 mL.
- Adicione 100 mL de H2O destilado ao béquer.
- Micro-ondas intermitentemente até agarose está totalmente derretida.
NOTA: Observe o béquer, já que a agarose está propensa a ferver. - Despeje a agarose derretida em um cocho de reagente e dispense 80 μL de agarose derretida em cada poço de uma microplata de 96 poços usando uma pipeta multicanal. Deixe as placas curarem enquanto estão cobertas à temperatura ambiente. Leve à geladeira a sobra por até uma semana em um saco selado e derreta-a para fazer placas adicionais.
2. Classificação de moscas e fome
- Prepare os acoadores inserindo faixas de barreira nos canais de faixa de barreira. Se as tiras de barreira estiverem muito soltas, enrole-as ao redor do dedo para dar-lhes curvatura para segurá-las nos canais.
- Afixe o acoplador a uma placa de fome. Não use o acoplador para manipular a placa, pois o acoplador pode escorregar. Certifique-se de que os acopladores estejam corretamente orientados (ou seja, certifique-se de que o canto angular do acoplador corresponda ao canto angular da microplaca).
- Sob anestesia de CO2 (Tabela de Materiais),tipo moscas de 3 a 5 dias de idade. Carregue moscas individuais por coluna na placa de fome.
NOTA: Embora as moscas sejam carregadas por coluna, recomenda-se distribuir grupos de amostras por fileiras da placa em vez de colunas para baixo (ver Figura 4 para o exemplo de layout da placa). - Feche cada coluna enquanto ela preenche ajustando sua faixa de barreira à posição fechada.
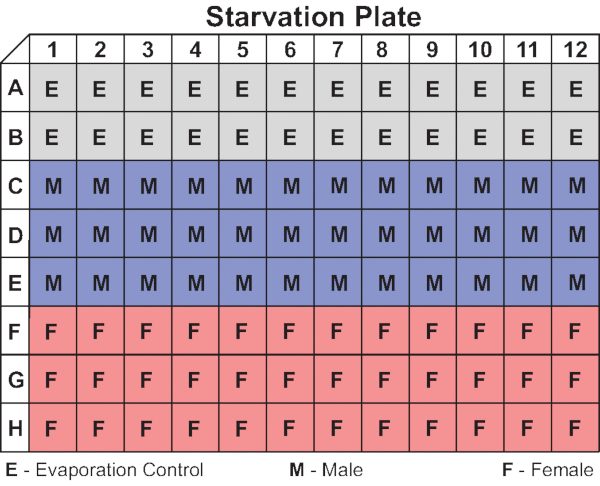
Figura 4: Layout da placa de fome representativa. O diagrama mostra a organização dos controles de evaporação e moscas masculinas e femininas em uma placa de 96 poços utilizada neste estudo. Também podem ser utilizadas configurações alternativas, incluindo linhas alternadas de machos e fêmeas com controles de evaporação nas linhas A e H. Clique aqui para ver uma versão maior desta figura.
- Grave cuidadosamente o layout da amostra dentro da microplacão. Uma vez que a placa de fome é preenchida, permita que as moscas se recuperem espontaneamente depois de remover o CO2 e esfomeá-las por 6h a partir do tempo inicial de anestesia.
3. Preparação líquida de alimentos
NOTA: Faça alimentos líquidos frescos todos os dias.
- Prepare uma solução de 10 mg/mL de corante da FD&C Blue #1 em H2O destilado.
NOTA: Pode ser armazenado à temperatura ambiente por até 6 meses. - Prepare 10 mL de alimentos líquidos (4% de sacarose, 1% extrato de levedura, 40 μg/mL de FD&C Azul #1) em um tubo cônico de 15 mL dissolvendo 0,4 g de sacarose e 0,1 g de extrato de levedura em 10 mL de destilado H2O. Vortex do tubo até que os sólidos se dissolvam totalmente. Adicione 40 μL de solução de estoque de corante e inverta o tubo repetidamente para homogeneizar a solução.
- Transfira o alimento líquido para uma seringa de 10 mL com um filtro de 0,45 μm. Filtrar ~1,5 mL da solução de cada vez em um tubo de microcentrifus de 1,7 mL. Reserve a seringa que contém a solução e filtre a solução adicional conforme necessário durante a preparação da placa de alimentação.
4. Preparação da placa alimentadora
NOTA: Manuseie as placas do alimentador suavemente após o enchimento para evitar a formação de bolhas ou gotículas no poço que possam influenciar as leituras de absorção.
- Prepare uma placa alimentadora selando a parte inferior de uma microplacão de 1536 poços com uma máquina de selar. Use uma remada de vedação para aderir bem ao filme. Corte o excesso de filme das bordas esquerda e direita com uma lâmina de barbear.
- Dispense 10 μL da coluna de alimentos líquidos filtrados (ver Figura 5 para ilustração) nos poços apropriados da microplacão de 1536 poços. Dispense no poço superior-esquerdo para cada conjunto de quatro poços (ver Figura 5 para ilustração).
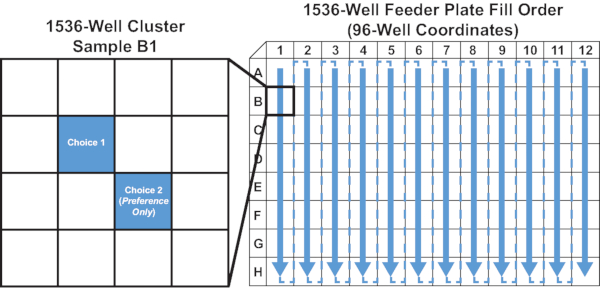
Figura 5: Preencha a ordem e a localização do poço para a placa alimentadora de 1536 poços. O diagrama ilustra o passo 4.2 do protocolo. As setas mostram a ordem em que a solução de alimentação é introduzida na placa alimentadora uma coluna de cada vez da coluna 1 a 12. A amostra B1 é ampliada para mostrar um exemplo da localização das soluções de alimentação para ensaios de 1 escolha e 2 opções. Clique aqui para ver uma versão maior desta figura.
- Uma vez que todos os poços são preenchidos, aplique um filme de vedação na parte superior da placa. Use uma remada de vedação para aderir bem ao filme. Corte o excesso de filme das bordas esquerda e direita com uma lâmina de barbear. Repita para o número desejado de placas.
- Centrifugar as placas a 200 x g por 10 s para liquidar o fluido. Não permita que a placa seja resfriada, pois isso pode causar o acúmulo de condensação nos poços, ocultando leituras de absorvência.
5. Exposição
- Uma vez que as moscas estejam prontas para o ensaio de consumo, perfure os poços na superfície superior da placa com a ferramenta da sonda de agulha equipada com uma agulha de 0,25 mm de diâmetro. Use a mesma ordem para perfurar como foi utilizado na dispensa das soluções. Vire a placa e perfure os poços na parte inferior. Limpe a agulha entre as soluções para evitar a contaminação cruzada. Tenha cuidado para não tocar nas perfurações, pois isso retira a solução dos poços.
- Leia a absorção da placa a 630 nm sem tampa.
- Coloque uma tampa interna na película de vedação superior para garantir que os anéis de condensação circundem os poços perfurados. Coloque a tampa externa na placa.
- Coloque a placa alimentadora de frente para cima no acoplador de tal forma que as guias alinhem os orifícios apropriados da placa alimentadora e da placa de fome. Certifique-se de que o acoplador e as placas estejam corretamente orientados (ou seja, certifique-se de que o canto angular do acoplador e as placas combinem). Enrole faixas elásticas ao redor das placas superior e inferior para segurar o acoplador. Verifique se há alinhamento e lacunas entre a placa alimentadora e o acoplador.
- Uma vez que todas as placas alimentadoras são carregadas sobre os acoplamentos, abra os poços para as placas ajustando as faixas de barreira no acoplador. Coloque os conjuntos acoplador/placa no recipiente secundário. Cada contêiner secundário pode acomodar até seis conjuntos.
- Coloque a metade inferior de uma caixa de pipeta contendo toalhas de papel encharcadas em cada recipiente secundário para fornecer umidade. Feche a tampa dos recipientes secundários e transfira-os para um ambiente controlado (25 °C, umidade controlada, 12h de luz:ciclos escuros). Deixe as moscas consumirem por 22 h.
- Após a exposição de 22 horas, verifique cada placa se há moscas mortas e atualize o layout da placa de acordo. Depois que todas as placas forem verificadas, anestesia as moscas em massa, bombeando CO2 dentro do recipiente secundário. Depois de ~60 s, certifique-se de que todas as moscas estão imobilizadas. Tampe suavemente as moscas para a placa de fome e substitua as tiras de barreira de plástico. Remova as placas alimentadoras para leitura.
- Leia a absorvência da placa a 630 nm. Repita até que todas as placas tenham sido lidas.
6. Análise de dados
NOTA: A análise pode ser realizada com o pacote de software preferido do investigador.
- Omitir todas as moscas que morreram durante a exposição de 22 horas.
- Para cada poço, calcule o volume consumido como:
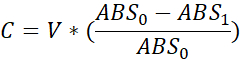
C - Volume Consumido (μL)
V - Volume inicial do poço (ou seja, 10 μL)
ABS0 - Absorvância pré-exposição
ABS1 - Absorvência pós-exposição
NOTA: O consumo é denotado como um volume positivo no cálculo. - Para explicar a evaporação, subtraia o volume médio de evaporação dos valores de consumo de moscas dentro das respectivas placas. Para testes de 2 opções/preferências, ajuste cada poço por sua respectiva solução,porexemplo, ajuste os poços de "escolha 1" por "escolha 1" nos controles de evaporação.
- Após ajuste para evaporação, solte todas as amostras com um valor de consumo inferior a zero.
- Para testes de 2 opções, calcule a preferência por cada um, bem como:
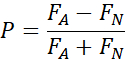
P - Índice de Preferência (direção positiva indica preferência)
FA - Volume de Alimentos Líquidos Consumidos contendo Aditivo (Escolha 2)
FN - Volume de Alimentos Líquidos Normais Consumidos (Escolha 1)
7. Protocolo de lavagem de microplato e acoplador.
NOTA: Tome cuidado para evitar danos nas partes inferiores das microplacões, pois os danos podem afetar a vedação.
- Remova os filmes e rótulos das microplatas de 1536 poços. Separe os acopladores e as faixas de barreira. Coloque as faixas de barreira em um recipiente vedado, como uma garrafa. Lave as tiras de barreira tremendo vigorosamente em uma série de água quente da torneira, solução de detergente suave, água morna da torneira e, em seguida, destilada H2O.
- Enxágüe microplacas de 1536 poços e acopladores sob água morna da torneira. Para microplacares, passe água da torneira pelos poços de cada microplaque para limpar o máximo de soluções e detritos possível. Se necessário, use uma ponta de pipeta para desalojar detritos; não use utensílios metálicos ou de vidro nas placas.
- Cubra cada placa e acoplador com uma solução de detergente suave (por exemplo, 1% v/v Aquet). Para as placas, esfregue as superfícies com uma mão enluvada. Para os acopladores, use um pincel.
- Enxágüe cada placa completamente com água da torneira e, em seguida, com H2O destilado. Certifique-se de que os poços são especificamente enxaguados sob o fluxo de água.
- Deixe que as placas e acopladores sequem ao ar cobertos à temperatura ambiente. Guarde em uma lixeira limpa até usar.
NOTA: Nunca manuseie as microplacões de 1536 poços sem luvas. Óleos residuais da pele podem dificultar a vedação, levando a vazamento de poços e evaporação.
Resultados
Para determinar se existem correlações entre os poços de placas individuais, a evaporação foi quantificada para cada poço (n = 96 poços/placa para três placas). A evaporação foi encontrada em -0,036 μL ± 0,003 μL (média ± SEM em todo). (Figura 6A) As correlações de Pearson foram calculadas para avaliar tendências entre evaporação e locais de poços. O coeficiente de correlação (Figura 6B,C) para evaporação versus linhas foi de -0,04 (p = 0,4949) e para evaporação vs colunas foi de -0,23 (p = 0,0001). Os grupos foram posteriormente distribuídos entre colunas para mitigar as correlações leves, mas estatisticamente significativas entre as colunas.
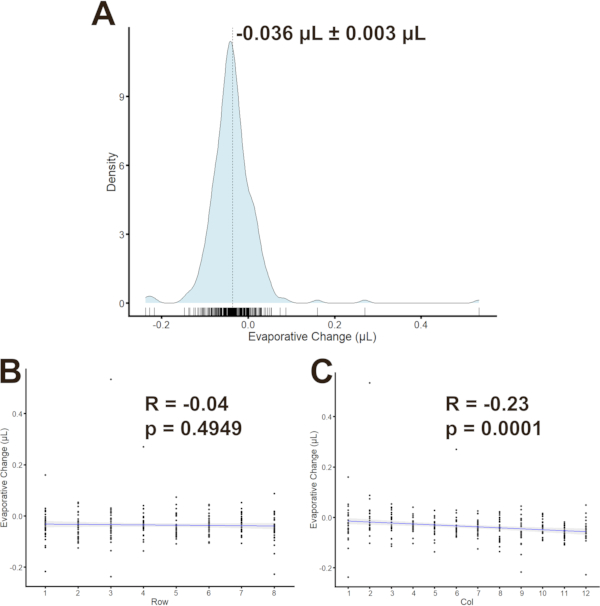
Figura 6: Evaporação no MFA. (A) Distribuição de densidade de alterações de evaporação com ± SD média indicada pela linha tracejada. Correlações entre evaporação e linhas(B) ou colunas(C)com o coeficiente de correlação de Pearson e p-valor como indicado. Clique aqui para ver uma versão maior desta figura.
Para estabelecer a validade do protocolo, o consumo foi quantificado para moscas Canton-S B de 3-5 dias de idade (n = 36/sexo/placa e n = 24 controles de evaporação/placa para três placas)(Figura 7). A evaporação entre os poços de controle foi significativamente diferente de zero (-0,030 μL ± 0,006 μL, p = 4,81 x 10-6; uma amostra t-teste vs zero). Duas amostras foram omitidas (ambas do sexo masculino) do conjunto de dados, uma por morte durante a exposição durante a noite e outra devido ao valor negativo de consumo após ajuste para evaporação. Isso rendeu uma taxa de retenção amostral de > 99%.
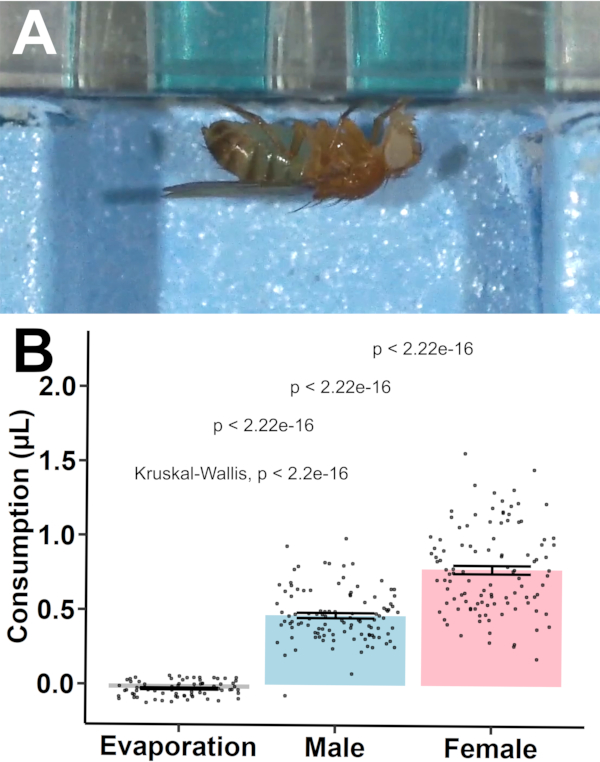
Figura 7: Quantificação de consumo utilizando o MFA. (A) O consumo foi visualizado utilizando uma câmara de vidro fabricada sob medida. As moscas foram observadas bebendo de poços perfurados e apresentaram manchas abdominais azuis após a ingestão da solução tingida. Veja também Vídeo Suplementar S.1. (B) Valores de consumo (média ± SEM) entre controles de evaporação, moscas machos e moscas fêmeas. O teste pós-t pós-hoccom variação desigual foi realizado para comparações estatísticas, com significância indicada por barras. Clique aqui para ver uma versão maior desta figura.
Posteriormente, foi construído um modelo de Análise de Variância (ANOVA) conforme descrito por Y = μ + S + P + P + SxP + e, com Y como média de grupo, μ como média geral, S como efeito fixo do sexo, P como efeito fixo da placa, SxP como a interação entre Sexo e Placa, e como a variabilidade residual. A ANOVA não apresentou variabilidade significativa entre placas (p = 0,671) ou interações sex-específicas com placas (p = 0,104) para consumo, enquanto o sexo sozinho contribuiu significativamente para a variação observada no consumo (p = 4,17 x 10-18). Um teste pós-hoc tmostrou que os machos consumiram significativamente menos do que as fêmeas (0,500 μL ± 0,017 μL vs 0,811 μL ± 0,028 μL, p = 1,13 x 10-17, duas amostras t-testecom variância desigual).
Para demonstrar que o ensaio pode ser usado para quantificação de preferência de duas opções, as moscas tiveram a escolha entre uma solução de 4% de sacarose com extrato de levedura de 1% e uma solução de sacarose de 4% complementada com 15% de etanol e extrato de 1% de levedura. Tanto o sexo masculino quanto o feminino apresentaram preferência esmagadora pela solução com etanol e extrato de levedura com índices de preferência de 0,974 ± 0,026 para o sexo masculino e 0,876 ± 0,06 para as fêmeas (média ± SEM) (Figura 8).
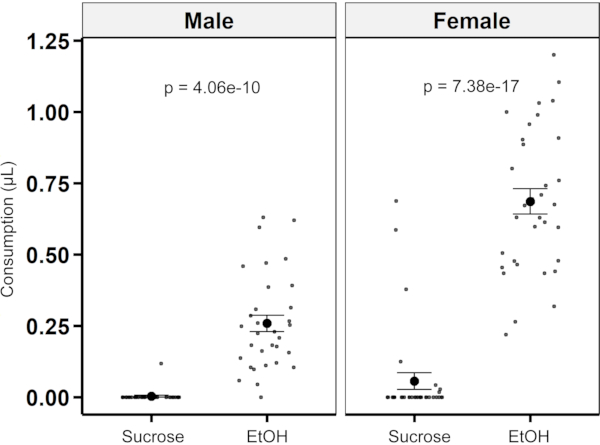
Figura 8: Quantificação de preferência utilizando o MFA. Consumo de 4% de sacarose contra 4% de sacarose suplementada com 15% de etanol e extrato de levedura para moscas masculinas e femininas (n = 33 para cada sexo). As moscas masculinas consumiram mais da solução de etanol do que a solução de sacarose de controle (0,511 μL ± 0,029 μL versus 0,00 μL ± 0,017 μL; p = 4,06e-10; teste tde duas amostras). As moscas fêmeas também consumiram mais solução de etanol do que a solução de sacarose de controle (0,939 μL ± 0,044 μL versus 0,132 μL ± 0,044 μL; p = 7,38e-17; teste tde duas amostras). Clique aqui para ver uma versão maior desta figura.
Vídeo suplementar S.1: O vídeo mostra uma mosca se alimentando do poço perfurado e acumulando manchas abdominais azuis ao ingerir a solução tingida. Uma imagem parada é mostrada na Figura 7A. Clique aqui para baixar este vídeo.
Arquivo suplementar S.2: Acoplador de ensaio de alimentador de microplaco. Esta é uma construção 3D imprimível do acoelômado usado no MFA. Material de impressão Nylon PA12 foi utilizado para o MFA. Clique aqui para baixar este arquivo.
Arquivo suplementar S.3: Microplaque Feeder Assay Barrier Strip. Este contém o desenho das tiras de barreira de plástico usadas para alternar a exposição de moscas à placa alimentadora. Um único acodorador pode utilizar até doze faixas de barreira. Clique aqui para baixar este arquivo.
Arquivo suplementar S.4: Desempacotamento e instruções de fabricação para o ensaio do alimentador de microplaco. As instruções estão incluídas para desempacotar o acopato e as faixas de barreira. As instruções de fabricação estão incluídas para a tampa interna, tampa externa e recipiente secundário usado para limitar a evaporação durante a exposição. Clique aqui para baixar este arquivo.
Arquivo suplementar S.5:Comparação de custos do ensaio do alimentador de microplape (MFA) e um ensaio de 1 mosca única CApillary FEeder (CAFE). Testar 72 moscas/sexo para uma única linha exigiria dois conjuntos de equipamentos MFA (acopladores + placas + tiras de barreira), enquanto o CAFE precisaria apenas de 1 capilar para cada frasco de cultura. Apesar da grande diferença no investimento inicial para o MFA, a grande diferença nos custos recorrentes (US$ 14,80 vs US$ 46,08, respectivamente) permitiria que os custos iniciais fossem recuperados após o teste de apenas 4 linhas (ponto de partida). Clique aqui para baixar este arquivo.
Discussão
O estudo descreve um novo protocolo para quantificar o consumo em Drosophila: o Ensaio alimentador de microplato (MFA). Neste ensaio, as moscas consomem de poços selados de uma microplaca de 1536 poços através de perfurações de tamanho controlado(Figura 1, Figura 2; Vídeo suplementar S.1). Uma vez que o alimento líquido é tingido e fornecido via microplape, as medidas da absorção óptica do alimento podem ser obtidas por meio de um espectrômetro microplato(Figura 3). Dessa forma, o consumo é determinado comparando a absorvância antes e depois do consumo e, em seguida, aplicando essa proporção ao volume conhecido dispensado antes do consumo. Isso foi verificado empiricamente medindo a absorvância de diferentes volumes do meio tingido(Figura 3B).
Para desenvolver este ensaio, foi necessário um dispositivo que pudesse alavancar a quantificação de consumo baseada em absorvência. O teste voa em formato de microplaca é atraente porque complementa a microplaca usada para dispensar alimentos e permite flexibilidade na seleção de vários formatos de placa (por exemplo, formatos de 6, 12, 48 ou 96 bem) ajustando a geometria do acoplador. Um formato de microplacão de 96 poços foi escolhido para permitir a cultura de moscas individuais.
O dispositivo impresso 3D (Figura 1) orienta precisamente a placa alimentadora de 1536 poços com a placa de cultura de 96 poços, dando a cada mosca acesso a até 4 poços da placa alimentadora para consumo. Além disso, para fornecer tempo adequado para distribuir moscas na placa de habitação e controlar a iniciação do ensaio, o dispositivo inclui faixas de barreira de toggling contendo as moscas em seus respectivos poços e prevenindo violações. Os arquivos necessários para a aquisição ou modificação dessas peças sãofornecidos (Arquivos Suplementares S.2-S.3),bem como as instruções de fabricação necessárias para as peças relevantes(Arquivo Suplementar S.4).
O MFA fornece um método simples de alta produtividade que complementa métodos mais elaborados para monitorar o comportamento alimentar de Drosophila18,21,22. O MFA oferece múltiplas vantagens em relação a outros métodos usados para quantificar a ingestão de alimentos. O rendimento é aumentado quantificando o consumo usando um leitor de placas. Isso elimina as medidas manuais e evita a entrada manual de dados. Os dados também são favoráveis à extração e processamento programáticos. Além disso, o maior rendimento aumenta o número viável de réplicas biológicas, particularmente em comparação com os projetos alimentares comunitários, o que aumenta substancialmente o poder de detectar pequenas diferenças no consumo. Usando o MFA, um único experimentador pode quantificar o consumo ou a preferência de mais de 500 moscas por corrida durante a noite do ensaio. Ao sobrepor as corridas do ensaio, mais de 2.000 moscas podem ser testadas em um período de 5 dias. Por fim, há redução de custos de longo prazo devido à reutilização de microplacas e acopladores(Arquivo Suplementar S.5). Usando o MFA, o custo estimado por ensaio pode ser tão baixo quanto US $ 14,80, com um custo adiantado de US $ 127,60 para o equipamento. Usando o clássico ensaio CApillary FEeder (CAFE), que requer microcapillaries de precisão dispendiosos, o custo estimado por ensaio para um número comparável de réplicas é de US$ 46,08. Assim, embora haja um investimento inicial na aquisição dos equipamentos necessários, a redução dos custos recorrentes pode levar a uma economia substancial, especialmente em casos em que são realizados testes repetidos.
Como em todos os ensaios, o MFA tem certas limitações. Principalmente, requer acesso a um espectrômetro de microplape capaz de ler microplatos de 1536 poços. Além disso, a dependência de medidas de absorção para quantificação torna o método suscetível a interferência óptica. Isso se manifesta como valores de consumo negativos para um pequeno subconjunto de amostras testadas. Nutrientes, medicamentos, fármacos ou toxinas de interesse também devem ser solúveis em água para serem compatíveis com o ensaio.
Apesar de suas limitações, este método oferece um método de alta produtividade de quantificar comportamentos de consumo em Drosophila. Além disso, o dispositivo de acoplamento poderia ser facilmente modificado para aceitar muitos formatos de placa, permitindo-o acomodar uma variedade de espécies de insetos.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Este trabalho foi apoiado por uma subvenção do Instituto Nacional de Abuso de Drogas (U01 DA041613) à TFCM e à RRHA.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.25 mm Diameter Needles | Rave Scientific | RS-MN-52-001012 | |
| 0.45 µm Syringe Filters | Olympus Plastics | 25-245 | |
| 10 mL Disposable Syringe | EXELINT | 26200 | |
| Agarose | Fisher Scientific | BP1600 | |
| Barrier Strips (Laser Cut) | Ponoko | - | Material: clear PETG, 0.5mm thickness; Supplementary File: |
| Centrifuge 5810 R | Eppendorf | 22625501 | |
| Centrifuge Rotor A-4-62 with micro-titer plate buckets | Eppendorf | 22638041 | |
| FD&C Blue #1 | Spectrum Chemical Mfg Corp | FD110 | |
| Film Sealing Paddle | Fisher Scientific | 50-563-280 | |
| Flystuff Flypad | Genesee Scientific | #59-114 and #59-119 | CO2 Anesthesia: The Flypads come in two sizes, either of which is appropriate |
| Microplate Coupler (3D Printed) | Shapeways | - | Material: Multi Jet Fusion nylon (MJF PA12); Supplementary File: |
| Microplate Lids | Greiner Bio-One | 656170 | |
| Molecular Devices SpectraMax iD5 | Molecular Devices | - | Any microplate reader with 1536-well resolution will do. |
| Needle Probe Holder | Rave Scientific | RS-MN-52-001000 | |
| Polyester Sealing Film | Excel Scientific, Inc. | 100-SEAL-PLT | |
| Polystyrene 96-well microplates | Greiner Bio-One | 655101 | |
| Polystyrene, Bottomless, 1536-well microplates | Greiner Bio-One | 783000 | Made to Order; allow for adequate lead time when purchasing. |
| Rubber Bands | |||
| Sucrose | Sigma | S7903 | |
| Weather Stripping | 1/2" x 1/8" High Density Self Adhesive Neoprene Rubber | ||
| Yeast Extract | Fisher Scientific | BP1422 |
Referências
- Wong, R., Piper, M. D. W., Wertheim, B., Partridge, L. Quantification of food intake in Drosophila. PLoS ONE. 4 (6), (2009).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Disease Models & Mechanisms. 9 (3), 235-244 (2016).
- Spitaler, U., et al. Yeast species affects feeding and fitness of Drosophila suzukii adults. Journal of Pest Science. 93 (4), 1295-1309 (2020).
- Wang, Q. P., et al. PGC1α controls sucrose taste sensitization in Drosophila. Cell Reports. 31 (1), 107480 (2020).
- Valtierra-de-Luis, D., et al. Quantification of dose-mortality responses in adult Diptera: Validation using Ceratitis capitata and Drosophila suzukii responses to spinosad. PLoS ONE. 14 (2), 1-11 (2019).
- Williams, M. J., et al. Exposure to bisphenol A affects lipid metabolism in Drosophila melanogaster. Basic & Clinical Pharmacology & Toxicology. 114 (5), 414-420 (2014).
- Jajoo, A., Donlon, C., Shnayder, S., Levin, M., McVey, M. Sertraline induces DNA damage and cellular toxicity in Drosophila that can be ameliorated by antioxidants. Scientific Reports. 10 (1), 1-12 (2020).
- Fochler, S., et al. Genetics of alcohol consumption in Drosophila melanogaster. Genes, Brain and Behavior. 16 (7), 675-685 (2017).
- Highfill, C. A., Baker, B. M., Stevens, S. D., Anholt, R. R. H., Mackay, T. F. C. Genetics of cocaine and methamphetamine consumption and preference in Drosophila melanogaster. PLOS Genetics. 15 (5), 1007834 (2019).
- Keebaugh, E. S., Park, J. H., Su, C., Yamada, R., Ja, W. W. Nutrition Influences caffeine-mediated sleep loss in Drosophila. Sleep. 40 (11), (2017).
- Ja, W. W., et al. Prandiology of Drosophila and the CAFE assay. Proceedings of the National Academy of Sciences. 104 (20), 8253-8256 (2007).
- Qi, W., et al. A quantitative feeding assay in adult Drosophila reveals rapid modulation of food ingestion by its nutritional value. Molecular Brain. 8 (1), 87 (2015).
- Shiraiwa, T., Carlson, J. R. Proboscis extension response (PER) assay in Drosophila. Journal of Visualized Experiments: JoVE. (3), e193 (2007).
- Shell, B. C., et al. Measurement of solid food intake in Drosophila via consumption-excretion of a dye tracer. Scientific Reports. 8 (1), 1-13 (2018).
- Wu, Q., et al. Excreta quantification (EX-Q) for longitudinal measurements of food intake in Drosophila. iScience. 23 (1), 100776 (2020).
- Park, A., Tran, T., Atkinson, N. S. Monitoring food preference in Drosophila by oligonucleotide tagging. Proceedings of the National Academy of Sciences of the United States of America. 115 (36), 9020-9025 (2018).
- Deshpande, S. A., et al. Quantifying Drosophila food intake: Comparative analysis of current methodology. Nature Methods. 11 (5), 535-540 (2014).
- Yapici, N., Cohn, R., Schusterreiter, C., Ruta, V., Vosshall, L. B. A Taste circuit that regulates ingestion by integrating food and hunger signals. Cell. 165 (3), 715-729 (2016).
- Jaime, M. D. L. A., et al. The high-throughput WAFFL system for treating and monitoring individual Drosophila melanogaster adults. bioRxiv. , (2018).
- IUPAC. . Compendium of Chemical Terminology (The "Gold Book"). , (1997).
- Itskov, P. M., et al. Automated monitoring and quantitative analysis of feeding behaviour in Drosophila. Nature Communications. 5, 4560 (2014).
- Ro, J., Harvanek, Z. M., Pletcher, S. D. FLIC: high-throughput, continuous analysis of feeding behaviors in Drosophila. PLoS One. 9 (6), 101107 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados