É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Funcionalização vesícula extracelular derivada de plaquetas de implantes ti
Neste Artigo
Resumo
Aqui, apresentamos um método para o isolamento de Vesículas Extracelulares (EVs) derivados das plaquetas (PL) e seu uso para revestimento de superfícies de implante de titânio (Ti). Descrevemos o método de revestimento de fundição de gota, o perfil de liberação de EVs das superfícies e a biocompatibilidade in vitro de superfícies Ti revestidas de EVs.
Resumo
Vesículos extracelulares (EVs) são nanovesculas biológicas que desempenham um papel fundamental na comunicação celular. Seu conteúdo inclui biomoléculas ativas, como proteínas e ácidos nucleicos, que apresentam grande potencial na medicina regenerativa. Mais recentemente, os EVs derivados de Plaqueta Lysate (PL) mostraram uma capacidade osteogênica comparável ao PL. Além disso, os biomateriais são frequentemente utilizados em ortopedia ou restauração dentária. Aqui, fornecemos um método para funcionalizar superfícies ti com EVs derivados de PL, a fim de melhorar suas propriedades osteogênicas.
Os EVs são isolados do PL por cromatografia de exclusão de tamanho, e depois as superfícies ti são funcionalizadas com PL-EVs por fundição de gota. A funcionalidade é comprovada pela liberação de EVs e sua biocompatibilidade pelo ensaio de liberação de lactato desidrogenase (LDH).
Introdução
Os EVs são vesículas de membrana (30-200 nm) secretadas por qualquer célula e desempenham um papel fundamental na comunicação célula-celular, entregando sua carga. Eles contêm uma variedade de biomoléculas ativas que podem incluir ácidos nucleicos, fatores de crescimento ou lipídios bioativos1. Por essas razões, os EVs têm sido avaliados por seu potencial uso na terapêutica. Em termos de ortopedia e regeneração óssea, EVs de diferentes fontes foram testados. Entre eles, os EVs derivados de plaquetas têm sido mostrados para induzir um efeito de diferenciação sobre as células-tronco, mantendo um perfil citotóxico baixo2,3. Portanto, mais pesquisas são necessárias para explorar a possibilidade de combinar EVs com biomateriais para usá-los na prática clínica diária.
Os biomateriais à base de titânio são amplamente utilizados como andaimes para intervenções clínicas de cicatrização óssea devido às suas propriedades mecânicas, alta biocompatibilidade e durabilidade a longo prazo4. No entanto, os implantes ti são um material biointendo e, portanto, apresentam uma baixa capacidade de ligação com o tecido ósseo circundante5. Por essa razão, modificações de titânio estão sendo estudadas para melhorar seu desempenho, alcançando um microambiente mais funcional em sua superfície4,6,7. Nesse sentido, os EVs podem ser ancorados em titânio por interações químicas8 ou físicas9,10. EVs imobilizados derivados de células-tronco ou macrófagos aumentam a bioatividade de Ti, promovendo a adesão celular e a proliferação, induzindo assim um efeito osteogênico8,9,10.
Este artigo se concentrará em uma estratégia de lançamento de gota para revestimento de superfícies Ti com EVs derivados de PL em detalhes. Além disso, avaliaremos o perfil de liberação de EVs da superfície revestida ao longo do tempo e confirmaremos sua biocompatibilidade celular in vitro.
Protocolo
A plaqueta Lysate (PL) é obtida como descrito anteriormente em conformidade com as diretrizes institucionais3 utilizando casacos de buffy fresco fornecidos pelo IdISBa Biobank como material inicial. Sua utilização para o projeto atual foi aprovada pelo Comitê de Ética (IB 1995/12 BIO).
1. Isolamento de EVs do PL
- Remoção de corpos maiores
- Descongelar PL em temperatura ambiente.
- Centrifugar PL a 1.500 x g para 15 min a 4 °C. Descarte a pelota, pois contém detritos celulares.
- Colete o supernatante e realize duas centrífugas consecutivas a 10.000 x g por 30 min a 4 °C.
NOTA: A pelota corresponde a EVs maiores, como microvesículos, e neste caso, é descartada. - Filtre o supernasal primeiro através de 0,8 μm de membrana porosa e, em seguida, através de 0,2 μm de membrana porosa.
NOTA: Estas etapas removem todos os EVs não desejados. - Acumule o PL filtrado e armazene a -20 °C até usar.
- Cromatografia de exclusão de tamanho
- Equilibre a coluna acoplada ao equipamento de cromatografia na vazão desejada com PBS filtrado.
NOTA: A taxa de fluxo utilizada depende das características da coluna; neste caso, está definido para 0,5 mL/min. - Carregue o PL processado (5 mL) com uma seringa no equipamento.
- Injete o PL na coluna e comece a coletar frações de 5 mL em tubos de 15 mL.
- Colete as frações enriquecidas dos EVs e armazene-as a -80 °C até usar.
NOTA: Ao realizar o experimento pela primeira vez, caracterize todas as frações por quantificação proteica e imunodeseção para determinar a enriquecida com EVs3,11. Neste experimento, a 9ª fração é coletada. - Lave a coluna cromatográfica com 30 mL de solução NaOH de 0,2% e armazene-a em solução de 20% de etanol quando atingir o equilíbrio.
- Equilibre a coluna acoplada ao equipamento de cromatografia na vazão desejada com PBS filtrado.
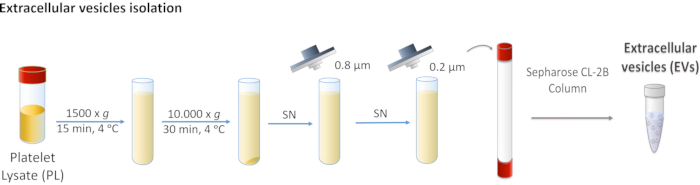
Figura 1: Diagrama esquemático do isolamento de vesícula extracelular (EVs) da plaqueta lysate (PL). PL é centrifugado primeiro a 1.500 x g, e depois a 10.000 x g para remover corpos maiores. O supernante é filtrado através de filtros de 0,8 e 0,2 μm. O PL processado é carregado na coluna, e os EVs são separados por cromatografia de exclusão de tamanho. Clique aqui para ver uma versão maior desta figura.
2. Caracterização de EVs
NOTA: A caracterização dos EVs é necessária para a realização de estudos funcionais12. Microscopia eletrônica ou caracterização de manchas ocidentais foram relatadas anteriormente13. Este relatório se concentrará nas técnicas essenciais de caracterização para a funcionalização da superfície Ti.
- Análise de rastreamento de nanopartículas (NTA)
- Diluir os EVs (1:1000) em PBS filtrado de 0,2 μm.
NOTA: Amostras muito concentradas ou amostras muito diluídas estarão fora de alcance para determinação da NTA, e será necessário ajuste. - Carregue 1 mL dos EVs diluídos com uma seringa no equipamento NTA e injete-os no equipamento NTA.
- Siga o protocolo do fabricante para a concentração de partículas e determinação de distribuição de tamanho.
- Diluir os EVs (1:1000) em PBS filtrado de 0,2 μm.
- Concentração de proteínas
- Determine a concentração usando 1 μL da solução EVs. Meça a absorvância com um espectrofotômetro em um comprimento de onda de 280 nm.
NOTA: Os EVs devem apresentar baixos níveis de proteínas em comparação com o número de partículas. - Siga as instruções do fabricante para obter a leitura de absorvência usando o espectrômetro.
- Determine a concentração usando 1 μL da solução EVs. Meça a absorvância com um espectrofotômetro em um comprimento de onda de 280 nm.
3. Funcionalização da superfície de titânio
NOTA: Neste método, são utilizados discos de titânio usinados, grau IV, 6,2 mm de diâmetro e 2 mm de altura. Os discos podem ser manipulados com pinças Ti, mas é importante não arranhar a superfície. Além disso, o lado usinado deve enfrentar para cima durante todo o processo.
- Ti discos lavam
NOTA: O volume de soluções utilizadas para a lavagem ti deve ser suficiente para cobrir discos Ti. Coloque discos Ti em um béquer de vidro e despeje soluções sobre eles. Em seguida, remova a solução decantando.- Lave os implantes ti com água deionizada (DI) e, em seguida, descarte a água.
- Lave os implantes com etanol 70%, e depois decante para remover a solução.
- Coloque os implantes em água DI e sonicate a 50 °C por 5 min. Descarte a água.
- Incubar implantes ti em uma solução NaOH de 40% a 50 °C por 10 min com agitação. Descarte a solução.
ATENÇÃO: A solução NaOH aquece durante a preparação. A solução é corrosiva e deve ser usada dentro de um capô de fumaça. - Sonicar os implantes em água DI a 50 °C por 5 minutos e, em seguida, remova a água.
- Realize várias lavagens com água DI (pelo menos 5) até chegar ao pH neutro. Verifique o pH com indicadores de pH.
- Sonicar os implantes em água DI a 50 °C por 5 minutos e remover a água.
- Incubar implantes ti em uma solução HNO3 de 50% a 50 °C por 10 minutos com agitação. Remova a solução.
ATENÇÃO: HNO3 é uma substância corrosiva e oxidante, e deve ser usado dentro de um capô de fumaça. - Sonicar os implantes em água DI a 50 °C por 5 min. Retire a água.
- Realize várias lavagens com água DI (pelo menos 5) até obter pH neutro. Verifique o pH com indicadores de pH.
- Sonicar os implantes em água DI a 50 °C por 5 min. Retire a água.
NOTA: Neste ponto, o experimento pode ser interrompido armazenando implantes ti em uma solução de 70% de etanol.
- Ti passivation
NOTA: As etapas de passivação ti são realizadas cobrindo completamente os discos Ti com as diferentes soluções no pedido listado abaixo. Os discos ti são colocados em um copo de vidro e as soluções são suavemente derramadas sobre eles. Os volumes utilizados em todas as etapas de lavagem devem cobrir completamente os implantes e são removidos por decantação.- Incubar os implantes ti em uma solução HNO3 de 30% por 30 minutos à temperatura ambiente sob suave agitação. Remova a solução.
- Realize várias lavagens com água DI (pelo menos 5) até chegar ao pH neutro. Verifique o pH com indicadores de pH.
- Incubar implantes ti durante a noite em temperatura ambiente em água DI.
- Seque os implantes em condições de vácuo a 40 °C por 10 minutos.
- EVs lançam lançamento
NOTA: Para estudos funcionais de células, é importante trabalhar em um armário de cultura celular.- Coloque os implantes Ti em uma placa de 96 poços, com o lado usinado voltado para cima.
NOTA: Se os implantes forem virados de cabeça para baixo, uma agulha pode ser usada para atrvê-los. - Descongele a solução de EVs e misture-as com agitação. Use um vórtice para pulsar por 3 s.
- Deposite os EVs na superfície ti. Neste estudo, gotas de 40 μL de solução de EVs são colocadas na Ti para imobilizar um máximo de 4 x 1011 EVs por implante de acordo com a concentração determinada pela NTA.
- Coloque as placas contendo a Ti em condições de vácuo a 37 °C até que as gotas estejam completamente secas (~2 h).
NOTA: Ajuste o tempo dependendo do número de implantes e da água presente na câmara de vácuo.
- Coloque os implantes Ti em uma placa de 96 poços, com o lado usinado voltado para cima.
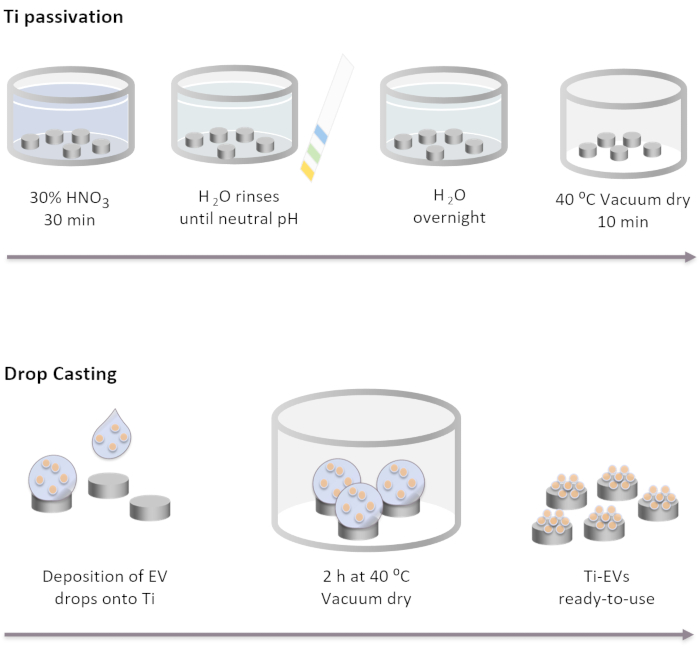
Figura 2: Diagrama esquemático de ti passivation e funcionalização de EVs por fundição de gota. Os implantes ti são passivados primeiro pela incubação por 30 min em uma solução HNO3 de 30% à temperatura ambiente. Depois de várias lavagens com água DI, o pH chega neutro. Em seguida, os implantes ti são incubados durante a noite à temperatura ambiente em água DI. Depois disso, os implantes são secos em condições de vácuo a 40 °C. Para a imobilização de EVs, 40 μL de solução EVs são depositados em implantes Ti. Em seguida, os implantes são incubados no vácuo por 2 h até que os EVs estejam fisicamente ligados à superfície. Clique aqui para ver uma versão maior desta figura.
4. Caracterização da superfície ti
- Estudo de liberação
- Incubar a superfície Ti com 200 μL de PBS filtrado a 37 °C.
NOTA: O PBS é filtrado para evitar interferências na medição NTA. - Substitua o PBS em diferentes pontos de tempo e armazene a -80 °C.
NOTA: Neste estudo, foram analisados os pontos de tempo de 2, 6, 10 e 14 dias. - Analise o PBS armazenado para estudos de partículas pela NTA de acordo com as instruções do fabricante.
NOTA: A concentração de partículas no PBS em diferentes momentos é uma representação do perfil de liberação de EVs ao longo do tempo.
- Incubar a superfície Ti com 200 μL de PBS filtrado a 37 °C.
- Estudos de biocompatibilidade
NOTA: As células-tronco mesenquimais derivadas do cordão umbilical humano (hUC-MSC) são obtidas do IdISBa Biobank em conformidade com as diretrizes institucionais.- Manter hUC-MSC em DMEM baixa glicose suplementada com 20% de FBS até o uso. Troque o meio duas vezes por semana.
- Para semeadura celular, lave as células em frascos com 5 mL de PBS duas vezes.
- Trypsinize hUC-MSC adicionando 1 mL de solução de trippsina. Certifique-se de que cobre completamente a monocamada das células. Remova a solução de trippsina e coloque o frasco de cultura celular a 37 °C por 2 min aproximadamente. Veja o desprendimento celular sob o microscópio. As células isoladas aparecerão em forma redonda e estarão em suspensão.
- Células resuspendas em DMEM de baixa glicose com EVs de 1% esgotadas FBS.
NOTA: Prepare a mídia complementada com 1% de FBS e, em seguida, ultracentrifuuge a 120.000 x g por 18 h para remover FBS-EVs. É importante remover EVs para evitar interferências com EVs plaquetas. - Determine a concentração celular contando o número de células com uma câmara de Neubauer14.
- Leve o hUC-MSC a uma concentração de 50.000 células/mL.
- Semente 200 μL da solução celular para os implantes ti.
- Após 48 h, colete 50 μL de mídia e realize a determinação citotóxica usando o kit de atividade lactato desidrogenase (LDH), de acordo com o protocolo do fabricante.
Resultados
O método apresentado neste artigo permite a obtenção de discos de titânio funcionalizados EVs. Os EVs são fisicamente ligados à superfície, o que permite uma liberação sustentada ao longo do tempo. A quantidade de EVs liberados pode ser medida pela NTA nos dias 2, 6, 10 e 14. As primeiras medições, no dia 2, mostram que cerca de 109 EVs são lançados, seguidos de uma liberação sustentada no dia 6 (~108 EVs); dia 10 (~107 EVs) e dia 14 (~107 EVs). Isso confirma uma...
Discussão
Este protocolo visa fornecer instruções claras para a funcionalização dos EVs nas superfícies ti. O método apresentado baseia-se em uma estratégia de fundição de gota, que é um tipo de funcionalização de fissionação. A má bibliografia existe em relação à funcionalização de EVs nas superfícies de Ti, embora existam poucos estudos mostrando diferentes vantagens ao imobilizar EVs no Ti10. De qualquer forma, algumas das estratégias exploradas incluem ligação bioquímica8, armad...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Esta pesquisa foi financiada pelo Instituto de Salud Carlos III, Ministerio de Economía y Competitividad, co-financiado pelo Fundo Social Europeu da ESF e pelo Fundo Europeu de Desenvolvimento Regional do ERDF (MS16/00124; CP16/00124; PI17/01605), o Direcció General d'Investigació, Conselleria d'Investigació, Govern Balear (FPI/2046/2017) e PROGRAMA JUNIOR del projecte TALENT PLUS, construyendo SALUD, generando VALOR (JUNIOR01/18), financiado pelo imposto sobre o turismo sustentável das Ilhas Baleares.
Materiais
| Name | Company | Catalog Number | Comments |
| 0,8 µm syringe filter | Sartorius | 16592K | |
| 1.5 mL Centrifuge tube | SPL life sciences | PLC60015 | |
| 1mL syringe | BD | 303174 | |
| 96-well culture plate | SPL life sciences | PLC30096 | |
| Absolut ethanol | Scharlau | ET0006005P | Used to prepare 20 % ethanol with Milli-Q® water |
| AKTA purifier System | GE Healthcare | 8149-30-0014 | |
| Allegra X-15R Centrifuge | Beckman Coutler | 392934 | SX4750A swinging rotor |
| Centrifuge 5430 R | Eppendorf | 5428000210 | F-45-48-11 rotor |
| Conical Tube, Conical Bottom, 50ml | SPL life sciences | PLC50050 | |
| Cytotoxicity Detection Kit (LDH) | Roche | 11644793001 | |
| Disposable Syringes 10 ml | Becton Dickinson | BDH307736 | |
| DMEM Low Glucose Glutamax | GIBCO | 21885025 | |
| Dulbecco's PBS (1x) | Capricorn Scientific | PBS-1A | |
| Fetal Bovine Serum (FBS) Embrionic Certified | GIBCO | 16000044 | |
| Filtropur S 0.2 µm syringe filter | Sarstedt | 83.1826.001 | |
| HiPrep 16/60 Sephacryl S-400 HR | GE Healthcare | 28-9356-04 | Precast columns |
| human umbilical cord-derived mesenchymal stem cells (hUC-MSC) | IdISBa Biobank | ||
| Nanodrop 2000 spectrophotometer | ThermoFisher | ND-2000 | |
| NanoSight NS300 nanoparticle tracking analysis | Malvern | NS300 | Device with embedded laser at λ= 532 nm and camera sCMOS |
| Needle | Terumo | 946077135 | |
| Nitric acid 69,5% | Scharlau | AC16071000 | |
| Optima L-100 XP Ultracentrifuge | Beckman Coulter | 8043-30-1124 | SW-32Ti Rotor |
| Penicillin-Streptomycin Solution 100X | Biowest | L0022 | |
| pH Test strips 4.5-10.0 | Sigma | P-4536 | |
| Platelet Lysate (PL) | IdISBa Biobank | Obtained from buffy coats discarded after blood donation | |
| Polypropylene centrifuge tubs | Beckman Coutler | 326823 | |
| Power wave HT | BioTek | 10340763 | |
| Screw cap tube, 15 ml, (LxØ): 120 x 17 mm, PP, with print | Sarstedt | 62554502 | |
| Sodium hidroxide | Sharlau | SO04251000 | |
| Titanium implants replicas | Implantmedia, SA | NA | Titanium grade IV. Diameter: 6,2 mm. Height: 1,95 mm |
| Trypsin-EDTA 1 X | Biowest | L0930 | |
| Tryton X100 | Sigma | T8787 |
Referências
- Van Niel, G., D'Angelo, G., Raposo, G. Shedding light on the cell biology of extracellular vesicles. Nature Reviews. Molecular Cell Biology. 19 (4), 213-228 (2018).
- Torreggiani, E., et al. Exosomes: novel effectors of human platelet lysate activity. European Cells & Materials. 28, 137-151 (2014).
- Antich-Rosselló, M., et al. Platelet-derived extracellular vesicles promote osteoinduction of mesenchymal stromal cells. Bone and Joint Research. 9 (10), 667-674 (2020).
- Li, Y., et al. New developments of Ti-based alloys for biomedical applications. Materials. 7 (3), 1709-1800 (2014).
- Lan, W. C., et al. The potential of a nanostructured titanium oxide layer with self-assembled monolayers for biomedical applications: Surface properties and biomechanical behaviors. Applied Sciences. 10 (2), 590 (2020).
- Jemat, A., Ghazali, M. J., Razali, M., Otsuka, Y. Surface modifications and their effects on titanium dental implants. BioMed Research International. 2015, 791725 (2015).
- Damiati, L., et al. Impact of surface topography and coating on osteogenesis and bacterial attachment on titanium implants. Journal of Tissue Engineering. 9, 2041731418790694 (2017).
- Chen, L., et al. Self-assembled human adipose-derived stem cell-derived extracellular vesicle-functionalized biotin-doped polypyrrole titanium with long-term stability and potential osteoinductive ability. ACS Applied Materials & Interfaces. 11 (49), 46183-46196 (2019).
- Wei, F., Li, M., Crawford, R., Zhou, Y., Xiao, Y. Exosome-integrated titanium oxide nanotubes for targeted bone regeneration. Acta Biomaterialia. 86, 480-492 (2019).
- Wang, X., et al. Exosomes influence the behavior of human mesenchymal stem cells on titanium surfaces. Biomaterials. 230, 119571 (2020).
- Lozano-Ramos, I., et al. Size-exclusion chromatography-based enrichment of extracellular vesicles from urine samples. Journal of Extracellular Vesicles. 4, 27369 (2015).
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750 (2018).
- Liu, J., et al. Isolation and characterization of extracellular vesicles from adult schistosoma japonicum. Journal of Visualized Experiments: JoVE. (135), e57541 (2018).
- JoVE. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. JoVE Science Education Database. , (2021).
- Chouirfa, H., Bouloussa, H., Migonney, V., Falentin-Daudré, C. Review of titanium surface modification techniques and coatings for antibacterial applications. Acta Biomaterialia. 83, 37-54 (2019).
- Córdoba, A., Monjo, M., Hierro-Oliva, M., González-Martín, M. L., Ramis, J. M. Bioinspired quercitrin nanocoatings: A fluorescence-based method for their surface quantification, and their effect on stem cell adhesion and differentiation to the osteoblastic lineage. ACS Applied Materials and Interfaces. 7 (30), 16857-16864 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados