É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Análise de interação biomecânica de fluido-estrutura biomecânica baseada em coerência óptica da progressão da aterosclerose coronária
Neste Artigo
Resumo
Há necessidade de determinar quais lesões ateroscleróticas progredirão na vasculatura coronária para orientar a intervenção antes do infarto do miocárdio ocorrer. Este artigo descreve a modelagem biomecânica das artérias a partir da Tomografia de Coerência Óptica usando técnicas de interação fluido-estrutura em um solucionador de elementos finitos comerciais para ajudar a prever essa progressão.
Resumo
Neste artigo, apresentamos um fluxo de trabalho completo para a análise biomecânica da placa aterosclerótica na vasculatura coronária. Com a aterosclerose como uma das principais causas de morte global, morbidade e carga econômica, novas formas de analisar e prever sua progressão são necessárias. Um desses métodos computacionais é o uso da interação fluido-estrutura (FSI) para analisar a interação entre o fluxo sanguíneo e os domínios da artéria/placa. Juntamente com imagens in vivo, essa abordagem poderia ser adaptada a cada paciente, auxiliando na diferenciação entre placas estáveis e instáveis. Delineamos o processo de reconstrução tridimensional, fazendo uso da Tomografia de Coerência Óptica intravascular (OCT) e angiografia coronária invasiva (ICA). A extração de condições de fronteira para a simulação, incluindo a replicação do movimento tridimensional da artéria, é discutida antes que a configuração e análise seja conduzida em um solucionador de elementos finitos comerciais. O procedimento para descrever as propriedades hiperelásticas altamente não lineares da parede da artéria e a velocidade/pressão pulsante é delineado juntamente com a configuração do acoplamento do sistema entre os dois domínios. Demonstramos o procedimento analisando uma placa não-culpada, levemente estenótica e rica em lipídios em um paciente após o infarto do miocárdio. Marcadores estabelecidos e emergentes relacionados à progressão da placa aterosclerótica, como o estresse da tesoura de parede e a helicidade normalizada local, respectivamente, são discutidos e relacionados à resposta estrutural na parede e placa da artéria. Finalmente, traduzimos os resultados para potencial relevância clínica, discutimos limitações e delineamos áreas para o desenvolvimento posterior. O método descrito neste artigo mostra a promessa de auxiliar na determinação de locais em risco de progressão aterosclerótica e, portanto, poderia auxiliar na gestão da morte significativa, morbidade e carga econômica da aterosclerose.
Introdução
A doença arterial coronariana (CAD) é o tipo mais comum de doença cardíaca e uma das principais causas de morte e carga econômica globalmente1,2. Nos Estados Unidos, cerca de uma em cada oito mortes é atribuída ao CAD3,4, enquanto a maioria das mortes globais por CAD são agora vistas em países de baixa e média renda5. A aterosclerose é o condutor predominante dessas mortes, com ruptura de placa ou erosão que leva à oclusão da artéria coronária e infarto agudo do miocárdio (IAM)6. Mesmo após a revascularização das lesões coronárias culpadas, os pacientes têm risco substancial de eventos cardiovasculares adversos recorrentes (MACE) após a AMI, em grande parte devido à presença concomitante de outras placas não culpadas que também são vulneráveis à ruptura7. A imagem intracoronária oferece uma oportunidade de detectar essas placas de alto risco8. Embora o ultrassom intravascular (IVUS) seja o padrão-ouro para avaliar o volume da placa, ele tem resolução limitada para identificar características microestruturais de placa vulnerável em contraste com a alta resolução (10-20 μm) da tomografia de coerência óptica (OUT). Uma tampa fibrosa fina e inflamada sobrepondo uma grande piscina lipídica foi demonstrada como a assinatura mais importante de uma placavulnerável 9 e é melhor identificada e medida por OUTUBRO entre as modalidades de imagem intracoronárias disponíveis atualmente10. É importante ressaltar que o OCT também é capaz de avaliar outras características de placa de alto risco, incluindo: arco lipídeído; infiltração de macrófago; presença de fibroatheroma de tampa fina (TCFA), que é definido como núcleo rico em lipídios com tampa fibrosa fina excessivamente fina (<65 μm); calcificação irregular; e microcanais de placa. A detecção de OCT desses recursos de alto risco em placas não-culpadas pós-AMI tem sido associada a um risco aumentado de até 6 vezes do mace11futuro . No entanto, apesar disso, a capacidade da angiografia e da imagem de OCT de prever quais placas coronárias progredirão e, em última instância, romperá ou corroer é limitada, com valores preditivos positivos de apenas 20%-30%8. Essa capacidade preditiva limitada dificulta a tomada de decisão clínica em torno das quais placas não culpadas tratam (por exemplo, por stent)7,12.
Além dos fatores do paciente e das características biológicas da placa, as forças biomecânicas nas artérias coronárias também são determinantes importantes da progressão da placa e da instabilidade13. Uma técnica que mostra a promessa de ajudar a avaliar de forma abrangente essas forças é a interação fluida-estrutura (FSI)14 simulação. O estresse da cisalhamento de parede (SSM), também chamado de estresse endotelial, tem sido um ponto focal tradicional para a pesquisa de biomecânica coronária15, com um entendimento geral de que a SSM desempenha um papel etiológico na formação da aterosclerose16. Predominantemente simuladas utilizando técnicas de dinâmica computacional de fluidos (CFD), regiões de baixo WSS têm sido associadas com espessamento intimal17, remodelação vascular18 e previsão de progressão da lesão19 e futura MACE20. Avanços recentes nessas análises sugerem a topologia de campo vetorial WSSsubjacente 21, e suas características multidirecionais22, como um melhor preditor de risco de aterosclerose do que apenas a magnitude do WSS. No entanto, o WSS apenas captura um vislumbre do sistema biomecânico global na parede do lúmen, e assim como as modalidades de imagem, nenhuma métrica biomecânica pode discernir com confiança características ateroscleróticas de alto risco.
Outras métricas estão emergindo como potencialmente importantes na formação da aterosclerose. Características de fluxo intraluminal23 são um exemplo, com fluxo helicoidal, quantificado através de vários índices24, sugerido como desempenhando um papel atheroprotetor suprimindo padrões de fluxoperturbados 25,26. Embora as técnicas de CFD possam analisar essas características de fluxo e apresentar uma ampla gama de resultados úteis, elas não consideram as interações subjacentes entre o fluxo sanguíneo, a estrutura da artéria e o movimento cardíaco geral. Essa simplificação do sistema dinâmico para uma parede rígida perde resultados potencialmente críticos, como o estresse da tampa fibrosa. Enquanto o debate a favor e contra a necessidade de FSI sobre CFD continua27,28,29, muitas comparações não incluem o impacto da função ventrículo. Essa limitação pode ser superada com o FSI, que demonstrou que a dobra dinâmica e a compressão exercida na artéria através da influência da função ventrículo podem impactar significativamente a placa e o estresse estrutural da artéria, bem como métricas de fluxo como WSS30,31,32. Isso é importante, pois as tensões estruturais também são uma métrica fundamental para analisar e prever a ruptura da placa33,34 e foram sugeridas a co-localização com regiões de placa aumentar14,35. A captura dessas interações permite uma representação mais realista do ambiente coronário e dos mecanismos potenciais de progressão da doença.
Abordando isso, aqui descrevemos o processo de desenvolvimento de uma geometria específica do paciente a partir da imagemOCT 36 e a configuração e execução de uma simulação FSI da artéria usando um solucionador de elementos finitos comerciais. O processo para extrair manualmente a parede da artéria lúmen, lipídica e externa é detalhado antes da reconstrução computacional tridimensional da artéria do paciente. Delineamos a configuração da simulação, o acoplamento e o processo de comparação da linha de base e os parâmetros de imagem de OCT de acompanhamento para determinar a progressão da lesão. Por fim, discutimos o pós-processamento de resultados numéricos e como esses dados podem ter relevância clínica, comparando os resultados biomecânicos com a progressão/regressão da lesão. O método geral é demonstrado em não-culpado, placas levemente estenóticas e ricas em lipídios na artéria coronária direita (RCA) de um paciente caucasiano de 58 anos que apresentou um infarto agudo de mingração de elevação não-ST no cenário de hipertensão, diabetes mellitus tipo 2, obesidade (IMC 32,6) e histórico familiar de cmagem coronariana prematura e imagem de OCT foram realizadas durante sua internação inicial, e, em seguida, 12 meses depois como parte de um estudo clínico em andamento (teste COCOMO-ACS ACTRN12618000809235). Prevemos que essa técnica pode ser ainda mais refinada e usada para identificar placas coronárias que estão em alto risco de progredir.
Protocolo
Os seguintes dados desidentidos foram analisados a partir de um paciente recrutado no ensaio controlado randomizado COCOMO-ACS em curso (ACTRN12618000809235; Número de referência do Hospital Royal Adelaide HREC: HREC/17/RAH/366), com aprovação ética adicional concedida pelos Serviços de Pesquisa da Central Adelaide Local Health Network (CALHN) para fins de simulação biomecânica (CalHN Reference Number 14179). A Figura 1 resume o fluxo de trabalho completo descrito no protocolo a seguir, que pode ser aplicado a qualquer software ou códigos compatíveis com FSI.
1. Avaliação de imagem
- Coincidir com as imagens de linha de base e de acompanhamento de OUTUBRO usando marcos anatômicos, como bifurcações e usando imagens imediatamente proximais à bifurcação distal e distal à bifurcação mais proximal. As imagens combinadas entre esses marcos devem ser analisadas, conforme descrito na Figura 2A.
- Seção transversal de lúmen oct
- Carregue cada imagem OCT no digitalizador de imagem e clique para marcar pontos no ponto central do cateter e nos limites da escala (Figura 2B). Exporte esses pontos para serem usados posteriormente.
- Marque manualmente a borda do lúmen, começando no mesmo local em cada imagem, tendo a certeza de capturar as curvas do lúmen o mais preciso possível. Deixe uma lacuna no artefato do cateter, pois o processo de reconstrução será interpolado por toda a região em um estágio posterior. Exporte esses arquivos em formato .dat e repita isso para cada imagem.
- Parede externa e lipídios oct
- No software DICOM, extraia a parede externa em regiões de alta atenuação usando partes visíveis da membrana elástica externa para encaixar manualmente uma elipse para estimar a localização externa da parede, conforme descrito na Figura 3. Clique e arraste o botão esquerdo do mouse para definir a elipse e posicione-se adequadamente.
- Defina manualmente o arco lipídico, calculado para o lumen centroid, e a espessura da tampa fibrosa, conforme descrito na Figura 3,clicando e arrastando medidas de ângulo e distância, respectivamente. Estes serão usados para analisar a progressão da lesão juntamente com a área do lúmen.
- Importe essas imagens sobrepostas no digitalizador de imagem e selecione manualmente os pontos externos da parede, usando a elipse instalada como guia em regiões de alta atenuação onde a membrana elástica externa não é visível. Repita o passo 1.2.2 para selecionar e exportar os pontos para um formato .dat.
- Da mesma forma para os lipídios, selecione manualmente a superfície lipídica, partindo da mesma extremidade do lipídio em todos os casos. Use o guia elipsoidal da parede externa (passo 1.3.1) para um arco traseiro consistente. A exportação aponta para um arquivo .dat e repetir para todas as imagens com lipídios presentes, deixando uma lacuna no artefato do fio-guia, conforme descrito na etapa 1.2.2.
NOTA: A progressão da lesão é analisada comparando três métricas: área de lúmen, arco lipídico e espessura da tampa fibrosa, que podem ser avaliadas diretamente do visualizador DICOM. A técnica para extrair a parede externa e a parte traseira lipídica é necessária devido à profundidade de penetração limitada do OCT. A OCT foi utilizada nesta investigação devido ao foco na relação entre a composição da placa e as forças biomecânicas.
- Centro baseado em angiografia
- Carregue a primeira imagem angiográfica no digitalizador de imagem37. Selecione as bordas do cateter para dimensionar a imagem em etapas posteriores e, em seguida, marque manualmente a linha central do cateter começando com o marcador proximal e movendo-se distralmente, com pontos espaçados uniformemente, como mostrado na Figura 4A. Exporte os dados para .dat formato e repita para o segundo plano angiográfico.
NOTA: Geralmente, os planos com um ângulo maior que 20° entre eles melhoram a robustez de reconstrução da linha central tridimensional. O cateter e o fio-guia OCT devem ser visíveis em cada imagem.
- Carregue a primeira imagem angiográfica no digitalizador de imagem37. Selecione as bordas do cateter para dimensionar a imagem em etapas posteriores e, em seguida, marque manualmente a linha central do cateter começando com o marcador proximal e movendo-se distralmente, com pontos espaçados uniformemente, como mostrado na Figura 4A. Exporte os dados para .dat formato e repita para o segundo plano angiográfico.
2. Reconstrução tridimensional
- Projeções de angiografia
- Carregue os arquivos de dados que foram exportados na etapa 1.4. Use os dois primeiros pontos para dimensionar os dados para milímetros (os dois primeiros pontos são usados com as especificações conhecidas do cateter, 6F neste caso). Subtraia o ponto de dados proximal dos pontos restantes em cada conjunto de dados para que a curva comece na origem do sistema de coordenadas.
- Gerar matrizes de rotação para cada vista angiográfica, onde φ e Φ representam os ângulos RAO/LAO e CAU/CRA, respectivamente. Usamos ângulos de LAO e CRA como negativos. As duas matrizes de rotação nas instruções x (Rotx) e y (Roty)são:
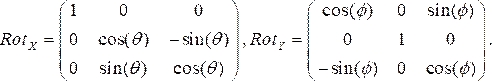 (1)
(1) - Multiplique as matrizes de rotação juntas e multiplique-as com as coordenadas de cada ponto a partir da etapa 2.1.1. A equação resultante:
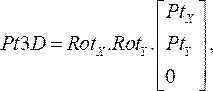 (2)
(2)
dá a localização tridimensional do ponto do cateter em seu respectivo plano de angiograma(Pt3D)girando os pontos bidimensionais que foram especificados a partir de cada imagem angiográfica. - Calcule o vetor normal para cada plano angiográfico multiplicando as matrizes de rotação x e y pelo vetor da unidade na direção z. Do local proximal ao distal, projete cada ponto normal até seu respectivo plano e calcule o ponto médio da menor distância entre as projeções. Isso resulta no ponto tridimensional no fio-guia OCT no espaço.
- Usando a função 'interparc', disponível na troca de arquivos central MATLAB38,divida a linha central tridimensional em pontos igualmente espaçados. O espaçamento entre os pontos deve ser igual ao espaçamento entre as imagens OCT, que é determinada pela velocidade de recuo. Estes são os locais onde as seções transversais de OCT serão colocadas.
- Rotação transversal OCT
- Usando o arquivo de dados contendo o centro e a escala do cateter, converta cada seção transversal de pixels para mm usando o segundo e terceiro pontos no arquivo de escala. Para centralizar a seção transversal sobre a localização do cateter, subtraia o primeiro ponto do arquivo de escala (o centro do cateter) de todos os pontos de seção transversal. Calcule o vetor normal para a seção transversal (paralelo ao cateter na artéria) subtraindo o ponto central tridimensional do próximo ponto distal ao longo da curva do cateter.
- Gire a seção transversal OCT para alinhar perpendicular à linha central do cateter multiplicando os pontos de dados dimensionados pela matriz de rotação:
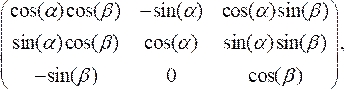 (3)
(3)
onde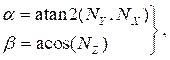 (4)
(4)
e NX, N Ye NZ são os componentes x,y e z, respectivamente, do vetor normal calculado na seção 2.1. Adicione o ponto central tridimensional a todos os pontos girados na seção transversal, resultando na localização da seção transversal no espaço tridimensional(Figura 4B). - Repetir as etapas 2.2.1-2.2.2 para cada seção transversal (lúmen, artéria e lipídio). Exporte as seções transversais para um arquivo de texto, que pode ser importado para o software de design auxiliado por computador (CAD) para a criação final do corpo sólido.
- Criação de modelo sólido 3D
- Em um software de modelagem 3D, importe e gere as seções transversais um arquivo de cada vez. Importe os arquivos de texto contendo as seções transversais no software de modelagem 3D clicando na caixa de entrada conceito(Figura 5A-1) e selecionando curva 3D(Figura 5A-2). Clique em Gerar.
- Para criar um componente sólido, selecione todas as curvas em ordem e elas as juntem(Figura 5A-3),garantindo que o acréscimo congelado seja selecionado para gerar um novo sólido. Realize essas etapas para que o lúmen, os lipídios e a parede externa criem sólidos separados, garantindo permitir a topologia da fusão.
NOTA: Pode ser necessário pular uma curva se surgir geometria problemática. Nesta reconstrução, omite um pequeno lipídio de seção média devido ao seu tamanho e ao custo computacional adicionado e complexidade numérica associada à sua inclusão. - Para subtrair o lúmen e os lipídios da parede da artéria, crie uma operação booleana a partir da lista de criação e escolha o corpo alvo como a parede e os lipídios/lúmen como os corpos de ferramentas para subtrair o lúmen e lipídios da parede da artéria(Figura 5A-4).
- Compartilhe a topologia entre a parede e os lipídios para garantir que os nós de malha sejam compartilhados em etapas futuras. Para isso, destaque manualmente a parede e os lipídios e clique com o botão direito do mouse para formar uma nova peça (Figura 5A-5).
NOTA: Esta etapa garante que os nós de malha sejam compartilhados entre as superfícies que impedem regiões de contato inadequadas ou penetração de malha entre as duas camadas, auxiliando muito na fase da solução. A geometria final da linha central do cateter, lipídios, lúmen e parede da artéria é visualizada na Figura 5B.
- Pré-processamento: Condições de limite
NOTA: Antes de configurar a simulação, são necessárias condições específicas de limite do paciente (BC's). Aqui foi utilizado o deslocamento extraído da angiografia, que é aplicado na entrada e saída da simulação e velocidade/pressão do fluxo sanguíneo medidos de pacientes humanos e descritos na literatura39.- Deslocamento
- Repita as etapas 1.4 e 2.1, mas escolhendo apenas os marcadores distais e proximais, começando com a imagem angiográfica imediatamente anterior à estatola final. Faça isso por todas as imagens angiográficas ao longo de um ciclo cardíaco.
- Ajuste as coordenadas de alisamento para as coordenadas x, y, e z dos dois conjuntos de pontos. Isso resulta no deslocamento das regiões de entrada e saída. Os resultados representativos para os deslocamentos dos pacientes são mostrados na Figura 6A.
NOTA: A análise de deslocamento foi iniciada na imagem anterior à diastole final para a melhor combinação de fases entre o deslocamento extraído e os perfis de pressão e velocidade aplicados encontrados na seção 3.1.2, cuja fase sistólica começa em 0,1 s (correspondente ao espaçamento entre imagens angiográficas). Ao extrair movimento, certifique-se de que não há nenhum movimento de tabela/imagem ao longo do conjunto de imagens.
- Velocidade/pressão sanguínea
- Crie perfis que descrevam a velocidade e a pressão pulsantes compilando Funções Definidas pelo Usuário (UDF). Aqui foram aplicados perfis transitórios medidos de pacientes humanos na literatura 39, modelados como uma série Fourier, matematicamente descrita por:
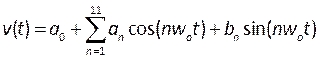 , (5)
, (5)
onde t é o tempo, w0 é a frequência, T é o período de sinal, n é o número de termos, e um0-11, b1-11 são coeficientes instalados em perfis descritos na literatura. Neste caso, estamos usando os primeiros 11 termos. - NOTA: Esses perfis são descritos na Figura 6B e devem ser escritos em um arquivo formatado C em um ambiente de desenvolvimento integrado, como o Microsoft Visual Studio. A pressão de saída é um perfil plano e a velocidade da entrada é aplicada como um perfil parabólico totalmente desenvolvido, descrito como suficiente para reproduzir condições realistas40. O desenvolvimento adicional deste procedimento pode incluir a medição da velocidade sanguínea do paciente (como pela ecocardiografiadoppler 41) e a pressão (usando fios de pressão) como condições de fronteira mais realistas. Além disso, a medição simultânea do deslocamento, da velocidade sanguínea e da pressão garantiria que suas fases fossem adequadamente combinadas.
- Crie perfis que descrevam a velocidade e a pressão pulsantes compilando Funções Definidas pelo Usuário (UDF). Aqui foram aplicados perfis transitórios medidos de pacientes humanos na literatura 39, modelados como uma série Fourier, matematicamente descrita por:
- Deslocamento
3. Artéria/estrutural
- Para definir as propriedades do material para a artéria e lipídio, digite dados de engenharia e adicione um novo material chamado artéria. A densidade de arrasto e o modelo Mooney-Rivlin de 5 parâmetros para o novo material e definir seus parâmetros. Insira uma densidade de 1.000 kg/m3 e os coeficientes hiperelásticos descritos na Tabela 1, com base nas propriedades intima42 e lipídica43 da literatura. Repita isso para o lipídio.
NOTA: O modelo Mooney-Rivlin é descrito por44: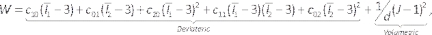 (6)
(6)
Onde c10, c01, c20, c11, e c02 são constantes materiais e d é o parâmetro de incompressão (zero para material incompressível neste caso). Aqui eux é o xth invariante do tensor de tensão e J é o determinante gradiente de deformação elástica. - Digite o componente modelo, suprimir o componente lúmen/fluido clicando com o botão direito do mouse no Lumen/Fluido e selecionando Suprimir (Figura 7A). Atribua os materiais previamente definidos à artéria e aos sólidos lipíduos, selecionando-os da lista de queda de material, verificando se as unidades são apropriadas.
- A geometria agora precisa ser misturada. Clique na malha(Figura 7B),defina a preferência física para mecânica não linear e especifique o dimensionamento da malha. Aqui foi utilizada a malha adaptativa com um tamanho de alvo de 0,14 mm. Ajuste as preferências da malha conforme necessário para obter valores razoáveis de especiação da malha e aponte para pelo menos dois a três elementos de malha em lacunas como a tampa fibrosa. A geração da malha pode levar algum tempo devido à geometria complexa.
NOTA: Um estudo de independência de malha deve ser realizado para garantir que os resultados não sejam impactados pelas características da malha. Diminuir gradualmente o tamanho da malha e comparar resultados até que a variação seja menor que um limite definido; neste caso, utilizamos 2%45 (medido na tampa fibrosa da terceira placa). Além disso, para garantir a qualidade da malha, verifique a inclinação da malha; a inclinação da malha alta resultará em dificuldades numéricas durante a convergência ou resultados imprecisos. Para diminuir a inclinação, tente diminuir o tamanho da malha ou ajustar a taxa de crescimento, tamanho máximo e/ou ângulo de curvatura. Os resultados do nosso teste de independência de malha estão descritos na Tabela 2,com variação percentual nos resultados em relação ao dimensionamento médio da malha, utilizado ao longo desta análise. - Clique nas configurações de Análise (Figura 7C). Para simulações de FSI, desligue o tempo automático e defina o número de subpassos para um (o acoplamento do sistema controlará subpassos), defina o tempo final da simulação, neste caso 0,8 s (frequência cardíaca do paciente de 75 bpm). O acoplamento do sistema controlará o tempo e os subpassos.
- Na lista de drop-down dos controles do solver, defina o tipo de solucionador para programar controlado para usar o método direto ou iterativo. Os métodos diretos são mais robustos, mas usam uma quantidade significativa de memória. Coloque o método Newton-Raphson completo. (Devido à complexidade da geometria e da não linearidade na simulação, o método direto e o método iterativo newton-raphson completo podem ser necessários; no entanto, estes aumentam significativamente o custo de computação.)
- Especifique o domínio de acoplamento do sistema como a parede interna da artéria inserindo uma interface fluida-sólida. Faça isso clicando com o botão direito do mouse e inset uma interface fluida-sólida sob a guia Transient (Figura 7D). Selecione o interior da parede da artéria para a interface. Isso passará dados entre a estrutura e o fluido neste local.
- As condições de limite de deslocamento podem ser inseridas como função de deslocamento na direção x, ye z aplicada na entrada e saídas. Faça isso clicando com o botão direito do mouse na guia Transient e inserindo deslocamentos(Figura 7E). Duplique o deslocamento para as direções x, ye z. Na lista suspensa da direção, selecione a função e copie os deslocamentos extraídos na etapa 2.4.1.
NOTA: O deslocamento pode ser inserido como uma função ou como uma tabela de pontos, dependendo das preferências. - Para auxiliar na solução de problemas, sob a guia Solução, insira quatro resíduos Newton-Raphson. Estes podem ser visualizados se surgirem erros para encontrar a geometria problemática ou locais de malha.
NOTA: Para inserir opções pós-processamento, como o máximo de estresse principal, clique com o botão direito do mouse na guia Solução e insira os resultados apropriados(Figura 7F).
4. Sangue/fluido
- Digite a guia Modelo, verifique as unidades e suprime a artéria e a parte lipídica, deixando o domínio fluido, de forma semelhante ao passo 3.2.
- Especifique as métricas de malha e gere a malha, verificando a inclinação e ajustando se necessário (aplicamos um tamanho de malha de 0,14 mm com um tamanho máximo de parede de 0,12 mm). É uma boa prática usar tamanho e forma de malha semelhantes, como feito na parte estrutural, nas áreas onde a interação fluido-sólido está ocorrendo.
NOTA: Assim como na etapa 3.3, deve ser realizado um teste de independência de malha para garantir que os resultados sejam independentes das propriedades da malha, conforme mostrado na Tabela 2. Verifique a qualidade da malha e ajuste o tamanho do elemento, taxa de crescimento, refinamento ou curvatura conforme necessário para garantir que a inclinação permaneça baixa e que a independência da malha seja alcançada. - Crie seleções nomeadas para a entrada, saída e parede antes de entrar na configuração do fluido, clicando com o botão direito do mouse na superfície respectiva e selecionando a seleção nomeada de inserção.
- Digite a guia Configuração e certifique-se de que a dupla precisão esteja ativada. Defina o tipo Solver como Baseado em Pressão e certifique-se de que o tempo seja definido como Transitório verificando suas respectivas caixas de marca(Figura 8A).
- Habilite o modelo K-omega Viscous Turbulence e habilite o Transporte de Estresse de Cisalhamento e Correções de Baixo Reynolds inserindo a guia Modelos Viscosos(Figura 8B) e verificando suas respectivas caixas de marca.
- Para habilitar modelos de viscosidade não lineares com turbulência, digite o comando '/definir/modelos/viscoso/turbulência-expert/turb-non-newtonian?' no console de comando(Figura 8C) e digite 'sim' quando solicitado.
- Em Materiais (Figura 8D),defina as propriedades sanguíneas inserindo densidade e selecionando a lei de poder não newtoniana na lista de queda de viscosidade. Faça isso renomeando o fluido como sangue, estabelecendo uma densidade de 1.050 kg/m3, e estabelecendo o índice de consistência não newtoniana da Lei de Potência, k, para 0,035, o índice de direito de poder, n,para 0,6.
NOTA: O modelo de viscosidade não newtoniana da Lei do Poder foi escolhido com base na literatura para descrever a viscosidade sanguínea não linear46, η, em termos da taxa de cepa de fluido,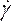 como:
como: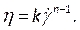 (7)
(7)
Existem vários modelos de viscosidade sanguínea não newtoniana para capturar a natureza de afinação de sangue. Várias publicações46,47,48,49 investigaram a eficácia de diversos modelos de viscosidade e seus coeficientes, que devem ser consultados para maiores informações na escolha do modelo adequado. - Compile nossa função definida pelo usuário, descrita anteriormente na etapa 2.4.2, contendo a velocidade e pressão arterial transitórias, verificando as linhas de comando para quaisquer erros(Figura 8C). Agora carregue o UDF digitando a guia Definida pelo Usuário(Figura 8E),selecionando Compilada e navegando para o diretório do UDF antes de importá-lo e clicar em Build, e depois em Carregar.
NOTA: O texto aparecerá no console(Figura 8C). Verifique isso cuidadosamente para garantir que não haja erros ou avisos. Se o UDF for carregado corretamente, os nomes do UDF aparecerão no console (destacado na Figura 8C). - Estes podem ser aplicados na entrada e na tomada. Para fazer isso, selecione a guia Condições de Limite. Clique duas vezes em Entrada (Figura 8F) e escolha o UDF de entrada na lista de drop-down do perfil. Repita esta etapa para definir também a pressão de saída.
- Habilite a malha dinâmica (verificando a caixa de marca sob a guia Malha Dinâmica mostrada na Figura 8G), incluindo suavização, remeshing e 6° de caixas de tick do solucionador de liberdade, definindo o parâmetro de difusão para 1,5 e as escamas máximas e mínimas apropriadas para a sua malha.
- Certifique-se de que as escalas de malha máxima e mínima estão dentro dos limites da zona de malha e que a inclinação do alvo está definida para 0,7. As propriedades da malha podem ser mostradas clicando na guia Propriedades de malha.
- Crie uma nova zona de malha dinâmica clicando no botão Criar, especifique a parede do lúmen na lista de drop down da Região e selecione o acoplamento do sistema. Esta é a interface para passar dados para o componente artéria da simulação.
- Crie zonas de malha deformante para o lúmen de entrada, saída e interior com valores apropriados para a balança de malha. Faça isso clicando em Criar na guia Malha dinâmica e escolhendo Deformar. Habilite a remeshing e suavização e defina as balanças de malha com base nos limites de cada região. Muitas vezes, erros negativos de volume celular estão associados a esta malha dinâmica, por isso verifique cuidadosamente e ajuste as balanças de malha, se necessário para cada região.
- Certifique-se de que o acoplamento de velocidade de pressão está definido para acoplamento e definir os esquemas transitórios de formulação e discretização espacial para segunda ordem, inserindo a guia Métodos (Figura 8H) e fazendo seleções das respectivas listas de drop-down.
- Nos controles(Figura 8H),digite um número de courant de dois, e defina os critérios de convergência residual na guia Monitores (Figura 8I). Usamos um valor de 1e-5 para continuidade e 1e-6 para o restante.
NOTA: O número de Courant pode ser estimado com base no tamanho da malha, dx,tamanho do passo do tempo, dt, e velocidade do sangue, v, usando: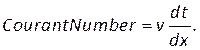 (8)
(8)
Digite este número na seção número de courant na guia Controles (Figura 8H). Aqui aplicamos um número courant de dois. O número de Courant é geralmente menor que um; no entanto, à medida que o solucionador de velocidade de pressão acoplado com métodos implícitos de solução é usado, o resultado é inerentemente mais estável e menos sensível a esse valor; portanto, dois é considerado aceitável. - Para definir uma função personalizada para resultados como a helicidade normalizada local (LNH), selecione funções de campo personalizadas na guia Parâmetros e Personalização (Figura 8J) e insira uma nova função clicando com o botão direito do mouse e seleção de Novo. Use a janela pop-up para definir conforme necessário. Digite a fórmula usando a lista de variáveis de solucionador. Como resultado representativo, usamos LNH50,51, uma medida do alinhamento entre a velocidade, e
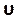 vorticidade, ω,vetores, como uma função personalizada descrita por:
vorticidade, ω,vetores, como uma função personalizada descrita por: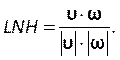 (9)
(9)
NOTA: Outras variáveis personalizadas devem ser definidas nesta etapa, como o índice de cisalhamento oscilatório (OSI)52,53, uma medida de reversão de fluxo. - Na guia Cálculo de execução (Figura 8K),defina o número de prazos para 160 (um tamanho de etapa de 0,005 s e tempo final de 0,8 s), tamanho da etapa de tempo de 5 ms e o número de iterações para 300 para garantir que o resultado seja independente do tempo.
NOTA: Dependendo da complexidade da simulação, podem ser necessárias iterações maiores por etapa. Múltiplos ciclos cardíacos podem ser necessários para uma convergência numérica completa, algo que notamos como uma limitação; no entanto, isso é frequentemente aplicado em simulações de biomecânica coronária devido ao custo computacional associado a essas simulações. - Verifique se a caixa de tique-taque data Sampling for Time Statistics está ativada e certifique-se de que as estatísticas de parede e os estresses da tesoura de fluxo sejam selecionados, bem como a função personalizada previamente definida.
- Crie a exportação de dados na guia Atividades de Cálculo e Autosave (Figura 8L),selecionando a opção CFD-Post Compatible para pós-processamento. Se desejar processar resultados em um software separado, ajuste o tipo de exportação conforme necessário. Selecione todas as regiões (parede, malha interior, entrada, saída) e os resultados a serem exportados.
- Por fim, inicialize a simulação com o esquema híbrido inserindo a guia Initialização (Figura 8M),selecionando o esquema Híbrido, clicando em Configuraçõese aumentando o número de iterações para 20. Clique em Initialize.
5. Acoplamento do sistema
- Certifique-se de que as configurações estruturais e fluidas estejam conectadas ao acoplamento do sistema e atualizadas. Faça isso clicando e arrastando a configuração estrutural e fluida para acoplamento do sistema para vinculá-los, como mostrado na Figura 9A, garantindo que ambas as configurações sejam atualizadas clicando com o botão direito do mouse e selecionando Update.
- Em System Coupling, defina o tempo final para 0,8 s e o passo do tempo para 0,005 s. Faça isso selecionando Configurações de análise (Figura 9B-1) e digitando o tempo final e o tamanho da etapa de tempo. Defina as iterações máximas para 10.
NOTA: Geralmente, entre 10 e 15 iterações é suficiente se os componentes estruturais e fluidos estiverem convergindo bem. - Selecione a parede e a interface sólida dos componentes fluidos e estruturais, respectivamente, e adicione uma transferência de dados segurando ctrl e selecionando as duas interfaces de estrutura de fluido(Figura 9B-2); clique com o botão direito do mouse e crie uma transferência de dados entre o fluido e os componentes estruturais(Figura 9B-3). Ajuste o subcontração ou rampa da força que está sendo transferida do fluido para a estrutura para auxiliar na convergência.
NOTA: Dependendo da complexidade do modelo, condições de limite e propriedades materiais, pode-se exigir rampa de transferência de dados ou sub-relaxamento para a convergência numérica. Estes podem ser aplicados à transferência de dados de fluidos (ou seja, a força que está sendo transferida do componente fluido para a parede da artéria). Essas opções estão disponíveis dentro das transferências de dados criadas(Figura 9B-2). - Quando estiver pronto para ser executado, clique em Atualizar. Dados de simulação como convergência estrutural e fluida e sua respectiva convergência de transferência de dados são impressos no console.
NOTA: Observe que as simulações de FSI são computacionalmente caras, com esta simulação levando 11 dias em uma máquina de 16 núcleos (Intel Xeon Gold de 2,6 GHz usando 180 Gb de memória física (RAM)), com maior variação nos tempos de simulação dependendo da configuração do hardware e da complexidade do modelo. Os resíduos representativos de transferência de dados são mostrados no gráfico (Figura 9B-4) e os dados da solução são impressos no console (Figura 9B-5). Nas primeiras iterações, a convergência dos resíduos de transferência de dados pode não ser completamente obtida até que um estado de equilíbrio seja alcançado. Isso é descrito com mais detalhes na legenda para a Figura 9B. - Quando a simulação estiver concluída, os resultados podem ser pós-processados dentro do software comercial ou em um software separado, dependendo do seu tipo de exportação de dados descrito na etapa 4.19.
Resultados
Os resultados representativos são apresentados tanto para marcadores biomecânicos estabelecidos quanto emergentes da progressão da aterosclerose. Métricas estabelecidas como os resultados derivados do WSS e WSS (incluindo o estresse da tesoura de parede mediana (TAWSS) e o índice de tesoura oscilatória (OSI)) são visualizados na Figura 10. O estresse da cisalhamento da parede sobre o ciclo cardíaco é em grande parte impulsionado pela velocidade do sangue, no entanto, a geometria da ...
Discussão
O uso de métodos FSI para analisar a biomecânica coronária ainda é um campo em desenvolvimento tanto a partir da modelagem numérica quanto dos aspectos do resultado clínico. Aqui descrevemos o esboço da criação de uma análise de FSI específica do paciente, com base nos métodos de elemento finito/volume finito, utilizando OCT e imagem angiográfica. Embora o método que descrevemos aqui utilize um solucionador de elementos finitos comerciais, o procedimento pode ser aplicado a qualquer software capaz de FSI. A...
Divulgações
Os autores não têm conflitos para declarar sobre a elaboração deste artigo. S.J.N. recebeu apoio de pesquisa da AstraZeneca, Amgen, Anthera, Eli Lilly, Esperion, Novartis, Cerenis, The Medicines Company, Resverlogix, InfraReDx, Roche, Sanofi-Regeneron e Liposcience e é consultor da AstraZeneca, Akcea, Eli Lilly, Anthera, Kowa, Omthera, Merck, Takeda, Resverlogix, Sanofi-Regeneron, CSL Behring, Esperion e Boehringer Ingel P.J.P. recebeu apoio de pesquisa da Abbott Vascular, taxas de consultoria da Amgen e Esperion e palestrante honoraria da AstraZeneca, Bayer, Boehringer Ingelheim, Merck Schering-Plough e Pfizer.
Agradecimentos
Os autores gostariam de reconhecer o apoio da Universidade de Adelaide, do Royal Adelaide Hospital (RAH) e do South Australian Health and Medical Research Institute (SAHMRI). O estudo COCOMO-ACS é um estudo iniciado por pesquisadores financiado por subvenções de projetos do National Health and Medical Research Council (NHMRC) da Austrália (ID1127159) e da National Heart Foundation of Australia (ID101370). H.J.C. é apoiado por uma bolsa de estudos da Westpac Scholars Trust (Future Leaders Scholarship) e reconhece o apoio da Universidade de Adelaide, Escola de Engenharia Mecânica e do Programa de Treinamento em Pesquisa em Educação, Habilidades e Emprego (RTP). S.J.N. recebe uma Bolsa de Pesquisa Principal do NHMRC (ID1111630). P.J.P. recebe uma Bolsa líder futura nível 2 da National Heart Foundation of Australia (FLF102056) e a Bolsa de Desenvolvimento de Carreira nível 2 do NHMRC (CDF1161506).
Materiais
| Name | Company | Catalog Number | Comments |
| ANSYS Workbench (version 19.0) | ANSYS | Commercial finite element solver | |
| MATLAB (version 2019b) | Mathworks | Commercial programming platform | |
| MicroDicom/ImageJ | MicroDicom/ImageJ | Open Source DICOM reader | |
| Visual Studio (version 2019) | Microsoft | Commercial Integrated Development Environment |
Referências
- American Heart Association. Cardiovascular disease: A costly burden for America projections through 2035. American Heart Association. , (2017).
- Gheorghe, A., et al. The economic burden of cardiovascular disease and hypertension in low-and middle-income countries: A systematic review. BMC Public Health. 18 (1), 975 (2018).
- Virani, S. S., et al. Heart disease and stroke statistics-2020 update: A report from the American Heart Association. Circulation. 141 (9), 139 (2020).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56 (2019).
- Cardiovascular diseases (CVDs). World Health Organisation Available from: https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds) (2017)
- Calvert, J. W., Willis, M. S., Homeister, J. W., Stone, J. R. . Cellular and Molecular Pathobiology of Cardiovascular Disease. , 79-100 (2014).
- Baumann, A. A. W., Mishra, A., Worthley, M. I., Nelson, A. J., Psaltis, P. J. Management of multivessel coronary artery disease in patients with non-ST-elevation myocardial infarction: a complex path to precision medicine. Therapeutic Advances in Chronic Disease. 11, 1-23 (2020).
- Montarello, N. J., Nelson, A. J., Verjans, J., Nicholls, S. J., Psaltis, P. J. The role of intracoronary imaging in translational research. Cardiovascular Diagnosis and Therapy. 10 (5), 1480-1507 (2020).
- Narula, J., et al. Histopathologic characteristics of atherosclerotic coronary disease and implications of the findings for the invasive and noninvasive detection of vulnerable plaques. Journal of the American College of Cardiology. 61 (10), 1041-1051 (2013).
- Kim, S. -. J., et al. Reproducibility of in vivo measurements for fibrous cap thickness and lipid arc by OCT. JACC: Cardiovascular Imaging. 5 (10), 1072-1074 (2012).
- Prati, F., et al. Relationship between coronary plaque morphology of the left anterior descending artery and 12 months clinical outcome: the CLIMA study. European Heart Journal. 41 (3), 383-391 (2019).
- Nelson, A. J., Ardissino, M., Psaltis, P. Current approach to the diagnosis of atherosclerotic coronary artery disease: more questions than answers. Therapeutic Advances in Chronic Disease. 10, 1-20 (2019).
- Carpenter, H. J., Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. A review on the biomechanics of coronary arteries. International Journal of Engineering Science. 147, (2020).
- Wang, L., et al. Fluid-structure interaction models based on patient-specific IVUS at baseline and follow-up for prediction of coronary plaque progression by morphological and biomechanical factors: A preliminary study. Journal of Biomechanics. 68, 43-50 (2018).
- Shishikura, D., et al. The relationship between segmental wall shear stress and lipid core plaque derived from near-infrared spectroscopy. Atherosclerosis. 275, 68-73 (2018).
- Cameron, J. N., et al. Exploring the relationship between biomechanical stresses and coronary atherosclerosis. Atherosclerosis. 302, 43-51 (2020).
- Giannoglou, G. D., Soulis, J. V., Farmakis, T. M., Farmakis, D. M., Louridas, G. E. Haemodynamic factors and the important role of local low static pressure in coronary wall thickening. International Journal of Cardiology. 86 (1), 27-40 (2002).
- Stone, P. H., et al. Effect of endothelial shear stress on the progression of coronary artery disease, vascular remodeling, and in-stent restenosis in humans: In vivo 6-month follow-up study. Circulation. 108 (4), 438-444 (2003).
- Bourantas Christos, V., et al. Shear stress estimated by quantitative coronary angiography predicts plaques prone to progress and cause events. JACC: Cardiovascular Imaging. 13 (10), 2206-2219 (2020).
- Stone, P. H., et al. Role of low endothelial shear stress and plaque characteristics in the prediction of nonculprit major adverse cardiac events: The PROSPECT study. JACC: Cardiovascular Imaging. 11 (3), 462-471 (2018).
- Arzani, A., Gambaruto, A. M., Chen, G., Shadden, S. C. Wall shear stress exposure time: a Lagrangian measure of near-wall stagnation and concentration in cardiovascular flows. Biomechanics and Modeling in Mechanobiology. 16 (3), 787-803 (2017).
- Hoogendoorn, A., et al. Multidirectional wall shear stress promotes advanced coronary plaque development: comparing five shear stress metrics. Cardiovascular Research. 116 (6), 1136-1146 (2020).
- Chiastra, C., et al. Healthy and diseased coronary bifurcation geometries influence near-wall and intravascular flow: A computational exploration of the hemodynamic risk. Journal of Biomechanics. 58, 79-88 (2017).
- Gallo, D., Steinman, D. A., Bijari, P. B., Morbiducci, U. Helical flow in carotid bifurcation as surrogate marker of exposure to disturbed shear. Journal of Biomechanics. 45 (14), 2398-2404 (2012).
- De Nisco, G., et al. The atheroprotective nature of helical flow in coronary arteries. Annals of Biomedical Engineering. 47 (2), 425-438 (2019).
- De Nisco, G., et al. The impact of helical flow on coronary atherosclerotic plaque development. Atherosclerosis. 300, 39-46 (2020).
- Eslami, P., et al. Effect of wall elasticity on hemodynamics and wall shear stress in patient-specific simulations in the coronary arteries. Journal of Biomechanical Engineering. 142 (2), (2019).
- Malvè, M., García, A., Ohayon, J., Martínez, M. A. Unsteady blood flow and mass transfer of a human left coronary artery bifurcation: FSI vs. CFD. International Communications in Heat and Mass Transfer. 39 (6), 745-751 (2012).
- Chiastra, C., Migliavacca, F., Martínez, M. &. #. 1. 9. 3. ;., Malvè, M. On the necessity of modelling fluid-structure interaction for stented coronary arteries. Journal of the Mechanical Behavior of Biomedical Materials. 34, 217-230 (2014).
- Carpenter, H., Gholipour, A., Ghayesh, M., Zander, A. C., Psaltis, P. In vivo based fluid-structure interaction biomechanics of the left anterior descending coronary artery. Journal of Biomechanical Engineering. 143 (8), (2021).
- Tang, D., et al. 3D MRI-based anisotropic FSI models with cyclic bending for human coronary atherosclerotic plaque mechanical analysis. Journal of Biomechanical Engineering. 131 (6), (2009).
- Gholipour, A., Ghayesh, M. H., Zander, A. C., Psaltis, P. J. In vivo based biomechanics of right and left coronary arteries. International Journal of Engineering Science. 154, (2020).
- Pei, X., Wu, B., Li, Z. -. Y. Fatigue crack propagation analysis of plaque rupture. Journal of Biomechanical Engineering. 135 (10), (2013).
- Wang, L., et al. IVUS-based FSI models for human coronary plaque progression study: components, correlation and predictive analysis. Annals of Biomedical Engineering. 43 (1), 107-121 (2015).
- Fan, R., et al. Human coronary plaque wall thickness correlated positively with flow shear stress and negatively with plaque wall stress: an IVUS-based fluid-structure interaction multi-patient study. BioMedical Engineering OnLine. 13 (1), 32 (2014).
- Migliori, S., et al. Application of an OCT-based 3D reconstruction framework to the hemodynamic assessment of an ulcerated coronary artery plaque. Medical Engineering & Physics. 78, 74-81 (2020).
- DIGITIZE07. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/14703-digitize07 (2021)
- interparc. MATLAB Central File Exchange Available from: https://www.mathworks.com/matlabcentral/fileexchange/34874-interparc (2021)
- Davies Justin, E., et al. Evidence of a dominant backward-propagating "suction" wave responsible for diastolic coronary filling in humans, attenuated in left ventricular hypertrophy. Circulation. 113 (14), 1768-1778 (2006).
- Campbell, I. C., et al. Effect of inlet velocity profiles on patient-specific computational fluid dynamics simulations of the carotid bifurcation. Journal of Biomechanical Engineering. 134 (5), (2012).
- Chang, W. -. T., et al. Ultrasound based assessment of coronary artery flow and coronary flow reserve using the pressure overload model in mice. Journal of Visualized Experiments: JoVE. (98), (2015).
- Holzapfel, G. A., Sommer, G., Gasser, C. T., Regitnig, P. Determination of layer-specific mechanical properties of human coronary arteries with nonatherosclerotic intimal thickening and related constitutive modeling. American Journal of Physiology-Heart and Circulatory Physiology. 289 (5), 2048-2058 (2005).
- Versluis, A., Bank, A. J., Douglas, W. H. Fatigue and plaque rupture in myocardial infarction. Journal of Biomechanics. 39 (2), 339-347 (2006).
- ANSYS Inc. ANSYS Academic Research Mechanical, Release 19.0, Mechanical APDL Theory Reference, Structures with Material Nonlinearities, Hyperelasticity, Mooney-Rivlin. ANSYS Inc. , (2019).
- Dong, J., Sun, Z., Inthavong, K., Tu, J. Fluid-structure interaction analysis of the left coronary artery with variable angulation. Computer Methods in Biomechanics and Biomedical Engineering. 18 (14), 1500-1508 (2015).
- Johnston, B. M., Johnston, P. R., Corney, S., Kilpatrick, D. Non-Newtonian blood flow in human right coronary arteries: Steady state simulations. Journal of Biomechanics. 37 (5), 709-720 (2004).
- Abbasian, M., et al. Effects of different non-Newtonian models on unsteady blood flow hemodynamics in patient-specific arterial models with in-vivo validation. Computer Methods and Programs in Biomedicine. 186, (2020).
- Soulis, J. V., et al. Non-Newtonian models for molecular viscosity and wall shear stress in a 3D reconstructed human left coronary artery. Medical Engineering & Physics. 30 (1), 9-19 (2008).
- Liu, B., Tang, D. Influence of non-Newtonian properties of blood on the wall shear stress in human atherosclerotic right coronary arteries. Molecular & Cellular Biomechanics: MCB. 8 (1), (2011).
- Morbiducci, U., Ponzini, R., Grigioni, M., Redaelli, A. Helical flow as fluid dynamic signature for atherogenesis risk in aortocoronary bypass. A numeric study. Journal of Biomechanics. 40 (3), 519-534 (2007).
- Morbiducci, U., et al. In vivo quantification of helical blood flow in human aorta by time-resolved three-dimensional cine phase contrast magnetic resonance imaging. Annals of Biomedical Engineering. 37 (3), (2009).
- Sughimoto, K., et al. Effects of arterial blood flow on walls of the abdominal aorta: Distributions of wall shear stress and oscillatory shear index determined by phase-contrast magnetic resonance imaging. Heart and Vessels. 31 (7), 1168-1175 (2016).
- Ku, D. N., Giddens, D. P., Zarins, C. K., Glagov, S. Pulsatile flow and atherosclerosis in the human carotid bifurcation. Positive correlation between plaque location and low oscillating shear stress. Arteriosclerosis. 5 (3), 293-302 (1985).
- Mazzi, V., et al. Wall shear stress topological skeleton analysis in cardiovascular flows: Methods and applications. Mathematics. 9 (7), 720 (2021).
- Moraes, M. C., Cardenas, D. A. C., Furuie, S. S. Automatic lumen segmentation in IVOCT images using binary morphological reconstruction. BioMedical Engineering OnLine. 12 (1), 78 (2013).
- Akyildiz, A. C., et al. The effects of plaque morphology and material properties on peak cap stress in human coronary arteries. Computer Methods in Biomechanics and Biomedical Engineering. 19 (7), 771-779 (2016).
- Tang, D., et al. Quantifying effects of plaque structure and material properties on stress distributions in human atherosclerotic plaques using 3D FSI models. Journal of Biomechanical Engineering. 127 (7), 1185-1194 (2005).
- Li, J., et al. Multimodality intravascular imaging of high-risk coronary plaque. JACC: Cardiovascular Imaging. , (2021).
- Bourantas Christos, V., et al. Utility of multimodality intravascular imaging and the local hemodynamic forces to predict atherosclerotic disease progression. JACC: Cardiovascular Imaging. 13 (4), 1021-1032 (2020).
- Liao, R., Luc, D., Sun, Y., Kirchberg, K. 3-D reconstruction of the coronary artery tree from multiple views of a rotational X-ray angiography. The International Journal of Cardiovascular Imaging. 26 (7), 733-749 (2010).
- Holzapfel, G. A., Gasser, T. C., Ogden, R. W. A new constitutive framework for arterial wall mechanics and a comparative study of material models. Journal of Elasticity and the Physical Science of Solids. 61 (1), 1-48 (2000).
- Gholipour, A., Ghayesh, M. H., Zander, A., Mahajan, R. Three-dimensional biomechanics of coronary arteries. International Journal of Engineering Science. 130, 93-114 (2018).
- Akyildiz, A. C., et al. Effects of intima stiffness and plaque morphology on peak cap stress. BioMedical Engineering OnLine. 10 (1), 25 (2011).
- Baranger, J., Mertens, L., Villemain, O. Blood flow imaging with ultrafast doppler. Journal of Visualized Experiments: JoVE. (164), (2020).
- Westra, J., et al. Diagnostic performance of in-procedure angiography-derived quantitative flow reserve compared to pressure-derived fractional flow feserve: The FAVOR II Europe-Japan study. Journal of the American Heart Association. 7 (14), (2018).
- Torii, R., et al. The impact of plaque type on strut embedment/protrusion and shear stress distribution in bioresorbable scaffold. European Heart Journal - Cardiovascular Imaging. 21 (4), 454-462 (2020).
- Peirlinck, M., et al. Precision medicine in human heart modeling. Biomechanics and Modeling in Mechanobiology. , 1-29 (2021).
- Franke, K. B., et al. Current state-of-play in spontaneous coronary artery dissection. Cardiovascular Diagnosis and Therapy. 9 (3), 281 (2019).
- Alber, M., et al. Integrating machine learning and multiscale modeling-perspectives, challenges, and opportunities in the biological, biomedical, and behavioral sciences. NPJ Digital Medicine. 2 (1), 115 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados