É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um ensaio celular baseado em repórter para monitorar a eficiência do splicing
Neste Artigo
Resumo
Este protocolo descreve um ensaio de repórter minigene para monitorar o impacto de mutações de 5'-splices no splicing e desenvolve snRNA supressor U1 para o resgate da inibição de emenda induzida por mutação. As construções de snRNA do repórter e supressor U1 são expressas em células HeLa, e o splicing é analisado por extensão de primer ou RT-PCR.
Resumo
Durante a expressão genética, o passo vital da emenda pré-mRNA envolve o reconhecimento preciso de locais de emenda e a montagem eficiente de complexos emendas omais para unir exons e remover introns antes da exportação citoplasmática do mRNA maduro. A eficiência do splicing pode ser alterada pela presença de mutações em locais de emenda, pela influência de fatores de emenda trans-ação ou pela atividade terapêutica. Aqui, descrevemos o protocolo para um ensaio celular que pode ser aplicado para monitorar a eficiência de emenda de qualquer exon dado. O ensaio usa um plasmídeo adaptável codificado 3-exon/2-intron minigene reporter, que pode ser expresso em células de mamíferos por transfecção transitória. Após a transfecção, o RNA celular total é isolado, e a eficiência do splicing de exon no mRNA repórter é determinada por extensão de primer ou reação em cadeia de transcriptase-polimerase reversa semi-quantitativa (RT-PCR). Descrevemos como o impacto das mutações associadas à doença de 5′ podem ser determinados introduzindo-as no repórter; e como a supressão dessas mutações pode ser alcançada por co-transfecção com u1 pequeno RNA nuclear (snRNA) construir carregando mutações compensatórias em sua região de 5′ que baseiam-se com os 5'-splices em junções exon-intron em pré-mRNAs. Assim, o repórter pode ser usado para o desenho de partículas U1 terapêuticas para melhorar o reconhecimento de locais de emenda mutantes de 5′. A inserção de sites regulatórios de ação cis, como emendar melhorador ou sequências silenciadores, no repórter também pode ser usada para examinar o papel do U1 snRNP na regulação mediada por um fator alternativo específico de emenda. Finalmente, as células expressas por repórteres podem ser incubadas com pequenas moléculas para determinar o efeito de potenciais terapêuticas na emenda pré-mRNA constitutiva ou em exons que carregam locais de emenda mutantes de 5′. No geral, o ensaio do repórter pode ser aplicado para monitorar a eficiência do splicing em uma variedade de condições para estudar mecanismos fundamentais de emenda e doenças associadas à emenda.
Introdução
O emenda pré-mRNA é uma etapa essencial de processamento que remove introns não codificantes e ligantes precisamente exons de codificação para formar mRNA maduro. Reconhecimento de sequências de consenso em junções exon-intron, referidas como local de 5'-emendas e 3'-splices, por componentes do maquinário de emenda inicia o processo de emenda. A pequena ribonucleoproteína nuclear U1 (snRNP) reconhece o local de 5'-splice por emparelhamento base do SnRNA U1 com o pré-mRNA1. Mutações geneticamente herdadas que alteram sequências de 5'emendas estão associadas a muitas doenças2,3. Prevê-se que a perda da base de snRNA U1 com os sites mutantes de 5'-emendas causa emenda aberrante, o que pode comprometer a tradução da transcrição afetada. Uma abordagem terapêutica potencial para corrigir os defeitos de emenda envolve a supressão de mutações por snRNA U1 modificado carregando alterações de nucleotídeos compensatórios em sua região de 5′que baseiam-se com o local de 5'-splice. Tais SnRNAs modificadas, também referidas como exon específicas U1 snRNAs, têm sido consideradas eficazes na reversão de defeitos de emenda, resultando em aumento da expressão proteica do mRNA4, 5,6,7,8 resgatados.
Aqui, descrevemos o ensaio de complementação do U1 snRNP, um ensaio de emenda celular baseado em repórter que permite a avaliação do efeito das mutações de 5's na emenda de um exon e também pode ser usado para o desenvolvimento de SnRNAs U1 modificadas para permitir o resgate da inclusão exon. Também fornecemos protocolos para monitoramento das transcrições de repórteres emendadas por extensão primer e RT-PCR, e para determinar a expressão de SNRNAs U1 modificadas por extensão primer e RT-qPCR.
Protocolo
1. Reagentes e tampões
NOTA: Toda a esterilização utilizando filtros de vácuo deve ser realizada com membrana de 0,2 μm de polietroéfone (PES) em um armário de biossegurança.
- Prepare a água sem RNase adicionando 1,0 mL de dietilpirto (DEPC) a 1,0 L de água desionizada, misture por pelo menos 1 hora à temperatura ambiente (RT), autoclave duas vezes e depois esfrie para RT antes de usar.
- Prepare o DMEM (Modified Eagle Medium, meio de águia modificada) de Dulbecco misturando um pacote de pó DMEM (13,4 g), 3,7 g de bicarbonato de sódio, 100 mL de soro bovino fetal (FBS), penicilina e estreptomicina a ~800 mL de água desionizada estéril. A concentração final de penicilina e estreptomicina no DMEM deve ser de 50 U/mL e 50 μg/mL, respectivamente. Ajuste o pH para 7,4 e, em seguida, compor o volume para 1,0 L com água deionizada estéril. Esterilize por filtragem e armazene a 4 °C.
- Prepare 10x salina tamponada de fosfato (10x PBS) adicionando 25,6 g de heptahydrate de hidrogênio dissódico (Na2HPO4· 7H2O), 2 g de fosfato de dihidrogênio de potássio (KH2PO4), 2 g de cloreto de potássio (CÍN) e 80 g de cloreto de sódio (NaCl) a 800 mL de água desionizada. Misture para dissolver e compor o volume até 1,0 L. Esterilize por filtragem e armazene a 4 °C.
- Prepare 0,5 M 0,5 M de diamina de etileno tetra-actic ácido (EDTA) dissolvendo 186,1 g de Na2•EDTA•2H2O em ~800 mL de água desionizada. Ajuste o pH para 8.0 e, em seguida, compor o volume para 1,0 L com água deionizada estéril. Esterilize por filtragem e armazene a 4 °C.
- Prepare a solução 1x trypsin-EDTA misturando 100 mL de trippsina de 10x (2,5%), 2 mL de 0,5 M EDTA e adicione 1x PBS até 1,0 L. Esterilize por filtragem e alíquota em tubos consíquicos de 50 mL. Armazene a 4 °C durante 1-2 semanas ou congele a -20 °C para uso a longo prazo.
- Prepare 2x corante de carregamento de DNA/RNA formamide misturando 14,4 mL de formamida e 0,6 mL de 0,5 M EDTA para um volume final de 15 mL. Adicione bromofenol azul e xileno cyanol em pó a uma concentração final de 0,02% e armazene a 4 °C.
NOTA: A formamida é tóxica e corrosiva. Leia as folhas de dados de segurança do material para obter recomendações adicionais de segurança. - Prepare 5x Tampão Tris/Borate/EDTA (5x TBE) misturando 54,0 g de base tris, 27,5 g de ácido bórico e 20 mL de 0,5 M EDTA em ~800 mL de água desionizada. Misture para dissolver e compor o volume até 1,0 L com água deionizada.
- Prepare a solução de eletroforese de gel de ureia-poliacrilamida (ureia-PAGE) misturando 200 mL de 5x TBE, 250 mL de 40% 19:1 bis/acrilamida e 450,5 g de ureia. Em seguida, adicione água deionizada até 1,0 L. Misture até que os ingredientes estejam completamente dissolvidos, depois esterilize por filtragem e armazene a 4 °C em uma garrafa de vidro âmbar.
NOTA: Bis/acrilamida é tóxico. Leia as fichas de segurança do material para procedimentos adicionais de segurança. - Prepare 10% persulfito de amônio (APS) dissolvendo 1 g de APS em 10 mL de água desionizada e armazene a 4 °C.
2. Cotransfecção de células HeLa com o repórter e plasmídeos de snRNA U1
NOTA: A transfecção das células hela devem ser realizadas em condições estéreis em um gabinete de segurança biológica. A superfície externa de todos os materiais deve ser pulverizada com 70% de etanol antes de ser introduzida no gabinete de segurança biológica.
- Mantenha as células Hela em DMEM em uma incubadora de 37 °C com 5% de CO2 , passando a cada 2-3 dias quando as células são cerca de 80-90% confluentes.
- Para a passagem de células HeLa, aspire o meio gasto e, em seguida, incubar células com 3 mL de 0,25% de trippsina contendo 1 mM EDTA a 37 °C por 3 min.
- Após a incubação, adicione 7 mL de DMEM fresco. Transfira a suspensão celular para um tubo de 10 mL, centrífuga a 1.000 x g por 5 min.
- Resuspend a pelota celular em 10 mL de DMEM fresco, e, em seguida, plaque as células em um novo prato de cultura tecidual em 20% de confluência.
- Para transfecções transitórias, conte as células hela com um escorregador hemótmetro limpo e prepare uma suspensão com uma densidade de 2,5 x 105 células/mL.
- Semente 1,0 mL de 2,5 x 105 células/mL suspensão de células Hela em cada poço de uma placa de 12 poços e incubar durante a noite a 37 °C.
- No dia seguinte, aspire o meio gasto e adicione 0,8 mL de DMEM fresco com soro.
- Prepare a solução I adicionando 0,2 μg de Plasmid repórter Dup51 ou Dup51p, 1,8 μg de pcDNA, pNS6U1 ou pNS6U1-5a plasmid, e 100 μL de meio de transfecção em um novo tubo de microcentrifuge de 1,5 mL.
- Prepare uma mistura mestre da Solução II para que todas as amostras sejam transfeccionadas adicionando 100 μL de meio de transfecção e 4,0 μL de reagente de transfecção por amostra.
- Prepare o mix de transfecção adicionando 100 μL de Solução II em cada tubo de microcentrifuuagem contendo a Solução I.
- Vórtice a transfecção se mistura para 15 s, centrífuga em uma microcentrifuagem de mesa a 3.000 x g por 10 s em RT, e depois incubar na RT por 5 minutos.
- Adicione todos os 200 μL da mistura de transfecção em um poço da placa de célula HeLa de 12 poços para obter um volume final de 1,0 mL por poço e incubar a placa a 37 °C por 48 horas.
- Após a incubação, extraia RNA das células HeLa transfectadas com solução comercialmente disponível de tiocianato e fenol.
NOTA: Este reagente contém fenol e este passo deve ser realizado em um capô de fumaça. Recomenda-se o uso de água tratada DEPC para a ressuspensão do RNA extraído.- Aspire o meio gasto e adicione 500 μL do reagente em cada poço. Incubar na RT por 5 min.
- Homogeneize-se se escoando para cima e para baixo. Em seguida, transfira a solução para um novo tubo de microcentrifusagem de 1,5 mL.
- Adicione 100 μL de clorofórmio e vórtice para 15 s.
- Centrifugar a 12.000 x g por 15 min no RT.
- Transfira 200 μL do RNA contendo, camada superior aquosa para um novo tubo de microcentrifuge de 1,5 mL.
- Adicione 2 μg de glicogênio e 200 μL de isopropanol a cada amostra de RNA. Misture invertendo os tubos.
- Colete o RNA precipitado por centrifugação a 12.000 x g por 10 min a 4 °C.
- Remova e descarte o supernatante sem perturbar a pelota de RNA.
- Lave a pelota duas vezes adicionando 1,0 mL de 70% de etanol, invertendo os tubos e centrifugando conforme descrito no Passo 2.13,7.
- Aere a pelota por ~10-20 min na RT e resuspenque o RNA em 10-20 μL de água sem RNase.
- Determine a concentração de RNA medindo a absorvância a 260 nm, conforme descrito por Desjardins e Conklin9.
- Proceda com extensão de primer ou armazene amostras de RNA em -20 °C. O RNA isolado pode ser armazenado a -20 °C durante 6-12 meses.
3. Rotulagem 32P de oligonucleotídeos
NOTA: As etapas que envolvem o uso de oligonucleotídeos 32P-ATP e 32P devem ser realizadas atrás de um escudo acrílico por indivíduos treinados com aprovação de entidades institucionais autorizadas. O protocolo descrito abaixo pode ser usado para rotulagem de oligonucleotídeos, Dup3r e U17-26-R, e marcadores para ureia-PAGE. Recomenda-se o uso de água tratada DEPC para a ressuspensão de oligonucleotídeos e contas de exclusão de tamanho.
- Para um tubo de microcentrifuge de 1,5 mL, adicione oligonucleotídeo, quinase de polinucleotídeo T4 (T4 PNK), tampão T4 PNK e 32P-ATP conforme descrito na Tabela 1. Adicionar 32P-ATP por último à mistura; isso é importante.
NOTA: Para a adição de soluções radioativas, recomenda-se o uso de dicas de filtro. - Incubar em um banho de água a 37 °C por 30 min.
- Enquanto as reações de rotulagem estão incubando, resuspenque as contas de exclusão de tamanho com um peso molecular de 25 kDa cortado por vórtice suavemente para ~10 s.
NOTA: As contas de exclusão de tamanho devem ser preparadas de acordo com as instruções do fabricante e armazenadas como uma suspensão de 50% em 25% de etanol a 4 °C. - Prepare as colunas transferindo 600 μL das contas resuspended para uma mini coluna descartável colocada em um tubo de coleta de 1,5 mL e devolvendo o estoque de contas para 4 °C.
- Centrifugar a 2.000 x g por 1 min em RT e descartar o fluxo através.
- Lave as contas adicionando 300 μL de água sem RNase à coluna.
- Repita os passos 3.5. e 3,6. duas vezes e transfira a mini-coluna para um novo tubo de centrífuga de 1,5 mL.
- Adicione a mistura de reação quinase à coluna de contas de exclusão de tamanho e centrífuga a 5000 x g por 1 min no RT.
- Colete e salve o fluxo através, que tem o oligonucleotídeo 32P rotulado, e descarte todas as pontas e tubos em uma caixa de resíduos acrílicos.
- Adicione 20 μL de água sem RNase para diluir oligonucleotídeo rotulado em 32P a uma concentração final de 2,5 μM.
NOTA: Diluir os marcadores rotulados conforme necessário para o carregamento em géis de ureia-PAGE. - Armazene o oligonucleotídeo rotulado em uma caixa de microtubo acrílico a -20 °C ou prossiga com a análise de extensão do primer.
4. Análise das transcrições de repórteres emendadas por extensão de primer
NOTA: Recomenda-se limpar superfícies e equipamentos com um reagente de inativação RNase antes de usar.
- Adicione 2,0 μg de RNA extraído das células Hela em tubos separados de microcentrífugo de 200 μL e adicione água livre de RNase para compensar o volume a 6,55 μL.
- Prepare o Master Mix I com os 32P-Dup3r diluídos e dNTPs, conforme mostrado na Tabela 2 e adicione 0,9 μL da mistura a cada tubo PCR contendo amostras de RNA.
- Incubar os tubos, primeiro a 65 °C por 5 min e depois no gelo por 1 min.
- Prepare o Master Mix II com 5x First Strand Buffer, dithiothreitol (DTT), inibidor de RNase e transcriptase reversa, como mostrado na Tabela 2.
- Adicione 2,55 μL da mistura a cada tubo contendo RNA e Master Mix 1; o volume total da reação deve ser de 10 μL. Mantenha os tubos em RT por 10 minutos.
- Transfira os tubos para um banho seco ou um ciclofatóte e incubar, primeiro a 50 °C por 60 min e depois a 70 °C por 15 min.
- Após a incubação, adicione 10 μL de 2x de corante de carregamento de RNA formamida a cada amostra e armazene em uma caixa de acrílico a -20 °C ou proceda com a separação de fragmentos por ureia-PAGE usando um gel de 14 cm de comprimento e visualização de imagem de gel conforme descrito abaixo na Etapa 8.
- Realize a varredura densitométrica da imagem em gel com um software de análise de imagem e use as intensidades de banda de produtos incluídos e ignorados para calcular a porcentagem de inclusão do exon 2, conforme mostrado abaixo.

5. Análise das transcrições de repórteres emendadas por RT-PCR fluorescente
NOTA: A análise RT-PCR descrita abaixo utiliza hexamers aleatórios para síntese de CDNA e uma combinação de oligonucleotídeos Dup3r não rotulados e Cy5 para amplificação pcr dos produtos emendados.
- Para a síntese de CDNA, adicione 2,0 μg de RNA extraído das células Hela transfectadas em tubos separados de microcentrifuuge de 200 μL e adicione água livre de RNase para compensar o volume a 11,0 μL.
- Prepare o Master Mix I, contendo hexamers aleatórios e dNTP como mostrado na Tabela 3 e adicione 2,0 μL da mistura a cada amostra. Incubar, primeiro a 65 °C por 5 min e depois no gelo por 1 min.
- Prepare o Master Mix II, contendo o Primeiro Buffer de Fio, inibidor de RNase, DTT e transcriptase reversa, conforme mostrado na Tabela 3 e adicione 7,0 μL da mistura a cada tubo contendo RNA e Master Mix I.
- Mantenha os tubos em RT por 10 minutos e, em seguida, incubar a 50 °C por 60 min e 70 °C por 15 min.
NOTA: As reações completas do CDNA podem ser armazenadas a -20 °C. - Para PCR, transfira 1,0 μL (100 ng/μL) de cada amostra de cDNA para novos tubos PCR.
- Prepare uma mistura mestre composta por Dup8f, Cy5-Dup3r, dNTPs, tampão Taq, polimerase Taq e água conforme descrito na Tabela 4 e adicione 11,5 μL da mistura a cada tubo contendo cDNA.
- Execute o PCR utilizando um cicloviário térmico com uma etapa inicial de desnaturação a 94 °C por 3 min; seguido por 20 ciclos de desnaturação (94 °C para 30 s), ressarnamento (65 °C para 30 s) e extensão (72 °C para 15 s), e uma etapa de término a 72 °C por 5 min.
- Adicione 12,5 μL de 2x de corante de carregamento de DNA formamida a cada tubo e aqueça a 95 °C por 5 min.
- Armazene a reação do PCR a -20 °C ou proceda com ureia-PAGE conforme descrito abaixo na Etapa 8.1-8.4.
- Após a eletroforese, remova as placas de vidro do aparelho de eletroforese e escaneie usando um imager de fluorescência para visualizar o gel.
- Realize a varredura densitométrica da imagem do gel e use a intensidade da banda dos produtos incluídos e os produtos ignorados para calcular a porcentagem de inclusão do exon 2, conforme descrito na Etapa 4.8.
6. Análise da variante U1 expressão snRNA por extensão de primer
- Adicione 2,0 μg de RNA extraído das células Hela em tubos separados de microcentrífugo de 200 μL e adicione água livre de RNase para compensar o volume a 4.325 μL e, em seguida, adicione dATP, como mostrado na Tabela 5.
- Adicione 10.000 CPM do oligonucleotídeo 32P-U17-26-R a cada tubo.
NOTA: Para preparar uma solução de 10.000 cpm/μL de 32P-U17-26-R (a partir do passo 3), diluir o oligonucleotídeo rotulado (diluição 1:20), determinar cpm em 1,0 μL usando um contador de cintilação, e diluir ainda mais com água deionizada para preparar uma solução de 10.000 cpm/μL em um novo tubo de microcentrifuge de 1,5 mL. - Incubar a 65 °C por 5 min, e depois no gelo por 1 min.
- Prepare uma mistura mestre com 5x First Strand Buffer, inibidor de RNase, DTT e transcriptase reversa, como mostrado na Tabela 5 e adicione 1,8 μL da mistura a cada amostra.
- Incubar, primeiro na RT por 10 min e depois a 42 °C por 10 min.
- Após a incubação, adicione 10 μL de 2x de corante de carregamento de RNA formamida em cada amostra e armazene em uma caixa de acrílico a -20 °C ou proceda com a separação de fragmentos por ureia-PAGE usando um gel de 38 cm de comprimento (ver Passo 8).
7. Análise da variante U1 expressão snRNA por RT-qPCR
- Diluir o estoque de cDNA preparado como descrito acima nas Etapas 5.1 - 5.4 para uma concentração de 0,2 ng/μL.
- Pipeta 5,0 μL de cDNA diluída em poços individuais de uma placa qPCR de 96 poços em triplicado. Adicione água deionizada em vez de cDNA para controle sem modelo (NTC).
- Prepare duas misturas de primer separadas que consistem nos primers dianteiros e invertidos para snRNAs U1 e U2, e água como mostrado na Tabela 6.
NOTA: As sequências para primers específicos de SnRNA U1 e U2 são fornecidas na Tabela 7. - Adicione 5,0 μL da mistura de primer U1 e U2 snRNA à amostra e aos poços NTC.
- Adicione 10,0 μL de mix pcr em tempo real a cada poço.
- Sele as placas com uma película óptica, depois centrífuga a 1.000 x g por 2 min no RT para coletar as reações ao fundo dos poços.
- Realize qPCR com uma etapa inicial de desnaturação a 95 °C por 10 min, seguido por 40 ciclos de um protocolo de 2 etapas consistindo em denaturação (95 °C para 15 s) e ressarem/extensão (62 °C para 60 s) enquanto coletam os valores do ciclo de quantificação limiar (Cq) de amplicons-alvo.
- Termine a reação qPCR verificando um único pico na curva de dissociação para reações de snRNA U1 e U2.
- A partir dos valores Cq, calcule delta Cq (ΔCq) para U1 e U2 snRNAs em comparação com o controle pcDNA.
- Determine a variante U1 expressão de snRNA como quantidade relativa (RQ) de U1 em comparação com u2 usando o valor ΔΔCq como mostrado abaixo para todas as amostras.

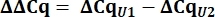
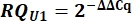
8. Configuração e execução de géis Urea-PAGE
NOTA: A montagem das placas de vidro e o aparelho de funcionamento do gel devem ser executados de acordo com as instruções do fabricante. O fundição do gel de 10% de ureia-PAGE pode ser realizado de acordo com um protocolo descrito anteriormente por Summer et al.10. As etapas que envolvem a preparação de marcadores e amostras, e de corrida e visualização de géis são descritas abaixo. Opcionalmente, para evitar que o gel grude em placas de vidro, a superfície interna pode ser revestida com solução de silicone adicionando 1 mL da solução sobre a superfície e se espalhando uniformemente por toda a superfície com tecido. Uma vez secas, as placas devem ser lavadas com água deionizada e secas novamente.
ATENÇÃO: A crilamida não despolumerizada é neurotóxica e deve ser tratada com proteções recomendadas na ficha técnica de segurança do material.
- Prepare as amostras de extensão e marcadores do primer aquecendo a 95 °C por 5 min e, em seguida, centrifugando em uma microcentrifuagem de mesa a 3.000 x g para 5 s em RT.
- Antes de carregar os marcadores e amostras, limpe os poços com 1x tampão TBE para remover a ureia assentada.
- Carregue 10 μL/amostra/bem e execute o gel a 300-500V por 2-3 horas ou até que o cianol de xileno chegue ao fundo.
NOTA: Cerca de 1.000 cpm do marcador 32P pode ser carregado. - Após a eletroforese, remova as placas de vidro do aparelho de eletroforese.
- Separe cuidadosamente as duas placas para que o gel fique liso em qualquer superfície de vidro e transfira o gel para um papel filtro e cubra-o com plástico.
- A vácuo seque o gel no papel do filtro a 80 °C por 30 minutos usando uma secadora de gel.
- Coloque o gel seco em um de imagem fosfor e mantenha no RT durante a noite.
NOTA: A tela do fósforo deve ser apagada usando uma caixa de luz antes de ser usada. - Para visualizar a imagem em gel, remova a tela e digitalize usando um imager de fósforo.
Resultados
O repórter dup51, um minigene de três exon-dois intron, foi derivado do gene humano β-globina e foi descrito anteriormente (Figura 1A)11,12 . Criamos um repórter mutante, Dup51p, introduzindo mutações associadas à síndrome de Usher de 5'-splices que ocorrem no exon 3 do gene protocadherin 15 (PCDH15). A sequência do local de 5'-splice na junção exon 2-intron 2 foi alterada de CAG/GUUGGUAUC ...
Discussão
O ensaio pode ser adaptado para análise de emendas em linhas celulares diferentes de HeLa, no entanto, fatores que afetam a eficiência da transfecção, como a confluência celular e a quantidade de DNA podem precisar ser otimizados. A proporção de construção repórter para U1 é outro parâmetro crítico que pode precisar ser determinado dependendo dos níveis de expressão observados em outros tipos de células. A qualidade do RNA extraído é fundamental para a análise de emendas; portanto, o uso de água sem R...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado por fundos para s.S. dos Institutos Nacionais de Saúde (R21CA170786 e R01GM127464) e para a American Cancer Society (o Institutional Research Grant 74-001-34-IRG) e para S.S. e W.M. do Valley Research Partnership Program (P1-4009 e VRP77). O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais dos Institutos Nacionais de Saúde.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagent Grade Deionized Water | ThermoFisher Scientific | 23-751628 | |
| Diethyl pyrocarbonate (DEPC) | Sigma-Aldrich | D5758-25ML | |
| Dulbecco's Modified Eagle Medium (DMEM) powder packet | Gibco | 12100-046 | |
| Sodium Bicarbonate | ThermoFisher Scientific | S233-500 | |
| Fetal Bovine Serum (FBS), Australian Source, Heat Inactivated | Omega Scientific | FB-22 | |
| Penicillin-Streptomycin (P/S) | Sigma-Aldrich | P4458-100ML | |
| Sodium Hydroxide, Standard Solution 1.0N | Sigma-Aldrich | S2567-16A | |
| Hydrochloric Acid, Certified ACS Plus, 36.5 to 38.0% | ThermoFisher Scientific | A144-500 | |
| Disposable PES Bottle Top Filters | ThermoFisher Scientific | FB12566510 | |
| EDTA Disodium Salt Dihydrate | Amresco | 0105-2.5KG | |
| 2.5% Trypsin (10x), no phenol red | ThermoFisher Scientific | 15090046 | |
| Sodium Chloride | Fisher Bioreagent | BP358-212 | |
| Potassium Chloride | Fisher Bioreagent | BP366-1 | |
| Disodium Hydrogen Phosphate Heptahydrate | Fisher Bioreagent | BP332-1 | |
| Potassium Dihydrogen Phosphate | Fisher Bioreagent | BP362-1 | |
| Transfection medium - Opti-MEM™ I Reduced Serum Medium, no phenol red | ThermoFisher Scientific | 11058021 | |
| Transfection Reagent - Lipofectamine™ 2000 | ThermoFisher Scientific | 13778150 | |
| TRIzol™ Reagent | ThermoFisher Scientific | 15596018 | |
| Chloroform (Approx. 0.75% Ethanol as Preservative/Molecular Biology) | ThermoFisher Scientific | BP1145-1 | |
| Ethanol, Absolute (200 Proof), Molecular Biology Grade, Fisher BioReagents | ThermoFisher Scientific | BP2818-4 | |
| Isopropanol, Molecular Biology Grade, Fisher BioReagents | ThermoFisher Scientific | BP2618-212 | |
| Glycogen (5 mg/ml) | ThermoFisher Scientific | AM9510 | |
| Direct-zol RNA Miniprep Kit | Zymo Research | R2052 | |
| ATP, [γ-32P]- 6000Ci/mmol 150mCi/ml Lead, 1 mCi | PerkinElmer | NEG035C001MC | |
| T4 Polynucleotide Kinase | New England Biolabs | M0201L | |
| Size exclusion beands - Sephadex® G-25 | Sigma-Aldrich | G2580-10G | |
| Size exclusion mini columns | USA Scientific | 1415-0600 | |
| pBR322 DNA-MspI Digest | New England Biolabs | N3032S | |
| Low Molecular Weight Marker, 10-100 nt | Affymetrix | 76410 100 UL | |
| Rnase inactivating reagents - RNaseZAP™ | Sigma-Aldrich | R2020-250ML | |
| dNTP Mix (10 mM ea) | ThermoFisher Scientific | 18427013 | |
| RNaseOUT™ Recombinant Ribonuclease Inhibitor | ThermoFisher Scientific | 10777019 | |
| Reverse Transcriptase - M-MLV Reverse Transcriptase | ThermoFisher Scientific | 28025013 | used for primer extension |
| Taq DNA Polymerase | ThermoFisher Scientific | 10342020 | |
| Random Hexamers (50 µM) | ThermoFisher Scientific | N8080127 | |
| Real time PCR mix - SYBR™ Select Master Mix | ThermoFisher Scientific | 4472903 | |
| SuperScript™ III Reverse Transcriptase | ThermoFisher Scientific | 18080093 | used for cDNA preparation |
| Dithiothreitol (DTT) | ThermoFisher Scientific | 18080093 | |
| 5X First-Strand Buffer | ThermoFisher Scientific | 18080093 | |
| Formamide (≥99.5%) | ThermoFisher Scientific | BP228-100 | Review Material Safety Data Sheets |
| Bromophenol Blue sodium salt | Sigma-Aldrich | 114405-5G | |
| Xylene Cyanol FF | Sigma-Aldrich | 2650-17-1 | |
| Tris Base (White Crystals or Crystalline Powder/Molecular Biology) | ThermoFisher Scientific | BP152-5 | |
| Boric Acid (Crystalline/Electrophoresis) | ThermoFisher Scientific | BP168-500 | |
| Acrylamide: Bis-Acrylamide 19:1 (40% Solution/Electrophoresis) | ThermoFisher Scientific | BP1406-1 | Review Material Safety Data Sheets |
| Urea (Colorless-to-White Crystals or Crystalline Powder/Mol. Biol.) | ThermoFisher Scientific | BP169-212 | |
| Ammonium peroxodisulphate (APS) ≥98%, Pro-Pure, Proteomics Grade | VWR | M133-25G | |
| Sigmacote | Sigma-Aldrich | SL2-100ML | |
| N,N,N',N'-Tetramethylethylenediamine (TEMED) ≥99%, Ultrapure | VWR | 0761-25ML | Review Material Safety Data Sheets |
| Adjustable Slab Gel Systems, Expedeon | VWR | ASG-400 | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 14.5cm | VWR | NGP-125NR | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 22.0cm | VWR | NGP-200NR | |
| Vertical Gel Wrap™ Glass Plate Sets, 16.5 x 38.7cm | VWR | NGP-400NR | |
| GE Storage Phosphor Screens | Sigma-Aldrich | GE28-9564 | |
| Typhoon™ FLA 7000 Biomolecular Imager | GE Healthcare | 28-9610-73 AB | |
| Beckman Coulter LS6500 Liquid Scintillation Counter | GMI | 8043-30-1194 | |
| C1000 Touch Thermal Cycler | ThermoFisher Scientific | ||
| QuantStudio 6 Flex Real-Time PCR Systems | ThermoFisher Scientific |
Referências
- Zhuang, Y., Weiner, A. M. A compensatory base change in U1 snRNA suppresses a 5' splice site mutation. Cell. 46 (6), 827-835 (1986).
- Scotti, M. M., Swanson, M. S. RNA mis-splicing in disease. Nature Review Genetics. 17 (1), 19-32 (2016).
- Ward, A. J., Cooper, T. A. The pathobiology of splicing. Journal of Pathology. 220 (2), 152-163 (2010).
- Scalet, D., et al. Disease-causing variants of the conserved +2T of 5' splice sites can be rescued by engineered U1snRNAs. Human Mutatation. 40 (1), 48-52 (2019).
- Yamazaki, N., et al. Use of modified U1 small nuclear RNA for rescue from exon 7 skipping caused by 5'-splice site mutation of human cathepsin A gene. Gene. 677, 41-48 (2018).
- Yanaizu, M., Sakai, K., Tosaki, Y., Kino, Y., Satoh, J. I. Small nuclear RNA-mediated modulation of splicing reveals a therapeutic strategy for a TREM2 mutation and its post-transcriptional regulation. Science Reports. 8 (1), 6937 (2018).
- Balestra, D., et al. Splicing mutations impairing CDKL5 expression and activity can be efficiently rescued by U1snRNA-based therapy. International Journal of Molecular Sciences. 20 (17), 20174130 (2019).
- Donadon, I., et al. Exon-specific U1 snRNAs improve ELP1 exon 20 definition and rescue ELP1 protein expression in a familial dysautonomia mouse model. Human Molecular Genetics. 27 (14), 2466-2476 (2018).
- Desjardins, P., Conklin, D. NanoDrop microvolume quantitation of nucleic acids. Journal of Visualized Experiments. (45), e2565 (2010).
- Summer, H., Gramer, R., Droge, P. Denaturing urea polyacrylamide gel electrophoresis (Urea PAGE). Journal of Visualized Experiments. (32), e1485 (2009).
- Dominski, Z., Kole, R. Selection of splice sites in pre-mRNAs with short internal exons. Molecular Cell Biology. 11 (12), 6075-6083 (1991).
- Amir-Ahmady, B., Boutz, P. L., Markovtsov, V., Phillips, M. L., Black, D. L. Exon repression by polypyrimidine tract binding protein. RNA. 11 (5), 699-716 (2005).
- Le Guedard-Mereuze, S., et al. Sequence contexts that determine the pathogenicity of base substitutions at position +3 of donor splice-sites. Human Mutation. 30 (9), 1329-1339 (2009).
- Sharma, S., Wongpalee, S. P., Vashisht, A., Wohlschlegel, J. A., Black, D. L. Stem-loop 4 of U1 snRNA is essential for splicing and interacts with the U2 snRNP-specific SF3A1 protein during spliceosome assembly. Genes and Development. 28 (22), 2518-2531 (2014).
- Steitz, J. A., et al. . Functions of the abundant U-snRNPs. Structure and function of major and minor small nuclear ribonucleoprotein particles. , 115-154 (1988).
- Fortes, P., et al. Inhibiting expression of specific genes in mammalian cells with 5' end-mutated U1 small nuclear RNAs targeted to terminal exons of pre-mRNA. Proceedings of the National Academy of Sciences U.S.A. 100 (14), 8264-8269 (2003).
- Roca, X., et al. Widespread recognition of 5' splice sites by noncanonical base-pairing to U1 snRNA involving bulged nucleotides. Genes and Development. 26 (10), 1098-1109 (2012).
- Roca, X., Krainer, A. R. Recognition of atypical 5' splice sites by shifted base-pairing to U1 snRNA. Nature Structural Molecular Biology. 16 (2), 176-182 (2009).
- Taladriz-Sender, A., Campbell, E., Burley, G. A. Splice-switching small molecules: A new therapeutic approach to modulate gene expression. Methods. 167, 134-142 (2019).
- Hamid, F. M., Makeyev, E. V. A mechanism underlying position-specific regulation of alternative splicing. Nucleic Acids Research. 45 (21), 12455-12468 (2017).
- Martelly, W., et al. Synergistic roles for human U1 snRNA stem-loops in pre-mRNA splicing. RNA Biology. , 1-18 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados