Method Article
Produção em Escala Livre de Células e Adição de Adjuvante a uma Proteína Recombinante da Membrana Externa Principal de Chlamydia muridarum para o Desenvolvimento de Vacinas
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve o uso de kits comerciais de expressão de proteínas livres de células para produzir proteínas de membrana suportadas em nanodiscos que podem ser usadas como antígenos em vacinas de subunidades.
Resumo
As vacinas de subunidades oferecem vantagens sobre as vacinas inativadas ou atenuadas derivadas de células inteiras mais tradicionais em segurança, estabilidade e fabricação padrão. Para alcançar uma vacina de subunidade baseada em proteína eficaz, o antígeno proteico muitas vezes precisa adotar uma conformação nativa. Isso é particularmente importante para antígenos de superfície de patógenos que são proteínas ligadas à membrana. Métodos livres de células têm sido usados com sucesso para produzir proteínas de membrana funcionais corretamente dobradas através da co-tradução de partículas de nanolipoproteínas (NLPs), comumente conhecidas como nanodiscos.
Essa estratégia pode ser usada para produzir vacinas de subunidades constituídas por proteínas de membrana em um ambiente ligado a lipídios. No entanto, a produção de proteína livre de células é frequentemente limitada a pequena escala (<1 mL). A quantidade de proteína produzida em pequenas séries de produção é geralmente suficiente para estudos bioquímicos e biofísicos. No entanto, o processo livre de células precisa ser ampliado, otimizado e cuidadosamente testado para obter proteína suficiente para estudos de vacinas em modelos animais. Outros processos envolvidos na produção de vacinas, como purificação, adição de adjuvantes e liofilização, precisam ser otimizados em paralelo. Este artigo relata o desenvolvimento de um protocolo ampliado para expressar, purificar e formular uma vacina de subunidade proteica ligada à membrana.
Reações livres de células em escala requerem otimização das concentrações e proporções de plasmídios ao usar múltiplos vetores de expressão plasmidial, seleção lipídica e adição de adjuvantes para produção de alto nível de partículas de nanolipoproteínas formuladas. O método é demonstrado aqui com a expressão de uma proteína de membrana externa principal (MOMP) da clamídia, mas pode ser amplamente aplicado a outros antígenos de proteínas de membrana. A efetividade do antígeno pode ser avaliada in vivo por meio de estudos de imunização para medir a produção de anticorpos, como demonstrado aqui.
Introdução
Lisados procarióticos ou eucarióticos para expressão livre de células de proteínas estão prontamente disponíveis como produtos comerciais para sintetizar proteínas de interesse (para uma revisão completa, ver 1). Esses sistemas de expressão estão disponíveis em várias escalas e utilizam lisados de vários organismos, incluindo E. coli, plantas de tabaco e culturas de mamíferos. Os lisados livres de células oferecem múltiplos benefícios em relação às abordagens tradicionais de produção de proteínas recombinantes, incluindo facilidade de uso e produção robusta e rápida de proteínas. Embora essas abordagens sejam usadas principalmente para produzir proteínas solúveis, este grupo foi pioneiro em uma abordagem para seu uso para expressar proteínas de membrana.
Esta nova abordagem faz pequenas modificações nos sistemas de expressão livre de células existentes, incluindo DNA que codifica dois produtos proteicos para expressão, uma apolipoproteína e a proteína de membrana de interesse. A apolipoproteína expressa (derivados de ApoA1 ou ApoE4) interage com lipídios adicionados ao lisado livre de células para montar espontaneamente (~20 nm) NLPs. Quando co-traduzido com uma proteína de membrana de interesse, a PNL e a proteína de membrana formam um complexo de nanopartículas solúveis no qual a proteína de membrana é embutida dentro da bicamada lipídica de PNL. Assim, a proteína de membrana é mais acessível para aplicações a jusante, pois está contida em partículas solúveis e discretas. Esta abordagem pode produzir complexos proteicos oligoméricos funcionais dentro da bicamada2 da PNL e pode produzir o componente antigênico de uma vacina de subunidade, que é posteriormente misturada com adjuvantes lipofílicos para formar uma vacina de nanopartículas com antígeno co-localizado e adjuvante adequado para avaliação in vivo .
Este método atual é modificado a partir de um protocolo publicado anteriormente3. As principais modificações são focadas no aumento de escala da reação livre de células e subsequente purificação do complexo proteína-PNL. Uma modificação adicional inclui a adição de um polímero anfifílico conhecido como telodendríaco, que é primeiramente misturado com os lipídios antes da adição à reação livre de células. A co-tradução dos plasmídeos na presença do telodendrímero e dos lipídios produz um telodendrômico PNL (tNLP). A adição do telodendrímico também ajuda a modular o tamanho e a monodispersidade das nanopartículas de tNLPresultantes4. Este protocolo é especificamente otimizado para estudos de vacinas em larga escala para produzir uma proteína antigênica de subunidade ligada à membrana, a clamídia MOMP 5,6. O método produz MOMP recombinante associado a tNLP para formar um complexo MOMP-tNLP altamente solúvel que retém a oligomerização do MOMP. Uma produção em escala típica de 3 mL produz >1,5 mg de MOMP purificado. O MOMP-tNLP produzido sem células é passível de adição rápida de adjuvante para testes de imunogenicidade in vivo.
Protocolo
Todos os estudos em animais foram realizados na Universidade da Califórnia, Irvine, em instalações asseguradas pelo Serviço de Saúde Pública (PHS), de acordo com as diretrizes estabelecidas pelo Comitê Institucional de Cuidados e Uso de Animais.
1. Preparação de vidraria
NOTA: Todos os materiais utilizados na produção de formulações de grau vacinal para animais são livres de endotoxinas.
- Para destruir a endotoxina contaminante, leve ao forno os utensílios de vidro limpos que manterão os tampões em um forno a 180 °C por 4 h.
2. Preparação do tampão
- Preparar 250 mL dos tampões de purificação de afinidade de Ni listados na Tabela 1. Conservá-los a 4 °C por até 6 meses.
3. Preparação da reação
- Pesar 20 mg de 1,2-dimiristoil-sn-glicero-3-fosfocolina (DMPC) em um tubo de centrífuga de 1,5 mL livre de endotoxinas. Dissolva em 1 mL de água livre de endotoxinas, sonda-sonicate pelo menos quatro vezes a 6 A por 1 min, com 1 min de pausas entre elas, até ficar claro. Remova qualquer metal contaminante da sonda por centrifugação a 13.000 × g por 2 min a 22 °C e, em seguida, transfira o lipídio solubilizado para um novo tubo livre de endotoxinas de 1,5 mL.
- Pesar 1 mg de telodendrímico PEG5k-CA8 em um tubo livre de endotoxinas de 1,5 mL. Dissolver em água livre de endotoxinas até uma concentração de 20 mg/mL. Vórtice até dissolver completamente e diluir a 2 mg/ml.
- Em um novo tubo livre de endotoxinas, combinar 210 μL de solução de DMPC 20 mg/mL com 210 μL de solução de telodendrímico 2 mg/mL.
4. Produção livre de células de MOMP-tNLPs para formulações de vacinas de subunidades
- Prepare MOMP-tNLPs usando métodos livres de células modificados de um protocolo5 publicado anteriormente.
- Duas horas antes de configurar a reação livre de células, abra o kit de expressão de proteína livre de células procarióticas e descongele um dos tampões de reconstituição. Depois de descongelado, adicione um comprimido de coquetel inibidor de protease livre de EDTA e deixe dissolver completamente.
- Siga este protocolo usando um kit projetado para executar reações de 5 x 1 mL.
NOTA: Uma produção em escala típica é de 3 x 1 mL.- Para cada 1 ml de reação, adicionar 525 μL de tampão de reconstituição ao frasco de lisado de E. coli e enrolar suavemente para dissolver. Adicione 250 μL de tampão de reconstituição ao frasco contendo aditivos de reação (por exemplo, ATP, GTP) e enrole suavemente para dissolver.
- Adicione 8,1 mL de tampão de reconstituição ao frasco de alimentação de reação, reencape com uma rolha de borracha (tome cuidado para não tocar no interior da rolha de borracha) e inverta/enrole suavemente para dissolver.
- Adicione 3 mL de tampão de reconstituição ao frasco de mistura de aminoácidos, reencape com uma rolha de borracha e inverta/enrole suavemente para dissolver.
OBS: Tome cuidado para não tocar no interior da rolha de borracha, pois isso pode levar à contaminação. - Adicione 1,8 ml de tampão de reconstituição ao frasco de metionina, enrole suavemente para dissolver e, em seguida, guarde no gelo até à utilização.
- Prepare a solução de reação.
- Ao frasco de lisado de E. coli , adicionar 225 μL de mistura de reação reconstituída, 270 μL de mistura de aminoácidos reconstituída sem metionina e 30 μL de metionina reconstituída. Além disso, adicionar 400 μL da mistura DMPC/telodendrímero, 15 μg de plasmídeo MOMP e 0,6 μg de plasmídeo Δ49ApoA1. Rolar/agitar suavemente para misturar.
NOTA: Certifique-se de que ambos os plasmídeos são construídos a partir da mesma espinha dorsal do plasmídeo. Não vórtice. - Tomar 20 μL da solução total e separá-la num tubo de 1,5 ml para a reacção de controlo que exprime GFP (ver abaixo).
- Ao frasco de lisado de E. coli , adicionar 225 μL de mistura de reação reconstituída, 270 μL de mistura de aminoácidos reconstituída sem metionina e 30 μL de metionina reconstituída. Além disso, adicionar 400 μL da mistura DMPC/telodendrímero, 15 μg de plasmídeo MOMP e 0,6 μg de plasmídeo Δ49ApoA1. Rolar/agitar suavemente para misturar.
- Prepare a solução de alimentação. Ao frasco de mistura de ração, adicionar 2,65 mL de mistura de aminoácidos reconstituídos sem metionina e 300 μL de metionina reconstituída. Rolar/agitar suavemente para dissolver.
NOTA: Neste momento, o buffer de reconstituição não utilizado e a metionina podem ser devolvidos ao congelador para armazenamento. - Transfira 1 mL da solução de reação para a câmara de reação interna fornecida no kit de reação livre de células e sele quando preenchido. Transferir 10 mL da solução de alimentação para a câmara externa do recipiente de reação e selar.
NOTA: Não encha demais as câmaras! A presença de bolhas de ar no topo da câmara de reação interna e da câmara de alimentação interna afetará negativamente a reação. Qualquer solução de reação restante pode ser colocada em um tubo de 1,5 mL e deixada misturar ao lado do vaso principal. - Adicionar 0,5 μL do plasmídeo de controle da GFP (0,5 mg/mL) à mistura de reação de 20 μL previamente aliquotada.
NOTA: Muitos kits são fornecidos com um plasmídeo de controle para fins de controle de qualidade. A maioria dos plasmídeos que expressam GFP com um promotor T7 e o sítio de ligação do ribossomo E.coli (RBS) também pode ser usada como plasmídeo de controle. - Coloque a reação em um agitador a 300 rpm, 30 °C por até 18 h. Para verificar se a reação foi bem sucedida, use uma fonte de luz UV para verificar se há fluorescência devido à síntese da GFP controle (Figura 1A) após apenas 15 min de incubação.
NOTA: Estas condições, particularmente a temperatura, podem precisar ser otimizadas para a expressão de outras proteínas de membrana.
5. Purificação MOMP-tNLP
- Use cromatografia de afinidade de níquel imobilizado para purificar o complexo de nanopartículas MOMP-tNLP da mistura de reação livre de células usando o His-tag na proteína Δ49ApoA1.
- Transfira 1 mL de uma pasta de 50% de Resina de Purificação His-Tag para uma coluna de cromatografia descartável de 10 mL e equilibre-a com 3 mL de tampão de ligação.
- Deixe o tampão escorrer, tampe a saída e adicione 250 μL de tampão de ligação à resina.
- Antes de adicionar a reação livre de células à coluna, salve 20 μL para análise posterior por SDS-PAGE. Misturar a reacção livre de células com a resina equilibrada e incubá-la num balancim de laboratório a 4 °C durante 1 h.
- Retire a coluna, lave a tampa com 500 μL de tampão de ligação adicional e adicione este líquido ao resto da coluna.
- Coletar o fluxo de líquido da coluna para posterior análise por SDS-PAGE.
- Lavar a coluna com 1 ml de tampão de lavagem contendo imidazol 20 mM seis vezes e recolher fracções. Tome cuidado para não deixar a resina secar entre as lavagens. Na segunda lavagem, agitar vigorosamente a resina pipetando para cima e para baixo usando uma pipeta de 1 mL.
- Eluir os MOMP-tNLPs em seis frações de 300 μL de tampão de eluição 1 (contendo imidazol 250 mM), seguido de uma eluição final com 300 μL de tampão de eluição 2 (contendo imidazol 500 mM). Na segunda eluição agitar vigorosamente a resina pipetando para cima e para baixo usando uma pipeta de 1 mL.
6. Análise por SDS-PAGE
NOTA: Todas as frações de eluição devem ser analisadas por SDS-PAGE para triagem da quantidade e pureza da proteína de interesse.
- Carregar 1 μL de cada um dos lisados totais e flow-through e, em seguida, 5 μL para todas as lavagens e frações de eluição coletadas.
- Misture alíquotas dos MOMP–tNLPs eluídos, lavagens, flow-through e lisado total com 4x tampão de carregamento de amostra SDS-PAGE. Misturar e desnaturar caloricamente as amostras com 10x agente redutor de amostras, salvo indicação em contrário.
- Analisar as frações por eletroforese em gel usando géis Bis-Tris SDS-PAGE de 1,0 mm, 4 a 12% com 1x tampão de corrida MES-SDS, juntamente com um padrão de peso molecular apropriado. Passe os géis por 35 min a 200 V.
- Manchar os géis de acordo com as instruções do fabricante.
- Retire o gel do e coloque-o em 60 mL de coloração de gel. Leve o gel ao micro-ondas na mancha de gel por 30 s e agite suavemente o recipiente por 30 s para distribuir o calor uniformemente. Leve o gel ao micro-ondas na mancha a 80–85 °C por mais 30 s e coloque o gel em um agitador orbital para balançar por 5 min.
- Leve o gel ao micro-ondas uma terceira vez por 30 s e, em seguida, retorne ao agitador orbital para balançar por mais 23 min.
- Transferir o gel para um recipiente limpo e lavar em 100 mL de solução de lavagem (metanol a 10%, ácido acético a 7%) por 30 min.
NOTA: Esta é uma etapa crítica, pois é essencial evitar o aquecimento da solução de lavagem. Se isso não for feito, pode resultar em coloração de fundo e irregularidades na imagem final do gel. - Após a lavagem, enxágue o gel em água ultrapura duas vezes por 5 min cada.
- Imagem dos géis usando um imageador de gel a 600 nm (Figura 2). Use SDS-PAGE para quantificar a quantidade de proteína individual na solução de nanopartículas se houver um padrão de proteína para comparação.
NOTA: Neste exemplo, diluições seriais de MOMP recombinantemente expressas são resolvidas por SDS-PAGE e as densidades das bandas são quantificadas usando software de instrumento. - Gere uma curva padrão usando as densidades das bandas do MOMP. Resolva as amostras MOMP-tNLP no mesmo gel SDS-PAGE e calcule o componente MOMP das partículas usando a curva padrão MOMP (Figura 3).
7. Western e dot blots e armazenamento
- Para western blotting, resolver as amostras por SDS-PAGE e transferir os géis usando um sistema comercial de dry blotting com configurações padrão de acordo com o protocolo do fabricante.
- Remova as manchas da pilha após a transferência estar concluída e incube cada mancha durante a noite a 4 °C em um tampão de bloqueio adequado contendo 0,2% de Tween 20 e 0,5 mg/mL de MAb40 ou 0,2 mg/mL de anticorpo anti-His-tag MAbHIS direcionado contra o His-tag da proteína Δ49ApoA1.
NOTA: As diluições de anticorpos usadas para blotting são 1:1.000 para MAb40 e 1:500–1.000 para o anticorpo MAbHIS. - Lave cada mancha 3 vezes por 5 min com PBS-T (1x PBS, 0,2% Tween 20, pH 7,4).
- Incubar os coágulos por 1 h em tampão de bloqueio contendo anticorpo secundário conjugado a um fluoróforo (por exemplo, IRDye) em uma diluição de 1:10.000.
- Lave novamente as manchas 3 vezes por 5 min com PBS-T. Use um imageador de fluorescência para obter imagens das manchas após a lavagem final.
- Remova as manchas da pilha após a transferência estar concluída e incube cada mancha durante a noite a 4 °C em um tampão de bloqueio adequado contendo 0,2% de Tween 20 e 0,5 mg/mL de MAb40 ou 0,2 mg/mL de anticorpo anti-His-tag MAbHIS direcionado contra o His-tag da proteína Δ49ApoA1.
- Para os pontos blots, borrar 3 μg de MOMP-tNLP purificado e esvaziar o tNLP usando um aparelho dot blot. Bloqueie e desenvolva as manchas usando os mesmos métodos descritos acima para western blotting.
8. Avaliação da endotoxina
- Quantificar os níveis de endotoxinas usando um sistema de teste de endotoxinas baseado no ensaio Limulus Amebocyte Lysate (LAL). Preparar 25 mM Tris livre de endotoxinas, pH 7,4, tampão de amostra usando solução de cloridrato de Tris 1 M e água livre de endotoxinas.
NOTA: Normalmente, as amostras têm de ser diluídas utilizando este tampão de amostra e as diluições ajustadas para encontrar o intervalo adequado para amostras individuais. Aqui, as amostras de MOMP-tNLP são diluídas 500 vezes em tampão de amostra e 25 μL são carregados em cada poço de um cartucho de dispositivo com sensibilidade de 0,05 EU/mL. Os níveis de endotoxinas de MOMP-tNLP e tNLP vazio utilizados nos estudos em ratinhos descritos abaixo situam-se entre 0,4 a 12 EU/μg de proteína, dependendo da amostra.
9. Liofilização
- Liofilizar e armazenar as nanopartículas MOMP-tNLP para uso a longo prazo (até anos) a -20 °C. Para preparar suspensões de tNLP e MOMP-tNLP para liofilização, adicione trealose como protetor durante o processo de congelamento e liofilização.
NOTA: Este processo foi extensivamente validado para uma variedade de formulações de tNLP 7,8. - Divida o volume atual da solução MOMP-tNLP por 9 para obter o volume de 1 M de trealose em água estéril, livre de endotoxinas e deionizada necessária para atingir uma concentração final de trealose 0,1 M. Anote o volume final e alíquota em tubos de polipropileno livres de endotoxina, conforme desejado.
- Congele a solução misturada em gelo seco e liofilize-a durante a noite usando um liofilizador. Conservar as formulações secas a -20 °C até ser necessário.
- Reconstituir tNLPs liofilizadas usando água livre de endotoxinas. Enrole suavemente até que o bolo liofilizado esteja totalmente dissolvido e reidratado novamente. Para remover a trealose, dialisar a solução contra PBS usando uma membrana de diálise de corte de 3,5 kDa.
10. Adição de adjuvante
NOTA: Estas e outras formulações vacinais similares baseadas em PNL podem incorporar prontamente adjuvantes lipofílicos como CpG-ODN1826 e FSL-1. CpG-ODN1826 é um oligonucleotídeo CpG de classe B modificado (5'-tccatgacgttcctgacgtt-3') com uma espinha dorsal completa de fosforotioato apresentando uma porção de colesterol 5' (5'-chol-C6). A conjugação de CpG-ODN1826 a tNLPs é mediada pelas interações hidrofóbicas entre a fração colesterol e a bicamada fosfolipídica da tNLP e tem sido demonstrada e bem caracterizada, como relatado anteriormente 9,10.
- Antes da incorporação nessas formulações, purificar a CpG modificada pelo colesterol por cromatografia de fase reversa para remover a endotoxina contaminante, bem como quaisquer moléculas de CpG não modificadas.
- Após o recebimento do fornecedor, reidratar o material liofilizado CpG em água livre de endotoxinas e purificá-lo em uma coluna preparativa C4 RP-HPLC usando um gradiente de separação composto por 10 mM de acetato de trietilamônio (TEAA) (fase móvel A) e acetonitrila (fase móvel B).
NOTA: Detalhes adicionais estão disponíveis na Tabela 2. - Agrupar e liofilizar as frações contendo CpG modificada por colesterol. Para garantir a remoção completa do TEAA residual, reconstituir a CpG com 15 mL de água livre de endotoxinas e reliofilizá-la três vezes.
- Após a liofilização final, reconstituir a CpG em água livre de endotoxinas (concentração final de CpG de >20 mg/mL), alíquota, e armazená-la a -80 °C até que seja necessário. Para adição às formulações, diluir a CpG para uma concentração de 1–2,5 mg/mL.
NOTA: FSL-1 está disponível como um pó liofilizado de grau vacinal. Este é reconstituído usando água estéril e livre de endotoxinas na concentração de 1 mg/mL. A vacina é administrada por via intramuscular (i.m.), com cada dose contendo 10 μg de MOMP em um volume total de 50 μL.
- Após o recebimento do fornecedor, reidratar o material liofilizado CpG em água livre de endotoxinas e purificá-lo em uma coluna preparativa C4 RP-HPLC usando um gradiente de separação composto por 10 mM de acetato de trietilamônio (TEAA) (fase móvel A) e acetonitrila (fase móvel B).
- Para atingir a dose de formulação desejada, dialise as nanopartículas em PBS e concentre-as usando um concentrador centrífugo a vácuo antes da adição de adjuvante. Tome cuidado ao fazer isso para evitar a secagem completa da amostra — verifique o volume da amostra a cada 20 a 30 minutos durante a centrifugação.
- Adicionar o adjuvante em condições estéreis em um armário de biossegurança. Para avaliar o sucesso da incorporação, analise as formulações finais e seus componentes por cromatografia analítica de exclusão de tamanho (SEC).
NOTA: Para estas preparações, uma coluna SEC foi usada em tampão PBS (0,5 mL/m em vazão), e a eluição foi detectada usando um detector de arranjo de diodos UV-vis. A incorporação foi avaliada comparando-se a absorção das partículas adjuvantes com a das partículas não adjuvantes a 214 e 280 nm. - Conservar o adjuvante MOMP-tNLP e o tNLP vazio a 4 °C antes da utilização animal por um período máximo de 14 dias. Para avaliar completamente a estabilidade de uma nova formulação de tNLP, analise periodicamente os tNLPs armazenados pela SEC.
NOTA: A estabilidade varia de formulação para formulação.
11. Testes séricos
- Obter camundongos fêmeas com 3 semanas de idade (BALB/c, n = 6).
- Vacinar os camundongos por via intramuscular (i.m.) em cada membro posterior com 10 μg de MOMP na forma de MOMP-tNLP adjuvante com 5 μg de CpG e 1 μg FSL-1 (volume total por injeção = 50 mL).
- Após a vacinação, observe os camundongos até que eles sejam capazes de manter a decúbito esternal.
- Quatro semanas após a vacinação inicial (prime), vacinar os animais uma segunda vez (boost) com 10 μg de MOMP na forma de MOMP-tNLP adjuvante com 5 μg de CpG e 1 μg FSL-1 (volume total por injeção = 50 mL).
- No dia 56 após a vacinação inicial, coletar sangue para avaliar os títulos de anticorpos. Comece anestesiando os camundongos injetando i.p. uma solução de xilazina (0,3 mg/20 g de peso corporal) e cetamina (3,0 mg/20 g de peso corporal). Aperte as patas dianteiras e traseiras para garantir que não ocorram empurrões. Aplique vaselina ao redor dos olhos para evitar o ressecamento ocular durante a anestesia.
- Com tubo capilar de microhematócrito, puncionar o plexo retro-orbitário. Coletar 100 mL de sangue em um tubo de microcentrífuga.
- Após a coleta de sangue, observe os camundongos até que eles se recuperem da anestesia e possam manter o decúbito esternal.
- Deixe o coágulo de sangue à temperatura ambiente por 30 min e, em seguida, gire para baixo a 2.000 × g por 10 min. Recolher o soro e congelar a -80 °C.
- Neste momento, desafie os animais com Chlamydia muridarum ou eutanasie-os. Eutanasiar os camundongos injetando primeiro i.p. uma solução de xilazina (0,3 mg/20 g de peso corporal) e cetamina (3,0 mg/20 g de peso corporal), seguida de deslocamento cervical.
- Testar anticorpos séricos específicos para MOMP usando técnicas de western blotting, conforme descrito acima. Agrupe soros de camundongos de todos os camundongos imunizados e use o soro agrupado no lugar de um anticorpo primário na diluição de 1:5.000.
Resultados
O perfil SDS-PAGE da purificação por afinidade de Ni do MOMP-tNLP a partir de uma reação livre de células de 1 mL é mostrado na Figura 1B. A reação resultou em altos níveis de expressão tanto para o MOMP quanto para a proteína Δ49ApoA1. Resultados anteriores mostraram que a expressão livre de células de Δ49ApoA1 na presença de DMPC e telodendrímico resultou na formação de partículas de nanolipoproteínas telodendrínicas (tNLPs)4. A co-eluição do MOMP com Δ49ApoA1 indicou que o MOMP está associado com tNLPs, já que o His-tag está presente apenas no scaffold tNLP Δ49ApoA1 e não no MOMP. MOMP é uma proteína altamente insolúvel que só pode ser eluída através da complexação com tNLPs, que demonstraram facilitar a solubilização de proteínas de membrana.
As frações de eluição contendo MOMP-tNLPs foram agrupadas e a concentração de proteína total determinada usando um dispositivo de quantificação baseado em fluorescência, ou um dispositivo que mede a concentração através da absorbância a 280 nm, seguindo as instruções do fabricante para a quantificação de proteínas. Para permitir a dosagem precisa da vacina MOMP, também é importante determinar a concentração de MOMP nos complexos purificados. Desenvolvemos um método para quantificar o MOMP baseado na densitometria em gel (Figura 2), no qual um MOMP recombinante purificado com concentração conhecida foi usado como padrão. Ao estabelecer a curva padrão e compará-la com a amostra MOMP-tNLP, a concentração de MOMP pode ser quantificada com precisão. A determinação da concentração de MOMP na amostra purificada permitiu estimar o rendimento de MOMP em reações livres de células em várias escalas, o que é importante para o planejamento do arranjo da reação adequado aos estudos a jusante (Tabela 3).
O MOMP precisa formar oligômeros para provocar uma resposta imune robusta11. Para testar o estado oligomérico do MOMP, o MOMP-tNLP foi analisado na presença e ausência de calor e do agente redutor ditiotreitol (TDT, 50 mM, Figura 3A). Oligômeros de ordem superior do MOMP foram identificados através de SDS-PAGE quando as amostras não foram tratadas com calor e TDT. Em comparação, amostras tratadas com calor na presença de TDT apresentaram primariamente duas bandas distintas no gel, correspondendo a MOMP e Δ49ApoA1 (aproximadamente 40 kDa e 22 kDa, respectivamente). Esses resultados se assemelham muito ao padrão de bandagem em gel atribuído à formação de oligômeros de MOMP, que é crítico para sua eficácia.
Uma análise mais aprofundada de western blot usando MAb40, um anticorpo contra o epítopo linear no domínio variável da proteína MOM, mostrou um padrão de bandas semelhante, confirmando a formação de oligômeros pela proteína MOMP em seu estado não desnaturado (Figura 3B). Um fator importante que afeta a formação de oligômeros MOMP é a razão entre o plasmídeo MOMP e o plasmídeo Δ49ApoA1 durante a configuração da reação livre de células. A Tabela 4 lista a proporção de plasmídeos e a taxa de inserção resultante de MOMP em tNLPs. Estudos prévios indicaram que o CMMO de clamídia e outras proteínas da membrana externa podem existir primariamente como trimers12. Para maximizar a formação de trimer na reação livre de células, é desejável ter a taxa de inserção próxima a três proteínas MOMP por PNL, o que corresponde a uma razão de plasmídios de ~25:1 MOMP-para-Δ49ApoA1.
Um ensaio dot blot foi usado como um método mais simplificado para detectar a presença de MOMP e tNLP. O anticorpo MAb40 foi utilizado para detectar a MOMP total. O anticorpo MAbHIS direcionado para o His-tag no arcabouço Δ49ApoA1 da tNLP foi usado para avaliar a presença de tNLP. A co-sinalização dos anticorpos MAb40 e MAbHIS indicou a formação de MOMP-tNLP. A reação de controle produziu tNLP vazio, que mostrou apenas um sinal positivo do MAbHIS (Figura 3C). Para testar a imunogenicidade dos MOMP-tNLPs produzidos na reação livre de células, adjuvantes MOMP-tNLP com CpG + FSL-1 e injetados por via intramuscular (i.m.) em camundongos em um regime de prime-boost, conforme descrito acima. Soros foram coletados dos camundongos imunizados, e o anticorpo IgG específico para MOMP foi medido usando um ensaio de western blot (Figura 4). Os soros de camundongos injetados com adjuvante MOMP-tNLP mostraram forte ligação MOMP, indicando que MOMP-tNLP poderia provocar uma resposta imune in vivo.
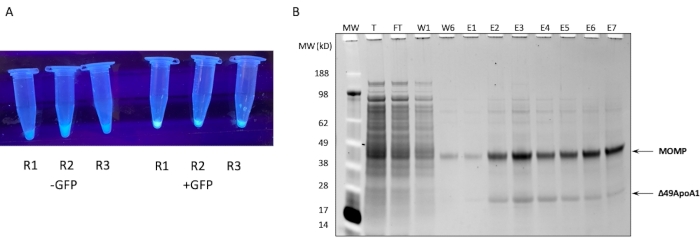
Figura 1: Expressão e purificação do MOMP-tNLP. (A) Imagem de tubos contendo pequenas alíquotas de uma reação livre de células que expressou com sucesso os controles de GFP luminando sob fonte de luz UV (direita) em comparação com lisados sem plasmídeo de GFP (esquerda). (B) Gel proteico corado com SYPRO Ruby após SDS-PAGE mostra o perfil de purificação do MOMP-tNLP. O MOMP migra a 40 kDa e o 49ApoA1 migra a 22 kDa. Abreviações: MOMP = proteína da membrana externa principal da clamídia; tNLP = partícula de nanolipoproteína do telodendrímero; MOMP-tNLP = complexo MOMP-tNLP; GFP = plasmídeo codificador de proteína fluorescente verde; MW = Marcador de peso molecular; T = lisado total livre de células; FT = fluxo-through; R1-R3 = alíquotas de reação livre de células; W1, W6 = Lavagens 1 e 6; E1-E7 = Eluções de 1 a 7; Δ49ApoA1 = Derivado de ApoA1 de camundongo marcado com His-marked. Clique aqui para ver uma versão maior desta figura.

Figura 2: Quantificação do MOMP em amostras de MOMP-tNLP. (A) Gel de SDS-PAGE corado com SYPRO Ruby para quantificação de MOMP. MOMP recombinante com concentração conhecida foi carregado no gel para obter a curva padrão. Cada pista continha 0,1 μg, 0,5 μg, 1,0 μg, 2,0 μg e 4,0 μg de MOMP. As amostras de MOMP-tNLP que estavam sendo quantificadas foram carregadas no mesmo gel. (B) A curva padrão de concentração do MOMP foi gerada por densitometria. Uma equação relacionando a densidade de bandas normalizada e a quantidade de MOMP foi estabelecida. A equação foi utilizada para calcular o teor de MOMP nas amostras desconhecidas. Abreviações: MOMP = proteína da membrana externa principal da clamídia; tNLP = partícula de nanolipoproteína do telodendrímero; MOMP-tNLP = complexo MOMP-tNLP; SDS-PAGE = eletroforese em gel de poliacrilamida com dodecilsulfato de sódio. Clique aqui para ver uma versão maior desta figura.
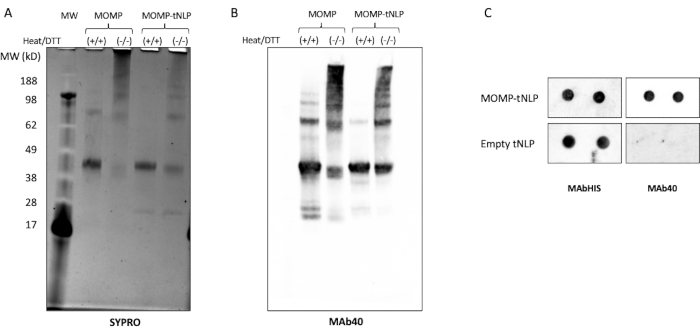
Figura 3: O MOMP-tNLP produzido sem células permite que o MOMP forme estruturas de ordem superior. (A) Gel SDS-PAGE de MOMP-tNLP com e sem tratamento térmico e redutor de TDT, corado com SYPRO Ruby. Com o calor e a TDT, o MOMP apareceu principalmente como uma banda de monômero a ~40 kDa, já que o calor e o agente redutor quebraram a maioria da estrutura MOMP de ordem superior. Na ausência de calor e TDT, as bandas de ordem superior estavam presentes, indicando a conformação do oligômero MOMP. (B) Western blot de MOMP-tNLP e MOMP isoladamente, não tratado e tratado com calor e TDT. Após a transferência, a membrana foi sondada com MAb40 (diluição 1:1.000). Um padrão de bandas semelhante ao gel corado com rubi SYPRO foi observado, confirmando que as bandas de maior peso molecular eram realmente oligômeros MOMP. (C) Dot blot de amostras de MOMP-tNLP e tNLP vazias (em duplicata) sondadas com MAb40 e MAbHIS. Abreviações: MOMP = proteína da membrana externa principal da clamídia; tNLP = partícula de nanolipoproteína do telodendrímero; MOMP-tNLP = complexo MOMP-tNLP; SDS-PAGE = eletroforese em gel de poliacrilamida com dodecilsulfato de sódio; TDT = ditiotreitol. Clique aqui para ver uma versão maior desta figura.
Figura 4: MOMP-tNLP produzido sem células é altamente imunogênico. O soro de camundongos imunizados mostrou forte sinal anti-MOMP IgG. MOMP-tNLP adjuvante com CpG + FSL-1 foi usado para imunizar camundongos. Soros de seis camundongos imunizados foram coletados, agrupados e usados para sondar MOMP-tNLP. O soro foi capaz de se ligar ao MOMP em um ensaio de western blotting e mostrou forte sinal de IgG (esquerda). O western blot usando MAb40 como anticorpo primário (direita) mostrou bandas semelhantes, indicando que o soro continha IgG específica para MOMP. Abreviações: MOMP = proteína da membrana externa principal da clamídia; tNLP = partícula de nanolipoproteína do telodendrímero; MOMP-tNLP = complexo MOMP-tNLP; CpG = adjuvante CpG modificado por colesterol; FSL-1 = adjuvante lipofílico. Clique aqui para ver uma versão maior desta figura.
| Nome do buffer | NaH2PO4 | NaCl | Imidazol | ph |
| Buffer de vinculação | 50 mM | 300 mM | 10 mM | 8.0 |
| Tampão de lavagem | 50 mM | 300 mM | 20 mM | 8.0 |
| Buffer de Eluição 1 | 50 mM | 300 mM | 250 mM | 8.0 |
| Buffer de Eluição 2 | 50 mM | 300 mM | 500 mM | 8.0 |
Tabela 1: Lista de tampões necessários para purificação por afinidade de níquel detalhando as concentrações de cada componente e pH.
| Runtime | 50 minutos |
| Vazão | 6,0 mL/min |
| Tipo de gradiente | Binário |
| Buffer A | 10 mM TEAA em H20 |
| Amortecedor B | MeCN |
| Gradiente | % Buffer B |
| 0 min | 25% |
| 30 minutos | 60% |
| 30.5 minuto | 100% |
| 40 minutos | 100% |
| 40.5 minuto | 25% |
| 50 minutos | 25% |
Tabela 2: Condições para purificação por HPLC em fase reversa de CpG modificada por colesterol. Abreviaturas: TEAA = acetato de trietilamônio; MeCN = acetonitrila.
| Lisado livre de células (mL) | Lipídio DMPC (mg) | Telodendrimero (mg) | Plasmídeo MOMP (μg) | Rendimento de MOMP purificado (mg) |
| 1 | 4 | 0.4 | 15 | 0.5 |
| 2 | 8 | 0.8 | 30 | 1.1 |
| 3 | 12 | 1.2 | 45 | 1.6 |
| 5 | 20 | 2 | 75 | 2.7 |
Tabela 3: A quantidade de lipídios, telodendrômeros e plasmídeos usados para reações livres de células em diferentes escalas e os rendimentos correspondentes. Abreviações: MOMP = proteína da membrana externa principal da clamídia; DMPC = 1,2-dimiristoil-sn-glicero-3-fosfocolina.
| Razões de entrada de plasmídeos, MOMP : Δ49ApoA1 | 1:1 | 5:1 | 10:1 | 25:1 | 50:1 | 100:1 | |
| Razões da quantidade de proteína produzida, MOMP : Δ49ApoA1 | 0.02 | 0.32 | 0.64 | 3.46 | 6.55 | 20.04 | |
| Número estimado de inserção do MOMP por tNLP | 0.03 | 0.37 | 0.75 | 4.04 | 7.65 | 23.39 | |
Tabela 4: As razões plasmidiais em uma reação livre de células e as taxas de inserção MOMP resultantes. Abreviações: MOMP = proteína da membrana externa principal da clamídia; tNLP = partícula de nanolipoproteína do telodendrímero; Δ49ApoA1 = Derivado de ApoA1 de camundongo marcado com His-marked.
Discussão
A clamídia é a infecção sexualmente transmissível mais comum que afeta homens e mulheres. Embora a pesquisa de vacinas contra a Chlamydia se estenda por décadas, uma vacina segura e eficaz que possa ser escalada para produção em massa permanece indefinida13. O MOMP clamídia é considerado o principal candidato como antígeno vacinal protetor; no entanto, o PMMO é altamente hidrofóbico e propenso a dobramento incorreto14,15. Estudos posteriores revelaram que a PMMO existe em estados oligoméricos que são essenciais para sua imunogenicidade11. Detalhado aqui é um método validado, livre de células de co-expressão que produz MOMP oligomérico formado dentro de nanopartícula de tNLP como uma vacina, com rendimentos de aproximadamente 1,5 mg de MOMP purificado por 3 mL de lisado. Este procedimento totalmente coligido pode ser ainda mais dimensionado para a produção industrial, aumentando suas perspectivas como uma abordagem útil para a geração de vacinas.
Publicamos anteriormente sobre o uso da expressão livre de células para produzir proteínas de membrana embutidas em NLPs 3,16, bem como a expressão em discos estabilizados por telodendrídeos. Entretanto, esta última técnica produziu partículas de membrana-proteína com maior heterogeneidade e menor solubilidade. 4 Além disso, a imunogenicidade das partículas MOMP-telodendrímicos não é clara em comparação com as partículas MOMP-tNLP6.
Este procedimento pode ser adaptado para ampliar a expressão de proteínas de membrana bacteriana que são candidatas promissoras como antígenos para uso em vacinas de subunidades. Não só este procedimento produz proteína de membrana bacteriana solubilizada, mas a estrutura geral de nanopartículas é passível de modificação adicional usando uma variedade de adjuvantes vacinais lipofílicos, incluindo, mas não limitado a, CpG conjugado a uma fração de colesterol ou FSL-1. A expressão de outros antígenos candidatos a partir de bactérias é viável, embora parâmetros como temperatura de expressão, escolha lipídica e tipo de sistema de expressão possam precisar ser explorados para alcançar rendimentos ótimos.
Além disso, a escolha e a proporção de plasmídeos são críticas nesse processo. Ambos os plasmídeos utilizados devem ser construídos a partir da mesma espinha dorsal. Se as inserções tiverem aproximadamente o mesmo comprimento, as razões podem ser baseadas na massa do plasmídeo adicionado, conforme descrito aqui. No entanto, o racionamento baseado em moles dará resultados mais reprodutíveis, particularmente ao escalar as reações. Proporções que funcionam bem em reações em escala de tela (< 0,5 mL) podem não ser aplicáveis a reações maiores e podem exigir otimização adicional. Proteínas não-membrana ainda podem ser expressas usando kits livres de células, mas podem não exigir a nanopartícula lipídica (co-expressão) para produzir um produto solúvel. Além disso, enquanto este protocolo descreve adjuvantes com CpG e FSL-1, este sistema é passível de formulação com outros adjuvantes lipofílicos ou mistura com adjuvantes solúveis, conforme desejado.
É essencial evitar a contaminação ao configurar a reação de expressão livre de células, pois isso pode afetar os rendimentos. Quaisquer aditivos à reação, incluindo os próprios plasmídeos, devem ser altamente puros. Além disso, as proteínas expressas só devem estar em contato com materiais e soluções livres de contaminação por endotoxinas. A contaminação por endotoxinas em formulações candidatas pode levar a resultados inconsistentes e espúrios de ensaios imunológicos e pode ser prejudicial em quantidades suficientes. Embora não descrito aqui, purificação adicional após cromatografia de afinidade por níquel pode ser necessária se muitos contaminantes forem observados em etapas de análise subsequentes, como através de SDS-PAGE. Isso poderia ser realizado com SEC, embora as condições possam exigir otimização em uma base de formulação por formulação.
Divulgações
Os autores declaram não ter interesses financeiros concorrentes conhecidos ou relações pessoais que possam ter influenciado o trabalho relatado neste artigo.
Agradecimentos
Este trabalho foi apoiado pelo serviço de saúde pública concessão R21 AI20925 e U19 AI144184 do Instituto Nacional de Alergia e Doenças Infecciosas. Este trabalho foi realizado sob os auspícios do Departamento de Energia dos EUA pelo Lawrence Livermore National Laboratory sob o contrato DE-AC52-07NA27344 [LLNL-JRNL-822525, LLNL-VIDEO-832788].
Materiais
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-sn-glycero-3-phosphocholine (DMPC) as powder | Avanti Polar Lipids | 850345 | |
| 1.5 mL endotoxin-free centrifuge tubes | Eppendorf | 2600028 | |
| 1 M Trizma hydrochloride solution | Millipore Sigma | T2194 | |
| Acetic acid, glacial, ACS reagent, ≥99.7% | Millipore Sigma | 695092 | |
| Bio-Dot apparatus | Bio-Rad | 1706545 | |
| Buffer Dam for XCell SureLock | Life Technologies | EI0012 | |
| C24 Incubator shaker | New Brunswick Scientific | ||
| Cell-Free Expression System: RTS 500 ProteoMaster E. coli HY Kit | BiotechRabbit | BR1400201 | |
| cOmplete His-Tag Purification Resin | Roche Molecular Diagnostics | 5893682001 | |
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Roche Molecular Diagnostics | 4693132001 | |
| CpG-ODN1826 | Biosearch Technologies | T9449 | |
| D-(+)-Trehalose dihydrate | Millipore Sigma | 71509 | |
| Dialysis tubes D-Tube Dialyzer Maxi | Millipore Sigma | 71508-3 | |
| Disposable, polypropylene fritted columns 10 mL capacity | Bio-Rad | 7311550EDU | |
| Dulbecco’s Phosphate-buffered Saline (PBS) | Millipore Sigma | D8537 | |
| Electrophoresis Power Supply | |||
| Endosafe PTS cartridge | Thermo Fisher Scientific | NC9594798 | |
| Endosafe-PTS Testing System | Charles River | ||
| Gel wash solution: 10% methanol, 7% acetic acid | |||
| HCl and NaOH solutions for pH adjustment | |||
| HPLC with UV-vis diode array detector | Shimadzu | ||
| HyClone HyPure culture-grade water | VWR | 82007-328 | |
| iBlot 2 Dry Blotting System | Life Technologies | ||
| iBlot 2 Transfer Stacks, PVDF | Life Technologies | IB24001 | |
| Image Studio V2.0 software | Li-COR Biiosciences | ||
| Imidazole | Millipore Sigma | I5513 | |
| Immun-Blot PVDF Membrane | Bio-Rad | 1620177 | |
| LI-COR Odyssey Fc imager | Li-COR Biiosciences | ||
| Lyophilizer | Labconco | ||
| Methanol (≥99.9%) | Millipore Sigma | 34860 | |
| Microcentrifuge | |||
| Microwave oven | |||
| NanoDrop One/OneC Microvolume UV-Vis Spectrophotometer | Thermo Fisher Scientific | ND-ONE-W | |
| NuPAGE 4 to 12%, Bis-Tris, 1.0 mm | Life Technologies | NP0321 | |
| NuPAGE LDS Sample Buffer (4x) | Life Technologies | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Life Technologies | NP000202 | |
| NuPAGE Sample Reducing Agent (10x) | Life Technologies | NP0009 | |
| Odyssey Blocking Buffer in TBS containing 0.2% Tween 20 | Li-COR Biosciences | 927-50000 | |
| Orbital Shaker | |||
| PBS-T (1x PBS, 0.2% Tween 20, pH 7.4) | |||
| PEG5K-CA8 Telodendrimer (custom synthesis product) | |||
| pIVEX2.4d vector | Roche Molecular Diagnostics | ||
| Plasmid Maxi Kit | Qiagen | 12162 | |
| Primary antibody: MAb40 (monoclonal antibody to the variable domain 1 (VD1) of C. muridarum MOMP, de la Maza laboratory)4 | |||
| Primary antibody: MAbHIS, Penta-His antibody | Qiagen | 34660 | |
| Probe sonicator | |||
| Qubit 3.0 Fluorometer | Life Technologies | Q33216 | |
| Qubit Protein Assay Kit | Life Technologies | Q33212 | |
| Rainin Pipette tips: LTS 1000 µL | Rainin | 17002428 | |
| Rainin Pipette tips: LTS 20 µL | Rainin | 17002429 | |
| Rainin Pipette tips: LTS 200 µL | Rainin | 17002426 | |
| Rainin Pipettes | Rainin | ||
| Secondary antibody: IRDye 800CW goat (polyclonal) anti-mouse IgG (heavy and light) | Li-COR Biosciences | 926-32210 | |
| SeeBlue Plus2 Pre-stained Protein Standard | Life Technologies | LC5925 | |
| Sodium chloride NaCl | Millipore Sigma | S7653 | |
| Sodium phosphate monobasic NaH2PO4 | Millipore Sigma | S0751 | |
| Superdex 200, 5/150 GL column | Cytiva | GE28-9909-45 | |
| Synthetic diacylated lipoprotein-TLR2/6 FSL-1 | Invivogen | tlrl-fsl | |
| SYPRO Ruby Protein Gel Stain | Life Technologies | S12001 | |
| TWEEN 20 | Millipore Sigma | P1379 | |
| UV light source | |||
| Vacufuge Bench Top Centrifuge | Eppendorf | ||
| Vortexer | |||
| VWR 15 mL conicals (89039-666) | VWR | ||
| VWR 50 mL conicals (89039-656) | VWR | ||
| XCell SureLock Mini-Cell (Life Technologies ) | Life Technologies | EI0001 |
Referências
- Carlson, E. D., Gan, R., Hodgman, C. E., Jewett, M. C. Cell-free protein synthesis: applications come of age. Biotechnology Advances. 30 (5), 1185-1194 (2012).
- Coleman, M. A., et al. Expression and association of the Yersinia pestis translocon proteins, YopB and YopD, are facilitated by nanolipoprotein particles. PLoS One. 11 (3), 0150166(2016).
- Cappuccio, J. A., et al. Cell-free co-expression of functional membrane proteins and apolipoprotein, forming soluble nanolipoprotein particles. Molecular & Cellular Proteomics: MCP. 7 (11), 2246-2253 (2008).
- He, W., et al. Controlling the diameter, monodispersity, and solubility of ApoA1 nanolipoprotein particles using telodendrimer chemistry. Protein Science. 22 (8), 1078-1086 (2013).
- He, W., et al. Cell-free production of a functional oligomeric form of a Chlamydia major outer-membrane protein (MOMP) for vaccine development. Journal of Biological Chemistry. 292 (36), 15121-15132 (2017).
- Tifrea, D. F., et al. Induction of protection in mice against a Chlamydia muridarum respiratory challenge by a vaccine formulated with the major outer membrane protein in nanolipoprotein particles. Vaccines. 9 (7), 755(2021).
- Cleveland, T. E., et al. Small-angle X-ray and neutron scattering demonstrates that cell-free expression produces properly formed disc-shaped nanolipoprotein particles. Protein Science. 27 (3), 780-789 (2018).
- Fischer, N. O., et al. Conjugation to nickel-chelating nanolipoprotein particles increases the potency and efficacy of subunit vaccines to prevent West Nile encephalitis. Bioconjugate Chemistry. 21 (6), 1018-1022 (2010).
- Fischer, N. O., et al. Colocalized delivery of adjuvant and antigen using nanolipoprotein particles enhances the immune response to recombinant antigens. Journal of the American Chemical Society. 135 (6), 2044-2047 (2013).
- Fischer, N. O., et al. Evaluation of nanolipoprotein particles (NLPs) as an in vivo delivery platform. PLoS One. 9 (3), 93342(2014).
- Pal, S., Peterson, E. M., de la Maza, L. M. Vaccination with the Chlamydia trachomatis major outer membrane protein can elicit an immune response as protective as that resulting from inoculation with live bacteria. Infection and Immunity. 73 (12), 8153-8160 (2005).
- Sun, G., et al. Structural and functional analyses of the major outer membrane protein of Chlamydia trachomatis. Journal of Bacteriology. 189 (17), 6222-6235 (2007).
- Hafner, L. M., Wilson, D. P., Timms, P. Development status and future prospects for a vaccine against Chlamydia trachomatis infection. Vaccine. 32 (14), 1563-1571 (2014).
- Findlay, H. E., McClafferty, H., Ashley, R. H. Surface expression, single-channel analysis and membrane topology of recombinant Chlamydia trachomatis Major Outer Membrane Protein. BMC Microbiology. 5, 5(2005).
- Sun, G., Pal, S., Weiland, J., Peterson, E. M., de la Maza, L. M. Protection against an intranasal challenge by vaccines formulated with native and recombinant preparations of the Chlamydia trachomatis major outer membrane protein. Vaccine. 27 (36), 5020-5025 (2009).
- He, W., et al. Cell-free expression of functional receptor tyrosine kinases. Scientific Reports. 5 (1), 12896(2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados