Method Article
Quantificação do impacto potencial dos produtos à base de glifosato em microbiomas
Neste Artigo
Resumo
Os produtos à base de glifosato (GBP) são os herbicidas de amplo espectro mais comuns em todo o mundo. Neste artigo, introduzimos diretrizes gerais para quantificar o efeito do GBP nos microbiomas, desde experimentos de campo até análises bioinformáticas.
Resumo
Os produtos à base de glifosato (GBP) são os herbicidas de amplo espectro mais comuns em todo o mundo. O alvo do glifosato é a enzima 5-eolpyruvylshikimate-3-fosfato synthase (EPSPS) no caminho shikimate, que é virtualmente universal nas plantas. A inibição da enzima interrompe a produção de três aminoácidos essenciais: fenilalanina, tyrosina e triptofano. O EPSPS também está presente em fungos e procariotes, como arqueias e bactérias; assim, o uso de GBP pode ter impacto na composição do microbioma de solos, plantas, herbívoros e consumidores secundários. Este artigo tem como objetivo apresentar diretrizes gerais para avaliar o efeito do GBP em microbiomas, desde experimentos de campo até análises bioinformáticas e fornecer algumas hipóteses testáveis. Dois experimentos de campo são apresentados para testar o GBP em organismos não-alvo. Primeiro, micróbios associados a plantas de 10 lotes de tratamento replicados e GBP simulando o plantio não-até o plantio são amostrados e analisados. No segundo experimento, foram obtidas amostras de parcelas experimentais fertilizadas por estrume de aves contendo resíduos de glifosato ou estrume de controle não tratado. A análise bioinformática das sequências proteicas EPSPS é utilizada para determinar a sensibilidade potencial dos micróbios ao glifosato. O primeiro passo para estimar o efeito do GBP nos microbiomas é determinar sua sensibilidade potencial à enzima alvo (EPSPS). Sequências microbianas podem ser obtidas a partir de repositórios públicos ou por meio de amplificação pcr. No entanto, na maioria dos estudos de campo, a composição do microbioma tem sido determinada com base em marcadores universais de DNA, como o rRNA 16S e o espaçador transcrito interno (ITS). Nestes casos, a sensibilidade ao glifosato só pode ser estimada através de uma análise probabilística das sequências de EPSPS utilizando espécies intimamente relacionadas. A quantificação da sensibilidade potencial dos organismos ao glifosato, com base na enzima EPSPS, fornece uma abordagem robusta para novos experimentos para estudar mecanismos de alvo e não-alvo resistentes.
Introdução
O uso intenso de agrotóxicos na agricultura moderna é claramente um dos principais contribuintes para o declínio da biodiversidade1. Este artigo se concentra no glifosato porque os produtos à base de glifosato (GBPs) tornaram-se os pesticidas mais utilizados globalmente devido à sua eficiência e preço acessível 2,3. Além de matar ervasdas em campos agrícolas, os GBPs são comumente usados em silvicultura, ambientes urbanos e hortas domésticas; além disso, eles foram proclamados como nãotóxicos para organismos não-alvo se usados de acordo com as instruções do fabricante. No entanto, um número crescente de estudos recentes revelou que os resíduos de glifosato e seus produtos de degradação podem ser retidos e transportados em solos, tendo efeitos em cascata em organismos não-alvo 4,5,6,7,8 . Os efeitos do glifosato não se limitam apenas às plantas - o caminho shikimate está presente em muitos fungos e procariotes também. O glifosato tem como alvo a enzima 5-eolpyruvylshikimate-3-fosfato synthase (EPSPS) no caminho shikimate, também conhecido como aroA9. Esta enzima está no centro do caminho shikimate na síntese dos três aminoácidos aromáticos essenciais (fenilalanina, tyrosina e triptofano), e está presente na maioria dos procariotes, plantas e fungos10,11. Algumas espécies microbianas desenvolveram resistência parcial ou absoluta ao glifosato por meio de vários mecanismos, incluindo mutações nas sequências de EPSPS. Assim, tem sido sugerido que o uso de GBPs pode ter um efeito direto sobre microbiomas vegetais e animais, incluindo o microbioma intestinal humano 12,13,14. No entanto, o uso de GBP pode ter um impacto adverso em praticamente qualquer função e serviço do ecossistema que dependem de micróbios e processos facilitados por micróbios. As ameaças consequentes podem estar em processos bioquímicos do solo, biologia da polinização e bem-estar animal e humano. Isso exige uma compreensão mais abrangente de como o glifosato afeta caminhos e métodos shikimate para avaliar a sensibilidade dos micróbios ao glifosato.
Neste protocolo, apresentamos um pipeline para testar o efeito do glifosato e do GBP no microbioma, desde experimentos de campo até análises bioinformáticas. Descrevemos em detalhes um método bioinforático recentemente publicado que pode ser usado para determinar a sensibilidade potencial dos organismos ao glifosato12. Para o conhecimento dos pesquisadores, esta é a primeira e até agora, a única ferramenta bioinformática para avaliar a sensibilidade intrínseca da enzima EPSPS ao componente ativo dos GBPs. Este método bioinformática baseia-se na detecção de marcadores de aminoácidos conhecidos na enzima alvo do glifosato (EPSPS)12. O gasoduto é dividido em cinco fases principais de trabalho (Figura 1): 1) uma breve introdução a dois experimentos de campo para testar o efeito de GBPs, 2) um breve resumo das análises de microbioma (16S rRNA, ITS e gene EPSPS ), 3) coletando sequências EPSPS de repositórios públicos, 4) determinando a sensibilidade potencial dos organismos ao glifosato e 5) avaliando a classe EPSPS a partir de marcadores microbianos universais (16S rRNA e ITS).
Protocolo
1. Dois experimentos de campo para testar o efeito de GBPs
NOTA: Este protocolo apresenta dois exemplos de projetos experimentais de campo para testar o efeito de GBPs em micróbios associados à planta. Ambos os experimentos foram realizados em campos de reserva sem histórico prévio de herbicida ou uso agrícola no Jardim Botânico da Universidade de Turku Ruissalo, na Finlândia (60º26'N, 22º10'E). O solo é argila arenosa com uma alta proporção de matéria orgânica.
- Experimento 1
NOTA: Este experimento foi projetado para simular as práticas agrícolas gerais da agricultura no-till com aplicações gbp antes e depois da estação de crescimento para combater as weeds.- Divida o campo experimental em 10 parcelas de tratamento replicadas e GBP (23 m x 1,5 m) com faixas tampão de vegetação entre as parcelas (neste estudo na primavera de 201415) (Figura 2).
- Certifique-se de que as parcelas são lavouradas com um leme rotativo a uma profundidade de 5 cm e tratadas duas vezes por ano. Aqui, as parcelas foram tratadas no início (maio) e no final (outubro) da estação de crescimento.
- Trate os lotes de controle com água da torneira (5 L/plot) e os lotes GBP com GBP comercial (concentração de glifosato 450 g· L-1, taxa de aplicação 6,4 L·ha-1 em 5 L de água da torneira por parcela) para imitar a dosagem máxima permitida de glifosato nas práticas agrícolas (3 kg·ha-1).
- Aplique os tratamentos com um tanque de pressão operado à mão que tenha um pulverizador manual. Duas semanas após a aplicação do GBP, semear aveia (Avena sativa), faba beans (Vicia faba), estupros de nabo (Brassica rapa subsp. oleifera) e batatas vegetais (Solanum tuberosum) nos lotes de acordo com as práticas agrícolas.
- Durante a temporada de cultivo, a mão-de-casa as parcelas para manter a competição vegetal e a estrutura do solo o mais semelhante possível no controle e parcelas tratadas com GBP.
- Prove a microbiota de plantas experimentais. Neste estudo, a microbiota foi amostrada consecutivamente de 2017 a 2020 tanto nas parcelas de tratamento e tratamento de controle do GBP uma vez por estação de crescimento ao longo do estudo.
- Colete dez réplicas das amostras da planta (raiz e folha) do campo, coloque-as imediatamente no gelo e leve-as ao laboratório para posterior processamento, conforme descrito na seção 2.1.
- Experimento 2
NOTA: Este experimento foi projetado para testar riscos associados à economia alimentar circular; mais precisamente, foi projetado para examinar as consequências dos resíduos de GBP em estrume aplicados como fertilizante às plantasagrícolas 2 (Figura 3).- Recolher roupas de cama, incluindo aparas de madeira, fezes e alguma ração derramada, de codornas alimentadas com rações contaminadas por GBP ou controle em um experimento aviário de 12meses 16,17.
NOTA: A ração contaminada pelo GBP consistiu em ração orgânica para a colocação de galinhas combinadas com um equivalente a 160 mg de glifosato/kg, que corresponde a uma ingestão diária de 12-20 mg de massa corporal glifosato por quilograma em codornas japonesas adultas16,17. - Para validação, envie as amostras para um laboratório credenciado para medições de concentração de glifosato em seis lotes de ração.
- Além disso, meça os resíduos de glifosato em amostras de excreta de codorna após 12 meses de exposição. O grupo controle foi alimentado com a mesma ração orgânica sem adição de GBP16,17.
- Durante o experimento aviário, mude as camas quinzenais. Colete as camas usadas regularmente de 8 a 12 meses de exposição ao tratamento e controles gbp, piscina por tratamento e armazene em recipientes fechados em um depósito seco e escuro a 6 °C antes de usar como fertilizante.
- Espalhe 12 L das camas manualmente em cada um dos gráficos de controle de 18 GBP e 18 (tamanho 1 m x 1 m) em uma grade de tabuleiro de xadrez 6 x 6 no campo experimental em dois pontos de tempo. Neste estudo, as camas foram espalhadas em agosto de 2018 e em maio de 2019.
- Envie as amostras de cama para um laboratório credenciado para as medições de concentração de glifosato diretamente após sua disseminação (neste estudo em maio de 2019).
- Plante plantas perenes de grama e morango em cada parcela para estudar sua microbiota raiz e folha.
NOTA: Neste estudo, quatro plantas perenes de grama (Festuca pratensis) e duas plantas de morango (Fragaria x vescana) foram plantadas em cada parcela e estudadas para sua microbiota raiz e folha.
- Recolher roupas de cama, incluindo aparas de madeira, fezes e alguma ração derramada, de codornas alimentadas com rações contaminadas por GBP ou controle em um experimento aviário de 12meses 16,17.
2. Análises de microbioma (16S rRNA, ITS e gene EPSPS )
NOTA: A maioria dos estudos de microbioma baseia-se na análise do gene 16S rRNA para regiões de espaçadores transcritos bacterianos e internos (ITS) para comunidades fúngicas usando tecnologias de sequenciamento de próxima geração. Assim, o papel não possui informações sobre o tipo de EPSPS. Sequências EPSPS de milhares de espécies estão disponíveis em repositórios públicos (Seção protocolo 3) (Figura 4).
- 16S gene rRNA
- A partir das amostras de folhas e raízes separadas coletadas nos experimentos descritos acima, identificar os micróbios endofíticos (ou seja, micróbios que vivem dentro dos tecidos vegetais).
- Lave as amostras da planta com água da torneira e, em seguida, esterilize-as para remover os micróbios epífticos (ou seja, micróbios na superfície dos tecidos vegetais). Esterilize usando 3% de alvejante por 3 min, seguido de uma solução de 70% de etanol por 1 min, e lave três vezes com água ultrauso autoclavada por 1 min cada.
- Congele as amostras a -80 °C até a extração genômica de DNA.
- Realize a extração genômica de DNA usando um kit de extração de DNA vegetal comercialmente disponível seguindo o protocolo do fabricante.
- Atingir as regiões variáveis V6-V8 do gene 16S rRNA a partir de amostras de DNA extraídos usando uma abordagem aninhada com primers discriminantes que se ligam especificamente ao DNA bacteriano18, minimizando assim a amplificação do DNA da planta hospedeira.
- Após três rodadas de reação em cadeia de polimerase (PCR), marque o gene alvo com sequências de código de barras e adaptador para prepará-lo como o modelo para sequenciamento. Siga as etapas 2.1.7- 2.1.11 para amplificação pcr
- Prepare o mix mestre pcr para o número necessário de amostras para que cada reação tenha 30 μL de volume total e consista em 30 ng de DNA, 1x tampão PCR, 0,2 mM dNTPs, 0,3 μM de cada primer e polimerase de DNA U/mL de 2000. Siga o mesmo passo para a segunda e terceira rodadas de PCR.
- Para a primeira rodada de PCR, utilize os primers 799F19 e 1492R (modificados a partir de20) (Tabela 1). Configure o perfil de amplificação no termociclador (desnaturação inicial de 3 min a 95 °C, seguido de 35 ciclos de desnaturação a 95 °C para 45 s, ressarada a 54 °C para 45 s, e extensão a 72 °C por 1 min). Realize a prorrogação final a 72 °C por 5 min.
- Como modelo para a segunda rodada de PCR, verifique a amplificação por eletroforese (5 μL dos produtos PCR em gel de 1,5% de agarose) e, em seguida, dilua o restante de 25 μL do produto PCR em água ultrapura autoclavada na razão de 1:10.
- Repita o PCR com os modelos pcr diluídos e primers uni-1062F21 e uni-1390R22 (Tabela 1). Mantenha as mesmas condições de reação pcr e perfil de amplificação (etapa 2.1.8) exceto reduzindo o número de ciclos para 25.
- Diluir os produtos PCR resultantes em água ultrapura autoclavada na proporção de 1:1. Realize a terceira rodada de PCR para marcar os produtos com os códigos de barras e sequência de adaptador P1 com 8 ciclos do mesmo perfil pcr mencionado na etapa 2.1.8.
- Preparação da biblioteca
- Verifique a concentração e a qualidade dos produtos PCR em um bioanalíquio e acumule os volumes que constituem 30 ng de DNA de cada amostra em um tubo de 1,5 mL para preparar uma biblioteca equimolar.
- Selecione os amplicons de tamanho 350-550 bp por fracionamento de tamanho usando um sistema automatizado de seleção de tamanho de DNA em uma fita de gel agarose. Observe que isso também elimina amplicons não específicos e reagentes PCR da biblioteca. Colete o elute consistindo de amplificadores do tamanho especificado em um frasco no, resultando em uma biblioteca genética de rRNA purificada de 16S.
- Pipeta para fora do elto em um tubo de 1,5 mL e verificar a pureza e concentração no bioanalílise. Diluir a biblioteca de DNA usando água ultrapura autoclavada para uma concentração final de 26 pM; a amostra está pronta para sequenciamento.
- SEU
NOTA: A região ITS é amplificada usando primers específicos de ITS (Tabela 1), e o produto PCR resultante é rotulado com códigos de barras e uma sequência de adaptador P1 para sequenciamento.- Prepare o mix mestre pcr de acordo com o mesmo protocolo mencionado na seção 2.1 com os primers ITS .
- Defina o perfil de amplificação no termociclador como desnaturação inicial de 5 min a 95 °C seguido de 35 ciclos de desnaturação, renas e extensão a 95 °C para 30 s, 55 °C para 30 s, 72 °C para 1 min, respectivamente, e extensão final de 72 °C para 7 min.
- Analise 5 μL do produto PCR em gel de 1,5 % de agarose e dilua os 25 μL restantes para 1:10 usando água ultrapura autoclavada. Use o produto PCR diluído como modelo para a segunda rodada de PCR.
- Prepare o mix mestre pcr para o número necessário de amostras (consulte a etapa 2.1.6) com primers avançados marcados por código de barras e primers reversos marcados pelo adaptador P1. Amplie com o mesmo perfil de amplificação da etapa 2.3.2, exceto usando 8 ciclos.
- Prepare os produtos PCR resultantes para sequenciamento conforme os protocolos mencionados na seção 2.2.
- Gene EPSPS
- Sequencie e analise os genes EPSPS dos micróbios.
NOTA: No interesse de descobrir se a exposição ao GBP alterou a composição de micróbios sensíveis ao glifosato e resistentes na comunidade, os genes EPSPS dos micróbios precisam ser sequenciados e analisados. Assim, foram coletadas 353 sequências de genes EPSPS de uma ampla coleção de taxas microbianas no banco de dados Alignable Tight Genomic Clusters (ATGC), e todas as sequências proteicas foram alinhadas22. Esses alinhamentos estão disponíveis no banco de dados ATGC23 e podem ser utilizados para gerar primers de regiões conservadas. Uma ferramenta de bioinformática fácil de usar foi projetada para identificar regiões conservadas a partir de um alinhamento de sequência múltipla, e isso está disponível na página de pesquisa de Pere Puigbo24. No entanto, está fora do escopo desta publicação fornecer uma descrição detalhada deste servidor web. No entanto, um protocolo prospectivo para utilizar esses primers para amplificação do gene EPSPS para encontrar a sensibilidade do microbioma ao glifosato é fornecido na Figura 4.
- Sequencie e analise os genes EPSPS dos micróbios.
3. Coletando sequências de proteínas EPSPS de repositórios públicos
- Sequências de EPSPS a serem usadas em estudos de macroevolução
- Coletar proteínas EPSPS de repositórios públicos como PFAM23 (banco de dados de famílias de proteínas25), GenBank24 (banco de dados de genes, genomas e proteínas26 ), COG25 (Clusters of Orthologous Groups27; um banco de dados de proteínas ortologos de arqueias e bactérias); e PDB26 (Protein Data Bank28; banco de dados de estruturas proteicas).
NOTA: Um estudo recente realizado pelos pesquisadores mostrou que essas proteínas poderiam ser utilizadas para realizar análises microevolutivas e comparativas do efeito potencial do glifosato em organismos que têm o caminho shikimate12. Os autores desenvolveram um site fácil de usar que reúne informações sobre dezenas de milhares de sequências de proteínas EPSPS29, incluindo um conjunto de dados com curadoria manual de proteínas do microbioma intestinal humano12. As informações nesses conjuntos de dados pré-computados incluem a classificação EPSPS atual em sensível e resistente ao glifosato, informações taxonômicas sobre espécies, anotações do site ativo EPSPS e links para bancos de dados PDB e NCBI. Além disso, o servidor web inclui os códigos de ID do EPSPS e links para várias bases de dados externas (Tabela 2).
- Coletar proteínas EPSPS de repositórios públicos como PFAM23 (banco de dados de famílias de proteínas25), GenBank24 (banco de dados de genes, genomas e proteínas26 ), COG25 (Clusters of Orthologous Groups27; um banco de dados de proteínas ortologos de arqueias e bactérias); e PDB26 (Protein Data Bank28; banco de dados de estruturas proteicas).
- Sequências de EPSPS a serem usadas em estudos de microevolução ATGC
NOTA: Repositórios gerais de sequências proteicas são úteis para a realização de estudos comparativos entre organismos relativamente distantes; no entanto, o efeito potencial do glifosato é relativamente recente do ponto de vista evolutivo. Assim, em alguns estudos, é necessário comparar espécies intimamente relacionadas (por exemplo, cepas diferentes das mesmas espécies bacterianas) para determinar o efeito do glifosato14. Nestes casos, o banco de dados de Clusters Genômicos Apertados Alinhados (ATGC)30, que contém uma lista abrangente de genomas arqueais e bacterianos intimamente relacionados, é um recurso mais adequado. O banco de dados ATGC contém informações de vários milhões de proteínas de milhares de genomas organizados em centenas de aglomerados30. Cada aglomerado de genomas é alinhado (genomas compartilham sintetização acima de ≥85% de seus comprimentos) e apertado (tendo uma taxa de substituição sinônimo abaixo da saturação). Os pesquisadores utilizaram o conjunto de dados atgc em um estudo recente para analisar mudanças microevolucionárias nas proteínas EPSPS14. As seguintes etapas são necessárias para identificar a sequência de proteínaS EPSPS no ATGC:- Baixe todo o banco de dados de ATGCs do link31 e todas as proteínas do COG0128 (código correspondente às proteínas EPSPS no banco de dados)32 em um projeto local.
NOTA: Se os pesquisadores/experimentadores estiverem sediados na Finlândia, o CSC-IT Center for Science33 fornece instalações de armazenamento e software. É importante reunir todas as sequências no formato FASTA. - Construiu um banco de dados de explosão do COG0128 que contém ortologs da proteína EPSPS em um conjunto representativo de espécies de procariotes. O CSC tem o programa de explosão34 pré-instalado, permitindo o uso do comando makeblastdb -in COG0128.fa -dbtype prot para criar um banco de dados de referência de sequências EPSPS.
- Mapeie o banco de dados ATGC no COG0128.fa (proteínas EPSPS) usando uma pesquisa de explosão iterativa com a consulta de blastp de comando [ATGC_X.fa] -db [COG0128.fa] -max_target_seqs 1 -outfmt 6 -out tmpfile -evalue 1e-150.
- Como resultado, ele cria um conjunto de dados de sequências de proteína EPSPS dentro de cada uma. Um conjunto de dados pré-computado de sequências de proteína EPSPS intimamente relacionadas do banco de dados ATGC está disponível29.
- Baixe todo o banco de dados de ATGCs do link31 e todas as proteínas do COG0128 (código correspondente às proteínas EPSPS no banco de dados)32 em um projeto local.
4. Algoritmo para determinar a sensibilidade potencial dos organismos ao glifosato (servidor web EPSPSClass: entradas, processamento e saídas)
NOTA: Os pesquisadores implementaram um servidor fácil de usar que está livremente disponível aos 29 anos para determinar a classe de sequências proteicas EPSPS12,35. O servidor requer apenas uma entrada de sequência de proteínas no formato FASTA para determinar a porcentagem de identidade para cada uma das classes EPSPS e sua sensibilidade potencial ao glifosato. Além disso, os usuários podem utilizar o servidor web para testar suas próprias sequências de referência e marcadores de aminoácidos. Primeiro, o algoritmo (Figura 5) alinha sequências de consulta e sequências de referência usando um programa de alinhamento de sequência múltipla35 para determinar posições de aminoácidos. Em seguida, busca a presença de marcadores de aminoácidos para identificar a classe EPSPS (I, II, III ou IV) da sequência de consulta.
- Introduza uma sequência de proteínaS EPSPS no formato FASTA na caixa de texto de entrada para identificar a classe da enzima (Figura 6A) e pressione Enviar.
- Avalie a sensibilidade potencial da sequência de consulta ao glifosato (Figura 6B-E) do servidor fornecido saídas:
Saída 1: Fração de marcadores de aminoácidos (ou seja, identidade) presentes nas sequências de consulta (classe I, II e IV), e o número de motivos (classe III).
Saída 2: Alinhamentos das sequências de consulta e referência com base em resíduos de marcadores.
Saída 3: Alinhamentos completos em pares das sequências de consulta e referência.
Saída 4: Sequências de referência EPSPS: Vibrio cholerae(vcEPSPS, classe I), Coxiella burnetii(cbEPSPS, classe II), Brevundimonas vesicularis (bvEPSPS, classe III), Streptomyces davawensis(sdEPSPS, classe IV). - No final da página de saída, encontre links para ferramentas externas, como blastp e domínios conservados para analisar melhor a sequência EPS de consulta (Figura 6F).
5. Avaliação da classe EPSPS a partir de marcadores microbianos universais (16S rRNA e ITS )
NOTA: A maioria dos estudos de microbioma baseia-se na análise do rRNA 16S e/ou ITS36. Nesses casos, não é possível realizar uma análise direta da sequência EPSPS. Assim, é necessária uma abordagem probabilística para estimar a sensibilidade potencial dos organismos ao glifosato. Esta análise é simples e fornece uma estimativa razoável do tipo de sequências de EPSPS em um projeto de microbioma. O processo é dividido em 3 etapas (Figura 7 e Figura 8):
- Identifique sequências EPSPS de repositórios públicos. A classe EPSPS de um conjunto de dados abrangente de sequências representativas foi compilada e pré-calculada a partir de PFAM37, GenBank38, COG39, PDB40, ATGC30. Acesse esses conjuntos de dados a partir da página principal do servidor EPSPSClass, contendo informações taxonomicas e a classe EPSPS de mais de 50.000 sequências (Figura 7).
- Meça a altura das plantas experimentais quinzenalmente durante a estação de cultivo, e pese a biomassa acima do solo das plantas no final da estação de campo para comparar o crescimento das plantas em GBP e parcelas de controle.
NOTA: As análises de microbiota dos experimentos de campo ainda não foram totalmente analisadas. - Use uma planilha para mapear as OTUs bacterianas (baseadas em rRNA ou ITS 16S) de experimentos de microbioma em conjuntos de dados pré-computados.
NOTA: Estudos anteriores mostraram que a classe EPSPS (ou seja, a sensibilidade intrínseca ao glifosato) é altamente conservada dentro de um grupo filogenético14. Assim, é relativamente seguro supor que espécies intimamente relacionadas de taxons altamente conservados podem ter respostas EPSPS semelhantes ao glifosato (Figura 8). - Na mesma planilha, calcule a sensibilidade intrínseca ao glifosato, com base em um escore probabilístico (S = s / (s + r + u) onde S: Escore de Sensibilidade; s: número de sequências potencialmente sensíveis; r: número de sequências potencialmente resistentes; u: número de sequências não classificadas) calculadas a partir de sequências EPSPS conhecidas em bancos de dados públicos.
NOTA: Esta pontuação varia de 0 (nenhuma sequência de EPSPS sensível é encontrada em um taxon) a 1 (todas as sequências em um taxon são sensíveis ao glifosato) (Figura 8). Além disso, existem valores intermediários, ou seja, espécies com cepas sensíveis, resistentes ou desconhecidas.
Resultados
O objetivo deste protocolo é fornecer um pipeline geral, desde experimentos de campo até análises bioinformáticas, que quantifique a sensibilidade potencial dos organismos ao glifosato de herbicida. No Experimento 2, a concentração média de glifosato na ração de codorna foi de 164 mg/kg e a concentração média de glifosato das amostras de excreta (urina e matéria fecal combinada) foi de 199 mg/kg. As camas coletadas de codornas alimentadas com ração contaminada por GBP tinham, em média, 158 mg/kg e roupas de cama de controle medindo 0,17 mg/kg de glifosato (Tabela 3). Nos experimentos de campo, as espécies vegetais responderam de forma diferente aos resíduos de glifosato nos solos (seção 1). A biomassa de estupro de aveia e nabo foi maior em solos de controle em comparação com solos tratados com GBP. No entanto, o feijão faba e a batata pareciam se beneficiar do tratamento gbp no final da temporadade cultivo 15. O glifosato no estrume avícola diminuiu o crescimento vegetal na grama (Pratensis Festuca) e morango (Fragaria x vescana) (seção 1). As análises de microbiota dos experimentos de campo ainda não foram totalmente analisadas e não são apresentadas aqui (seção 2). Os resultados deste protocolo, quando lidos diretamente (como mostrado nas seções 3 e 4) ou indiretamente (seção 5), fornecem uma medida da proporção de organismos potencialmente sensíveis e resistentes ao glifosato em um conjunto de dados (Figura 9). O uso deste método foi testado com uma coleção de sequências proteicas EPSPS de espécies microbianas do microbioma intestinal humano núcleo que foram obtidos a partir de repositórios públicos12. No estudo, foram analisadas 890 cepas das 101 espécies bacterianas mais abundantes com o método EPSPSClass para quantificar a proporção de bactérias sensíveis e resistentes. Os resultados mostraram que 54% das espécies do microbioma intestinal humano são potencialmente sensíveis ao glifosato12. Essa tendência também é observada na maior parte do mundo procariótico; além disso, em eucariotes (principalmente plantas e fungos), a proporção de espécies potencialmente sensíveis é ainda maior12. Além disso, utilizamos este método para quantificar mudanças de sensibilidade na proteína EPSPS a um nível microevolucionário (Figura 10)14. Identificamos alterações no estado de sensibilidade em 12 dos 32 grupos intimamente relacionados de procariotes analisados (Tabela 4)14. Assim, o uso contínuo dos GBPs pode produzir disbiose microbiana (ou seja, um desequilíbrio de espécies bacterianas sensíveis e resistentes) em microbiomas vegetais, animais e solo. Além disso, tem-se hipótese de que um aumento das bactérias resistentes ao glifosato pode promover microbiomas multidroga resistentesa multidrogas 14,41,42. Assim, este protocolo lança luz sobre a interpretação de todos esses cenários, uma vez que o método de classificação EPSPS fornece uma estimativa direta da sensibilidade intrínseca dos microbiomas ao glifosato. Devido à sensibilidade intrínseca da proteína EPSPS ao glifosato é filogeneticamente conservada14, é possível extrapolar os resultados dos conjuntos de dados existentes em microbiomas desconhecidos (Figura 8).
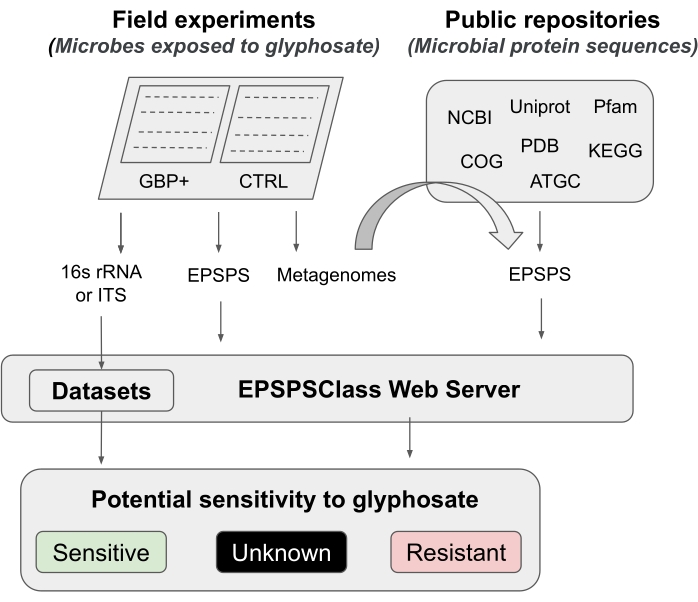
Figura 1: Pipeline geral Este é um pipeline geral para analisar a sensibilidade ao GBP desde experimentos de campo até análises bioinformáticas. Clique aqui para ver uma versão maior desta figura.
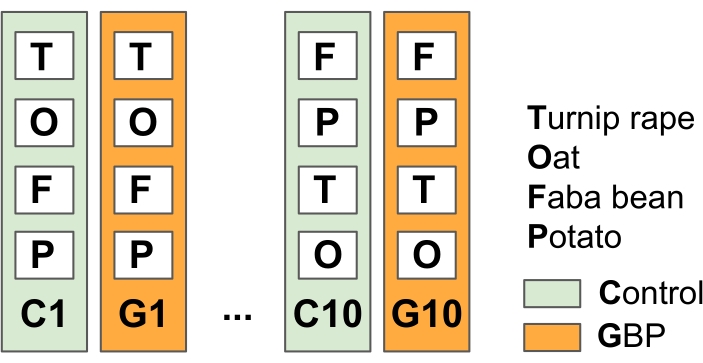
Figura 2: Experimento de campo 1 para testar os efeitos dos resíduos de GBP em micróbios associados à cultura. O campo experimental consiste em alternar 10 parcelas de controle e parcelas de tratamento de 10 GBP (23 m x 1,5 m) com tiras tampão de 1,5 m entre as parcelas. Duas vezes por ano desde 2014, as parcelas gbp foram tratadas com GBP comercial (concentração de glifosato 450 g L-1, taxa de aplicação 6,4 L ha-1 em 5 L de água da torneira por parcela) e os lotes de controle com a mesma quantidade de água da torneira sem glifosato. Os tratamentos foram aplicados com um tanque de pressão operado à mão usando um capuz plástico na ponta do aspersor para proteger os GBPs de se espalharem fora das parcelas de tratamento. Após um período de segurança de duas semanas após a aplicação do GBP, foram semeadas aveia (Avena sativa), faba beans (Vicia faba) e nabo (Brassica rapa subsp. oleifera) e batatas (Solanum tuberosum) foram plantadas nas parcelas. Amostras de microbiota das plantas, folhas e raízes estudadas foram coletadas várias vezes desde o início do experimento, em 2014. Clique aqui para ver uma versão maior desta figura.
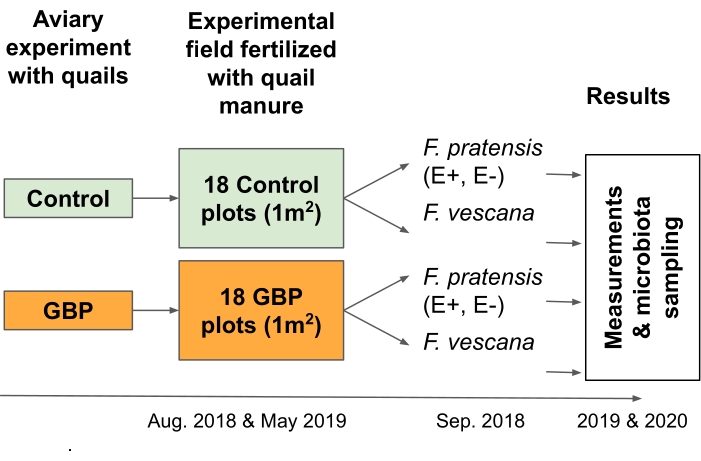
Figura 3: O experimento de campo 2 testou as consequências dos resíduos de GBP em fertilizantes de estrume para duas culturas perenes e sua microbiota associada. Roupas de cama coletadas de um experimento aviário de 12 meses com codornas japonesas alimentadas com controle ou ração contaminada por GBP foram usadas como fertilizante de estrume em um experimento de campo. O campo experimental consistia de 18 lotes de controle e 18 GBP (1 m x 1 m) dispostos em uma grade de tabuleiro de xadrez 6 x 6. As camas foram espalhadas no campo experimental duas vezes, em agosto de 2018 e maio de 2019 (25 L/enredo). As parcelas de controle foram fertilizadas com roupas de cama coletadas de codornas alimentadas com alimentação de controle e parcelas GBP com camas de codornas alimentadas com ração contaminada por GBP. Os resíduos de glifosato nas roupas de cama de controle foram de 0,17 mg/kg de glifosato e na cama GBP, a quantidade foi de 158 mg/kg de glifosato. Dois endofito-simbióticos (E+), dois sem endofito (E-) Festuca pratensis e dois Fragaria x vescana foram plantados por parcela em setembro de 2018, aproximadamente um mês após a propagação das primeiras camas. As medições do desempenho e da aptidão da planta, bem como a amostragem para microbiota associada à raiz e à folha foram realizadas durante duas estações de crescimento consecutivas (2019 & 2020). Clique aqui para ver uma versão maior desta figura.
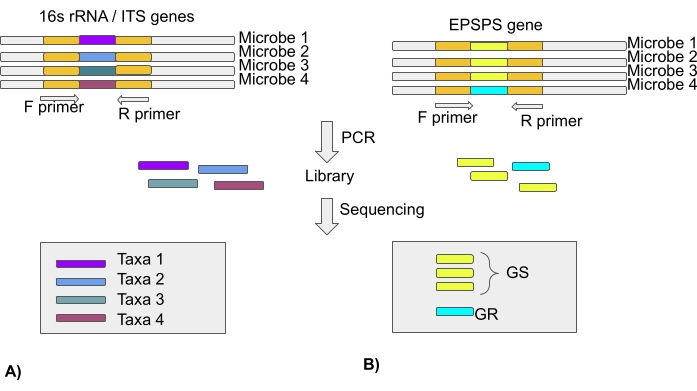
Figura 4: Análise da taxa microbiana utilizando 16S rRNA gene/REGIÃO ITS e sensibilidade de microbiomas para glifosato utilizando o gene EPSPS . (A) Análise das sequências de rRNA ou ITS 16S para identificar taxas microbianas. (B) Análise das sequências de EPSPS para identificar sensibilidade de micróbios ao glifosato (sensível ao gs-glifosato/gr-glifosato resistente) Clique aqui para ver uma versão maior desta figura.
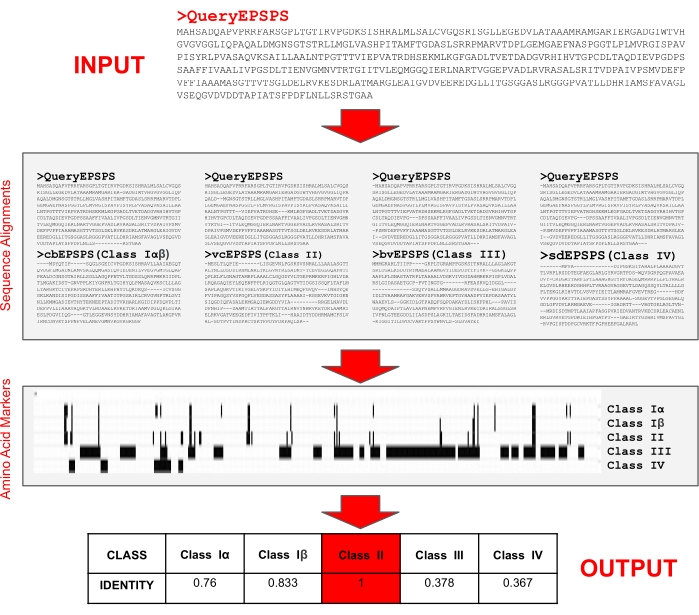
Figura 5: Algoritmo para identificar a classe de sequências proteicas EPSPS. A entrada é uma sequência de proteínas EPSPS no formato FASTA. O algoritmo realiza comparações com marcadores conhecidos de aminoácidos em sequências proteicas de referência que determinam a sensibilidade potencial ao glifosato. O algoritmo foi implementado no servidor web epspsclass29 de acesso livre. Clique aqui para ver uma versão maior desta figura.

Figura 6: Entradas e saídas básicas do servidor web EPSPSClass. (A) Entrada: uma sequência de proteínaS EPSPS no formato FASTA. (B) Saída 1 - identidade: fração de marcadores de aminoácidos presentes nas sequências de consulta (Classes I-IV)e motivos (Classe III). (C) Saída 2 - identidade: alinhamentos das sequências de consulta e referência. (D) Saída 3 - alinhamentos em pares das sequências de consulta e referência. (E) Referência sequências de EPSPS: Vibrio cholerae (vcEPSPS, classe I), Coxiella burnetii (cbEPSPS, classe II), Brevundimonas vesicularis (bvEPSPS, classe III), Streptomyces davawensis (sdEPSPS, classe IV). (F) Links para realizar pesquisas de blastp de adição e identificação de domínios conservados Clique aqui para ver uma versão maior desta figura.
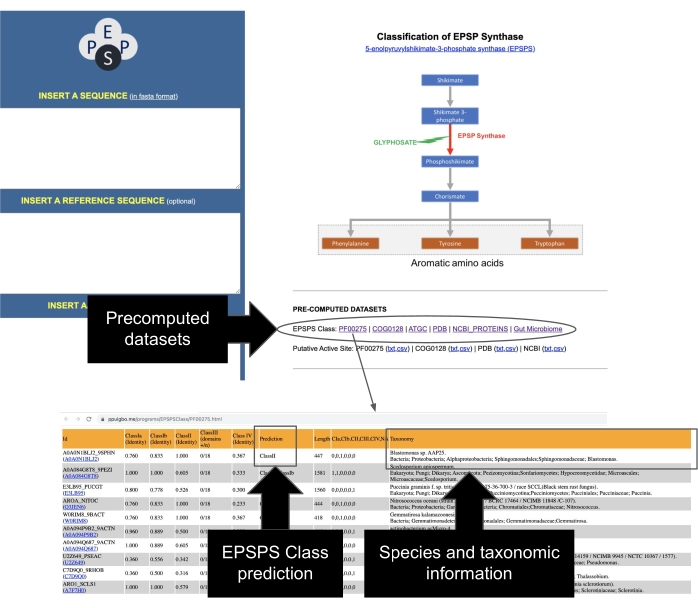
Figura 7: Acesso a conjuntos de dados pré-computados de sequências EPSPS. Siga as indicações na figura para acessar o conjunto de dados pré-computado das sequências EPSPS. Clique aqui para ver uma versão maior desta figura.
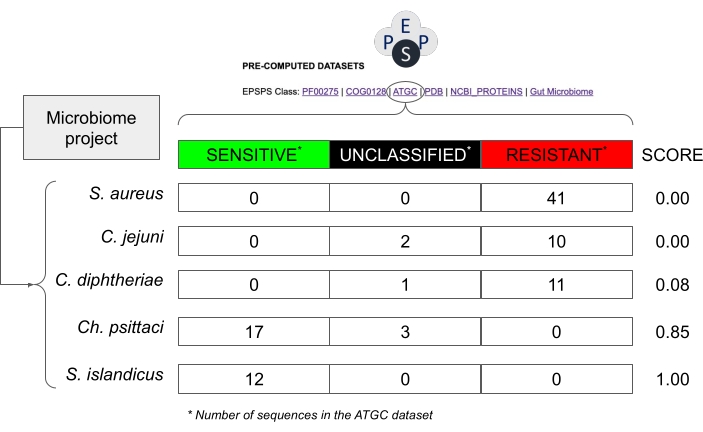
Figura 8: Exemplo de como estimar a sensibilidade potencial em projetos de microbioma sem sequências de EPSPS. O exemplo usa valores do banco de dados de Clusters Genômicos Apertados Alinhados30, que contém sequências de espécies procarióticas. Espécies hipotéticas de um projeto de microbioma são Staphylococcus aureus, Corynebacterium difhtheriae, Campylobacter jejuni, Chlamydia psittaci e Sulfolobus islandicus. O escore de sensibilidade ao glifosato é calculado como Number_Sensitive_Sequences/Total_Number_Of_Sequences. Clique aqui para ver uma versão maior desta figura.
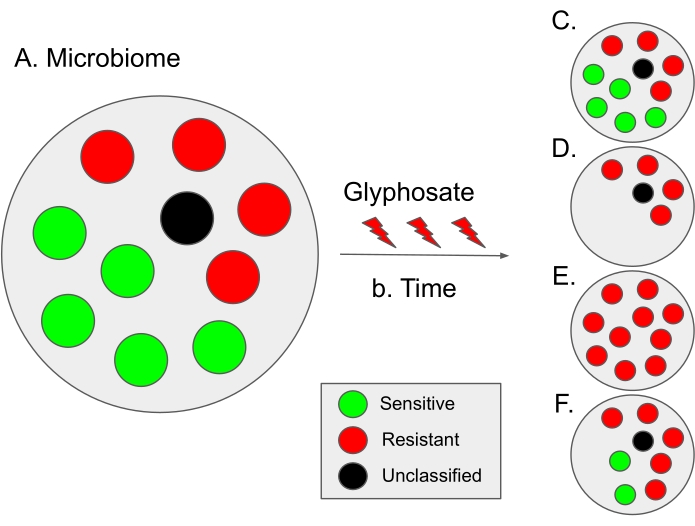
Figura 9: Esquema de interpretação dos resultados deste protocolo e cenários evolutivos hipotéticos. (A) Em um microbioma, a proporção de sensibilidade potencial (em verde) e resistência (em vermelho) bactérias é de aproximadamente 50:50. Pontos negros denotam espécies microbianas não classificadas; assim, sua sensibilidade ao glifosato é desconhecida. Em alguns microbiomas, a proporção de bactérias sensíveis é ligeiramente maior, como no microbioma intestinal humano12. (B) Com o tempo, o uso do glifosato pode levar à disbiose microbiana (ou seja, um desequilíbrio na proporção de bactérias sensíveis e resistentes) levando a diferentes cenários hipotéticos. (C) Caso hipotético 1 (sem seleção): O uso do glifosato não influencia o microbioma; assim, a proporção de bactérias sensíveis e resistentes permanece constante. (D) Caso hipotético 2: O uso do glifosato remove bactérias sensíveis ao glifosato da população. Especulamos que este cenário pode ser dependente de doses. (E) Caso hipotético 3: A pressão de seleção do uso do glifosato aumenta as mutações no gene EPSPS que alteram o estado de sensibilidade das bactérias. Assim, toda a população microbiana torna-se resistente ao glifosato. Além disso, neste cenário, pode haver um aumento de bactérias multirresistentes. (F) Caso hipotético 4: o uso de glifosato altera a composição de determinadas espécies bacterianas, produzindo um desequilíbrio em relação às bactérias resistentes, enquanto algumas espécies bacterianas permanecem sem alterações, possivelmente devido a mecanismos resistentes adicionais, como bombas de efflux ou por superexpressão do gene EPSPS 13. Esse cenário também pode levar a um aumento de bactérias resistentes ao glifosato, bem como um aumento da resistência bacteriana a antibióticos adicionais. Clique aqui para ver uma versão maior desta figura.
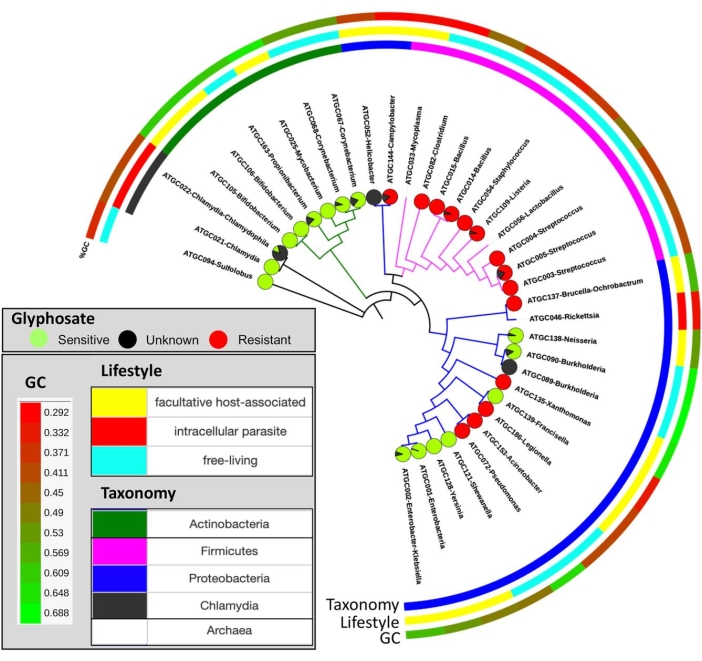
Figura 10: Distribuição da sensibilidade prevista ao glifosato em toda a árvore da espécie. Gráficos de tortas indicam a proporção de espécies que são putativamente sensíveis (verde) ou resistentes (vermelho) ao glifosato, e não classificadas (pretas). Este valor foi adaptado com permissão de Rainio et al.14. Clique aqui para ver uma versão maior desta figura.
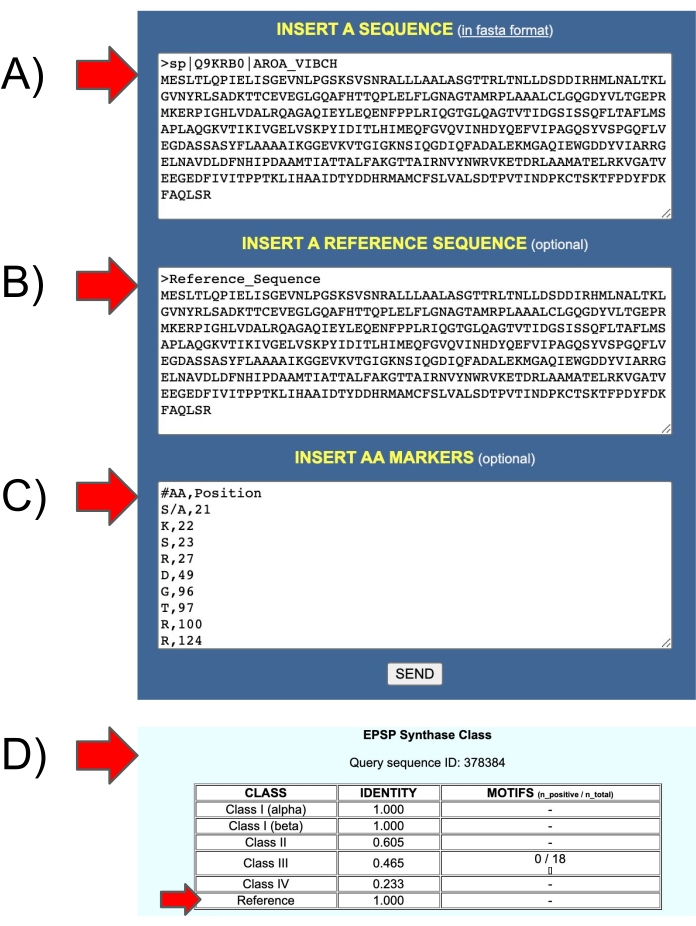
Figura 11: Entradas e saídas do servidor web EPSPSClass para testar a sequência de referência do próprio usuário. (A) Entrada 1: sequência de consulta. (B) Entrada 2: sequência de referência. (C) Entrada 3: marcadores de aminoácidos nas sequências de referência. (D) Saída: identidade: fração de marcadores de aminoácidos nas sequências de consulta (classe I-IV e sequências de referência do próprio usuário). Clique aqui para ver uma versão maior desta figura.
Tabela 1: Lista de primers para amplificação pcr de 16S ração e região ITS na análise de microbioma Por favor clique aqui para baixar esta Tabela.
Tabela 2: Códigos da enzima 5-enolpyruvylshikimate-3-fosfato synthase (EPSPS) em diferentes bancos de dados Clique aqui para baixar esta Tabela.
Tabela 3: Concentração média de glifosato Clique aqui para baixar esta Tabela.
Tabela 4: Tabela sumária da porcentagem de espécies sensíveis/resistentes ao glifosato. Esta tabela foi adaptada com permissão de Rainio et al.14. Clique aqui para baixar esta Tabela.
Tabela 5: Posições dos marcadores de aminoácidos nas sequências de referência Clique aqui para baixar esta Tabela.
Discussão
Este protocolo fornece orientação geral sobre como quantificar o efeito do GBP em microbiomas com base na análise da proteína EPSPS. O protocolo tem três grandes etapas críticas: (i) Quantificação da proteína EPSPS a partir de dados de microbioma. Esta etapa é fundamental porque o EPSPS é a enzima alvo direta do herbicida. Assim, as espécies que possuem uma cópia do gene EPSPS podem ser impactadas pelo uso de GBP. No entanto, mesmo espécies que não possuem cópia do gene EPSPS podem ser impactadas pelo herbicida através de mecanismos alternativos não-alvo43,44. (ii) Se a análise do gene EPSPS não estiver incluída no desenho do estudo, é possível obter uma boa estimativa analisando o rRNA 16S (bactérias) ou ITS (fungos). Neste caso, é essencial contar com uma tabela de referência abrangente (por exemplo, o banco de dados ATGC fornece sequências da proteína EPSPS de várias espécies intimamente relacionadas). (iii) A proteína EPSPS é dividida em potencialmente sensível ou resistente ao glifosato, dependendo de certos resíduos de aminoácidos do local ativo do EPSPS. No entanto, mutações que afetam um único aminoácido podem alterar essa classificação45 e transições entre as classes podem ocorrer em um período relativamente curto detempo 14.
A sensibilidade potencial dos organismos ao glifosato pode ser determinada por genomas de referência, marcadores de aminoácidos e alinhamentos de sequências. (i) Genomas de referência: A enzima EPSPS pode ser classificada como potencialmente sensível (classe I [alfa ou beta]46,47) ou resistente (classes II48,49, III50 e IV51) ao glifosato com base na presença de marcadores e motivos de aminoácidos (no caso da classe III). Estes marcadores e motivos de aminoácidos baseiam-se na localização de resíduos de aminoácidos na proteína EPSPS de Vibrio cholerae (vcEPSPS, classe I), Coxiella burnetii (cbEPSPS, classe II), Brevundimonas vesicularis (bvEPSPS, classe III) e Streptomyces davawensis (sdEPSPS, classe IV). (ii) Marcadores de aminoácidos: O glifosato interage com a enzima EPSPS e compete com fosfoenolpyruvate (PEP, o segundo substrato da enzima EPSPS)52,53. Em certas espécies, pequenas alterações de aminoácidos na sequência de EPSPS proporcionam maior afinidade para o PEP e uma resistência ao glifosato 12,14,52,54,55. Em outras sequências, o glifosato liga a sequência EPSPS em uma conformação não inibitória 45. Embora muitas sequências resistentes de 12,14,48,49,52,54,55 e tolerantes 56,57 sequências de EPSP ao glifosato tenham sido descritas, o sistema de classificação atual para o EPSPS é dividido em quatro classes principais (I-IV )12 (Tabela 5 ). (iii) Alinhamentos de sequência: Para classificar uma enzima EPSPS, realizamos alinhamentos em pares, com um alinhamento de sequência múltipla de parâmetros padrão do programa35-, da sequência de consulta contra cada uma das sequências de referência (vcEPSPS, cbEPSPS, bvEPSPS e sdEPSPS). Esses alinhamentos são necessários para identificar as posições dos marcadores de aminoácidos na sequência de consulta. Como resultado, uma enzima é classificada como descrita de12 classes I, II e/ou IV com base na presença de marcadores de aminoácidos e marcadores de motivos baseados na classe III.
O protocolo é baseado em quatro tipos conhecidos de EPSPS: um tipo é sensível, os outros três são resistentes). No entanto, aproximadamente 10% das sequências de EPSPS em procariotes ainda não são classificadas (16% em archaea e 8% em bactérias)12. Assim, novas pesquisas devem analisar essas sequências para determinar a sensibilidade do glifosato. O servidor EPSPSClass oferece uma opção para testar novos marcadores genéticos. A identificação de classes conhecidas do EPSPS é simples, como mostrado na seção 4.4. e Figura 5. Além disso, nos casos em que os usuários querem comparar suas próprias proteínas de consulta e referência, o servidor oferece uma opção para incluir manualmente uma sequência de referência e um conjunto de marcadores de aminoácidos (Figura 11). Esta opção pode ser utilizada para identificar novas classes do EPSPS, bem como para testar outros herbicidas e sequências de destino.
A análise da classe EPSPS é determinada pela análise de sequência e pela presença/ausência de marcadores de aminoácidos. Esta é uma estimativa preliminar que pode ser usada para testes de hipóteses no campo. Os marcadores de aminoácidos foram determinados na literatura com base em estudos empíricos e observacionais 46,47,48,49,50,51. No entanto, sequências proteicas de referência para determinar a classe EPSPS foram testadas apenas em um número limitado de espécies e podem ocasionalmente não explicar a resistência ao glifosato. O efeito de mutações compensatórias e domínios associados ao EPSPS (principalmente em fungos) também podem afetar a sensibilidade ao glifosato58. A análise deste artigo é baseada em quatro classes EPSPS. Um levantamento de bactérias no microbioma intestinal humano mostrou que cerca de 30% delas não foram classificadas (ou seja, proteínas EPSPS dessas espécies não pertencem a nenhuma das classes conhecidas), e estudos adicionais são necessários para identificar outras classes EPSPS. Além disso, deve-se notar que a sequência de proteínas EPSPS em bactérias e plantas é unidomain, enquanto as proteínas Fúngicos EPSPS contêm vários domínios59. Assim, uma proteína dobrável em fungos pode levar a uma resposta diferente da enzima EPSPS ao glifosato. Além disso, não são considerados mecanismos adicionais de resistência não-alvo (por exemplo, bombas efflux e superexpressão do gene EPSPS 13) ou sensibilidade ao glifosato (por exemplo, o efeito do glifosato na cadeia de transporte mitocondrial12).
Embora os GBPs existam como um herbicida desde 1974 e tenham sido amplamente utilizados desde 1991, este é o primeiro método bioinforático a determinar a sensibilidade potencial dos organismos ao glifosato. O método baseia-se na identificação de resíduos conhecidos de aminoácidos na sequência alvo. Assim, nosso método fornece uma estimativa de linha de base do efeito potencial do glifosato na espécie. Em um futuro próximo, novos métodos de bioinformática devem incluir classes adicionais da proteína EPSPS para determinar a sensibilidade potencial ao glifosato de sequências não classificadas 12,54,55. Além disso, dado que o comportamento exato da enzima EPSPS pode variar de acordo com as alterações únicas de aminoácidos 12,14,52,54,55, mais adiante nos experimentos de silico devem levar em conta pequenas variações na dobra da proteína EPSPS, bem como o efeito dos domínios associados ao EPSPS na estrutura proteica em fungos 58 . Além disso, mostrou-se que a tolerância ao glifosato pode ser produzida pela superexpressão da proteína EPSPS56,57; assim, análises bioinformáticas baseadas na amenização do uso decodon 60 podem ser utilizadas para identificar novas sequências de EPSPS que maximizam ou minimizam a expressão genética.
Agricultores, políticos e tomadores de decisão precisam urgentemente de uma compreensão completa dos riscos associados ao uso pesado de pesticidas. Assim, ambas as ferramentas bioinformáticas que revelam a sensibilidade potencial dos organismos a pesticidas e estudos experimentais bem replicados, randomizados e realistas de campo realizados em diferentes ambientes são necessários. O método bioinforático apresentado projetado para examinar a sensibilidade dos organismos ao glifosato pode ser modulado para outros pesticidas. Da mesma forma, os métodos de ecologia experimental podem ser aplicados para estudar quaisquer questões ecológicas relacionadas. Juntos, os métodos podem ser usados para demonstrar baixas entre observações de campo, dados genômicos e uso de pesticidas. Todos os métodos apresentados são inestimáveis na avaliação de riscos. Métodos bioinforáticos podem ser utilizados, por exemplo, no monitoramento de adaptações microbianas a agrotóxicos e para fornecer um método quantitativo para testar os potenciais outros riscos associados, como o aumento da resistência de patógenos a agrotóxicos, efeitos negativos sobre micróbios usados como agentes de controle biológico no manejo integrado de pragas (IPM) e resistência a antibióticos em bactérias.
Divulgações
Conflitos de interesse: nenhum.
Agradecimentos
Este trabalho foi financiado pela Academia da Finlândia (conceder no. 311077 a Marjo Helander).
Materiais
| Name | Company | Catalog Number | Comments |
| 2100 Bioanalyzer Instrument | Agilent | G2939B | To check the concentration and quality of PCR products |
| dNTP mix (10 mM each) | ThermoFisher Scientific | R0192 | For PCR reactions |
| GoTaq G2 DNA Polymerase kit | Promega | M7848 | PCR buffer and DNA Polymerase for PCR amplification |
| Invisorb Spin Plant Mini Kit | INVITEK Molecular | 1037100300 | Genomic DNA extraction from plant tissues |
| Ion Chip Minifuge | ThermoFisher Scientific | 4479672 | For targeted sequencing of microbial PCR products |
| Ion PGM System | ThermoFisher Scientific | 4462921 | For targeted sequencing of microbial PCR products |
| Ion PGM Torrent Server | ThermoFisher Scientific | 4483643 | For targeted sequencing of microbial PCR products |
| Pippinprep | SageScience | PIP0001 | For size fractionation of PCR amplicons |
| Pressure tank | Berthoud | 102140 | For sprayin glyphosate based products in field |
| Primers | Sigma Aldrich | Custom-made | For PCR amplification |
| Rotary tiller | Grillo | 984511 | For tilling the soil in experimental plots |
| S1000 ThermalCycler | BIO-RAD | 1852196 | For PCR amplification |
Referências
- Williams, G. M., Kroes, R., Munro, I. C. Safety evaluation and risk assessment of the herbicide Roundup and its active ingredient, glyphosate, for humans. Regulatory Toxicology and Pharmacology. 31, 117-165 (2000).
- Muola, A., et al. Risk in the circular food economy: Glyphosate-based herbicide residues in manure fertilizers decrease crop yield. The Science of the Total Environment. 750, 141422 (2021).
- Helander, M., Saloniemi, I., Saikkonen, K. Glyphosate in northern ecosystems. Trends in Plant Science. 17 (10), 569-574 (2012).
- Fuchs, B., Saikkonen, K., Helander, M. Glyphosate-Modulated Biosynthesis Driving Plant Defense and Species Interactions. Trends in Plant Science. 26 (4), 312-323 (2021).
- Helander, M., Saloniemi, I., Omacini, M., Druille, M., Salminen, J. -. P., Saikkonen, K. Glyphosate decreases mycorrhizal colonization and affects plant-soil feedback. The Science of the Total Environment. 642, 285-291 (2018).
- Bai, S. H., Ogbourne, S. M. Glyphosate: environmental contamination, toxicity and potential risks to human health via food contamination. Environmental Science and Pollution Research International. 23 (19), 18988-19001 (2016).
- Cuhra, M., Bøhn, T., Cuhra, P. Glyphosate: too much of a good thing. Frontiers in Environmental Science. 4, (2016).
- de Brito Rodrigues, L., et al. Impact of the glyphosate-based commercial herbicide, its components and its metabolite AMPA on non-target aquatic organisms. Mutation Research. 842, 94-101 (2019).
- Steinrücken, H. C., Amrhein, N. The herbicide glyphosate is a potent inhibitor of 5-enolpyruvylshikimic acid-3-phosphate synthase. Biochemical and Biophysical Research Communications. 94 (4), 1207-1212 (1980).
- Bentley, R. The shikimate pathway--a metabolic tree with many branches. Critical Reviews in Biochemistry and Molecular Biology. 25 (5), 307-384 (1990).
- Richards, T. A., et al. Evolutionary origins of the eukaryotic shikimate pathway: gene fusions, horizontal gene transfer, and endosymbiotic replacements. Eukaryotic Cell. 5 (9), 1517-1531 (2006).
- Leino, L., et al. Classification of the glyphosate target enzyme (5-enolpyruvylshikimate-3-phosphate synthase) for assessing sensitivity of organisms to the herbicide. Journal Of Hazardous Materials. 408, 124556 (2021).
- Rainio, M. J., Ruuskanen, S., Helander, M., Saikkonen, K., Saloniemi, I., Puigbò, P. Adaptation of bacteria to glyphosate: a microevolutionary perspective of the enzyme 5-enolpyruvylshikimate-3-phosphate (EPSP) synthase. BioRxiv. , (2020).
- Rainio, M. J., Ruuskanen, S., Helander, M., Saikkonen, K., Saloniemi, I., Puigbò, P. Adaptation of bacteria to glyphosate: a microevolutionary perspective of the enzyme 5-enolpyruvylshikimate-3-phosphate synthase. Environmental Microbiology Reports. 13 (3), 309-316 (2021).
- Helander, M., Pauna, A., Saikkonen, K., Saloniemi, I. Glyphosate residues in soil affect crop plant germination and growth. Scientific Reports. 9 (1), 19653 (2019).
- Ruuskanen, S., Rainio, M. J., Uusitalo, M., Saikkonen, K., Helander, M. Effects of parental exposure to glyphosate-based herbicides on embryonic development and oxidative status: a long-term experiment in a bird model. Scientific Reports. 10 (1), 6349 (2020).
- Ruuskanen, S., et al. female preference and adverse developmental effects of glyphosate-based herbicides on ecologically relevant traits in Japanese quails. Environmental Science & Technology. 54 (2), 1128-1135 (2020).
- Mäki, A., Rissanen, A. J., Tiirola, M. A practical method for barcoding and size-trimming PCR templates for amplicon sequencing. Biotechniques. 60 (2), 88-90 (2016).
- Chelius, M. K., Triplett, E. W. The diversity of archaea and bacteria in association with the roots of Zea mays L. Microbial Ecology. 41 (3), 252-263 (2001).
- Lane, D. J. 16S/23S rRNA sequencing. Nucleic acid techniques in bacterial systematics. , 115-175 (1991).
- Ghyselinck, J., Pfeiffer, S., Heylen, K., Sessitsch, A., De Vos, P. The effect of primer choice and short read sequences on the outcome of 16S rRNA gene based diversity studies. Plos One. 8 (8), 71360 (2013).
- Zheng, D., Alm, E. W., Stahl, D. A., Raskin, L. Characterization of universal small-subunit rRNA hybridization probes for quantitative molecular microbial ecology studies. Applied and Environmental Microbiology. 62 (12), 4504-4513 (1996).
- . JoVE Supplementary Material Available from: https://ppuigbo.me/programs/EPSPSClass/JOVE_SM (2021)
- . Alignments Conserved Positions Available from: https://ppuigbo.me/programs/primers (2021)
- . NCBI GenBank Available from: https://www.ncbi.nim.nih.gov/genbank (2021)
- . COG Database Available from: https://www.ncbi.nim.nih.gov/research/cog (2021)
- . Protein Data Bank Available from: https://www.rcsb.org (2021)
- . EPSPSClass Available from: https://ppuigbo.me/programs/EPSPSClass (2021)
- Kristensen, D. M., Wolf, Y. I., Koonin, E. V. ATGC database and ATGC-COGs: an updated resource for micro- and macro-evolutionary studies of prokaryotic genomes and protein family annotation. Nucleic Acids Research. 45, 210-218 (2017).
- . CSC - IT CENTER FOR SCIENCE LTD Available from: https://www.csc.fi (2021)
- Altschul, S. F., Gish, W., Miller, W., Myers, E. W., Lipman, D. J. Basic local alignment search tool. Journal of Molecular Biology. 215 (3), 403-410 (1990).
- Edgar, R. C. MUSCLE: multiple sequence alignment with high accuracy and high throughput. Nucleic Acids Research. 32 (5), 1792-1797 (2004).
- Tkacz, A., Hortala, M., Poole, P. S. Absolute quantitation of microbiota abundance in environmental samples. Microbiome. 6 (1), 110 (2018).
- El-Gebali, S., et al. The Pfam protein families database in 2019. Nucleic Acids Research. 47, 427-432 (2019).
- Benson, D. A., et al. GenBank. Nucleic Acids Research. 41, 36-42 (2013).
- Galperin, M. Y., Makarova, K. S., Wolf, Y. I., Koonin, E. V. Expanded microbial genome coverage and improved protein family annotation in the COG database. Nucleic Acids Research. 43, 261-269 (2015).
- Burley, S. K., Berman, H. M., Kleywegt, G. J., Markley, J. L., Nakamura, H., Velankar, S. Protein data bank (PDB): the single global macromolecular structure archive. Methods in Molecular Biology. 1607, 627-641 (2017).
- Raoult, D., Hadjadj, L., Baron, S. A., Rolain, J. -. M. Role of glyphosate in the emergence of antimicrobial resistance in bacteria. The Journal of Antimicrobial Chemotherapy. 76 (7), 1655-1657 (2021).
- Liu, J., Gefen, O., Ronin, I., Bar-Meir, M., Balaban, N. Q. Effect of tolerance on the evolution of antibiotic resistance under drug combinations. Science. 367 (6474), 200-204 (2020).
- Peixoto, F. Comparative effects of the Roundup and glyphosate on mitochondrial oxidative phosphorylation. Chemosphere. 61 (8), 1115-1122 (2005).
- Peillex, C., Pelletier, M. The impact and toxicity of glyphosate and glyphosate-based herbicides on health and immunity. Journal of Immunotoxicology. 17 (1), 163-174 (2020).
- Funke, T., Han, H., Healy-Fried, M. L., Fischer, M., Schönbrunn, E. Molecular basis for the herbicide resistance of Roundup Ready crops. Proceedings of the National Academy of Sciences of the United States of America. 103 (35), 13010-13015 (2006).
- Light, S. H., Krishna, S. N., Minasov, G., Anderson, W. F. An unusual cation-binding site and distinct domain-domain interactions distinguish Class II Enolpyruvylshikimate-3-phosphate synthases. Biochemistry. 55 (8), 1239-1245 (2016).
- Firdous, S., Iqbal, S., Anwar, S., Jabeen, H. Identification and analysis of 5-enolpyruvylshikimate-3-phosphate synthase (EPSPS) gene from glyphosate-resistant Ochrobactrum intermedium Sq20. Pest Management Science. 74 (5), 1184-1196 (2018).
- Barry, G. F., Kishore, G. M., Padgette, S. R., Stallings, W. C. Glyphosate-tolerant 5-enolpyruvylshikimate-3-phosphate synthases. United States Patient. , (1997).
- Priestman, M. A., Funke, T., Singh, I. M., Crupper, S. S., Schönbrunn, E. 5-Enolpyruvylshikimate-3-phosphate synthase from Staphylococcus aureus is insensitive to glyphosate. FEBS Letters. 579, 728-732 (2005).
- Carozzi, N., Carr, B., Hammer, P. E. Identification of a new class of EPSP synthases. World Intellectual Property Organization Publ.of the Int.Appl. without Int.search. , (2006).
- Lira, J. M., Cicchillo, R. M., Nair, S. K. Novel class of glyphosate resistance genes. US Patent. , (2013).
- Funke, T., et al. Structural basis of glyphosate resistance resulting from the double mutation Thr97 -> Ile and Pro101 -> Ser in 5-enolpyruvylshikimate-3-phosphate synthase from Escherichia coli. The Journal of Biological Chemistry. 284 (15), 9854-9860 (2009).
- Schönbrunn, E., et al. Interaction of the herbicide glyphosate with its target enzyme 5-enolpyruvylshikimate 3-phosphate synthase in atomic detail. Proceedings of the National Academy of Sciences of the United States of America. 98 (4), 1376-1380 (2001).
- Stalker, D. M., Hiatt, W. R., Comai, L. A single amino acid substitution in the enzyme 5-enolpyruvylshikimate-3-phosphate synthase confers resistance to the herbicide glyphosate. The Journal of Biological Chemistry. 260 (8), 4724-4728 (1985).
- Eschenburg, S., Healy, M. L., Priestman, M. A., Lushington, G. H., Schönbrunn, E. How the mutation glycine96 to alanine confers glyphosate insensitivity to 5-enolpyruvyl shikimate-3-phosphate synthase from Escherichia coli. Planta. 216 (1), 129-135 (2002).
- Achary, V. M. M., et al. Overexpression of improved EPSPS gene results in field level glyphosate tolerance and higher grain yield in rice. Plant Biotechnology Journal. 18 (12), 2504-2519 (2020).
- Huang, Z., Liu, Y., Zhang, C., Jiang, C., Huang, H., Wei, S. Molecular basis of natural tolerance to glyphosate in Convolvulus arvensis. Scientific Reports. 9 (1), 8133 (2019).
- Tall, T. . A census analysis of the 5-enolpyruvylshikimate-3-phosphate (EPSP) synthase and EPSP-associated domains. , (2020).
- Tall, T., Puigbò, P. The glyphosate target enzyme 5-Enolpyruvyl Shikimate 3-Phosphate Synthase (EPSPS) contains several EPSPS-associated domains in fungi. ATLA Summary of Proceedings. 76 (1), 6 (2020).
- Puigbò, P., Guzmán, E., Romeu, A., Garcia-Vallvé, S. OPTIMIZER: a web server for optimizing the codon usage of DNA sequences. Nucleic Acids Research. 35, 126-131 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados