Method Article
Expansão do Kit de Ferramentas para Imagens In Vivo do Transporte Axonal
Neste Artigo
Resumo
Usando camundongos fluorescentes transgênicos, protocolos detalhados são descritos para avaliar o transporte in vivo axonal de endosários e mitocôndrias dentro de axônios motores e sensoriais do nervo ciático intacto em animais vivos.
Resumo
O transporte axonal mantém a homeostase neuronal, possibilitando o tráfico bidirecional de diversas organelas e cargas. Interrupções no transporte axonal têm consequências devastadoras para os neurônios individuais e suas redes, e contribuem para uma infinidade de distúrbios neurológicos. Como muitas dessas condições envolvem mecanismos autônomos e não autônomos celulares, e muitas vezes exibem um espectro de patologia entre subtipos neuronais, métodos para identificar e analisar com precisão subconjuntos neuronais são imperativos.
Este artigo detalha protocolos para avaliar o transporte axonal in vivo de endosários de sinalização e mitocôndrias em nervos ciáticos de camundongos anestesiados. Instruções stepwise são fornecidas a 1) distinguir motor de neurônios sensoriais in vivo, in situ e ex vivo , utilizando camundongos que expressam seletivamente proteínas fluorescentes dentro de neurônios motores colinérgicos; e 2) avaliar separadamente ou simultaneamente o transporte axonal in vivo de endosários e mitocôndrias de sinalização. Essas abordagens intravitais complementares facilitam a imagem simultânea de diferentes cargas em axônios nervosos periféricos distintos para monitorar quantitativamente o transporte axonal em saúde e doenças.
Introdução
O sistema nervoso periférico (PNS) conecta o sistema nervoso central (SNC) aos seus alvos distais, permitindo que o relé de sinais eferentes exerça controle motor e sinais diferentes para fornecer feedback sensorial. Usando a infinidade de avanços na genética dos camundongos, os cientistas desenvolveram diferentes modelos de camundongos para investigar muitas doenças/síndromes que afligem a PNS 1,2,3. Como a maioria das patologias neurodegenerativas são multifatoriais com contribuições autônomas celulares e não autônomas 4,5, desembaraçar patologias específicas de células/neurônios pode fornecer novas percepções cruciais sobre mecanismos de doença.
Para isso, o desenvolvimento de cromossomo artificiais bacterianos (BAC)-transgênicos camundongos6 permitiu a expressão endógena seletiva de proteínas fluorescentes em subconjuntos direcionados de neurônios. Por exemplo, camundongos BAC-transgênicos estão disponíveis, que expressam proteína fluorescente verde (GFP) em neurônios colinérgicos7 ou glicocinérgicos8, ou uma variante de proteína fluorescente vermelha (tdTomato) em neurônios parvalbumina-positivos9. Alternativamente, a expressão neuronal seletiva de proteínas fluorescentes pode ser alcançada através da tecnologia Cre-loxP 10. Por exemplo, cepas de camundongos expressando Cre-recombinase em subconjuntos de neurônios (por exemplo, acetiltransferase de colina (ChAT)-Cre) podem ser criadas com camundongos que expressam uma proteína fluorescente (por exemplo, tdTomato ou GFP) de um lócus constitutivo (por exemplo, Gt(ROSA)26Sor) sob o controle de um repressor transcricional ladeado pelos locais loxP11 (por exemplo, gerando ratos que expressam tdTomato apenas em neurônios colinérgicos). De fato, usando a recombinação Cre-loxP, foram gerados camundongos transgênicos que expressam proteína fluorescente amarela em axônios do trato corticospinaldescendente 12.
Além disso, os recentes avanços na edição de genes CRISPR/Cas9, como o ORANGE, permitem a marcação fluorescente de múltiplas proteínas neuronais endógenas, com expressão alcançável na resolução de nanoescala13. Além disso, em combinação com cepas de camundongos que expressam Cre, orange-cake pode ser usado para marcar múltiplas proteínas endógenas em neurônios individuais13. Alternativamente, o rastreamento neuronal mediado por virais também permite a rotulagem de subconjuntos neuronais e pode ser alcançado com combinações direcionadas de sorotipos virais e/ou promotores específicos de células 14,15,16,17.
Além dos métodos de rotulagem neuronal, as linhas de camundongos também foram projetadas para expressar proteínas repórteres direcionadas a organelas específicas, como mitocôndrias expressando proteína fluorescente de ciano (Mito.CFP)18 ou autofagossos expressando GFP (LC3.GFP)19. Além disso, as linhas de camundongos foram projetadas para avaliar a dinâmica do cálcio especificamente em neurônios (por exemplo, Thy1.GCaMP)20,21. Ao todo, com o avanço desses modelos, novas aplicações experimentais permitem aos cientistas fazer perguntas biológicas e patológicas mais precisas sobre o CNS e a PNS.
O principal papel dos nervos motores periféricos é transmitir sinais elétricos ao músculo esquelético para provocar movimentos. Além disso, e ocorrendo em escalas de tempo mais longas, mensagens neuroquímicas e fisiológicas na forma de organelas diversas (por exemplo, mitocôndrias, endólises, endossomos, endomentosomos) atravessam a rede citoesqueletal de forma uni ou bidirecional para ajudar a manter a homeostase neuronal 22,23,24. Os prejuízos no transporte axonal têm consequências desastrosas para a saúde neuronal e estão ligados a muitas doenças neurodesenvolvimentares e neurodegenerativas25. No nível molecular, os prejuízos no transporte axonal podem interromper eventos fisiológicos que regulam a sinalização sináptica e a plasticidade, transcrição genética e tradução local ao longo do axônio26,27. Embora exista uma infinidade de ferramentas para estudar esses eventos em células/neurônios cultivados28,29, avaliar a dinâmica do transporte axonal e eventos biológicos ligados axonal in vivo são necessários para confirmar insights-chave sobre processos fisiológicos e patológicos30.
Ao longo dos anos, o Laboratório Schiavo otimizou protocolos para tirar diversas dúvidas sobre o transporte axonal 31,32,33,34,35,36. Esses experimentos expandiram-se a partir da descoberta de que um fragmento atóxico fluorescentemente rotulado de neurotoxina tétano (HCT) é internalizado em terminais de axônio no músculo esquelético através de interações com nidogens e polisialogangliosides37. Uma vez internalizado, HCT é retrógradamente transportado em rab7-positivo, neurotrophin-contendo endossósias que são destinados para os corpos celulares de neurônios motores e sensoriais 38,39,40,41. Em paralelo, os avanços na tecnologia de imagem permitiram a análise em tempo real de feixes nervosos periféricos e axônios individuais em ratos vivos e anestesiados30. A primeira incursão na avaliação da dinâmica do transporte axonal in vivo na patologia revelou prejuízos pré-síntomicos no transporte de endosários de sinalização e mitocôndrias no modelo de camundongos SOD1G93A de esclerose lateral amiotrófica (ELA)35. É importante ressaltar que esses defeitos dificilmente representarão simplesmente consequências secundárias da neurodegeneração, dado a constatação de que a perda de neurônios motores pode ocorrer na ausência de perturbações de transporte axonal em um modelo de rato da doença de Kennedy42 e um modelo de FUS mutante heterozigoso de ALS43. Esses déficits de transporte axonal podem ser corrigidos em camundongos da ALS usando inibidores de quinases específicas33 ou receptores de fator de crescimento34. Além disso, tratar neurônios com um bloqueador de histone deacetilado específico altera o transporte mitocondrial in vivo36. Mais recentemente, relatamos que a modulação dependente de BDNF do transporte axonal é desregulada em subtipos distintos de neurônios motores em camundongosALS 44.
Usando um kit de ferramentas em constante expansão para avaliar a dinâmica do transporte axonal 28,29, este protocolo de vídeo descreve várias aplicações que permitirão mais insights sobre diferentes cenários biológicos e patológicos. Em primeiro lugar, camundongos transgênicos que expressam seletivamente proteínas fluorescentes em neurônios colinérgicos (ou seja, neurônios motores) são usados para discriminar entre axônios motores e sensoriais tanto in vivo quanto ex vivo. HCT fluorescentemente rotulado é então carregado em endossóis de sinalização em três linhas transgênicas para diferenciar a dinâmica de transporte axonal em neurônios periféricos distintos. O próximo protocolo experimental detalha uma abordagem de fluorescência multiplex para avaliar o transporte mitocondrial especificamente em neurônios motores, criando camundongos ChAT.tdTomato com camundongos Mito-CFP. Finalmente, são fornecidas instruções sobre como imaginar simultaneamente mitocôndrias e endossários de sinalização dentro do mesmo axônio in vivo.
Protocolo
Todos os manuseios e experimentos de camundongos foram realizados de acordo com a Lei de Animais (Procedimentos Científicos) (1986) e foram aprovados pelo Comitê de Ética do Instituto queen square de neurologia.
1. Animais
- Abrigam todos os animais em gaiolas ventiladas individualmente em um ambiente controlado pela temperatura e umidade e os mantêm em um ciclo claro/escuro de 12 horas com acesso a ad libitum a alimentos e água.
- Use camundongos machos e fêmeas das seguintes cepas transgênicas: 1) camundongos Tg heterozigous (Chat-EGFP) GH293Gsat/Mmucd, chamados de camundongos ChAT.eGFP; 2) heterozigos B6.Cg-Tg(Hlxb9-GFP)1Tmj/J, referido como HB9. Ratos GFP; e 3) heterozigos B6.Cg-Tg (Thy1-CFP/COX8A)S2Lich/J, referidos como camundongos Mito.CFP.
- Gerar camundongos ChAT.tdTomato cruzando homozigos B6;129S6-Chat tm2(cre)Lowl/J, conhecidos como camundongos ChAT.Cre, com homozigous B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J, referido como camundongos Rosa26.tdTomato.
- Gerar ratos ChAT.tdTomato::Mito.CFP cruzando camundongos heterozigous ChAT.tdTomato com camundongos mito.CFP heterozigous.
2. Injeções intramusculares de HCT fluorescente
- Preparação pré-cirurgia
- Express HCT (HCT441, resíduos 875-1315) fundidos a uma etiqueta melhorada e rica em cisteína em bactérias como uma proteína de fusão glutatione-S-transferase por 45. Rotule HCT com AlexaFlour555 C2 maleimide31, dialise-lo em tampão de diálise gelada (10 mM HEPES-NaOH, 100 mM NaCl, pH 7.4), congelá-lo em nitrogênio líquido, e armazená-lo a -80 °C. Antes de realizar experimentos in vivo , primeiro teste HCT in vitro para captação e transporte bem-sucedidos em neurônios primários.
- Diluir hct fluorescente (por exemplo, HCT-555) para uma concentração final e experimentalmente consistente variando de 2,5 a 10 μg/μL em soro fisco estéril tamponado de fosfato (PBS) em um tubo de 0,2 mL. Nesta etapa, adicione mais compostos/fatores à solução HCT, se necessário (por exemplo, fator neurotrófico derivado do cérebro).
NOTA: O volume final deve ser apropriado para o tamanho dos músculos de interesse. Por exemplo, prepare um volume de injeção de 3-4 μL para o músculo tibialis anterior (TA) e ~1 μL para o músculo soleus menor. Mantenha a concentração de trabalho de HCT entre 2,5 e 10 μg/μL independentemente do volume final. - Misture a solução HCT usando uma pipeta ou vórtice, e gire brevemente a baixa velocidade usando uma centrífuga de desktop para coletar o líquido e remover grandes bolhas. Proteja o HCT da luz e transporte no gelo.
- Use uma micropipette de vidro puxada para injeções intramusculares ideais em músculos menores (por exemplo, soleus) ou para injeções intrascáticas nervosas. Puxe micropipettos de vidro classificados (por 46) antes da cirurgia.
NOTA: Para permitir a tubulação e restringir o fluxo para cima e para fora da parte de trás da micropipette, quebre cuidadosamente uma pequena peça da ponta afiada usando fórceps finos sob um microscópio dissecando. Tome cuidado para descartar a extremidade quebrada na lixeira apropriada. - Esterilize e limpe todas as ferramentas cirúrgicas antes do uso.
- Injeções intramusculares cirúrgicas
- Prepare-se para a cirurgia, fixando uma cortina cirúrgica estéril em um tapete de calor definido para 37°C. Posicione e concentre o microscópio operacional. Para o início da cirurgia, desempacote na cortina cirúrgica as ferramentas cirúrgicas presterilizadas, fita cirúrgica, cotonetes de algodão estéreis, 70% (v/v) etanol na água, soro fisiológico estéril, suturas e uma agulha Hamilton ou micropipettos de vidro puxados.
- Certifique-se de que a máquina anestésico tenha oxigênio e isoflurano suficientes durante a duração do procedimento cirúrgico. Direcione o fluxo de anestesia para a câmara de indução e ligue a máquina anestéstica.
- Para começar, use uma taxa de fluxo de oxigênio de 1-2 L/min e 5% de isoflurane. Coloque o rato na câmara de indução para iniciar a anestesia. Quando o reflexo de redoação estiver ausente, reduza a anestesia para 2-3% isoflurane, direcione o fluxo de anestesia para o porta-voz e transfira o rato para o porta-voz localizado em uma área separada do espaço cirúrgico.
- Certifique-se de que tanto os reflexos de retirada da córnea quanto do pedal estão ausentes antes de raspar a área de pele que cobre os músculos a serem injetados. Quando estiver completo, remova o máximo de pele raspada do camundongo usando o lado pegajoso da fita cirúrgica e coloque o mouse em escalas de pesagem para registrar seu peso pré-cirúrgico.
- Aplique cuidadosamente lubrificante ocular usando um cotonete e transfira o rato e o porta-voz para a área cirúrgica.
NOTA: Tente limitar a quantidade de pele raspada que também é transferida para a área cirúrgica. Use fita cirúrgica para fixar a cabeça no porta-voz para evitar que o rato escorregue. Usando um cotonete separado, aplique etanol na região raspada para esterilizar e reduzir a contaminação dos peles. - Posicione o corpo de acordo com o músculo a ser injetado. Por exemplo, para o TA, coloque o mouse em suas costas e estique a retalho traseira a ~10° da linha média. Alternativamente, para injeções de soleus, coloque o animal de lado e estenda a barra traseira a ~45° da linha média. Quando a cetam para trás estiver na posição correta, use fita cirúrgica no pé para evitar movimentos indesejados durante a cirurgia.
NOTA: Os procedimentos de injeção para os músculos TA, gastrocnemius e soleus foram previamente detalhados32. - Antes de fazer uma incisão, confirme que a anestesia é suficiente testando o reflexo de retirada do pedal. Monitore a anestesia continuamente e mantenha-a durante todo o procedimento cirúrgico com avaliação regular da respiração e do reflexo de abstinência.
- Neste ponto, desenhe a solução HCT de trabalho para a seringa Hamilton ou micropipette de vidro puxada.
- Faça uma pequena incisão sobre os músculos de interesse na área(s) que correspondem com as regiões da placa final do motor 46,47,48. Fure a fáscia externa no músculo e injete lentamente o HCT conforme 32. Deixe a seringa/micropipette em posição por 5-10 s antes de retirar lentamente.
- Feche as incisões com suturas 1-2 e transfira o mouse para uma gaiola de recuperação isolada. Monitore o mouse pós-cirurgia por um mínimo de 30 minutos, antes de devolvê-lo para a gaiola doméstica. Quando o camundongo tiver se recuperado com sucesso e o monitoramento pós-cirúrgico estiver completo, retorne a gaiola às condições normais de habitação.
3. Transporte axonal vivo
- Expondo o nervo ciático
- Defina a câmara ambiental do microscópio para 37 °C pelo menos 1 h antes da imagem.
- Prepare-se para expor o nervo ciático organizando a cortina cirúrgica, ferramentas, fita, cotonetes de algodão estéreis, 70% de etanol e soro fisiológico ao redor da área cirúrgica. Certifique-se de que a máquina anestésico tenha estoques suficientes de oxigênio e isoflurano por até 2 h por mouse. Crie uma cunha a partir de parafilm ou fita invisível cortando-a em um retângulo estreito (por exemplo, ~1 cm de largura para ratos maiores) com uma ponta angular e coloque-a sob o nervo ciático exposto para ajudar no processo de imagem. Coloque a câmara de indução em cima de um tapete de calor e coloque-a à temperatura corporal.
NOTA: Quatro horas é tempo suficiente para HCT ter sido ocupado e retrógradamente transportado do local da injeção para o nervo ciático; portanto, um único rato pode ser readied para re-anestesia após este tempo. - Direcione o fluxo de anestesia para a câmara de indução, ligue a máquina anestéstica com uma taxa de fluxo de oxigênio de 1-2 L/min e 3-4% de isoflurano, e coloque o rato na câmara de indução para iniciar a anestesia.
NOTA: Como o experimento de transporte axonal in vivo é um procedimento terminal, não há necessidade de lubrificar os olhos. - Quando o reflexo de direita estiver ausente, reduza a anestesia para 2-3% isoflurane, direcione o fluxo de anestesia para o bocal e transfira o rato para o bocal. Use fita cirúrgica para fixar a cabeça ao bocal, estenda a linha traseira direcionada a ~45° da linha média e use fita cirúrgica sobre o pé para manter esta posição.
NOTA: A anestesia reduzida é vantajosa neste momento, pois pode limitar o impacto dos artefatos respiratórios durante o processo de imagem. - Certifique-se de que os reflexos de abstinência da córnea e do pedal estão ausentes e, em seguida, use a tesoura para cortar a pele sobrepondo o nervo ciático32 (ou seja, uma grande área que se estende da medula espinhal central para o fundo médio da linha vertebral). Remova o músculo fórico de bíceps, bem como qualquer outro musculatura e tecido conjuntivo que esteja perto do nervo ciático. Evite danificar o nervo ciático e os vasos sanguíneos circundantes, especialmente aqueles localizados perto do aspecto lateral da patela/aspecto proximal da cabeça gastrocnemius lateral.
- Quando o nervo ciático intacto estiver suficientemente exposto, aplique soro fisiológico pré-armado à área ao redor do nervo ciático para evitar a proficação. Use fórceps curvos para interromper o tecido conjuntivo profundo e coloque a 'cunha' pré-preparada sob o nervo. Quando estiver concluído, coloque a lã de algodão encharcada de soro salino na área exposta e mova o rato para a câmara de indução posicionada em cima do tapete de calor (definido para 37 °C), que ainda deve ser preenchido com isoflurano em O2.
- In vivo imagem axonal
- Coloque um vidro de cobertura de 22 x 64 mm no estágio do microscópio personalizado e proteja sua posição com fita. Selecione e aplique óleo de imersão ao objetivo e, em seguida, conecte o estágio do microscópio ao microscópio invertido. Levante lentamente o objetivo imerso em óleo até que o contato seja feito entre o óleo e a tampa.
NOTA: Ou os objetivos de 40x, 1.3 de abertura numérica (NA) DIC Plan-Apochromat ou 63x, 1.4 NA DIC Plan-Apochromat óleo-imersão podem ser usados para imagem in vivo transporte no nervo ciático. - Mova o bocal anestésico para o estágio do microscópio e proteja as mangueiras de anestesia com fita adesiva para evitar perturbação da anestesia. Retire a lã de algodão do nervo ciático e transfira o rato da câmara de indução para o bocal, com o nervo exposto voltado para a tampa. Use fita cirúrgica para garantir que a cabeça do mouse esteja fixada no bocal e mantenha o nível mais baixo e eficaz de anestesia. Levante suavemente o mouse pela cauda e adicione soro fisiológico estéril ao deslizamento de tampas perto do nervo ciático exposto para restringir a dessecação e ajudar a imagem.
NOTA: Feche todas as portas da câmara ambiental para garantir que a área permaneça à temperatura corporal. - Usando os oculares, localize o nervo ciático, determine o ponto focal ideal e selecione uma área de interesse contendo organelas axonal motile.
NOTA: Uma explicação detalhada desse processo foi descrita anteriormente32. - Mude para o software do computador clicando no botão Aquisição (ou equivalente) e selecione uma área de interesse. Use um zoom digital para obter um total de ampliação >80x e gire a área selecionada para visualizar horizontalmente os axônios (por exemplo, carga retrógrada móvel da direita para a esquerda e carga anterograda em movimento da esquerda para a direita).
NOTA: Os parâmetros de direcionalidade são dependentes do usuário, mas devem permanecer consistentes durante todos os experimentos. - Otimize a intensidade do sinal ajustando parâmetros como intensidade laser (0,2 - 1%), abertura pinhole (1 UA - máx), ganho (Master) (700 - 1000), deslocamento digital (-50 - 0) e ganho digital (1.0 - 4.0). Para reduzir a influência potencial da fototoxicidade, mantenha a intensidade do laser em ≤ 1% sempre que possível, com uma intensidade máxima de laser de 2%. Altere todos os outros parâmetros antes de ajustar a intensidade do laser para detecção ideal de sinal.
- Clique na caixa Regiões (ou equivalente), selecione uma região retangular de interesse, em seguida, no Modo de Aquisição (ou equivalente), defina o tamanho do quadro para um mínimo de 1024 x 1024 pixels e inicie a aquisição de lapso de tempo de 100-1.000 quadros.
NOTA: A taxa de aquisição de quadros desejada é dependente do usuário (por exemplo, o transporte pode ser avaliado com taxas de quadros entre 0,1 e 6 s) e pode ser ajustado com parâmetros de software, como região de interesse, tempo de velocidade de digitalização, média de aquisição e direcionalidade a laser. Por exemplo, para obter uma taxa de quadros mais lenta, aumente a altura/largura da região de interesse, adquira velocidades de varredura mais lentas, aumente a média de aquisição e use direcionalidade única a laser, e vice-versa para uma taxa de quadros mais rápida. A taxa de aquisição de quadros deve permanecer consistente em conjuntos de dados comparáveis, pois imagens em diferentes frequências podem causar inconsistências. Cargas rápidas, como a sinalização, requerem uma taxa de quadros mais rápida (por exemplo, 0,1-3 s) em comparação com organelas mais lentas como mitocôndrias que podem ser analisadas usando uma taxa mais lenta (por exemplo, 2,5-6 s). - Procure capturar um mínimo de 10 cargas motile de um mínimo de três axônios por mouse.
NOTA: Com base em cálculos de potência de duas amostras e duas verias laterais (com potência padrão de 0,8 (1-β) e taxa de erro tipo I de 5% (α)), os tamanhos amostrais de 6-8 são suficientes para identificar diferenças de transporte axonal entre os modelos de tipo selvagem edoenças 35,43. - Uma vez que a imagem esteja completa, eutanize o rato imediatamente enquanto estiver sob anestesia (por exemplo, luxação cervical). Tecido pós-morte, como músculos e nervos ciáticos, também pode ser colhido para análise posterior.
- Coloque um vidro de cobertura de 22 x 64 mm no estágio do microscópio personalizado e proteja sua posição com fita. Selecione e aplique óleo de imersão ao objetivo e, em seguida, conecte o estágio do microscópio ao microscópio invertido. Levante lentamente o objetivo imerso em óleo até que o contato seja feito entre o óleo e a tampa.
Resultados
Este artigo detalha um protocolo versátil que expande o kit de ferramentas de transporte in vivo axonal em modelos de roedores. A Figura 1 demonstra que os axônios do neurônio motor podem ser diferenciados tanto dos axônios de neurônios sensoriais quanto das células Schwann usando camundongos transgênicos. A Figura 1A retrata a expressão eGFP em axônios motores colinérgicos de um mouse ChAT.eGFP ao vivo e anestesiado. A Figura 1B usa um método alternativo para alcançar a expressão tdTomato em um nervo recém-extirpado (ou seja, nenhum processamento adicional de tecido) de um rato ChAT.tdTomato. Assim, o uso de cepas transgênicas como ChAT.eGFP, ChAT.tdTomato ou Hb9.GFP permite rotulagem específica do axônio do motor in vivo.
Alternativamente, os axônios também podem ser identificados injetando rastreadores/marcadores (por exemplo, HCT31,32 ou vírus codificando o eGFP15) em músculos esqueléticos. A Figura 2 destaca tal aplicação, representando oito axônios fortemente expressos chat.eGFP-positivos que contêm endosoladores de sinalização HCT-555-positivos (setas brancas), ~4 h de injeção pós-sonda no músculo TA. Usando este design experimental, poderíamos identificar neurônios α motor, que são predominantemente44 de gordura rápida. Outros cinco axônios ChAT.eGFP com expressão eGFP menos robusta (Figura 2A, asteriscos laranja) estavam parcialmente fora de foco e provavelmente estavam localizados ligeiramente mais profundos dentro do nervo ciático.
Além disso, identificamos endos de sinalização HCT-555-positivo em axônios sensoriais eGFP-negativos (setas amarelas). Como tal, usando esse paradigma experimental, pode-se avaliar e comparar especificamente o transporte axonal de endosários de sinalização em neurônios motor versus sensoriais in vivo. De fato, usando esta cepa de repórter transgênica, descobrimos que o transporte de endossários de sinalização em axônios motores chat.eGFP positivos é mais rápido do que em axônios sensoriais ChAT.eGFP-negativos, que podem ser confiávelmente diferenciados usando larguras de axônio43.
Identificamos anteriormente axônios de neurônio motor usando o mouse ChAT.eGFP in vivo43. Agora reportamos esse HB9. Camundongos GFP também podem ser usados para alcançar a identificação do axônio do neurônio motor in vivo. De fato, a Figura 3 apresenta uma série de imagens de lapso de tempo do HB9. Axônios GFP contendo endoss de sinalização HCT-555 positivos em movimento retrógrado. Note que, ao contrário da expressão baseada em ChAT, o GFP tem um padrão mais pontual/granular no HB9. Axônios GFP; a razão para isso não está clara.
Descrevemos anteriormente como monitorar a dinâmica mitocondrial in vivo em nervos ciáticos através de injeções nervosas intrascáticas do corante mitocondrial, tetrametilrhodamina, éster etílico, perclorato (TMRE)32,36. Para diferenciar de forma confiável mitocôndrias motoras versus sensoriais, o rato Mito.CFP, que expressa CFP sob o promotor Thy1 18, pode ser cruzado com camundongos transgênicos que expressam um gene repórter fluorescente em tipos neuronais específicos. De fato, ao criar camundongos Mito.CFP com camundongos ChAT.tdTomato (conhecidos como ChAT.tdTomato::Mito.CFP), poderíamos visualizar mitocôndrias especificamente em axônios motores, como mostrado na Figura 4. Neste exemplo multiplex vivo, cinco axônios ChAT.tdTomato poderiam ser visualizados, quatro dos quais contêm mitocôndrias positivas em CFP. Além disso, o nó de Ranvier (seta branca no painel iii) também poderia ser identificado. Além disso, os nós de Ranvier são claramente detectáveis em ChAT.eGFP, HB9. Camundongos GFP e Mito.CFP (não mostrados). Essas cepas transgênicas duplas permitem que imagens intravitais de lapso de tempo de ratos vivos e anestesiados monitorem o conteúdo mitocondrial específico do neurônio motor e a dinâmica do transporte axonal.
Finalmente, a sinalização de endossósmos e mitocôndrias pode ser visualizada simultaneamente dentro dos mesmos axônios in vivo injetando HCT nos músculos dos camundongos Mito.CFP (Figura 5). Injeções intramusculares de HCT-555 foram realizadas em músculo TA em um rato Mito.CFP ~4 h antes da imagem. Ambas as mitocôndrias (painéis i) e endossários de sinalização (ii painéis) foram visualizadas simultaneamente em axônios específicos dos músculos (ou seja, axônios inervadores do TA). De fato, podem ser observadas organelas móveis anterogradely (triângulos amarelos) e retrógradas (triângulos verdes e círculos), bem como organelas paralisadas (triângulos e círculos laranjas). Usando esse paradigma experimental, pode-se avaliar as complexas interações funcionais entre mitocôndrias axonanas e endosários sinalizadores in vivo. No geral, demonstramos várias abordagens experimentais diferentes para avaliar o transporte axonal de endosários de sinalização e/ou mitocôndrias, especificamente em neurônios motores colinérgicos in vivo.
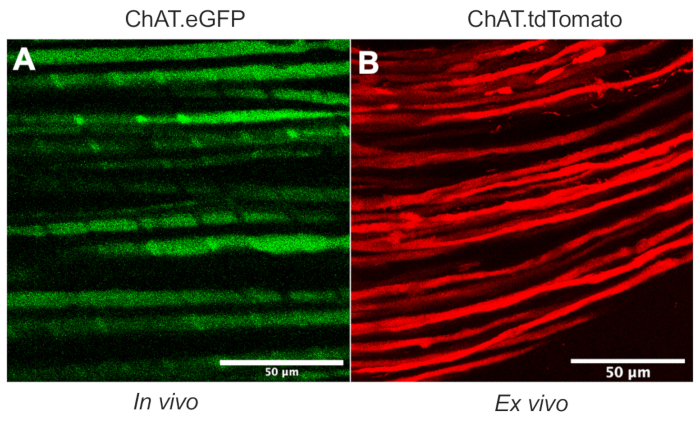
Figura 1: Axônios motores nervosos ciáticos. (A) Imagem representativa de um avião único de axônios motores eGFP positivos obtidos in vivo a partir de um mouse ChAT.eGFP. (B) Imagem representativa de um plano único de axônios motores tdTomato positivo em um nervo ciático excisado de um rato ChAT.tdTomato. Distinções no calibre do axônio resultam de diferenças na idade e tamanho do mouse. Barras de escala = 50 μm. Abreviaturas: eGFP = proteína fluorescente verde aprimorada; ChAT = acetiltransferase de colina. Clique aqui para ver uma versão maior desta figura.

Figura 2: Transporte axonal in vivo de endosários de sinalização em motores nervosos ciáticos vivos e neurônios sensoriais de um mouse ChAT.eGFP. (A-C) Imagens representativas de axônios colinérgicos expressando eGFP (A) e contendo endossing de sinalização HCT-555-positivo (B) e a fusão (C). As setas brancas destacam um axônio motor eGFP positivo contendo endosários de sinalização HCT-555-positivos, as setas de ciano identificam um axônio motor sem endosários de sinalização HCT-555 positivo, e as setas amarelas destacam um axônio sensorial eGFP-negativo transportando endos de sinalização HCT-555-positivo. Asteriscos laranjas identificam axônios motores com expressão eGFP mais fraca. Barra de escala = 25 μm. Abreviaturas: eGFP = proteína fluorescente verde aprimorada; ChAT = acetiltransferase de colina; HCT-555 = domínio de ligação de toxinas tétanos. Clique aqui para ver uma versão maior desta figura.
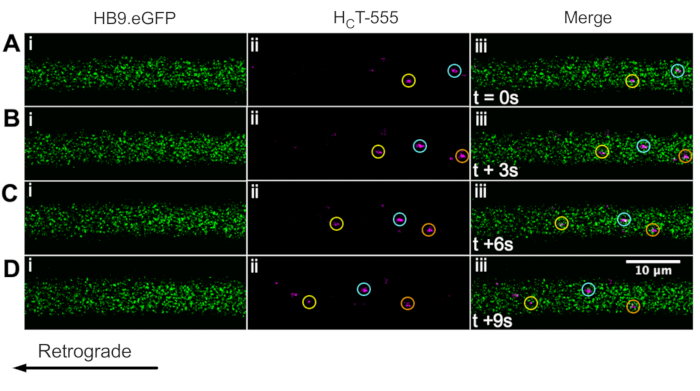
Figura 3: Série de imagens de lapso de tempo representando in vivo transporte axonal de endossóis de sinalização em neurônios motores vivos de um HB9. Mouse GFP. (A-D) Imagens de lapso de tempo tiradas a cada 3 s representando axônios neurônios motores expressando proteína fluorescente verde (i) e contendo endossolas de sinalização HCT-555-positivos (ii), e a fusão (iii). Cada círculo da mesma cor identifica o mesmo endosomhante em movimento em diferentes quadros. O movimento retrógrado é da direita para a esquerda. Barra de escala = 10 μm. Abreviaturas: GFP = proteína fluorescente verde; HCT-555 = domínio de ligação de toxinas tétanos. Clique aqui para ver uma versão maior desta figura.
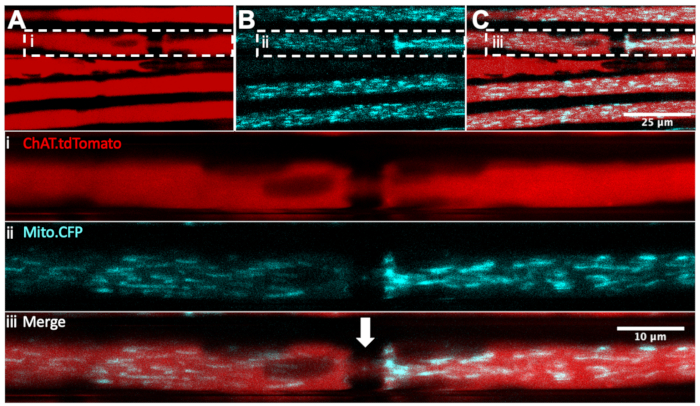
Figura 4: Transporte axonal in vivo de mitocôndrias em neurônios motores nervosos ciáticos vivos de um ChAT.tdTomato:: Mito.CFP: mouse. (A-C) Imagens representativas de axônios motores tdTomato-positivo (A), contendo mitocôndrias cfp-positivas (B), e a fusão (C). As imagens de entrada i-iii contêm uma ampliação maior de cada painel. A flecha branca representa um nó suspeito de Ranvier. Barras de escala = 25 (A-C) e 10 μm (i-iii). Abreviaturas: ChAT = acetiltransferase de colina; CFP = proteína fluorescente de ciano. Clique aqui para ver uma versão maior desta figura.
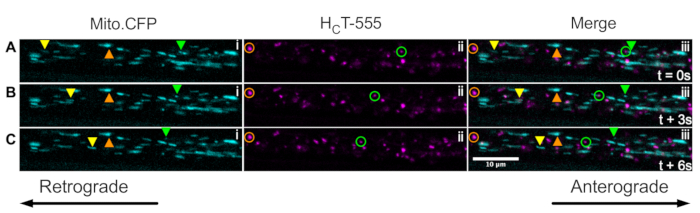
Figura 5: Série de imagens de lapso de tempo representando o transporte axonal in vivo simultâneo de mitocôndrias e sinalizando endosários em neurônios motores nervosos ciáticos vivos de um rato Mito.CFP. (A-C) Imagens de lapso de tempo tiradas a cada 3 s representando o transporte axonal de ambas as mitocôndrias (i) e sinalizando endosários (ii) dentro do mesmo axônio do nervo ciático (iii). Os triângulos amarelos identificam cargas em movimento anterogradely, os círculos/triângulos verdes identificam cargas móveis retrógradamente, e os círculos/triângulos laranjas identificam cargas estacionárias. O movimento anterograde é da esquerda para a direita, enquanto o movimento retrógrado está na direção oposta. Barra de escala = 10 μm. Abreviaturas: HCT-555 = domínio de ligação de toxinas tétanos; CFP = proteína fluorescente de ciano. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo detalha etapas para avaliar o transporte axonal in vivo de endosários de sinalização e mitocôndrias em axônios intactos do nervo ciático do camundongo. De fato, é fornecida uma configuração experimental que permite aos usuários distinguir motor de neurônios sensoriais in vivo, in situ e ex vivo , usando camundongos expressando proteínas fluorescentes de repórteres seletivamente expressas em neurônios motores; 2) avaliar in vivo o transporte axonal de endossóis de sinalização especificamente em axônios neurônios motores utilizando três camundongos transgênicos diferentes; 3) investigar in vivo o transporte axonal de mitocôndrias especificamente em axônios de neurônios motores; e 4) avaliar simultaneamente a dinâmica de transporte in vivo de endosários e mitocôndrias dentro do mesmo axônio. Esta abordagem tem grande potencial para investigar o transporte axonal em condições basais e pode ser usada para avaliar perturbações patológicas em diferentes doenças que afetam os nervos motores e sensoriais periféricos.
Usando paradigmas experimentais anteriores como base31,32, aqui temos novas e robustas formas detalhadas de diferenciar o transporte axonal que ocorre em neurônios motores versus sensoriais usando ratos repórteres transgênicos. Utilizando o mouse Mito.CFP, esta abordagem foi desenvolvida para avaliar o transporte mitocondrial in vivo, evitando injeções nervosas intrascáticas de TMRE36. Isso contorna possíveis danos neurais e perturbações no transporte axonal causados pela injeção intranerve da sonda. Além disso, este protocolo permite a visualização do transporte axonal de múltiplas organelas em axônios motores invasando músculos com propriedades fisiológicas distintas (por exemplo, músculos fatigable de contração rápida vs. músculos resistentes à fadiga de contração lenta). Como tal, a sinalização de dinâmica de transporte axonal e/ou mitocondrial pode ser avaliada em diferentes subconjuntos de neurônios α-motores44. Além disso, o transporte axonal dessas organelas em ambientes patológicos também pode ser avaliado através de cruzamentos com modelos de camundongos de diferentes doenças neurodegenerativas 1,2,3.
O kit de ferramentas de transporte axonal está continuamente expandindo28,29, e protocolos ex vivo foram desenvolvidos para avaliar a dinâmica de transporte usando explantas de chifre ventral de rato49 ou preparações nervosas de camundongosexcisadas 50. Além disso, o desenvolvimento de protocolos para avaliar o transporte axonal em células-tronco pluripotentes humanas induzidas (hiPSC) derivados de51 neurônios ou neurônios motores espinhais derivados do hiPSC52 permitiu a investigação de neurônios humanos com mutações causadoras de doenças. Tais protocolos de ponta no tecido do camundongo e células humanas podem fornecer insights críticos sobre a função neuronal, facilitar a descoberta pathomecanística em modelos de doenças neurodegenerativas e serem usados para testar moléculas e estratégias terapêuticas.
Várias etapas críticas precisam ser seguidas para a implementação bem-sucedida dessas técnicas, e algumas notas importantes foram fornecidas na seção de protocolo. Os principais requisitos para a imagem intravital são o microscópio confocal invertido com inserção de palco personalizada e o equipamento para manter anestesia e temperatura ideal. De fato, é necessário um sistema anestésico móvel especializado para 1) indução de anestesia, 2) dissecção/processamento tecidual (ou seja, expondo o nervo ciático) e 3) mantendo a anestesia durante a imagem intravital (como detalhado anteriormente em 31,32). Especialmente quando se usa objetivos de ampliação mais elevados (por exemplo, 40x ou 63x), a profundidade da anestesia pode impactar a qualidade da imagem, uma vez que anestesia mais profunda induz grandes respirações 'gaspy' que resultam em mudanças frequentes de foco. Tais grandes movimentos, sem dúvida, impactarão as análises de transporte pós-imagem (por exemplo, o rastreamento de cargas usando os plugins De Fiji TrackMate53 ou KymoAnalyzer54) à medida que os movimentos respiratórios produzem artefatos em vídeos de lapso de tempo que podem torná-los inadequados para rastreamento automatizado ou requerem uma avaliação mais demorada. Além disso, também observamos artefatos de imagem causados por artérias pulsantes dentro do nervo ciático, que só podem ser resolvidos escolhendo uma região de imagem diferente. O microscópio deve ser equipado com uma câmara ambiental capaz de manter a temperatura corporal constante, pois a temperatura e o pH influenciam o transporte axonal55. Além disso, deve-se evitar a aplicação de analgésicos pós-cirurgia, pois podem alterar a dinâmica do transporte56. Se o projeto experimental é longitudinal e requer imagens repetidas (por exemplo,57), os protocolos de dissecção precisam ser ajustados adequadamente para serem minimamente invasivos e podem exigir aprovação ética/licença adicional.
Certas considerações experimentais precisam ser mantidas em mente. Em primeiro lugar, a maioria dos protocolos aqui detalhados envolvem o uso de camundongos transgênicos que possuem proteínas fluorescentes de repórteres em mitocôndrias ou axônios de neurônios motores. Cada uma dessas linhas de rato deve ser criada e imagem como hemi/heterozigoto. As exceções, no entanto, são as linhas de camundongos ChAT.Cre e Rosa26.tdTomato que podem ser mantidas separadamente como homozigoas, com a prole hemizgota resultante permitindo a expressão tdTomato em neurônios colinérgicos após a recombinação cre-loxP . Quando camundongos transgênicos transgênicos (por exemplo, Mito.CFP) com outros camundongos hemi/heterozigotos transgênicos (por exemplo, ChAT.eGFP), é preciso considerar cuidadosamente a estratégia de reprodução, pois obter os números desejados de prole duplo-mutante pode ser demorado. Além disso, ao criar a geração F1 de camundongos ChAT.Cre e Rosa26.tdTomato (ou seja, ChAT.tdTomato) com cepas transgênicas adicionais (por exemplo, Mito.CFP), deve-se esperar ainda menos camundongos carregando os transgenes triplos desejados. Além disso, deve-se considerar também a potencial sobreposição fluorópica ao criar camundongos de dois repórteres com propriedades de comprimento de onda próximas (por exemplo, Mito-CFP-excitação: 435 nm, emissão: 485 nm, criado com ChAT.eGFP-excitação: 488 nm, emissão: 510 nm), embora possa ser possível superar esse problema com espectral desmusar58.
Essa técnica tem algumas limitações a serem consideradas. Neste trabalho e em nossos protocolos anteriores31,32, mostramos como vários marcadores geneticamente codificados e diferentes métodos de coloração podem ser usados para rotular e rastrear organelas distintas in vivo. No entanto, nem todas as sondas são adequadas para esta abordagem experimental. Avaliamos injeções em ta ou músculo soleus de subunidade beta de cólera (CTB)-488 (0,5-1,5 μg/μL ~4 h antes da imagem), uma sonda rotineiramente usada para rotular corpos celulares neurônios motores em experimentos rastreadores in vivo retrógrados59,60. No entanto, quando injetado sozinho ou co-injetado com HCT-555, a rotulagem CTB-488 foi fraca, apesar de usar concentrações semelhantes às usadas para rastreamento de neurônio motor retrógrado bem sucedido. Assim, concluímos que, apesar do CTB ser um excelente marcador in vitro de endosários de sinalização nas culturas neuronais61, HCT continua sendo a sonda padrão-ouro para identificar endossóis de sinalização in vivo em axônios nervosos ciáticos.
Usando diferentes rotas, também testamos sondas rotineiramente usadas para rotular lysosomes, como LysoTracker verde DND-26, e marcadores de hidrolases lyosômicas ativas, como BODIPY-FL-pepstatin A para Cathepsin D62 e Magic Red para Cathepsin B, mas sem sucesso. Tentamos a entrega intramuscular de BODIPY-FL-pepstatin A (2,5 μg no TA ~4 h antes da imagem), bem como injeção de nervo intrascático de 2 μL de LysoTracker (10 μM), BODIPY-FL-pepstatin A (10 μM) ou Vermelho Mágico (1/10) 30-60 min antes da imagem. Apesar dessas sondas que destacam o nervo, não conseguimos encontrar organelas claramente rotuladas. As sondas se acumularam em torno de axônios, provavelmente sendo retidos por células Schwann. Assim, a rotulagem mal sucedida de lysososomes pode ser devido à entrega deficiente da sonda em neurônios, embora a existência de concentrações mais adequadas não possa ser descartada. Dado que a rotulagem TMRE funciona em condições semelhantes (ou seja, injeções intrascáticas do nervo), a intensidade de rotulagem pode ser dependente de corante e deve ser testada para cada marcador independentemente. No entanto, concluímos que o direcionamento de lysossomes in vivo com essas sondas não é viável nas concentrações acima indicadas.
Métodos de anestesia podem alterar leituras fisiológicas distintas (por exemplo, função de cóclea63 e eletrofisiologia cortical64); no entanto, se a anestesia influencia no transporte axonal vivo no nervo ciático é atualmente desconhecida. Dada a atividade neuromuscular reduzida sob anestesia induzida por isoflurano, é possível que a cinética de transporte difere em comparação com o estado de vigília. No entanto, o único estudo in vivo que investigou diretamente isso revelou que o transporte de vesículas densas em projeções thalamocorticas não difere entre camundongos anestesiados e acordados65. Além disso, como distinções no transporte entre camundongos do tipo selvagem e modelo de doença são detectáveis sob anestesia35,43, é evidente que a exposição isoflurane não impede a identificação de perturbações na sinalização de tráfico endosomo ou mitocondrial.
Este protocolo tem outras aplicações potenciais, que foram descritas abaixo. A criação dos camundongos transgênicos descritos neste protocolo (por exemplo, Mito.CFP, ChAT.eGFP) com modelos de camundongos de doença neurodegenerativa 1,2,3 permitirá investigações específicas do subtipo e/ou de carga. Além disso, o rato recém-desenvolvido Cre lines66 também permitiria a visualização de proteínas fluorescentes de repórteres em distintas populações de axônio sensorial. Por exemplo, camundongos Rosa26.tdTomato podem ser cruzados com um receptor neuropeptídeo Y-2-expressing (Npy2r). Rato cre para habilitar fluorescência tdTomato em nociceptores de fibra A mielique67. Além disso, o controle temporal também pode ser alcançado usando sistemas cre indutíveis (por exemplo, tamoxifen)68. Outra aplicação em potencial depende da disponibilidade de camundongos transgênicos expressando proteínas fluorescentes em células Schwann. De fato, os camundongos S100-GFP69 e PLP-GFP70 permitem imagens in vivo e/ou in situ de células Schwann e estiveram na vanguarda das pesquisas envolvidas na migração celular de Schwann durante a regeneração nervosa periférica.
Além dessas aplicações e complementando o mouse Mito.CFP está a disponibilidade de várias linhas de camundongos transgênicos que expressam proteínas fluorescentes em organelas distintas, como mitocôndrias e autofagontos. Por exemplo, investigar o transporte mitocondrial in vivo pode ser possível com o rato mito::mKate271 ou o fotoconvertível mitoDendra mouse57. Além disso, o transporte mitofagoso in vivo pode ser possível usando o rato mito-Keima sensível ao pH72 e o rato mito-QC73 para análises de mitofagia. Além disso, as dificuldades de rotulagem lysosômicas que encontramos podem ser superadas pelo uso de camundongos expressando LAMP1-GFP, com a ressalva de que lamp1 também está presente em organelas endocíticas distintas dos lysosomos74.
Em resumo, fornecemos novas formas de avaliar o transporte in vivo axonal de várias organelas em axônios periféricos específicos de diversos camundongos transgênicos. A imagem simultânea de diferentes organelas será particularmente importante, dado os recentes achados de interações axonais e co-tráfico de organelas como mitocôndrias e endósmosos75,76. Acreditamos que os métodos apresentados serão úteis para melhorar a compreensão da fisiologia basal dos axônios in vivo e desessencantar importantes mecanismos que conduzem a neurodegeneração dos nervos periféricos.
Divulgações
Os autores não têm conflitos de interesse.
Agradecimentos
Gostaríamos de agradecer a Robert M. Brownstone (Queen Square Institute of Neurology, University College London) por compartilhar os ratos ChAT-eGFP, ChAT.Cre e Rosa26.tdTomato, e Pietro Fratta (Queen Square Institute of Neurology, University College London) por compartilhar o HB9. Mouse GFP. Gostaríamos de agradecer a Elena R. Rhymes, Charlotte J.P. Kremers e Qiuhan Lang (Queen Square Institute of Neurology, University College London) pela leitura crítica do manuscrito. Este trabalho foi apoiado por uma Bolsa Não Clínica Júnior da Associação de Doenças do Neurônio Motor (Reino Unido) (Tosolini/Out20/973-799) (APT), o Wellcome Trust Senior Investigator Awards (107116/Z/15/Z e 223022/Z/21/Z) (GS), um prêmio da Fundação Instituto de Pesquisa de Demência do Reino Unido (GS); e prêmio de Desenvolvimento de Carreira do Conselho de Pesquisa Médica (MR/S006990/1) (JNS).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 mL PCR tube | |||
| 70% (v/v) ethanol in distilled water | |||
| AlexaFlour555 C2 maleimide | ThermoFisher Scientific | A-20346 | Can also use AlexaFlour-488 or -647 Maleimide |
| B6.Cg-Gt(ROSA)26Sortm9(CAG-tdTomato)Hze/J | Jackson Laboratory | 7909 | Rosa26.tdTomato mice |
| B6.Cg-Tg(Hlxb9-GFP)1Tmj/J mice | Jackson Laboratory | 5029 | HB9.GFP mice |
| B6.Cg-Tg(Thy1-CFP/COX8A)S2Lich/J mice | Jackson Laboratory | 7967 | Mito.CFP mice |
| B6;129S6-Chattm2(cre)Lowl/J mice | Jackson Laboratory | 6410 | ChAT.Cre mice |
| Computer with microscope control and image acquisition software | Zeiss | Zen | |
| Cotton swab | |||
| Desktop centrifuge | |||
| Dissecting microscope | |||
| Eye lubricant | |||
| Fine curved forceps | Dumont | ||
| Fine straight forceps | Dumont | ||
| Glass coverslip (22 x 64 mm, thickness no. 1) | |||
| Graduated, glass micropipette with microliter markings and plunger | Drummond Scientific | 5-000-1001-X10 | |
| Hair clippers | |||
| Hamilton microliter syringe (701 N, volume 10 μL, needle size 26 s G, bevel tip, needle L 51 mm) | Merck | 20779 | |
| HcT-441 | N/A | N/A | See Restani et al., 2012 for more details |
| Heating pad | |||
| Immersion oil for fluorescent imaging at 37 °C | |||
| Inverted confocal microscope with environmental chamber | Zeiss | LSM 780 | Most inverted confocals should be adaptable |
| Isoflurane | |||
| Isoflurane vaporizer/anesthesia machine with induction cham-ber and mask stabilizer | |||
| Magic tape | invisible tape | ||
| Micropipette puller | |||
| Parafilm | Parafilm | ||
| Phosphate-buffered saline (PBS): 137 mM NaCl, 10 mM Na2HPO4, 2.7 mM KCl, 1.8 mM KH2PO4–HCl, pH 7.4 | |||
| Recombinant human brain-derived neurotrophic factor (BDNF) | Peprotech | 450-02 | BDNF that can be co-injected with HcT-555 |
| Saline | |||
| Scalpel blade | Dumont | ||
| Small spring scissors | Dumont | ||
| Surgery/operating microscope | |||
| Surgical drape | |||
| Surgical suture | |||
| Surgical tape | |||
| Tg(Chat-EGFP) GH293Gsat/Mmucd mice | MMRRC | 000296-UCD | ChAT.eGFP |
| Vortex mixer |
Referências
- Webster, R. G. Animal models of the neuromuscular junction, vitally informative for understanding function and the molecular mechanisms of congenital myasthenic syndromes. International Journal of Molecular Sciences. 19 (5), 1326 (2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models & Mechanisms. 4 (4), 457-467 (2011).
- De Giorgio, F., Maduro, C., Fisher, E. M. C., Acevedo-Arozena, A. Transgenic and physiological mouse models give insights into different aspects of amyotrophic lateral sclerosis. Disease Models & Mechanisms. 12 (1), 037424 (2019).
- Ilieva, H., Polymenidou, M., Cleveland, D. W. Non-cell autonomous toxicity in neurodegenerative disorders: ALS and beyond. The Journal of Cell Biology. 187 (6), 761-772 (2009).
- Brown, R. H., Al-Chalabi, A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 377 (2), 162-172 (2017).
- Gong, S., et al. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425 (6961), 917-925 (2003).
- Tallini, Y. N., et al. BAC transgenic mice express enhanced green fluorescent protein in central and peripheral cholinergic neurons. Physiological Genomics. 27 (3), 391-397 (2006).
- Zeilhofer, H. U., et al. Glycinergic neurons expressing enhanced green fluorescent protein in bacterial artificial chromosome transgenic mice. The Journal of Comparative Neurology. 482 (2), 123-141 (2005).
- Kaiser, T., Ting, J. T., Monteiro, P., Feng, G. Transgenic labeling of parvalbumin-expressing neurons with tdTomato. Neuroscience. 321, 236-245 (2016).
- Zheng, B., Sage, M., Sheppeard, E. A., Jurecic, V., Bradley, A. Engineering mouse chromosomes with Cre-loxP: range, efficiency, and somatic applications. Molecular and Cellular Biology. 20 (2), 648-655 (2000).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 13 (1), 133-140 (2010).
- Bareyre, F. M., Kerschensteiner, M., Misgeld, T., Sanes, J. R. Transgenic labeling of the corticospinal tract for monitoring axonal responses to spinal cord injury. Nature Medicine. 11 (12), 1355-1360 (2005).
- Willems, J., et al. A CRISPR/Cas9-based genome editing toolbox for epitope tagging of endogenous proteins in neurons. PLoS Biology. 18 (4), 3000665 (2020).
- Huh, Y., Oh, M. S., Leblanc, P., Kim, K. -. S. Gene transfer in the nervous system and implications for transsynaptic neuronal tracing. Expert Opinion on Biological Therapy. 10 (5), 763-772 (2010).
- Tosolini, A. P., Morris, R. Targeting motor end plates for delivery of adenoviruses: an approach to maximize uptake and transduction of spinal cord motor neurons. Scientific Reports. 6, 33058 (2016).
- Andrews, M. R. Gene therapy in the CNS-one size does not fit all. Gene Therapy. 28 (7-8), 393-395 (2021).
- Kügler, S. Tissue-specific promoters in the CNS. Methods in Molecular Biology. 1382, 81-91 (2016).
- Misgeld, T., Kerschensteiner, M., Bareyre, F. M., Burgess, R. W., Lichtman, J. W. Imaging axonal transport of mitochondria in vivo. Nature Methods. 4 (7), 559-561 (2007).
- Mizushima, N., Yamamoto, A., Matsui, M., Yoshimori, T., Ohsumi, Y. In vivo analysis of autophagy in response to nutrient starvation using transgenic mice expressing a fluorescent autophagosome marker. Molecular Biology of the Cell. 15 (3), 1101-1111 (2004).
- Dana, H., et al. Thy1-GCaMP6 transgenic mice for neuronal population imaging in vivo. PLoS One. 9 (9), 108697 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Maday, S., Twelvetrees, A. E., Moughamian, A. J., Holzbaur, E. L. F. Axonal transport: cargo-specific mechanisms of motility and regulation. Neuron. 84 (2), 292-309 (2014).
- Terenzio, M., Schiavo, G., Fainzilber, M. Compartmentalized signaling in neurons: from cell biology to neuroscience. Neuron. 96 (3), 667-679 (2017).
- Abouward, R., Schiavo, G. Walking the line: mechanisms underlying directional mRNA transport and localisation in neurons and beyond. Cellular and Molecular Life Sciences. 78 (6), 2665-2681 (2021).
- Sleigh, J. N., Rossor, A. M., Fellows, A. D., Tosolini, A. P., Schiavo, G. Axonal transport and neurological disease. Nature Reviews. Neurology. 15 (12), 691-703 (2019).
- Bronfman, F. C., Moya-Alvarado, G. BDNF/TrkB signaling endosomes mediate long-distance dendritic growth by activating CREB/PI3K-mTOR-dependent translation in neuronal cell bodies. BioRxiv. , (2020).
- Nagano, S., Araki, T. Axonal Transport and Local Translation of mRNA in Neurodegenerative Diseases. Frontiers in Molecular Neuroscience. 14, 697973 (2021).
- Boecker, C. A., Olenick, M. A., Gallagher, E. R., Ward, M. E., Holzbaur, E. L. F. ToolBox: Live Imaging of intracellular organelle transport in induced pluripotent stem cell-derived neurons. Traffic. 21 (1), 138-155 (2020).
- Surana, S., et al. The evolution of the axonal transport toolkit. Traffic. 21 (1), 13-33 (2020).
- Sleigh, J. N., Vagnoni, A., Twelvetrees, A. E., Schiavo, G. Methodological advances in imaging intravital axonal transport. F1000Research. 6, 200 (2017).
- Gibbs, K. L., Kalmar, B., Sleigh, J. N., Greensmith, L., Schiavo, G. In vivo imaging of axonal transport in murine motor and sensory neurons. Journal of Neuroscience Methods. 257, 26-33 (2016).
- Sleigh, J. N., Tosolini, A. P., Schiavo, G. In vivo imaging of anterograde and retrograde axonal transport in rodent peripheral nerves. Methods in Molecular Biology. 2143, 271-292 (2020).
- Gibbs, K. L., et al. Inhibiting p38 MAPK alpha rescues axonal retrograde transport defects in a mouse model of ALS. Cell Death & Disease. 9 (6), 596 (2018).
- Fellows, A. D., Rhymes, E. R., Gibbs, K. L., Greensmith, L., Schiavo, G. IGF1R regulates retrograde axonal transport of signalling endosomes in motor neurons. EMBO Reports. 21 (3), 49129 (2020).
- Bilsland, L. G., Sahai, E., Kelly, G., Golding, M., Greensmith, L., Schiavo, G. Deficits in axonal transport precede ALS symptoms in vivo. Proceedings of the National Academy of Sciences of the United States of America. 107 (47), 20523-20528 (2010).
- Kalinski, A. L., et al. Deacetylation of Miro1 by HDAC6 blocks mitochondrial transport and mediates axon growth inhibition. The Journal of Cell Biology. 218 (6), 1871-1890 (2019).
- Bercsenyi, K., et al. Tetanus toxin entry. Nidogens are therapeutic targets for the prevention of tetanus. Science. 346 (6213), 1118-1123 (2014).
- Deinhardt, K., et al. Rab5 and Rab7 control endocytic sorting along the axonal retrograde transport pathway. Neuron. 52 (2), 293-305 (2006).
- Debaisieux, S., Encheva, V., Chakravarty, P., Snijders, A. P., Schiavo, G. Analysis of signaling endosome composition and dynamics using SILAC in embryonic stem cell-derived neurons. Molecular & Cellular Proteomics. 15 (2), 542-557 (2016).
- Surana, S., et al. The travel diaries of tetanus and botulinum neurotoxins. Toxicon. 147, 58-67 (2018).
- Villarroel-Campos, D., Schiavo, G., Lazo, O. M. The many disguises of the signalling endosome. FEBS Letters. 592 (21), 3615-3632 (2018).
- Malik, B., et al. Absence of disturbed axonal transport in spinal and bulbar muscular atrophy. Human Molecular Genetics. 20 (9), 1776-1786 (2011).
- Sleigh, J. N., et al. Mice carrying ALS mutant TDP-43, but not mutant FUS, display in vivo defects in axonal transport of signaling endosomes. Cell Reports. 30 (11), 3655-3662 (2020).
- Tosolini, A. P., Sleigh, J. N., Surana, S., Rhymes, E. R., Cahalan, S. D., Schiavo, G. modulation of axonal transport is selectively impaired in ALS. BioRxiv. , (2021).
- Restani, L., et al. Botulinum neurotoxins A and E undergo retrograde axonal transport in primary motor neurons. PLoS Pathogens. 8 (12), 1003087 (2012).
- Mohan, R., Tosolini, A. P., Morris, R. Intramuscular injections along the motor end plates: a minimally invasive approach to shuttle tracers directly into motor neurons. Journal of Visualized Experiments: JoVE. (101), e52846 (2015).
- Tosolini, A. P., Mohan, R., Morris, R. Targeting the full length of the motor end plate regions in the mouse forelimb increases the uptake of fluoro-gold into corresponding spinal cord motor neurons. Frontiers in Neurology. 4, 58 (2013).
- Mohan, R., Tosolini, A. P., Morris, R. Targeting the motor end plates in the mouse hindlimb gives access to a greater number of spinal cord motor neurons: an approach to maximize retrograde transport. Neuroscience. 274, 318-330 (2014).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments: JoVE. (159), e60993 (2020).
- Boyer, N. P., Azcorra, M., Jung, P., Brown, A. Imaging and analysis of neurofilament transport in excised mouse tibial nerve. Journal of Visualized Experiments: JoVE. (162), e61264 (2020).
- Mou, Y., Mukte, S., Chai, E., Dein, J., Li, X. -. J. Analyzing mitochondrial transport and morphology in human induced pluripotent stem cell-derived neurons in hereditary spastic paraplegia. Journal of Visualized Experiments: JoVE. (156), e60548 (2020).
- Stoklund Dittlau, K., et al. Generation of human motor units with functional neuromuscular junctions in microfluidic devices. Journal of Visualized Experiments: JoVE. (175), e62959 (2021).
- Tinevez, J. -. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Neumann, S., Chassefeyre, R., Campbell, G. E., Encalada, S. E. KymoAnalyzer: a software tool for the quantitative analysis of intracellular transport in neurons. Traffic. 18 (1), 71-88 (2017).
- Bohnert, S., Schiavo, G. Tetanus toxin is transported in a novel neuronal compartment characterized by a specialized pH regulation. The Journal of Biological Chemistry. 280 (51), 42336-42344 (2005).
- Kanai, A., et al. Low-concentration lidocaine rapidly inhibits axonal transport in cultured mouse dorsal root ganglion neurons. Anesthesiology. 95 (3), 675-680 (2001).
- Bolea, I., Gan, W. -. B., Manfedi, G., Magrané, J. Imaging of mitochondrial dynamics in motor and sensory axons of living mice. Methods in Enzymology. , 97-110 (2014).
- Cohen, S., Valm, A. M., Lippincott-Schwartz, J. Multispectral live-cell imaging. Current Protocols in Cell Biology. 79 (1), 46 (2018).
- Blum, J. A., et al. Single-cell transcriptomic analysis of the adult mouse spinal cord reveals molecular diversity of autonomic and skeletal motor neurons. Nature Neuroscience. 24 (4), 572-583 (2021).
- Xu, J., et al. An approach to maximize retrograde transport based on the spatial distribution of motor endplates in mouse hindlimb muscles. Frontiers in Cellular Neuroscience. 15, 707982 (2021).
- Wang, T., et al. Flux of signalling endosomes undergoing axonal retrograde transport is encoded by presynaptic activity and TrkB. Nature Communications. 7, 12976 (2016).
- Chen, C. S., Chen, W. N., Zhou, M., Arttamangkul, S., Haugland, R. P. Probing the cathepsin D using a BODIPY FL-pepstatin A: applications in fluorescence polarization and microscopy. Journal of Biochemical and Biophysical Methods. 42 (3), 137-151 (2000).
- Cederholm, J. M. E., et al. Differential actions of isoflurane and ketamine-based anaesthetics on cochlear function in the mouse. Hearing Research. 292 (1-2), 71-79 (2012).
- Michelson, N. J., Kozai, T. D. Y. Isoflurane and ketamine differentially influence spontaneous and evoked laminar electrophysiology in mouse V1. Journal of Neurophysiology. 120 (5), 2232-2245 (2018).
- Knabbe, J., Nassal, J. P., Verhage, M., Kuner, T. Secretory vesicle trafficking in awake and anaesthetized mice: differential speeds in axons versus synapses. The Journal of Physiology. 596 (16), 3759-3773 (2018).
- Gong, S., et al. Targeting Cre recombinase to specific neuron populations with bacterial artificial chromosome constructs. The Journal of Neuroscience. 27 (37), 9817-9823 (2007).
- Arcourt, A., et al. Touch receptor-derived sensory information alleviates acute pain signaling and fine-tunes nociceptive reflex coordination. Neuron. 93 (1), 179-193 (2017).
- Valny, M., Honsa, P., Kirdajova, D., Kamenik, Z., Anderova, M. Tamoxifen in the mouse brain: implications for fate-mapping studies using the tamoxifen-inducible Cre-loxP system. Frontiers in Cellular Neuroscience. 10, 243 (2016).
- Hayashi, A., et al. A double-transgenic mouse used to track migrating Schwann cells and regenerating axons following engraftment of injured nerves. Experimental Neurology. 207 (1), 128-138 (2007).
- Chen, B., Chen, Q., Parkinson, D. B., Dun, X. -. P. Analysis of schwann cell migration and axon regeneration following nerve injury in the sciatic nerve bridge. Frontiers in Molecular Neuroscience. 12, 308 (2019).
- Barrasso, A. P., Tong, X., Poché, R. A. The mito::mKate2 mouse: A far-red fluorescent reporter mouse line for tracking mitochondrial dynamics in vivo. Genesis. 56 (2), (2018).
- Sun, N., et al. A fluorescence-based imaging method to measure in vitro and in vivo mitophagy using mt-Keima. Nature Protocols. 12 (8), 1576-1587 (2017).
- McWilliams, T. G., et al. mito-QC illuminates mitophagy and mitochondrial architecture in vivo. The Journal of Cell Biology. 214 (3), 333-345 (2016).
- Cheng, X. -. T., et al. Characterization of LAMP1-labeled nondegradative lysosomal and endocytic compartments in neurons. The Journal of Cell Biology. 217 (9), 3127-3139 (2018).
- Cioni, J. -. M., Lin, J. Q., et al. Late Endosomes Act as mRNA Translation Platforms and Sustain Mitochondria in Axons. Cell. 176 (12), 56 (2019).
- Liao, Y. -. C., Fernandopulle, M. S., et al. RNA Granules Hitchhike on Lysosomes for Long-Distance Transport, Using Annexin A11 as a Molecular Tether. Cell. 179 (1), (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados