É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Dispositivo microfluídico para a separação de células de câncer de mama não metastático (MCF-7) e não tumoral (MCF-10A) usando dieletroforese AC
Neste Artigo
Resumo
As células do câncer de mama exibem diferentes propriedades dielétricas em comparação com as células epiteliais da mama não tumorais. Foi levantada a hipótese de que, com base nessa diferença nas propriedades dielétricas, as duas populações podem ser separadas para fins de imunoterapia. Para suportar isso, modelamos um dispositivo microfluídico para classificar as células MCF-7 e MCF-10A.
Resumo
Os dispositivos dieletroforéticos são capazes de detectar e manipular células cancerígenas de maneira livre de rótulos, econômica, robusta e precisa, usando o princípio da polarização das células cancerígenas no volume da amostra aplicando um campo elétrico externo. Este artigo demonstra como uma plataforma microfluídica pode ser utilizada para a classificação contínua de alto rendimento de células de câncer de mama não metastático (MCF-7) e células epiteliais de mama não tumorais (MCF-10A) usando dieletroforese hidrodinâmica (HDEP) da mistura celular. Ao gerar um campo elétrico entre dois eletrodos colocados lado a lado com uma lacuna do tamanho de um mícron entre eles em um chip microfluídico HDEP, as células epiteliais mamárias não tumorais (MCF-10A) podem ser afastadas, exibindo DEP negativo dentro do canal principal, enquanto as células de câncer de mama não metastáticas seguem seu curso não afetadas quando suspensas em meio celular devido a terem condutividade maior que a condutividade da membrana. Para demonstrar esse conceito, foram realizadas simulações para diferentes valores de condutividade média, e a classificação das células foi estudada. Um estudo paramétrico foi realizado, e uma condutividade de mistura celular adequada foi encontrada para ser de 0,4 S / m. Mantendo a condutividade média fixa, estabeleceu-se uma frequência CA adequada de 0,8 MHz, dando máxima eficiência de classificação, variando a frequência do campo elétrico. Usando o método demonstrado, depois de escolher a condutividade do meio de suspensão de mistura celular apropriada e a frequência da CA aplicada, a máxima eficiência de classificação pode ser alcançada.
Introdução
Um tumor maligno que se desenvolve dentro e ao redor do tecido mamário é uma causa frequente de câncer de mama em mulheres em todo o mundo, causando um problema crítico de saúde1. Os tumores de mama antes da metástase podem ser tratados através de cirurgia se detectados em um estágio inicial, mas se ignorados, eles podem ter implicações graves na vida do paciente, espalhando-se para seus pulmões, cérebro e ossos. Os tratamentos oferecidos em estágios posteriores, como radiação e terapias químicas, apresentam efeitos colaterais graves2. Estudos recentes têm relatado que o diagnóstico precoce do câncer de mama reduz a taxa de mortalidade em 60%3. Por isso, é imperativo trabalhar em direção a métodos personalizados de detecção precoce. Para tanto, pesquisadores que atuam em diferentes áreas da ciência e da tecnologia têm utilizado a microfluídica para desenvolver dispositivos para o diagnóstico precoce do câncer de mama4. Esses métodos incluem microcromatografia de afinidade celular, classificadores de microcélulas ativadas por magnetismo, captura e separação de células cancerígenas baseadas em tamanho e dieletroforese no chip (DEP)5,6. Essas técnicas microfluídicas relatadas na literatura permitem a manipulação celular precisa, o monitoramento em tempo real e a triagem de amostras bem definidas, que servem como etapa intermediária em muitas aplicações diagnósticas e terapêuticas5. A integração desses mecanismos de classificação com a microfluídica oferece manipulação flexível e confiável das células-alvo 7,8,9,10. Uma das principais vantagens de tal integração é a capacidade de trabalhar com amostras de fluido em volumes nano a microlitros e também ser capaz de manipular as propriedades elétricas do fluido da amostra. Ajustando a condutividade do fluido suspenso no interior de dispositivos microfluídicos, as células biológicas podem ser classificadas com base em seus tamanhos e diferenças em suas propriedades dielétricas11,12.
Entre essas técnicas, o DEP no chip é frequentemente preferido, pois é uma técnica de classificação de células sem rótulo que explora as propriedades elétricas das amostras biológicas. Foi relatado que o DEP manipula bioamostras como DNA13, RNA14, proteínas 15, bactérias16, células sanguíneas 17, células tumorais circulantes (CTCs)18 e células-tronco 19. Dispositivos microfluídicos que empregam DEP para triagem de amostras biológicas têm sido amplamente relatados na literatura20. Dispositivos microfluídicos DEP (rDEP) baseados em reservatórios para triagem de células de levedura viáveis e não viáveis têm sido relatados que protegem as células dos efeitos adversos de reações eletroquímicas21,22. Piacentini e col. relataram um classificador de células microfluídicas casteladas que separou os glóbulos vermelhos das plaquetas com uma eficiência de 97%23. Dispositivos DEP no chip com orifícios assimétricos e eletrodos embutidos também foram relatados para classificar células viáveis e não viáveis24. Valero e Demierre et al. modificaram o classificador de células microfluídicas casteladas introduzindo duas matrizes de microeletrodos em ambos os lados do canal25,26. Isso ajudou a focar as células no centro do canal. Zeynep e col. apresentaram um dispositivo microfluídico baseado em DEP para separar e concentrar células de câncer de mama MCF7 de leucócitos27. Eles relataram uma eficiência de extração de células MCF7 de leucócitos entre 74%-98% com uma frequência de 1 MHz e uma tensão aplicada variando de 10-12 Vpp. A Tabela 1 Suplementar representa uma comparação qualitativa e quantitativa entre os dispositivos de classificação microfluídica baseados em DEP com base em seu projeto, configuração de eletrodos e parâmetros operacionais (frequência e tensão aplicadas).
Mais recentemente, pesquisadores têm tentado medir as diferenças no comportamento dielétrico de células epiteliais mamárias (MCF-10A) e células de câncer de mama não metastático (MCF-7) dentro de um chip microfluídico28,29. Jithin et al. também caracterizaram as respostas dielétricas de diferentes linhagens celulares de câncer usando uma técnica de sonda coaxial aberta com frequências entre 200 MHz e 13,6 GHz30. Essas diferenças nas respostas dielétricas das linhagens celulares MCF-7 e MCF-10A podem ser exploradas para separá-las em tempo de execução e podem levar ao desenvolvimento de dispositivos personalizados de diagnóstico em estágio inicial.
Neste artigo, simulamos a classificação controlada de células de câncer de mama não metastático (MCF-7) e células epiteliais de mama não tumorais (MCF-10A) usando dieletroforese AC. A região de mudança no campo elétrico influencia a classificação dentro do chip microfluídico. A técnica proposta é fácil de implementar e permite a integração da técnica de classificação em vários layouts de chips microfluídicos. Simulações computacionais de dinâmica de fluidos (CFD) foram realizadas para estudar a separação de células de câncer de mama não metastáticas e células epiteliais de mama não tumorais, variando a condutividade do meio fluido em que as células estavam suspensas. Nessas simulações, mostra-se que, mantendo a condutividade constante e alterando a frequência aplicada, a separação de células cancerígenas e células saudáveis pode ser controlada.
Access restricted. Please log in or start a trial to view this content.
Protocolo
NOTA: O protocolo aqui utilizado utiliza o COMSOL, um software de simulação multifísica, para simular a classificação controlada de células de câncer de mama não metastático (MCF-7) e células epiteliais mamárias não tumorais (MCF-10A) usando dieletroforese AC.
1. Projeto do chip e seleção de parâmetros
- Abra o software multifísico e selecione Modelo em branco. Clique com o botão direito do mouse nas Definições Globais e selecione Parâmetros. Importe os parâmetros fornecidos na Tabela 1 para definições globais como um arquivo de texto ou insira os valores individualmente.
- Selecione Adicionar componente na guia inicial e adicione um componente 2D. Clique com o botão direito do mouse na geometria e importe o arquivo de modelo clicando duas vezes no arquivo.
- Escolha um material em branco e use as propriedades do material da Tabela 1.
- Selecione Adicionar Física na guia inicial e digite AC/DC. No nó AC/DC, escolha correntes elétricas como Física sob o subnó de campos e correntes elétricas.
- Clique com o botão direito do mouse na Corrente Elétrica e escolha os subnós Conservação de Corrente, Isolamento e Potencial Elétrico para isolar as paredes do canal para atribuir potencial aos eletrodos.
- Selecione Adicionar Física na guia inicial e, no nó Fluxo de Fluido , escolha Física de Fluxo Rastejante no subnó de Fluxo Monofásico. Clique com o botão direito do mouse em Fluxo unifásico e renderize os limites do chip como paredes usando o subnó Parede.
- Clique com o botão direito do mouse em Fluxo unifásico e adicione dois subnós de entrada e um subnó de saída.
- Atribua as entradas usando o subnó de entrada e use normal em Velocidade de Fluxo como a Condição de Limite. Atribua a tomada usando o subnó de saída.
- Selecione Adicionar Física na guia inicial e, no nó Fluxo de Fluido , escolha Física de Fluxo de Rastreamento de Partículas no subnó de Rastreamento de Partículas.
- Clique com o botão direito do mouse no nó Rastreamento de partículas e adicione a parede de subnós, subnós de propriedade de duas partículas, dois subnós de entrada, um subnó de saída, dois subnós de força de dieletroforese e um subnó de força de arrasto.
- Defina as Propriedades das Partículas para as células MCF-7 e MCF-10A usando o subnó Propriedades da Partícula . Escolha as propriedades das partículas a partir dos parâmetros na seção Definição Global .
- Adicione o subnó Força de arraste para atribuir a força dieletroforética a ambos os tipos de células.
- Adicione Propriedades de partícula neste caso a partir da seção de parâmetros. Adicione o subnó Shell ao modelo de células de mamíferos.
- Na guia inicial, escolha Adicionar malha e selecione Malha fina. Escolha Build Mesh na guia home para criar uma malha.
- Na guia inicial, clique em Adicionar estudo para adicionar três etapas de estudo . O Passo de Estudo 1 é para simular uma resposta de frequência; use um subnó do Domínio de Frequência .
- Para simular o fluxo rastejante, escolha um nó Estudo Estacionário . Adicione duas etapas dependentes do tempo para simular condições com força dieletroforética e sem força dieletroforética.
- Para a condição sem dieletroforética, escolha Física e Seleção de Variáveis, marque a caixa intitulada Modificar Configuração do Modelo para a etapa de estudo e desative a Etapa Dieletroforética. Para condições dieletroforéticas, não desative. Salve o arquivo e pressione Compute para que a simulação seja executada.
NOTA: O chip microfluídico projetado para a classificação de células de câncer de mama não metastáticas (MCF-7) e células epiteliais de mama não tumorais (MCF-10A) possui duas entradas separadas para o fluxo de mistura celular e para o foco do fluxo hidrodinâmico, respectivamente, com larguras de 20 μm e 40 μm, respectivamente, como mostrado na Figura Suplementar 1 e na Figura Suplementar 2. - Atribua a frequência (f0) sob o subnó Domínio de Frequência e tensão usando o subnó Potencial Elétrico aos eletrodos de plaina (295 μm de largura) colocados ao longo da parede lateral superior da câmara de classificação. Na saída, use a condição de parede "congelar" para visualizar as partículas classificadas.
2. Modelo matemático e análise computacional
- Verifique os parâmetros operacionais para separar células de câncer de mama não metastático e células epiteliais de mama não tumorais dentro do dispositivo microfluídico, configurando um estudo computacional de dinâmica de fluidos (CFD).
NOTA: Software multifísico (módulos AC/DC, Microfluidics e Particle Tracking) foi utilizado para este fim. As equações governantes e a base teórica são dadas em detalhes no Arquivo Suplementar 1. O modelo foi testado utilizando-se as propriedades dielétricas de células de câncer de mama não metastáticas (MCF7) e células epiteliais mamárias não tumorais (MCF-10A) relatadas na literatura31,32, que estão resumidas na Tabela 1. - Realizar as simulações de CFD introduzindo linhagens celulares de câncer de mama não metastático (MCF7) e epitelial de mama não tumoral (MCF-10A) com uma proporção de 1:1 na entrada da mistura celular.
- Inicialmente, realizar um estudo de independência da malha para otimizar o tamanho da malha para as simulações33.
NOTA: Um estudo de independência da malha foi realizado para encontrar a melhor solução para os parâmetros operacionais. Um conjunto de cinco malhagens diferentes foi escolhido para quantificar o melhor tamanho de elemento possível para a convergência da solução. Observou-se que, quando o número total de elementos que definem uma malha foi de 635 (malha mais grossa), como mostra a Figura Suplementar 3A, a eficiência de classificação foi mais baixa, com algumas das células MCF7 se movendo para a saída inferior, conforme ilustrado na Figura 3B Suplementar. Quando a malhagem foi aumentada para fina, o número de elementos que definem a malha também aumentou para 2.288. A eficiência de classificação estava no seu máximo neste caso, com as células MCF7 e MCF-10A se movendo em direção às suas respectivas saídas. A malha mais fina também foi simulada, com o número de elementos que definem a malha aumentando para 3.188. A eficiência de classificação permaneceu inalterada além desse ponto. Assim, podemos dizer com segurança que a malhagem fina funciona melhor no nosso caso. - Resolva dois conjuntos de estudos de CFD.
- Para o primeiro conjunto, clique com o botão direito do mouse no Estudo 1 e adicione o subnó Varredura Paramétrica . Pressione o sinal + para adicionar a condutividade do meio fluido "σm" como a variável de varredura. Realizar um estudo de varredura paramétrica para a condutividade do meio fluido σ m variando de 0,01 S/m a 2,5 S/m , mantendo a frequência aplicada, f (Hz), constante a um valor de 800 kHz.
- Para o segundo conjunto, realizar um estudo de Varredura Paramétrica variando a frequência CA aplicada de 100 kHz a 100 MHz, mantendo a condutividade do meio fluido, σ m, fixada em 0,4 S /m para cada caso. Este valor de σm foi escolhido com base nos resultados do primeiro estudo de CFD, pois uma separação máxima entre MCF-7 e MCF-10A foi observada neste valor.
- A força da força de dieletroforese (DEP), FDEP (-), exercida sobre uma partícula esférica dielétrica em um meio condutor é dada pela Equação 1T34:
FDEP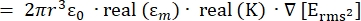 [1]
[1]
Use a Equação 1 sob o subnó de força dieletroforética. Na equação 1, r mostra o raio da partícula na qual FDEPé aplicado; K (-) é conhecido como fator de Clausius-Mossotti; εm(-) mostra a permissividade dielétrica do meio; e E(V/m) é o valor quadrado médio da raiz do campo elétrico. - Use a Equação 2 para uma partícula esférica sob o subnó de força dieletroforética.
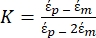 [2]
[2]
Na Equação 2,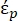 (-) mostra a permissividade complexa da partícula sobre a qual a força DEP é aplicada;
(-) mostra a permissividade complexa da partícula sobre a qual a força DEP é aplicada; 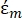 (-) mostra a permissividade complexa do fluido ao redor da partícula. A permissividade complexa
(-) mostra a permissividade complexa do fluido ao redor da partícula. A permissividade complexa 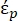 e
e 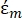 são definidos da seguinteforma 35:
são definidos da seguinteforma 35: - Use a Equação 3 para uma partícula esférica sob o subnó de força dieletroforética:
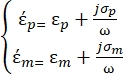 [3]
[3]
Na Equação 3, εp (-) mostra a parte real da permissividade complexa da partícula; εm (-) mostra a parte real da permissividade complexa do fluido que envolve a partícula; σp (S/m) mostra a condutividade da partícula; σ m (S/m ) mostra a condutividade do meio que envolve a partícula; e ω (Hz) é a frequência do campo elétrico aplicado.
NOTA: O sinal de Re(K) determina a polaridade do FDEP. Se o sinal de Re(K) é negativo, então a partícula experimenta uma força dieletroforética negativa (nDEP); ao contrário disso, se o sinal de Re(K) é positivo, implica uma força dieletroforética positiva (pDEP). Para o fator de Clausius-Mossotti (K), a variação está dentro da faixa de -1 a 1.
- Inicialmente, realizar um estudo de independência da malha para otimizar o tamanho da malha para as simulações33.
- Use uma forma modificada da Equação 3 para modelar células biológicas, como células de mamíferos, que são mais complexas e têm uma estrutura de várias camadas.
K (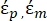 ) =
) = 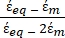 [4]
[4]
Na Equação 4, (-) incorpora tanto a permissividade complexa do citoplasma, (-), quanto a permissividade complexa da membrana celular,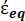
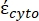
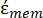 (-), e é dada da seguinte forma:36
(-), e é dada da seguinte forma:36 - Use a Equação 5 para resolver ""
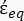 :
: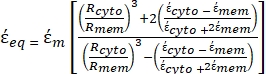 [5]
[5]
Na Equação 5, R cyto (m) e Rmem (m) mostram o raio do citoplasma celular e da membrana celular, respectivamente. - Em seguida, use a Equação 4 para plotar Re(K) como uma função do campo elétrico aplicado para células cancerígenas e saudáveis. Calcule a parte real do fator de Clausius-Mossotti (CM), Re(K), para quantificar a força dieletroforética (DEP) que a partícula experimenta.
- Clique com o botão direito do mouse no nó Resultados, adicione o subnó Avaliação de partículas e, na seção expressão, digite fpt.deff1.K para plotar o fator CM para a partícula 1 e fpt.deff2.K para a partícula 2.
NOTA: Todas as etapas de protocolo listadas no texto principal podem ser visualizadas no vídeo do protocolo (Vídeo 1).
Access restricted. Please log in or start a trial to view this content.
Resultados
Investigando os parâmetros operacionais ideais para a classificação eficaz baseada em DEP de células epiteliais não metastáticas de câncer de mama (MCF-7) e epiteliais de mama não tumorais (MCF-10A)
Para alcançar uma separação bem-sucedida de células do câncer de mama não metastático (MCF-7) e epitelial de mama não tumoral (MCF-10A) com propriedades dielétricas divergentes quando submetidas à dieletroforese, seus fatores K devem ser distintos, mantendo a frequência aplicada fixa
Access restricted. Please log in or start a trial to view this content.
Discussão
Dispositivos microfluídicos foram relatados anteriormente para cultura celular, aprisionamento e classificação 47,52,53. A fabricação desses dispositivos na sala limpa é um processo caro, e é imperativo quantificar a saída e a eficiência de um dispositivo microfluídico proposto por meio de simulações de CFD. Este estudo apresenta o desenho e as simulações de um dispositivo microfluídico dieletroforético AC para a...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram não haver potenciais conflitos de interesse.
Agradecimentos
Este estudo foi apoiado pela Comissão de Ensino Superior do Paquistão.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| COMSOL | COMSOL | multiphysics simulation software |
Referências
- Liang, L., et al. Microfluidic-based cancer cell separation using active and passive mechanisms. Microfluidics and Nanofluidics. 24 (4), 26(2020).
- Damiati, S., Kompella, U. B., Damiati, S. A., Kodzius, R. Microfluidic devices for drug delivery systems and drug screening. Genes. 9 (2), 103(2018).
- Pashayan, N., et al. Personalized early detection and prevention of breast cancer: ENVISION consensus statement. Nature Reviews Clinical Oncology. 17 (11), 687-705 (2020).
- Panesar, S., Neethirajan, S. Microfluidics: Rapid diagnosis for breast cancer. Nano-micro Letters. 8 (3), 204-220 (2016).
- Chen, J., Li, J., Sun, Y. Microfluidic approaches for cancer cell detection, characterization and separation. Lab on a Chip. 12 (10), 1753-1767 (2012).
- Beech, J. P., Holm, S. H., Adolfsson, K., Tegenfeldt, J. O. Sorting cells by size, shape and deformability. Lab on a Chip. 12 (6), 1048-1051 (2012).
- Kang, Y., Li, D. Electrokinetic motion of particles and cells in microchannels. Microfluidics and Nanofluidics. 6 (4), 431-460 (2009).
- Schmid, L., Weitz, D. A., Franke, T. Acoustic microfluidic fluorescence-activated cell sorter. Lab on a Chip. 14 (19), 3710-3718 (2014).
- Yu, B. Y., Elbuken, C., Shen, C., Huissoon, J. P., Ren, C. L. An integrated microfluidic device for the sorting of yeast cells using image processing. Scientific Reports. 8, 3550(2014).
- Asiaei, S., Darvishi, V., Davari, M. H., Zohrevandi, D., Moghadasi, H. Thermophoretic isolation of circulating tumor cells, numerical simulation and design of a microfluidic chip. Journal of Thermal Analysis and Calorimetry. 137 (3), 831-839 (2019).
- Song, Y., Li, M., Pan, X., Wang, Q., Li, D. Size-based cell sorting with a resistive pulse sensor and an electromagnetic pump in a microfluidic chip. Electrophoresis. 36 (3), 398-404 (2014).
- Giraud, G., et al. Dielectrophoretic manipulation of ribosomal RNA. Biomicrofluidics. 5 (2), 024116(2011).
- Valero, A., Braschler, T., Demierre, N., Renaud, P. A miniaturized continuous dielectrophoretic cell sorter and its applications. Biomicrofluidics. 4 (2), 022807(2010).
- Allahrabbi, N., Chia, Y. S. M., Saifullah, M. S. M., Lim, K. M., Lanry Yung, L. Y. A hybrid dielectrophoretic system for trapping of microorganisms from water. Biomicrofluidics. 9 (3), 034110(2015).
- Vykoukal, D. M., Gascoyne, P. R. C., Vykoukal, J. Dielectric characterization of complete mononuclear and polymorphonuclear blood cell subpopulations for label-free discrimination. Integrative Biology: Quantitative Biosciences from Nano to Macro. 1 (7), 477-484 (2009).
- Shim, S., et al. Antibody-independent isolation of circulating tumor cells by continuous-flow dielectrophoresis. Biomicrofluidics. 7 (1), 11807(2013).
- Jeon, H. J., Lee, H., Yoon, D. S., Kim, B. M. Dielectrophoretic force measurement of red blood cells exposed to oxidative stress using optical tweezers and a microfluidic chip. Biomedical Engineering Letters. 7 (4), 317-323 (2017).
- Song, H., et al. Continuous-flow sorting of stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15 (5), 1320-1328 (2015).
- Tsai, S. L., Chiang, Y., Wang, M. H., Chen, M. K., Jang, L. S. Battery-powered portable instrument system for single-cell trapping, impedance measurements, and modeling analyses. Electrophoresis. 35 (16), 2392-2400 (2014).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 011503(2018).
- Patel, S., et al. Microfluidic separation of live and dead yeast cells using reservoir-based dielectrophoresis. Biomicrofluidics. 6 (3), 34102(2012).
- Yildizhan, Y., Erdem, N., Islam, M., Martinez-Duarte, R., Elitas, M. Dielectrophoretic separation of live and dead monocytes using 3D carbon-electrodes. Sensors. 17 (11), 2691-2704 (2017).
- Piacentini, N., Mernier, G., Tornay, R., Renaud, P. Separation of platelets from other blood cells in continuous-flow by dielectrophoresis field-flow-fractionation. Biomicrofluidics. 5 (3), 34122(2011).
- Zhao, K., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Valero, A., et al. Tracking and synchronization of the yeast cell cycle using dielectrophoretic opacity. Lab on a Chip. 11 (10), 1754-1760 (2011).
- Demierre, N., Braschler, T., Muller, R., Renaud, P. Focusing and continuous separation Of cells in a microfluidic device using lateral dielectrophoresis. International Solid-State Sensors, Actuators and Microsystems Conference. 430 (98), 1777-1780 (2007).
- Arslan, Z. C., Yalçın, Y. D., Külah, H. Label-free enrichment of MCF7 breast cancer cells from leukocytes using continuous flow dielectrophoresis. Electrophoresis. 43 (13-14), 1531-1544 (2022).
- Turcan, I., Olariu, M. A. Dielectrophoretic manipulation of cancer cells and their electrical characterization. ACS Combinatorial Science. 22 (11), 554-578 (2020).
- Park, J., et al. Sequential cell-processing system by integrating hydrodynamic purification and dielectrophoretic trapping for analyses of suspended cancer cells. Micromachines. 11 (1), 47(2020).
- Hussein, M., et al. Breast cancer cells exhibits specific dielectric signature in vitro using the open-ended coaxial probe technique from 200 MHz to 13.6 GHz. Scientific Reports. 9, 4681(2019).
- Fornes-Leal, A., Garcia-Pardo, C., Frasson, M., Pons Beltrán, V., Cardona, N. Dielectric characterization of healthy and malignant colon tissues in the 0.5-18 GHz frequency band. Physics in Medicine and Biology. 61 (20), 7334-7346 (2016).
- Çetin, B., Li, D. Dielectrophoresis in microfluidics technology. Electrophoresis. 32 (18), 2410-2427 (2011).
- Khan, S., Khulief, Y. A., Al-Shuhail, A. A. Effects of reservoir size and boundary conditions on pore-pressure buildup and fault reactivation during CO2 injection in deep geological reservoirs. Environmental Earth Sciences. 79, 294(2020).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cellsand the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), 054109(2014).
- Lo, Y. J., et al. Measurement of the Clausius-Mossotti factor of generalized dielectrophoresis. Applied Physics Letters. 104, 083701(2014).
- Lo, Y. J., Lei, U. Measurement of the real part of the Clausius-Mossotti factor of dielectrophoresis for Brownian particles. Electrophoresis. 41 (1), 137-147 (2020).
- Ohta, A. T., et al. Optically controlled cell discrimination and trapping using optoelectronic Tweezers. IEEE Journal of Selected Topics in Quantum Electronics. 13 (2), 235-242 (2007).
- Sun, T., Morgan, H. Single-cell microfluidic Impedance cytometry. Microfluidics and Nanofluidics. 8 (4), 423-443 (2010).
- Weng, P. Y., et al. Size-dependent dielectrophoretic cross-over frequency of spherical particles. Biomicrofluidics. 10 (1), 1909-1921 (2016).
- Lu, Y. W., Sun, C., Kao, Y. C., Hung, C. L., Juang, J. Y. Dielectrophoretic cross-over frequency of single particles: Quantifying the effect of surface functional groups and electrohydrodynamic flow drag force. Nanomaterials. 10 (7), 1364(2020).
- Henslee, E. A., Sano, M. B., Rojas, A. D., Schmelz, E. M., Davalos, R. V. Selective concentration of human cancer cells using contactless dielectrophoresis. Electrophoresis. 32 (18), 2523-2529 (2011).
- Chan, J. Y., et al. Dielectrophoresis-based microfluidic platforms for cancer diagnostics. Biomicrofluidics. 12 (1), 11503-11525 (2018).
- Gascoyne, P. R. C., Shim, S. Isolation of circulating tumor cells by dielectrophoresis. Cancers. 6 (1), 545-579 (2014).
- Liang, W., et al. Determination of dielectric properties of cells using ac electrokinetic-based microfluidic platform. Micromachines. 11 (5), 513-537 (2020).
- Frusawa, H., et al. Frequency-modulated wave dielectrophoresis of vesicles and cells periodic U-turns at the crossover frequency. Nanoscale Research Letters. 13 (169), 2583-2589 (2018).
- Wei, M. T., Junio, J., Ou-Yang, D. H. Direct measurements of the frequency-dependent dielectrophoresis force. Biomicrofluidics. 3 (1), 12003(2009).
- Mustafa, A., Pedone, E., Marucci, L., Moschou, D., Lorenzo, M. D. A flow-through microfluidic chip for continuous dielectrophoretic separation of viable and non-viable human T-cells. Electrophoresis. 43 (3), 501-508 (2021).
- Wang, L., et al. Dual frequency dielectrophoresis with interdigitated sidewall electrodes for microfluidic flow-through separation of beads and cells. Electrophoresis. 30 (5), 782-791 (2021).
- Alazzam, A., Mathew, B., Alhammadi, F. Novel microfluidic device for the continuous separation of cancer cells using dielectrophoresis. Journal of Separation Science. 40 (5), 1193-1200 (2017).
- Yang, L., Banada, P. P., Bhunia, A. K., Bashir, R. Effects of dielectrophoresis on growth viability and immuno-reactivity of listeria monocytogenes. Journal of Biological Engineering. 2, 6(2008).
- Matbaechi, H., Soltani, P., Hölzel, R., Wenger, C. Dielectrophoretic immobilization of yeast cells using CMOS integrated microfluidics. Micromachines. 11 (5), 501-518 (2020).
- Mustafa, A., Pedone, E., La Regina, A., Erten, A. A., Marucci, L. Development of a single layer microfluidic device for dynamic stimulation, culture and imaging of mammalian cells. bioRxiv. , (2022).
- Mustafa, A., et al. Enhanced dissolution of liquid microdroplets in the extensional creeping flow of a hydrodynamic trap. Langmuir. 32 (37), 9460-9467 (2016).
- Chang, H. F., Chou, S. E., Cheng, J. Y. Electric-field-induced neural precursor cell differentiation in microfluidic devices. Journal of Visualized Experiments. (170), e61917(2021).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados