É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Reativação de Modelos celulares desmembrados em Chlamydomonas reinhardtii
Neste Artigo
Resumo
A reativação in vitro de células motil é um experimento crucial na compreensão dos mecanismos da motilidade celular. O protocolo descreve a reativação dos modelos de células demembradas de Chlamydomonas reinhardtii, um organismo modelo para estudar cílio/flagela.
Resumo
Desde o experimento histórico sobre a contração de músculo glicerinado adicionando ATP, que Szent-Györgyi demonstrou em meados do século XX, a reativação in vitro de células demembradas tem sido uma maneira tradicional e potente de examinar a motilidade celular. A vantagem fundamental deste método experimental é que a composição da solução de reativação pode ser facilmente alterada. Por exemplo, um ambiente de concentração de alta Ca2+ que ocorre apenas temporariamente devido à excitação da membrana in vivo pode ser replicado em laboratório. A cilia eucariótica (também conhecida como flagella) são máquinas de motilidade elaboradas cujos mecanismos regulatórios ainda devem ser esclarecidos. A alga verde unicelular Chlamydomonas reinhardtii é um excelente organismo modelo no campo de pesquisa da cília. Os experimentos de reativação utilizando modelos celulares demembrados de C. reinhardtii e seus derivados, como axonemes desmembraados de cílios isolados, contribuíram significativamente para a compreensão dos mecanismos moleculares da motilidade ciliar. Esses experimentos esclareceram que a ATP energiza a motilidade ciliar e que vários sinais celulares, incluindo ca2+, cAMP e espécies reativas de oxigênio, modulam movimentos ciliares. O método preciso para desmembranação de células C. reinhardtii e reativação dos modelos celulares é descrito aqui.
Introdução
A reativação in vitro de células motil desmembradas é uma ferramenta valiosa para estudar a base molecular para o mecanismo regulatório da motilidade celular. Szent-Györgyi demonstrou pela primeira vez contração in vitro de fibras musculares esqueléticas de coelho extraídas com 50% de glicerol adicionando adenosina triphosfato (ATP)1. Este experimento foi o primeiro a provar que a ATP energiza a contração muscular. A metodologia logo foi aplicada ao estudo da motilidade ciliar/flagellar energizada da ATP, como a flagela2, o Paramecium cilia3 e o Chlamydomonas reinhardtii cilia (também chamado de flagela)4 usando detergentes não iônicos para demembranation.
A alga verde unicelular C. reinhardtii é um organismo modelo para estudar cílios: nada com duas cílios batendo-as como um nado de peito5 humano. O movimento ciliar é impulsionado por dynein, uma proteína motor baseada em microtúbulo sem fim 6,7. Dyneins ciliares podem ser classificados em dyneins de braço externo e dyneins de braço interno. Mutantes sem cada tipo de dynein foram isolados como mutantes de natação lenta com diferentes anormalidades de motilidade. Análise detalhada de motilidade in vitro desses mutantes tem avançado significativamente a pesquisa de dynein8.
Muitos achados importantes foram alcançados utilizando este método e seus derivados desde que o experimento de reativação in vitro de células C. reinhardtii (modelos celulares) foi estabelecido. A reativação de modelos celulares em uma série de buffers Ca2+, por exemplo, mostrou9 que dois cílios são regulados de forma diferente pelo submicromolar Ca2+, e este controle assimétrico de clia permite a orientação fototática de C. reinhardtii10. Além disso, ambos os cilia mostram a conversão de forma de onda do modo de natação para a frente (chamado de forma de onda assimétrica) para o modo de natação para trás (chamado de forma de onda simétrica que aparece por um curto período quando as células estão foto ou mecano-chocadas)11,12. Essa conversão de forma de onda é regulada pelo submillimolar Ca2+, que foi demonstrado pela reativação do chamado aparelho nucleoflagelar (complexo contendo dois cílios, os corpos basais, as estruturas que ligam os corpos basais ao núcleo, e o remanescente do núcleo)11 ou axonemes de cílias isoladas13. Além do Ca2+, a postura de redox (redução-oxidação) é um sinal que regula a frequência de batida ciliar, que foi demonstrada pela reativação de modelos celulares em buffers de redox contendo diferentes razões de glutathione reduzida versus glutationaoxidada 14. Além disso, o monofosfato de adenosina cíclica (cAMP) regula assimétricamente dois cílios, o que foi mostrado pela reativação de axonemes com cAMP15 enjaular fotocleásable. Esses achados in vitro, combinados com achados genéticos, levaram a uma compreensão mais profunda dos mecanismos moleculares da regulação da clia em C. reinhardtii.
Um protocolo para reativar os modelos de células é descrito aqui. O método é simples, permite várias modificações, e pode ser aplicado a múltiplos organismos que se movem com cílios. No entanto, como as células demembraadas são frágeis, é preciso algumas dicas para reativar a motilidade dos modelos celulares com boa eficiência, evitando a dissociação.
Protocolo
Uma cepa selvagem de Chlamydomonas reinhardtii, CC-125, foi utilizada para o presente estudo. O CC-125 foi obtido do Centro de Recursos clamídias (ver Tabela de Materiais) e mantido em um tris-acetato-fosfato (TAP)16, 1,5% médio agarose a 20-25 °C.
1. Cultura celular
- Cultura Chlamydomonas reinhardtii (CC-125) em tap médio16 em um período claro-escuro de 12 h/12 h (condições de luz para o período de luz: ~50 μmol fótons m−2 s−1 luz branca) a 20-25 °C durante 2 dias (Figura 1).
NOTA: As células devem estar em uma fase de crescimento logarítmico médio (Filme 1). A cultura longa (>4 dias, no crescimento logarítmico tardio ou em fase estacionária) diminui a eficiência de reativação de modelos celulares desmembrados.

Figura 1: Cultura líquida após 2 dias de cultivo. A partir de uma placa de ágar TAP-1,5%, um pedaço de células do tipo selvagem para preencher o laço de platina foi inoculado para ~150 mL DE MEIO LÍQUIDO TAP em um frasco. A densidade celular após 2 dias de cultura foi de 2,3 × 106 células/mL. Clique aqui para ver uma versão maior desta figura.
Filme 1: Nadando de células vivas. As células foram observadas sob um microscópio com uma lente objetiva de 10x e um condensador de campo escuro de imersão a óleo. Barra de escala = 100 μm. Clique aqui para baixar este Filme.
2. Preparação de modelos de células demembradas
NOTA: Antes de iniciar o experimento, mantenha o tampão de lavagem à temperatura ambiente e a demembranação, diluição, tampões de reativação e a solução ATP no gelo. A composição desses buffers está prevista na Tabela Suplementar 1.
- Centrífuga ~10 mL de cultura líquida a 1000 × g a 20 °C por 3 min.
NOTA: Ao longo do protocolo a partir desta etapa, não utilize plásticos autoclaved (tubos, pontas de pipeta, etc.), diminuindo a eficiência de reativação. Para tubos cônicos, os reutilizados são preferíveis. A densidade celular após a cultura de 2 dias pode ser tipicamente 1.0-5.0 × 106 células/mL. Quando a densidade celular for menor que esta, tome volume de cultura suficiente para conter ~5 × 107 células. - Descarte o supernatante, primeiro por decantação e depois por uma pipeta Pasteur, e resuspenque os precipitados em ~5 mL de tampão de lavagem.
- Centrífugas no tampão de lavagem a 1000 × g por 3 min a 20 °C.
- Descarte o supernatante cuidadosamente com uma pipeta (Figura 2).
NOTA: As pipetas pasteur são preferíveis. Ao usar micropipettos, evite usar pontas de pipeta que foram autoclavadas. - Sobreposição ~0,5 mL de tampão de demembranation em uma pelota celular, agitar o tubo suavemente à mão para suspender aproximadamente as células no buffer, e colocar o tubo no gelo (Figura 3A).
NOTA: Não é necessário suspender totalmente a pelota neste momento. Aumente a concentração de MgSO de4 a 15 mM nos buffers de desmembranação e reativação quando os modelos de células forem reativados, com uma concentração final de ATP > 1 mM para reativação estável17. - Suspenda a pelota de célula restante suavemente com uma pipeta e coloque o tubo no gelo novamente (Figura 3B).
- Pegue 5-10 μL dos modelos celulares, diluir 10 vezes com o tampão de diluição e observar sob o microscópio (Filme 2) para confirmar que todos os modelos celulares estão desmembraados e não nadando (Figura 4).
NOTA: Se algumas células ainda estiverem nadando (vivas), adicione o detergente não iônico usado no tampão de demembranação diretamente à solução do modelo celular para a concentração final de ~0,15%. Alternativamente, repita as etapas 2.1-2.5 com a solução de demembranation contendo 0,15% de detergente.
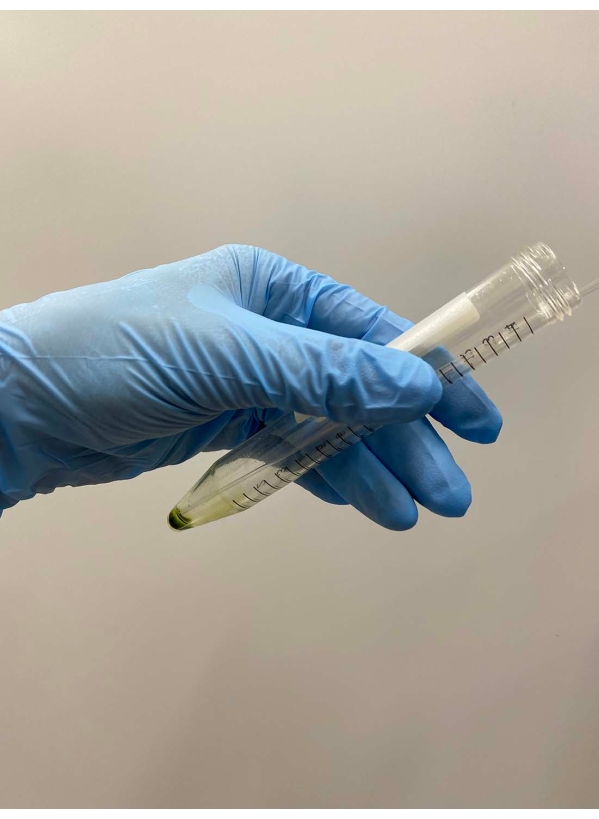
Figura 2: Descartando o supernaspe. O resto do supernante foi cuidadosamente removido com uma pipeta Pasteur depois que o supernatante foi removido por decantação do tubo. Clique aqui para ver uma versão maior desta figura.
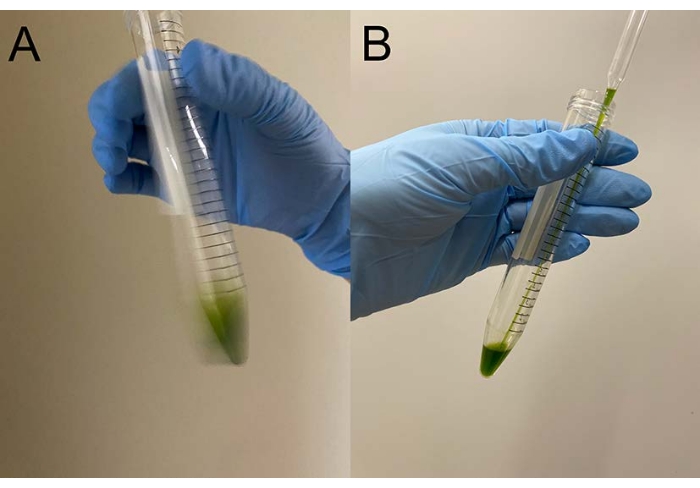
Figura 3: Demembranation. (A) Após sobrepor 0,5 mL de solução de demembranação na pelota celular, a solução foi misturada por uma mão para suspender as células aproximadamente. (B) Após a mistura, o resto da pelota de célula foi totalmente suspenso na solução por uma pipeta Pasteur. Clique aqui para ver uma versão maior desta figura.
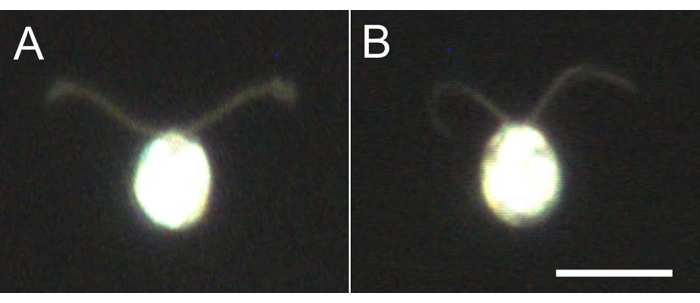
Figura 4: Efeitos da desmembranação. (A) Uma célula viva presa em um escorregador de vidro. (B) Um modelo de célula preso em uma lâmina de vidro. Note que no modelo celular, o cílio ficou um pouco mais fino. As imagens foram observadas sob um microscópio com uma lente objetiva de 20x e um condensador de campo escuro de imersão a óleo. Barra de escala = 10 μm. Clique aqui para ver uma versão maior desta figura.
Filme 2: Confirmação da desmembranation. A suspensão do modelo celular foi observada sob um microscópio com uma lente objetiva de 10x e um condensador de campo escuro de imersão a óleo. Nenhuma célula estava nadando. Barra de escala = 100 μm. Clique aqui para baixar este Filme.
3. Reativação de modelos celulares desmembrados
- Misture 80 μL de solução de reativação, 10 μL de solução ATP e 10 μL de modelos celulares em um tubo de 0,5 mL tocando no tubo (Figura 5).
NOTA: A concentração final do ATP deve ser de <3 mM porque a frequência de espancamento ciliar, um parâmetro para o movimento ciliar, aumenta com concentração de ATP e satura em 2-3 mM de ATP17.
ATENÇÃO: A mistura por pipetação ou vórtice causa decilidação e diminui a eficiência de reativação.- Para reativar com <0,2 mM de ATP, adicione um sistema de regeneração ATP, como 70 U/mL de creatina quinase e 5 mM de fosfato de creatina (ver Tabela de Materiais).
NOTA: A solução de reativação é preparada em maior concentração (1,125x, Tabela suplementar 1) do que a solução de diluição para que após a mistura do ATP dissolvido em água, o conteúdo atinja as seguintes concentrações finais: 30 mM de Hepes (pH 7,4), 5 mM de MgSO4, 1 mM de dithiothreitol (DTT), 1 mM de EGTA e 50 mM de acetato de potássio (ver Tabela de Materiais).
- Para reativar com <0,2 mM de ATP, adicione um sistema de regeneração ATP, como 70 U/mL de creatina quinase e 5 mM de fosfato de creatina (ver Tabela de Materiais).
- Coloque ~30 μL da solução mista em um slide de vidro e coloque delicadamente uma mancha de cobertura sobre ele com espaçadores para evitar choque mecânico nos modelos celulares (Figura 6).
NOTA: Podem ser usadas fitas adesivas brancas ou de dois lados para fazer os espaçadores. - Observe os modelos celulares reativados sob um microscópio (Filme 3).

Figura 5: Solução de mistura tocando no tubo. (A) A 80 μL da solução de reativação, 10 μL de solução ATP e 10 μL de modelos de células foram adicionados em ordem sequencial. (B) A solução foi misturada por tocar o tubo com um dedo. Clique aqui para ver uma versão maior desta figura.

Figura 6: Fazer espaçadores em bordas de deslizamento de cobertura. (A) Uma fina camada de petróleo branco foi aplicada na parte de trás de uma mão. (B) Uma pequena quantidade de petróleo branco foi raspada com uma borda de uma mancha de cobertura. (C) Um espaçador foi feito na borda de um deslizamento de tampa. (D) Outro espaçador foi feito na borda oposta. Clique aqui para ver uma versão maior desta figura.
Filme 3: Natação de modelos celulares reativados. A motilidade dos modelos celulares foi reativada adicionando ATP em uma concentração final de 1 mM, e observada sob um microscópio com uma lente objetiva de 10x e um condensador de campo escuro de imersão a óleo. Barra de escala = 100 μm. Clique aqui para baixar este Filme.
Resultados
O processo de demembranação e reativação em C. reinhardtii tipo de cepa selvagem (CC-125) é mostrado aqui. A cultura 2 dias após a inoculação tornou-se uma cor verde clara (passo 1.1) (Figura 1). Foram coletadas células (etapa 2.1), lavadas (etapa 2.2) e desmembradas (etapa 2.5). Após a desmembranação, todos os modelos celulares tornaram-se immotile (passo 2.7). Os cilias demembradas (chamados axonemes) permanecem ligados ao corpo celular, o que mostra que a imotilidade...
Discussão
Há dois passos críticos neste protocolo. O primeiro é um processo conhecido como demembranation, que precisa ser realizado suavemente, mas minuciosamente. A deciliação (ou seja, o descolamento de cílios do corpo celular) é induzida por tubulação vigorosa ou vórtice, tornando os modelos celulares imóveis mesmo após a adição de ATP. Normalmente, 5 × 107 células estão suspensas em ~0,5 mL de tampão de demembranação (densidade celular final: 1 × 108 células/mL). A taxa de reativaç...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este estudo foi apoiado por subsídios da Sociedade Japonesa para a Promoção da Ciência KAKENHI (https://www.jsps.go.jp/english/index.html) para a ONU (19K23758, 21K06295) e K.W. (19H03242, 20K21420, 21H00420), da Ohsumi Frontier Science Foundation (https://www.ofsf.or.jp/en/) à K.W., e da Aliança Dinâmica para Inovação Aberta conectando Humanos, Ambientais e Materiais (http://alliance.tagen.tohoku.ac.jp/english/) para a N.U. e K.W. Agradecemos à Sra. Miyuki Shinohara (Hosei Univ.) por sua ajuda na preparação dos números.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5 mL plastic tube | QSP | 502-PLN-Q | |
| 15 mL conical tube | SARSTEDT | 62.554.502 | |
| Adenosine 5'-triphosphate disodium salt hydrate (ATP) | Sima-Aldrich | A2383 | |
| Centrifuge | KUBOTA | 2800 | |
| Chlamydomonas strain CC-125 | Chlamydomonas Resource Center | https://www.chlamycollection.org/ | |
| Creatine kinase | Merck | CK-RO | |
| Creatine phosphate | Merck | CRPHO-RO | |
| Dithiothreitol (DTT) | Nakalai tesque | 14128-46 | |
| GEDTA(EGTA) | Dojindo | G002 | |
| Hepes | Dojindo | GB70 | |
| Igepal CA-630 | Sigma-Aldrich | I8896 | IUPAC name is octylphenoxypolyethoxyethanol: IGEPAL CA-630 is a substitute for Nonidet P-40 (NP-40); NP-40 is no longer available in Sigma-Aldrich. |
| MgSO4-7H2O | Nakalai tesque | 21002-85 | |
| Microscope | Olympus | BX-53 | |
| Pasteur pipette | fisher scientific | 13-678-20C | |
| Polyethylene glycol, Mr 20,000 | Merck | 8.18897.1000 | |
| Pottasium acetate | Nakalai tesque | 28434-25 | |
| Sodium Hydroxide | Nacalai | 31511-05 | |
| Sucrose | FUJIFILM Wako Pure Chemical Corporation | 196-00015 |
Referências
- Szent-Gyorgyi, A. Free-energy relations and contraction of actomyosin. Biological Bulletin. 96 (2), 140-161 (1949).
- Hoffman-Berling, H. Adenosintriphosphat als betriebsstoff von zellbewegungen. Biochimica et Biophysica Acta. 14, 182-194 (1954).
- Naitoh, Y., Kaneko, H. Reactivated Triton-extracted models of Paramecium: modification of ciliary movement by calcium ions. Science. 176 (4034), 523-524 (1972).
- Witman, G. B., Plummer, J., Sander, G. Chlamydomonas flagellar mutants lacking radial spokes and central tubules. Structure, composition, and function of specific axonemal components. Journal of Cell Biology. 76 (3), 729-747 (1978).
- Rüffer, U., Nultsch, W. Flagellar coordination in Chlamydomonas cells held on micropipettes. Cell Motility and the Cytoskeleton. 41 (4), 297-307 (1998).
- Sale, W. S., Satir, P. Direction of active sliding of microtubules in Tetrahymena cilia. Proceedings of the National Academy of Sciences of the United States of America. 74 (5), 2045-2049 (1977).
- Fox, L. A., Sale, W. S. Direction of force generated by the inner row of dynein arms on flagellar microtubules. Journal of Cell Biology. 105 (4), 1781-1787 (1987).
- Kamiya, R., Yagi, T. Functional diversity of axonemal dyneins as assessed by in vitro and in vivo motility assays of Chlamydomonas mutants. Zoolog Science. 31 (10), 633-644 (2014).
- Kamiya, R., Witman, G. B. Submicromolar levels of calcium control the balance of beating between the two flagella in demembranated models of Chlamydomonas. Journal of Cell Biology. 98 (1), 97-107 (1984).
- Okita, N., Isogai, N., Hirono, M., Kamiya, R., Yoshimura, K. Phototactic activity in Chlamydomonas 'non-phototactic' mutants deficient in Ca2+-dependent control of flagellar dominance or in inner-arm dynein. Journal of Cell Science. 118, 529-537 (2005).
- Hyams, J. S., Borisy, G. G. Isolated flagellar apparatus of Chlamydomonas: characterization of forward swimming and alteration of waveform and reversal of motion by calcium ions in vitro. Journal of Cell Science. 33, 235-253 (1978).
- Fujiu, K., Nakayama, Y., Yanagisawa, A., Sokabe, M., Yoshimura, K. Chlamydomonas CAV2 encodes a voltage- dependent calcium channel required for the flagellar waveform conversion. Current Biology. 19 (2), 133-139 (2009).
- Bessen, M., Fay, R. B., Witman, G. B. Calcium control of waveform in isolated flagellar axonemes of Chlamydomonas. Journal of Cell Biology. 86 (2), 446-455 (1980).
- Wakabayashi, K., King, S. M. Modulation of Chlamydomonas reinhardtii flagellar motility by redox poise. Journal of Cell Biology. 173 (5), 743-754 (2006).
- Saegusa, Y., Yoshimura, K. cAMP controls the balance of the propulsive forces generated by the two flagella of Chlamydomonas. Cytoskeleton. 72 (8), 412-421 (2015).
- Gorman, D. S., Levine, R. P. Cytochrome f and plastocyanin: their sequence in the photosynthetic electron transport chain of Chlamydomonas reinhardi. Proceedings of the National Academy of Sciences of the United States of America. 54 (6), 1665-1669 (1965).
- Takano, W., Hisabori, T., Wakabayashi, K. Rapid estimation of cytosolic ATP concentration from the ciliary beating frequency in the green alga Chlamydomonas reinhardtii. Journal of Biological Chemistry. 296, 100156 (2021).
- Wakabayashi, K., Yagi, T., Kamiya, R. Ca2+-dependent waveform conversion in the flagellar axoneme of Chlamydomonas mutants lacking the central-pair/radial spoke system. Cell Motility and the Cytoskeleton. 38 (1), 22-28 (1997).
- Yueh, Y. G., Crain, R. C. Deflagellation of Chlamydomonas reinhardtii follows a rapid transitory accumulation of inositol 1,4,5-trisphosphate and requires Ca2+ entry. Journal of Cell Biology. 123 (4), 869-875 (1993).
- Wakabayashi, K., Ide, T., Kamiya, R. Calcium-dependent flagellar motility activation in Chlamydomonas reinhardtii in response to mechanical agitation. Cell Motility and the Cytoskeleton. 66 (9), 736-742 (2009).
- Ueki, N., Wakabayashi, K. Detergent-extracted Volvox model exhibits an anterior-posterior gradient in flagellar Ca2. Proceedings of the National Academy of Sciences of the United States of America. 115 (5), 1061-1068 (2018).
- Tanno, A., et al. The four-celled Volvocales green alga Tetrabaena socialis exhibits weak photobehavior and high-photoprotection ability. PLoS One. 16 (10), 0259138 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados