Method Article
Purificação e Controle de Qualidade de Complexos de Septina Recombinante para Reconstituição Livre de Células
Neste Artigo
Resumo
A reconstituição in vitro de proteínas citoesqueléticas é uma ferramenta vital para entender as propriedades funcionais básicas dessas proteínas. O presente trabalho descreve um protocolo para purificar e avaliar a qualidade de complexos de septina recombinante, que desempenham um papel central na divisão e migração celular.
Resumo
As septinas são uma família de proteínas eucarióticas conservadas de ligação ao GTP que podem formar filamentos citoesqueléticos e estruturas de ordem superior a partir de complexos hetero-oligoméricos. Eles interagem com outros componentes citoesqueléticos e a membrana celular para participar de funções celulares importantes, como migração e divisão celular. Devido à complexidade das muitas interações das septinas, ao grande número de genes da septina (13 em humanos) e à capacidade das septinas de formar complexos heterooligoméricos com diferentes composições de subunidades, a reconstituição livre de células é uma estratégia vital para entender os fundamentos da biologia da septina. O presente trabalho descreve pela primeira vez um método para purificar septinas recombinantes em sua forma hetero-oligomérica usando uma abordagem de cromatografia de afinidade em duas etapas. Em seguida, o processo de controle de qualidade usado para verificar a pureza e a integridade dos complexos de septina é detalhado. Este processo combina eletroforese em gel nativa e desnaturante, microscopia eletrônica de coloração negativa e microscopia de espalhamento interferométrico. Finalmente, uma descrição do processo para verificar a capacidade de polimerização de complexos de septina usando microscopia eletrônica de coloração negativa e microscopia fluorescente é dada. Isso demonstra que é possível produzir hexâmeros e octameros de septina humana de alta qualidade contendo diferentes isoformas de septin_9, bem como hexâmeros de septina de Drosophila .
Introdução
O citoesqueleto tem sido classicamente descrito como um sistema de três componentes constituído por filamentos de actina, microtúbulos e filamentos intermediários 1, mas recentemente, as septinas têm sido reconhecidas como um quarto componente do citoesqueleto1. As septinas são uma família de proteínas ligadoras de GTP que são conservadas em eucariotas2. As septinas estão envolvidas em muitas funções celulares, como a divisão celular3, a adesão célula-célula4, a motilidade celular5, a morfogênese6, a infecção celular7 e o estabelecimento e manutenção da polaridade celular8. Apesar de suas funções importantes, como as septinas estão envolvidas em tais processos é pouco compreendida.
A família de proteínas septinas é subdividida em vários subgrupos (quatro ou sete, dependendo da classificação) com base na similaridade da sequência proteica2. Membros de diferentes subfamílias podem formar complexos heterooligoméricos palindrômicos, que são os blocos de construção dos filamentos e que, por sua vez, se reúnem em estruturas de ordem superior, como feixes, anéis e malhas 1,9,10,11,12. Maior complexidade molecular surge da presença de diferentes variantes de emenda, sendo um exemplo o SEPT9 humano, onde há evidências de funções específicas de diferentes variantes de emenda13,14,15. Além disso, o comprimento dos heterooligômeros depende da espécie e do tipo de célula. Por exemplo, as septinas de Caenorhabditis elegans formam os tetrâmeros 16, as septinas de Drosophila melanogaster formam hexâmeros 17 (Figura 1A), as septinas de Saccharomyces cerevisiae formam octameros 18 e as septinas humanas formam hexâmeros e octameros19 (Figura 1A). A capacidade das isoformas de septina, variantes de emenda e septinas pós-translacionais modificadas de uma mesma subfamília de se substituírem mutuamente no complexo e a (co)existência de heterooligômeros de tamanhos diferentes têm dificultado o delineamento das funções celulares de diferentes complexos heterooligoméricos12.
Outra habilidade interessante das septinas é a sua capacidade de interagir com muitos parceiros de ligação na célula. As septinas ligam-se à membrana plasmática e às organelas membranosas durante a interfase e a divisão celular20,21,22. Na divisão celular, as septinas cooperam com a anilina 23,24,25 e com a actina e miosina durante a citocinese 26,27. Nos estágios finais da citocinese, as septinas parecem regular os complexos de triagem endossômica necessários para o sistema de transporte (ESCRT) para abscisão do corpo médio28. Além disso, há também evidências de septina localizada no córtex de actina e fibras de estresse de actina de células em células interfásicas 29,30,31. Em tipos celulares específicos, as septinas também se ligam e regulam o citoesqueleto dos microtúbulos32,33.
Todas essas características tornam as septinas um sistema proteico muito interessante para estudar, mas também um desafio. A combinação do grande número de subunidades de septina (13 genes em humanos sem contar variantes de emenda 2) com o potencial de subunidades de septina da mesma subfamília para substituir umas às outras e formar hetero-oligômerosde tamanhos diferentes torna difícil tirar uma conclusão sobre a função celular de uma septina específica por manipulação genética. Além disso, as múltiplas interações das septinas tornam difícil interpretar os efeitos de ferramentas de pesquisa comuns, como drogas34 direcionadas a componentes citoesqueléticos ou de membrana.
Uma forma de superar essa situação é complementar a pesquisa em células com reconstituição in vitro (livre de células) de septinas. A reconstituição in vitro permite o isolamento de um único tipo de heterooligômeros de septina com uma composição e comprimento de subunidades específicas 18,35,36,37. Este complexo pode então ser estudado em um ambiente controlado, seja sozinho para descobrir as propriedades estruturais e físico-químicas básicas das septinas 38,39,40, ou em combinação com parceiros desejados, como biomembranas modelo 11,41,42, filamentos de actina 10,27 ou microtúbulos 32,36 para decifrar a natureza de seus Interações.
Portanto, um método confiável para purificar diferentes complexos de septina de forma eficiente é vital para a pesquisa de septina. No entanto, mesmo usando o mesmo protocolo, diferentes purificações podem dar proteínas com diferentes atividades/funcionalidades ou mesmo integridade. Para proteínas comercialmente disponíveis, como enzimas, a funcionalidade e a atividade enzimática são cuidadosamente validadas43. A implementação de um controle de qualidade cuidadoso para proteínas citoesqueléticas ou estruturais, como as septinas, pode ser um desafio, mas é essencial tornar os experimentos em laboratórios comparáveis.
Este trabalho descreve um método robusto para purificar septinas recombinantes de alta qualidade em sua forma hetero-oligomérica baseado na expressão simultânea de dois vetores contendo construtos mono ou bi-cistrônicos (Tabela 1) em células de Escherichia coli. O método consiste em uma abordagem de cromatografia de afinidade em duas etapas para capturar heterooligômeros de septina contendo uma septina marcada com6 e uma septina marcada com Strep-II (Figura 1B,C). Esse protocolo, descrito pela primeira vez em Iv et al.10, tem sido utilizado para purificar hexâmeros de Drosophila septina 11,27,35, hexâmeros de septina humana 10 e vários octameros de septina humana contendo diferentes isoformas nativas (isoforma 1, 3 e 5)10,32 ou mutantes de SEPT9 32 . Além disso, é dada uma descrição de um conjunto de técnicas para avaliar a qualidade das septinas purificadas. Primeiro, a integridade e a estequiometria correta das subunidades de septina são verificadas usando eletroforese desnaturante e microscopia eletrônica de transmissão (MET). Em seguida, a presença de heterooligômeros da massa molecular correta e a presença de monômeros ou oligômeros menores indicativos de instabilidade complexa são examinadas por eletroforese nativa e fotometria de massa via microscopia de espalhamento interferométrico (iSCAT). Por fim, a última etapa consiste na avaliação da atividade polimerizante das septinas utilizando microscopia de fluorescência e MET.
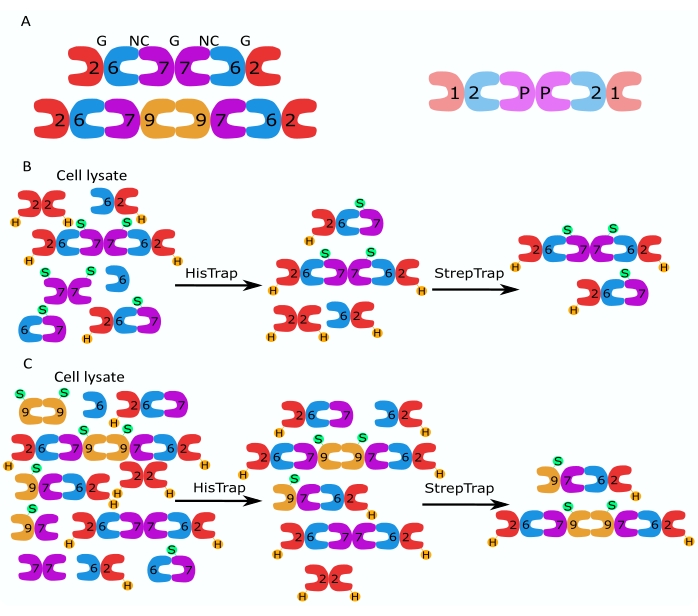
Figura 1: Estratégia de purificação. (A) Esquemas dos heterooligômeros de septina que existem em células humanas (esquerda) e Drosophila (direita). Os números denotam subunidades de septina dos grupos indicados, e P denota amendoim. O SEPT9 humano pode ser qualquer uma de suas isoformas. As subunidades de septina têm uma forma assimétrica e estão longitudinalmente associadas a duas interfaces distintas, a NC:NC e a interface G:G, como denotado por NC e G, respectivamente, no topo do hexâmero humano. (B,C) Ilustração esquemática da estratégia de cromatografia em duas etapas, mostrada para (B) hexâmeros de septina humana e (C) otâmeros. H indica as tags his, enquanto S indica as tags Strep-II. Por favor, clique aqui para ver uma versão maior desta figura.
Protocolo
1. Purificação de hetero-oligômeros de septina
- Co-transformação de células bacterianas com os vetores de expressão
- Selecione uma combinação de um pnEA e um plasmídeo pnCS44 que será usado para expressão. Escolha a combinação dependendo da composição desejada da subunidade do heterooligômero de septina10,35 e se a marcação fluorescente é ou não necessária.
NOTA: A superpasta monomérica GFP (msfGFP) com marcação C terminalmente marcada com SEPT2 (para septinas humanas) ou msfGFP ou GFP aprimorada monomérica (mEGFP)-DSep2 (para septinas de Drosophila ) é usada aqui (Tabela 1). - Pipetar 1 μL de cada plasmídeo (~1 ng/μL) para 100 μL de células BL21 Escherichia coli competentes e incubar no gelo durante 20 min.
- Colocar as células em banho-maria a 42 °C durante 40 s e, em seguida, incubá-las imediatamente durante 3 minutos no gelo.
- Adicionar 0,9 ml de caldo de lisogenia (LB) meio à suspensão celular e deixar as células crescerem durante 1 h a 37 °C. Placa de 100 μL de células em placas quentes de ágar LB contendo 100 μg/mL de ampicilina e 100 μg/mL de espectinomicina e incubar durante a noite a 37 °C.
- Selecione uma combinação de um pnEA e um plasmídeo pnCS44 que será usado para expressão. Escolha a combinação dependendo da composição desejada da subunidade do heterooligômero de septina10,35 e se a marcação fluorescente é ou não necessária.
- Cultivar pré-cultura bacteriana
- Encher um balão de Erlenmeyer de 250 ml com 100 ml de caldo Terrific (TB) ou meio LB contendo 100 μg/ml de ampicilina e 100 μg/ml de espectinomicina.
- Seleccionar uma única colónia da placa de ágar LB com um circuito de inoculação estéril e transferi-la para um meio fresco a partir do passo 1.2.1.
- Incubar a 37 °C numa incubadora agitadora rotativa, durante a noite ou durante, pelo menos, 6 h.
NOTA: A partir desta cultura, um estoque de glicerol pode ser preparado misturando a suspensão bacteriana 1:1 com glicerol e armazenado a -80 °C. Este estoque pode ser usado na etapa 1.2.2. em vez de uma colônia recém-transformada.
- Cultura bacteriana e indução da expressão proteica
- Transfira 100 mL de bactérias cultivadas para 5 L de TB ou LB contendo 50 μg/mL de ampicilina e 50 μg/mL de espectinomicina.
- Cultivar esta cultura a 37 °C em uma incubadora agitadora até atingir uma densidade óptica (OD) medida a um comprimento de onda de 600 nm na faixa de 2-3 para septinas não marcadas ou 0,6-0,8 para septinas marcadas com msfGFP/mEGFP e induzir a expressão de proteínas adicionando uma concentração final de 0,5 mM IPTG. A DO mais baixa para as septinas marcadas é evitar atingir a fase de morte em seu tempo de expressão mais longo, conforme detalhado na próxima etapa.
- Incubar as células que expressam heterooligômeros de septina não marcados por 3 h a 37 °C ou as células que expressam heterooligômeros marcados com msfGFP durante a noite a 17 °C.
NOTA: O curto tempo de expressão proteica para complexos não marcados, facilitado pelo uso do meio TB mais rico, é escolhido para evitar a degradação proteica. O tempo de expressão mais longo combinado com a temperatura mais baixa para complexos rotulados é escolhido para permitir a dobragem correta da tag msfGFP.
- Lise bacteriana e clarificação de lisado
NOTA: A partir deste ponto, no processo de purificação, manter a solução que contém proteínas no gelo ou a 4 °C em todos os momentos para evitar a degradação proteolítica da proteína ou a perda de atividade.- Recolher as células cultivadas por centrifugação a 4.000 x g durante 20 min a 4 °C. Descarte o sobrenadante.
- Opcionalmente, congele o pellet nesta etapa e armazene a -80 °C por no máximo 6 meses. Se esta opção for escolhida, certifique-se de descongelar a pelota no gelo antes de continuar.
- Dissolva o pellet em 100 mL de tampão de lise (Tabela 2) e lise as células. Escolha uma das duas opções abaixo
- Sonicate em 7 ciclos de 30 s ON e 59 s OFF com um sonicator de ponta usando 30% de amplitude (note que as configurações são sonicator-dependentes).
- Quebre as células da imprensa francesa passando-as pelo menos 3x.
- Clarificar o lisado celular centrifugando a 20.000 x g durante 30 min a 4 °C e manter o sobrenadante. Recomenda-se começar com a etapa 1.5.1. durante esta etapa centrífuga.
- Opcionalmente, colher uma amostra para electroforese desnaturante, conforme descrito na secção 2.
- Recolher as células cultivadas por centrifugação a 4.000 x g durante 20 min a 4 °C. Descarte o sobrenadante.
- Cromatografia de afinidade para proteínas marcadas com His
NOTA: Esta etapa produz complexos contendo SEPT2 humano ou Drosophila Sep1 usando uma coluna de níquel (Figura 1B).- Equilibrar uma coluna pré-embalada de cromatografia de alta eficiência de sefarose de níquel com tampão de septina (Tabela 2).
- Carregar o sobrenadante clarificado sobre a coluna a 1 ml/min e lavar a proteína ligada com, pelo menos, três volumes de coluna de tampão de septina.
- Eluir os complexos de septina com tampão de eluição HisTrap a 50% (Tabela 2) a 1 mL/min enquanto coleta frações de 0,5 mL para produzir uma concentração de imidazol de 250 mM.
- Escolher as fracções que contêm complexos de septina, conforme indicado pela absorvância óptica do eluato a 280 nm monitorizada online com um sistema de cromatografia líquida de proteínas rápidas (FPLC) ou após a purificação com um espectrofotómetro de microvolume.
NOTA: O imidazol absorve a luz a 280 nm. Isso provavelmente explica por que o pico de proteína não volta à absorvância zero após a eluição da septina (Figura 2A).
- Cromatografia de afinidade para proteínas marcadas com Strep-II
NOTA: Esta etapa produz complexos contendo SEPT7 humano (hexâmeros), SEPT9 humano (octameros) ou amendoim Drosophila usando uma coluna Strep-Tactin (Figura 1B). A coluna de cromatografia é baseada em um sistema modificado de biotina-estreptavidina. A proteína é marcada com biotina modificada (Strep-II-tag), e a coluna contém uma estreptavidina modificada (Strep-Tactin). Apesar de ser modificado a partir do sistema de biotina-estreptavidina, não há interferência entre o sistema Strep-Tactin-Strep-II-tag e o sistema de biotina-estreptavidina. O sistema descrito é usado para evitar interferência com ensaios de reconstituição usando biotina e estreptavidina.- Equilibrar uma coluna pré-embalada de cromatografia de alta eficiência StrepTactin sepharose com tampão de septina (Tabela 2). Carregar as fracções contendo septina recuperadas da coluna de níquel a 1 ml/min e lavar a proteína ligada com, pelo menos, três volumes de coluna de tampão de septina.
- Eluir os complexos de septina com tampão de eluição StrepTrap a 100% (Tabela 2) a 1 mL/min enquanto coleta frações de 0,5 mL para produzir uma concentração de destiobiotina de 2,5mM.
NOTA: A destiobiotina no buffer de eluição StrepTrap deve ser dissolvida fresca. - Escolher as fracções que contêm complexos de septina, conforme indicado pela absorvância óptica do eluato a 280 nm monitorizada online com um sistema FPLC ou após a purificação com um espectrofotómetro de microvolume.
NOTA: A eletroforese de desnaturação é geralmente feita neste ponto com amostras das lavagens da coluna e frações de septina. A ordem das colunas pode ser invertida com resultados indistinguíveis, ou seja, o lisado clarificado após o passo 1.4. pode ser submetido à cromatografia de afinidade Strep-Tactin seguida de cromatografia de afinidade de níquel.
- Diálise e armazenamento
- Para remover a destiobiotina da solução de armazenamento final, dialise os complexos de septina em uma relação de volume de amostra para tampão de ~1:300 em relação ao tampão de septina (Tabela 2) suplementada com TDT de 1 mM durante a noite, ou por pelo menos 4 h, a 4 °C usando uma membrana de diálise MWCO de 30 kDa.
- Opcionalmente, concentrar as septinas usando uma coluna de concentração centrífuga MWCO de 30 kDa até a concentração desejada. Apontar para uma concentração de 5-7 μM, medida através da absorbância óptica da solução a 280 nm e utilizando um coeficiente de extinção teórico calculado através do ProtParam (Tabela 3).
- Aliquotar os complexos proteicos no tamanho de alíquota desejado, congelar a alíquota e armazená-la a -80 °C.
NOTA: Recomenda-se não armazenar a proteína por mais de 6 meses. Além disso, recomenda-se a realização de experimentos regulares de controle de qualidade, especialmente se a proteína for armazenada por mais tempo do que o tempo recomendado.
2. Controle de qualidade da pureza e integridade do heterooligômero da septina
NOTA: O controle de qualidade do heterooligômero consiste em um conjunto de técnicas bioquímicas e de imagem que permitem a detecção da massa e integridade dos complexos de septina presentes na solução.
- Eletroforese desnaturante para verificar a formação do hetero-oligômero de septina com os componentes corretos
- Misture 10 μL das frações selecionadas com 10 μL de tampão de amostra SDS 2x, carregue-os em um gel TGX pré-moldado de 4% a 15% e encha o sistema com tampão de corrida Tris/glicina/SDS.
- Execute a eletroforese por 35 min a 200 V e manche o gel (Tabela de Materiais) para visualizar os resultados. Os pesos moleculares das proteínas septinas individuais e dos complexos heterooligoméricos de septina podem ser encontrados na Tabela 3.
- Meça a intensidade relativa de cada faixa dentro de cada pista contendo septinas purificadas em uma imagem invertida por contraste. Faça isso calculando a intensidade média de retângulos de tamanho igual em torno de cada banda e de um retângulo de tamanho igual em uma região sem qualquer faixa na mesma faixa. Em seguida, normalize os valores dividindo a intensidade de cada banda pela intensidade da região sem bandas.
NOTA: Se a intensidade estiver saturada (por exemplo, valores de 255 para uma imagem de 8 bits em uma imagem invertida por contraste), pule a faixa.
- Distribuição de tamanho nativo em média de conjunto via eletroforese nativa
- Prepare 800 mL de tampão ânodo e 200 mL de tampão catódico azul claro no dia anterior e guarde-os na geladeira. Para preparar o tampão anódico, dilua 40 mL de tampão de corrida 20x com 760 mL de água deionizada tipo I (I-água). Para preparar o tampão catódico azul claro, diluir 10 mL de tampão de corrida 20x e 1 mL de aditivo catódico 20x com 189 mL de água I. O tampão de corrida e o aditivo catódico vêm com um kit (Tabela de Materiais).
- Preparar 10 μL da amostra misturando ~500 ng de septina com a quantidade necessária de tampão de amostra (2,5 μL neste caso, devido ao uso de um tampão de amostra 4x; ver Tabela de Materiais) e água I suficiente para atingir um volume de 10 μL.
- Carregue as amostras no gel e encha o sistema com os tampões de ânodo e cátodo gelados.
- Execute a eletroforese por cerca de 115 min a 150 V com uma fonte de alimentação que não pare em baixas correntes e manche o gel (Tabela de Materiais) para visualizar os resultados. Os pesos moleculares das proteínas e complexos isolados calculados com base na sequência podem ser encontrados na Tabela 3.
- Distribuição de massa de molécula única usando fotometria de massa via microscopia de espalhamento interferométrico
- Lave as lâminas de vidro # 1.5 sonicando-as em um limpador ultra-sônico por 5 min em I-water, 5 min em isopropanol e, finalmente, 5 min em I-water.
- Seque duas lâminas de vidro com um fluxo suave de gás nitrogênio e coloque uma gota de 7 μL de solução de poli-L-lisina (PLL) a 0,01% no centro de uma das lâminas. Em seguida, coloque o centro da outra lâmina em cima da gota PLL, orientando as duas lâminas ortogonalmente para facilitar a separação. Incubar por 30 s.
- Lave imergindo em um copo com I-água 1x e aplicando diretamente uma corrente de I-água 2x. Em seguida, seque as duas lâminas com um fluxo de gás nitrogênio. Estas lâminas podem ser armazenadas depois por cerca de 6 semanas à temperatura ambiente em condições secas.
Observação : rotule o lado do slide que é tratado com o PLL para executar corretamente o experimento.
- Lave imergindo em um copo com I-água 1x e aplicando diretamente uma corrente de I-água 2x. Em seguida, seque as duas lâminas com um fluxo de gás nitrogênio. Estas lâminas podem ser armazenadas depois por cerca de 6 semanas à temperatura ambiente em condições secas.
- Pouco antes do experimento, corte um pedaço de 2 x 2, 3 x 2 ou 3 x 3 juntas (que produzem 4, 6 ou 9 câmaras de imagem / slide, respectivamente) e cole-o na parte tratada com PLL de uma lâmina de vidro, evitando que a lâmina de vidro e as juntas entrem em contato com qualquer superfície suja. Coloque o deslizamento em um lenço de limpeza leve e pressione as juntas com uma ponta de pipeta para colá-las com o plástico protetor ainda nas juntas.
- Aqueça o tampão de septina (Tabela 2) à temperatura ambiente e descongele as proteínas na mão (mantenha-as no gelo depois).
NOTA: O iSCAT mostra o sinal de alguns detergentes e pequenas moléculas que se assemelham a sinais proteicos45. A TDT é uma dessas pequenas moléculas, e é por isso que não é usada para esta experiência. Há apenas um vestígio de TDT proveniente da septina armazenada. - Coloque a lâmina com juntas no sistema comercial de fotometria de massa contendo 19 μL de tampão de septina e foque o microscópio usando a opção de foco automático. Siga as instruções do fabricante para verificar se o foco encontrado está correto. O objetivo padrão de 100x que faz parte da configuração é usado aqui.
- Crie ou carregue uma pasta de projeto para armazenar os dados usando Arquivo > Novo Projeto ou Arquivo > Projeto de Carregamento.
- Pipetar 1 μL de amostra para os 19 μL de gota tampão de septina (passo 2.3.5) utilizada para focar e misturar, minimizando o movimento da lâmina, não tocando em nada ao fazê-lo. Em seguida, grave um vídeo de 6.000 quadros clicando em Gravar.
- Para uma análise correta, registre as seguintes amostras: tampão de septina, padrão de massa proteica para a calibração da relação sinal-massa (se uma calibração recente estiver disponível e as condições ambientais não tiverem mudado, esta amostra pode ser ignorada) e 250 nM de complexos de septina diluídos em tampão de septina sem TDT (isso dá uma concentração final de ~12,5 nM).
- Analise os vídeos usando o software do fabricante para obter a distribuição de massa de proteínas. Verifique se há dados de boa qualidade da seguinte forma.
- Se os picos de diferentes tamanhos de hetero-oligômeros de septina estiverem se sobrepondo demais ou muitos eventos forem detectados (>3.500 eventos para um vídeo de 6.000 quadros com o campo de visão regular de 128 pixels x 34 pixels abrangendo 10,8 μm x 2,9 μm), diminua a concentração final de septina e meça novamente.
- Se não houver contagens suficientes de moléculas individuais medidas (pelo menos 2.500-3.500 para um vídeo de 6.000 quadros com o campo de visão regular), aumente a concentração de septina e meça novamente.
- Imagem direta de complexos de septina via microscopia eletrônica de transmissão de coloração negativa
- Diluir as amostras até uma concentração de cerca de 50 nM em tampão de septina e preparar a solução de coloração (formato de uranilo a 2% ou acetato de uranilo em I-água).
NOTA: O formato Uranyl deve ser preparado fresco. - Pipetar 4 μL de septinas diluídas em uma grade de microscopia eletrônica descarregada por brilho e incubar por 30 s.
- Remova a maior parte da solução proteica usando um papel de filtro e lave a grade 2x com tampão de septina e 1x com I-água para remover septinas vagamente adsorvidas.
- Coloração com acetato de uranila a 2% ou solução de formato de uranila em I-água por 1 min, absorva a solução de coloração com um papel de filtro e seque a grade ao ar por alguns minutos.
- Filtre a grade usando um microscópio eletrônico de transmissão devidamente alinhado para procurar regiões de mancha aprimorada e coletar cerca de 100 imagens dentro dessas áreas selecionadas.
- Colete imagens com uma ampliação de pelo menos 50.000x para obter um tamanho de pixel de cerca de 2 Å/pixel e com um desfoco variando de -1 μm a -2 μm. Use uma tensão de aceleração de 200 kV. De preferência, utilize um procedimento automatizado para coletar os dados, o que dependerá do software de aquisição disponível.
- Execute o processamento de imagens 2D usando software dedicado
- Encaixote pelo menos 2.000 partículas usando um software dedicado46.
- Execute o alinhamento bidimensional e a classificação iterativamente até que as classes sejam obtidas sem melhorias adicionais. A primeira etapa de alinhamento e classificação deve ser livre de referência para evitar qualquer viés na classificação.
- Use as médias obtidas a partir da primeira classificação livre de referência como novas referências para realizar uma rodada extra de classificação. Repita esse processo iterativamente até que nenhuma melhoria adicional seja alcançada. Certifique-se de que cada classe seja baseada em 50 a 100 partículas escolhidas e que as subunidades individuais sejam claramente visíveis. Diferentes ferramentas de software podem ser usadas (Spider, Eman ou Relion)46,47,48.
- Diluir as amostras até uma concentração de cerca de 50 nM em tampão de septina e preparar a solução de coloração (formato de uranilo a 2% ou acetato de uranilo em I-água).
3. Controle de qualidade funcional da septina via análise de polimerização
NOTA: O controle de qualidade da funcionalidade consiste em um conjunto de técnicas de imagem que permitem a detecção de complexos de septina polimerizados. Abaixo, as septinas não marcadas são referidas como septinas "escuras", e o tampão usado para polimerizar septinas não marcadas é referido como tampão de polimerização de septina "escura" (SPB).
- Imagem do feixe de septina via microscopia de fluorescência
- Preparar o fluoSPB 5x (Tabela 2) e uma mistura de septina composta por 90% de septina escura e 10% de msfGFP-septina na concentração seis vezes maior do que a concentração final desejada no tampão septina + 1 mM DTT. Uma concentração típica para este ensaio é de 300 nM e, portanto, a concentração é de 1.800 nM para esta mistura.
- Polimerizar a septina misturando, nesta ordem específica, água I (suficiente para completar até o volume final desejado), 20% de 5xfluoSPB (uma diluição final de 1:5), 0,05 μM de PCD e 16,67% de mistura de septina (uma diluição final de 1:6). Para 10 μL, misture 6,23 μL de água I, 2 μL de 5xfluoSPB, 0,1 μL de PCD (com um estoque de 5 μM) e 1,67 μL de mistura de septina. Incubar esta mistura durante pelo menos 30 minutos à temperatura ambiente.
- Adicionar as amostras a uma câmara de imagem lavada com fluoSPB (Tabela 2) e visualizar os feixes de septina. Os canais de fluxo passivados por PLL-PEG, conforme descrito em pesquisas anteriores10,32, funcionam bem para este experimento.
- Imaginação de feixe de septina via microscopia eletrônica de transmissão de coloração negativa
- Preparar o 5x darkSPB (Tabela 2) e uma mistura de septina constituída por 100% de septina escura a uma concentração seis vezes superior à concentração final desejada em tampão de septina + 1 mM de TDT. Uma concentração típica para este ensaio é de 300 nM e, portanto, a concentração é de 1.800 nM para esta mistura.
- Polimerizar os complexos de septina misturando, nesta ordem específica, água I (suficiente para completar até o volume final desejado), 20% 5xdarkSPB e 16,67% mistura de septina. Para 5 μL, misture 3,16 μL de I-água, 1 μL de 5x darkSPB e 0,83 μL de mistura de septina. Incubar esta mistura durante pelo menos 30 minutos à temperatura ambiente.
- Adicionar 3-5 μL de amostra a uma grelha de microscopia eletrônica descarregada por brilho e incubar por 1 min. Em seguida, lave a grade 2x com darkSPB (Tabela 2) absorvendo o líquido com um papel de filtro e adicionando uma gota de tampão darkSPB, lave 1x com água I, incube por ~30 s com acetato de uranila a 2%, limpe a mancha e seque a amostra ao ar por alguns minutos.
- Fotografe os feixes de septina a 120 kV e ampliações entre 5.000x e 60.000x com um desfocagem entre 1-2 μm.
Resultados
Como mencionado no protocolo, 5 L de células de E. coli co-transformadas com os dois plasmídeos que expressam septina foram cultivadas, e a expressão de septinas foi induzida pela adição de IPTG. Após 3 h, as células foram coletadas por centrifugação, ressuspensas em tampão de lise e lisadas por sonicação. O lisado foi então clarificado por centrifugação e a solução clarificada foi aplicada a uma coluna HisTrap (Figura 2A). Após a primeira purificação, as frações contendo septina foram agrupadas e aplicadas em uma coluna StrepTrap (Figura 2B). Isso normalmente produz cerca de 3-5 mL de ~ 1 μM de complexo de septina. Antes de agrupar as frações contendo septina, a eletroforese em gel de desnaturação pode ser usada para verificar a integridade das subunidades de septina e a razão estequiométrica equimolar entre as diferentes subunidades de septina que formam o complexo. (Figura 3A). Se o gel apresentar bandas igualmente intensas correspondentes aos pesos moleculares (Tabela 3) das subunidades de septina, o protocolo pode ser continuado. Caso contrário, recomenda-se iniciar o protocolo novamente. No exemplo mostrado para o octamero de septina humana com SEPT9_i1, a Figura 3A mostra claramente bandas correspondentes a SEPT9_i1, SEPT6, SEPT7 e SEPT2 (na ordem de cima para baixo) com intensidades semelhantes; o intervalo de confiança de 99% da intensidade normalizada foi de 1,128 ± 0,048 para SEPT2, 1,092 ± 0,034 para SEPT6, 1,108 ± 0,040 para SEPT7 e 1,067 ± 0,029 para SEPT9. Se SEPT2 for marcado com msfGFP, ele mudará muito abaixo SEPT9_i1. Dependendo do sistema de eletroforese usado e da presença da tag C-terminal TEV-Strep para SEPT7 (o que faz com que ele migre mais lentamente do que SEPT7 não marcado), as bandas SEPT7 e SEPT6 às vezes se fundem devido a seus pesos moleculares comparáveis. O próximo passo é agrupar as frações e dializá-las contra o buffer de septina com TDT. Após a diálise, se a concentração for muito baixa (<2 μM) ou se for necessária uma concentração maior para os experimentos, uma etapa de concentração pode ser incluída, conforme descrito no protocolo. Concentrações abaixo de 1 μM geralmente indicam uma má qualidade funcional das septinas. Uma concentração final de complexo de septina entre 3,5 μM e 7 μM funciona bem para a maioria dos ensaios in vitro . Essas concentrações geralmente são obtidas quando o volume após a concentração atinge 0,5-1 mL.
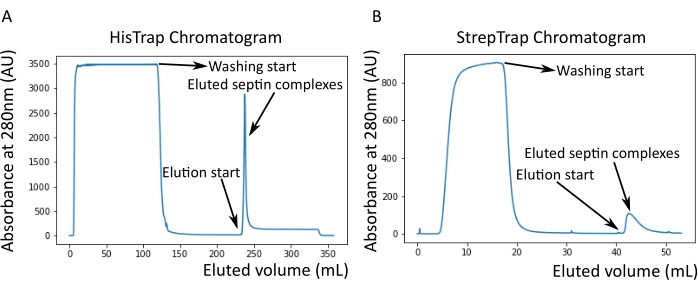
Figura 2: Exemplo de cromatogramas correspondentes à purificação de septina humana escura octamers_9i1 . (A) Cromatograma em coluna HisTrap. Após o pico de eluição da septina, a absorvância não volta a zero, provavelmente devido à presença de imidazol no tampão. A fração agrupada foi desde o início do pico de eluição até a estabilização da absorbância em torno de 250 mL. (B) Cromatograma em coluna StrepTrap. A fração agrupada foi desde o início do pico de eluição até que a absorbância voltou para cerca de 0 a 50 mL. Por favor, clique aqui para ver uma versão maior desta figura.
Para continuar com o controle de qualidade, foi realizada eletroforese nativa, conforme descrito no protocolo, (Figura 3B). Nos géis, observa-se uma banda maior correspondente aos heterooligômeros intactos e, geralmente, uma faixa menor correspondente aos dímeros. Os hexâmeros humanos são encontrados um pouco acima da banda de marcadores de 242 kDa, enquanto os octameros são encontrados acima da banda de 480 kDa, acima de sua massa molecular calculada. A localização dessas bandas foi verificada pela análise de western blot de extratos de células eucarióticas32. A marcação com msfGFP acopla cada SEPT2 com uma proteína msfGFP. Isso causa um aumento no peso molecular dos complexos de septina de 53,4 kDa (molécula de 26,7 kDa/msGFP). No entanto, no gel de eletroforese nativo, o peso molecular aparente dos complexos marcados com msfGFP é indistinguível do dos complexos não marcados.
Uma técnica complementar para testar se os complexos de septina estão intactos é a fotometria de massa por microscopia iSAT. O iSCAT monitora o espalhamento de luz de moléculas que pousam em uma lâmina de vidro amplificada pela interferência com a luz de referência, tipicamente a reflexão do laser na parte inferior da lâmina de vidro. Em seguida, uma abordagem de subtração de fundo é usada para dar contraste às partículas. Devido a essa correção, o sinal apresenta valores positivos e negativos, dependendo se as partículas pousam no vidro ou se afastam dele49. O sinal detectado é diretamente proporcional ao peso molecular das proteínas50. Portanto, uma calibração sinal-massa com um padrão de massa pode determinar a massa das proteínas da amostra. A Figura 3C mostra um exemplo de octameros de septina humana contendo SEPT9_i1. A maioria das partículas individuais detectadas (~50%) é de um peso molecular esperado para octameros completos contendo SEPT9_i1 (423 kDa) (Figura 3C). Existem também partículas com massas entre 150-300 kDa, mas nenhum pico claro é observado, indicando a possível presença de outras espécies de septina em baixa abundância. Da mesma forma, a maioria das partículas únicas detectadas para hexâmeros de Drosophila marcados com mEGFP é de um peso molecular esperado para hexâmeros intactos (361 kDa) (Figura 3D). Um pico claro adicional de 241 kDa indica a presença de tetrâmeros estáveis contendo duas proteínas de amendoim, uma DSep1 e uma mEGFP-DSep2. Finalmente, tanto o complexo de septina humana quanto o de mosca mostram um pico em torno de 80 kDa que poderia ser uma mistura de monômeros e dímeros, possivelmente amplificado por um traço de TDT ou qualquer outra pequena molécula que se agrega, mostrando um pico no lado positivo do gráfico45.
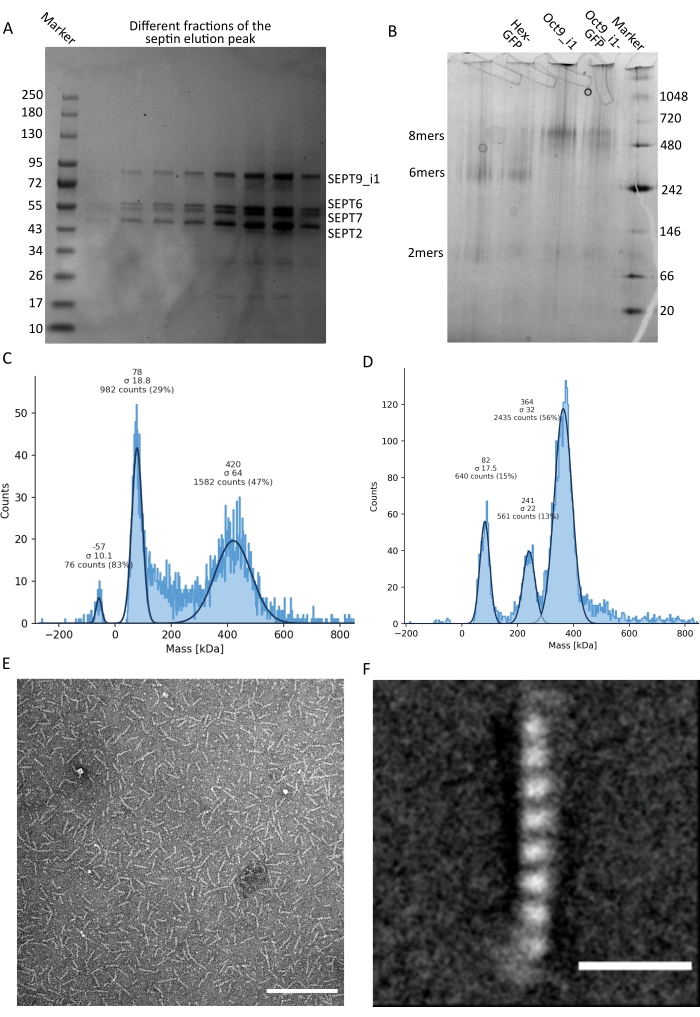
Figura 3: Exemplos de resultados do controle de qualidade do oligômero . (A) Exemplo de gel desnaturante mostrando diferentes frações do pico de eluição da purificação de septina humana escura octamers_9i1. (B) Exemplo de eletroforese nativa de diferentes complexos de septina. (C,D) Diferentes exemplos de resultados histográficos de fotometria de massa a 12,5 nM de complexos de septina: (C) septina humana escura octamers_9i1 e (D) hexâmeros de septina DSep1-msfGFP Drosophila . As linhas são encaixes gaussianos. (E) Imagem TEM de 25 nM de septina humana escura octamers_9i1 em tampão de septina. Barra de escala = 200 nm. (F) Imagem média de classe de octamers_9i1 de septina humana SEPT2-msfGFP. As tags msfGFP são visíveis como densidades difusas, nas duas extremidades. Barra de escala = 10 nm. Os painéis (E) e (F) são de propriedade da The Company of Biologists e foram adaptados de Iv et al.10 com permissão. Por favor, clique aqui para ver uma versão maior desta figura.
Dado que tanto os géis nativos quanto o iSCAT fornecem apenas informações médias de conjunto, a média de classe das imagens de microscopia eletrônica de transmissão de oligômeros de septina única foi usada para verificar a integridade e a pureza dos complexos por visualização direta. Em imagens MET de complexos de septina em tampão de septina, podem ser observadas hastes de 24 nm (hexâmeros) ou 32 nm (octameros) de comprimento. Um exemplo de um octamero de septina humano contendo SEPT9_i1 pode ser visto na Figura 3E. Ao classificar a média deles, cada uma das subunidades pode ser observada e contada, como visto para o octômero humano marcado com msfGFP com SEPT9_i1 na Figura 3F. Caso o oligômero seja marcado fluorescentemente, densidades extras que correspondem à SEPT2-msfGFP podem ser observadas no final das hastes (Figura 3F).
A combinação das técnicas acima prova que os octameros (ou hexâmeros) com a razão estequiométrica correta e alta pureza podem ser purificados usando o protocolo descrito. Finalmente, a última verificação de controle de qualidade é para a funcionalidade dos complexos de septina em termos de sua capacidade de polimerização. Na presença de baixa concentração de sal (<150 mM KCl com o tampão descrito 9), se as septinas não estiverem na presença de outras proteínas ou membranas lipídicas carregadas negativamente, elas se auto-montam em feixes9. As septinas são impedidas de polimerização, mantendo-as no tampão de armazenamento, que tem uma alta concentração de KCl (300 mM). Os heterooligômeros da septina são então diluídos a uma proporção de volume de 1:6 em um tampão da mesma composição, mas sem KCl para atingir uma concentração final de KCl de 50 mM. Para fazer imagens de fluorescência, este tampão é complementado com um sistema de limpeza de oxigênio para proteger do fotobranqueamento e com um supressor piscando. Na microscopia TIRF, pequenos aglomerados de proteínas podem ser observados dentro do campo TIRF raso (~100 nm; Figura 4A,B). Em um microscópio confocal, grandes aglomerados de estruturas filamentosas podem ser vistos flutuando mais alto em solução (Figura 4C). Finalmente, com o MET, pequenos feixes de septina (Figura 4D), correspondentes aos aglomerados observados pelo TIRF, e grandes feixes (Figura 4E), correspondentes às estruturas observadas por microscopia confocal, podem ser observados. As inserções da Figura 4D,E revelam que ambos os tipos de estruturas consistem em filamentos longos e finos que correm em paralelo, formando feixes com extremidades cônicas. Juntas, as imagens de fluorescência e TEM provam que os complexos de septina purificados podem polimerizar em filamentos, que por sua vez se auto-montam em feixes.
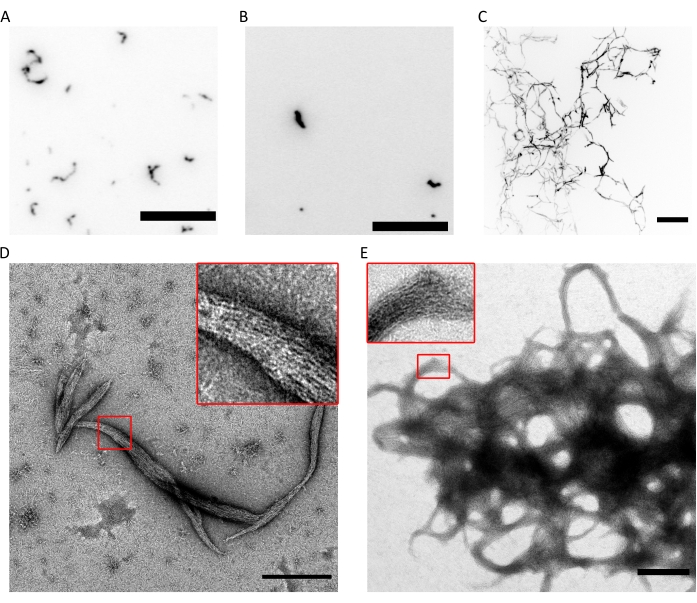
Figura 4: Exemplos de resultados do controle de qualidade da capacidade de polimerização. (A) Imagem TIRF de hexâmeros de septina humana de 300 nM (hexâmeros marcados com msfGFP a 10%) em fluoSPB. (B) Imagem TIRF de octameros de septina humana de 300 nM contendo SEPT9_i1 (10% de octamers9_i1 marcados com msfGFP) em fluoSPB. (C) Projeções confocais de intensidade máxima de pilhas Z em ~30 μm com 0,5 μm de espaçamento de 300 nM de septina humana octamers_9i3 no fluoSPB. (A-C) Barra de escala = 10 μm e escala de cinza invertida. (D,E) Exemplos de imagens TEM de (D) pequenos e (E) grandes feixes de septina humana octamers_9i1 em darkSPB. As inserções mostram regiões onde filamentos claros correndo paralelamente dentro do feixe podem ser observados. Barras de escala = 500 nm. Os painéis (C-E) são direitos autorais da The Company of Biologists e foram adaptados de Iv et al.10 com permissão. Por favor, clique aqui para ver uma versão maior desta figura.
Tabela 1: Lista de plasmídeos. Plasmídeos para purificar oligômeros de septina seguindo este protocolo. Todos os plasmídeos foram depositados em Addgene (primeira coluna). Por favor, clique aqui para baixar esta Tabela.
Tabela 2: Lista de buffers. Composições tampão utilizadas para a purificação e controle de qualidade de oligômeros de septina. Por favor, clique aqui para baixar esta Tabela.
Tabela 3: Pesos moleculares e coeficientes de extinção. Lista de pesos moleculares (MW) e coeficientes ópticos de extinção (ε) em um comprimento de onda de 280 nm calculado com ProtParam com base nas sequências do complexo, assumindo a fusão linear das subunidades de septina, os diferentes complexos de septina e as subunidades únicas de septina (apenas MW) que podem ser purificadas com os plasmídeos listados na Tabela 1. Por favor, clique aqui para baixar esta Tabela.
Discussão
O método aqui descrito permite a purificação robusta e o controle de qualidade de heterooligômeros de septina pré-formados. Algumas das principais questões a serem consideradas para a aplicação correta do método são as seguintes. Durante as etapas de eluição nas separações cromatográficas, é importante usar a taxa de fluxo recomendada (ou menor) para minimizar a diluição dos complexos de septina. Além disso, para maximizar a recuperação da proteína durante a etapa de concentração final, a coluna do concentrador é orientada de tal forma que a solução não é empurrada contra o filtro (quando há apenas um filtro de um lado). Se a solução for diretamente para o filtro, a proteína adere muito mais a ele, diminuindo substancialmente o rendimento final. Também é importante considerar que o passo de concentração nem sempre é necessário. A colheita de frações apenas de uma faixa estreita em torno do pico no cromatograma geralmente fornece uma concentração de estoque alta o suficiente (>3.000 nM) para muitas aplicações de reconstituição (que geralmente operam entre 10-300 nM). Finalmente, para o controle de qualidade da funcionalidade dos complexos de septina por microscopia de fluorescência, é importante passivar corretamente a superfície das lâminas de microscopia, uma vez que os complexos de septina aderem avidamente ao vidro. A passivação das lâminas de vidro pode ser feita tanto via funcionalização PLL-PEG quanto pela formação de bicamadas lipídicas neutras (100% DOPC) suportadas 11,32.
Em comparação com o protocolo de purificação original descrito pela primeira vez em Iv et al.10, há uma mudança nas composições do tampão (Tabela 2). A concentração de MgCl 2 foi reduzida de 5 mM para2 mM, e a concentração e o pH de Tris-HCl foram reduzidos de 50 mM para 20 mM e de 8,0 para 7,4, respectivamente. Essas alterações foram feitas para tornar as condições tampão compatíveis com estudos das interações de septinas humanas com bicamadas lipídicas, filamentos de actina e microtúbulos10,11,32. Isso porque os autores formaram bicamadas lipídicas suportadas e actina polimerizada no tampão F, cuja composição é idêntica à do darkSPB, além da presença de ATP no tampão F. A mudança do tampão não produziu nenhuma alteração na qualidade ou na vida útil das septinas purificadas em comparação com os tampões originais.
Este método de purificação ainda tem várias limitações. Primeiro, diferentes tentativas de purificação podem variar em rendimento (0,5-1 mL de complexos de septina 2-5 μM) e qualidade funcional, conforme verificado pela capacidade de formação de feixes dos complexos de septina purificados. É por isso que é muito importante realizar consistentemente as verificações de qualidade descritas neste artigo. Controlar muito bem os tempos de expressão e a densidade óptica da cultura bacteriana pode ajudar a mitigar a diferença no rendimento. Em segundo lugar, esta conduta de purificação não consegue distinguir entre trímeros e hexâmeros ou entre tetrâmeros e octameros (Figura 1B). No entanto, os experimentos de controle de qualidade podem ser usados para provar que a maioria dos complexos de septina está em sua forma de oligômero longo. No caso de ser necessária uma distribuição de tamanho de oligômero ainda mais estreita, a cromatografia de exclusão de tamanho pode ser inserida entre a etapa 1.6. e passo 1.7. do protocolo de purificação. Esta etapa opcional, no entanto, diminui drasticamente o rendimento, e não é recomendada, a menos que seja estritamente necessária. Uma última limitação, mais fundamental, vem do uso de E. coli como um sistema de expressão para complexos de septina recombinantes. Naturalmente, esse sistema não permite modificações pós-traducionais (PTMs), que têm sido relatadas em células animais, como fosforilação, acetilação e sumoilação 6,51,52,53. Essas modificações pós-traducionais podem ser adicionadas através da implementação de uma estratégia de purificação semelhante em células de insetos ou humanos. Além disso, este artigo apenas discutiu a reconstituição de septinas por si só, mas estudos em células indicam que proteínas reguladoras como proteínas da família Borg54,55 e anilina 24,25,56 podem ter efeitos substanciais, mas pouco compreendidos, sobre a montagem e as funções das septinas e, portanto, são importantes para eventualmente incorporá-las in vitro. Estudos. Protocolos para a purificação de proteínas Borg e anilina têm sido relatados54,57.
O protocolo de purificação de septina relatado aqui oferece uma maneira padronizada de purificar as septinas em sua forma de oligômero com a estequiometria de subunidade correta, oferecendo um avanço importante em relação a muitos estudos in vitro anteriores baseados em subunidades de septina única. Embora algumas septinas em contextos específicos possam atuar como uma única subunidade2, o corpo atual da literatura sugere fortemente que, em células animais, as septinas funcionam principalmente em complexos 9,58. Portanto, o uso de heterooligômeros pré-formados, como os descritos neste trabalho e outros 10,11,18,32,35,36,37, é de grande importância para o estudo das propriedades estruturais e biofísicas das septinas via in vitro reconstituição para dissecar suas funções na célula. Além disso, as septinas são proteínas automontáveis com muitos parceiros de interação, incluindo a membrana e o citoesqueleto, o que as torna de grande interesse para a biologia sintética de baixo para cima 59,60,61 e estudos de alterações induzidas por proteínas nas propriedades biofísicas da membrana, como a curvatura42,62,63.
Divulgações
Os autores declaram não haver interesses concorrentes ou financeiros.
Agradecimentos
Agradecemos a Cecilia de Agrela Pinto, Tomás de Garay e Katharina Häußermann por sua assistência com experimentos de fotometria de massa (iSCAT); Arjen Jakobi e Wiel Evers por sua ajuda com TEM; Lucia Baldauf por sua assistência com o TIRF; Pascal Verdier-Pinard por seu conselho sobre eletroforese nativa; Agata Szuba e Marjolein Vinkenoog por sua ajuda na criação dos esforços de purificação de septina de Drosophila, e o Cell and Tissue Imaging (PICT-IBiSA), Institut Curie, membro da Infraestrutura Nacional de Pesquisa Francesa France-BioImaging (ANR10-INBS-04). Esta investigação recebeu financiamento da Organização Neerlandesa de Investigação Científica (NWO/OCW) através da bolsa de Gravitação 'BaSyC-Building a Synthetic Cell' (024.003.019) e da Agence Nationale pour la Recherche (ANR grants ANR-17-CE13-0014: "SEPTIMORF"; ANR-13-JSV8-0002-01: "SEPTIME"; e ANR-20-CE11-0014-01: "SEPTSCORT").
Materiais
| Name | Company | Catalog Number | Comments |
| 488nm laser combiner iLAS2 | Gataca | TIRF microscope | |
| 488nm Sapphire laser lines | Coherent | Confocal microscope | |
| 4k X 4k F416 CMOS camera | TVIPS | For JEM-1400plus | |
| 4x sample buffer nativePAGE | Thermo Fisher scientific | BN2003 | |
| 6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid (TROLOX) | Sigma-Aldrich | 238813 | To prevent blinking |
| AKTA pure 25 M1 | GE healthcare | 1680311 | |
| Ampicillin | Sigma-Aldrich | A9518-25G | |
| Carbon Type-B, 300 mesh EM grid | Ted pella | 01813-F | |
| Carbon Type-B, 300 mesh EM grid | Electron micoscopy sciences | CF300-Cu | |
| Cover glass #1.5H | Thorslabs | CG15KH | |
| CSU-X1-M1 confocal unit | Yokogawa | Confocal microscope | |
| Desthiobiotin | Sigma-Aldrich | D1411-1G | |
| Dithiothreitol (DTT) | Sigma-Aldrich | D9779 | |
| DNAse | Sigma-Aldrich | 10104159001 | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Eclipse Ti2-E | Nikon instruments | Confocal microscope | |
| EDTA-free protease inhibtor cocktail | Roche | 481761 | |
| HisTrap HP, 5 mL | GE healthcare | 29-0588-3 | |
| iLAS2 azimuthal TIRF illumination system | Gataca | TIRF microscope | |
| Imidazole | Sigma-Aldrich | 1202-1KG | |
| InstantBlue Protein Gel Stain | Westburg Life Sciences | EP ab119211 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Thermo Fisher scientific | 10849040 | |
| iXon Ultra 888 EMCCD camera | Andor | Confocal microscope | |
| iXon Ultra 897 EM-CCD | Andor | TIRF microscope | |
| JEM-1400plus | JOEL | TEM microscope TUDelft | |
| kappa-cassein | Sigma-Aldrich | C0406 | |
| LB broth | Sigma-Aldrich | L3022-6X1KG | |
| Lyzozyme | Sigma-Aldrich | 62971-10G-F | |
| Magnesium Chloride | Sigma-Aldrich | M8266-100G | |
| Magnesium sulfate | Sigma-Aldrich | 746452-1KG | |
| Methylecllulose | Sigma-Aldrich | 8074844 | |
| MilliQ system (Integral 10) | Merck-Millipore | I-water dispenser | |
| Mini protean TGX gels | BIORAD | 4561086 | |
| NativeMark unstained protein standard | Invitrogen | LC0725 | For iSCAT and Native gels |
| NativePAGE 4-16% GELS | Thermo Fisher scientific | BN1002BOX | |
| NativePAGE Running Buffer kit | Thermo Fisher scientific | BN2007 | |
| Nikon Ti2-E | Nikon instruments | TIRF microscope | |
| Nr. 1 Menzel coverslips | Thermo Fisher scientific | 11961988 | |
| parafilm | Sigma-Aldrich | P7668 | |
| Plan Apo ×100/1.45 NA oil immersion objective | Nikon instruments | Confocal microscope | |
| PMSF | Sigma-Aldrich | 10837091001 | |
| Poly(L-lysine)-graft-biotinylated PEG (PLL-PEG) | SuSoS | CHF560.00 | |
| Poly-L-lysine solution 0.01% | Sigma-Aldrich | P4832 | For iSCAT glass slides |
| Pottassium Chloride | Sigma-Aldrich | P9541-1KG | |
| Power supply for native gels | CONSORT | S/N 71638 | |
| POWERPAC UNIVERSAL | BIORAD | 042BR31206 | |
| Protocatechuate 3,4-Dioxygenase (PCD) | Sigma-Aldrich | P8279-25UN | oxygen scavenger - enzyme |
| Protocatechuic acid (PCA) | Sigma-Aldrich | 03930590-50MG | oxygen scavenger - reagent |
| Q500 Sonicator | Qsonica | Q500-110 | |
| Quemesa camera | Olympus | For Tecnai Spirit | |
| Refeyn OneMP | Refeyn | ||
| Sample buffer, laemmli 2x concentrate | Sigma-Aldrich | S3401-10vl | |
| Silicon gaskets | Sigma-Aldrich | GBL103250-10EA | |
| Slide-A-Lyzer Dialysis cassettes 30k MWCO 3mL | Thermo Fisher scientific | 66381 | |
| Spectinomycin | Sigma-Aldrich | PHR1441-1G | |
| StrepTrap HP, 1 mL | GE healthcare | 28-9075-46 | |
| Tecnai Spirit microscope | Thermo Scientific, FEI | TEM microscope Institute Curie | |
| Terrific broth | Sigma-Aldrich | T0918-1KG | |
| Tris/Glyine/SDS buffer | BIORAD | 1610772 | |
| Tris-HCl | Sigma-Aldrich | T5941-1KG | |
| Ultrasonic cleaner | Branson | CPX2800H-E | |
| Vivaspin 6, 30,000 MWCO PES | Sartorius | VS0622 |
Referências
- Mostowy, S., Cossart, P. Septins: The fourth component of the cytoskeleton. Nature Reviews Molecular Cell Biology. 13 (3), 183-194 (2012).
- Shuman, B., Momany, M. Septins from protists to people. Frontiers in Cell and Developmental Biology. 9, 3802(2022).
- Bridges, A. A., Gladfelter, A. S. Septin form and function at the cell cortex. Journal of Biological Chemistry. 290 (28), 17173-17180 (2015).
- Smith, C., et al. Septin 9 exhibits polymorphic binding to F-actin and inhibits myosin and cofilin activity. Journal of Molecular Biology. 427 (20), 3273-3284 (2015).
- Gilden, J. K., Peck, S., Chen, Y. C. M., Krummel, M. F. The septin cytoskeleton facilitates membrane retraction during motility and blebbing. Journal of Cell Biology. 196 (1), 103-114 (2012).
- Marquardt, J., Chen, X., Bi, E. Architecture, remodeling, and functions of the septin cytoskeleton. Cytoskeleton. 76 (1), 7-14 (2018).
- Van Ngo, H., Mostowy, S. Role of septins in microbial infection. Journal of Cell Science. 132 (9), (2019).
- Fung, K. Y. Y., Dai, L., Trimble, W. S. Cell and molecular biology of septins. International Review of Cell and Molecular Biology. 310, 289-339 (2014).
- Kinoshita, M., Field, C. M., Coughlin, M. L., Straight, A. F., Mitchison, T. J. Self- and actin-templated assembly of mammalian septins. Developmental Cell. 3 (6), 791-802 (2002).
- Iv, F., et al. Insights into animal septins using recombinant human septin octamers 2 with distinct SEPT9 isoforms. Journal of Cell Science. 134 (15), (2021).
- Szuba, A., et al. Membrane binding controls ordered self-assembly of animal septins. eLife. 10, 63349(2021).
- Kinoshita, M. Assembly of mammalian septins. Journal of Biochemistry. 134 (4), 491-496 (2003).
- Connolly, D., et al. Septin 9 isoform expression, localization and epigenetic changes during human and mouse breast cancer progression. Breast Cancer Research. 13 (4), 76(2011).
- Connolly, D., et al. Septin 9 amplification and isoform-specific expression in peritumoral and tumor breast tissue. Biological Chemistry. 395 (2), 157-167 (2014).
- Estey, M. P., Di Ciano-Oliveira, C., Froese, C. D., Bejide, M. T., Trimble, W. S. Distinct roles of septins in cytokinesis: SEPT9 mediates midbody abscission. Journal of Cell Biology. 191 (4), 741-749 (2010).
- John, C. M., et al. The Caenorhabditis elegans septin complex is nonpolar. EMBO Journal. 26 (14), 3296-3307 (2007).
- Field, C. M., et al. A purified Drosophila septin complex forms filaments and exhibits GTPase activity. Journal of Cell Biology. 133 (3), 605-616 (1996).
- Bertin, A., et al. Saccharomyces cerevisiae septins: Supramolecular organization of heterooligomers and the mechanism of filament assembly. Proceedings of the National Academy of Sciences of the United States of America. 105 (24), 8274-8279 (2008).
- Sellin, M. E., Sandblad, L., Stenmark, S., Gullberg, M. Deciphering the rules governing assembly order of mammalian septin complexes. Molecular Biology of the Cell. 22 (17), 3152-3164 (2011).
- Akil, A., et al. Septin 9 induces lipid droplets growth by a phosphatidylinositol-5-phosphate and microtubule-dependent mechanism hijacked by HCV. Nature Communications. 7, 12203(2016).
- Tanaka-Takiguchi, Y., Kinoshita, M., Takiguchi, K. Septin-mediated uniform bracing of phospholipid membranes. Current Biology. 19 (2), 140-145 (2009).
- Omrane, M., et al. Septin 9 has two polybasic domains critical to septin filament assembly and Golgi integrity. iScience. 13, 138-153 (2019).
- Carim, S. C., Kechad, A., Hickson, G. R. X. Animal cell cytokinesis: The rho-dependent actomyosin-anilloseptin contractile ring as a membrane microdomain gathering, compressing, and sorting machine. Frontiers in Cell and Developmental Biology. 8, 575226(2020).
- El Amine, N., Kechad, A., Jananji, S., Hickson, G. R. X. Opposing actions of septins and Sticky on Anillin promote the transition from contractile to midbody ring. Journal of Cell Biology. 203 (3), 487-504 (2013).
- Renshaw, M. J., Liu, J., Lavoie, B. D., Wilde, A. Anillin-dependent organization of septin filaments promotes intercellular bridge elongation and Chmp4B targeting to the abscission site. Open Biology. 4 (1), 130190(2014).
- Vogt, E. T., et al. The ultrastructural organization of actin and myosin II filaments in the contractile ring: new support for an old model of cytokinesis. Molecular Biology of the Cell. 28 (5), 613-623 (2017).
- Mavrakis, M., et al. Septins promote F-actin ring formation by crosslinking actin filaments into curved bundles. Nature Cell Biology. 16 (4), 322-334 (2014).
- Karasmanis, E. P., et al. A septin double ring controls the spatiotemporal organization of the ESCRT machinery in cytokinetic abscission. Current Biology. 29 (13), 2174-2182 (2019).
- Hagiwara, A., et al. Submembranous septins as relatively stable components of actin-based membrane skeleton. Cytoskeleton. 68 (9), 512-525 (2011).
- Calvo, F., et al. Cdc42EP3/BORG2 and septin network enables mechano-transduction and the emergence of cancer-associated fibroblasts. Cell Reports. 13 (12), 2699-2714 (2015).
- Salameh, J., Cantaloube, I., Benoit, B., Poüs, C., Baillet, A. Cdc42 and its BORG2 and BORG3 effectors control the subcellular localization of septins between actin stress fibers and microtubules. Current Biology. 31 (18), 4088-4103 (2021).
- Kuzmić, M., et al. Septin-microtubule association via a motif unique to isoform 1 of septin 9 tunes stress fibers. Journal of Cell Science. 135 (1), (2022).
- Shindo, A., et al. Septin-dependent remodeling of cortical microtubule drives cell reshaping during epithelial wound healing. Journal of Cell Science. 131 (12), (2018).
- Hu, Q., Nelson, W. J., Spiliotis, E. T. Forchlorfenuron alters mammalian septin assembly, organization, and dynamics. Journal of Biological Chemistry. 283 (43), 29563-29571 (2008).
- Mavrakis, M., Tsai, F. C., Koenderink, G. H. Purification of recombinant human and Drosophila septin hexamers for TIRF assays of actin-septin filament assembly. Methods in Cell Biology. 136, 199-220 (2016).
- Nakos, K., Radler, M. R., Spiliotis, E. T. Septin 2/6/7 complexes tune microtubule plus-end growth and EB1 binding in a concentration- and filament-dependent manner. Molecular Biology of the Cell. 30 (23), 2913-2928 (2019).
- Kaplan, C., et al. Absolute arrangement of subunits in cytoskeletal septin filaments in cells measured by fluorescence microscopy. Nano Letters. 15 (6), 3859-3864 (2015).
- Castro, D. K. S. V., et al. A complete compendium of crystal structures for the human SEPT3 subgroup reveals functional plasticity at a specific septin interface. IUCrJ. 7, Pt 3 462-479 (2020).
- Jiao, F., Cannon, K. S., Lin, Y. -C., Gladfelter, A. S., Scheuring, S. The hierarchical assembly of septins revealed by high-speed AFM. Nature Communications. 11 (1), 1-13 (2020).
- Bertin, A., et al. Phosphatidylinositol-4,5-bisphosphate promotes budding yeast septin filament assembly and organization. Journal of Molecular Biology. 404 (4), 711-731 (2010).
- Bridges, A. A., Jentzsch, M. S., Oakes, P. W., Occhipinti, P., Gladfelter, A. S. Micron-scale plasma membrane curvature is recognized by the septin cytoskeleton. Journal of Cell Biology. 213 (1), 23-32 (2016).
- Beber, A., et al. Membrane reshaping by micrometric curvature sensitive septin filaments. Nature Communications. 10, 420(2019).
- Zhou, R., Shi, Y., Yang, G. Expression, purification, and enzymatic characterization of intramembrane proteases. Methods in Enzymology. 584, 127-155 (2017).
- Diebold, M. L., Fribourg, S., Koch, M., Metzger, T., Romier, C. Deciphering correct strategies for multiprotein complex assembly by co-expression: Application to complexes as large as the histone octamer. Journal of Structural Biology. 175 (2), 178-188 (2011).
- Lebedeva, M. A., Palmieri, E., Kukura, P., Fletcher, S. P. Emergence and rearrangement of dynamic supramolecular aggregates visualized by interferometric scattering microscopy. ACS Nano. 14 (9), 11160-11168 (2020).
- Ludtke, S. J., Baldwin, P. R., Chiu, W. EMAN: Semiautomated software for high-resolution single-particle reconstructions. Journal of Structural Biology. 128 (1), 82-97 (1999).
- Zivanov, J., et al. New tools for automated high-resolution cryo-EM structure determination in RELION-3. eLife. 7, 42166(2018).
- Frank, J., et al. SPIDER and WEB: Processing and visualization of images in 3D electron microscopy and related fields. Journal of Structural Biology. 116 (1), 190-199 (1996).
- Young, G., Kukura, P. Interferometric scattering microscopy. Annual Review of Physical Chemistry. 70, 301-322 (2019).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Hernández-Rodríguez, Y., Momany, M. Posttranslational modifications and assembly of septin heteropolymers and higher-order structures. Current Opinion in Microbiology. 15 (6), 660-668 (2012).
- Ribet, D., et al. SUMOylation of human septins is critical for septin filament bundling and cytokinesis. Journal of Cell Biology. 216 (12), 4041-4052 (2017).
- Sinha, I., et al. Cyclin-dependent kinases control septin phosphorylation in Candida albicans hyphal development. Developmental Cell. 13 (3), 421-432 (2007).
- Sheffield, P. J., et al. Borg/Septin interactions and the assembly of mammalian septin heterodimers, trimers, and filaments. Journal of Biological Chemistry. 278 (5), 3483-3488 (2003).
- Joberty, G., et al. Borg proteins control septin organization and are negatively regulated by Cdc42. Nature Cell Biology. 3 (10), 861-866 (2001).
- Chen, X., Wang, K., Svitkina, T., Bi, E. Critical roles of a RhoGEF-anillin module in septin architectural remodeling during cytokinesis. Current Biology. 30 (8), 1477-1490 (2020).
- Kučera, O., et al. Anillin propels myosin-independent constriction of actin rings. Nature Communications. 12 (1), 1-12 (2021).
- Hsu, S. C., et al. Subunit composition, protein interactions, and structures of the mammalian brain sec6/8 complex and septin filaments. Neuron. 20 (6), 1111-1122 (1998).
- Olivi, L., et al. Towards a synthetic cell cycle. Nature Communications. 12 (1), 1-11 (2021).
- Hürtgen, D., Härtel, T., Murray, S. M., Sourjik, V., Schwille, P. Functional modules of minimal cell division for synthetic biology. Advanced Biosystems. 3 (6), 1800315(2019).
- Jia, H., Schwille, P. Bottom-up synthetic biology: Reconstitution in space and time. Current Opinion in Biotechnology. 60, 179-187 (2019).
- Cannon, K. S., Woods, B. L., Crutchley, J. M., Gladfelter, A. S. An amphipathic helix enables septins to sense micrometer-scale membrane curvature. The Journal of Cell Biology. 218 (4), 1128-1137 (2019).
- Lobato-Márquez, D., Mostowy, S. Septins recognize micron-scale membrane curvature. Journal of Cell Biology. 213 (1), 5-6 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados