Method Article
Modelo experimental para avaliar a resolução da pneumonia
Neste Artigo
Erratum Notice
Resumo
Este manuscrito descreve o estabelecimento de um modelo infeccioso de pneumonia em camundongos e a respectiva caracterização da resolução da lesão juntamente com métodos de crescimento de bactérias e instilação intratraqueal. Uma nova abordagem usando citometria de fluxo de alta dimensão para avaliar a paisagem imune também é descrita.
Resumo
A síndrome do desconforto respiratório agudo (SDRA) causa lesão pulmonar aguda, caracterizada por dano alveolar rápido e hipoxemia grave. Isso, por sua vez, leva a alta morbidade e mortalidade. Atualmente, não existem modelos pré-clínicos que recapitulem a complexidade da SDRA humana. No entanto, modelos infecciosos de pneumonia (PNA) podem replicar as principais características fisiopatológicas da SDRA. Aqui, descrevemos um modelo de PNA induzido pela instilação intratraqueal de Streptococcus pneumoniae e Klebsiella pneumoniae vivos em camundongos C57BL6. Para avaliar e caracterizar o modelo, após a indução da lesão, foram realizadas medidas seriadas de peso corporal e lavado broncoalveolar (LBA) para mensuração de marcadores de lesão pulmonar. Além disso, colhemos pulmões para contagem de células e diferenciais, quantificação de proteína LBA, citospina, contagem de unidades formadoras de colônias bacterianas e histologia. Por fim, foi realizada citometria de fluxo de alta dimensão. Propomos este modelo como uma ferramenta para entender o cenário imunológico durante as fases de resolução inicial e tardia da lesão pulmonar.
Introdução
A síndrome do desconforto respiratório agudo (SDRA) continua sendo uma síndrome letal e incapacitante comum que afeta aproximadamente 10% dos pacientes em unidades de terapia intensiva (UTI) e até 23% dos indivíduos sob ventilação mecânica, levando a uma taxa de mortalidade hospitalar de 35%-46%1. Além disso, a recente pandemia de COVID-19 enfatizou novamente a importância de estudar a SDRA. Os casos positivos para COVID-19 foram responsáveis por um aumento na mortalidade por SDRA, destacando a limitação das terapias farmacológicas2.
Em humanos, a SDRA é caracterizada pelo rápido início de hipoxemia (PaO2/FiO2 < 300) e evidência de edema pulmonar bilateral não hidrostático devido à permeabilidade alvéolo-capilar excessiva e alveolite3. Embora a SDRA tenha sido tradicionalmente descrita como um padrão de lesão pulmonar aguda (LPA) secundária a uma variedade de insultos, a pneumonia bacteriana e viral (PNA) permanece entre as causas mais comuns. Três estágios fisiopatológicos principais, ou seja, os estágios exsudativo, proliferativo e fibrótico, foram descritos, enquanto as duas principais características cardinais da SDRA são inflamação desregulada e ruptura alvéolo-capilar4. Durante esses processos, a lesão alveolar é produzida pela liberação de citocinas inflamatórias (por exemplo, fator de necrose tumoral [TNF-α], interleucina [IL-1β, IL-6, IL-8, etc.]), um influxo de neutrófilos e macrófagos inflamatórios e a inundação de fluido rico em proteínas. Em última análise, esses eventos levam a danos alveolares irregulares e bilaterais 5,6,7,8.
Embora tenha havido um progresso significativo na compreensão da lesão pulmonar precoce e da inflamação, os mecanismos subjacentes à resolução da PNA são menos conhecidos e devem ser o foco de futuras investigações mecanicistas. O principal objetivo deste artigo de método é fornecer aos investigadores um modelo de resolução de lesões de pneumonia infecciosa que possa replicar as principais características fisiopatológicas da SDRA. Propomos que este modelo ajude a entender melhor os mecanismos biológicos subjacentes à resolução e reparo da inflamação pulmonar, servindo assim como uma plataforma para terapêuticas de resgate.
Os principais estágios fisiopatológicos que ocorrem durante a SDRA podem ser replicados em modelos animais pré-clínicos de LPA, que devem incluir uma evidência histológica de resposta inflamatória, lesão tecidual, disfunção fisiológica, alveolite e alteração da barreira alvéolo-capilar9. Um modelo de camundongo que induz PNA e ALI é vantajoso devido à sua alta reprodutibilidade, reprodução rápida e disponibilidade de múltiplas ferramentas para realizar estudos mecanísticos e moleculares. Não existe um modelo único que recapitule totalmente todas as características da SDRAhumana 9.
Modelos de PNA em camundongos permitem a replicação dos principais mecanismos fisiopatológicos produzidos pela SDRA infecciosa em humanos, como início rápido, evidência de lesão tecidual na histologia, comprometimento da barreira alvéolo-capilar, evidência de resposta inflamatória e disfunção fisiológica, produzindo mortalidade modesta10. Os modelos infecciosos podem ser induzidos pela administração local ou sistêmica do patógeno, sendo a administração intranasal, intratraqueal e intravenosa as vias de administração mais frequentes. A via intratraqueal permite a inoculação direta do agente infeccioso nos pulmões, diminuindo a aerossolização e otimizando a entrega11,12.
A metodologia para um modelo murino pré-clínico de PNA por instilação intratraqueal de Streptococcus pneumoniae vivo (Spn) ou Klebsiella pneumoniae (Kp) é descrita aqui. Esses modelos representam um bom substituto da SDRA produzida pela PNA bacteriana, possuindo várias vantagens, incluindo: causas prevalentes de PNA-SDRA humana (adquirida na comunidade e no hospital); alta reprodutibilidade; a mortalidade e a lesão podem ser facilmente tituladas (modelando diferentes graus de inflamação pulmonar) para exibir uma resposta inflamatória robusta, levando à alveolite e disfunção alvéolo-capilar; a avaliação das fases inicial e tardia da lesão pulmonar e resolução; e a avaliação de estratégias terapêuticas em diferentes estágios da PNA-SDRA.
Protocolo
Todos os protocolos animais descritos neste estudo foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (ACUC) da Escola de Medicina da Universidade Johns Hopkins para o protocolo animal MO21M160. Além disso, os experimentos foram realizados seguindo as regulamentações institucionais, estaduais e federais para pesquisa com animais.
CUIDADO: A replicação de todos os protocolos descritos abaixo deve ser realizada em um gabinete de nível de biossegurança 2 (BSL-2), seguindo todas as diretrizes institucionais do BSL-2 sob o gabinete de biossegurança.
1. Revestimento de estoques bacterianos de loops comerciais
NOTA: Este protocolo pode ser usado para cultivar estoques bacterianos para Spn (ATCC 49619) e Kpn (ATCC 43816), começando com os culti-loops obtidos do provedor (consulte a Tabela de Materiais para obter detalhes).
- Aqueça uma placa de ágar sangue de ovelha a 5% por 15 min a 37 ° C em uma incubadora. Uma incubadora de células pode ser usada para essa finalidade.
- Sob o capô, remova a bainha da alça de inoculação bacteriana e espalhe-a com cuidado, riscando na placa de ágar, seguindo um padrão em zigue-zague. Repita esta etapa usando uma placa separada como duplicata. Até cinco placas podem ser listradas com o mesmo laço.
- Incube as placas durante a noite a 37 °C para um crescimento ideal de bactérias. Passe a bactéria diariamente por 3 dias. Aquecer as placas de ágar-ágar sangue durante 15 minutos a 37 °C, retirar entre 15 a 20 colónias da primeira placa de ágar-ágar utilizando uma alça de inoculação descartável e espalhá-las para uma nova placa de ágar-ágar pré-aquecida. Rotule a placa adequadamente.
2. Crescimento e armazenamento de bactérias para uso futuro
- Após 3 dias, pegue até 30 colônias da placa de ágar sangue com uma alça de listras e coloque-a diretamente em um frasco de 250 mL contendo caldo Todd Hewitt (caldo TH). Incubar a 37 °C, agitando a 250 rpm, com 5% de CO2 por aproximadamente 4 h.
- Pegue alíquotas a cada 15 min para medir a OD620nm até atingir 0,3, o que equivale a aproximadamente 3 x 108 unidades formadoras de colônias (UFC) por mL.
- Aliquota 1 mL do estoque de novas bactérias imediatamente em frascos criogênicos de 2 mL. Congele rapidamente os frascos recém-aliquotados em nitrogênio líquido por 5 min. Armazene alíquotas de bactérias em um freezer a -80 ° C (os frascos podem ser usados por até 6-8 meses antes de perderem a potência).
- Após 7 dias de congelamento, as alíquotas podem ser usadas para estudos em animais. Portanto, determine a nova concentração da bactéria.
3. Descongelamento de bactérias para instilação intratraqueal
- Aquecer uma placa de ágar-ágar sangue durante 10 min a 37 °C num shaker. Retire um dos novos frascos de estoque do freezer e descongele-o por agitação suave em banho-maria a 37 °C por aproximadamente 2 min. Evite tocar no O-ring ou na tampa com água morna.
- Placa em uma placa de ágar sangue para contar manualmente as colônias bacterianas. Efectuar uma diluição de 1 x 10-6 e colocar 200 μL a partir da última diluição numa placa de ágar sangue pré-aquecido . Faça isso em duplicatas.
- Incubar as placas durante a noite a 37 °C para um crescimento ideal das bactérias. No dia seguinte, aplique a seguinte fórmula para determinar a nova concentração bacteriana: UFC/mL = (número de colônias x fator de diluição) / volume de material plaqueado
4. Instilação intratraqueal de bactérias vivas
NOTA: Este protocolo foi otimizado para instilar um volume de 50 μL por via intratraqueal. Os estoques bacterianos podem ser armazenados por até 6-9 meses. Para garantir a UFC bacteriana em cada frasco, certifique-se de colocá-lo antes de cada experimento, calcule a UFC de estoque bacteriano conforme descrito acima e use o caldo TH para diluições subsequentes.
CUIDADO: Sob o gabinete de biossegurança, execute um procedimento de sobrevivência de roedores usando instrumentos cirúrgicos estéreis.
- Anestesiar o camundongo injetando intraperitonealmente 100 mg / kg de cetamina e 2,5 mg / kg de acetilpromazina. Repita para o número de camundongos sendo injetados por vez.
NOTA: Os camundongos podem ser expostos ao isoflurano para facilitar o manuseio dos animais. No entanto, um manipulador experiente que é capaz de injetar anestésicos intraperitoneais sem causar sofrimento significativo ao animal pode evitar a exposição ao isoflurano. O número de camundongos a serem injetados depende da experiência do cirurgião. - Depois que todos os camundongos estiverem sob anestesia adequada, confirme a anestesia com pinça de cauda. Coloque o camundongo anestesiado em uma superfície limpa e esterilizada, pendure o animal pelos incisivos e prenda suavemente os membros anteriores (Figura 1A).
NOTA: Para garantir o bem-estar do animal, forneça lubrificação da córnea em todos os animais anestesiados. Pode-se usar colírio de carboximetilcelulose, aplicando uma gota por olho. - Depile a região do pescoço e desinfete a área com clorexidina e álcool 70%. Com tesoura cirúrgica, faça uma incisão superficial de 1 cm na linha média do pescoço para visualizar a traqueia (Figura 1B). Uma pequena incisão deve ser suficiente, mas se uma abundância de tecido adiposo for vista, disseque cuidadosamente o tecido adiposo verticalmente para visualizar a traqueia.
NOTA: Use luvas estéreis e instrumentos estéreis por meio da técnica somente de pontas. O risco de infecção é mínimo se o procedimento for realizado em condições estéreis. - Usando uma pinça, intube cada camundongo. Puxe a língua para fora suavemente e introduza um angiocateter de 20 G pela boca, avançando o cateter para a traqueia. Aplique uma leve pressão sobre a traqueia para facilitar a intubação.
NOTA: Como a traqueia é anterior ao corpo do camundongo, dobre levemente a ponta do cateter, pois isso ajudará a obter o ângulo para intubar o camundongo com sucesso. A incisão cervical é realizada principalmente para fins de visualização; alternativamente, o operador pode intubar a traqueia às cegas. - Após a intubação, conecte o mouse a um respirador para confirmar a intubação. Os parâmetros ventilatórios regulares usados neste procedimento são 200 μL de volume sistólico e 200 golpes por minuto. Aumente e/ou diminua a frequência do ventilador brevemente para confirmação rápida e fácil.
- Após confirmar a intubação, desconecte o mouse do respirador e instile cuidadosamente 50 μL do agente bacteriano através do angiocateter usando uma ponta de carregamento de gel pipetado de 200 μL. Para camundongos controle, injete 50 μL de caldo TH estéril.
- Depois de instilar o agente bacteriano, conecte o mouse ao respirador novamente para ajudar a reiniciar a respiração. Deixe o mouse no respirador por 30-60 s. Depois de injetar todos os ratos, monitore sua respiração. Se houver um padrão de respiração lenta, conecte os ratos ao respirador novamente.
- Feche a incisão adicionando uma pequena gota de cola na pele. Junte as dobras da pele e aplique uma leve pressão até que a cola seque.
- Coloque os ratos em uma almofada de aquecimento para recuperação e monitore-os de perto até que recuperem a consciência suficiente. Transfira os ratos de volta para a gaiola depois de totalmente recuperados. Para o controle da dor/angústia pós-operatória, os camundongos podem ser tratados com buprenorfina, com uma dose de 0,05-0,1mg/kg por via subcutânea (SC).
NOTA: Animais com perda de peso superior a 20% ou com sofrimento significativo após o procedimento, como letargia, incapacidade de alcançar água ou comida, respiração difícil, resposta prejudicada a estímulos externos ou diminuição do estado de alerta mental devem ser sacrificados.
5. Lavagem broncoalveolar e coleta pulmonar
- Eutanasiar o camundongo colocando-o em um recipiente fechado contendo 5% de isoflurano. Continue a exposição ao isoflurano por 1 minuto depois que o camundongo parar de respirar. Realize a toracotomia para confirmar a eutanásia.
NOTA: Confirme a eutanásia por meio de exame visual e físico. O coração deve ter parado de bater e os ratos não respirarem. As membranas mucosas devem ser brancas ou pálidas. - Coloque o mouse em decúbito dorsal em uma tábua cirúrgica limpa e pendure-o pelos incisivos. Pulverize a pele do camundongo com etanol 70%. Usando uma tesoura cirúrgica, faça uma pequena incisão superficial no pescoço para visualizar a traqueia do camundongo.
- Canular a traqueia com um cateter 20 G. Com cuidado, adicione 1 mL de solução salina tamponada com fosfato livre de cálcio (PBS) por via intratraqueal, usando uma seringa de 1 mL. Permita a expansão pulmonar completa e, em seguida, aspire o fluido usando a mesma seringa. Repita esta etapa para um total de 2 mL.
- Transferir o LBA para uma alíquota de 2 ml. Execute esta etapa duas vezes para um volume final de 2 mL. Não lave os pulmões com mais de 1 mL de cada vez, devido ao alto risco de ruptura do espaço alveolar.
- Abra a cavidade torácica e exponha o pulmão, o coração e a traqueia usando tesouras e pinças. Disseque cuidadosamente o diafragma e remova a caixa torácica. Certifique-se de não beliscar o tecido pulmonar.
- Tranecte a aorta abdominal para permitir a exsanguinação. Perfundir o tecido pulmonar fazendo uma pequena incisão de aproximadamente 2 mm no ventrículo direito usando uma tesoura e injetar 5 mL de PBS frio usando um cateter 20 G. O PBS deve perfundir o pulmão. Se uma perfusão adequada for realizada, o tecido pulmonar ficará pálido e o PBS deixará o compartimento intravascular através da aorta abdominal.
- Com cuidado, extraia os pulmões e disseque-os da traqueia para realizar histologia ou processamento adicional para suspensão de célula única.
- Se estiver processando para histologia, insira cuidadosamente um cateter 20 G para inflar os pulmões até 25 cm H2O com solução de formalina (tamponado neutro a 10%). Assim que os pulmões estiverem insuflados, passe um fio de sutura 3.0 com cerca de 5 cm de comprimento abaixo da traqueia e amarre-o firmemente duas vezes para garantir que a formalina permaneça no tecido pulmonar. Delicadamente, disseque o pulmão do resto dos tecidos e coloque-o em um tubo cônico de 15 mL contendo 10 mL de solução de formalina.
6. Processamento da lavagem broncoalveolar
- Centrifugar o BAL a 500 x g a 4 °C durante 5 min. Remover o sobrenadante sem células num tubo separado e conservar a -80 °C.
NOTA: Uma análise mais aprofundada pode ser realizada no sobrenadante do LBA, incluindo quantificação de proteínas (por exemplo, ensaio BCA13) ou medição de biomarcadores ou citocinas específicos (ensaios ELISA e ensaios múltiplos com plataformas como MSD e Luminex). - Lise os glóbulos vermelhos adicionando 100 μL de tampão de lise por 1 min. Neutralize a reação de lise adicionando 1 mL de PBS. Centrifugar o LBA a 500 x g a 4 °C durante 5 min e remover o sobrenadante.
- Ressuspenda as células em PBS (100-300 μL; com base no tamanho do pellet celular). Realize uma contagem de células com 0,4% de coloração azul de tripano por contagem manual ou automatizada de células. Utilizar o sedimento restante para coloração por citometria de fluxo e/ou criopreservação (ressuspendendo em solução criopreservadora) em azoto líquido para ensaios adicionais.
7. Processamento pulmonar para suspensão de célula única
- Disseque suavemente o pulmão do resto dos tecidos e coloque-o em um tubo cônico de 15 mL contendo 5 mL de PBS frio. Remova o pulmão do PBS e seque-o com uma toalha de papel.
- Prepare um coquetel de digestão adicionando 1 mg de DNase e 5 mg de colagenase em 1 mL de meio de Eagle modificado de Dulbecco com baixo teor de glicose (DMEM). Transfira o pulmão para um tubo C contendo 1 mL de coquetel de digestão.
- Transferir o tubo C para o dissociador tecidual e seguir o protocolo padronizado para processamento de tecido pulmonar14.
- Adicione 10 mL de PBS frio no tubo C e misture bem. Filtrar a suspensão unicelular utilizando um filtro de células de 70 μm sobre um tubo cónico de 50 ml. Execute a filtragem duas vezes.
- Centrifugar a suspensão a 500 x g a 4 °C durante 5 min. Transvasar cuidadosamente o sobrenadante e adicionar 1 ml de tampão de lise durante 1 minuto à temperatura ambiente. Adicione 10 mL de PBS frio para interromper a reação de lise e remover o sobrenadante.
- Centrifugar a suspensão a 500 x g a 4 °C durante 5 min. Transvasar cuidadosamente o sobrenadante e adicionar 10 ml de PBS frio.
- Realize uma contagem de células com coloração de azul de tripano por contagem manual ou automatizada de células. Use um pellet de célula para coloração por citometria de fluxo e/ou criopreservação em nitrogênio líquido para testes adicionais.
Resultados
Os procedimentos descritos acima permitiram modelar os mecanismos fisiopatológicos subjacentes à lesão pulmonar induzida por pneumonia bacteriana em camundongos. Para começar a modelar, camundongos C57BL / 6 do tipo selvagem (WT) foram obtidos do Laboratório Jackson e criados nas instalações de animais do instituto. Camundongos WT C57BL/6 machos, com 8 semanas de idade, foram submetidos à inoculação intratraqueal de caldo TH (controle), 3 x 106 UFC de Spn vivo ou 200 UFC de Kpn vivo. Após a infecção, os camundongos foram monitorados por 6 e 10 dias para Spn e Kpn, respectivamente. Embora os grupos infectados tenham apresentado menor peso corporal em comparação com o controle não infectado, o grupo Spn recuperou seu peso corporal em direção à linha de base, enquanto os camundongos infectados com Kpn apresentaram recuperação lenta após 6 dias de infecção (Figura 2A). Durante a duração do estudo, nenhum camundongo precisou ser submetido à eutanásia devido ao peso corporal superior a 20%, e não houve evidência de dor e angústia.
Medimos a lesão pulmonar em diferentes intervalos. A concentração de proteína no LBA e a contagem total de células para o LBA e os pulmões foram notavelmente maiores nos grupos infectados (Figura 2). Cortes histológicos representativos exibindo o processo inflamatório em ambos os modelos foram obtidos nos dias 2, 4 e 6 pós-inoculação (Figura 3), mostrando evidências de inflamação alveolar persistente nos camundongos infectados com Kpn (Figura 4), mesmo no dia 10. Os camundongos infectados com Kpn continuaram a lesão no dia 10 (Figura 2 e Figura 4), enquanto os camundongos infectados com Spn resolveram a inflamação pulmonar no dia 6 (Figura 2 e Figura 3).
Suspensões de células únicas de pulmão foram usadas para discriminar a paisagem imune por citometria de fluxo de alta dimensão no dia 6 pós-infecção no modelo Spn , usando um painel de 18 cores em classificação de células ativadas por fluorescência (FACS). Usando a incorporação de vizinhos estocásticos distribuídos por t (t-SNE), as diferenças gerais na composição das células imunes podem ser visualizadas, sendo notáveis para um número aumentado de granulócitos (CD45+, CD11b+, CD24+, MHC-II-), macrófagos intersticiais (CD45+, CD11b+, MHC-II-, CD24-), monócitos (CD45+, CD11b+, MHC-II-, CD24-, CD64-), células B (CD45+, CD19+) e células T (CD45+, CD3+), incluindo células natural killer (CD45+, CD3+, NK1.1+), conforme exibido na Figura 5. As estratégias de gating são mostradas na Figura 6.
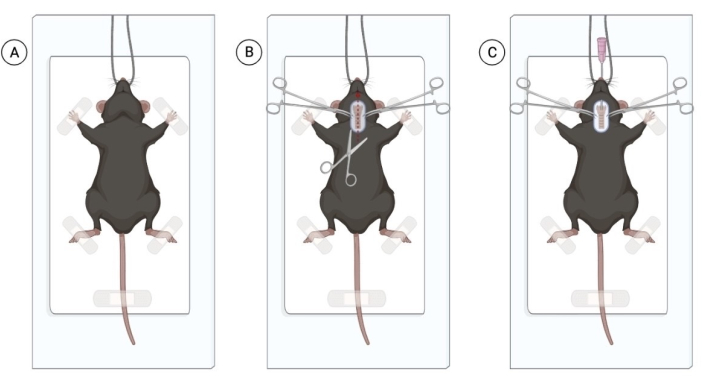
Figura 1: Procedimento cirúrgico para instilação intratraqueal de bactérias vivas. (A) Posição do camundongo na área cirúrgica estéril, pendurado pelos incisivos. (B) Área de incisão e exposição da traqueia. (C) Processo de intubação inserindo o cateter 20 G. Figura criada com Biorender.com. Clique aqui para ver uma versão maior desta figura.
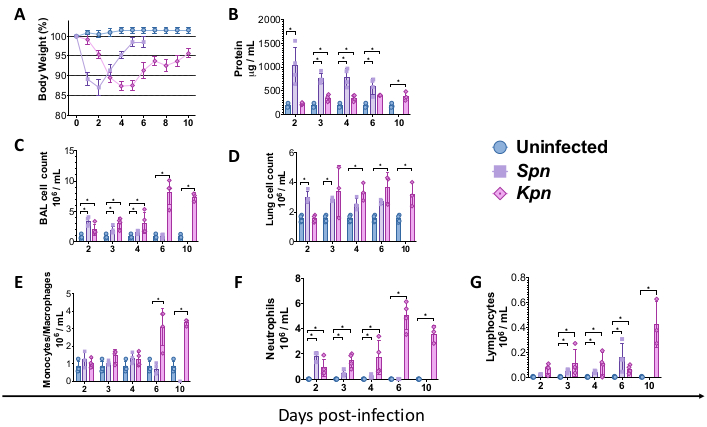
Figura 2: Perfis de lesão pulmonar aguda (LPA) após modelos de pneumonia. (A) Peso corporal ao longo do tempo em relação à linha de base, controle versus Kpn e Spn (n = 4, por grupo). (B) Quantificação de proteína total de LBA pelo ensaio de BCA (n = 4, por grupo). (C) Contagem total de células de LBA no controle (n = 3), Kpn (n = 4) e Spn (n = 3). (D) Contagem total de células pulmonares no controle (n = 3), Kpn (n = 4) e Spn (n = 3). (E-G) Diferencial de células de LBA pela contagem histológica manual da citospina de LBA no controle (n = 3), Kpn (n = 4) e Spn (n = 3). Os testes estatísticos foram feitos pelo teste t individual, comparando o controle não infectado versus os grupos infectados. *p < 0,05. Os dados são exibidos usando o erro padrão (SE) para cada gráfico. O eixo y é dias após a infecção para todos os painéis. Abreviaturas: LBA = lavado broncoalveolar; Spn = Streptococcus pneumoniae; Kpn = Klebsiella pneumoniae. Clique aqui para ver uma versão maior desta figura.
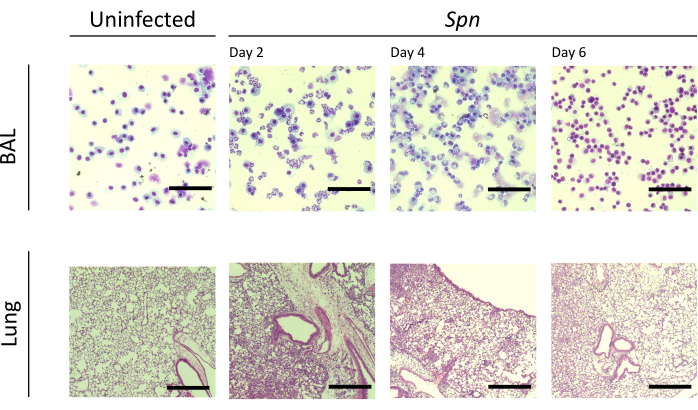
Figura 3: Achados histopatológicos pulmonares durante a infecção por Spn . Coloração de hematoxilina e eosina (H&E) de cortes histológicos de um LBA representativo e corte pulmonar após a infecção intratraqueal de Spn e nos dias 2, 4 e 6. Ampliação do LBA = 100x; aumento pulmonar = 10x. Abreviaturas: LBA = lavado broncoalveolar; Spn = Streptococcus pneumoniae. Clique aqui para ver uma versão maior desta figura.
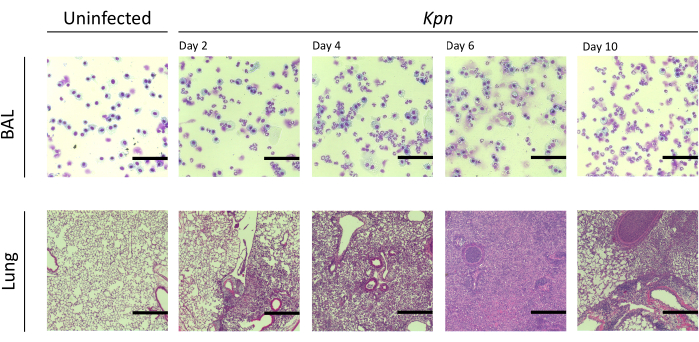
Figura 4: Achados histopatológicos pulmonares durante a infecção por Kpn . Coloração de hematoxilina e eosina (H&E) de cortes histológicos de um LBA representativo e corte pulmonar após a infecção intratraqueal de Kpn nos dias 2, 4, 6 e 10. As imagens mostram uma ampliação de alta potência (barra de escala = 50 μm). Abreviaturas: LBA = lavado broncoalveolar; Kpn = Klebsiella pneumoniae. Clique aqui para ver uma versão maior desta figura.
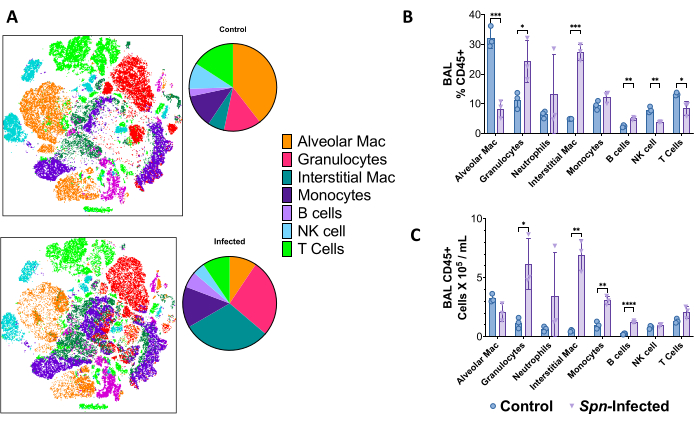
Figura 5: Paisagem de células imunes por citometria de fluxo multicolorida após 6 dias de infecção por Spn . (A) A incorporação de vizinhos estocásticos distribuídos por T (t-SNE) foi usada para visualizar as populações de células imunes (CD45+) do pulmão comparando o grupo controle não infectado versus infectado. (B) Resumo das frequências das células imunes do total de células CD45 + no pulmão. (C) Contagem total de células de cada população individual. As comparações estatísticas foram feitas por meio de testes t entre o controle e os infectados. *p < 0,05, **p < 0,01, ***p < 0,001. Os dados são exibidos usando o erro padrão (SE) para cada gráfico. Abreviaturas: LBA = lavado broncoalveolar; Spn = Streptococcus pneumoniae. Clique aqui para ver uma versão maior desta figura.

Figura 6: Estratégias de bloqueio para identificar a subpopulação de células imunes nos pulmões no início e após a pneumonia. A suspensão de LBA e células pulmonares foi submetida à coloração para citometria de fluxo multicolorida. Os detritos foram fechados primeiro usando SSC-A e FSC-A, e as células individuais foram fechadas por duas estratégias (SSC-W vs. SSC-H e FSC-W vs. FSC-H). As células vivas foram identificadas usando um discriminador vivo/morto versus SSC-A. As populações de células subsequentes foram identificadas por marcadores previamente identificados 15. Abreviatura: LBA = lavado broncoalveolar. Clique aqui para ver uma versão maior desta figura.
Discussão
Modelos murinos experimentais de PNA oferecem uma plataforma para avaliar os mecanismos celulares e moleculares subjacentes à lesão e resolução da SDRA. Os componentes fisiopatológicos que podem ser avaliados incluem vias inflamatórias precoces, depuração bacteriana, alterações dinâmicas da paisagem imune, resolução da inflamação, fibroproliferação e reparo epitelial e vascular16. No entanto, vários aspectos devem ser considerados ao planejar a replicação desse modelo de lesão pulmonar induzida por pneumonia, incluindo idade, sexo, linhagem do camundongo, fatores intrínsecos do hospedeiro (por exemplo, estado imunocomprometido), o patógeno específico e a carga bacteriana usada e a experiência da equipe que realiza o procedimento.
A PNA está entre as principais causas de SDRA. Optou-se por utilizar Spn e Kpn vivos, que são causas prevalentes de PNA adquirida na comunidade e hospitalar em humanos, respectivamente17. Sugerimos otimizar os modelos bacterianos de PNA titulando doses de bactérias vivas para atingir o perfil desejado de mortalidade e resolução de lesões que melhor se adapte à hipótese do investigador. Otimizamos uma inoculação intratraqueal de bactérias de 3 x 106 UFC para Spn e 200 UFC para Kpn em camundongos, o que causou inflamação alveolar, ruptura da barreira alveolocapilar e disfunção orgânica (Figura 2). No entanto, lotes bacterianos de diferentes fontes ou mesmo dentro de alças duplicadas podem exibir diferentes graus de inflamação e lesão, mesmo quando usando a mesma cepa e UFC.
Portanto, para replicar os resultados apresentados neste manuscrito, os pesquisadores devem começar com a concentração de bactérias aqui descrita; no entanto, eles podem precisar aumentar ou diminuir a dose para obter um perfil de modelo semelhante. Portanto, cada novo lote de bactérias utilizado precisa ser otimizado para seu potencial efeito de resolução de lesões. Apresentamos um modelo robusto de PNA com dois resultados de resolução diferentes, um de auto-resolução (Spn) e outro de resolução lenta/não resolvida (Kpn), que podem servir como plataformas para os investigadores avaliarem mecanismos imunológicos e testarem intervenções terapêuticas, particularmente no pico ou após a infecção (por exemplo, 2 dias após a infecção).
Idade, sexo, tensão e fatores genéticos afetam a cinética dos padrões de resolução da lesão16. Por exemplo, o sexo apresenta resolução acelerada em mulheres em comparação com homens18; portanto, um aumento na carga bacteriana leva ao aumento da mortalidade e atraso na resolução em homens em comparação com mulheres. O envelhecimento é outro fator a ser considerado ao titular a UFC das bactérias utilizadas. Camundongos idosos apresentaram 100% de mortalidade quando usamos a dose de Spn especificada (não mostrada aqui). Camundongos jovens são mais frequentemente usados nos modelos pneumocócicos PNA (variando de 6 a 14 semanas), enquanto camundongos idosos (19-26 meses de idade) exibem uma resposta imune alterada e são usados para investigar o papel do envelhecimento no PNA11 . Tivemos que diminuir a UFC para 300% para alcançar a sobrevivência em animais idosos (não mostrado aqui). Camundongos C57BL/6 machos (8-12 semanas de idade) foram usados neste estudo e foram acompanhados durante 6 a 10 dias após a infecção. Diferenças significativas na suscetibilidade também podem ser encontradas entre as cepas; cepas endogâmicas como BALB/C e C57BL6/J têm diferentes respostas à infecção11,19.
A inoculação direta de bactérias por via intratraqueal permite uma entrega mais precisa do inóculo (até 99%) nos pulmões12, representando uma alternativa para sorotipos menos virulentos e diminuindo a aerossolização de bactérias11. No entanto, pode-se argumentar que é um procedimento invasivo. A intubação pode ser desafiadora, requer anestesia sistêmica e pode levar a trauma traqueal com subsequente edema das vias aéreas e estridor. Os camundongos podem desenvolver um reflexo vasovagal que leva à apneia, para a qual é necessário ter um pequeno ventilador de camundongo para fornecer suporte ventilatório adicional quando necessário. A experiência do cirurgião que realiza o procedimento é um componente crítico para garantir o sucesso da intubação11. Em nosso estudo, nenhum camundongo precisou ser sacrificado devido ao controle adequado da dor e não superior a 20% de perda de peso corporal. Não foram observados sinais de dor e angústia, como letargia, incapacidade de alcançar água ou comida, dificuldade para respirar ou diminuição do estado de alerta mental. Métodos alternativos de entrega bacteriana direta aos pulmões são a aspiração orofaríngea, embora a resolução da lesão pulmonar pareça ocorrer mais rapidamente, e algumas bactérias podem terminar no estômago e no trato gastrointestinal20.
Modelos pré-clínicos de PNA permitem que os investigadores avaliem o cenário imunológico. Os compartimentos broncoalveolar e intersticial podem ser avaliados quanto a alterações dinâmicas nas células imunes16. Além disso, as células podem ser cultivadas e estimuladas ex vivo para determinar sua produção específica de citocinas e quimiocinas. Aqui, nos concentramos em explorar a paisagem de células imunes no pulmão e na LBA usando citometria de fluxo multicolorida. O sequenciamento de RNA de célula única também pode ser realizado para entender as assinaturas transcriptômicas específicas da célula em diferentes estágios de resolução da lesão.
Os modelos PNA-SDRA geram efeitos sistêmicos que podem ser detectados precocemente pela medida do peso corporal durante o curso da doença10. Embora não meçamos diretamente os efeitos sistêmicos da SDRA, a disfunção orgânica também pode ser avaliada pela medição sanguínea de perfis químicos e pela coleta de diferentes tecidos, como baço, rim e fígado para histologia. Os efeitos sistêmicos da PNA-SDRA pneumocócica foram previamente descritos por outros grupos usando a mesma cepa de bactéria21.
Aqui, é descrito um modelo de PNA experimental que se assemelha a alguns dos principais achados fisiopatológicos subjacentes à SDRA humana. Embora não existam modelos ideais que recapitulem completamente a complexidade e heterogeneidade da SDRA humana9, esses modelos são relevantes e reprodutíveis para o estudo dos mecanismos de lesão e reparo pulmonar, servindo também como plataforma para a identificação de novos alvos farmacológicos potenciais que se concentram em acelerar a resolução da inflamação pulmonar e promover o reparo pulmonar.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este estudo foi apoiado pelo NIH grant R01 HL131812 e R01HL163881.
Materiais
| Name | Company | Catalog Number | Comments |
| 1-200 µL Round 0.5 mm Thick Gel-Loading Pipet Tips | Corning | 4853 | |
| 2 mL Cryogenic vials | Corning Incorporated | 431420 | 2 mL self standing, round bottom, red cap, polypropylene |
| 2 mL Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Fisherscientific | 05-402-24C | Shape: Round, Length (Metric): 38mm, Diameter (Metric) Outer: 10mm, Capacity (Metric): 2mL |
| 70 µm Cell Strainer | Falcon | 352350 | White, Sterile, Individually Packaged |
| 96-well Clear Round Bottom | Falcon | 353077 | TC-treated Cell Culture Microplate, with Lid, Individually Wrapped, Sterile |
| Acepromizine Maleate Injection, USP 500 mg/50 mL (10mg/mL) | Phoenix | NDC 57319-604-04 | EACH mL CONTAINS: acepromazine maleate 10 mg, sodium citrate 0.36%, Citric acid 0.075%, benzyl alcohol 1% and water for injection. |
| Ammonium-Chloride-Potassium (ACK) Lysing Buffer | Quality Biological | 118-156-721 | 4 x 100mL |
| Anti-mouse I-A/I-E | Biolegend | 107628 | APC/Cyanine7 anti-mouse I-A/I-E [M5/114.15.2]; Isotype: Rat IgG2b |
| BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| BD Trypticase Soy Agar | BD-Biosciences | 90001-276 | 5% Sheep Blood Prepared Media Stacker Plates, BD Diagnostics |
| Biotix Disposable Reagent Reservoirs | Biotix | 89511-194 | |
| Bovine Serum Albumin | Sigma-Aldrih | A4503 | |
| CD103 | Invitrogen | 509723 | Integrin alpha E) Armenian Hamster anti-Mouse, FITC, Clone: 2E7 |
| CD11b | Invitrogen | RM2817 | PE-Texas Red, Clone: M1/70.15, Invitrogen |
| CD11c | BD Biosciences | 565872 | Hamster anti-Mouse, APC-R700, Clone: N418, BD Horizon |
| CD19 | Biolegend | 152410 | APC anti-mouse CD19 [1D3/CD19]; Isotype: Rat IgG2a, κ |
| CD24 | BD Biosciences | 563450 | Rat anti-Mouse, Brilliant Violet 711, Clone: M1/69 |
| CD4 | BD Biosciences | 563790 | BUV395; Clone: GK1.5 |
| CD45 | Biolegend | 103157 | Brilliant Violet 750 anti-mouse CD45 [30-F11]; Isotype: Rat IgG2b, κ; |
| CD8a | BD Biosciences | 612759 | Rat anti-Murine, Brilliant Ultraviolet 737, Clone: 53-6.7 |
| Cell Counting Slides | Bio-rad | 1450017 | For TC20 Cell Counter |
| Cell strainer 70 µL Nylon | Falcon | 198718 | REF 352350 |
| Collagenase Type1 | Worthington Biochemical Corporation | LS004197 | |
| Culti-Loop Streptococcus pneumoniae | Thermo Scientific | R4609015 | ATCC 4961 |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrih | DN25 | |
| Disposable inoculation loops/needles | Fisherbrand | 22-363-603 | Color blue; Volume 1 µL |
| DMEM (Dulbecco’s Modified Eagle’s Medium) | Corning | 10-014-CV | |
| Fc Block | BD Biosciences | 553142 | CD16/CD32 Rat anti-Mouse, Unlabeled, Clone: 2.4G2 |
| Formalin solution | Sigma-Aldrih | HT501640 | Formalin solution, neutral buffered, 10% |
| Gauze Sponges, Covidien | Curity | 2146- | |
| gentleMACS C Tubes | MACS Miltenyi Biotec | 130-093-237 | |
| gentleMACS Dissociator | MACS Miltenyi Biotec | 130-093-235 | SN: 4715 |
| Hema 3 Manual Staining System and Stat Pack | Thermo Scientific | 23123869 | |
| Isoflurane Liquid Inhalation | Henry Schein | 1182097 | |
| IV CATHETER JELCO 20GX1.25" | Hanna Pharmaceutical Supply Co., Inc | 405611 | |
| Ketamine HCl Injection | Henry Schein | 1049007 | Ketamine HCl Injection MDV 100mg/mL 10mL 10/Box |
| Klebsiella pneumoniae | ATCC | 43816 | subsp. pneumoniae (Schroeter) Trevisan |
| Loctite 409 | Electron Microscopy Sciences | 7257009 | |
| Ly-6C | Biolegend | 128036 | Brilliant Violet 605 anti-mouse Ly-6C [HK1.4]; Isotype: Rat IgG2c |
| Ly-6G | BD Biosciences | 740157 | Rat anti-Mouse, Brilliant Violet 510, Clone: 1A8, BD Optibuild |
| MiniVent Type 845 | Hugo Sachs Elektronik- Harvard Apparatus | 4694 | D-79232 March (Germany) |
| NK-1.1 | BD Biosciences | 553165 | Mouse anti-Mouse, PE, Clone: PK136, BD |
| Phase Hemacytometer | Hausser Scientific | 1475 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | 1X without calcium and magnesium, |
| Round Bottom | Sarstedt | 55.476.305 | |
| Round-Bottom Polystyrene Test Tubes | Falcon | 352235 | With Cell Strainer Snap Cap, 5mL |
| SealRite 1.5 mL Natural Microcentrifuge Tube | USA Scientific | 1615-5500 | Free of detectable Rnase, DNase, DNA and pyrogens. |
| Shandon EZ Single Cytofunnel | Epredia | A78710003 | |
| Siglec-F | BD Biosciences | 562681 | Anti-Mouse, Brilliant Violet 421, Clone: E50-2440 |
| Silk Black Braided 30"(75 cm) Sterile, nonabsorbable surgical suture U.S.P. | Ethicon | K-834 | 0 (3.5 metric) |
| Stainless-Steel Slide Clip | Epredia | 59910052 | |
| Sterile Single Use Vacuum Filter Units | Thermo Scientific | 1660045 | |
| Syringe sterile, single use, 1 mL | BD-Biosciences | 309628 | |
| TC20 Automatic Cell Counter | Bio-Rad | 508BR05740 | |
| TipOne 200 ul yellow pipet tip refill | USA Scientific | 1111-0706 | |
| TODD HEWITT BROTH | RPI | T47500 | |
| TPX Sample Chamber | Epredia | A78710018 | |
| TPX Single Sample Chamber, Caps and Filter Cards | Epredia | 5991022 | |
| Trypan Blue | Bio-rad | 1450022 | |
| U-100 Insulin Syringes | BD-Biosciences | 329461 | |
| Wet-Proof Multi-Heat Electric Heat Pad | Cullus | Model PR7791AB | 120 volst AC; 45 watts; Listed 562B/E26869 |
Referências
- Bellani, G., et al. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 315 (8), 788-800 (2016).
- Hariri, L., Hardin, C. C. Covid-19, angiogenesis, and ARDS endotypes. The New England Journal of Medicine. 383 (2), 182-183 (2020).
- Ferguson, N. D., et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Medicine. 38 (10), 1573-1582 (2012).
- Tomashefski Jr, J. F. Pulmonary pathology of the adult respiratory distress syndrome. Clinics in Chest Medicine. 11 (4), 593-619 (1990).
- Martin, T. R. Lung cytokines and ARDS: Roger S. Mitchell lecture. Chest. 116 (1 Suppl), 2S-8S (1999).
- Colletti, L. M., et al. Role of tumor necrosis factor-alpha in the pathophysiologic alterations after hepatic ischemia/reperfusion injury in the rat. The Journal of Clinical Investigation. 85 (6), 1936-1943 (1990).
- Donnelly, S. C., et al. The association between mortality rates and decreased concentrations of interleukin-10 and interleukin-1 receptor antagonist in the lung fluids of patients with the adult respiratory distress syndrome. Annals of Internal Medicine. 125 (3), 191-196 (1996).
- Miller, E. J., Cohen, A. B., Matthay, M. A. Increased interleukin-8 concentrations in the pulmonary edema fluid of patients with acute respiratory distress syndrome from sepsis. Critical Care Medicine. 24 (9), 1448-1454 (1996).
- Matute-Bello, G., et al. An official American Thoracic Society workshop report: features and measurements of experimental acute lung injury in animals. American Journal of Respiratory Cell and Molecular Biology. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 66 (2), e1-e14 (2022).
- Borsa, N., Pasquale, M. D., Restrepo, M. I. Animal models of pneumococcal pneumonia. International Journal of Molecular Sciences. 20 (17), 4220(2019).
- Rubins, J. B., et al. Dual function of pneumolysin in the early pathogenesis of murine pneumococcal pneumonia. The Journal of Clinical Investigation. 95 (1), 142-150 (1995).
- Thermo Scientific, Pierce BCA Protein Assay Kit. , https://www.thermofisher.com/order/catalog/product/23225 Forthcoming.
- Jungblut, M., Oeltze, K., Zehnter, I., Hasselmann, D., Bosio, A. Standardized preparation of single-cell suspensions from mouse lung tissue using the gentleMACS Dissociator. Journal of Visualized Experiments. (29), e1266(2009).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. an official American Thoracic Society Workshop report. American Journal of Respiratory Cell and Molecular Biology. 61 (2), 150-161 (2019).
- Aeffner, F., Bolon, B., Davis, I. C. Mouse models of acute respiratory distress syndrome: a review of analytical approaches, pathologic features, and common measurements. Toxicologic Pathology. 43 (8), 1074-1092 (2015).
- Torres, A., et al. Pneumonia. Nature Reviews Disease Primers. 7 (1), 25(2021).
- Xiong, Y., et al. Estradiol resolves pneumonia via ERβ in regulatory T cells. JCI Insight. 6 (3), e133251(2021).
- D'Alessio, F. R., et al. Enhanced resolution of experimental ARDS through IL-4-mediated lung macrophage reprogramming. American Journal of Physiology. Lung Cellular and Molecular Physiology. 310 (8), L733-L746 (2016).
- D'Alessio, F. R. Mouse models of acute lung injury and ARDS. Methods in Molecular Biology. 1809, 341-350 (2018).
- Gotts, J. E., et al. Clinically relevant model of pneumococcal pneumonia, ARDS, and nonpulmonary organ dysfunction in mice. American Journal of Physiology. Lung Cellular and Molecular Physiology. 317 (5), L717-L736 (2019).
Erratum
Formal Correction: Erratum: Experimental Model to Evaluate Resolution of Pneumonia
Posted by JoVE Editors on 6/13/2023. Citeable Link.
An erratum was issued for: Experimental Model to Evaluate Resolution of Pneumonia. A figure was updated.
Figure 2 was updated from:

to:

Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados