Method Article
Desenvolvendo Modelos de Melanogaster Drosophila para Imagem e Controle Optogenético da Função Cardíaca
Neste Artigo
Resumo
O presente protocolo descreve a geração de Drosophila melanogaster expressando opsinas eNpHR2.0 ou ReaChR no coração para imagem OCT e ritmo cardíaco optogenético. Instruções detalhadas para imagem de Drosophila OCT e modulação de batimentos cardíacos, incluindo a simulação de parada cardíaca restauradora, bradicardia e taquicardia em animais vivos em diferentes estágios de desenvolvimento, são relatadas.
Resumo
O uso de Drosophila melanogaster (mosca-das-frutas) como organismo modelo tem garantido progressos significativos em muitas áreas da ciência biológica, desde organização celular e investigações genômicas até estudos comportamentais. Devido ao conhecimento científico acumulado, nos últimos anos, drosophila foi trazida para o campo da modelagem de doenças humanas, incluindo distúrbios cardíacos. O trabalho apresentado descreve o sistema experimental de monitoramento e manipulação da função cardíaca no contexto de todo um organismo vivo utilizando luz vermelha (617 nm) e sem procedimentos invasivos. O controle sobre o coração foi alcançado usando ferramentas optogenéticas. A optogenética combina a expressão de opsinas transgênicas sensíveis à luz e sua ativação óptica para regular o tecido biológico de interesse. Neste trabalho, foi utilizada uma tomografia de coerência óptica integrada personalizada (OCT) e um sistema de estimulação optogenética para visualizar e modular o coração D. melanogaster em funcionamento nos estágios larval e de desenvolvimento pupal instar. O sistema genético duplo UAS/GAL4 foi empregado para expressar halorhodopsina (eNpHR2.0) e channelrhodopsin de mudança vermelha (ReaChR), especificamente no coração de mosca. São fornecidos detalhes sobre a preparação de D. melanogaster para imagens de OCT ao vivo e ritmo optogenético. Um software de integração desenvolvido em laboratório processou os dados de imagem para criar apresentações visuais e características quantitativas da função cardíaca Drosophila . Os resultados demonstram a viabilidade de iniciar parada cardíaca e bradicardia causada pela ativação do eNpHR2.0 e pela realização do ritmo cardíaco após a ativação do ReaChR.
Introdução
No final de 2010, a revista Nature Methods selecionou a optogenética como o Método do Ano1. O uso de ferramentas genéticas (opsinas transgênicas) reguladas pela luz para controlar tecidos biológicos de interesse com precisão e velocidade sem precedentes abriu um portão de inundação para novas aplicações. Até o momento, a maioria das realizações pertence à neurociência. A tecnologia foi introduzida como um novo método de controle preciso de neurônios únicos2 e avançou para descobertas na área de funções cognitivas do organismo vivo3. Desde o início, os neurocientistas demonstraram a capacidade de modular todo o comportamento do organismo. A expressão e a ativação da luz da osina ChR2 em camundongos neurônios dopaminérgicos causaram sua ativação e foram suficientes para conduzir o condicionamento comportamental4. A inibição optogenética de um subconjunto de neurônios contendo halorhodopsina NpHR2.0 entregue ao foco epiléptico do cérebro de roedor resultou na atenuação de convulsões eletroencefalográficas5.
Aplicações optogenéticas em cardiologia estão se desenvolvendo a um ritmo constante6. O ChR2 foi expresso com sucesso na cultura celular cardiomiócitos e em camundongos; o ritmo cardíaco foi conduzido por flashes de luz azul (realizados utilizando uma fibra implantada em animais vivos)7. Em zebrafish, ChR2 foi expressa e usada para identificar a região cardíaca que faz o ritmo; Ativação NPHR induziu parada cardíaca8. O ritmo cardíaco optogenético tem o potencial único para desenvolver novas terapias de ritmo e ressincronização9. Tentativas de estabelecer um sistema de rescisão de arritmia autógena foram relatadas recentemente também10.
Pesquisas extensivas e o desenvolvimento de novos tratamentos terapêuticos requerem a aplicação de vários sistemas modelo, da cultura celular aos mamíferos. O coração de um vertebrado é um órgão muito complexo. Os cardiomiócitos (CM) compreendem um terço de todas as células cardíacas; outras células incluem neurônios, células musculares lisas vasculares e células não excitáveis (ou seja, células endoteliais, fibroblastos e células imunes). Pesquisar a cultura celular cm limita a tradução dos resultados obtidos para aplicações médicas humanas. As manipulações genéticas dos organismos de modelos mamíferos são limitadas e demoradas. Modelos invertebrados menores têm muitas vantagens; seu sistema cardiovascular carrega todos os elementos histológicos essenciais. Drosophila melanogaster (mosca-das-frutas) é um sistema de modelo genético simples e poderoso para investigar o papel dos genes associados às doenças humanas, incluindo doenças cardíacas 11,12,13. Como animais de curta duração, as moscas-das-frutas representam uma excelente oportunidade para modelar mudanças de função cardíaca dependentes da idade ou da doença que podem ser traçadas ao longo da vida 14,15,16,17. O tubo cardíaco da mosca-das-frutas está localizado no lado dorsal de seu corpo dentro de 200 μm da superfície da cutícula, permitindo que a luz visível até quase infravermelha chegue ao tubo cardíaco. Este recurso anatômico permite o ritmo óptico não invasivo do coração Drosophila usando ferramentas optogenéticas existentes.
Para monitorar o coração Drosophila, foi desenvolvido um sistema de imagem de coerência óptica de domínio espectral personalizado (SD-OCT) com um módulo de excitação LED de luz vermelha integrada18. Alterações morfológicas e rítmicas em um coração de mosca de frutas relativamente simples podem ser facilmente analisadas com esta tecnologia de imagem biomédica não invasiva 12,19,20,21. Com desempenho de secção óptica aprimorada e resolução espacial em escala de micron, o OCT tem sido usado com sucesso para investigar a estrutura e monitorar a função do coração Drosophila em diferentes estágios de desenvolvimento, incluindo a 3ª larva instar e a pupaprecoce 18. Este sistema também permite o monitoramento simultâneo e estimulação da condição cardíaca da Drosophila no animal intacto. Uma visão esquemática do sistema OCT é mostrada na Figura 1. O sistema SD-OCT usa um diodo superluminescente (SLD) como fonte de luz (comprimento de onda central: 850 nm ± 10 nm, FWHM: 165 nm, ver Tabela de Materiais). Usando uma lente objetiva de 10x, o sistema de imagem OCT pode alcançar uma resolução axial de ~4,4 μm no ar e ~3,3 μm em tecido e uma resolução lateral de ~2,8 μm, suficiente para resolver detalhes finos das estruturas cardíacasde mosca 18,22. Sinais de interferência da luz refletida do braço de referência e do braço de amostra são detectados usando um espectrômetro com uma câmera de varredura de linha de 2048 pixels (taxa de linha máxima: 80 kHz, ver Tabela de Materiais). A sensibilidade do sistema medido é de ~95,1 dB. Cada varredura de OCT no modo B gera uma imagem transversal no plano de imagem xz. Imagens repetidas do modo B são adquiridas no mesmo local para criar imagens no modo M capturando o coração pulsante por mais de ~30 s 18,22,23. A taxa de quadros para imagens do modo M é de ~125 quadros/s, suficiente para capturar a dinâmica de bater coração de mosca de frutas.
Para a regulação optogenética da função cardíaca Drosophila , um módulo de iluminação com uma fonte de luz LED de 617 nm é integrado com o braço amostral do sistema SD-OCT. A luz de estimulação é focada em um ponto de ~2,2 mm de diâmetro na superfície da amostra, na mesma posição que o ponto de foco de imagem. Um software personalizado é utilizado para controlar o modo de iluminação (intensidade de luz, largura de pulso e ciclo de dever), ajustar a frequência de estimulação do pulso de luz e sincronizar a iluminação do módulo LED e a aquisição de imagens OCT do modo M22.
Publicações recentes descreveram o sistema transgênico Drosophila consistindo de operações chr2, ReaChR e eNpHR2.0 com o sistema genético UAS/GAL4. Os resultados obtidos demonstraram a capacidade de iniciar a parada cardíaca e a bradicardia causada pela ativação da luz vermelha do eNpHR2.0 e pelo ritmo cardíaco de maior frequência causado pela ativação da luz azul do ChR2. Experimentos semelhantes de ritmo foram realizados com outro channelrhodopsin, ReaChR, induível pela iluminação da luz vermelha 22,23,24. A expressão da osina em todos os experimentos descritos foi impulsionada pelo 24B-GAL4, onde a expressão da opsina foi observada em uma ampla gama de tecidos, incluindo cardiomiócitos e células musculares circundantes. No presente estudo, o 24B-GAL4 foi substituído por um driver Hand-GAL4 para alcançar a expressão de opsinas eNpHR2.0 e ReaChR específicas.
No geral, os resultados experimentais apresentados demonstram a parada cardíaca restauradora e as condições cardíacas indutíveis de bradicardia e taquicardia. Um protocolo detalhado com instruções passo a passo sobre a criação de modelos transgênicos de Drosophila e a realização de experimentos simultâneos de imagem e ritmo optogenético em animais vivos é fornecido.
Protocolo
Para o presente estudo, eNpHR2.0 linha transgênica w[*]; P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2, linha transgênica ReaChR w[*]; P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO, e driver GAL4 específico para o coração contendo fragmento de regulação genética manual w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM3 Sb[1] (este estoque de driver será indicado como Hand-GAL4) foram utilizados. y[*] w[*]; P{w[+mC]=UAS-2xEGFP}AH3 foi usado como a linha de repórteres GFP. Os estoques de Drosophila mencionados foram obtidos do Bloomington Drosophila Stock Center (BDSC, ver Tabela de Materiais) e mantidos à temperatura ambiente ou a 18 °C em mídia de fubá padrão. Os modelos de Drosophila desenvolvidos neste estudo estão disponíveis mediante solicitação de trabalho colaborativo.
1. Cruzes genéticas drosophila e preparação da mídia
- Alterar o 3º balanceador de cromossomo TM3 Sb[1] para TM6 Sb Tb, criando w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM6 Sb Tb (Hand-GAL4/TM6 Sb Tb). Consulte a Figura Suplementar 1 para o esquema de travessia. Coloque cruzes em frascos com mídia de fubá regular.
NOTA: A presença de um marcador de Tb permite que os usuários distinguem larvas e pupas contendo transgene opsin e o condutor GAL4 de animais contendo opsina, mas nenhum motorista25. - Mantenha as cruzes genéticas em uma incubadora de 25 °C, 70% de umidade em mídia contendo retina totalmente trans (ATR) especialmente formulada (ver Tabela de Materiais) no escuro por 5 dias para coleta de larvas e 6 dias para coleta de pupas.
- Combine cinco fêmeas virgens Hand-GAL4 /TM6 Sb Tb e dois a três machos de estoques de UAS-opsin (eNpHR2.0, ou ReaChR) por frasco. Consulte o diagrama cruzado para eNpHR2.0 e ReaChR opsin na Figura 2A e Figura 2B, respectivamente.
- No dia seguinte, prepare os frascos de mídia contendo ATR.
- Preparar alimentos semi-definidos de acordo com as instruções do BDSC26. Em vez de sacarose e glicose, adicione apenas sacarose (5,14 g/100 mL). Esfrie a ~60 °C com agitação constante.
- Prepare frascos de moscas estreitos e adicione 50 μL de solução atr-etanol atr de 100 mM para cada frasco.
- Usando uma pipeta sorológica, descarte alimentos de mosca para estreitar frascos de mosca, 5 mL por frasco. Vórtice a velocidade máxima para 10 s.
- Conecte os frascos e enrole-os no tecido escuro para protegê-los da luz. Deixe os frascos secarem por pelo menos 12 h (durante a noite).
- No dia seguinte, transfira as moscas constantemente colocando ovos do passo 1.3. aos frascos com alimentos contendo ATR (Passo 1.4.4.). Proteja os racks com frascos de luz.
- Após 24-48 h (dependendo do número de ovos colocados), descarte os pais para prevenir o excesso de população.
- Colete progêneres não-tb e use-os para imagens cardíacas.
NOTA: As diferenças fenotípicas nos estágios larval e pupal são demonstradas na Figura 2C. O resumo e a linha do tempo aproximada das etapas de preparação do espécime são mostrados na Figura 3.
2. Controle optogenético do coração de Drosophila
- Escolha uas-opsin/Hand-GAL4 larva/pupa do frasco (Passo 1.7.), coloque o tecido e limpe suavemente a mídia da superfície do corpo usando um pincel de pintura.
- Prepare o slide do microscópio e coloque um pequeno pedaço de fita dupla face no meio.
- Usando um pincel ou pinça fina, coloque delicadamente a larva/pupa na superfície da fita com o lado dorsal para cima e perpendicular ao lado longo da lâmina. Aplique pressão suave para anexar a larva/pupa à superfície da fita.
- Configure o slide no estágio de imagem, larva/pupa virada para baixo.
- Ligue a fonte de luz OCT por software de controle a laser (ver Tabela de Materiais). Abra o software de controle SD-OCT escrito sob medida e clique na janela Visualização .
- Defina os parâmetros de varredura no software SD-OCT.
NOTA: O objetivo é alinhar a amostra para uma imagem ideal do coração pulsante, de modo que selecionar a faixa X e a faixa Y abrange a região do coração. Nesta etapa, tanto o número de A-scans quanto B-scans são 400. A faixa nas direções x e y é de ~490 μm e ~537 μm, mostrando as duas seções ortogonais do coração (xz e yz), respectivamente. - Use micromanipuladores para controlar o estágio amostral para colocar o coração voador em foco. Ajuste a posição focal para minimizar o reflexo da luz da superfície da cutícula da mosca. Considere aplicar óleo mineral na superfície larva/pupa para minimizar o reflexo.
NOTA: O óleo pode aumentar o risco de movimento animal comprometendo as propriedades adesivas da fita. - Garantir que o coração voador possa ser totalmente visualizado na janela da imagem sem quaisquer distorções, sendo bloqueado por tecido e sombras e reflexões não desprezíveis; caso contrário, volte para o Passo 2.7.
- Defina os parâmetros de varredura para aquisição de imagem OCT no modo M.
NOTA: O número de exames A é reduzido em comparação com a Etapa 2.7. para a taxa de quadros mais rápida para capturar a dinâmica de batida do coração voador (vários Hz). O número de varreduras B denota o número de quadros repetidos para imagens no modo M, que podem ser ajustados com base no tempo de gravação e na memória disponível do sistema. Neste experimento, 128 varreduras A podem permitir uma velocidade de ~125 quadros/s, e 4.000 varreduras B repetidas são gravadas, fornecendo uma gravação contínua de ~32 s. - Adquira cinco conjuntos de dados de controle sem pulsos de estimulação da luz vermelha para calcular a frequência cardíaca de repouso (RHR).
- Projete o pulso de luz para a estimulação do ritmo no software de controle de OCT personalizado. Em "Configurações", adicione as sequências de pulso de luz projetadas para controlar a frequência de pulso, largura do pulso, duração da estimulação e tempo de espera de acordo com diferentes protocolos de estimulação.
NOTA: O RHR é medido a partir do experimento de controle sem iluminação luminosa e usado para calcular a frequência em que a luz deve ser pulsada para experimentos de taquipacing e bradypacing22. - Abra o software do controlador de luz (ver Tabela de Materiais) para gerar pulsos de luz vermelha. Escolha o modo de pulso em "Seleção de modo". Clique duas vezes na figura para as configurações "Perfil de Pulso" e escolha o Modo Seguidor. Mantenha a intensidade OFF como 0 e ajuste a porcentagem de intensidade ON ao calcular a densidade de potência real.
NOTA: Os pulsos de luz de estimulação são acionados por um sinal do software de controle OCT de acordo com as configurações da Etapa 2.12. - Adquira vídeos de modo M do coração Drosophila batendo com estimulação de luz clicando em Acquire no software de controle OCT. Repita as medidas 5x.
3. Análise de imagem
- Abra o software de segmentação de coração voador desenvolvido sob medida.
- Clique em Selecionar arquivo e selecione o arquivo a ser analisado na GUI que aparece.
- Insira os limites verticais e horizontais da região do coração em pixels nas caixas de texto superiores. Clique em Resize. Usando o controle deslizante na parte inferior, certifique-se de que toda a região do coração esteja visível e que ele preencha toda a caixa para toda a coleção. Se não for, repita esse processo e ajuste os limites.
- Clique em Prever para prever a região do coração. O programa passará agora por cada fatia da coleção e selecionará a região do coração, levando aproximadamente 3 minutos.
- Clique em Plot de RH assim que a previsão estiver concluída. Isso abrirá uma nova janela exibindo um enredo da área do coração ao longo do tempo. Certifique-se de que as áreas corretas de pico ou vale estão selecionadas. Escolha o Pulse e, em seguida, o RH para gerar uma figura final, e os parâmetros funcionais serão salvos nos arquivos .csv simultaneamente.
Resultados
Os animais de d. melanogaster que expressavam opsinas sensíveis à luz vermelha eNpHR2.0 ou ReaChR no tubo cardíaco foram gerados pela obtenção de prole a partir da cruz entre cada linha transgênica UAS-opsin e motorista Hand-GAL4 . A especificidade tecidual do condutor GAL4 foi verificada por expressão de imagem GFP (Figura 4). A terceira larva instar e os estágios iniciais de desenvolvimento da pupa foram utilizados para demonstrar os efeitos da ativação eNpHR2.0 e ReaChR por luz vermelha. Projetados ~617 nm pulsos de luz vermelha, fornecidos por LED, iluminaram a larva/pupa e ativaram o eNpHR2.0 e o ReaChR no coração. Embora o comprimento de onda de resposta máxima relatado de NpHR seja ~580 nm e de ReaChR seja ~600 nm, a iluminação de luz de 617 nm pode penetrar mais profundamente com uma entrega de energia leve aprimorada em direção ao tecido cardíaco expresso em opsina22.
Montada no slide do microscópio com o lado dorsal para baixo na configuração do microscópio invertido, a larva/pupa foi iluminada por um feixe de luz LED direcionado para o segmento do corpo A7. Exemplos de imagens transversais do corpo são mostrados na Figura 5A e Figura 6A. O coração aparece como uma forma circular de contração e dilatação nas gravações de vídeo compostas por 4.000 quadros (vídeos complementares 1-6). Para imitar diferentes condições cardíacas, quatro tipos de pulsos de luz foram projetados. Um único pulso com duração de 10 s após 5 s tempo de espera gerou parada cardíaca restauradora induzida por eNpHR2.0, como mostrado na Figura 5B. Para o ritmo cardíaco em frequências mais lentas que a frequência cardíaca de repouso (RHR), mediada por eNpHR2.0, duas sequências de pulso de luz com frequências de ritmo iguais a RHR/2 e RHR/4 com duração de 8 s com tempo de espera de 6 s no meio foram usadas (Figura 5C). O ciclo de trabalho de cada sequência de pulso de luz foi de 90%. Este regime de estimulação leve causou uma doença cardíaca que lembra a bradicardia. O padrão de estimulação para aumentar a frequência cardíaca devido à ativação do ReaChR consistiu em três sequências de pulsos de luz em frequências de RHR + 0,5 Hz, RHR + 1 Hz, e RHR + 1,5 Hz, respectivamente, com uma largura de pulso de 20 ms (Figura 5D). Este regime de pulso visava causar um problema cardíaco taquicárdico. A densidade de energia da luz foi de 7,49 mW/mm2 durante todos os experimentos. Para experimentos de controle, nenhuma iluminação foi definida.
Cada variante experimental foi registrada cinco vezes. Vídeos de modo M do coração voador foram transformados em máscaras 2D usando FlyNet 2.027. Este software segmenta automaticamente a região cardíaca para produzir os conjuntos de dados de função cardíaca. O programa fornece uma máscara do coração em cada quadro, que pode ser corrigida manualmente, se necessário, para gerar quantificação precisa dos parâmetros funcionais do coração pulsante, como frequência cardíaca (RH), dimensão diastólica final (EDD) e dimensão sistólica final (ESD), encurtamento fracionado (FR), área diastólica final (EDA), área sistólica final (ESA), etc. A frequência cardíaca é medida analisando a área cardíaca ao longo do tempo. O vídeo de controle sem pulsos de luz é usado para estabelecer uma frequência cardíaca de linha de base (por exemplo, RHR) para cada animal.
A Figura 5B e a Figura 6B mostram 10 s de parada cardíaca longa causada pela ativação hand>eNpHR2.0 usando luz vermelha (617 nm) em larva e pupa, respectivamente. Quando a luz vermelha foi acesa, o coração da Drosophila parou de bater e permaneceu neste estado até o fim da iluminação da luz. A função do coração foi restaurada depois que a luz vermelha foi desligada. Os animais que não possuíam opsina expressa ("no opsin" controle) não responderam à iluminação da luz vermelha (Figura Suplementar 2A e Figura Suplementar 3A). Os experimentos de controle com animais hand>eNpHR2.0 onde a iluminação da luz vermelha de 10 s não foi ligada (controle "sem luz") mostraram o coração batendo normalmente (Figura Suplementar 4A e Figura Suplementar 4C).
Utilizando animais > DeseNpHR2.0 , foram aplicados pulsos de luz vermelha em frequências inferiores ao RHR. A frequência de contração cardíaca foi reduzida após os sinais de luz; esta frequência cardíaca mais lenta imita um tipo de arritmia cardíaca, bradicardia (Figura 5C e Figura 6C para larva e pupa, respectivamente). O ritmo cardíaco mais lento não foi observado em experimentos de controle "sem opsina" (Figura Suplementar 2B e Figura Suplementar 3B) e em experimentos de controle "sem luz" (Figura Suplementar 4A e Figura Suplementar 4C).
O aumento das frequências cardíacas pode ser alcançado ativando a opsina Hand>ReaChR com trens de pulso de luz vermelha em uma frequência maior do que o RHR do animal dado. Uma série de três trens de pulso leve em diferentes frequências de estimulação (por exemplo, RHR + 0,5 Hz, RHR + 1 Hz, RHR + 1,5 Hz) foram aplicados em larvas Hand>ReaChR e pupae hearts. Os dados obtidos mostram claramente aumento da frequência cardíaca após os pulsos de luz (Figura 5D e Figura 6D para larva e pupa, respectivamente). A condição cardíaca demonstrada nesses experimentos imita taquicardia. Os experimentos de controle negativos são mostrados na Figura Suplementar 2C, Figura Suplementar 3C e Figura Suplementar 4B,D.
No geral, os resultados demonstram a viabilidade do controle optogenético não invasivo e específico do ritmo cardíaco em vários estágios de desenvolvimento em modelos animais transgênicos de D. melanogaster.
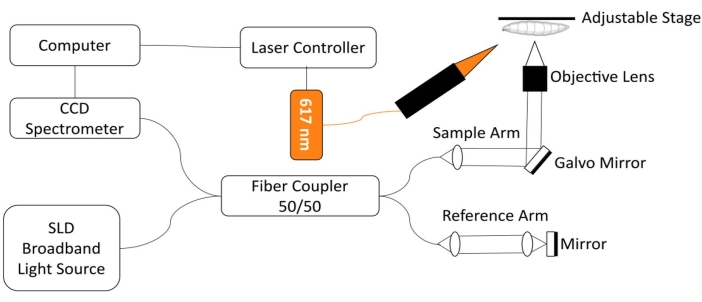
Figura 1: Sistema de imagem OCT integrado com módulo LED de 617 nm para controle optogenético da função cardíaca Drosophila . Clique aqui para ver uma versão maior desta figura.
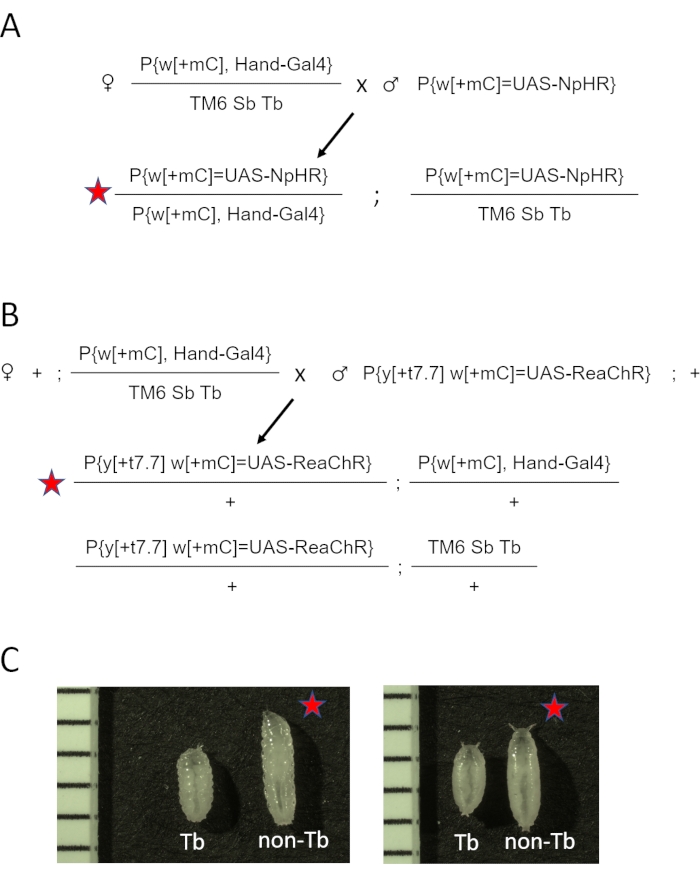
Figura 2: Gerando animais D. melanogaster expressando opsina no coração. (A) Diagrama transversal genético. As fêmeas Hand-GAL4/TM6 SbTb foram cruzadas para machos portadores de eNpHR2.0. A prole Hand-GAL4/eNpHR2.0 resultante (marcada pela estrela vermelha) foi coletada para imagem OCT, e a Tb-Mãe-GAL4/TM6 sb foi descartada com base em sua aparência fenotípica. (B) Diagrama cruzado genético. As fêmeas Hand-GAL4/TM6 SbTb foram cruzadas para machos portadores de ReaChR. A progêneria Hand-GAL4/ReaChR resultante (marcada pela estrela vermelha) foi coletada para imagem OCT, e a Tb-Sb Hand-GAL4/TM6 foi descartada com base em sua aparência fenotípica. (C) Diferenças fenotípicas entre a progêneria Hand-GAL4/opsin (estrela vermelha) e a progêneria de Tb Hand-GAL4/TM6. Os animais que carregam a mutação genética da Tuberculose no cromossomo TM6 têm uma forma corporal "tubby" em comparação com a larva normal, não-Tb ou pupa. O painel esquerdo mostra larvas; o painel direito mostra pupas precoces. As imagens também incluem uma régua com marcas de 1 mm. Clique aqui para ver uma versão maior desta figura.
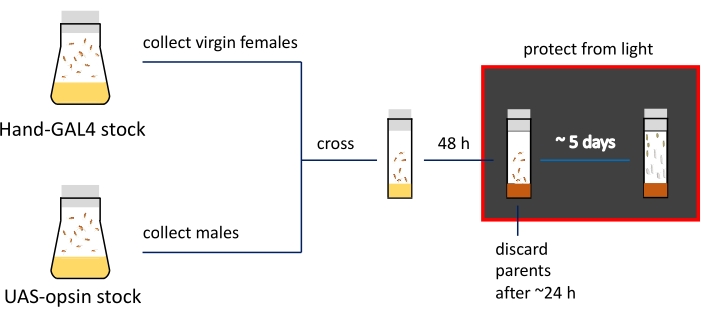
Figura 3: Apresentação esquemática e cronograma dos procedimentos de preparação de imagens. Os estoques dos pais são mantidos em garrafas de mosca; fêmeas virgens e machos são atravessados em frascos estreitos cheios de alimentos regulares (indicados pela cor amarela). Moscas que pousam ovos ativamente são transferidas para frascos de mídia contendo ATR (mostrados em marrom). Frascos com prole em desenvolvimento precisam ser mantidos no escuro a partir desta etapa. 3ª larva instar e pupa precoce são coletadas das paredes do frasco para imagem. Clique aqui para ver uma versão maior desta figura.
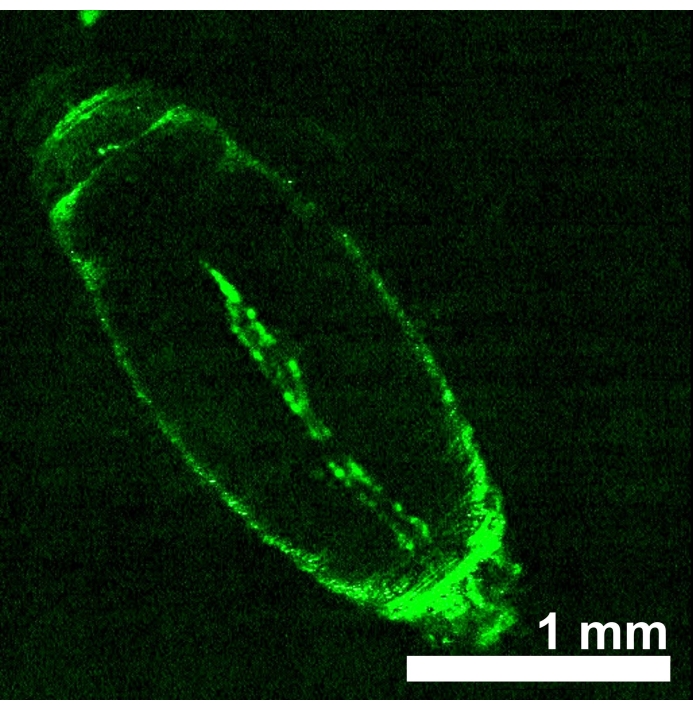
Figura 4: D. melanogaster pupa precoce expressando UAS-GFP (BDSC 6658) impulsionado por Hand-GAL4 (BDSC 48396). O padrão de fluorescência confirma a especificidade cardíaca do motorista Hand-GAL4 . Clique aqui para ver uma versão maior desta figura.
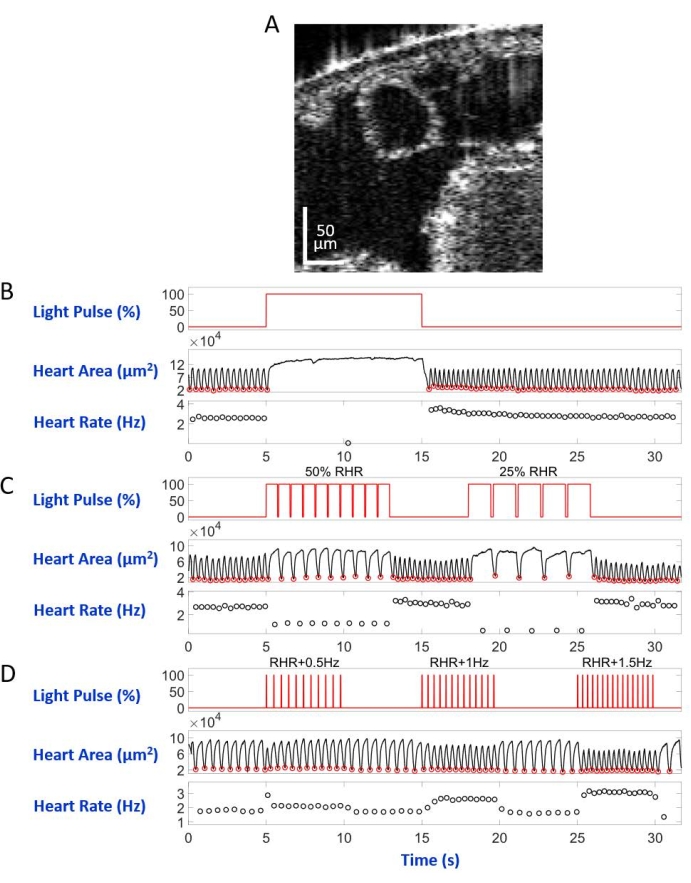
Figura 5: Simulação de parada cardíaca, bradicardia e taquicardia em D. melanogaster larva. (A) Imagem oct de uma seção transversal do corpo larval. O coração aparece como um círculo abaixo da superfície do corpo. (B) Apresentação gráfica da parada cardíaca restauradora. O painel superior mostra o tempo (eixo X) da iluminação da luz vermelha (eixo Y, porcentagem de nível de energia da fonte de luz). O painel do meio indica a mudança na área cardíaca (eixo Y, micrômetros quadrados) ao longo do tempo (eixo X). O painel inferior mostra a mudança da frequência cardíaca (eixo Y, hertz) ao longo do tempo (eixo X). (C) Apresentação gráfica da bradicardia restauradora mediada eNpHR2.0. O painel superior mostra pulsos da iluminação da luz vermelha, induzindo dois períodos de bradicardia: 50% do RHR e 25% do RHR. Alterações na área cardíaca e na frequência cardíaca são mostradas nos painéis médio e inferior, respectivamente. (D) Apresentação gráfica do ritmo cardíaco pelo ReaChR ativado. O painel superior mostra uma série de pulsos de luz vermelha de 20 ms ocorrendo nas frequências RHR + 0,5 Hz, RHR + 1 Hz e RHR + 1,5 Hz. As contrações cardíacas seguem as frequências de pulso de luz, como mostrado nos painéis médio e inferior. Clique aqui para ver uma versão maior desta figura.
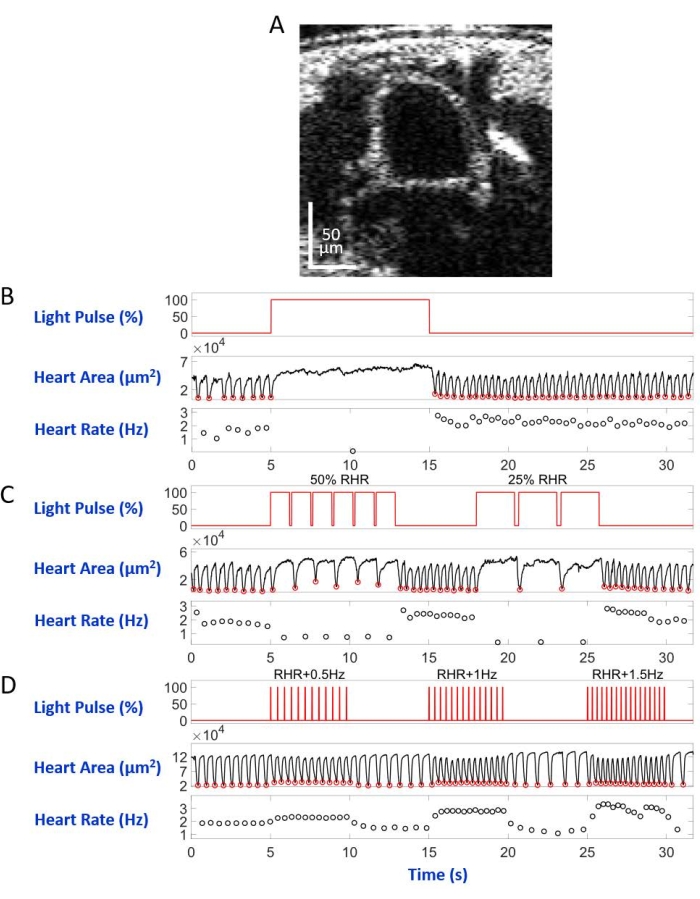
Figura 6: Simulação de parada cardíaca, bradicardia e taquicardia em D. melanogaster pupa. (A) IMAGEM OCT da seção transversal do corpo pupal. O coração aparece como um círculo abaixo da superfície do corpo. (B) Apresentação gráfica da parada cardíaca restauradora. O painel superior mostra o tempo (eixo X) da iluminação da luz vermelha (eixo Y, porcentagem de nível de energia da fonte de luz). O painel do meio indica a mudança na área cardíaca (eixo Y, micrômetros quadrados) ao longo do tempo (eixo X). O painel inferior mostra a mudança da frequência cardíaca (eixo Y, hertz) ao longo do tempo (eixo X). (C) Apresentação gráfica da bradicardia restauradora mediada eNpHR2.0. O painel superior mostra pulsos da iluminação da luz vermelha, induzindo dois períodos de bradicardia: 50% do RHR e 25% do RHR. Os painéis médio e inferior mostram mudanças na área cardíaca e na frequência cardíaca, respectivamente. (D) Apresentação gráfica do ritmo cardíaco pelo ReaChR ativado. O painel superior mostra uma série de pulsos de luz vermelha de 20 ms nas frequências RHR + 0,5 Hz, RHR + 1 Hz e RHR + 1,5 Hz. As contrações cardíacas seguem as frequências do pulso de luz, como mostrado nos painéis médio e inferior. Clique aqui para ver uma versão maior desta figura.
Figura suplementar 1: Cruzes genéticas para substituir cromossomo balanceador TM3 Sb por TM6 Sb Tb. Fêmeas virgens Hand-GAL4 w+/ TM3 Sb foram cruzadas com nub-GAL4NP3537 tub-GAL80ts w+/ TM6 Sb Tb masculinos. Foram selecionadas progêneres de Tb-M+/ TM6 A tb , incluindo fêmeas virgens e machos, foi selecionada (triagem para olhos pigmentados combinados com forma corporal tubby). As moscas selecionadas foram auto-cruzadas para estabelecer um estoque estável. Clique aqui para baixar este Arquivo.
Figura suplementar 2: Em experimentos de controle, o ritmo cardíaco da larva do tipo selvagem (wt) não muda após a iluminação da luz vermelha. (A) Nenhuma parada cardíaca foi observada durante a iluminação da luz vermelha na larva wt. O painel superior mostra as imagens cardíacas do modo M. A linha vermelha indica o tempo de iluminação. Os painéis médio e inferior mostram a área do coração e os batimentos cardíacos durante o tempo de imagem dos anos 32. (B,C) Pulsos de luz vermelha não alteram as frequências cardíacas em larva wt. Os painéis superiores mostram as imagens cardíacas do modo M. A linha vermelha indica o tempo de iluminação. Os painéis médio e inferior mostram a área do coração e os batimentos cardíacos durante o tempo de imagem dos anos 32. Clique aqui para baixar este Arquivo.
Figura suplementar 3: Em experimentos de controle, o ritmo cardíaco do tipo selvagem (wt) pupa não muda após a iluminação da luz vermelha. (A) Nenhuma parada cardíaca foi observada durante a iluminação da luz vermelha na larva wt. O painel superior mostra as imagens cardíacas do modo M. A linha vermelha indica o tempo de iluminação. Os painéis médio e inferior mostram a área do coração e os batimentos cardíacos durante o tempo de imagem dos anos 32. (B,C) Pulsos de luz vermelha não alteram os batimentos cardíacos na pupa wt. Os painéis superiores mostram as imagens cardíacas do modo M. A linha vermelha indica o tempo de iluminação. Os painéis médio e inferior mostram a área cardíaca e os batimentos cardíacos durante o tempo de imagem dos anos 32. Clique aqui para baixar este Arquivo.
Figura suplementar 4: Larvas de melanogaster d. d. melanogaster e pupae expressando Mão>eNpHR2.0 ou Mão>ReaChR não apresentam alterações significativas de RH durante a imagem oct sem iluminação de luz vermelha. (A) As frequências cardíacas da larva Hand>eNpHR2.0 . (B) As frequências cardíacas da larva Hand>ReaChR . (C) As frequências cardíacas de Hand>eNpHR2.0 pupa. (D) As frequências cardíacas de Hand>ReaChR pupa. Clique aqui para baixar este Arquivo.
Vídeo suplementar 1: Ativada eNpHR2.0 causa parada cardíaca em D. melanogaster larva. Clique aqui para baixar este vídeo.
Vídeo suplementar 2: Ativada eNpHR2.0 causa parada cardíaca em D. melanogaster pupa. Clique aqui para baixar este vídeo.
Vídeo suplementar 3: eNpHR2.0-mediado bradycardia restauradora em D. melanogaster larva. Clique aqui para baixar este vídeo.
Vídeo suplementar 4: eNpHR2.0-mediado bradycardia restauradora em D. melanogaster pupa. Clique aqui para baixar este vídeo.
Vídeo suplementar 5: Ritmo cardíaco ativado ReaChR em D. melanogaster larva. Clique aqui para baixar este vídeo.
Vídeo suplementar 6: Ritmo cardíaco ativado ReaChR em D. melanogaster pupa. Clique aqui para baixar este vídeo.
Discussão
Em comparação com nossos relatórios anteriores, onde a expressão das opsinas foi conduzida não apenas no coração, mas também nos tecidos musculares circundantes, o presente trabalho relata usando um motorista específico do coração, Hand-GAL4. Esta nova configuração genética de opsina > Hand usada para regulação cardíaca optogenética confirma ainda mais os resultados relatados anteriormente e estabelece um modelo melhor de pesquisa cardiovascular de Drosophila .
A preparação da mídia é essencial para o sucesso dos experimentos. As proteínas opsinas requerem um ligante, retinina totalmente trans (ATR), para funcionar28. As moscas não produzem ATR suficiente, então a ATR tem que ser complementada à mídia voadora. Neste estudo, o alimento instantâneo relatado anteriormente foi substituído por mídia semi-definida29. A nova receita de mídia contendo ATR foi introduzida para garantir uma distribuição uniforme de ATR. ATR não é solúvel em água; quando o estoque atr de 100 mM à base de etanol é adicionado à mídia à base de água, ele é dispersado por vórtices dos frascos que contêm mídia semi-definida quente. Além disso, a concentração de ATR relatada anteriormente foi reduzida de 10 mM para eNpHR2.0 e 3 mM para ReaChR22 para uma concentração final de 1 mM para ambos. Esta concentração é suficiente para garantir a função eNpHR2.0 adequada e ReaChR.
Um componente vital do sucesso experimental é o melhor processamento de dados com a FlyNet 2.027. O laboratório continuou a desenvolver este software para melhorar a eficiência computacional e a precisão do algoritmo automatizado de segmentação de coração de mosca. As máscaras transversais produzidas por este software são usadas para derivar dados fisiológicos de Drosophila , como encurtamento fracionado e velocidade da parede cardíaca. Essa abordagem permitiu uma análise eficiente de dados com supervisão humana mínima, tornando-a mais rápida e confiável para caracterizar a função cardíaca para grandes conjuntos de imagens cardíacas de mosca.
O infarto do miocárdio continua a ser a principal causa de morte, e a isquemia do miocárdio contribui para dois terços de todos os casos de insuficiência cardíaca, que está emergindo rapidamente entre as principais causas de mortalidade e morbidade nos Estados Unidos30. O desenvolvimento de novos dispositivos terapêuticos e médicos requer profundo conhecimento dos mecanismos de distúrbios cardíacos nos níveis fisiológico e bioquímico. Esses objetivos podem ser alcançados com a ajuda de organismos modelo. D. melanogaster estabeleceu-se como um dos modelos mais confiáveis e eficientes 31,32,33,34,35. Este trabalho gerou os modelos simulados de distúrbios cardíacos de Drosophila induzidos por uma abordagem optogenética não invasiva. O desenvolvimento de tecnologias de ritmo cardíaco óptico não invasivo fornece uma base para o desenvolvimento de uma alternativa aos dispositivos tradicionais de ritmo cardíaco elétrico. O uso do OCT para observar a função cardíaca em tempo real permite que estudos caracterizem com precisão a fisiologia cardíaca relevante em modelos de Drosophila para investigações avançadas, incluindo a triagem de candidatos a medicamentos. A imagem OCT tem uma profundidade de penetração de ~1 mm, que funciona bem para estudos cardíacos de Drosophila, mas limita seu uso para caracterizar a função cardíaca em modelos animais maiores. Além disso, traduzir diretamente a pesquisa de Drosophila para modelos de mamíferos representa um desafio. Novas ferramentas optogenéticas precisam ser desenvolvidas para melhorar a sensibilidade das opsinas e traduzi-las para vários sistemas de modelos, incluindo zebrafish, ratos, ratos e organoides cardíacos humanos, para pesquisas cardiovasculares.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores agradecem a Andrey Komarov, Yuxuan Wang e Jiantao Zhu por sua ajuda na análise de dados e agradecem aos membros do laboratório Zhou por suas valiosas discussões. O trabalho no laboratório do Dr. Zhou foi apoiado por um fundo inicial da Universidade de Washington em St. Louis, o National Institutes of Health (NIH) concede R01-EB025209 e R01-HL156265, e o Clayco Foundation Innovative Research Award.
Materiais
| Name | Company | Catalog Number | Comments |
| All-trans retinal | Cayman Chemicals | 18449 | |
| Bacto Peptone | Gibco | 02-10-2025 | |
| BioLED Light Source Control Module, 4-channel | Migtex Systems | BLS-SA04-US | Part of the optogenetic stimulation module |
| Broadband Light Source Module | Superlum | cBLMD-T-850-HP | Part of the SD-OCT imaging system |
| Cobra-S 800 OCT Spectrometers | Wasatch Photonics | CS800-840/180-80-OC2K-U3 | Part of the SD-OCT imaging system |
| Delicate Task Wipers | Kimberly-Clark Professtional | 34155 | tissues |
| Drosophila agar | Genesee Scientific | 66-103 | |
| Drosophila culture bottles | Genesee Scientific | 32-131 | |
| FlyNet 2.0 Software | Z-Lab | Custom software for fly heart segmentation and heart function analysis developed in the Zhou lab | |
| High-Power LED Collimator Sources | Migtex Systems | BLS-LCS-0617-03-22 | Part of the optogenetic stimulation module |
| Inactive dry yeast | Genesee Scientific | 62-106 | |
| Microscope slides | AmScope | BS-72P | |
| Narrow plugs for Drosophila culture | Genesee Scientific | 59-200 | |
| Narrow vials for Drosophila culture | Genesee Scientific | 32-116SB | |
| Permanent double-sided tape | Scotch | ||
| Plugs for Drosophila bottles | Genesee Scientific | 59-194 | |
| Propionic Acid | Sigma | P1386-1L | |
| SD-OCT control software | Z-Lab | Custom software for image acquisition and pacing control developed in the Zhou lab | |
| SD-OCT imaging and optogenetic pacing system | Z-Lab | Imaging and optogenetic pacing system developed in the Zhou lab (~$50k BOM) | |
| Sucrose | Carolina | 89-2871 | |
| w[*]; P{y[+t7.7] w[+mC]=UAS-eNpHR-YFP}attP2 | Bloomington Drosophila Stock Center (BDSC) | stock # 41752 | eNpHR2.0 transgenic line |
| w[*]; P{y[+t7.7] w[+mC]=UAS-ReaChR}su(Hw)attP5/CyO | Bloomington Drosophila Stock Center (BDSC) | stock # 53748 | ReaChR transgenic line |
| w[1118]; P{y[+t7.7] w[+mC]=GMR88D05-GAL4}attP2/TM3 Sb[1] | Bloomington Drosophila Stock Center (BDSC) | stock # 48396 | Heart specific GAL4 driver containing Hand gene regulatory fragment |
| y[*] w[*]; P{w[+mC]=UAS-2xEGFP}AH3 | Bloomington Drosophila Stock Center (BDSC) | stock #6658 | GFP reporter line |
| Yeast extract | Lab Scientific bioKEMIX | 978-907-4243 |
Referências
- Nature Methods. Method of the Year 2010. Nature Methods. 8, 1(2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8 (9), 1263-1268 (2005).
- Deisseroth, K. Optogenetics: 10 years of microbial opsins in neuroscience. Nature Neuroscience. 18 (9), 1213-1225 (2015).
- Tsai, H. -C. Phasic firing in dopaminergic neurons is sufficient for behavioral conditioning. Science. 324 (5930), 1080-1084 (2009).
- Wykes, R. C., et al. Optogenetic and potassium channel gene therapy in a rodent model of focal neocortical epilepsy. Science Translational Medicine. 4 (161), (2012).
- Entcheva, E., Kay, M. W. Cardiac optogenetics: a decade of enlightenment. Nature Reviews Cardiology. 18 (5), 349-367 (2021).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7 (11), 897-900 (2010).
- Arrenberg, A. B., Stainier, D. Y. R., Baier, H., Huisken, J. Optogenetic control of cardiac function. Science. 330 (6006), 971-974 (2010).
- Nussinovitch, U., Gepstein, L. Optogenetics for in vivo cardiac pacing and resynchronization therapies. Nature Biotechnology. 33 (7), 750-754 (2015).
- Nyns, E. C. A., et al. An automated hybrid bioelectronic system for autogenous restoration of sinus rhythm in atrial fibrillation. Science Translational Medicine. 11 (481), (2019).
- Bier, E., Bodmer, R. Drosophila, an emerging model for cardiac disease. Gene. 342 (1), 1-11 (2004).
- Wolf, M. J., Amrein, H., Izatt, J. A., Choma, M. A., Reedy, M. C., Rockman, H. A. Drosophila as a model for the identification of genes causing adult human heart disease. Proceedings of the National Academy of Sciences of the United States of America. 103 (5), 1394-1399 (2006).
- Yu, L., Lee, T., Lin, N., Wolf, M. J. Affecting rhomboid-3 function causes a dilated heart in adult Drosophila. PLOS Genetics. 6 (5), 1000969(2010).
- Cooper, A. S., Rymond, K. E., Ward, M. A., Bocook, E. L., Cooper, R. L. Monitoring heart function in larval Drosophila melanogaster for physiological studies. Journal of Visualized Experiments. (33), e1596(2009).
- Zhu, Y. C., Yocom, E., Sifers, J., Uradu, H., Cooper, R. L. Modulatory effects on Drosophila larva hearts: Room temperature, acute and chronic cold stress. Journal of Comparative Physiology. B, Biochemical, Systemic, and Environmental Physiology. 186 (7), 829-841 (2016).
- Zhu, Y. C., Uradu, H., Majeed, Z. R., Cooper, R. L. Optogenetic stimulation of Drosophila heart rate at different temperatures and Ca2+ concentrations. Physiological Reports. 4 (3), 12695(2016).
- Malloy, C., et al. Using optogenetics to assess neuroendocrine modulation of heart rate in Drosophila melanogaster larvae. Journal of Comparative Physiology. A, Neuroethology, Sensory, Neural, and Behavioral Physiology. 203 (10), 791-806 (2017).
- Men, J., et al. Drosophila preparation and longitudinal imaging of heart function in vivo using optical coherence microscopy (OCM). Journal of Visualized Experiments. (118), e55002(2016).
- Choma, M. A., Izatt, S. D., Wessells, R. J., Bodmer, R., Izatt, J. A. In vivo imaging of the adult Drosophila melanogaster heart with real-time optical coherence tomography. Circulation. 114 (2), 35-36 (2006).
- Li, A., et al. Changes in the expression of the Alzheimer's disease-associated presenilin gene in drosophila heart leads to cardiac dysfunction. Current Alzheimer Research. 8 (3), 313-322 (2011).
- Li, A., et al. Silencing of the Drosophila ortholog of SOX5 in heart leads to cardiac dysfunction as detected by optical coherence tomography. Human Molecular Genetics. 22 (18), 3798-3806 (2013).
- Men, J., Li, A., Jerwick, J., Li, Z., Tanzi, R. E., Zhou, C. Non-invasive red-light optogenetic control of Drosophila cardiac function. Communications Biology. 3 (1), 1-10 (2020).
- Alex, A., Li, A., Tanzi, R. E., Zhou, C. Optogenetic pacing in Drosophila melanogaster. Science Advances. 1 (9), 1500639(2015).
- Stanley, C. E., Mauss, A. S., Borst, A., Cooper, R. L. The effects of chloride flux on Drosophila heart rate. Methods and Protocols. 2 (3), 73(2019).
- Lindsley, D. L., Zimm, G. G. The Genome of Drosophila melanogaster. , Elsevier. (1992).
- Bloomington Drosophila Stock Center. , Available from: https://bdsc.indiana.edu/information/recipes/germanfood.html (2022).
- Dong, Z., et al. FlyNet 2.0: Drosophila heart 3D (2D + time) segmentation in optical coherence microscopy images using a convolutional long short-term memory neural network. Biomedical Optics Express. 11 (3), 1568-1579 (2020).
- Deisseroth, K. Optogenetics. Nature Methods. 8 (1), 26-29 (2011).
- Backhaus, B., Sulkowski, E., Schlote, F. W. A semi-synthetic, general-purpose medium for Drosophila melanogaster. Drosophila Information Service. 60, 210-212 (1984).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2019 update: A report from the American Heart Association. Circulation. 139 (10), 56(2019).
- Wolf, M. J., Rockman, H. A. Drosophila, genetic screens, and cardiac function. Circulation Research. 109 (7), 794-806 (2011).
- Choma, M. A., Suter, M. J., Vakoc, B. J., Bouma, B. E., Tearney, G. J. Physiological homology between Drosophila melanogaster and vertebrate cardiovascular systems. Disease Models & Mechanisms. 4 (3), 411-420 (2011).
- Ocorr, K., Vogler, G., Bodmer, R. Methods to assess Drosophila heart development, function and aging. Methods [Supplement to Methods in Enzymology]. 68 (1), 265-272 (2014).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Disease Models & Mechanisms. 9 (3), 235-244 (2016).
- Rotstein, B., Paululat, A. On the morphology of the Drosophila heart. Journal of Cardiovascular Development and Disease. 3 (2), 15(2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados