É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Tomografia por Emissão de Pósitrons Cardíacos de Alta Resolução/Tomografia Computadorizada para Animais de Pequeno Porte
Neste Artigo
Resumo
Aqui, apresentamos um protocolo de imagem experimental para a quantificação da função cardíaca e morfologia utilizando tomografia por emissão de pósitrons de alta resolução/tomografia computadorizada para animais de pequeno porte. Tanto camundongos quanto ratos são considerados, discutindo os diferentes requisitos de agentes de contraste da tomografia computadorizada para as duas espécies.
Resumo
A tomografia por emissão de pósitrons (PET) e a tomografia computadorizada (TC) estão entre as técnicas de diagnóstico por imagem mais empregadas, e ambas servem na compreensão da função cardíaca e do metabolismo. Na pesquisa pré-clínica, são empregados scanners dedicados com alta sensibilidade e alta resolução espaço-temporal, projetados para lidar com os exigentes requisitos tecnológicos impostos pelo pequeno tamanho do coração e taxas cardíacas muito altas de camundongos e ratos. Neste trabalho, um protocolo bimodal de imagem PET/CT cardíaca para modelos experimentais de doenças cardíacas em camundongos e/ou ratos é descrito, desde o preparo animal e aquisição e reconstrução de imagens até o processamento e visualização de imagens.
Em particular, o examede 18 fluordesoxiglicose marcada com F ([18F]FDG)-PET permite a medição e visualização do metabolismo da glicose nos diferentes segmentos do ventrículo esquerdo (VE). Os mapas polares são ferramentas convenientes para exibir essas informações. A parte de TC consiste em uma reconstrução 3D com resolução temporal de todo o coração (TC-4D) por meio de gating retrospectivo sem eletrocardiografia (ECG), permitindo a avaliação morfofuncional do VE e a posterior quantificação dos parâmetros mais importantes da função cardíaca, como fração de ejeção (FE) e volume sistólico (SV). Usando um scanner PET/CT integrado, este protocolo pode ser executado dentro da mesma indução anestésica sem a necessidade de reposicionar o animal entre diferentes scanners. Assim, a PET/CT pode ser vista como uma ferramenta abrangente para a avaliação morfofuncional e metabólica do coração em vários modelos animais de pequeno porte de doenças cardíacas.
Introdução
Modelos de pequenos animais são de extrema importância para o avanço da compreensão das doenças cardiovasculares 1,2. As ferramentas de diagnóstico por imagem não invasivas revolucionaram a maneira como olhamos para a função cardíaca nas últimas décadas, tanto em ambientes clínicos quanto pré-clínicos. No que diz respeito a pequenos modelos animais de doenças cardíacas, ferramentas de imagem específicas foram desenvolvidas com resolução espaço-temporal muito alta. Assim, tais instrumentos podem corresponder à necessidade de quantificação precisa dos parâmetros metabólicos e cinéticos miocárdicos relevantes nos corações muito pequenos e muito rápidos de camundongos e ratos em modelos específicos de doenças, como insuficiência cardíaca (IC)3 ou infarto do miocárdio (IM)4. Várias modalidades estão disponíveis para este fim, cada uma com seus próprios pontos fortes e fracos. A ultrassonografia (US) é a modalidade mais utilizada devido à sua grande flexibilidade, resolução temporal muito alta e custo relativamente baixo. A adoção da US de imagem cardíaca em animais de pequeno porte aumentou consideravelmente desde o advento de sistemas que utilizam sondas com frequência ultra-alta5,6, com resoluções espaciais abaixo de 50 μm.
Entre as principais desvantagens da US para imagens cardíacas totalmente 3D está a necessidade de varreduras lineares ao longo do eixo cardíaco, montando a sonda em um estágio de tradução motorizada para criar uma pilha completa de imagens dinâmicas de modo B de todo o coração7. Eventualmente, este procedimento dá origem (após um registro espacial e temporal preciso das imagens adquiridas em cada posição de sonda) a uma imagem 4D com diferentes resoluções espaciais entre as direções no plano e fora do plano. O mesmo problema de resolução espacial não uniforme ocorre na RM cardíaca (RMC),8 que ainda representa o padrão-ouro na imagem funcional do coração. A imagem 3D isotrópica real pode ser obtida por meio da tomografia computadorizada (TC) e da tomografia por emissão de pósitrons (PET)9. O PET fornece uma ferramenta muito sensível em termos de sinal de imagem por quantidade de sonda injetada (na faixa nanomolar), embora sofra de uma resolução espacial reduzida em comparação com a TC, RM ou US. A principal vantagem da PET é a sua capacidade de exibir os mecanismos celulares e moleculares subjacentes à fisiopatologia do órgão. Por exemplo, uma tomografia por emissão de pósitrons (PET) após a injeção de [18F]FDG permite a reconstrução de um mapa 3D do metabolismo da glicose no corpo. Ao combinar isso com a aquisição de dados dinâmicos (ou seja, resolvidos no tempo), a modelagem cinética traçadora pode ser utilizada para calcular mapas paramétricos das taxas metabólicas de captação de glicose (MRGlu), o que fornecerá informações importantes sobre a viabilidade miocárdica10.
A TC requer volumes significativos de agentes de contraste externos (AC) em altas concentrações (até 400 mg de iodo por mL) para fornecer um aprimoramento mensurável dos componentes teciduais relevantes (por exemplo, sangue versus músculo), mas se destaca na resolução espacial e temporal, especialmente ao usar scanners de micro-TC de última geração projetados para imagens de pequenos animais. 11 Um modelo típico de doença no qual a PET/TC cardíaca pode ser aplicada é a avaliação experimental do infarto do miocárdio e da insuficiência cardíaca e a resposta relacionada à terapia. Uma forma comum de induzir o IAM em animais de pequeno porte é por ligadura cirúrgica da artéria coronária descendente anterior esquerda (DAE)12,13 e, em seguida, avaliando-se longitudinalmente a progressão da doença e o remodelamento cardíaco nos dias subsequentes4. No entanto, a avaliação morfofuncional quantitativa do coração em pequenos animais é amplamente aplicável também para outros modelos de doenças, como a avaliação do efeito do envelhecimento sobre a função cardíaca14 ou a expressão alterada do receptor em modelos de obesidade15. O protocolo de imagem apresentado não se restringe a nenhum modelo de doença e, portanto, pode ser de maior interesse em diversos contextos de pesquisa pré-clínica com pequenos roedores.
Neste trabalho, apresentamos um protocolo experimental de início a fim para imagens cardíacas utilizando PET/CT integrado a pequenos animais. Embora o protocolo apresentado seja projetado para um scanner integrado bimodal específico, as partes PET e CT do procedimento descrito podem ser realizadas de forma independente em scanners separados de diferentes fabricantes. No scanner PET/CT em uso, a sequência de operações é organizada em um fluxo de trabalho pré-programado. As principais ramificações de cada fluxo de trabalho são um ou mais protocolos de aquisição; cada protocolo de aquisição pode ter uma ou mais ramificações para protocolos de pré-processamento específicos e, por sua vez, cada protocolo de pré-processamento pode ter uma ou mais ramificações para protocolos de reconstrução específicos. Tanto a preparação do animal no leito de imagem quanto a preparação dos agentes externos a serem injetados durante os procedimentos de imagem são descritas. Após a conclusão do procedimento de aquisição de imagens, são fornecidos procedimentos de exemplo para análise quantitativa de imagens com base em ferramentas de software comumente disponíveis. O protocolo principal é projetado especificamente para modelos de mouse; embora o camundongo continue sendo a espécie mais utilizada neste campo, também mostramos uma adaptação do protocolo para imagens de ratos ao final do protocolo principal. Resultados representativos são mostrados para camundongos e ratos, demonstrando o tipo de saída que pode ser esperada com os procedimentos descritos. Uma discussão aprofundada é feita no final deste artigo para enfatizar os prós e contras da técnica, pontos críticos, bem como como diferentes radiotraçadores PET poderiam ser usados com quase nenhuma modificação nas etapas preparatórias e de aquisição/reconstrução.
Access restricted. Please log in or start a trial to view this content.
Protocolo
As experiências com animais foram realizadas de acordo com as recomendações do Guia para o Cuidado e Uso de Animais de Laboratório das Diretrizes Internacionais sobre Manuseio de Animais de Laboratório, exigidas pela Diretiva Europeia (Diretiva 86/609/CEE de 1986 e Diretiva 2010/63/UE) e leis italianas (D.Lgs. 26/2014).
1. Configuração dos protocolos de imagem PET/CT e fluxo de trabalho
NOTA: O protocolo aqui apresentado destina-se especificamente a imagens cardíacas de modelos de ratinhos. Trabalhar com ratos pode implicar algumas modificações no protocolo real, principalmente por causa do tamanho maior do animal (cerca de 10x mais pesado). As modificações para a imagem de ratos são especificamente mencionadas nas etapas; se nenhuma modificação for mencionada, as mesmas etapas para imagens de camundongos podem ser usadas para ratos.
- Abra a interface gráfica do usuário (GUI) do scanner PET/CT (consulte Tabela de Materiais) e criar um conjunto de novos protocolos (incluindo parâmetros para aquisição de dados, pré-processamento e reconstrução de imagens): (i) a PET scan dinâmico, ii) a tomografia computadorizada (TC) de baixa dose para correção de atenuação (O CTAC) sem contraste e (iii) a cinco-tomografia computadorizada com contraste.
NOTA: A criação de novos protocolos (ou seja, instruções de software específicas para o tomógrafo) para as fases de aquisição, pré-processamento e reconstrução é um processo simples; em caso de problema, o usuário pode encontrar informações mais detalhadas no manual do usuário da GUI.- Para a PET scan, abra a guia Protocolo do scanner (GUI) e crie três novos protocolos (para aquisição, pré-processamento e reconstrução) com os seguintes parâmetros:
- Para o protocolo de aquisição : definir 3.600 s de tempo total de varredura e posição da cama de solteiro. Salve esse protocolo com um nome apropriado para importação subsequente no fluxo de trabalho. Faça o mesmo também para todos os próximos protocolos nos pontos a seguir.
- Para o protocolo de pré-processamento para mouse: selecione uma janela de energia (EW) de 250-750 keV e habilite as seguintes correções: decaimento radioativo, coincidências aleatórias e tempo morto. Defina o protocolo de enquadramento (ou seja, divisão dinâmica dos dados brutos) da seguinte forma: 8 x 5 s, 8 x 10 s, 3 x 40 s, 2 x 60 s, 2 x 120 s, 10 x 300 s (= 3.600 s). Para ratos, selecione uma janela de energia (EW) de 350-750 keV, usando o mesmo enquadramento que para o protocolo de rato.
- Para o protocolo de reconstrução: selecione o algoritmo de Maximização de Expectativa de Subconjunto Ordenado 3D (3D-OSEM-MC) de alta qualidade, baseado em Monte Carlo, com 8 subconjuntos e 8 iterações, com normalização, correção quantitativa e correção de atenuação de TC habilitada.
- Para a tomografia computadorizada de baixa dose para correção de atenuação (CTAC), use os seguintes parâmetros:
- Para o protocolo de aquisição : quadro único, posição do leito individual, varredura completa; configurações do tubo: 80 kV, baixa corrente (baixa dose); 576 visualizações em 360°, com 34 ms de tempo de exposição por visão (tempo de varredura de 20 s); tipo de rotação: contínuo, modo de sensibilidade: alta sensibilidade.
- Para o protocolo de pré-processamento: tamanho de voxel de 240 μm, FOV transversal: Rato, FOV axial: 100%.
- Para o protocolo de reconstrução : janela de filtro: liso, tamanho do voxel: padrão , ativar o endurecimento do feixe e a pré-correção do anel, desativar a correção do pós-correção do artefato do anel.
- Para a tomografia computadorizada controlada com contraste, crie três novos protocolos (para aquisição, pré-processamento e reconstrução) com as seguintes configurações:
- Para o protocolo de aquisição para mouse: definir quadro único, posição da cama de solteiro, varredura completa; configurações do tubo: 65 kV, corrente total (baixo ruído); 8.000 visualizações em 360°, com 15 ms de tempo de exposição por visualização (tempo de varredura de 120 s); tipo de rotação: contínuo, modo de sensibilidade: alta sensibilidade. Para ratos, defina os parâmetros do protocolo de aquisição da seguinte forma: tensão do tubo de 80 kV, 16.000 visualizações em 360°, com tempo de exposição de 12 ms por visualização (tempo de varredura de 192 s).
- Para o protocolo de pré-processamento para mouse: selecione 120 μm de tamanho de voxel; Campo de visão transversal (FOV): Mouse; FOV axial: 50%. Para ratos, selecione um tamanho de voxel de 240 μm; Campo de visão transversal (FOV): Rato; FOV axial: 50%.
- Para o protocolo de reconstrução: janelas de filtro: liso, tamanho do voxel: padrão; ativar o endurecimento do feixe e a pré-correção do anel, desativar a correção do poste do artefato do anel.
- Abra a guia Fluxo de trabalho na GUI e crie um novo fluxo de trabalho , adicionando os protocolos recém-criados: etapas 1.1.1.1-1.1.1.3 para PET, etapas 1.1.2.1. -1.1.2.3. para CTAC e etapas 1.1.3.1. -1.1.3.3. para TC fechado, na ordem dada. Em ambos os casos, certifique-se de que os protocolos estão aninhados com a seguinte ordem: Aquisição | Pré-processamento | Reconstrução.
NOTA: Quadros dinâmicos de PET com durações <5 s para melhor capturar o pico da função de entrada arterial no início da PET scan são possíveis, mas não são recomendados, pois isso pode levar a imagens barulhentas com precisão quantitativa reduzida. Na etapa 1.1.2.2, utilizamos o tamanho "Rato" para o FOV transversal. Isso é comumente usado para ratos e camundongos no CTAC.
- Para a PET scan, abra a guia Protocolo do scanner (GUI) e crie três novos protocolos (para aquisição, pré-processamento e reconstrução) com os seguintes parâmetros:
2. Preparação animal para imagens PET/CT
NOTA: Para o presente protocolo, todos os animais foram mantidos em jejum durante a noite.
- Anestesiar o camundongo com isoflurano de 3%-4% (v/v) em uma câmara de indução inicialmente e, em seguida, manter com isoflurano a 1%-2% (v/v).
- Pesar o rato e medir a glicemia basal para monitorizar o estado do animal. Para tirar a amostra de sangue necessária, use uma tesoura afiada e faça um pequeno corte na ponta da cauda, em seguida, massageie suavemente a cauda para coletar uma gota de sangue (~ 1 μL) diretamente na tira de teste.
- Proceder à inserção de um acesso venoso ao nível da veia caudal utilizando uma borboleta 29 G para ratinho e 24 G para rato.
- Para realizar a técnica de canulação, use aquecimento simultâneo (normalmente, sob uma lâmpada de aquecimento) e desinfecção do ponto onde a agulha é inserida para vasodilatação da veia. Após a canulação, fixe a borboleta com uma fita de seda na cauda para mantê-la no lugar durante o procedimento.
NOTA: O jejum é necessário para estudos [18F]FDG. Diferentes marcadores podem envolver diferentes preparações animais, mas uma discussão aprofundada sobre este tópico está fora do escopo do presente protocolo. No que diz respeito ao [18F]FDG, evitar o jejum leva a uma biodistribuição de traçadores muito diferente16.
- Para realizar a técnica de canulação, use aquecimento simultâneo (normalmente, sob uma lâmpada de aquecimento) e desinfecção do ponto onde a agulha é inserida para vasodilatação da veia. Após a canulação, fixe a borboleta com uma fita de seda na cauda para mantê-la no lugar durante o procedimento.
- Ligue o sistema de anestesia (isoflurano 1%-2%, 0,8 L/min O 2 para rato e 1-1,2 L/min para rato) ligado ao scanner PET-CT e transfira o rato para a cama.
- Coloque o rato na posição supina, de cabeça em primeiro lugar, no leito do scanner do tomógrafo PET-CT, colocando o nariz na máscara do nariz para anestesia e bloqueando suavemente a cabeça do rato à máscara com fita adesiva.
- Fixe os membros superiores e inferiores do rato no leito do scanner para evitar quaisquer movimentos involuntários durante os procedimentos de imagem, o que pode levar a artefatos de movimento.
- Monitore a temperatura corporal e a taxa de respiração usando uma sonda retal e um travesseiro de respiração, respectivamente.
3. Preparação da dose do traçador PET
- Para camundongos, retire 10 MBq de [18F]FDG em um volume de 100-150 μL com uma seringa de insulina (1 mL). Para ratos, obtenha uma dose mais elevada de 15 MBq em 0,20-0,25 ml.
NOTA: Evite uma atividade mais alta, pois o scanner PET discutido neste protocolo tem sensibilidade muito alta e requer apenas uma quantidade modesta de atividade para obter imagens de alta qualidade. - Se a concentração original do marcador no frasco para injetáveis for demasiado elevada, utilize solução fisiológica (0,9% p/v NaCl) para diluir a dose do marcador para uma concentração de 50-100 MBq/ml.
- Use o calibrador de dose PET para medir a atividade real na seringa. Anote a atividade de pré-injeção e o tempo de medição, pois esses valores serão usados posteriormente usando módulos de entrada específicos da GUI do scanner PET.
4. Preparação do agente de contraste por TC
- Retirar 0,2 ml por 20 g de peso de rato de agente de contraste em emulsão lipídica iodada para uma seringa de 1 ml. Limitar o volume de injeção a 0,5 ml de AC para ratinhos mais pesados. Se estiver a utilizar iomeprol, defina a taxa de injeção para ratinhos para 10 ml/h (~0,17 ml/min) e limite o volume de injeção a 0,5 ml.
- Para ratos, retire 2,3-3 ml de iomeprol, diluído a uma concentração de 200 mg/ml, numa seringa de 5 ml.
NOTA: Se a emulsão lipídica de pequenos animais CA não estiver disponível, o iomeprol com injeção contínua por meio de uma bomba de seringa pode ser usado, conforme discutido abaixo. - Ligue a seringa à bomba da seringa e ajuste a bomba para o tamanho e diâmetro reais da seringa.
- Ligue a seringa ao tubo e à agulha da AC e encha previamente a tubagem com a AC.
- Defina a taxa de injeção para 24 ml/h (= 0,4 ml/min), limitando a injeção a um volume máximo de 2 ml.
NOTA: O uso de CA de pool sanguíneo à base de emulsão lipídica iodada também é possível em ratos, apesar do custo relativamente alto deste procedimento devido ao maior volume de uma única injeção. Se essa opção for preferida (por exemplo, para simplificar o protocolo evitando a bomba de seringa), o seguinte procedimento pode ser empregado:
- Para ratos, retire 2,3-3 ml de iomeprol, diluído a uma concentração de 200 mg/ml, numa seringa de 5 ml.
- Retirar 7,5 ml por kg de peso corporal de agente de contraste em emulsão lipídica iodada numa seringa de 5 ml. Limite o volume de injeção a 2 mL de CA também para ratos mais pesados.
5. Alinhamento dos animais e operações preliminares antes da obtenção de imagens
- Após a imobilização do animal no leito de imagem, crie um novo estudo sobre a GUI do tomógrafo. Adicione um identificador de nome de estudo no módulo Nome do estudo e selecione o fluxo de trabalho de imagem salvo anteriormente no menu suspenso.
- Selecione a parte anatômica adequada com informações sobre Animais/Espécimes | Parte anatômica | Posicionamento cardíaco e animal por informações sobre animais/espécimes | Posicionamento | Supina/Cabeça primeiro. Anote o peso do animal em gramas para o módulo correspondente: Informações sobre animais/espécimes | Peso animal.
NOTA: Todas as outras informações nesta seção são opcionais, mas é útil fornecer o máximo possível das informações solicitadas para encontrá-las no cabeçalho DICOM das imagens de reconstrução, facilitando assim a consulta de dados subsequente. - Selecione o radionuclídeo nas informações do PET Scan | F18 para estudos de [18 F]FDG e outros 18compostos marcados com F; modificar se outros rastreadores (por exemplo, [13N]NH3) forem usados. Escreva também o nome do marcador nas informações do PET Scan | Módulo de nome do rastreador como este nome será relatado no cabeçalho DICOM após a conclusão da reconstrução da imagem.
NOTA: As informações sobre o tempo, a atividade e o volume da injeção do traçador são obrigatórias, mas podem ser fornecidas posteriormente durante a aquisição do PET. - Nas informações da tomografia computadorizada, escreva todas as informações disponíveis sobre o agente de contraste.
Observação : todas essas informações são opcionais, mas podem facilitar a consulta de dados subsequente, se fornecidas. - Pressione Executar varredura e aguarde que outra aba da GUI seja aberta, permitindo o posicionamento do animal e a especificação de outras opções de digitalização.
- Selecione o tipo de calibração de TC em calibração de TC | Use a calibração de TC padrão.
- Na seção Preparação do estudo , selecione cada protocolo de varredura no menu suspenso e marque a caixa de seleção Aguarde a confirmação do usuário antes dessa verificação .
NOTA: Esta etapa é muito importante, pois colocará o scanner em espera aguardando a entrada do usuário antes de iniciar a fase de aquisição correspondente. Para a varredura PET, isso permitirá a sincronização da injeção do traçador e o início real da varredura PET; para a tomografia computadorizada, permitirá que o usuário feche a tampa (blindagem) antes da emissão de raios-X durante a tomografia computadorizada (o estudo será abortado automaticamente se a tampa estiver aberta antes do início da tomografia computadorizada); para a varredura Cine-CT, essa pausa permitirá que o usuário inicie o protocolo de infusão de CA e a tomografia computadorizada com o atraso necessário. - Para o posicionamento de animais, ligue o módulo de controle do motor usando o interruptor no painel esquerdo da GUI.
NOTA: Isso ativará os lasers de centralização na cama do animal e ativará os botões de alinhamento manual da cama colocados na lateral do scanner. - Use os botões de alinhamento manual da cama para mover o peito do animal para as marcas a laser. Verifique cuidadosamente o alinhamento longitudinal e vertical do animal.
- Uma vez que o animal é colocado na posição correta de acordo com o laser de centralização, pressione Desligar o laser para salvar a posição atual marcada a laser, que deve ser movida para o centro dos scanners PET e CT durante as fases de aquisição correspondentes. Depois, desligue o módulo de controle do motor.
6. Tomografia por emissão de pósitrons (PET)
- Pressione Iniciar aquisição para mover o animal para o scanner PET FOV. A cauda e a cânula permanecerão fora do FOV para permitir a injeção do traçador. O scanner permanecerá ocioso até que o usuário pressione o botão Continuar .
- Prepare a seringa com a dose calibrada do marcador PET.
- Inicie a aquisição pressionando o botão Continue e comece a injetar o marcador na cânula dentro de 5 s a partir do início da digitalização (Figura 1).
NOTA: A duração da injeção será de ~20-25 s. - Coloque a seringa no calibrador de dose PET para medir a atividade residual na seringa. Anote a atividade real e o tempo de medição.
- Na guia Monitor de hardware da GUI do scanner, use o botão Atualizar informações do traçador PET para inserir o tempo, a atividade e o volume injetados reais.
- Durante a varredura, verifique os parâmetros fisiológicos do animal periodicamente.
- Durante o exame, meça a glicemia conforme explicado na etapa 2.2 nos seguintes momentos: 5 min, 20 min, 40 min e 60 min após o início do PET scan.
- Após a medição da glicemia, coloque a tira de teste no contador gama e realize a medição da atividade por 60 s. Registre o tempo real em que a medição da atividade foi realizada e corrija o decaimento radioativo, tomando o tempo de injeção do traçador como um tempo de referência. Converta os valores de atividade registrados em concentração de atividade (Bq/mL) considerando um volume sanguíneo médio de 1 μL na tira de teste de glicose (ou seja, usando a equação [1]):
C sangue(t) = Asangue(t)/0,001 mL [Bq/mL] (1)
em que A(t) de sangue é a actividade medida corrigida pelo decaimento da amostra de sangue na tirade ensaio, expressa em Bq.
NOTA: O início da tomografia computadorizada e a injeção do traçador podem ser realizados pelo mesmo operador usando o dispositivo de controle móvel do tomógrafo colocado na mesa lateral do scanner perto do local do operador durante a injeção. Atrasos mais longos entre o início da varredura e o início da injeção são permitidos, mas alguns quadros reconstruídos no início da sequência dinâmica permanecerão em branco. Recomenda-se evitar atrasos maiores que 10 s (ou seja, levando a dois quadros em branco com o protocolo atual).

Figura 1: Injeção do traçador PET. Esta operação é realizada logo após o início da PET Scan. O animal está dentro do campo de visão do PET (cabeça primeiro, com a cauda visível no lado do operador). Abreviação: PET = tomografia por emissão de pósitrons. Por favor, clique aqui para ver uma versão maior desta figura.
7. Tomografia computadorizada
- Antes de injetar o agente de contraste CT, inicie a varredura CTAC logo após fechar a tampa do scanner e pressionar o botão Continuar na GUI. No final desta aquisição muito curta, empregue os seguintes procedimentos para garantir o aumento adequado do pool sanguíneo, injetando o CA antes da aquisição usando o mesmo acesso vascular empregado para a injeção do marcador PET.
- Emulsão lipídica iodada CA:
- Após a conclusão da varredura CTAC, injete a emulsão lipídica iodada CA usando a cânula já conectada à veia da cauda do rato. A duração típica da injeção é da ordem de 30-60 s.
- Inicie a imagem logo após a conclusão da injeção. Pressione Continue na GUI do scanner para iniciar a aquisição do Cine-CT.
- Bomba de iomeprol/seringa:
- Se uma CA de raios-X normal for usada, como o iomeprol, use uma bomba de seringa que permita a injeção lenta a uma taxa constante.
- Para camundongos, defina a taxa de injeção do CA para 10 mL/h (~ 0,17 mL/ min) limitando o volume de injeção a 0,5 mL. Com esta configuração, pare a injeção após ~ 3 min. Para ratos, ajuste a bomba para uma taxa de 24 mL/h (= 0,4 mL/min) e limite o volume de injeção a 2 mL. Com esta configuração, pare a injeção após 5 minutos.
- Conecte a agulha presa à tubulação CA à cânula da veia da cauda, garantindo que tanto a tubulação quanto a agulha sejam pré-preenchidas com CA.
- Inicie a injeção. Feche a tampa do scanner e prepare-se para a varredura Cine-CT.
- Pressione o botão Continuar na GUI do tomógrafo após 60 s do início da injeção para camundongos e após 90 s do início da injeção para ratos, para que a aquisição do Cine-CT seja iniciada. A injeção de CA irá parar aproximadamente ao mesmo tempo que a conclusão da varredura Cine-CT para camundongos e após a conclusão para ratos.
- Emulsão lipídica iodada CA:
- Após a conclusão da tomografia computadorizada Cine-CT, desconecte o animal do sistema de monitoramento fisiológico e remova a cânula da veia da cauda. Dependendo do protocolo real, os animais são recuperados ou sacrificados após o procedimento de imagem descrito. No primeiro caso, os animais são acordados em suas gaiolas em um ambiente quente sob uma lâmpada infravermelha. Eles são monitorados até o despertar completo, levando 15/30 min após a anestesia gasosa. No caso de protocolos que exijam, por exemplo, a colheita de tecidos no final do procedimento de imagem, os animais são eutanasiados usando uma overdose de anestésico em uma câmara de indução (isoflurano a 5%), conforme Anexo VI da D.Lgs. 26/2014.
NOTA: No caso de 18radionuclídeos à base de F, conforme discutido neste protocolo, 24 horas após a injeção do traçador são suficientes para atingir um nível de radioatividade residual no corpo do animal que seja seguro para todos os fins práticos.
8. Reconstrução das imagens cardíacas de 4DCT utilizando gating cardiorrespiratório intrínseco
NOTA: Após a conclusão do estudo de imagem, a reconstrução padrão de PET e TC é realizada automaticamente. No entanto, a reconstrução da sequência de cardiotomografia computadorizada 4D (Cine) deve ser realizada manualmente e requer alguma interação do usuário. Este tipo especial de reconstrução, obrigatório para a subsequente análise morfofuncional da TC cardíaca, é discutido nesta seção.
- Abra o módulo de bloqueio cardíaco da GUI do tomogragh e selecione o estudo de imagem a ser analisado.
- Selecione uma região de interesse (ROI) nas radiografias do animal exibido (Figura 2) para construir uma curva de movimento cardíaco dependente do tempo, representando o sinal de bloqueio - o quimograma. Mova verticalmente o ROI retangular pré-desenhado de tal forma que o ápice cardíaco e o diafragma sejam selecionados. Em seguida, selecione Análise de sinal de Gating. A interface do usuário agora mostrará o sinal de bloqueio tanto no domínio do tempo quanto no domínio da frequência.
- No primeiro gráfico do domínio da frequência, selecione a banda de frequência respiratória destacando o primeiro grupo de picos do espectro de frequências (consulte a Figura 3 para obter um exemplo de espectro).
- No segundo gráfico no domínio da frequência, selecione a banda de frequência de movimento cardíaco, destacando o segundo pico mais acentuado.
- Na fase seguinte, observe o sinal de bloqueio no domínio do tempo com marcadores de cor (pontos) sobrepostos, mostrando os picos respiratórios e os picos de contração cardíaca identificados. Se as posições do marcador se encaixarem bem com os picos respiratórios e cardíacos do sinal de bloqueio original, prossiga para a próxima fase. Caso contrário:
- Se a forma do sinal de bloqueio for muito diferente da exibida na Figura 3, volte para a etapa 8.2 e selecione outro ROI.
- Se a forma do sinal de bloqueio for razoavelmente semelhante à mostrada na Figura 3, volte para as etapas 8.3 e 8.4 e selecione bandas de frequência diferentes no espectro de sinal de bloqueio.
- Na próxima fase, selecione um mínimo de quatro portas cardíacas.
NOTA: A reconstrução típica da Cine-TC consiste em 8-12 portas cardíacas. - Selecione a janela respiratória adequada usando o menu suspenso: Janela respiratória | 20%-80%.
NOTA: Isso reterá 60% dos dados adquiridos na reconstrução, excluindo a fase de pico de inspiração e, assim, melhorando a nitidez das paredes miocárdicas reconstruídas em cada fase cardíaca. - Execute a reconstrução para converter as imagens Cine-CT retrospectivamente fechadas no formato DICOM, prontas para serem importadas para o software para posterior análise funcional.
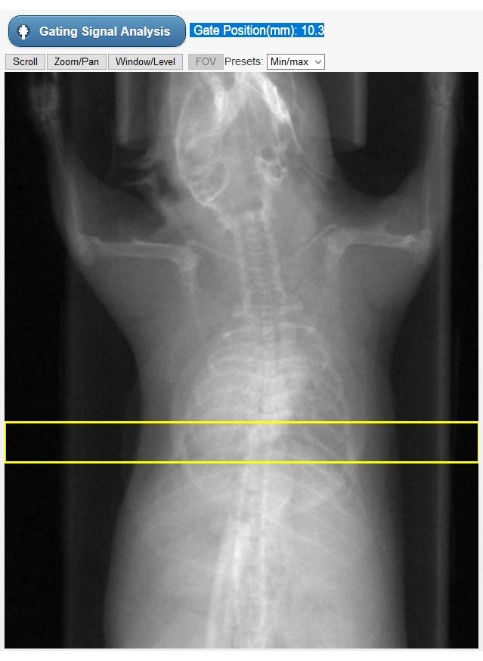
Figura 2: Ferramenta de seleção de ROI para gating intrínseco. Esta imagem é mostrada na GUI do tomógrafo durante a fase de reconstrução do Cine-CT. O usuário deve selecionar a posição do ROI (retângulo amarelo) no qual o sinal de bloqueio intrínseco (quimograma) é obtido a partir das projeções brutas de TC. O objeto de forma circular sobreposto ao peito do animal é o travesseiro respiratório usado apenas para monitoramento fisiológico durante o estudo. Abreviaturas: ROI = região de interesse; TC = tomografia computadorizada; GUI = interface gráfica do usuário. Por favor, clique aqui para ver uma versão maior desta figura.
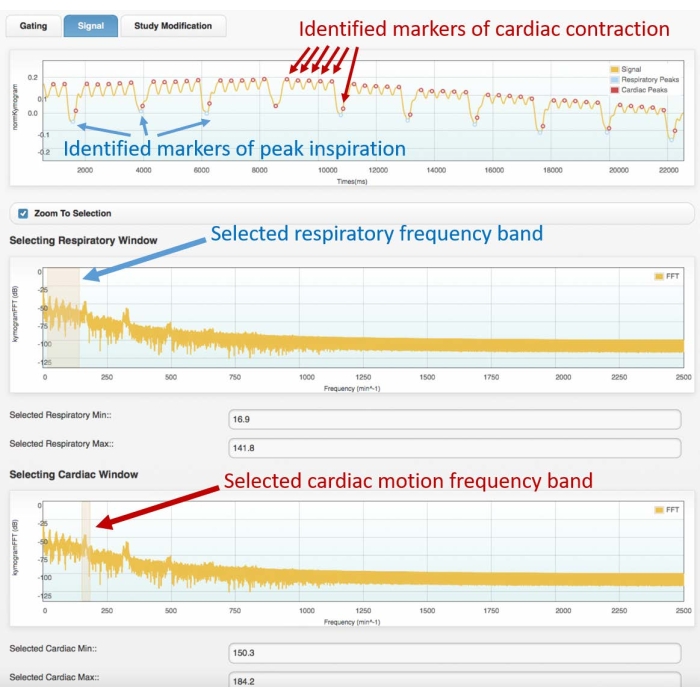
Figura 3: Exemplo de sinal de bloqueio (quadro superior) e espectro de frequência correspondente (centro e inferior). Imagens obtidas com o módulo de bloqueio cardíaco do software Atrium. O usuário deve selecionar as bandas de frequência adequadas para o movimento respiratório (quadro central) e cardíaco (quadro inferior). Isso permitirá a identificação dos marcadores respiratórios e cardíacos no sinal de bloqueio, que devem ser verificados pelo usuário antes de prosseguir com a reconstrução 4D. A má identificação dos picos ou a atribuição errada (por exemplo, respiratória para cardíaca, ou vice-versa) levará a uma reconstrução incorreta. Os dados apresentados foram obtidos a partir da análise de uma cinétilografia 4D de um rato Wistar macho adulto saudável (507 g) injetado com 2 mL de iomeprol, 200 mg/mL, à taxa de 0,4 mL/min por 5 min (o gráfico no topo é ampliado nos primeiros 22 s de aquisição para permitir uma melhor visualização do movimento cardíaco e respiratório identificado). Abreviação: TC = tomografia computadorizada. Por favor, clique aqui para ver uma versão maior desta figura.
9. Análise cardíaca PET
NOTA: Esta seção mostra como realizar uma análise cinética de dados dinâmicos [18F]FDG do ventrículo esquerdo de pequenos animais. A análise é baseada no software Carimas. As instruções abaixo não se destinam a substituir o manual do usuário do software17. O procedimento apresentado a seguir baseia-se na análise gráfica de Patlak dos dados dinâmicos do PET18. Consulte a seção Discussão para obter detalhes sobre essa análise.
- Abra as imagens DICOM da PET scan dinâmica.
- Selecione o módulo HeartPlugin .
- Amplie a imagem no coração do rato/rato e selecione o último período de tempo (ou, equivalentemente, a soma dos últimos três a cinco períodos de tempo) para o qual a maior parte da atividade do pool de sangue já foi lavada.
- Siga as instruções na tela para reorientar a imagem ao longo do eixo principal do coração do animal (eixo curto, eixo longo vertical e horizontal). Faça isso interativamente movendo os marcadores exibidos para a base e o ápice do coração (Figura 4).
- Selecione a ferramenta Segmentação .
Observação : por padrão, a segmentação automática está habilitada, o que produz resultados confiáveis na maioria dos casos. - Se o resultado da segmentação automática não for aceitável, refine a forma do miocárdio segmentado e/ou da cavidade do VE ativando o Modo Manual (ROI Search Disabled).
- Na Ferramenta de modelagem , selecione o modelo cinético apropriado a ser usado para a análise dinâmica de PET. Nesse caso, selecione Gráfico | Patlak para permitir a análise do gráfico de Patlak para o cálculo da taxa metabólica de captação de glicose (MRGlu) para cada setor cardíaco.
- Na ferramenta polarmap , selecione o número correto de segmentos cardíacos exibidos. Nesse caso, selecione 17 segmentos.
- Agora, pressione o botão Ajustar para executar o procedimento de ajuste da análise de Patlak.
- Ao final do procedimento de ajuste, observe o mapa polar exibido dos valores de Ki (ou seja, a inclinação da regressão linear expressa em mL/[mL × min]).
- Usando os valores de Ki para cada setor mostrado em uma tabela, calcule o MRGlu usando a equação (2):
MR Glu = (Ki × PGlu)/LC (2)
onde PGlu é um valor derivado de amostra de sangue da concentração de glicose plasmática (mmol / L), e a constante agrupada (LC) é um coeficiente empírico usado para compensar a diferença na absorção entre glicose normal e FDG. Ver, por exemplo, Ng et al.22 para valores típicos da constante agrupada em várias condições experimentais.
NOTA: Antes de iniciar a análise PET, é uma boa prática inspecionar visualmente a sequência dinâmica dos volumes de PET dentro da ferramenta de software de análise PET. Isso é necessário para excluir o movimento macroscópico do animal entre os períodos de tempo durante o estudo. Se houver movimento, o registro adequado da imagem (fora do escopo deste protocolo) deve ser realizado antes da análise, se possível.
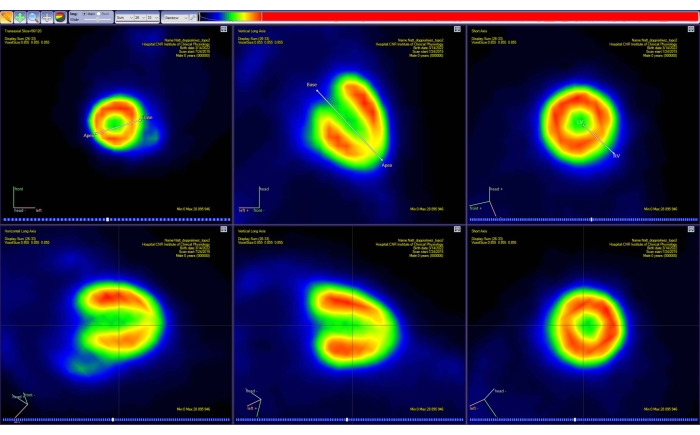
Figura 4: Ferramenta de reorientação do software de análise PET. A projeção de dois segmentos de linha simples no espaço 3D é mostrada em cada um dos três planos padrão (transaxial, coronal e sagital). O primeiro segmento permite que o usuário selecione a base e o ápice do coração, enquanto o segundo permite selecionar os lados esquerdo e direito do coração. Esta etapa resulta em uma nova imagem PET (interpolada) (linha inferior), com o coração reorientado ao longo da representação AHA padrão. As imagens foram obtidas com Carimas de um rato CD-1 macho adulto saudável pesando 51 g e injetado com 10 MBq de [18F]FDG. Abreviaturas: PET = tomografia por emissão de pósitrons; AHA = Associação Americana do Coração; FDG = fluorodesoxiglicose. Por favor, clique aqui para ver uma versão maior desta figura.
10. Análise cardíaca por cine-TC
NOTA: Esta seção mostra como realizar a análise quantitativa da imagem cardíaca Cine-CT para coletar dados quantitativos globais da função cardíaca. A análise é baseada no software Osirix MD. As instruções abaixo não se destinam a substituir o manual do usuário do Osirix24.
- Carregue as imagens DICOM da varredura Cine-CT no software.
- Abra o conjunto de dados dinâmico com o visualizador 4D incorporado.
- Usando a ferramenta Reforma Multiplanar 3D (MPR), reoriente os dados da imagem ao longo do eixo curto (Figura 5).
- Exporte os dados reorientados para o DICOM, garantindo que todos os dados 4D sejam exportados, com espessura de fatia preservada (igual à original) e profundidade de bits da imagem (16 bits por voxel)
- Abra as imagens 4D MPR exportadas usando o visualizador 4D.
- Selecione um período de tempo correspondente à diástole-final. Navegue por todos os períodos de tempo com o controle deslizante de tempo na barra de ferramentas principal para garantir que a fase cardíaca correta seja selecionada.
- Nesse período de tempo, escolha a ferramenta de anotação de polígono fechado e delineie manualmente a parede endocárdica do VE.
- Faça o mesmo para 10-20 fatias da base ao ápice, garantindo que todos os ROIs tenham o mesmo nome (por exemplo, LVENDO).
- No menu ROI , selecione Volume de ROI | Gere ROIs ausentes para gerar os ROIs em todas as fatias de eixo curto por interpolação dos ROIs desenhados manualmente.
- No menu ROI , selecione Volume de ROI | Calcule Volume para calcular o volume do grupo ROI com o mesmo nome de ROI.
- Navegue pelos períodos de tempo e selecione uma fase correspondente à sístole final (volume LV menor) e repita as etapas 10.7-10.10 acima.
- Calcular o volume sistólico (SV) e a fração de ejeção utilizando as equações (3) e (4):
VS = EDV - ESV[mL] (3)
FE = 100 × SV/EDV [%] (4)
onde EDV é o volume diastólico final e ESV é o volume sistólico final.
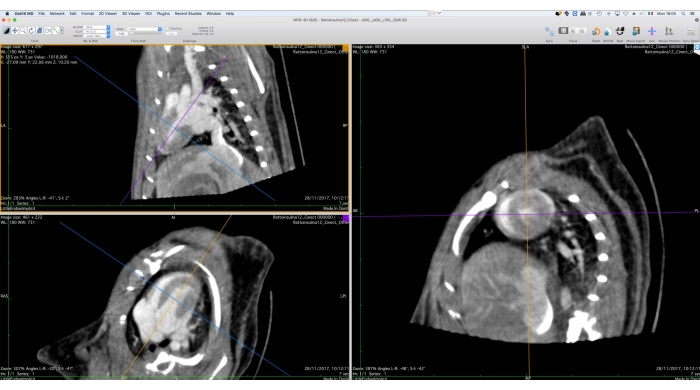
Figura 5: Interface gráfica da ferramenta de reforma multiplanar. Esta ferramenta é utilizada para a reorientação dos dados do Cine-CT para posterior análise funcional. O utilizador deve girar e traduzir os eixos de referência no lado esquerdo do ecrã de modo a que a vista de eixo curto do coração seja mostrada à direita. No final deste procedimento, o usuário pode exportar as imagens reorientadas como um conjunto de arquivos DICOM. As imagens foram obtidas com Osirix MD e referem-se a um rato Wistar macho adulto saudável (507 g) injetado com 2 mL de iomeprol, 200 mg/mL, a uma taxa de 0,4 mL/min por 5 min, reconstruído com Retroprojeção Filtrada com um tamanho de voxel de 0,24 mm3. Por favor, clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Nesta seção, os resultados típicos são mostrados para a análise de PET e TC seguindo os procedimentos descritos até o momento. A Figura 6 mostra os resultados da segmentação automática do miocárdio e da cavidade do VE do exame de [18F]FDG PET de um camundongo CD-1 controle (saudável). Embora o ventrículo direito nem sempre seja visível nas imagens reconstruídas, os eixos de orientação baseados no cabeçalho DICOM podem ser utilizados para discriminar corretamente o...
Access restricted. Please log in or start a trial to view this content.
Discussão
O protocolo apresentado neste artigo enfoca um procedimento experimental típico para pesquisa cardiovascular translacional em pequenos modelos animais de lesão cardíaca usando imagens PET/CT de alta resolução. Os resultados apresentados são indicativos do alto valor quantitativo e qualitativo das imagens PET e Cine-CT, fornecendo informações funcionais e estruturais de todo o coração sobre seu metabolismo da glicose, forma e dinâmica de sua contração. Além disso, todas as imagens obtidas são 3D, resolvidas...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Daniele Panetta recebeu subsídios para a P&D de instrumentação micro-CT da Inviscan Sas.
Agradecimentos
Esta pesquisa foi apoiada em parte pelo Projeto JPI-HDHL-INTIMIC "GUTMOM": Obesidade materna e disfunção cognitiva na prole: Papel de causa-efeito do GUT MicrobiOMe e prevenção dietética precoce (projeto no. INTIMIC-085, Ministério da Educação, Universidade e Decreto de Pesquisa da Itália nº 946/2019).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.9% sterile saline | Fresenius Kabi | 0.9% sodium chloride for injection | |
| 1025L Physiological Monitoring | Small Animal Instruments | Physiological monitoring system for small animal imaging | |
| 5 mL syringes | Artsana | Syringes with needle for injection of PET tracer | |
| Atomlab 500 | Else Nuclear | PET Dose calibrator | |
| Atrium software | Inviscan | Version 1.5.5 | PET/CT operating software |
| Butterfly catheters | Delta Med | 27.5 G needle | |
| Carimas software | Turku PET Center | Version 2.10 | Image analysis software |
| Fenestra VC | Medilumine | Lipid emulsion iodinated contrast agent for small animals | |
| Heat lamp | Heat lamp with clamp and switch | ||
| Insulin syringes | Artsana | Syringes with needle for injection of CT CA | |
| Iomeron 400 mgI/mL | Bracco | Iomeprol, vascular contrast agent | |
| IRIS PET/CT | Inviscan | PET/CT scanner for small animals | |
| Isoflurane | Zoetis | Inhalation anesthetic, 250 mL | |
| OneTouch Glucometer | Johnson&Johnson Medical | Glucose meter kit | |
| Osirix MD software | Pixmeo | Version 11 | Image analysis software |
| Oxygen | Air liquide | Compressed gas | |
| Rectal probe for 1025L | Small Animal Instruments | Rectal probe with cable for SAII 1025L systems | |
| Respiratory sensor for 1025L | Small Animal Instruments | Respiratory pillow with tubings for SAII 1025L systems | |
| TJ-3A syringe pump | Longer | Motorized syringe pump for CT CA injection |
Referências
- Zaragoza, C. Animal models of cardiovascular diseases. Journal of Biomedicine and Biotechnology. 2011, 497841(2011).
- Russell, J. C., Proctor, S. D. Small animal models of cardiovascular disease: Tools for the study of the roles of metabolic syndrome, dyslipidemia, and atherosclerosis. Cardiovascular Pathology. 15 (6), 318-330 (2006).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Menichetti, L., et al. MicroPET/CT imaging of αvß3 integrin via a novel 68Ga-NOTA-RGD peptidomimetic conjugate in rat myocardial infarction. European Journal of Nuclear Medicine and Molecular Imaging. 40 (8), 1265-1274 (2013).
- Zhou, H., et al. Development of a micro-computed tomography-based image-guided conformal radiotherapy system for small animals. International Journal of Radiation Oncology, Biology, Physics. 78 (1), 297-305 (2010).
- Di Lascio, N., Kusmic, C., Stea, F., Faita, F. Ultrasound-based pulse wave velocity evaluation in mice. Journal of Visualized Experiments. (120), e54362(2017).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. American Journal of Physiology-Heart and Circulatory Physiology. 322 (3), 359-372 (2022).
- Espe, E. K. Novel insight into the detailed myocardial motion and deformation of the rodent heart using high-resolution phase contrast cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15 (1), 82(2013).
- Vanhove, C., et al. Accurate molecular imaging of small animals taking into account animal models, handling, anaesthesia, quality control and imaging system performance. EJNMMI Physics. 2 (1), 31(2015).
- Garcia, M. J., et al. State of the art: Imaging for myocardial viability: A scientific statement from the American Heart Association. Circulation: Cardiovascular Imaging. 13 (7), 000053(2020).
- Panetta, D., et al. Cardiac computed tomography perfusion: Contrast agents, challenges and emerging methodologies from preclinical research to the clinics. Academic Radiology. 28 (1), 1-18 (2020).
- Kusmic, C. Up-regulation of heme oxygenase-1 after infarct initiation reduces mortality, infarct size and left ventricular remodeling: experimental evidence and proof of concept. Journal of Translational Medicine. 12 (1), 89(2014).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: A model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments. (94), e52206(2014).
- Fischer, M., et al. Comparison of metabolic and functional parameters using cardiac 18F-FDG-PET in early to mid-adulthood male and female mice. EJNMMI Research. 11 (1), 7(2021).
- Valenta, I., et al. Feasibility evaluation of myocardial cannabinoid type 1 receptor imaging in obesity: A translational approach. JACC: Cardiovascular Imaging. 11 (2), 320-332 (2018).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. Journal of Nuclear Medicine. 47 (6), 999-1006 (2006).
- Carimas User Manual. , Available from: https://turkupetcentre.fl/carimas/files/archive/Html/a1.html (2022).
- Peters, A. M. Graphical analysis of dynamic data: The Patlak-Rutland plot. Nuclear Medicine Communications. 15 (9), 669-672 (1994).
- Choi, Y., et al. Parametric images of myocardial metabolic rate of glucose generated from dynamic cardiac PET and 2-[18F]fluoro-2-deoxy-d-glucose studies. Journal of Nuclear Medicine. 32 (4), 733-738 (1991).
- Laffon, E., Marthan, R. Is Patlak y-intercept a relevant metrics. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1287-1290 (2021).
- Flores, J. E., McFarland, L. M., Vanderbilt, A., Ogasawara, A. K., Williams, S. -P. The effects of anesthetic agent and carrier gas on blood glucose and tissue uptake in mice undergoing dynamic FDG-PET imaging: Sevoflurane and isoflurane compared in air and in oxygen. Molecular Imaging and Biology. 10 (4), 192-200 (2008).
- Ng, C. K. Sensitivity of myocardial fluorodeoxyglucose lumped constant to glucose and insulin. American Journal of Physiology-Heart and Circulatory Physiology. 260 (2), 593-603 (1991).
- Shoghi, K. I., Welch, M. J. Hybrid image and blood sampling input function for quantification of small animal dynamic PET data. Nuclear Medicine and Biology. 34 (8), 989-994 (2007).
- Heuberger, J., Pixmeo, S., Rosset, A. OsiriX User Manual. Blurb. , San Francisco, CA. (2017).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation. 105 (4), 539-542 (2002).
- Kolanowski, T. J., et al. Multiparametric evaluation of post-MI small animal models using metabolic ([18F]FDG) and perfusion-based (SYN1) heart viability tracers. International Journal of Molecular Sciences. 22 (22), 12591(2021).
- Guiducci, L., et al. Contribution of organ blood flow, intrinsic tissue clearance and glycaemia to the regulation of glucose use in obese and type 2 diabetic rats: A PET study. Nutrition Metabolism and Cardiovascular Diseases. 21 (9), 726-732 (2011).
- Tadinada, S. M., et al. Functional resilience of C57BL/6J mouse heart to dietary fat overload. American Journal of Physiology-Heart and Circulatory Physiology. 321 (5), 850-864 (2021).
- Dreyfuss, A. D., et al. A novel mouse model of radiation-induced cardiac injury reveals biological and radiological biomarkers of cardiac dysfunction with potential clinical relevance. Clinical Cancer Research. 27 (8), 2266-2276 (2021).
- Hsu, B. PET tracers and techniques for measuring myocardial blood flow in patients with coronary artery disease. Journal of Biomedical Research. 27 (6), 452-459 (2013).
- Dinkel, J., et al. Intrinsic gating for small-animal computed tomography. Circulation: Cardiovascular Imaging. 1 (3), 235-243 (2008).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Physics in Medicine and Biology. 55 (7), 2069-2085 (2010).
- Li, Y., Zhang, W., Wu, H., Liu, G. Advanced tracers in PET imaging of cardiovascular disease. BioMed Research International. 2014, 504532(2014).
- Kim, D. -Y., Cho, S. -G., Bom, H. -S. Emerging tracers for nuclear cardiac PET imaging. Nuclear Medicine and Molecular Imaging. 52 (4), 266-278 (2018).
- Maddahi, J., Packard, R. R. S. Cardiac PET perfusion tracers: Current status and future directions. Seminars in Nuclear Medicine. 44 (5), 333-343 (2014).
- Bentourkia, M. Kinetic modeling of PET data without blood sampling. IEEE Transactions on Nuclear Science. 52 (3), 697-702 (2005).
- Lammertsma, A. A. Forward to the past: The case for quantitative PET imaging. Journal of Nuclear Medicine. 58 (7), 1019-1024 (2017).
- Nahrendorf, M., et al. High-resolution imaging of murine myocardial infarction with delayed-enhancement cine micro-CT. American Journal of Physiology-Heart and Circulatory Physiology. 292 (6), 3172-3178 (2007).
- Badea, C. T., Fubara, B., Hedlund, L. W., Johnson, G. A. 4-D micro-CT of the mouse heart. Molecular Imaging. 4 (2), 110-116 (2005).
- Technical Resources. MediLumine. , Available from: https://www.medilumine.com/technical-resources (2019).
- Nebuloni, L., Kuhn, G. A., Müller, R. A Comparative analysis of water-soluble and blood-pool contrast agents for in vivo vascular imaging with micro-CT. Academic Radiology. 20 (10), 1247-1255 (2013).
- Panetta, D., et al. Performance evaluation of the CT component of the IRIS PET/CT preclinical tomograph. Nuclear Instruments & Methods in Physics Research Section A: Accelerators Spectrometers Detectors and Associated Equipment. 805, 135-144 (2016).
- Gu, J., et al. At what dose can total body and whole abdominal irradiation cause lethal intestinal injury among C57BL/6J mice. Dose-Response. 18 (3), 1559325820956783(2020).
- Amirrashedi, M., Zaidi, H., Ay, M. R. Advances in preclinical PET instrumentation. PET Clinics. 15 (4), 403-426 (2020).
- Clark, D. P., Badea, C. T. Advances in micro-CT imaging of small animals. Physica Medica. 88, 175-192 (2021).
- Belcari, N., Del Guerra, A., Panetta, D. High-Resolution and Animal Imaging Instrumentation and Techniques. Handbook of Particle Detection and Imaging. Grupen, C., Buvat, I. , Springer. Berlin, Heidelberg. 1497-1535 (2021).
- Wang, G., Rahmim, A., Gunn, R. N. PET Parametric imaging: Past, present, and future. IEEE Transactions on Radiation and Plasma Medical Sciences. 4 (6), 663-675 (2020).
- Befera, N. T., Badea, C. T., Johnson, G. A. Comparison of 4D-microSPECT and microCT for murine cardiac function. Molecular Imaging and Biology. 16 (2), 235-245 (2014).
- van Deel, E., Ridwan, Y., van Vliet, J. N., Belenkov, S., Essers, J. In vivo quantitative assessment of myocardial structure, function, perfusion and viability using cardiac micro-computed tomography. Journal of Visualized Experiments. (108), e53603(2016).
- Lee, C. -L., et al. Assessing cardiac injury in mice with dual energy-microCT, 4D-microCT and microSPECT imaging following partial-heart irradiation. International Journal of Radiation Oncology, Biology, Physics. 88 (3), 686-693 (2014).
- Harms, H., et al. Comparison of clinical non-commercial tools for automated quantification of myocardial blood flow using oxygen-15-labelled water PET/CT. European Heart Journal - Cardiovascular Imaging. 15 (4), 431-441 (2013).
- Nesterov, S. V., et al. Myocardial perfusion quantitation with 15O-labelled water PET: High reproducibility of the new cardiac analysis software (CarimasTM). European Journal of Nuclear Medicine and Molecular Imaging. 36 (10), 1594-1602 (2009).
- Nesterov, S. V., et al. Myocardial perfusion quantification with Rb-82 PET: Good interobserver agreement of Carimas software on global, regional, and segmental levels. Annals of Nuclear Medicine. 36, 507-514 (2022).
- Nesterov, S. V., et al. One-tissue compartment model for myocardial perfusion quantification with N-13 ammonia PET provides matching results: A cross-comparison between Carimas, FlowQuant, and PMOD. Journal of Nuclear Cardiology. , (2021).
- Thackeray, J. T. Preclinical Multimodality Imaging and Image Fusion in Cardiovascular Disease. Image Fusion in Preclinical Applications. Kuntner-Hannes, C., Haemisch, Y. , Springer. Cham, Switzerland. 161-181 (2019).
- Vohra, R., Batra, A., Forbes, S. C., Vandenborne, K., Walter, G. A. Magnetic resonance monitoring of disease progression in mdx mice on different genetic backgrounds. The American Journal of Pathology. 187 (9), 2060-2070 (2017).
- Baehr, A., et al. Agrin promotes coordinated therapeutic processes leading to improved cardiac repair in pigs. Circulation. 142 (9), 868-881 (2020).
- Lalwani, K., et al. Contrast agents for quantitative microCT of lung tumors in mice. Comparative Medicine. 63 (6), 482-490 (2013).
- Bertoldo, A., et al. Evaluation of compartmental and spectral analysis models of [18F]FDG kinetics for heart and brain studies with PET. IEEE Transactions on Bio-medical Engineering. 45 (12), 1429-1448 (1998).
- Li, Y., Kundu, B. K. An improved optimization algorithm of the three-compartment model with spillover and partial volume corrections for dynamic FDG PET images of small animal hearts in vivo. Physics in Medicine and Biology. 63 (5), 055003(2018).
- Mabrouk, R., Dubeau, F., Bentourkia, M., Bentabet, L. Extraction of time activity curves from gated FDG-PET images for small animals' heart studies. Computerized Medical Imaging and Graphics. 36 (6), 484-491 (2012).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados