É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Mediadora fosfolipídida induzida transformação em culturas tridimensionais
Neste Artigo
Resumo
O presente protocolo descreve a criação de culturas 3D 'no topo' de uma linha celular epitelial de mama não transformada, MCF10A, que foi modificada para estudar a transformação induzida pelo Fator de Ativação de Plaquetas (PAF). A imuno-fluorescência tem sido usada para avaliar a transformação e é discutida em detalhes.
Resumo
Vários modelos foram desenvolvidos para estudar o câncer, como modelos de roedores e linhas celulares estabelecidas. Insights valiosos sobre carcinogênese foram fornecidos por estudos que utilizam esses modelos. As linhas celulares têm proporcionado uma compreensão da desregulamentação da sinalização molecular associada à tumorigênese mamária, enquanto modelos de roedores são amplamente utilizados para estudar características celulares e moleculares do câncer de mama in vivo. O estabelecimento de culturas 3D de células epiteliais e cancerosas mamárias auxilia na ponte entre modelos in vivo e in vitro , imitando as condições in vivo in vitro. Este modelo pode ser usado para entender a desregulamentação de eventos complexos de sinalização molecular e as características celulares durante a carcinogênese mamária. Aqui, um sistema de cultura 3D é modificado para estudar uma transformação induzida por mediadores fosfolipídides (Fator de Ativação de Plaquetas, PAF). Os imunomoduladores e outras moléculas secretadas desempenham um papel importante na iniciação e progressão do tumor na mama. No presente estudo, culturas acinadoras 3D de células epiteliais mamárias são expostas a características de transformação expostas ao PAF, como perda de polaridade e características celulares alteradas. Este sistema de cultura 3D ajudará a lançar luz sobre perturbações genéticas e/ou epigenéticas induzidas por várias pequenas entidades de moléculas no microambiente tumoral. Além disso, este sistema também fornecerá uma plataforma para a identificação de novos, bem como genes conhecidos que podem estar envolvidos no processo de transformação.
Introdução
Uma miríade de modelos estão disponíveis para estudar a progressão do câncer, sendo cada um deles único e representando um subtipo dessa doença complexa. Cada modelo fornece insights únicos e valiosos sobre a biologia do câncer e melhorou os meios para imitar a condição real da doença. Linhas celulares estabelecidas cultivadas como monocamadas forneceram insights valiosos sobre processos vitais in vitro, como proliferação, invasividade, migração e apoptose1. Embora a cultura celular bidimensional (2D) tenha sido a ferramenta tradicional para investigar a resposta das células mamíferas a várias perturbações ambientais, a extrapolação desses achados para prever respostas em nível tecidual não parece suficientemente convincente. A maior limitação das culturas 2D é que o microambiente criado difere em grande parte do do próprio tecido mamário2. A cultura 2D carece da interação das células com a matriz extracelular, que é vital para o crescimento de qualquer tecido. Além disso, as forças de tração experimentadas pela célula nas culturas de monocamadas dificultam a polaridade dessas células, alterando assim a sinalização celular e o comportamento 3,4,5. Sistemas de cultura tridimensionais (3D) abriram uma nova avenida no campo da pesquisa sobre câncer com sua capacidade de imitar as condições in vivo in vitro. Muitas pistas microambientais cruciais que são perdidas na cultura celular 2D poderiam ser restabelecidas usando culturas 3D de matriz extracelular rica em laminino (lrECM)6.
Vários estudos identificaram a importância do microambiente tumoral na carcinogênese 7,8. Fatores associados à inflamação são uma parte importante do microambiente. O Fator de Ativação de Plaquetas (PAF) é um mediador fosfolipídide secretado por várias células imunes que media múltiplas respostas imunes 9,10. Altos níveis de PAF são secretados por diferentes linhas de células cancerígenas de mama e estão associados à maior proliferação11. Estudos do nosso laboratório mostraram que a presença prolongada de PAF em culturas acinar leva à transformação das células epiteliaismamárias 12. O PAF ativa o receptor PAF (PAFR), ativando o eixo de sinalização PI3K/Akt13. O PAFR também está associado ao EMT, invasão e metástase14.
O presente protocolo demonstra um sistema modelo para estudar a transformação induzida pelo PAF, utilizando culturas 3D de células epiteliais mamárias, como foi descrito anteriormente por Chakravarty et al.12. As células epiteliais mamárias cultivadas na matriz extracelular (culturas 3D) tendem a formar esferoides polarizados presos pelo crescimento. Estes são chamados de acini e se assemelham muito ao acini do tecido mamário, a menor unidade funcional da glândula mamária, in vivo15. Estes esferoides (Figura 1A,B) consistem em uma monocamada de células epiteliais polarizadas estreitamente embaladas em torno de um lúmen oco e anexadas à membrana do porão (Figura 1C). Este processo de morfogênese foi bem descrito na literatura16. Quando semeadas no LrECM, as células passam por divisão e diferenciação para formar um aglomerado de células, que então polarizam a partir do dia 4. Até o dia 8, o acini consiste em um grupo de células polarizadas que estão em contato direto com a matriz extracelular e um aglomerado de células não polarizadas dentro das células externas polarizadas, sem contato com a matriz. Essas células não polidas são conhecidas por serem submetidas à apoptose até o dia 12 da cultura, formando um lúmen oco. Até o dia 16, as estruturas presas pelo crescimento são formadasem 16.
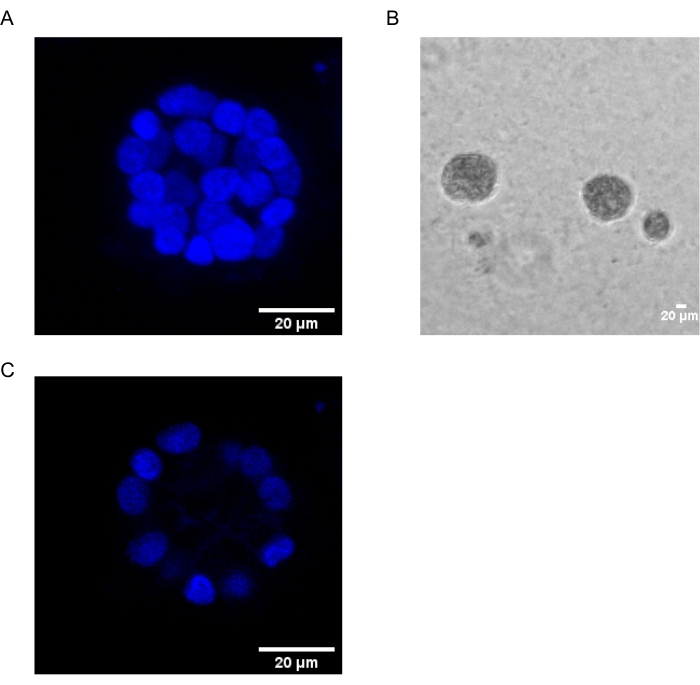
Figura 1: Núcleos de células em acini manchadas com uma mancha nuclear. (A) construção 3D do acini. (B) Imagem de contraste de fase do acini MCF10A cultivada em Matrigel por 20 dias. (C) A seção mais central mostra a presença de um lúmen oco. Barra de escala = 20 μm. Clique aqui para ver uma versão maior desta figura.
Ao contrário das culturas 2D, as culturas acinar ajudam a distinguir células normais e transformadas através de mudanças aparentes de morfologia. Células epiteliais de mama não transformadas formam acini com um lúmen oco, imitando o acini mamário humano normal. Esses esferoides, após a transformação, mostram uma morfologia interrompida caracterizada por uma grande perda de polaridade (uma das marcas do câncer), ausência de lúmen, ou interrupção do lúmen oco (devido à evasão da apoptose) que pode ser induzida devido à desregulamentação de vários genes 17,18,19,20 . Essas transformações podem ser estudadas utilizando técnicas comumente utilizadas, como a imunofluorescência. Assim, o modelo de cultura celular 3D pode funcionar como um método simples para investigar o processo de morfogênese acinar mama e carcinogênese mamária. A criação de um sistema de cultura 3D para entender o efeito de um mediador fosfolipídico, PAF, ajudará na triagem de medicamentos pré-clínicos de alto rendimento.
Este trabalho adaptou o protocolo de cultura 3D 'no topo'16,21 para estudar a transformação induzida pelo PAF22. As alterações fenotípicas induzidas pela exposição do acini ao mediador fosfolipídico foram estudadas por meio da imunofluorescência. Vários marcadores de polaridade e epitelial para transição mesenquimal (EMT)foram utilizados no estudo. A Tabela 1 menciona sua localização normal e seu fenótipo esperado após a transformação.
| Anticorpos | Marcas | Localização normal | Fenótipo transformado |
| α6-Integrin | Basolateral | Basal com mancha lateral fraca | Mancha lateral forte / Apical |
| β-Catenin | Junção celular | Basolateral | Localização anormal / nuclear ou citoplasmática |
| Vimentina | Emt | Presença ausente/fraca | Up-regulation |
Tabela 1: Marcadores utilizados no estudo. Diferentes marcadores utilizados com sua localização na presença e ausência de tratamento paf.
Este método pode ser melhor utilizado para estudar/testar drogas plausíveis e genes-alvo para vários subtipos de câncer de mama. Isso pode fornecer um dado de resposta a medicamentos mais próximo do cenário in vivo , auxiliando no desenvolvimento mais rápido e confiável de medicamentos. Além disso, este sistema pode ser usado para estudar a sinalização molecular associada à resposta a drogas e resistência a drogas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Semeando células MCF10A em lrECM
- Manter as células MCF10A (células epiteliais mamárias aderentes) no meio de crescimento. Passagem pelas celas a cada 4 dias.
NOTA: Composição do meio de crescimento: DMEM de alta glicose sem piruvato de sódio contendo soro de cavalo (5%), insulina (10 μg/mL), hidrocortisona (0,5 μg/mL), fator de crescimento epidérmico, EGF (20 ng/mL), de toxina de cólera (100 ng/mL) e penicilina-estreptomicina (100 unidades/mL) (ver Tabela de Materiais). - Descongele lrECM (ver Tabela de Materiais) no gelo 20 min antes do início do experimento. O dia da semeadura das células é geralmente considerado o dia 0.
- Para tentarpsinizar as células, aspire o meio e lave com 2 mL de PBS. Adicione 900 μL de 0,05% Trypsin-EDTA e incubar a 37 °C por ~15 min ou até que as células estejam completamente experimentadas.
- Prepare uma cama de lrECM em oito poços de um escorregador de vidro de cobertura câmara (ver Tabela de Materiais).
- Quando as células estiverem experimentpsinizando, cubra cada poço com 60 μL de lrECM e coloque-a em uma incubadora de CO2 de 37 °C por um máximo de 15 minutos.
- Prepare a suspensão do celular seguindo as etapas abaixo.
- Após a desalojadeira completa das células, adicione 5 mL de meio de re-suspensão para saciar a atividade de trypsin e gire as células a 112 x g por 10 min a 25 °C.
NOTA: Composição do meio de re-suspensão: DMEM de alta glicose sem piruvato de sódio, suplementado com soro de cavalo (20%) e penicilina-estreptomicina (100 unidades/mL). - Aspire o meio gasto e suspenda as células em 2 mL de meio de ensaio. Misture bem a suspensão para garantir a formação de uma única suspensão celular.
NOTA: Composição do médio ensaio: DMEM de alta glicose sem piruvato de sódio, suplementado com soro de cavalo (2%), hidrocortisona (0,5 μg/mL), toxina de cólera (100 ng/mL), insulina (10 μg/mL) e penicilina-estreptomicina (100 unidades/mL). - Conte as células usando um hemócito e calcule o volume de suspensão celular necessário para semear 6 x 103 células em cada poço.
NOTA: É geralmente preferível incluir um poço extra no cálculo para explicar quaisquer erros de pipetação. - De acordo com o número de poços necessários, diluir a suspensão celular em meio de sobreposição.
NOTA: A composição média de sobreposição para um único poço é a seguinte: 400 μL de médio ensaio, 8 μL de lrECM (2% final) e 0,02 μL de 100 μg/mL de EGF (final de 5 ng/mL).
- Após a desalojadeira completa das células, adicione 5 mL de meio de re-suspensão para saciar a atividade de trypsin e gire as células a 112 x g por 10 min a 25 °C.
- Realize a semeadura das células.
- Adicione 400 μL da suspensão da célula diluída aos leitos LrECM preparados (etapa 1.4), garantindo cuidadosamente não perturbar a cama lrECM. Incubar a 37 °C em uma incubadora umidificada de 5% de CO2 .
2. Tratamento PAF
- Adicione PAF 3 h após a semeadura das células. Prepare um estoque de 100 μM de PAF em PBS e adicione o volume necessário de 0,2 μL em cada poço (o que corresponde a 200 nM).
- Adicione a mesma concentração de PAF durante cada alteração de mídia.
3. Re-alimentação com mídia fresca
- Reabastecer as células com meio fresco a cada 4 dias (ou seja, dia 4, dia 8, dia 12 e dia 16).
4. Estudo de imunofluorescência para detectar alterações fenotípicas induzidas pela exposição prolongada ao PAF
- Após 20 dias de cultivo, cuidadosamente pipeta o meio de cada poço e lave os poços com 400 μL de PBS pré-aquecido.
- Fixar as estruturas acinar adicionando 400 μL de 4% de paraformaldeído (recém-preparado por diluição de 16% de paraformaldeído em 1x PBS) e incubação por 20 minutos à temperatura ambiente.
- Enxágüe os poços uma vez com PBS gelado e permeabilize com PBS contendo 0,5% Triton X-100 por 10 min a 4 °C.
- Depois de 10 min, imediatamente mas cuidadosamente pipeta a solução Triton-X 100 e enxágue com 400 μL de PBS-glicina (recém-preparada adicionando uma pitada de glicina em 1x PBS). Isso é repetido três vezes por 15 minutos cada.
- Adicione 400 μL da solução de bloqueio primário que compreende 10% de soro de cabra (ver Tabela de Materiais) no tampão de imunofluorescência (IF) e incubar à temperatura ambiente por 60 minutos.
NOTA: Composição do buffer IF: 0,05% azida de sódio, 0,1% BSA, 0,2% Triton-X 100 e 0,05% Tween (20 em 1 PBS). - Remova a solução de bloqueio primário, adicione 200 μL de anticorpo de bloqueio secundário de 2% (F(ab')2 fragmento de anticorpo levantado em cabra contra antígeno de camundongos, veja Tabela de Materiais) preparado em solução de bloqueio primário e deixe-o por 45-60 min à temperatura ambiente.
- Prepare o anticorpo primário (ver Tabela de Materiais) em solução de anticorpos de bloqueio secundário de 2% em uma diluição de 1:100. Depois de remover a solução de bloqueio secundário, adicione o anticorpo recém-preparado e incubar durante a noite a 4 °C.
- A etapa anterior pode provocar liquefação da membrana do porão. Antes de prosseguir com o experimento, espere até que o slide atinja a temperatura ambiente. Pipete cuidadosamente a solução de anticorpos primários e lave-a três vezes com 400 μL de tampão IF.
- Durante a última lavagem com tampão IF, prepare uma diluição de 1:200 do anticorpo secundário conjugado por fluorohore (ver Tabela de Materiais) na solução de bloqueio primária. Incubar os slides na solução de anticorpos secundários por 40-60 min em temperatura ambiente.
- Enxágüe os slides com 400 μL de tampão IF por 20 minutos, seguido por duas lavagens com PBS por 10 minutos cada.
- Contra-colori a contrapeso dos núcleos com PBS contendo 0,5 ng/mL de mancha nuclear (ver Tabela de Materiais) por 5-6 min em temperatura ambiente. Lave os slides três vezes com 400 μL de PBS para remover o excesso de mancha.
- Pipeta cuidadosamente toda a PBS e garanta a remoção da solução residual. Adicione uma gota de reagente de montagem (ver Tabela de Materiais) em cada poço e deixe-o ficar à temperatura ambiente durante a noite.
- Armazene os slides à temperatura ambiente e imagem dos slides o mais rápido possível.
- Imagem abaixo de 40x ou 63x de ampliação em um microscópio confocal (ver Tabela de Materiais), tomando seções ópticas Z de tamanho de passo de 0,6 mm (NA = 1,4).
- Abra as imagens adquiridas com um software de processamento de imagens (ver Tabela de Materiais). Demonstre as diferenças morfológicas usando projeções 3D.
NOTA: A seção Z óptica mais central pode ser melhor usada para mostrar diferenças na localização de marcadores de polaridade. Estes podem ser quantificados manualmente para representar a porcentagem de esferoides mostrando esse padrão de coloração específico. - Para ilustrar diferenças na expressão das proteínas, realize uma análise semi-quantitativa medindo o valor cinza médio ou calculando a fluorescência celular total corrigida (CTCF)23. Represente os dados como gráficos de violino ou ponto.
Access restricted. Please log in or start a trial to view this content.
Resultados
As células MCF10A, após a exposição ao tratamento de PAF, formam estruturas acinar com fenótipos muito distintos. α6-integrin foi encontrado como deslocalizado com manchas mais apical. Alguns acini também mostraram manchas descontínuas (Figura 2A). Ambos os fenótipos indicam a perda da polaridade basal, evidenciada pela literatura24,25. Relatórios anteriores indicam o controverso papel do α6-integrin na metástase do cânc...
Access restricted. Please log in or start a trial to view this content.
Discussão
Modelos baseados em linhas celulares estabelecidos são amplamente utilizados para estudar o processo de carcinogênese. As culturas monocamadas das células continuam a fornecer insights sobre as várias vias de sinalização molecular que mediam mudanças características nas célulascancerosas 32. Estudos sobre o papel de oncogenes conhecidos como Ras, Myc e p53 mutado foram relatados pela primeira vez usando culturas monocamadas como o sistema modelo 33,34,35,36.
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não declaram potenciais conflitos de interesse.
Agradecimentos
Agradecemos ao IISER Pune Microscopy Facility pelo acesso a equipamentos e infraestrutura e suporte para os experimentos. Este estudo foi apoiado por uma bolsa do Departamento de Biotecnologia (DBT), Govt. da Índia (BT/PR8699/MED/30/1018/2013), Conselho de Pesquisa em Ciência e Engenharia (SERB), Govt. of India (EMR/2016/001974) e em parte pelo IISER, fundo Pune Core. A. K. foi financiada pela bolsa CSIR-SRF, L.A. foi financiada através de bolsa DST-INSPIRE, V.C foi financiada pela DBT (BT/PR8699/MED/30/1018/2013).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin EDTA | Invitrogen | 25300062 | |
| 16% paraformaldehyde | Alfa Aesar | AA433689M | |
| Anti Mouse Alexa Flour 488 | Invitrogen | A11029 | |
| Anti Rabbit Alexa Flour 488 | Invitrogen | A-11008 | |
| BSA | Sigma | A7030 | |
| Chamber Coverglass | Nunc | 155409 | |
| Cholera Toxin | Sigma | C8052-1MG | 1 mg/mL in dH2O |
| Confocal Microscope | Leica | Leica SP8 | |
| DMEM | Gibco | 11965126 | |
| EDTA | Sigma | E6758 | |
| EGF | Sigma | E9644-0.2MG | 100 mg/mL in dH2O |
| F(ab’)2 fragment of antibody raised in goat against mouse antigen | Jackson Immunoresearch | 115-006-006 | |
| GM130 antibody | Abcam | ab52649 | |
| Goat Serum | Abcam | ab7481 | |
| Hoechst | Invitrogen | 33258 | |
| Horse Serum | Gibco | 16050122 | |
| Hydrocortisone | Sigma | H0888 | 1 mg/mL in ethanol |
| Image Processing Software | ImageJ | ||
| Insulin | Sigma | I1882 | 10 mg/mL stock dH2O |
| lrECM (Matrigel) | Corning | 356231 | |
| Mounting reagent (Slow fade Gold Anti-fade) | Invitrogen | S36937 | |
| Nuclear Stain (Hoechst) | Invitrogen | 33258 | |
| PAF | Cayman Chemicals | 91575-58-5 | Methylcarbamyl PAF C-16, procured as a 10 mg/mL in ethanol |
| Penicillin-Streptomycin | Lonza | 17-602E | |
| Sodium Azide | Sigma | S2002 | |
| Tris Base | Sigma | B9754 | |
| Triton X-100 | Sigma | T8787 | |
| Tween 20 | Sigma | P9416 | |
| Vimentin antibody | Abcam | ab92547 | |
| α6-integrin antibody | Millipore | MAB1378 |
Referências
- Lacroix, M., Leclercq, G. Relevance of breast cancer cell lines as models for breast tumours: an update. Breast Cancer Research and Treatment. 83 (3), 249-289 (2004).
- Vargo-Gogola, T., Rosen, J. M. Modelling breast cancer: one size does not fit all. Nature Reviews Cancer. 7 (9), 659-672 (2007).
- Runswick, S. K., O'Hare, M. J., Jones, L., Streuli, C. H., Garrod, D. R. Desmosomal adhesion regulates epithelial morphogenesis and cell positioning. Nature Cell Biology. 3 (9), 823-830 (2001).
- Streuli, C. H., Bailey, N., Bissell, M. J. Control of mammary epithelial differentiation: basement membrane induces tissue-specific gene expression in the absence of cell-cell interaction and morphological polarity. Journal of Cell Biology. 115 (5), 1383-1395 (1991).
- Streuli, C. H., et al. Laminin mediates tissue-specific gene expression in mammary epithelia. Journal of Cell Biology. 129 (3), 591-603 (1995).
- Bissell, M. J., Kenny, P. A., Radisky, D. C. Microenvironmental regulators of tissue structure and function also regulate tumor induction and progression: the role of extracellular matrix and its degrading enzymes. Cold Spring Harbor Symposia on Quantitative Biology. 70, 343-356 (2005).
- Heinrich, E. L., et al. The inflammatory tumor microenvironment, epithelial mesenchymal transition and lung carcinogenesis. Cancer Microenvironment. 5 (1), 5-18 (2012).
- Gonda, T. A., Tu, S., Wang, T. C. Chronic inflammation, the tumor microenvironment and carcinogenesis. Cell Cycle. 8 (13), 2005-2013 (2009).
- Berdyshev, E. V., Schmid, P. C., Krebsbach, R. J., Schmid, H. H. Activation of PAF receptors results in enhanced synthesis of 2-arachidonoylglycerol (2-AG) in immune cells. The FASEB Journal. 15 (12), 2171-2178 (2001).
- Rola-Pleszczynski, M., Stankova, J. Cytokine gene regulation by PGE(2), LTB(4) and PAF. Mediators of Inflammation. 1 (2), 5-8 (1992).
- Bussolati, B., et al. PAF produced by human breast cancer cells promotes migration and proliferation of tumor cells and neo-angiogenesis. The American Journal of Pathology. 157 (5), 1713-1725 (2000).
- Chakravarty, V., et al. Prolonged exposure to platelet activating factor transforms breast epithelial cells. Frontiers in Genetics. 12, 634938(2021).
- Chen, J., et al. Platelet-activating factor receptor-mediated PI3K/AKT activation contributes to the malignant development of esophageal squamous cell carcinoma. Oncogene. 34 (40), 5114-5127 (2015).
- Chen, J., et al. Feed-forward reciprocal activation of PAFR and STAT3 regulates epithelial-mesenchymal transition in non-small cell lung cancer. Cancer Research. 75 (19), 4198-4210 (2015).
- Vidi, P. A., Bissell, M. J., Lelievre, S. A. Three-dimensional culture of human breast epithelial cells: the how and the why. Methods in Molecular Biology. 945, 193-219 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Barcellos-Hoff, M. H., Aggeler, J., Ram, T. G., Bissell, M. J. Functional differentiation and alveolar morphogenesis of primary mammary cultures on reconstituted basement membrane. Development. 105 (2), 223-235 (1989).
- Petersen, O. W., Ronnov-Jessen, L., Howlett, A. R., Bissell, M. J. Interaction with basement membrane serves to rapidly distinguish growth and differentiation pattern of normal and malignant human breast epithelial cells. Proceedings of the National Academy of Sciences. 89 (19), 9064-9068 (1992).
- Shaw, K. R., Wrobel, C. N., Brugge, J. S. Use of three-dimensional basement membrane cultures to model oncogene-induced changes in mammary epithelial morphogenesis. Journal of Mammary Gland Biology and Neoplasia. 9 (4), 297-310 (2004).
- Weaver, V. M., Fischer, A. H., Peterson, O. W., Bissell, M. J. The importance of the microenvironment in breast cancer progression: recapitulation of mammary tumorigenesis using a unique human mammary epithelial cell model and a three-dimensional culture assay. Biochemistry and Cell Biology. 74 (6), 833-851 (1996).
- Lee, G. Y., Kenny, P. A., Lee, E. H., Bissell, M. J. Three-dimensional culture models of normal and malignant breast epithelial cells. Nature Methods. 4 (4), 359-365 (2007).
- Bodakuntla, S., Libi, A. V., Sural, S., Trivedi, P., Lahiri, M. N-nitroso-N-ethylurea activates DNA damage surveillance pathways and induces transformation in mammalian cells. BMC Cancer. 14, 287(2014).
- Banerjee, A., et al. A rhodamine derivative as a "lock" and SCN− as a "key": visible light excitable SCN− sensing in living cells. Chemical Communications. 49 (25), 2527-2529 (2013).
- Ren, G., et al. Reduced basal nitric oxide production induces precancerous mammary lesions via ERBB2 and TGFbeta. Scientific Reports. 9 (1), 6688(2019).
- Anandi, L., Chakravarty, V., Ashiq, K. A., Bodakuntla, S., Lahiri, M. DNA-dependent protein kinase plays a central role in transformation of breast epithelial cells following alkylation damage. Journal of Cell Science. 130 (21), 3749-3763 (2017).
- Sonnenberg, A., et al. Integrin alpha 6/beta 4 complex is located in hemidesmosomes, suggesting a major role in epidermal cell-basement membrane adhesion. Journal of Cell Biology. 113 (4), 907-917 (1991).
- Pignatelli, M., Cardillo, M. R., Hanby, A., Stamp, G. W. Integrins and their accessory adhesion molecules in mammary carcinomas: loss of polarization in poorly differentiated tumors. Human Pathology. 23 (10), 1159-1166 (1992).
- Natali, P. G., et al. Changes in expression of alpha 6/beta 4 integrin heterodimer in primary and metastatic breast cancer. British Journal of Cancer. 66 (2), 318-322 (1992).
- Davis, T. L., Cress, A. E., Dalkin, B. L., Nagle, R. B. Unique expression pattern of the alpha6beta4 integrin and laminin-5 in human prostate carcinoma. Prostate. 46 (3), 240-248 (2001).
- Liu, J. S., Farlow, J. T., Paulson, A. K., Labarge, M. A., Gartner, Z. J. Programmed cell-to-cell variability in Ras activity triggers emergent behaviors during mammary epithelial morphogenesis. Cell Reports. 2 (5), 1461-1470 (2012).
- Liu, C. Y., Lin, H. H., Tang, M. J., Wang, Y. K. Vimentin contributes to epithelial-mesenchymal transition cancer cell mechanics by mediating cytoskeletal organization and focal adhesion maturation. Oncotarget. 6 (18), 15966-15983 (2015).
- Kapalczynska, M., et al. 2D and 3D cell cultures-a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Schulze, A., Lehmann, K., Jefferies, H. B., McMahon, M., Downward, J. Analysis of the transcriptional program induced by Raf in epithelial cells. Genes & Development. 15 (8), 981-994 (2001).
- McCarthy, S. A., Samuels, M. L., Pritchard, C. A., Abraham, J. A., McMahon, M. Rapid induction of heparin-binding epidermal growth factor/diphtheria toxin receptor expression by Raf and Ras oncogenes. Genes & Development. 9 (16), 1953-1964 (1995).
- Willis, A., Jung, E. J., Wakefield, T., Chen, X. Mutant p53 exerts a dominant negative effect by preventing wild-type p53 from binding to the promoter of its target genes. Oncogene. 23 (13), 2330-2338 (2004).
- Haupt, S., Raghu, D., Haupt, Y. Mutant p53 drives cancer by subverting multiple tumor suppression pathways. Frontiers in Oncology. 6, 12(2016).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6(2018).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. ASSAY and Drug Development Technologies. 12 (4), 207-218 (2014).
- Lv, D., Hu, Z., Lu, L., Lu, H., Xu, X. Three-dimensional cell culture: A powerful tool in tumor research and drug discovery. Oncology Letters. 14 (6), 6999-7010 (2017).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33(2020).
- Saraiva, D. P., Matias, A. T., Braga, S., Jacinto, A., Cabral, M. G. Establishment of a 3D co-culture with MDA-MB-231 breast cancer cell line and patient-derived immune cells for application in the development of immunotherapies. Frontiers in Oncology. 10, 1543(2020).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados