Method Article
Uso de imagens in vivo para rastrear fenótipos de morfogênese em cepas mutantes de Candida albicans durante a infecção ativa em um hospedeiro mamífero
Neste Artigo
Resumo
Este manuscrito descreve um método para triagem de bibliotecas mutantes de Candida albicans de tamanho moderado para fenótipos de morfogênese durante a infecção ativa em um hospedeiro mamífero usando microscopia confocal não invasiva.
Resumo
Candida albicans é um importante patógeno humano. Sua capacidade de alternar entre formas morfológicas é central para sua patogênese; essas alterações morfológicas são reguladas por uma complexa rede de sinalização controlada em resposta a estímulos ambientais. Esses componentes reguladores têm sido altamente estudados, mas quase todos os estudos usam uma variedade de estímulos in vitro para desencadear a filamentação. Para determinar como a morfogênese é regulada durante o processo de patogênese, desenvolvemos um sistema de microscopia in vivo para obter imagens de alta resolução espacial de organismos submetidos à formação de hifas dentro do hospedeiro mamífero. O protocolo aqui apresentado descreve o uso deste sistema para rastrear pequenas coleções de cepas mutantes de C. albicans, permitindo identificar os principais reguladores da morfogênese à medida que ocorre no local da infecção. Resultados representativos são apresentados, demonstrando que alguns reguladores da morfogênese, como o regulador transcricional Efg1, têm fenótipos consistentes in vitro e in vivo, enquanto outros reguladores, como a adenil ciclase (Cyr1), têm fenótipos in vivo significativamente diferentes em comparação com in vitro.
Introdução
Candida albicans é um patógeno fúngico humano comum, causando doença mucocutânea, doença disseminada e infecções teciduais localizadas1. Uma característica fundamental da fisiologia de C. albicans é o seu complexo crescimento polimórfico, que está ligado ao seu papel como comensal e patógeno 2,3,4. Sob ricas condições nutricionais in vitro a 30 °C, normalmente cresce como uma levedura de brotamento ovoide. Uma variedade de gatilhos ambientais, incluindo privação de nutrientes, alterações de pH, crescimento a 37 °C, exposição ao soro e crescimento quando incorporado em ágar, resultam na transição para um padrão de crescimento polarizado, resultando na formação de hifas verdadeiras e/ou pseudo-hifas5. O início do crescimento polarizado e o crescimento resultante de organismos filamentosos é referido como morfogênese.
Devido à importância da morfogênese na virulência do organismo, a regulação da formação de hifas tem sido extensivamente estudada 6,7. Existe uma complexa rede de vias de sinalização e regulação transcricional que desencadeia a morfogênese. Apesar da relação da morfogênese de C. albicans com a patogênese, a maioria dos estudos que investigam a morfogênese tem utilizado estímulos in vitro para desencadear a formação de hifas. Está se tornando cada vez mais claro que os vários modelos in vitro de filamentação não são idênticos em termos das vias reguladoras individuais estimuladas. Além disso, nenhuma condição de crescimento in vitro corresponde fortemente ao ambiente complexo do hospedeiro. Dada a importância de C. albicans como patógeno humano, o objetivo deste protocolo é investigar sua morfogênese durante a infecção ativa em um hospedeiro mamífero usando um sistema com rendimento moderado, permitindo assim que um investigador rastreie bibliotecas mutantes de C. albicans.
Para facilitar essas investigações, foi desenvolvido um sistema de imagem in vivo que permite obter imagens de alta resolução espacial de células de C. albicans durante a infecção do pavilhão auricular de um camundongo anestesiado utilizando microscópio confocal invertido8,9,10. Como a pele do pavilhão auricular é bastante fina, essas imagens podem ser obtidas sem a necessidade de dissecção tecidual. Assim, os dados quantitativos do fenótipo podem ser medidos no local das infecções ativas dentro do tecido hospedeiro. O protocolo aqui descrito envolve a transformação de uma cepa de referência e uma ou mais cepas mutantes com diferentes fluorescentes de expressão proteica11,12. As cepas fluorescentes que expressam proteínas são então misturadas e co-injetadas por via intradérmica. Depois que a infecção é estabelecida, a imagem confocal é usada para quantificar a frequência de filamentação e o comprimento dos filamentos formados. Os dados obtidos das cepas mutantes são normalizados aos obtidos a partir da cepa de referência, que está presente na mesma região tecidual, proporcionando assim um controle interno. Este sistema permitiu-nos rastrear com sucesso várias séries de estirpes mutantes de C. albicans, muitas das quais apresentam defeitos de morfogénese in vitro 9,10. Muitas dessas cepas filamentam prontamente in vivo, destacando a importância de modelos in vivo para a investigação da morfogênese.
Protocolo
Os estudos deste protocolo foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Iowa (IACUC). Consulte as diretrizes do CDC para equipamentos e procedimentos para trabalhar com organismos BSL213.
1. Preparação de cepas de Candida albicans
- Identificar uma cepa de referência apropriada para uso como controle positivo. Certifique-se de que esta estirpe corresponda de perto às estirpes experimentais em termos de sua linhagem e manipulações genéticas.
NOTA: Para os experimentos representativos aqui apresentados, os mutantes foram criados a partir das cepas descritas em Homann, et al.14, que foram construídas a partir da SN152. Esses mutantes são Arg-. Portanto, a cepa de referência selecionada foi a SN250, que também foi criada a partir da SN152 e também é Arg-. Estressores nutricionais são críticos na regulação do crescimento polarizado na levedura Saccharomyces cerevisiae15; também têm sido implicados na filamentação de C. albicans e outros fungos16,17,18. Portanto, a cepa de referência deve ser combinada para auxotrofias com as cepas experimentais sempre que possível para evitar potenciais efeitos de confusão do estresse nutricional. - Escolha construções de expressão de proteínas fluorescentes. Ao rastrear uma variedade de cepas experimentais, crie uma cepa de referência que expresse uma proteína fluorescente e use outras proteínas fluorescentes para marcar as cepas mutantes.
NOTA: Os dados representativos aqui apresentados utilizam NEON para a estirpe de referência e iRFP para as estirpes mutantes. Qualquer proteína fluorescente pode ser usada se for altamente expressa, relativamente brilhante e capaz de ser excitada / detectada pelo microscópio que está sendo usado. Experimentos de controle comparando cepas de referência que expressam diferentes proteínas fluorescentes não demonstraram qualquer impacto da expressão de proteínas fluorescentes na morfogênese. - Transforme as cepas com construções de expressão de proteínas fluorescentes.
NOTA: Muitas instituições exigem o uso de precauções de Nível de Segurança Biológica 2 para o trabalho com C. albicans. Todo o trabalho deve seguir os regulamentos de segurança locais. Independentemente dos regulamentos locais, os investigadores que trabalham com C. albicans devem ser treinados no manuseio seguro do organismo.- Transformar as cepas de referência e experimentais utilizando protocolos padrão de acetato de lítio19.
NOTA: Os experimentos aqui descritos utilizam os plasmídeos pENO1-NEON-NAT R e pENO1-iRFP-NATR, generosamente fornecidos pelo Dr. Robert Wheeler 11,12. Os plasmídeos foram linearizados utilizando NotI9. - Selecione os transformadores com base no crescimento em nourseotricina ou outro meio de seleção relevante.
- Identifique transformadores bem-sucedidos. Escolha um pequeno pedaço de células de cada colônia usando um palito de dente e, em seguida, misture-as em uma gota de água de 2,5 μL em uma lâmina de microscópio. Aplique uma folha de cobertura e examine com uma ampliação de 10x-40x. Examine com um sistema de imagem confocal (usado para o resto do protocolo) ou qualquer microscópio de fluorescência de campo largo padrão. Os transformadores apropriados terão um sinal brilhante com excitação apropriada e comprimentos de onda de emissão.
NOTA: Para os resultados representativos, as deformações expressas NEON foram visualizadas usando um microscópio de fluorescência vertical com um filtro passa-longa com um filtro de excitação passa-banda de 472/30 nm, um filtro de emissão passa-banda de 520/35 nm e um divisor de feixe dicroico de borda única de 495 nm. Como o iRFP não é visível a olho, as cepas expressas do iRFP foram visualizadas usando o sistema de microscopia confocal usado para imagens in vivo , usando um laser de 638 nm para excitação e detectando a luz de emissão de 655-755 nm.- Alternativamente, avalie a fluorescência macroscópica de colônias usando estereomicroscopia de fluorescência, sistemas de excitação de fluorescência portáteis ou sistemas de detecção de fluorescência normalmente usados para géis e Western blots.
- Crie estoques de freezer de transformadores selecionados.
- Transformar as cepas de referência e experimentais utilizando protocolos padrão de acetato de lítio19.
- Inocular meios sólidos YPD (extrato de levedura peptona dextrose) com uma referência fluorescente de expressão de proteínas e cepas experimentais de estoques de freezer 3 dias antes da injeção, usando um palito de dente para transferir um pouco de organismos do estoque do freezer para o meio sólido YPD. Incubar a 30 °C durante 2 dias.
- Para cada estirpe, inocular um balão contendo 25 ml de YPD com células de C. albicans retiradas de várias colónias 1 dia antes da injeção. Faça isso usando um palito de dente para transferir um punhado de organismos de uma colônia para o YPD; repita várias vezes para obter células de várias colônias diferentes. Incubar durante a noite a 30 °C numa incubadora agitadora orbital a 175 rpm.
NOTA: É importante utilizar múltiplas colônias como fonte de inóculo porque C. albicans tem uma alta frequência de alterações genéticas espontâneas. O uso de múltiplas colônias ao iniciar a cultura de inóculo minimiza a chance de que todos os organismos do inóculo surjam de um pai com alterações espontâneas significativas. - No dia da injeção:
- Centrifugar 1 mL da cultura por 2 min a 500 x g.
- Lavar a cultura três vezes com 1 mL de solução salina tamponada com fosfato de Dulbecco estéril (dPBS). Após a lavagem final, ressuspender o pellet em 1 mL de dPBS estéril.
- Diluir uma amostra da cultura lavada à 1:100 e contar usando um hemocitômetro.
- Ajustar a densidade da cultura lavada para 1 x 108 organismos por mL usando dPBS.
- Para cada conjunto de estirpes a injectar, criar o inóculo misturando volumes iguais da estirpe de referência e das estirpes experimentais. Isso mantém a densidade do inóculo em 1 x 108 organismos por mL.
NOTA: O número de cepas que podem ser avaliadas por orelha é limitado pela capacidade do sistema de microscopia usado para discriminar claramente o sinal de cada proteína fluorescente. - Uma vez que o inóculo é preparado, prossiga diretamente para as injeções do animal. Não guarde o inóculo antes da utilização.
2. Preparação animal
- Obter a aprovação do Comitê Institucional de Cuidados e Uso de Animais local ou do órgão governamental local relevante.
- Obtenha camundongos de 6 a 12 semanas de idade de um fornecedor ou programa de reprodução. Hospede camundongos na instalação em que viverão durante todo o experimento por pelo menos 1 semana antes da inoculação.
NOTA: Para os resultados representativos, foram utilizadas camundongos DBA2/N fêmeas de 6 semanas de idade. - Alimente os animais com ração isenta de clorofila durante, pelo menos, 7 dias antes da inoculação.
3. Depilação e inoculação
- Induzir um plano cirúrgico de anestesia (Figura 1).
CUIDADO: Os agentes anestésicos inalados são materiais perigosos e podem causar irritação nos olhos ou na pele, bem como toxicidade no sistema nervoso. Todas as políticas e procedimentos institucionais e práticas gerais de segurança laboratorial para o uso de anestésicos inalatórios devem ser seguidos. Somente indivíduos treinados no uso de anestésicos inalatórios podem realizar essas etapas. As práticas padrão incluem o uso de luvas, um jaleco de laboratório, proteção ocular, uso de um sistema de limpeza de anestesia e manutenção cuidadosa de registros de acordo com as diretrizes institucionais.- Coloque um rato em uma câmara de indução de anestesia pré-aquecida. Mantenha o animal em um ambiente quente durante a anestesia geral. Realize isso usando almofadas de aquecimento projetadas para essa finalidade e um estágio de microscópio aquecido. Não use uma almofada de aquecimento sem receita, pois pode superaquecer e causar queimaduras.
- Fornecer isoflurano de 2% a 3% à câmara de indução até que o rato tenha perdido o seu reflexo de endireitamento e as respirações sejam lentas e estáveis. Purgar a câmara de indução da anestesia e transferir o animal para um cone nasal sem rebreather fornecendo isoflurano a 1% a 2%.
- Valide o plano de anestesia usando o reflexo de pinça do dedo do pé ou outros mecanismos de verificação. Ao longo do experimento, monitore o padrão respiratório e o plano anestésico do animal e ajuste a concentração anestésica conforme necessário.
- Aplique lubrificante ocular para evitar a dessecação da córnea.
- Depilação (Figura 1C,D)
- Aplique um creme depilatório sem receita médica liberalmente na superfície interna e externa de ambas as orelhas usando um cotonete com ponta de algodão.
- Após 2-3 min (ou de acordo com as instruções do fabricante), limpe suavemente a orelha com uma gaze seca para remover todo o creme e cabelo. Limpe mais duas vezes com compressas de gaze saturadas em água estéril para remover completamente o resíduo de creme depilatório. A falha em remover todo o creme depilatório resultará em irritação / inflamação da pele.
- Injeção (Figura 1E, F)
- Limpe a superfície do ouvido para ser injetado com uma gaze saturada em etanol a 70% e deixe secar ao ar.
- Misture bem o inóculo invertendo várias vezes ou vortexando.
- Desenhe 20-30 μL de inóculo numa seringa de insulina. Segurando a agulha apontando para cima, toque suavemente na seringa para garantir que qualquer ar no cano esteja no topo. Ejete cuidadosamente o ar e o excesso de inóculo de volta para o tubo de inóculo ou um tubo de resíduos, de modo que o êmbolo esteja na marca de 10 μL.
- Usando um dedal em um dedo ou polegar da mão não dominante, estabilize a orelha envolvendo-a através do dedal. Alternativamente, aplique fita de pele de dupla face sem receita médica (fita de moda) em um pequeno tubo de plástico cônico ou de fundo redondo e coloque a orelha em toda a fita. Tome cuidado para não desalojar o cone do nariz de anestesia ao fazer isso. Pode ser útil colar o cone nasal na superfície de trabalho.
NOTA: O lado interno ou externo do ouvido pode ser injetado com base no conforto físico do investigador. Para microscopia, certifique-se de colocar o mouse de modo que o lado da orelha injetada esteja voltado para a lente objetiva. - Mantendo a agulha da seringa quase completamente paralela à pele e evitando veias grandes, insira a ponta da agulha na camada mais externa da pele até que o bisel esteja apenas coberto.
- Injete lentamente o inóculo por via intradérmica. Uma boa injeção intradérmica levantará uma pequena bolha na pele. Mantenha a agulha no lugar por 15-20 s antes de removê-la da orelha para minimizar o vazamento.
- Se o lado inferior da orelha do animal ficar úmido, a agulha era muito profunda e passava pela orelha inteiramente. Nesse caso, repita a injeção em uma área diferente da orelha.
- Repita o processo usando a outra orelha do animal. Isso pode ser feito com as mesmas cepas de C. albicans para uma réplica ou com um conjunto diferente de cepas de C. albicans.
- Se não houver imagem imediata, coloque o animal em uma câmara de recuperação aquecida. Observe o animal até que ele tenha se recuperado da anestesia e, em seguida, devolva-o à sua gaiola de alojamento.
- Seguindo os protocolos institucionais, marque claramente a gaiola com rótulos de risco biológico e indique que os animais da gaiola estão infectados com Candida albicans.
- Preencha todos os registros necessários relacionados à anestesia animal e quaisquer outras práticas institucionais necessárias.
- Abrigar o animal em condições de instalação animal usando precauções de Nível 2 de Segurança Biológica Animal.
4. Quantificar a morfogênese in vitro para comparação com os resultados in vivo
- Usando as mesmas culturas lavadas que foram usadas para preparar o inóculo, criar uma diluição de 1:50 de organismos em RPMI1640 + 10% de soro fetal bovino inativado pelo calor e incubar a 37 °C com tombo por 4 h. Alternativamente, outros meios que estimulam a morfogênese in vitro podem ser usados.
- Centrifugar a amostra por 5 min a 500 x g e ressuspender em 0,5 mL de dPBS.
- Diluir a amostra numa proporção de 1:10, colocar 2,5 μL da amostra diluída numa lâmina de microscópio e cobri-la com uma folha de cobertura.
- Examine a amostra usando um microscópio de fluorescência. Conte pelo menos 100 células, registrando o número de leveduras e células filamentosas para cada cepa. Nos resultados representativos aqui apresentados, uma célula filamentosa é definida como qualquer célula com um comprimento superior a duas vezes o comprimento da célula-mãe.
NOTA: A quantificação da morfogênese in vitro pode ser feita no mesmo dia da inoculação dos animais. É possível iniciar o ensaio de morfogênese in vitro durante o preparo do inóculo para injeção e realizar a inoculação dos animais durante o período de incubação de 4 h. Se todos os procedimentos em animais estiverem concluídos antes do final do período de incubação de 4 h, proceder directamente ao exame das células estimuladas in vitro . Alternativamente, as células podem ser ressuspensas em formaldeído a 3,7% em dPBS (na etapa 4.2) e armazenadas a 4 °C por vários dias. Os organismos fixos podem então ser quantificados conforme o tempo permitir. A inoculação dos animais não deve ser atrasada para o ensaio de quantificação in vitro .
5. Preparação para imagens in vivo
- Prepare o microscópio (Figura 2A).
- Ligue todo o equipamento de microscopia e inicie o software de imagem.
- Se disponível, carregue todas as configurações de imagem predeterminadas.
- Ative os lasers e detectores necessários para detectar as proteínas fluorescentes que estão sendo usadas.
- Ligue o estágio aquecido do microscópio e deixe-o aquecer a 37 °C.
NOTA: É possível usar um microscópio com uma câmara ambiental totalmente fechada em vez de um estágio aquecido. - Defina um ponto de referência do eixo z com o plano de foco na superfície superior da tampa. Isso pode ser feito colando uma tampa no lugar sobre a abertura do palco e colocando uma gota de água na folha de cobertura. Use um objetivo "seco" de ampliação inferior (10x) para se concentrar na borda da gota de água e, em seguida, defina o ponto de referência do eixo z. Use um pedaço de toalha para absorver a água da tampa antes de removê-la do palco.
- Gire a objetiva de distância de trabalho muito longa no lugar e coloque uma gota de fluido de imersão na lente. Abaixe a lente para evitar possíveis danos ao colocar a tampa.
- Coloque uma tampa #1.5 sobre a abertura do palco e cole-a no lugar. Certifique-se de que a fita cubra totalmente todas as bordas da tampa para evitar que qualquer fluido penetre abaixo da tampa no microscópio. Levante a objetiva até o ponto de referência do eixo z para que o fluido de imersão esteja em contato com a lente objetiva e a tampa.
- Prepare vários pedaços de fita sensível à pressão para que estejam prontos para uso ao posicionar o cone nasal e o mouse.
- Ligue todo o equipamento de microscopia e inicie o software de imagem.
- Induzir a anestesia geral no rato a ser fotografada como acima (passo 3.1).
- Posicione o mouse (Figura 2B-D).
- Fixe um cone de anestesia no estágio do microscópio com o cone nasal posicionado de modo que ele cubra totalmente o nariz do animal quando o animal estiver em posição para imagem. Isso pode ser feito mais facilmente com dois investigadores. Peça ao primeiro investigador que coloque o nariz do rato anestesiado no cone nasal e mova o rato para a posição para a imagem, continuando a segurar o cone nasal sobre o nariz do animal. Peça ao outro investigador que coloque o cone nasal e a tubulação no lugar para que ele fique estável sobre o nariz do rato. Uma vez que o cone nasal é gravado no lugar, deixe-o lá para o restante da sessão de imagem.
- Depois de estabelecer o melhor lugar para colocar o nariz, observe sua posição. Para sessões de imagem subsequentes, o cone nasal pode ser fixado ao estágio antes de trazer um animal ao microscópio.
- Coloque uma gota de água estéril na tampa acima da lente objetiva.
- Posicione o rato no palco do microscópio. Certifique-se de que a orelha esteja em cima da gota de água e plana contra a tampa.
- Use uma segunda tampa (superior) para achatar a orelha.
- Coloque a borda da tampa paralela ao corpo do mouse, com a borda tocando o mouse onde a orelha encontra a cabeça.
- Abaixe a borda livre da tampa para o estágio do microscópio com um movimento de dobradiça. À medida que a tampa vem contra o estágio do microscópio, ela achatará a orelha. Tome cuidado para não criar dobras ou sulcos no ouvido.
- Cole a tampa superior no lugar de forma segura para que ela mantenha pressão suficiente para manter a orelha plana. Tome cuidado para não pegar o cabelo do rato ou bigodes na fita.
- A menos que um microscópio com uma câmara ambiental seja usado, cubra vagamente o corpo do rato com uma cortina estéril para manter um ambiente normotérmico.
- Identifique um campo de interesse.
- Certifique-se de que o objetivo esteja no ponto de referência do eixo z.
- Usando imagens de luz branca/campo amplo, ajuste o plano de foco no tecido da orelha. Uma boa estratégia é se concentrar nos vasos sanguíneos - se alguém pode ver os glóbulos vermelhos se movendo nos vasos sanguíneos, o plano de foco está dentro do tecido.
- Se o microscópio estiver equipado com capacidade de fluorescência de campo amplo, use-o para identificar um campo de interesse. Caso contrário, use imagens confocais. Em geral, o uso de microscopia de campo amplo para identificar áreas de interesse é mais rápido e requer menos irradiação do tecido do ouvido.
- Usando um cubo de filtro para detecção da proteína fluorescente expressa na cepa de referência, identifique um campo de visão que tenha um sinal fluorescente da cepa de referência. Tenha em mente que a luz fora de foco provavelmente impedirá a capacidade de se concentrar em organismos individuais. O objetivo desta etapa é identificar uma área de interesse para imagens confocais.
- Mude para um cubo de filtro que detectará a proteína fluorescente expressa pela(s) cepa(s) experimental(is) e verificará sua presença no campo de visão selecionado.
6. Imagens
- Determine as configurações.
- Enquanto o software de imagem estiver no modo confocal ao vivo, examine o campo de interesse à medida que o plano focal é movido através do eixo z. Escolha um plano de eixo z com um sinal forte de todas as proteínas fluorescentes que estão sendo usadas.
- Ajuste a potência do laser e/ou a velocidade de imagem para obter um sinal forte o suficiente para que a morfologia possa ser determinada para todas as células no campo de visão. Para evitar danos nos tecidos, use a menor potência de laser possível.
NOTA: Tal como acontece com todas as imagens, há um equilíbrio entre a potência do laser, a velocidade de aquisição e a resolução. Identifique as configurações que identificam claramente a morfologia do organismo, equilibrando a velocidade e a potência do laser para minimizar a irradiação do tecido do ouvido. Como a imagem está ocorrendo através da derme externa, é necessária maior potência do laser para a excitação do que normalmente é necessário para a imagem confocal de amostras tradicionais montadas em lâminas. Felizmente, o nível de resolução espacial necessário para a análise da morfologia não é extremo. Assim, a obtenção de imagens com um sinal suficiente para determinar a morfologia do organismo sem causar danos teciduais é facilmente alcançável. - Uma vez que esses parâmetros são estabelecidos, use-os durante toda a sessão de imagem para servir como ponto de partida para sessões de imagem subsequentes. Portanto, é útil salvar as configurações de imagem.
NOTA: Áreas individuais de infecção podem ser mais rasas ou mais profundas dentro do tecido. Áreas mais profundas podem exigir um aumento na potência do laser. Como esse ensaio se baseia na distribuição espacial do sinal, e não em sua intensidade, é aceitável alterar as configurações de imagem entre os campos, conforme necessário.
- Obtenha as imagens.
- Escolha um campo de visão que tenha formação clara de filamentos na cepa de referência e onde a maioria dos organismos esteja espalhada o suficiente para que sua morfologia possa ser determinada.
- Defina os planos superior e inferior de foco para uma pilha z. Não é necessário cobrir toda a profundidade da área infectada, mas tenha em mente que os organismos na parte superior ou inferior do volume fotografado são tipicamente excluídos da análise.
- Adquira imagens z-stack, pseudocolora cada canal para distinguir cada cepa e sobreponha os canais. Salve as imagens.
- Repita para outros campos de exibição. A morfogênese pode variar de local para local; portanto, adquirir e analisar pelo menos três campos de cada orelha é importante.
7. Análise bidimensional manual: Frequência de filamentação
- Use um software de imagem para executar uma projeção máxima da pilha z em uma imagem bidimensional. As instruções fornecidas aqui são para FIJI/Image J.
- Abra imagens de microscopia usando o software ImageJ.
- Se necessário, aplique uma pseudo-cor em cada canal para permitir a identificação direta de cada cepa de C. albicans. Para isso, clique em Imagem > Tabela de Pesquisa > Cor da LUT e selecione a pseudocor escolhida.
- Converta o arquivo de pilha em uma imagem bidimensional de projeção de intensidade máxima:
- Selecione o arquivo z-stack. Clique em Image > Stacks > projeção Z.
- Selecione o plano superior e inferior e selecione o tipo de projeção Intensidade Máxima.
- Conte cada organismo visto nas imagens de projeção máxima por tipo de deformação (distinguido pela cor do canal) e morfologia.
- Organismos que estão significativamente sobrepostos ou áreas com densidade de organismos muito alta serão difíceis de contar com precisão. Exclua-os da contagem, mas tome cuidado para não introduzir viés contra formas filamentosas, que são mais propensas a se sobrepor.
- Formas filamentosas projetando-se diretamente para dentro ou para fora da pilha z aparecerão como pequenos objetos redondos em uma projeção máxima. Da mesma forma, os organismos que são cortados pela borda da imagem podem parecer levedura porque o filamento está fora do campo de visão. Assim, a análise bidimensional sempre superestimará a porcentagem de formas de levedura. Como isso ocorrerá igualmente com a(s) cepa(s) de referência e experimental(is), compare sempre os resultados experimentais com os de uma cepa de referência.
- Realizar comparações estatísticas dos resultados conforme ditado pelo delineamento experimental.
8. Análise bidimensional manual: Comprimento do filamento
- Para C. albicans, a formação de filamentos aberrantes pode ocorrer porque: a) menos células de levedura "mãe" sofrem morfogênese, b) filamentos crescem a uma taxa mais lenta, ou c) o crescimento filamentoso é iniciado, mas não mantido. Para avaliar essas possibilidades, quantifique o comprimento do caminho da curva de cada filamento na imagem de projeção máxima como um substituto para o verdadeiro comprimento tridimensional (discutido abaixo).
- Quando um broto está se desenvolvendo em uma célula-mãe, não é possível dizer se ele se tornará um filamento ou uma levedura. Para garantir que apenas as células filamentosas são incluídas nesta análise, meça apenas os organismos em que a célula-filha tenha pelo menos o dobro do comprimento da célula-mãe.
- Abra a imagem de projeção máxima criada na etapa 7.
- No conjunto de ferramentas do ImageJ, clique com o botão direito do mouse na ferramenta Linha reta/segmentada e escolha a opção Linha segmentada. A opção de linha segmentada permite ao usuário medir o comprimento do filamento ao longo de um caminho curvo, uma necessidade dada a plasticidade dos filamentos de C. albicans.
- Meça o comprimento do filamento desde o pescoço do botão até a extremidade de crescimento do filamento. Clique com o botão esquerdo do mouse no pescoço do botão; o ponteiro mudará para um pequeno quadrado. Trace o filamento ao longo de seu comprimento, clicando no centro do filamento cada vez que houver uma curva, giro ou mudança do eixo longo do filamento. Clique duas vezes na ponta de crescimento do filamento.
- Controle de Pressione + M. Isso abrirá uma janela pop-up que tabula as medidas de Área, Média, Mín, Máxima e Comprimento. Depois de medir cada filamento, pressione Control + M novamente para adicionar a medição de corrente à tabela de medições.
- Quando todos os filamentos tiverem sido medidos, copie e cole as medições de comprimento em um arquivo de análise de dados.
- Realizar análises estatísticas para avaliar a distribuição dos comprimentos dos filamentos na estirpe de referência e na estirpe mutante.
9. Análise tridimensional manual
- Para obter uma medida mais precisa da morfogênese que evite a superestimação das formas de levedura e possa permitir a discriminação entre pseudo-hifas e hifas, role manualmente para cima e para baixo através da pilha z enquanto avalia a morfologia de cada organismo em três dimensões.
- Alternativamente, crie uma imagem tridimensional de cada pilha z e analise a forma de cada organismo enquanto gira a imagem.
10. Análise automatizada
- Usando o software de imagem, automatize a enumeração de organismos e sua morfologia em duas ou três dimensões.
NOTA: Alguns algoritmos para a discriminação de tipos de morfologia podem introduzir viés. Assim, as estratégias de automação precisam ser cuidadosamente validadas em relação ao desenho experimental. Uma análise de imagem automatizada bem projetada e validada pode aumentar a taxa de transferência da etapa de análise.
Resultados
Os resultados aqui apresentados baseiam-se em relatos publicados anteriormente 9,10. O objetivo desta análise é avaliar quantitativamente a capacidade de cepas mutantes de C. albicans de sofrerem morfogênese durante infecções ativas. Os parâmetros típicos que distinguem pseudo-hifas de hifas podem ser difíceis de avaliar em organismos que crescem em três dimensões em um ambiente complexo in vivo. Isto é particularmente verdadeiro quando se olha para as seções transversais bidimensionais criadas por imagens confocais. Portanto, esta análise de triagem está focada na identificação de organismos que crescem como filamentosos versus leveduras. Para estudos de acompanhamento usando uma análise mais aprofundada, incluindo reconstruções tridimensionais, esse método poderia ser adaptado para discriminar leveduras, hifas e pseudo-hifas.
A expressão de uma proteína fluorescente em uma cepa de referência ou mutante de C. albicans permite a detecção direta da morfologia da cepa in vivo (Figura 3 e Figura 4). Em geral, a análise quantitativa de microscopia de luz é melhor realizada quando poucos ou nenhum dos pixels na imagem estão saturados. Para este protocolo, no entanto, uma saturação da imagem muitas vezes simplifica a análise. A localização de proteínas fluorescentes não é uniforme em toda a célula e é frequentemente maior na levedura mãe do que nos filamentos. Felizmente, para a investigação da morfogênese, a distribuição espacial do sinal, em vez de sua intensidade, define o resultado. Portanto, a obtenção de imagens em que muitos pixels estão saturados melhora a capacidade de quantificar a morfogênese neste ensaio.
Para ilustrar a importância da avaliação da morfogênese in vivo, são apresentados resultados representativos para a cepa de referência (SN250) e dois mutantes: um sem o fator de transcrição Efg1 e outro sem adenilil ciclase Cyr1. In vitro, nenhuma dessas cepas cresce como filamentos20,21. Quando cultivada in vitro em meio RPMI suplementado com 10% de soro, a cepa de referência forma rapidamente filamentos, enquanto as cepas efg1ΔΔ e cyr1ΔΔ não o fazem (Figura 3 e Figura 4). Nessas condições, o mutante efg1ΔΔ exibe um crescimento um pouco polarizado, com as células filhas sendo ligeiramente alongadas em comparação com as células-mãe. Isso enfatiza a importância de usar uma definição clara de filamentação. Qualquer definição desse tipo é, por padrão, arbitrária, mas é necessária para uma avaliação consistente do fenótipo. Para estes estudos, um padrão filamentoso de crescimento é definido como um organismo com a dimensão mais longa de uma célula filha mais do que o dobro da célula-mãe. Usando esta definição, as células efg1ΔΔ alongadas não são filamentosas.
Consistente com seu fenótipo in vitro, o efg1 ΔΔ apresenta um defeito de filamentação significativo in vivo: aproximadamente 9% das células efg1ΔΔ cresceram como filamentos in vivo (Figura 3). Em contraste, 53% das células mutantes cyr1ΔΔ cresceram como filamentos in vivo (Figura 4). Embora o número de células mutantes cyr1 ΔΔ submetidas à filamentação in vivo tenha sido significativamente menor do que a cepa de referência, a capacidade do mutante cyr1ΔΔ de formar filamentos in vivo representa uma mudança substancial em relação à sua completa falta de morfogênese in vitro. Visualmente, os filamentos formados pelo mutante cyr1ΔΔ pareciam ser mais curtos do que a cepa de referência. Para avaliar isso quantitativamente, o comprimento do trajeto da curva das células filamentosas foi medido por meio de uma projeção bidimensional das imagens in vivo (Figura 4E). O comprimento mediano dos filamentos cyr1ΔΔ foi 29% menor do que os filamentos da cepa de referência.
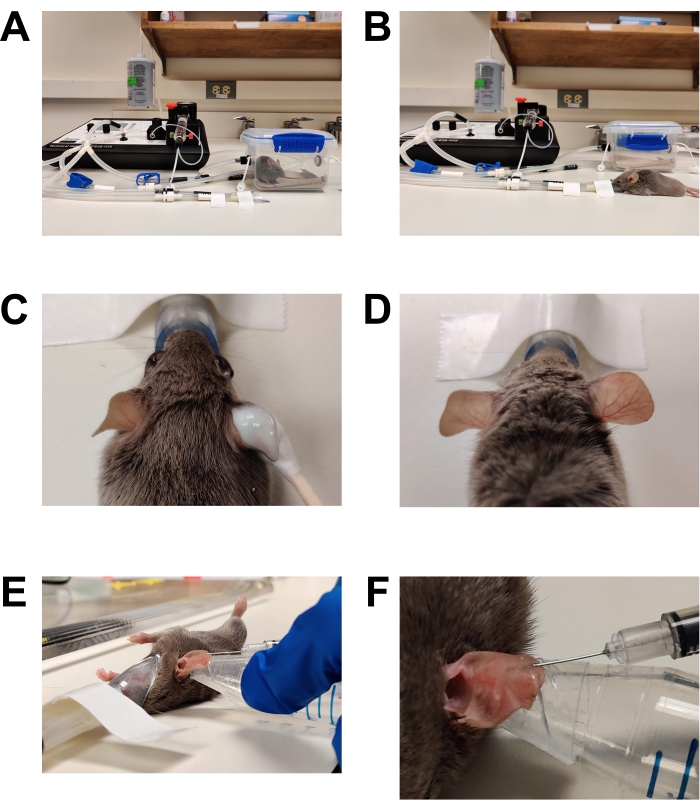
Figura 1: Anestesia e inoculação . (A) Indução da anestesia com câmara de indução. (B) A anestesia é mantida usando um cone nasal, permitindo que o rato seja reposicionado conforme necessário. (C) O creme de depilação é aplicado usando um aplicador com ponta de algodão. Gel de lubrificação ocular foi aplicado para proteger os olhos durante a anestesia. (D) Depilação eficaz da orelha direita. Compare com a orelha esquerda não tratada. (E) Injeção intradérmica de C. albicans na orelha do rato. A orelha é mantida no lugar usando a ponta de um tubo cônico envolto com fita de pele de dupla face (fita de moda). (F) Close up da injeção intradérmica. Uma bolha pálida é formada na pele, o que é um sinal de uma colocação intradérmica bem-sucedida. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 2: Preparação para imagem. (A) Estágio de microscópio preparado para imagem. O cone do nariz da anestesia é fixado no lugar. Uma tampa é colada no palco que cobre a abertura da lente. Peças adicionais de fita estão disponíveis. O estádio aquecido é pré-aquecido a 37 °C (não mostrado). (B) Colocação do camundongo anestesiado no cone nasal anestésico. (C) O rato é ligeiramente rodado de modo a que o lado da orelha que foi inoculado esteja virado para a tampa inferior/lente objetiva. A orelha é então achatada contra a tampa inferior e presa no lugar, colocando uma segunda tampa na parte superior da orelha. (D) A tampa superior é colada ao palco para fixar a orelha no lugar em relação ao estágio do microscópio. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3: Morfologia in vitro e in vivo da estirpe mutante efg1ΔΔ. (A) Imagem de campo largo de cepas mutantes WT e efg1ΔΔ após indução in vitro de filamentação por células em crescimento em RPMI + soro a 10% a 37 °C por 4 h. As barras de escala representam 10 μm. O contraste da imagem foi ajustado usando um software de edição de fotos para facilitar a visualização. (B) Percentagem de filamentação in vitro observada nas estirpes mutantes WT e efg1ΔΔ. Und = indetectável (não foram detectados filamentos). A altura da barra representa a porcentagem mediana de células filamentosas de três experimentos independentes em que pelo menos 100 células foram quantificadas. As barras de erro indicam desvio padrão (resultados comparados pelo teste t de student, p < 0,001). (C) Micrografia confocal de WT (verde) e do mutante efg1ΔΔ (vermelho) crescendo in vivo 24 h após a inoculação. As setas indicam exemplos de células mutantes efg1ΔΔ que atendem à nossa definição de "filamentosas". A barra de escala representa 50 μm. (D) Porcentagem de filamentação in vivo observada nas cepas mutantes WT e efg1ΔΔ. A altura da barra representa a porcentagem mediana de células filamentosas de dois experimentos independentes. As barras de erro indicam desvio padrão (resultados comparados pelo teste t de Student, p < 0,001). Por favor, clique aqui para ver uma versão maior desta figura.
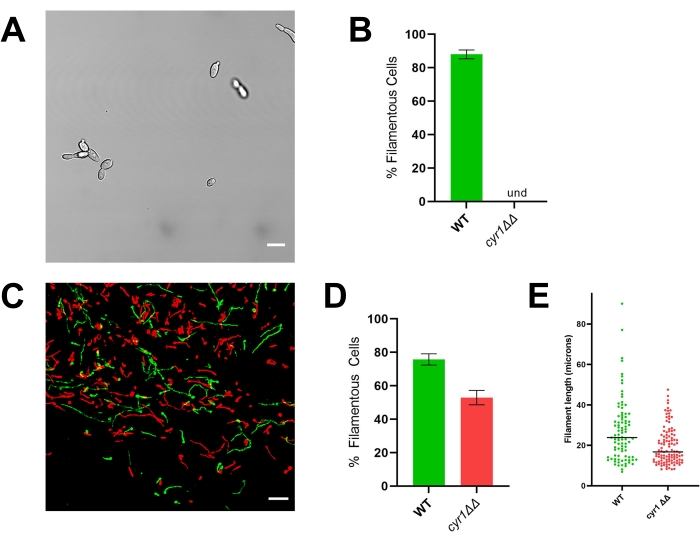
Figura 4: Morfologia in vitro e in vivo da estirpe mutante cyr1 ΔΔ. (A) Imagem widefield da estirpe mutante cyr1ΔΔ após indução in vitro da filamentação por células em crescimento em RPMI + soro a 10% a 37 °C durante 4 h. A barra de escala representa 10 μm. O contraste da imagem foi ajustado usando um software de edição de fotos para facilitar a visualização. (B) Percentagem de filamentação in vitro observada nas estirpes mutantes WT e cyr1ΔΔ. Und = indetectável (não foram detectados filamentos). A altura da barra representa a porcentagem mediana de células filamentosas de três experimentos independentes em que pelo menos 100 células foram quantificadas. As barras de erro indicam desvio padrão (resultados comparados pelo teste t de Student, p < 0,001). (C) Micrografia confocal de WT (verde) e do mutante cyr1ΔΔ (vermelho) crescendo in vivo 24 h após a inoculação. A barra de escala representa 50 μm. (D) Percentagem de filamentação in vivo observada nas estirpes mutantes WT e cyr1ΔΔ. A altura da barra representa a porcentagem mediana de células filamentosas de dois experimentos independentes. As barras de erro indicam desvio padrão (resultados comparados pelo teste t de Student, p < 0,001). (E) Distribuição do comprimento do filamento in vivo, medido pelo comprimento do caminho da curva numa projecção bidimensional da pilha z. Cada ponto representa o comprimento de um filamento. As células que crescem como levedura não foram incluídas nesta análise. A barra indica o comprimento médio do filamento. A distribuição dos comprimentos é significativamente diferente quando analisada pelo teste U de Mann-Whitney (p < 0,001). Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Este modelo utiliza microscopia confocal para obter imagens de organismos de C. albicans à medida que crescem dentro do tecido de um hospedeiro mamífero, permitindo-nos avaliar fenótipos de morfogênese durante a infecção ativa. O processo de morfogênese é central para a patogênese de C. albicans e tem sido amplamente estudado utilizando uma variedade de ensaios in vitro 2,3,4. No entanto, nenhum ensaio in vitro pode modelar completamente o complexo ambiente bioquímico e estrutural do hospedeiro.
O protocolo descrito aqui está focado no uso deste sistema de imagem in vivo para rastrear uma série/biblioteca de mutantes de C. albicans para identificar os genes envolvidos na morfogênese durante a infecção. O uso de cepas de C. albicans expressando diferentes proteínas fluorescentes nos permite quantificar a morfogênese in vivo de cepas mutantes de C. albicans em comparação com a de uma cepa de referência. Comparar a morfogênese no mutante com a cepa de referência dentro da mesma área de infecção garante que os organismos sejam expostos a ambientes idênticos. Isso permite a medição quantitativa da porcentagem de células submetidas à filamentação, bem como a extensão da filamentação. A normalização das medidas da(s) estirpe(s) mutante(s) para as da estirpe de referência permite-nos comparar melhor o desempenho de uma estirpe mutante com outra.
Os resultados representativos aqui apresentados demonstram o potencial de discrepância significativa entre os fenótipos in vitro e in vivo. A cepa mutante de C. albicans efg1ΔΔ é frequentemente utilizada como controle negativo para ensaios de morfogênese, pois não consegue filamentar em quase todas as condições in vitro 20. Embora os resultados in vivo tenham sido muito semelhantes aos resultados in vitro , mesmo essa cepa severamente prejudicada ocasionalmente formou filamentos no ambiente do tecido hospedeiro (Figura 3). Isso enfatiza a força do ambiente do hospedeiro no desencadeamento da morfogênese.
Em contraste, a cepa mutante cyr1ΔΔ demonstra uma discordância substancial entre o crescimento in vitro e in vivo; embora nenhuma das células mutantes sofra filamentação in vitro, aproximadamente metade das células cresce como filamentos in vivo (Figura 4)10,21. Curiosamente, esses filamentos eram significativamente mais curtos do que os formados pela cepa de referência, sugerindo que o CYR1 contribui para a taxa de crescimento do filamento ou para a capacidade de manter um fenótipo filamentoso. Para facilitar a análise do comprimento do filamento, o comprimento do caminho da curva dos filamentos foi medido usando uma projeção bidimensional das imagens. Em projeções bidimensionais de filamentos que crescem em três dimensões, qualquer filamento que cresça em um eixo que não seja paralelo ao plano xy se projetará tão menor do que seu comprimento real. Como esse encurtamento também ocorre para a cepa de referência, avaliar a distribuição dos comprimentos dos filamentos em uma projeção bidimensional ainda permite uma comparação quantitativa entre as cepas de referência e mutantes. A análise do comprimento do filamento em duas dimensões em vez de três requer uma análise de imagem menos intensiva; assim, ele pode ser realizado de forma relativamente rápida em um computador desktop típico. O uso dessa análise mais simples permite a inclusão da distribuição do comprimento do filamento como parte de um protocolo de triagem, dando uma compreensão mais sutil da capacidade de cada mutante de sofrer morfogênese sem causar atrasos substanciais no rendimento.
Os estudos representativos aqui apresentados foram realizados utilizando camundongos DBA2/N, que apresentam um defeito em seu sistema complemento causando uma falha no recrutamento de neutrófilos para o local da infecção por C. albicans 22. O objetivo desses estudos foi investigar mecanismos de regulação da filamentação de C. albicans no interior do tecido hospedeiro. Portanto, camundongos DBA2/N foram usados para evitar confundir os resultados devido à suscetibilidade ou resistência de uma cepa individual aos neutrófilos. Como a resposta anti-C. albicans de neutrófilos pode afetar a filamentação23, o recrutamento de neutrófilos para o local da infecção pode afetar os resultados de um ensaio de morfogênese. Se uma estirpe é capaz de filamentar in vivo , mas é fortemente inibida da filamentação quando os neutrófilos estão presentes, a filamentação seria detectada em ratinhos DBA2/N, mas seria improvável que fosse vista quando se usassem ratinhos com quimiotaxia de neutrófilos intacta. Assim, a tensão do mouse usado como host é um fator importante ao usar esse protocolo.
É improvável que a observação de que a estirpe mutante efg1ΔΔ não se filamenta in vivo esteja relacionada com as respostas dos neutrófilos do hospedeiro, porque esta estirpe também não consegue filamentar in vitro. A filamentação observada in vivo com a estirpe cyr1ΔΔ é discordante com a sua falha na filamentação in vitro. Dados do modelo de peixe-zebra da infecção por C. albicans indicam que os neutrófilos respondentes são importantes na prevenção da morfogênese24. Portanto, é improvável que o uso de camundongos DBA2/N, que não possuem respostas de neutrófilos, seja responsável pelo aumento da filamentação do cyr1ΔΔ in vivo em comparação com in vitro. No entanto, o ambiente in vivo está claramente impactando a morfogênese da cepa cyr1ΔΔ; assim, uma investigação mais aprofundada dessa cepa pode fornecer informações importantes sobre a regulação da morfogênese de C. albicans durante infecções ativas. O protocolo aqui descrito é projetado como um ensaio de triagem para identificar cepas como a cepa cyr1ΔΔ a ser usada em estudos futuros.
O uso de um sistema de anestesia gasosa de baixo fluxo é muito útil para este protocolo (Figura 1A,B). Durante o desenvolvimento inicial deste protocolo, os camundongos foram anestesiados usando um coquetel anestésico injetável de cetamina misturado com xilazina. Embora tenha sido possível realizar imagens limitadas com esse método anestésico, a duração da anestesia foi imprevisível, exigindo que as sessões de imagem fossem encerradas rapidamente para evitar que o camundongo se recuperasse da anestesia durante a imagem. Os sistemas anestésicos inalados tradicionais são volumosos e exigem altas taxas de fluxo de gases anestésicos, muitas vezes exigindo que eles sejam usados dentro de um exaustor. Assim, os sistemas anestésicos inalatórios tradicionais seriam muito difíceis de usar com as restrições de espaço de um microscópio confocal sem inadvertidamente expor os investigadores aos agentes anestésicos. O uso de um sistema anestésico inalatório de baixo fluxo permite a anestesia consistente do animal, mantendo um ambiente seguro para o investigador. O cone nasal de baixo fluxo permite fácil posicionamento do animal tanto para inoculação quanto para microscopia. A tubulação de entrega de pequeno calibre e baixo volume permite o uso de tubos relativamente longos, o que permite que a máquina de anestesia seja colocada a uma distância suficiente para não interferir na microscopia.
A clorofila presente na ração típica de camundongos leva a uma autofluorescência tecidual significativa25. Isso cria um ruído substancial nas imagens, dificultando a obtenção de imagens de alta qualidade e alta resolução espacial. Quando os animais foram alimentados com ração livre de clorofila por 7 dias antes da imagem, o fundo da autofluorescência foi substancialmente diminuído no tecido, mas a clorofila depositada no cabelo continuou a ser problemática. A remoção do pelo nos pinos usando um creme depilatório químico de venda livre é eficaz para minimizar a autofluorescência no cabelo (Figura 1C,D). Assim, a combinação de ração livre de clorofila e depilação adequada diminuiu substancialmente a autofluorescência e melhorou drasticamente a qualidade da imagem. Como o pelo é removido da orelha antes da imagem, a cor do pelo do animal não afeta esse sistema. Este protocolo tem sido usado com sucesso para estudar infecções por C. albicans em camundongos BALB/c (branco), C57BL/6 (preto) e DBA2/N (marrom). O protocolo também pode ser usado com camundongos knockout C57BL/6 que são deficientes em vários genes hospedeiros; Isso permitirá futuras investigações sobre como o sistema imunológico do hospedeiro de mamíferos afeta a filamentação. Uma característica deste modelo não discutida neste protocolo é que, como este sistema de imagem não é invasivo, o mesmo animal pode ser fotografado repetidamente ao longo de vários dias, permitindo acompanhar o progresso da infecção individual ao longo do tempo. Essa característica provavelmente desempenhará um papel fundamental em estudos futuros sobre a interação hospedeiro-patógeno.
Em resumo, esse protocolo resulta em imagens de alta resolução espacial de C. albicans crescendo no tecido de um hospedeiro vivo de mamíferos, permitindo uma avaliação precisa da morfogênese em cepas mutantes 8,9,10. Os resultados aqui apresentados demonstram como esse protocolo pode ser utilizado para triagem de uma biblioteca de mutantes de C. albicans. Dos mutantes de C. albicans testados até o momento, grande parte dos mutantes com defeitos conhecidos na morfogênese in vitro prontamente submetem-se à filamentação in vivo 9,10. Isso destaca a importância de incluir um sistema in vivo como este em experimentos destinados a elucidar os mecanismos da patogênese de C. albicans.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo NIH grant 1R01AI33409 e pelo Departamento de Pediatria, Carver College of Medicine, Universidade de Iowa.
Materiais
| Name | Company | Catalog Number | Comments |
| #1.5 coverslips | Thermo-Fisher | 20811 | large enough to cover the universal stage opening |
| 0.1 mL Insulin syringes | EXELint | 26018 | Can use syringes that are 5/16"–1/2" long and 29–32 G |
| 3.7% formaldehyde in dPBS | Sigma-Aldrich | SHBJ5734 | |
| 70% Ethanol/30% water | Decon Laboratories | A05061001A | |
| Alcohol prep pads | Covidien | 5110 | Alternative: gauze pads soaked in 70% isopropyl alcohol |
| C.albicans reference strain and experimental strains | SN250 | FGSC Online Catalog | The specific C. albicans strain varies with experiment and the investigators goals. We have used strains derived from SC5314 as well as other clinical isolates. |
| Chlorophyl free mouse chow | Envigo | 2920x | |
| Computer | Dell | Optiplex 7050 | Computer that can run imaging software for acquisition and for analysis of images. A variety of imaging software is available and varies with the specific microscope and user system. |
| Cotton tip applicator | Pro Advantage | 76200 | |
| DBA2/N (6-12 week old mice) | BALB/c and C57/BL6 mice can also be used. The latter allow for the use of widely available knockout mouse models as well as mouse models in which individual cell types, such as phagocytes, are identified by their expression of fluorescent proteins. | ||
| Double sided tape designed to hold fabric to skin (fashion tape) | local pharmacy or grocery store | Double sided adhesive tape designed for keeping clothing in place over human skin. This is typically available over the counter in pharmacies and variety stores. It is important to use this type of tape as it is designed for gentle adherence to skin. Examples: https://www.amazon.com/Womens-Fashion-Clothing-Transparent-Suitable/dp/B08S3TWR3H/ref=sr_1_40?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-40 https://www.amazon.com/Fearless-Tape-Sensitive-Clothing-Transparent/dp/B07QY8V5XT/ref=sr_1_26?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174320&sprefix= fashion+tape%2Caps%2C70&sr=8-26 https://www.amazon.com/Hollywood-Fashion-Secrets-Tape-Floral/dp/B009RX77MK/ref=sr_1_29?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-29 | |
| Dulbecco's phosphate buffered saline | Gibco / Thermo-Fisher | 14190-144 | Must be sterile; open a new container for every experiment |
| Fetal bovine serum | Gibco / Thermo-Fisher | 26140-079 | |
| Gauze pad | Pro Advantage | P157112 | |
| Gel eye lurbicant | local pharmacy or grocery store | ||
| ImageJ or FIJI analysis software | NIH | ImageJ (FIJI) | |
| Isoflurane | Akorn | J119005 | |
| Leica DMi8 (SP8 platform) with Leica 11506375 objective lens | Leica | DMi8 (SP8) | The objective lens (Leica 11506375) used here is a 25x water immersion lens to allow us to have a high NA (0.95) while approximating the refractive index of the ear tissue. The microscope (Leica DMi8 (SP8 platform) has 488 nm and 638 nm diode laser lines and is equipped with filter-free spectral detection with computer controlled adjustable bandwidth for detection of emission light. The stage must have enough clearance to allow the objective to reach the bottom coverslip without hitting the stage. |
| Low-flow anesthesia system or traditional anesthesia vaporizer | Kent Scientific International | SomnoSuite | |
| Nair hair remover lotion | local pharmacy or grocery store | Over the counter depilatory cream | |
| Nourseothricin | Jena Bioscience | AB-101L | |
| pENO1-NEON-NATR pENO1-iRFP-NATR plasmids | Fluorescent protein expression transformation constructs generously given to us by Dr. Robert Wheeler (Seman, et al., 2018, Infection and Immunity; Bergeron, et al., 2017, Infection and Immunity) | ||
| Pressure sensitive laboratory tape | Tape & Label Graphic Systems Inc | 1007910 | |
| RPMI1640 cell culture medium | Gibco / Thermo-Fisher | 11875-093 | |
| Thimble, plastic 15 mL conical tube, or Falcon 5 mL round bottom polystyrene tubes | Falcon | 352196 | To safely hold the animals ear during injectinos |
Referências
- Lopes, J. P., Lionakis, M. S. Pathogenesis and virulence of Candida albicans. Virulence. 13 (1), 89-121 (2022).
- Saville, S. P., Lazzell, A. L., Monteagudo, C., Lopez-Ribot, J. L. Engineered control of cell morphology in vivo reveals distinct roles for yeast and filamentous forms of Candida albicans during infection. Eukaryotic Cell. 2 (5), 1053-1060 (2003).
- Arita, G. S., et al. Cell wall associated proteins involved in filamentation with impact on the virulence of Candida albicans. Microbiological Research. 258, 126996(2022).
- Rai, L. S., Wijlick, L. V., Bougnoux, M. E., Bachellier-Bassi, S., d'Enfert, C. Regulators of commensal and pathogenic life-styles of an opportunistic fungus-Candida albicans. Yeast. 38 (4), 243-250 (2021).
- Sudbery, P. E. Growth of Candida albicans hyphae. Nature Reviews Microbiology. 9 (10), 737-748 (2011).
- Basso, V., d'Enfert, C., Znaidi, S., Bachellier-Bassi, S. From genes to networks: The regulatory circuitry controlling candida albicans morphogenesis. Current Topics in Microbiology and Immunology. 422, 61-99 (2019).
- Mancera, E., et al. Evolution of the complex transcription network controlling biofilm formation in Candida species. Elife. 10, 64682(2021).
- Mitra, S., Dolan, K., Foster, T. H., Wellington, M. Imaging morphogenesis of Candida albicans during infection in a live animal. Journal of Biomedical Optics. 15 (1), 010504(2010).
- Wakade, R. S., Huang, M., Mitchell, A. P., Wellington, M., Krysan, D. J. Intravital imaging of Candida albicans identifies differential in vitro and in vivo filamentation phenotypes for transcription factor deletion mutants. mSphere. 6 (3), 0043621(2021).
- Wakade, R. S., Kramara, J., Wellington, M., Krysan, D. J. Candida albicans filamentation does not require the cAMP-PKA pathway in vivo. mBio. 13 (3), 0085122(2022).
- Bergeron, A. C., et al. Candida albicans and Pseudomonas aeruginosa interact to enhance virulence of mucosal infection in transparent zebrafish. Infection and Immunity. 85 (11), 00475(2017).
- Seman, B. G., et al. Yeast and filaments have specialized, independent activities in a zebrafish model of Candida albicans infection. Infection and Immunity. 86 (10), 00415-00418 (2018).
- Centers for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories (BMBL). 6th edition. , Available from: https://www.cdc.gov/labs/BMBL.html (2020).
- Homann, O. R., Dea, J., Noble, S. M., Johnson, A. D. A phenotypic profile of the Candida albicans regulatory network. Plos Genetics. 5 (12), 1000783(2009).
- Cullen, P. J., Sprague, G. F. The regulation of filamentous growth in yeast. Genetics. 190 (1), 23-49 (2012).
- Herrero, A. B., et al. Control of filament formation in Candida albicans by polyamine levels. Infection and Immunity. 67 (9), 4870-4878 (1999).
- Ahmad Hussin, N., et al. Biotin auxotrophy and biotin enhanced germ tube formation in Candida albicans. Microorganisms. 4 (3), 37(2016).
- Nantel, A., et al. Transcription profiling of Candida albicans cells undergoing the yeast-to-hyphal transition. Molecular Biology of the Cell. 13 (10), 3452-3465 (2002).
- Noble, S. M., Johnson, A. D. Strains and strategies for large-scale gene deletion studies of the diploid human fungal pathogen Candida albicans. Eukaryotic Cell. 4 (2), 298-309 (2005).
- Glazier, V. E. EFG1, Everyone's favorite gene in Candida albicans: A comprehensive literature review. Frontiers in Cellular Infection and Microbiology. 12, 855229(2022).
- Huang, G., Huang, Q., Wei, Y., Wang, Y., Du, H. Multiple roles and diverse regulation of the Ras/cAMP/protein kinase A pathway in Candida albicans. Molecular Microbiology. 111 (1), 6-16 (2019).
- Saville, S. P., Lazzell, A. L., Chaturvedi, A. K., Monteagudo, C., Lopez-Ribot, J. L. Use of a genetically engineered strain to evaluate the pathogenic potential of yeast cell and filamentous forms during Candida albicans systemic infection in immunodeficient mice. Infection and Immunity. 76 (1), 97-102 (2008).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryotic Cell. 10 (7), 932-944 (2011).
- Brothers, K. M., et al. NADPH oxidase-driven phagocyte recruitment controls Candida albicans filamentous growth and prevents mortality. PLoS Pathogens. 9 (10), 1003634(2013).
- Holmes, H., Kennedy, J. C., Pottier, R., Rossi, R., Weagle, G. A recipe for the preparation of a rodent food that eliminates chlorophyll-based tissue fluorescence. Journal of Photochemistry and Photobiology. B: Biology. 29 (2-3), 199(1995).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados