É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Quantificação Experimental de Interações entre Sistemas de Liberação de Medicamentos e Células In Vitro: Um Guia para Avaliação Pré-Clínica de Nanomedicina
Neste Artigo
Resumo
Um fluxo de trabalho é demonstrado para a quantificação absoluta das interações fármaco-célula transportadora usando citometria de fluxo para permitir uma melhor avaliação racional de novos sistemas de liberação de medicamentos. Este fluxo de trabalho é aplicável a portadores de medicamentos de qualquer tipo.
Resumo
Um componente importante do projeto de sistemas de liberação de medicamentos diz respeito a como amplificar ou atenuar as interações com tipos específicos de células. Por exemplo, um quimioterápico pode ser funcionalizado com um anticorpo para melhorar a ligação às células cancerosas ("direcionamento") ou funcionalizado com polietilenoglicol para ajudar a evitar o reconhecimento de células imunes ("stealth"). Mesmo em um nível celular, otimizar a ligação e a absorção de um portador de medicamentos é um problema complexo de design biológico. Assim, é valioso separar o quão fortemente um novo transportador interage com uma célula da eficácia funcional da carga de uma transportadora uma vez entregue a essa célula.
Para continuar o exemplo quimioterápico, "quão bem ele se liga a uma célula cancerosa" é um problema separado de "quão bem ele mata uma célula cancerosa". Os ensaios quantitativos in vitro para estes últimos estão bem estabelecidos e geralmente dependem da medição da viabilidade. No entanto, a maioria das pesquisas publicadas sobre interações célula-portador é qualitativa ou semiquantitativa. Geralmente, essas medições dependem da marcação fluorescente do portador e, consequentemente, relatam interações com células em unidades relativas ou arbitrárias. No entanto, este trabalho pode ser padronizado e ser feito absolutamente quantitativo com um pequeno número de experimentos de caracterização. Essa quantificação absoluta é valiosa, pois facilita comparações racionais, inter e intraclasse de vários sistemas de liberação de drogas - nanopartículas, micropartículas, vírus, conjugados anticorpo-droga, células terapêuticas modificadas ou vesículas extracelulares.
Além disso, a quantificação é um pré-requisito para meta-análises subsequentes ou abordagens de modelagem in silico . Neste artigo, são apresentados guias em vídeo, bem como uma árvore de decisão sobre como alcançar a quantificação in vitro para sistemas de liberação de medicamentos transportadores, que levam em conta diferenças no tamanho do transportador e na modalidade de rotulagem. Além disso, outras considerações para a avaliação quantitativa de sistemas avançados de liberação de medicamentos são discutidas. Pretende-se que isso sirva como um recurso valioso para melhorar a avaliação racional e o design para a próxima geração de medicamentos.
Introdução
O design de construções de entrega de medicamentos que exibem um comportamento específico e projetado, dependendo do tipo de célula que encontram, atraiu um interesse substancial da pesquisa. Potenciais construções de liberação de medicamentos ou "transportadores" incluem formulações lipídicas, inorgânicos nano-cultivados, conjuntos poliméricos, vesículas extracelulares, células bacterianas funcionalizadas ou vírus modificados. Todos estes podem apresentar especificidade de órgãos, tecidos ou células devido a propriedades físicas, propriedades de superfície ou funcionalizações químicas modificadas, como a fixação de anticorpos 1,2.
Um passo quase onipresente na avaliação do transportador in vitro é incubar células com uma suspensão contendo o referido transportador carregado de drogas. Após a incubação, o desempenho do transportador é medido por meio de uma leitura funcional do desempenho da carga do medicamento, por exemplo, eficiência ou toxicidade da transfecção. As leituras funcionais são úteis, pois são uma medida a jusante da eficácia da transportadora. No entanto, para construções de liberação de medicamentos mais complexas, é cada vez mais importante ir além das leituras funcionais e quantificar separadamente o grau de interação do transportador com a célula de interesse. Existem algumas razões para isso.
Primeiro, há um interesse crescente em descobrir (e melhorar iterativamente) tecnologias de transportadoras de "plataforma", que podem transportar uma variedade de cargas. Por exemplo, nanopartículas lipídicas (LNPs) projetadas para encapsular RNA podem trocar uma sequência de RNA por outra com poucas ressalvas3. Assim, para melhorar iterativamente a tecnologia da transportadora, é fundamental quantificar seu desempenho independentemente da funcionalidade da carga. Em segundo lugar, as leituras funcionais podem não ser simples para a carga de interesse, comprometendo a capacidade de iterar e avaliar rapidamente as formulações da transportadora. Embora se possa realizar a otimização in vitro usando uma carga modelo com uma leitura funcional direta (por exemplo, fluorescência), a alteração da carga pode alterar a resposta biológica a um transportador4 e, portanto, não produzir resultados representativos. Em terceiro lugar, muitos portadores são projetados para interagir e ser absorvidos por um tipo específico de célula. Essa capacidade de segmentação de um transportador pode e deve ser diferenciada do desempenho da sua segmentação terapêutica de postos de carga. Para continuar o exemplo do LNP, uma carga de RNA pode ser extremamente potente, mas se o LNP for incapaz de se ligar à célula, ser internalizado e liberar o RNA, nenhum efeito funcional a jusante será observado. Isso pode ser um problema particularmente para portadores destinados a atingir tipos de células difíceis de transfectar, como as células T5. Por outro lado, um LNP poderia atingir de forma extremamente eficaz, mas a carga de RNA pode não funcionar. Um ensaio a jusante que mede apenas a funcionalidade da carga não será capaz de diferenciar entre essas duas situações, complicando assim o desenvolvimento e a otimização dos sistemas de entrega de medicamentos transportadores.
Neste trabalho, discute-se como quantificar absolutamente a associação de operadores. Associação é um termo que se refere ao grau de interação medido experimentalmente entre um portador e uma célula. A associação não diferencia entre ligação à membrana e internalização – um transportador pode estar associado porque está ligado à superfície celular ou porque a célula o internalizou. A associação é comumente medida como parte de experimentos de incubação de portadores de células. Historicamente, a associação tem sido relatada em unidades fluorescentes arbitrárias (tipicamente "intensidade de fluorescência mediana" ou MFI) ou como "associação percentual", métricas cujas limitações foram discutidas anteriormente6. Em suma, essas medições não são comparáveis entre experimentos, laboratórios e portadores de medicamentos devido a diferenças nos protocolos experimentais, configurações de citômetros de fluxo e intensidades de marcação de diferentes portadores. Esforços têm sido feitos para superar o primeiro calibrando o citômetro, convertendo assim a medida relativa da IFM em uma medida absolutamente quantitativa de fluorescência7. No entanto, esse método não leva em conta a variabilidade na intensidade de marcação de vários portadores e, portanto, não permite a comparação racional de vários desempenhos de portadores em uma célula-alvo de escolha8.
Aqui, como converter praticamente de unidades fluorescentes arbitrárias relativas para a métrica quantitativa absoluta do "número de portadores por célula" é demonstrado pela realização de um pequeno número de experimentos de caracterização adicionais. Se outra métrica de concentração de transportador for desejada (por exemplo, massa de transportador por célula ou volume de transportador por célula), é simples converter de portadores por célula, desde que a caracterização do transportador tenha sido feita. Para brevidade e para evitar jargões, a palavra "portador" é usada neste trabalho para se referir à vasta variedade de construções de entrega de drogas. Essas técnicas de quantificação são igualmente aplicáveis, sejam aplicadas a uma partícula de ouro nano-modificada ou a uma bactéria de bioengenharia.
Alguns fatos permitem a conversão de unidades fluorescentes arbitrárias em portadores por célula. Primeiro, a intensidade de fluorescência medida é proporcional à concentração de um fluoróforo9 (ou um transportador marcado fluorescentemente), assumindo que a fluorescência está dentro dos limites de detecção do instrumento e as configurações de instrumentação são as mesmas. Assim, se a fluorescência de um transportador e a fluorescência de uma amostra são conhecidas, pode-se determinar quantos portadores estão presentes nessa amostra se todas as medições foram realizadas sob as mesmas configurações e condições. No entanto, especialmente para portadores menores, pode não ser possível medir a fluorescência do portador, a autofluorescência celular e a fluorescência associada à célula com portadores no mesmo instrumento com as mesmas configurações. Neste caso, há um segundo requisito para tornar possível a conversão entre a fluorescência medida em um instrumento e a fluorescência medida em outro. Para tanto, uma curva padrão de concentração de fluoróforo pode ser estabelecida para medir a intensidade de fluorescência em ambos os instrumentos, aproveitandoo padrão 9 de Moléculas de Fluorocromo Solúvel Equivalente (MESF). Isso permite a medição da fluorescência do transportador em massa em um não-citômetro, uma medição que pode ser feita em portadores de qualquer tamanho ou característica. Quando essa quantificação a granel é feita numa suspensão transportadora de concentração conhecida, o número de transportadores por célula de uma amostra pode, uma vez mais, ser calculado.
Embora este trabalho demonstre o processo de medição da associação do transportador (determinado pela intensidade de fluorescência medida), um protocolo análogo poderia ser realizado para outras medidas de interação célula-portador (por exemplo, um protocolo experimental que diferencia portadores internalizados e ligados à membrana). Além disso, este protocolo seria em grande parte o mesmo se a associação fosse medida através de um ensaio não fluorescente (por exemplo, através de citometria de massa).
Protocolo
1. Escolhendo o fluxo apropriado
- Siga a árvore de decisão descrita na Figura 1 para determinar o melhor fluxo de trabalho (fluxo) (Figura 2) para a configuração experimental usada. Consulte a discussão para mais comentários sobre essa escolha de fluxo.
- Se seguir o fluxo do citômetro, continue com as etapas 2.1.1-2.2.7. Se estiver seguindo o Bulk Stream, continue com as etapas 3.1.1.1-3.1.5.7.
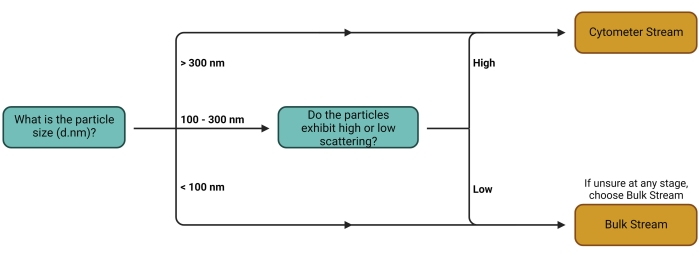
Figura 1: Árvore de decisão do fluxo de trabalho. A decisão sobre qual Stream usar depende principalmente do tipo de interesse da operadora. Portadores maiores e portadores com altas propriedades de dispersão podem ser mais facilmente detectados individualmente em citômetros, tornando-os adequados para quantificação usando o Cytometer Stream. O Bulk Stream é adequado para todos os outros tipos de transportadoras. Por favor, clique aqui para ver uma versão maior desta figura.
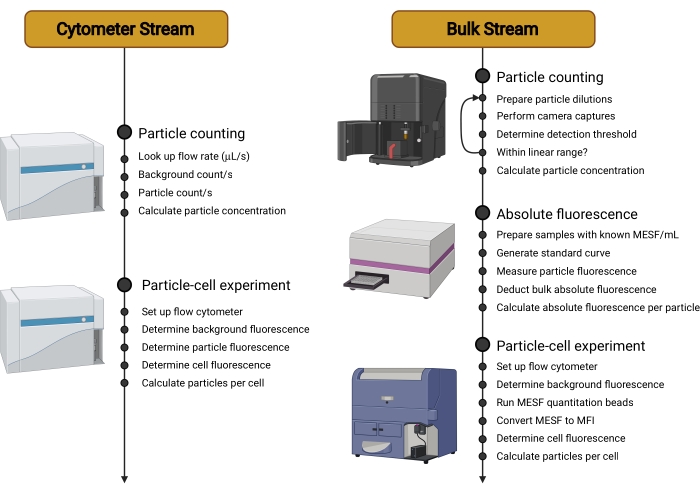
Figura 2: Visão geral dos fluxos de trabalho. Este protocolo é dividido em dois fluxos diferentes. O Cytometer Stream usa um citômetro sensível para contar os portadores em suspensão, medir sua fluorescência individual e, em seguida, determinar a fluorescência das células incubadas com portadores. O Bulk Stream usa técnicas não baseadas em citometria, como a Análise de Rastreamento de Nanopartículas, para contar os portadores em suspensão. A fluorescência do transportador individual é então quantificada usando um leitor de microplacas ou espectrofluorômetro. O uso do citômetro de fluxo restringe-se, portanto, à mensuração da fluorescência final de células incubadas com portadores, medida que pode ser feita em uma faixa mais ampla de citômetros e que independe do tipo de transportador utilizado. Abreviaturas: MESF = Moléculas de Fluorocromo Solúvel Equivalente; IFM = intensidade mediana da fluorescência. Por favor, clique aqui para ver uma versão maior desta figura.
2. O fluxo do citômetro
- Contagem de transportadoras
NOTA: Qualquer citômetro de fluxo pode ser usado para esta medição, desde que a taxa de fluxo (μL/s) seja conhecida. Se a vazão for desconhecida e não puder ser determinada, não prossiga com esta etapa. Em vez disso, prossiga com a etapa 3.1. A contagem dos portadores em suspensão permite a determinação precisa e reprodutível do número de portadores incubados em cada experimento celular.- Configure o citômetro para detectar portadores, tanto por um canal de espalhamento óptico (normalmente dispersão lateral [SSC]) quanto por fluorescência. Certifique-se de ajustar o limite para permitir a detecção das portadoras.
NOTA: A iteração através de diferentes canais de dispersão óptica pode ser necessária se o SSC não fornecer um sinal claro (por exemplo, dispersão direta [FSC]). - Execute uma amostra somente de diluente para quantificar a contagem de eventos em segundo plano no SSC e nos canais fluorescentes.
NOTA: As contagens de eventos em segundo plano ideais são <100 eventos/s. - Prepare os transportadores para a citometria de fluxo.
- Certifique-se de que os portadores estejam bem suspensos por vórtice ou sonicação, dependendo do sistema de transporte envolvido.
- Se possível, certifique-se de que a concentração do transportador esteja entre 1.000 portadores/μL e 10.000 portadores/μL. Uma contagem de eventos de uma a duas ordens de magnitude maior do que o plano de fundo é um bom começo. Se a ordem de grandeza da concentração do transportador for desconhecida, um bom começo é preparar uma diluição de 1:1.000 do estoque. Use os resultados iniciais como feedback para informar futuras diluições de amostras.
NOTA: Uma suspensão turva é geralmente muito concentrada.
- Carregue a primeira amostra transportadora no citômetro e inicie o registro.
- Comparar contagens de eventos resultantes do SSC e dos canais de fluorescência; estes devem ser aproximadamente iguais (diferença de <10%). Caso contrário, verifique as configurações do citômetro, por exemplo, as configurações do tubo fotomultiplicador (PMT) e a intensidade do laser para o canal fluorescente. Alternativamente, use outros métodos, como a microscopia confocal, para validar que a marcação fluorescente dos portadores está presente e uniforme.
- Repita os passos 2.1.3-2.1.5 duas ou mais vezes adicionais com diluições diferentes do reserva. Certifique-se de que a contagem de eventos em cada amostra seja pelo menos uma ordem de magnitude maior do que a contagem de eventos em segundo plano.
- Verifique se três ou mais amostras apresentam uma tendência linear, ou seja, uma diluição de amostra de duas vezes deve resultar numa redução correspondente de duas vezes na concentração do transportador medida.
- Utilizar as amostras dentro da gama linear, os factores de diluição correspondentes e o caudal do citómetro conhecido para calcular a concentração do transportador de reserva de acordo com a equação (1):
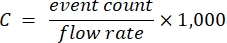 (1)
(1)
onde C é a concentração do transportador de estoque nos transportadores/mL. Recomenda-se usar a contagem de eventos derivada da detecção de espalhamento óptico em vez de fluorescência.
- Configure o citômetro para detectar portadores, tanto por um canal de espalhamento óptico (normalmente dispersão lateral [SSC]) quanto por fluorescência. Certifique-se de ajustar o limite para permitir a detecção das portadoras.
- Leitura da citometria de fluxo do experimento de células portadoras, incluindo a determinação da intensidade de fluorescência por transportadora
NOTA: Idealmente, a intensidade fluorescente por portadora será determinada o mais próximo possível do experimento de célula portadora. Isto destina-se a garantir que as IFM obtidas para portadores individuais possam ser directamente comparadas com as IFM de células associadas aos portadores. Na prática, um citômetro geralmente gera resultados semelhantes quando usado em dias consecutivos usando as mesmas tensões PMT, mas isso não pode ser garantido.- Projete o experimento de célula portadora. Utilizar a concentração do transportador determinada no passo 2.1 para administrar a dose desejada dos transportadores.
- Configure o citômetro de fluxo para o experimento final da célula portadora determinando as configurações ideais de tensão PMT nos canais relevantes. Defina os limites para permitir a detecção da operadora.
- Execute os portadores em suspensão para determinar a intensidade de fluorescência por transportadora sob as configurações atuais de PMT.
- Se necessário, altere os limiares do citômetro para detectar as células e não os portadores.
- Execute uma amostra de controle negativo - células não incubadas com portadores - para determinar a fluorescência de fundo (autofluorescência) das células.
- Execute as amostras de células portadoras para determinar a intensidade de fluorescência por célula. Esta fluorescência é uma combinação linear de autofluorescência celular e a presença de portadores fluorescentes.
- Calcule o número de portadores por célula usando a seguinte equação (2):
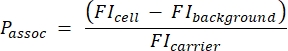 (2)
(2)
onde Passoc é o número de portadores associados por célula, célula FI é o MFI de células incubadas com portadores, fundo FI é o MFI de células não incubadas com portadores e FIcarrier é o MFI de portadores em suspensão.
3. O fluxo em massa
- Contagem de portadores: análise de rastreamento de nanopartículas
NOTA: No Bulk Stream, a contagem da transportadora é uma etapa necessária para quantificar a intensidade absoluta de fluorescência por transportadora (ver etapa 3.1.4). Além disso, a contagem dos portadores em suspensão permite a determinação precisa e reprodutível do número de portadores incubados em cada experimento celular.- Preparação
- Monte a célula de fluxo no módulo laser e trave todo o módulo laser no lugar dentro do instrumento.
- Lentamente (não mais rápido que 0,1 mL/s) lave a célula de fluxo com ~1 mL de água destilada. Se as bolhas se formarem dentro da célula de fluxo, retraia a suspensão parcialmente para fundir a bolha com a interface ar-líquido antes de prosseguir.
- Inicie a câmera mais ou menos na metade do caminho através da lavagem; Certifique-se de confirmar que os detritos da transportadora estão lavados. Selecione Capturar para abrir a guia Configurações de captura e clique em Iniciar câmera.
- Seque o sistema com 1 mL de ar. Se algum portador estático estiver visível na tela, limpe a célula de fluxo de acordo com as instruções do fabricante.
- Prepare os portadores para a Análise de Rastreamento de Nanopartículas, garantindo que os portadores estejam bem suspensos via vórtice ou sonicação, dependendo do sistema de suporte envolvido. Se a ordem de grandeza da concentração da unidade populacional for desconhecida, preparar uma diluição de 1:100 a partir da unidade populacional e utilizar os resultados iniciais como feedback para informar futuras diluições de amostras. Diluir os transportadores em água e não em solução salina tamponada com fosfato (PBS) para preparar pelo menos ~0,6-1 mL de cada amostra com uma concentração de transportador entre 1 × 107 carreadores/mL e 1 × 109 carreadores/mL.
NOTA: Uma suspensão turva é geralmente muito concentrada. Buffers e sais podem gerar alto ruído de fundo.
- Medição
- Retire o módulo laser e coloque-o na posição vertical.
- Elaborar a primeira amostra transportadora numa seringa de 1 ml. Ligue a seringa à entrada do tubo e carregue cuidadosamente a amostra na célula de fluxo. Se as bolhas se formarem dentro da célula de fluxo, retraia a suspensão parcialmente para fundir a bolha com a interface ar-líquido antes de prosseguir. Certifique-se de que toda a célula de fluxo esteja cheia de líquido e, em seguida, pause.
- Ajuste o foco da câmera, se necessário, para visualizar suportes individuais. Faça ajustes grosseiros de foco com o botão giratório no lado direito do instrumento. Faça ajustes mais precisos selecionando a guia Hardware | Bombas/Palco. Altere o foco ajustando o controle deslizante Foco .
- Ajuste o nível da câmera para garantir que não haja saturação excessiva. Na guia Capturar , selecione o Nível da câmera ideal ajustando o controle deslizante.
- Se o instrumento estiver equipado com este acessório, carregue a seringa que contém a amostra transportadora na bomba de seringa para garantir o fluxo contínuo da amostra durante as medições.
- Na guia POP , selecione Medição padrão para fazer cinco capturas de 30 s cada. Insira o nome do arquivo base e, se desejar, adicione informações de exemplo adicionais clicando no botão Avançado (que abre uma caixa de diálogo modal com uma variedade de opções).
NOTA: Se um fator de diluição for inserido, a medição final da concentração do transportador será ajustada automaticamente pelo software. Inserir este fator é desaconselhado. Em vez disso, execute o ajuste manualmente, o que facilita a análise e permite avaliar se cada diluição se enquadra na faixa dinâmica do instrumento (etapa 3.1.3.4). - Pressione Create and Run Script (Criar e Executar Script ) e aguarde a exibição de um pop-up solicitando o adiantamento da amostra.
- Se estiver a utilizar a Bomba de Seringa, selecione o separador Hardware | Guia Bomba de seringa | defina a Taxa de Infusão em 30-80 e pressione Infundir. Se não estiver a utilizar a bomba de seringa, avance manualmente a amostra.
- Na janela pop-up, selecione OK para iniciar a captura. Após cada uma das cinco capturas, quando o pop-up Avançar amostra reaparecer, verifique se a amostra ainda está se movendo através da célula de fluxo, manualmente ou através da bomba de seringa. Em seguida, selecione OK para prosseguir com a próxima captura.
NOTA: Após cinco capturas, o software abre automaticamente a guia Processo e abre um pop-up pedindo para ajustar as configurações do processo.
- Análise
- Na guia Processo , ajuste o controle deslizante Limiar de Detecção (entre 4 e 8) para identificar corretamente portadores distintos visíveis na tela. Ajuste o Ganho de Tela também para ajudar na visualização; não afectará a análise a jusante. Use o controle deslizante sob a tela de captura para percorrer vários quadros do vídeo para ajudar na configuração de limite de detecção.
NOTA: O limiar de detecção deve ser definido uma vez e, posteriormente, não deve ser alterado entre medições ou amostras. - No pop-up (observação após a etapa 3.1.2.9), pressione OK para iniciar a análise de rastreamento. Monitore o progresso da análise clicando na guia Análise | Guia Análise única .
- Quando a análise estiver concluída, procure um prompt de Configurações de exportação para aparecer, no qual Incluir PDF e Incluir resumo do experimento devem ser selecionados por padrão. Selecione quaisquer outros formatos de exportação conforme desejado.
- Na seção Resultados da exportação de dados em PDF, para garantir que a concentração medida seja confiável, verifique se a concentração do transportador medida está entre 1 × 107 portadores/mL e 1 × 109 portadores/mL - a faixa dinâmica do instrumento - e verifique se há mensagens de erro ou mensagens de cautela abaixo do resultado da medição de concentração.
- Repetir os passos 3.1.2.1-3.1.3.4 duas ou mais vezes com diluições diferentes da existência. Certifique-se de que a concentração de cada amostra se enquadra na faixa linear do instrumento.
- Selecione três ou mais amostras que mostrem uma tendência linear, ou seja, uma diluição de amostra de duas vezes deve resultar em uma redução de duas vezes correspondente na concentração de transportador medida. Utilizar as amostras seleccionadas e os factores de diluição correspondentes para calcular a concentração do transportador de existências.
- Na guia Processo , ajuste o controle deslizante Limiar de Detecção (entre 4 e 8) para identificar corretamente portadores distintos visíveis na tela. Ajuste o Ganho de Tela também para ajudar na visualização; não afectará a análise a jusante. Use o controle deslizante sob a tela de captura para percorrer vários quadros do vídeo para ajudar na configuração de limite de detecção.
- Determinação da intensidade absoluta de fluorescência por transportadora
NOTA: Uma vez que a fluorescência de portadores individuais neste fluxo não pode ser caracterizada diretamente, a intensidade de fluorescência é quantificada a granel. Este método baseia-se no fato de que a intensidade da fluorescência está linearmente relacionada à concentração de fluorocromo de acordo com a lei de Lambert-Beer. Quando essa quantificação a granel dos transportadores em suspensão é feita numa suspensão de concentração conhecida do transportador (ver etapa 3.1), a fluorescência por transportador pode ser obtida. Esta etapa pode ser feita em um leitor de placa de fluorescência ou em um espectrofluorômetro. A intensidade de fluorescência é comparada a uma curva padrão de amostras com fluorescência absoluta conhecida, dada em número de MESFs.- Use uma solução do fluorocromo livre para rotular o transportador: ressuscite o corante no tampão apropriado (por exemplo, DMSO) e execute diluições adicionais no mesmo tampão que o diluente transportador. Alternativamente, use uma solução de um anticorpo conjugado ao fluorocromo. Calcular a concentração da solução-mãe (MESF/ml) a partir da concentração em mg/ml, do peso molecular em mg/mol e do número de Avogadro utilizando a equação (3). Efectuar uma diluição em série no diluente transportador para gerar amostras de curva padrão.
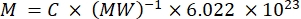 (3)
(3)
NOTA: Use um anticorpo conjugado com fluorocromo somente se o grau de marcação, ou seja, a relação molar entre o fluorocromo e o anticorpo na solução, for conhecido. Inicialmente, gere uma curva padrão com uma ampla gama, pois a intensidade de fluorescência da amostra portadora ainda é desconhecida. A partir daqui, restrinja-o para incluir o intervalo necessário. - Prepare as amostras do portador.
NOTA: A melhor prática é testar duas ou mais diluições de transportadores para validar que as medições são lineares e estão dentro do intervalo da curva padrão. - Meça a fluorescência de volumes iguais de cada amostra, ou seja, curvas portadoras e padrão.
- Gerar uma curva padrão e deduzir a intensidade de fluorescência absoluta em massa em MESF/mL para as amostras transportadoras medidas.
- Calcular a intensidade absoluta de fluorescência por transportador (MESF/transportador) dividindo a fluorescência a granel (MESF/mL) pela concentração do transportador (transportadores/mL) como na equação (4):
 (4)
(4)
- Use uma solução do fluorocromo livre para rotular o transportador: ressuscite o corante no tampão apropriado (por exemplo, DMSO) e execute diluições adicionais no mesmo tampão que o diluente transportador. Alternativamente, use uma solução de um anticorpo conjugado ao fluorocromo. Calcular a concentração da solução-mãe (MESF/ml) a partir da concentração em mg/ml, do peso molecular em mg/mol e do número de Avogadro utilizando a equação (3). Efectuar uma diluição em série no diluente transportador para gerar amostras de curva padrão.
- Experimento celular (incluindo a determinação da intensidade de fluorescência equivalente por portador)
NOTA: Nesta etapa, os grânulos de quantificação de citometria de fluxo são usados para gerar uma curva padrão da relação entre MESF e MFI. Essas contas de quantificação consistem em várias populações de contas com um número conhecido de MESF por conta, e essas contas individuais podem ser detectadas por qualquer citômetro. Idealmente, a curva padrão MESF é determinada ao mesmo tempo que a leitura dos experimentos de células portadoras. Isto destina-se a garantir que os valores de IFM calculados para portadores individuais possam ser diretamente comparados com os IFM de células associadas a portadores. Na prática, um citômetro geralmente gera resultados semelhantes quando usado em dias consecutivos usando as mesmas tensões PMT, mas isso não pode ser garantido.- Projete o experimento de célula portadora. Utilizar a concentração do transportador determinada na secção 3.1.3 para administrar a dose desejada dos transportadores.
- Configure o citômetro de fluxo para o experimento final da célula portadora determinando as configurações ideais de tensão PMT nos canais relevantes.
- Execute uma amostra de controle negativo, ou seja, células não incubadas com portadores, para determinar a fluorescência de fundo.
- Prepare e ressuspenda as contas de quantificação da citometria de fluxo. Use o mesmo buffer usado para as amostras de células (por exemplo, PBS). Se as populações de contas forem fornecidas separadamente, agrupe-as.
- Execute a amostra de contas de quantificação por citometria de fluxo.
- Execute as amostras de células portadoras para determinar a intensidade de fluorescência por célula.
- Use a amostra de contas de quantificação para gerar uma curva padrão convertendo a intensidade absoluta de fluorescência (MESF) em MFI. Utilizar esta curva padrão e os resultados da etapa 3.1.4 para calcular a IFM teórica dos portadores. Calcule o número de portadores por célula usando a equação (5):
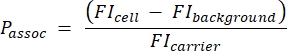 (5)
(5)
Em que Passoc é o número de portadores associados por célula, célula FI é o IFM de células incubadas com portadores, FI fundo é o IFM de células não incubadas com portadores e FI portador é o IFM calculado de portadores em suspensão (etapa 3.1.4).
- Preparação
Resultados
Como discutido anteriormente, diferentes tipos de portadores de drogas requerem o uso de diferentes técnicas para a quantificação absoluta da associação célula-portador. Por exemplo, as partículas de núcleo-casca de poli(ácido metacrílico) estabilizadas com dissulfeto de 633 nm (PMASH) são grandes e densas o suficiente para detecção usando um citômetro de fluxo sensível. Dessa forma, essas partículas foram marcadas fluorescentemente, depois fechadas e contadas por meio de espalhamento de luz de...
Discussão
Caracterizar as interações entre portadores de drogas e células está se tornando cada vez mais importante no desenvolvimento de novos sistemas de liberação de medicamentos. Especificamente, para permitir a avaliação racional e a comparação de vários construtos de portadores, a quantificação absoluta do desempenho do referido portador para interagir com células-alvo e fora do alvo é fundamental. Este protocolo descreve uma metodologia de dois fluxos que permite a qualquer pesquisador que trabalhe com um por...
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Australian National Health and Medical Research Council (NHMRC; Subsídio do Programa No. GNT1149990), o Centro Australiano de Pesquisa em Virologia de HIV e Hepatite (ACH2), bem como um presente do espólio de Réjane Louise Langlois. F.C. reconhece a concessão de uma Bolsa de Pesquisa Principal Sênior do Conselho Nacional de Saúde e Pesquisa Médica (NHMRC) (GNT1135806). A Figura 1 e a Figura 2 foram criadas com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 647 C2 Maleimide | Invitrogen | A20347 | pH-stable dye used to label 150 nm, 235 nm, or 633 nm PMASH carriers; example of good dye to use in cell-carrier association studies |
| Apogee A50 Microflow | Apogee | Sensitive flow cytometer capable of detecting small carriers for counting | |
| CytoFLEX S Flow Cytometer | Beckman Coulter | Sensitive flow cytometer capable of detecting small carriers for counting and read out for final cell-barrier experiments | |
| FCS Express | De Novo Software | Software used to analyze flow cytometry data, i.e., perform gating and derive median fluorescence intensity values of populations of choice. Alternatives include FlowJo, OMIQ, Python | |
| Infinite 200 PRO | Tecan Lifesciences | Standard microplate reader instrument used for bulk fluorescence measurements of carriers in solution | |
| LSRFortessa Cell Analyzer | BD Biosciences | Less sensitive flow cytometer, but one more generally available to researchers. Can be used to read out final cell-carrier experiment | |
| NanoSight NS300 | Malvern Panalytical | Instrument used for Nanoparticle Tracking Analysis | |
| Prism 8 | GraphPad | Software used to graph and calculate standard curves. Alternatives include Microsoft Excel, Origin, Minitab, Python amongst many others | |
| Quantum MESF kits Alexa Fluor 647 | Bangs Laboratories | 647 | Absolute quantitation beads for flow cytometery. Used to convert fluorescence intensities measured in bulk on a microplate reader to fluorescence intensities measured on a flow cytometer using the MESF standard |
Referências
- Conde, J., et al. Revisiting 30 years of biofunctionalization and surface chemistry of inorganic nanoparticles for nanomedicine. Frontiers in Chemistry. 2, 48 (2014).
- Cheng, Q., et al. Selective ORgan Targeting (SORT) nanoparticles for tissue specific mRNA delivery and CRISPR/Cas gene editing. Nature Nanotechnology. 15 (4), 313-320 (2020).
- Jackson, N. A. C., Kester, K. E., Casimiro, D., Gurunathan, S., DeRosa, F. The promise of mRNA vaccines: A biotech and industrial perspective. npj Vaccines. 5 (1), 1-6 (2020).
- Press, A. T., et al. Cargo-carrier interactions significantly contribute to micellar conformation and biodistribution. NPG Asia Materials. 9 (10), 444 (2017).
- Cevaal, P. M., et al. In vivo T cell-targeting nanoparticle drug delivery systems: Considerations for rational design. ACS Nano. 15 (3), 3736-3753 (2021).
- Faria, M., Johnston, S. T., Mitchell, A. J., Crampin, E., Caruso, F. Bio-nano science: Better metrics would accelerate progress. Chemistry of Materials. 33 (19), 7613-7619 (2021).
- Shin, H., Kwak, M., Geol Lee, T., Youn Lee, J. Quantifying the level of nanoparticle uptake in mammalian cells using flow cytometry. Nanoscale. 12 (29), 15743-15751 (2020).
- Lozano-Andrés, E., et al. Considerations for MESF-bead based assignment of absolute fluorescence values to nanoparticles and extracellular vesicles by flow cytometry. bioRxiv. , (2021).
- Schwartz, A., et al. Formalization of the MESF unit of fluorescence intensity. Cytometry. Part B, Clinical Cytometry. 57 (1), 1-6 (2004).
- Faria, M., et al. Revisiting cell-particle association in vitro: A quantitative method to compare particle performance. Journal of Controlled Release. 307, 355-367 (2019).
- Chen, A. K., Cheng, Z., Behlke, M. A., Tsourkas, A. Assessing the sensitivity of commercially available fluorophores to the intracellular environment. Analytical Chemistry. 80 (19), 7437-7444 (2008).
- Comfort, N., et al. Nanoparticle tracking analysis for the quantification and size determination of extracellular vesicles. Journal of Visualized Experiments. (169), e62447 (2021).
- Cui, J., et al. Immobilized particle imaging for quantification of nano- and microparticles. Langmuir. 32 (14), 3532-3540 (2016).
- Shang, J., Gao, X. Nanoparticle counting: Towards accurate determination of the molar concentration. Chemical Society Reviews. 43 (21), 7267-7278 (2014).
- Thomas, D. G., et al. ISD3: A particokinetic model for predicting the combined effects of particle sedimentation, diffusion and dissolution on cellular dosimetry for in vitro systems. Particle and Fibre Toxicology. 15 (1), 6 (2018).
- Johnston, S. T., Faria, M., Crampin, E. J. Isolating the sources of heterogeneity in nano-engineered particle-cell interactions. The Journal of the Royal Society Interface. 17 (166), 20200221 (2020).
- Ahmed-Cox, A., et al. Spatio-temporal analysis of nanoparticles in live tumor spheroids impacted by cell origin and density. Journal of Controlled Release. 341, 661-675 (2022).
- Faria, M., et al. Minimum information reporting in bio-nano experimental literature. Nature Nanotechnology. 13 (9), 777-785 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados