Method Article
Geração, Triagem de Alto Rendimento e Biobanco de Esferoides Cardíacos Derivados de Células-Tronco Pluripotentes Induzidos por Humanos.
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Apresenta-se aqui um conjunto de protocolos para a geração e criopreservação de esferoides cardíacos (CSs) de cardiomiócitos derivados de células-tronco pluripotentes induzidos por humanos cultivados em um formato multidimensional de alto rendimento. Esse modelo tridimensional funciona como uma plataforma robusta para modelagem de doenças, rastreios de alto rendimento e mantém sua funcionalidade após a criopreservação.
Resumo
Os cardiomiócitos derivados de células-tronco pluripotentes induzidos por humanos (hiPSC-CMs) são de suma importância para a modelagem e terapêutica de doenças cardíacas humanas. Publicamos recentemente uma estratégia econômica para a expansão maciça de CM-hiPSC em duas dimensões (2D). Duas grandes limitações são a imaturidade celular e a falta de arranjo tridimensional (3D) e escalabilidade em plataformas de triagem de alto rendimento (HTS). Para superar essas limitações, os cardiomiócitos expandidos formam uma fonte celular ideal para a geração de cultura de células cardíacas 3D e técnicas de engenharia de tecidos. Este último possui grande potencial no campo cardiovascular, proporcionando HTS mais avançada e fisiologicamente relevante. Aqui, descrevemos um fluxo de trabalho compatível com HTS com fácil escalabilidade para a geração, manutenção e análise óptica de esferoides cardíacos (CSs) em um formato de 96 poços. Esses pequenos CSs são essenciais para preencher a lacuna presente nos atuais modelos de doenças in vitro e/ou geração para plataformas de engenharia de tecidos 3D. Os CSs apresentam morfologia, tamanho e composição celular altamente estruturados. Além disso, os CMs hiPSC cultivados como CSs apresentam maturação aumentada e várias características funcionais do coração humano, como manuseio espontâneo de cálcio e atividade contrátil. Ao automatizar o fluxo de trabalho completo, desde a geração de CSs até a análise funcional, aumentamos a reprodutibilidade intra e interlotes, conforme demonstrado pela imagem de alto rendimento (HT) e pela análise de manuseio de cálcio. O protocolo descrito permite a modelagem de doenças cardíacas e a avaliação de efeitos medicamentosos/terapêuticos no nível de uma única célula dentro de um ambiente complexo de células 3D em um fluxo de trabalho HTS totalmente automatizado. Além disso, o estudo descreve um procedimento simples para preservação a longo prazo e biobanco de esferoides inteiros, proporcionando aos pesquisadores a oportunidade de criar armazenamento de tecidos funcionais de próxima geração. O HTS combinado com o armazenamento de longo prazo contribuirá substancialmente para a pesquisa translacional em uma ampla gama de áreas, incluindo descoberta e teste de medicamentos, medicina regenerativa e desenvolvimento de terapias personalizadas.
Introdução
A descoberta de células-tronco pluripotentes induzidas por humanos (hiPSCs) ofereceu oportunidades sem precedentes para estudar o desenvolvimento humano e a doença no nível celular. Ao longo da última década, utilizando lições de desenvolvimento, vários protocolos têm sido estabelecidos para garantir a diferenciação eficiente de hiPSCs em cardiomiócitos (MCs)1,2,3,4. Os cardiomiócitos derivados de hiPSC (hiPSC-CMs) podem servir como um recurso para modelar doenças cardiovasculares geneticamente hereditárias (DCV), testar a segurança cardíaca para novos medicamentos e estratégias regenerativas cardíacas 5,6,7,8. Apesar da diferenciação cardíaca direcionada das hiPSCs, os números indefinidos de MC continuam sendo um desafio no campo cardíaco, uma vez que os CM-HCs hiPSC amadurecidos geralmente não são proliferativos e as células humanas primárias não estão disponíveis em grandes quantidades.
Recentemente, descrevemos que a ativação concomitante da sinalização Wnt com cultura de baixa densidade celular resultou em uma resposta proliferativa maciça (até 250 vezes) de hiPSC-CMs 9,10. Essa estratégia econômica para a expansão maciça de hiPSC-CMs via passagem serial em formato de frasco de cultura facilita a padronização e o controle de qualidade de um grande número de hiPSC-CMs funcionais. Além disso, para acompanhar a demanda por grandes lotes de hiPSC-CMs de vários doadores, o biobanco de hiPSC-CMs tem sido descrito10. No entanto, as monocamadas de cardiomiócitos semeadas nessas placas de cultura padrão não são representativas da complexa estrutura 3D presente no coração. Além disso, a imaturidade dos CME-hiPSC tem permanecido um obstáculo, ficando aquém de imitar o fenótipo biológico e fisiológico do ambiente cardiovascular in vivo.
Novos modelos 3D in vitro foram desenvolvidos onde os CM-hiPSC mostram um comportamento fisiológico mais próximo, como auto-organização 11,12, remodelamento da matriz extracelular (ECM) 13, maturação aumentada 14,15,16 e contração sincronizada17,18,19 . Modelos 3D têm sido utilizados para descoberta de medicamentos, testes de cardiotoxicidade de medicamentos, modelagem de doenças, terapias regenerativas e até mesmo os primeiros ensaios clínicos 20,21,22,23,24. Um dos modelos mais utilizados é o tecido cardíaco modificado à base de fibrina (EHT), que apresenta arranjo tecidual e contratilidade cardíaca13,17,25. Anteriormente, mostramos que os EHTs gerados a partir de hiPSC-CMs expandidos exibiam contratilidade comparável aos de hiPSC-CMs não expandidos, demonstrando funcionalidade celular não comprometida após a expansão9. No entanto, embora a geração de EHTs a partir de CM-hiPSC tenha sido bem estabelecida, esperam-se novos desenvolvimentos em relação ao estabelecimento de uma plataforma de avaliação de HT. Aqui, a rápida geração de um grande número de esferoides cardíacos auto-agregadores (CSs) no formato de 96 poços permite uma melhoria nas condições 3D para fins de triagem de alto rendimento (HTS).
No geral, a vantagem dos CSs como cultura de células 3D é sua alta reprodutibilidade e escalabilidade. Em particular, os CSs combinados com o manuseio robótico de amostras podem padronizar e automatizar a cultura de CS, o tratamento medicamentoso e a análise de alto conteúdo20. Aqui, descrevemos protocolos otimizados para gerar CSs de alta pureza e alta qualidade, que podem ser eficientemente criopreservados e rastreados para a função cardíaca, realizando medições transitórias de Ca2+ usando um sistema óptico de aquisição e análise de cálcio. Este modelo fornece uma ferramenta simples, mas poderosa, para executar telas de alto rendimento em centenas a milhares de esferoides17,18.
Protocolo
NOTA: os CM-hiPSC utilizados neste estudo foram gerados de acordo com os protocolos de cultura e diferenciação de CM descritos anteriormente26,27. Opcionalmente, os CM-hiPSC podem ser expandidos e criopreservados conforme publicado recentemente antes do início do protocolo CS (seção 4)10.
1. Preparação de meios de cultura celular, soluções e alíquotas
- Preparar o meio basal
- Equilibre a penicilina-estreptomicina e o meio (RPMI 1640) à temperatura ambiente (RT) e certifique-se de que descongelou completamente. Misture 500 mL do meio e 5 mL de caneta/estreptococos. Conservar a 4 °C durante um período máximo de 8 semanas; equilibrar-se a 37 °C antes da utilização.
- Preparar RPMI + B27
- Equilibre o suplemento de B27 e o meio basal para RT. Certifique-se de descongelar o suplemento completamente. Misture 490 mL do meio basal e 10 mL do suplemento 50x B27. Conservar a 4 °C durante um período máximo de 2 semanas; equilibrar-se a 37 °C antes da utilização.
- Preparar o re-revestimento hiPSC-CM
- Adicione o inibidor de proteína quinase (ROCK) associado a Rho (concentração final de 2 μM) e a 10% de reposição sérica por nocaute (KSR) a meios RPMI + B27. Adicione o inibidor de ROCK diretamente ao meio RM, conforme necessário. Não armazene meios de cultura uma vez suplementados.
- Preparar o meio de descongelamento CM
- Adicione uma concentração de 1:100 de suplemento de sobrevivência celular (por exemplo, Revitacell) e KSR a 20% ao meio RPMI + B27 e equilibre-se a 37 °C antes do uso.
- Prepare o suplemento de maturação
- A fórmula28 do meio de maturação descrita anteriormente consiste em: 3 mM de glicose, 10 mM de L-lactato, 5 mg/mL de vitamina B12, 0,82 mM de biotina, 5 mM de creatina monohidratada, 2 mM de taurina, 2 mM de L-carnitina, 0,5 mM de ácido ascórbico, 1x NEAA, 0,5% (p/v) albumax, 1x B27 e 1% KOSR. Para preparar um frasco cheio (500 mL) de suplemento de maturação, remova 65 mL de um frasco de DMEM sem glicose e complemente com 2,7 g de glicose, 5,6 g de L-lactato, 0,025 mg de vitamina B12, 1 mg de Biotina, 3,73 g de creatina monohidratada, 1,25 g de taurina, 1,975 g de L-carnitina, 0,7125 g de ácido ascórbico, 50 mL de NEAA, 12,5 g de albumax e 5 mL de penicilina-estreptomicina.
- Filtrar através de uma unidade de filtro descartável estéril com uma membrana de polietersulfona (PES) de poros de 0,22 μm.
- Aliquota em 45 mL (para preparar 500 mL de meio de maturação) ou 4,5 mL (para preparar 50 mL de meio de maturação). Conservar a 20 °C até 6 meses.
- Preparar meios de maturação
- Equilibre o suplemento B27, o SR nocauteado, a penicilina-estreptomicina, o suplemento de maturação28 e o meio DMEM sem glicose no RT. Certifique-se de descongelar o suplemento completamente. Misture 435 mL do meio DMEM sem glicose com 10 mL do suplemento 50x B27, 5 mL de penicilina-estreptomicina, 5 mL de SR nocaute e 45 mL de suplemento de maturação. Conservar a 4 °C durante um período máximo de 2 semanas; equilibrar-se a 37 °C antes da utilização.
- Prepare o meio brilhante de flúor
- Equilibre a penicilina-estreptomicina e o meio fluorobrito DMEM no RT. Certifique-se de que o suplemento esteja completamente descongelado. Misture 500 mL do meio fluorbrite DMEM com 5 mL de penicilina-estreptomicina. Conservar a 4 °C até 1 mês; equilibrar-se a 37 °C antes da utilização.
- Preparar a solução detergente não iónica
- Misture 20% p/v detergente em pó não iônico (por exemplo, F-127) com PBS. Filtrar utilizando um filtro de 0,22 μm e conservar a 4 °C durante até 6 meses; equilibrar-se no RT antes do uso.
- Preparar meio corante de cálcio
- Misture a solução detergente não iônica (concentração final de 0,04% v/v) e 0,1x do corante de cálcio (por exemplo, Cal520 AM) em meio brilhante de flúor. Num tubo cónico de 50 ml, adicionar 10 μL de Cal520 e 20 μL da solução detergente não iónica. Misture até ficar totalmente dissolvido. Mantenha a solução no escuro antes de adicionar às células.
2. Preparação de buffers
- Preparar tampão de permeabilização e bloqueio: Este tampão contém 10 mL de PBS, 5% em peso/v BSA e 0,3% v/v Triton-X-100.
- Prepare o tampão de citometria de fluxo: Este tampão contém 50 mL de PBS, 1% em peso/v BSA e 0,3% v/v Triton-X-100.
- Tampão de lavagem por citometria de fluxo: Este tampão contém 50 mL de PBS e 1% em peso/v BSA.
- Tampão de lavagem esferoide (SWB): Este tampão contém 1 mL de Triton-X-100, 2 mL de SDS de 10% (p/v em DPBS) e 2 g de BSA em 1 L de PBS.
NOTA: O SWB pode ser armazenado a 4 °C por até 2 semanas. - Preparar a solução de incorporação (ES): Para preparar 100 mL da solução de incorporação, misture 50 mL de glicerol com 9,09 mL de dH2O, 1 mL de tampão Tris (1 M, pH 8,0) e 200 μL de EDTA (0,5 M). Adicionar 22,7 g de frutose e misturar a RT no escuro até dissolver. Quando estiver límpido, adicionar 22,2 g de frutose e misturar até dissolver. Em seguida, adicionar 15 g de ureia e misturar até dissolver (conservar a 4 °C no escuro).
- Prepare o buffer PBT (PBS com interpolação-20). Esse buffer contém PBS/Tween-20 (0,1% v/v). Para 1 L de PBS, adicione 1 mL de Tween-20.
3. Preparação de pequenas moléculas
- Reconstituir o pó de tiazovivina (inibidor de ROCK) em alíquotas de 10 mM de 50 μL em DMSO e conservar a -20 °C até 6 meses. Proteja da luz.
- Prepare alíquotas de 2,5 mM de 10 μL cada de Cal-520 AM em DMSO e armazene-as a -20 °C por até 6 meses. Proteja da luz.
4. Geração de esferoides cardíacos
NOTA: Para quantidades maiores de CSs, semeie até 1 milhão de CMs em uma placa de fixação ultrabaixa de 6 poços com 2 mL de meio de re-revestimento hiPSC-CM. Este estudo utilizou um mínimo de 2.500 (2,5k CS) até 20.000 (20k CS) hiPSC-CMs por poço de uma placa de 96 poços.
- Para uma placa de 96 poços, preparar uma cultura de células contendo um mínimo de 2 x 106 cardiomiócitos derivados de células-tronco pluripotentes induzidos por humanos (hiPSC-CMs)10.
- Quando os CM-hiPSC cultivados atingirem a confluência, adicione 0,1 mL/cm2 de solução de descolamento cardíaco estéril (por exemplo, tríplice) a cada poço. Incubar a placa a 37 °C durante 15 minutos.
- Usando uma pipeta de 5 mL, dissociar mecanicamente as células por lavagem com 2 mL de meio basal quente para fazer uma única suspensão celular. Confirme o descolamento com um microscópio de campo brilhante (ampliação de 4x); as células parecerão brancas e terão uma forma redonda.
- Transfira a suspensão celular para um tubo cônico de 15 mL e centrífuga por 3 min a 300 x g.
- Aspirar o sobrenadante e ressuspender as células em 1 mL de meio de replaqueamento hiPSC-CM.
- Usando uma ponta de pipeta de 1.000 μL, dissociar mecanicamente a pastilha celular. A solução parece homogénea após três ou quatro misturas. Conte as células. Transfira a quantidade apropriada de células em 100 μL do meio de re-chapeamento para cada poço de fixação ultra-baixa de fundo redondo de 96 poços.
- Coloque a placa de CSs em um agitador orbital a 70 rpm na incubadora por 24 h. Ajuste as condições da incubadora para 37 °C, 5% de CO 2, 21% de O2 e 90% de umidade.
- Aspirar 50 μL de meio de cada poço e adicionar 100 μL de RPMI + B27 de meio por poço durante as primeiras 48 h.
NOTA: Mantenha sempre 50 μL do meio na placa de 96 poços para evitar aspiração acidental e ruptura esferoide. - Aspirar 100 μL do meio de cada poço e adicionar 100 μL do meio de maturação por poço. Mantenha as células no meio de maturação e atualize o meio a cada 2-3 dias.
5. Criopreservação de CSs
NOTA: CSs podem ser criopreservados para armazenamento a longo prazo. A criopreservação pode ser realizada a partir do dia 3 após a geração de CSs. CSs podem ser criopreservados diretamente nos poços de uma placa de 96 poços ou como uma suspensão de CS em crioviais.
- Pré-resfrie a placa colocando a placa no gelo por 10 min.
- Centrifugar a placa esferoide durante 3 min a 70 x g.
- Remova o sobrenadante até que 50 μL permaneçam e adicione 200 μL de meio de congelamento de hiPSC gelado por poço.
NOTA: Mantenha a suspensão CS no gelo durante toda a duração do procedimento. No caso de uma placa de 6 poços com esferoides, congele um poço em um meio de congelamento de 500 μL criovial. - Sele a placa com filme de vedação de placa.
NOTA: A placa de 96 poços precisa ser armazenada em uma caixa de poliestireno ou, quando não disponível, um molde de silício pode ser feito conforme descrito na etapa 5.5.1. - Para garantir uma troca de calor uniforme entre a placa do poço e o congelador, coloque a placa cuidadosamente em uma caixa de poliestireno ou em um molde de silício.
- Para preparar o molde de silício: Misture vigorosamente dois componentes do kit de elastômero de silício em uma proporção de 10:1. Desborhe a solução usando uma bomba de vácuo por 15-20 min. Posteriormente, fundir a solução dentro da parte inferior da placa do poço e desbordar usando uma bomba de vácuo por 10 min. Coloque o molde num forno e cure a 60 °C durante 8 h para obter um elastômero semi-flexível que é retirado da placa.
- Congelar a placa a -80 °C durante um período mínimo de 4 h na caixa de poliestireno ou no molde de silício preparado.
- Transfira a placa para um tanque de nitrogênio líquido ou um freezer de -150 °C para armazenamento a longo prazo.
6. Descongelamento de esferoides cardíacos
NOTA: Não descongele mais do que uma placa de cada vez para garantir um processo de descongelamento rápido.
- Preparar 20 ml de meio basal pré-aquecido a 37 °C num tubo cónico de 50 ml.
- Recolha a placa celular com CSs do azoto líquido e coloque-a na incubadora durante 15 min. Ajuste as condições da incubadora para 37 °C, 5% de CO 2, 21% de O2 e 90% de umidade.
- Remova o sobrenadante e o pellet celular permanece, e ressuspenda cada poço em um meio basal quente. Use 200 μL de meio por poço.
- Centrífuga por 3 min a 70 x g.
- Repita as etapas 6.3 e 6.4.
- Remova o sobrenadante até que o pellet celular permaneça e adicione 200 μL de meio de descongelamento CM em cada poço.
- Coloque a placa de CSs em um agitador orbital a 70 rpm em uma incubadora por 24 h. Ajuste as condições da incubadora para 37 °C, 5% de CO 2, 21% de O2 e 90% de umidade.
- Aspirar 50 μL do meio de cada poço e adicionar 100 μL de RPMI + B27 de meio por poço durante as primeiras 48 h.
- Aspirar 100 μL do meio de cada poço e adicionar 100 μL de meio de maturação por poço. Mantenha as células no meio de maturação e atualize o meio a cada 2-3 dias.
7. Avaliação dos transientes intracelulares de Ca2+
NOTA: Os CSs estão em cultura por um total de 3 semanas; 2 semanas antes do congelamento e 1 semana após o descongelamento. Os controles "frescos" são compatíveis com a idade.
- Após 1 semana de cultura, os CSs descongelados são ideais para imagens ópticas de manipulação de cálcio. Use um corante de cálcio (por exemplo, Cal520AM) para avaliar a captação e liberação de Ca2+ das células.
- Trate-os com 100 μL de meio corante de cálcio por poço e incube por 60 min na incubadora. Ajuste as condições da incubadora para 37 °C, 5% de CO 2, 21% de O2 e 90% de umidade.
NOTA: Cal520AM é sensível à luz. Execute todos os procedimentos de carregamento e experimentos no escuro. - Prepare o sistema de aquisição e análise de cálcio.
- Ligue o microscópio, garantindo que a opção de controle ambiental esteja ligada.
- Ajuste as dimensões da câmera e da abertura do enquadramento para minimizar a área de fundo.
NOTA: Aqui, foi utilizado o microscópio Leica Thunder DMi8; outros sistemas de microscópio também são aplicáveis até que permitam uma taxa de amostragem acima de 30 quadros/segundo (fps).
- Grave um vídeo com um fluxo consistente de 2 a 10 picos dentro de 10 s e digitalize a placa de 96 poços, inicialmente movendo-se para a esquerda e, em seguida, para baixo em zigue-zague para cobrir toda a placa. Medir o sinal de cálcio usando um laser de 488 nm; defina o contraste para um fundo preto com um sinal verde brilhante durante a liberação de cálcio.
- Depois de adquirir os transientes Ca2+ , analise os dados com o software de análise de traços de fluorescência (por exemplo, CyteSeer, Vala Sciences) de acordo com as instruções do fabricante.
8. Análise da citometria de fluxo de esferoides cardíacos dissociados
NOTA: Neste estudo, a citometria de fluxo foi utilizada para determinar a viabilidade dos CSs antes e após o processo de descongelamento.
- Coletar os CSs em um tubo cônico de 15 mL usando um pipeta de 5 mL para evitar danos esferoides e centrifugar por 3 min a 70 x g. Aspirar o sobrenadante e adicionar 1 mL de PBS.
- Centrífuga por 3 min a 200 x g. Aspirar o sobrenadante e dissociar os CSs adicionando 1 mL de solução de descolamento cardíaco (por exemplo, triplo). Incubar o tubo a 37 °C durante 15 minutos.
- Usando uma pipeta de 5 mL, dissociar mecanicamente as células por lavagem com 2 mL de meio basal até que células individuais possam ser vistas quando observadas ao microscópio.
- Centrífuga por 3 min a 200 x g.
- Aspirar o sobrenadante e fixar os MCs com 200 μL de solução de paraformaldeído (PFA) a 4% em PBS 1x. Incubar por 10 min no RT.
- Centrífuga por 3 min a 200 x g. Aspirar o sobrenadante e adicionar 1 mL de PBS.
NOTA: Ponto de pausa: Os hiPSC-CMs fixos podem ser armazenados a 4 °C por até 4 semanas. - Transfira a suspensão da célula para um tubo FACS e centrífuga por 3 min a 200 x g. Aspirar o sobrenadante e ressuspender 1 x 105 células em 50 μL do tampão de permeabilização.
- Incubar as células durante 30 min a 4 °C.
- Para análise de citometria de fluxo de imunofluorescência, execute as etapas 8.9.1-8.9.4.
- Ressuspender as células do tampão de citometria de fluxo (50 μL) contendo o anticorpo α-actinina a uma diluição de 1:300. Em outro tubo FACS, ressuscite 1 x 105 células no tampão de citometria de fluxo (50 μL) com o respectivo controle isotipo (por exemplo, IgM de camundongo FITC, isotipo κ [diluição 1:200]). Da mesma forma, ressussuscite 1 x 105 células em 50 μL de tampão de citometria de fluxo para controle negativo.
- Incubar as células durante 30 min a 4 °C.
- Adicionar 2,5 mL de tampão de citometria de fluxo e centrifugar as células a 200 x g por 3 min a 4 °C; descarte o sobrenadante e repita esta etapa de lavagem duas vezes.
- Ressuscite as células em 50 μL de tampão de citometria de fluxo com o anticorpo secundário de cabra-anti-rato (diluição de 1:300).
NOTA: Coloque o tubo no escuro, uma vez que a solução de anticorpos secundários é sensível à luz.
- Para verificação de viabilidade com iodeto de propídio (PI), adicionar 150 μL de PI por amostra (1:1.000) e incubar por 15 min.
NOTA: Coloque o tubo no escuro, uma vez que a solução PI é sensível à luz. - Ajuste as comportas de acordo com a estratégia de bloqueio padrão, conforme mostrado na Figura 1 Suplementar, e analise as células com um citômetro de fluxo.
9. Coloração por imunofluorescência de esferoides 3D inteiros
NOTA: Este protocolo baseia-se no protocolo para imagem 3D de alta resolução de organoides inteiros mediante marcação imunofluorescente, que foi previamente publicado29 e ajustado para esferoides cardíacos. Durante o procedimento, todas as pontas da pipeta e tubos cônicos podem ser revestidos com 1% em peso / v BSA-PBS, a fim de evitar que os esferoides grudem nos plásticos. Para revestir os materiais, mergulhe no BSA-PBS de 1%. Tenha cuidado para não danificar os esferoides usando a pipeta de 5 mL, evitando a interrupção mecânica.
- Coletar os CSs em um tubo revestido de 15 mL com um pipeta de 5 mL. Os esferoides são visíveis aos olhos. Colete ~20-50 esferoides por combinação de anticorpos. Centrifugar durante 3 min a 70 x g e aspirar o sobrenadante.
- Ressussuscite cuidadosamente os esferoides em 1 mL de solução gelada de paraformaldeído a 4% (PFA) em PBS 1x usando uma ponta revestida de 1 mL.
- Fixar a 4 °C durante 45 min. Após 20 min, ressuscite suavemente os esferoides usando uma ponta revestida de 1 mL. Isso equilibra a fixação entre todos os esferoides.
- Adicione 10 mL de PBS gelado ao tubo e misture suavemente invertendo o tubo. Incubar durante 10 min a 4 °C e girar para baixo a 70 x g durante 3 min.
NOTA: A partir deste passo, o revestimento de pontas e tubos cônicos geralmente não é necessário, pois os CSs não aderem à ponta após a fixação. - Bloqueie os CSs ressuspendendo o pellet em SWB gelado (200 μL de SWB por poço) e transfira os esferoides para uma placa de cultura de suspensão de 24 poços.
NOTA: CSs de um pellet grande podem ser divididos em vários poços para realizar diferentes manchas. Use ~ 20-50 CSs por combinação de anticorpos. - Incubar a 4 °C durante, pelo menos, 15 minutos.
- Adicione 200 μL do SWB em um poço vazio para servir como um poço de referência.
NOTA: Para a coloração imunofluorescente, placas de 48 ou 96 poços também podem ser usadas para reduzir o uso de anticorpos. No entanto, os resultados de coloração e lavagem podem ser reduzidos devido ao menor volume por poço. - Deixe os esferoides se assentarem no fundo da placa, deixando a placa inclinada em um ângulo de 45° por 5 min.
- Remova o SWB, deixando os CSs em 200 μL do SWB (use o poço de referência para estimar o volume mínimo de 200 μL).
- Adicionar 200 μL do SWB com os anticorpos primários 2x concentrados (por exemplo, ɑ-actinina [1:200] e troponina T [1:200]) e incubar durante a noite a 4 °C enquanto balança/agita (40 rpm em um agitador horizontal).
- No dia seguinte, adicione 1 mL de SWB a cada poço.
- Deixe os esferoides se assentarem no fundo da placa, deixando a placa em um ângulo de 45° por 5 min.
- Remova o SWB, deixando 200 μL na placa. Adicione 1 mL de SWB e lave por 2 h com balanço lento/agitação.
- Repita as etapas 9.12 e 9.13 mais duas vezes.
- Deixe que os CSs se depositem no fundo da placa, deixando a placa inclinada a 45° por 5 min. Remova o SWB, deixando 200 μL em cada poço
- Adicione 200 μL do SWB com anticorpos secundários, anticorpos conjugados e corantes 2x concentrados (por exemplo, DAPI [1 μg/mL], camundongo-AF488 [1:500], coelho-AF568 [1:500]) e incube durante a noite a 4 °C no escuro, enquanto balança/agita lentamente.
- No dia seguinte, repita os passos 9.12 e 9.13 mais duas vezes.
- Transfira cuidadosamente os CSs para um tubo de 1,5 mL e gire para baixo a 70 x g por 3 min.
- Remova o máximo possível do SWB pipetando sem interromper os CSs.
- Adicionar a solução de incorporação (ES; pelo menos 50 μL, a RT) utilizando uma ponta de 200 μL com a extremidade cortada e ressuspender suavemente para evitar a formação de bolhas e incubar a RT durante 20 min.
- Enquanto isso, crie um recipiente quadrado em uma lâmina de vidro com esmalte ou selante de silicone.
- Corte a extremidade de uma ponta de 200 μL e transfira os CSs em ES para o meio do recipiente quadrado.
- Coloque uma tampa quadrada em cima. Para reduzir as bolhas de ar, coloque um lado da tampa primeiro, depois abaixe lentamente a tampa de um lado para o outro até que não haja ar preso sob a superfície e, em seguida, solte a tampa.
- Empurre suavemente todas as bordas da tampa para selá-la ao esmalte ou selante de silicone.
- Deixe o slide durante a noite em RT. No dia seguinte, o slide está pronto para geração de imagens.
NOTA: A limpeza óptica pelo ES pode causar um pequeno encolhimento do tecido. No entanto, isso não pode afetar a morfologia geral dos CSs. O procedimento de coloração pode ser pausado aqui, armazenando as lâminas a 4 °C (por pelo menos 1 semana) ou a -20 °C (por pelo menos 6 meses).
Resultados
O protocolo mostrado na Figura 1A descreve a geração de CSs a partir de CMs-hiPSC previamente expandidos. Os CSs adquirem uma estrutura 3D no dia 1 pós-semeadura em placas de fundo redondo de fixação ultrabaixa e podem ser cultivados por até 6 semanas (Figura 1B). Conforme avaliado pela coloração por imunofluorescência, a maioria das células em CSs de 3 semanas de idade expressou proteínas sarcômeras como α-actinina e troponina T e apresentou organização regular do sarcômero (Figura 1C). Para a quantificação de células positivas para α-actinina, foi realizada análise de citometria de fluxo. De acordo com os resultados da imunofluorescência, os dados da citometria de fluxo demonstraram níveis elevados comparáveis de α-actinina tanto no dia 0 (76,9% ± 16,6%) quanto nos CSs de 3 semanas de idade (71,1% ± 22,7%) (Figura 1D), indicando uma composição celular constante e altamente pura durante a cultura. Houve aumento da expressão dos genes cardíacos para junções (GJA1, JPH2 e PKP2), desmossomos (DES) e mitocôndrias (ATP5A) em esferoides derivados de hiPSC-CM (dia 42) versus hiPSC-CMs cultivados em 2D por 90 dias (Figura 1E). A expressão desses genes é uma marca registrada da interação célula-célula e maturação30.
Posteriormente, as propriedades funcionais dos CSs, ou seja, a taxa de batimento e o manuseio de Ca2+, foram avaliadas em diferentes momentos (Figura 2). Parâmetros transitórios de cálcio como tempo de elevação, tempo de pico, tempo de decaimento e duração transitória de cálcio (CTD90) foram avaliados conforme indicado na Figura 2A,B. A porcentagem de espancamento de CSs é semelhante nas primeiras 3 semanas pós-geração, mas caiu significativamente na semana 6 (Wk6) CSs (Figura 2C). A taxa de batimento foi significativamente reduzida em Wk3 em comparação com Wk1 e, semelhante à porcentagem de espancamento de CSs, caiu drasticamente em Wk6 (Figura 2D). No Wk6, observou-se deterioração da CS, o que pode explicar a queda tanto na taxa de batimento quanto no número de CSs de batimento. A medição dos parâmetros transitórios de cálcio indicou um valor de pico significativamente maior em Wk2 (Figura 2E), enquanto o tempo de subida, o tempo de decaimento e o CTD90 foram significativamente aumentados em Wk3 em comparação com Wk1 (Figura 2F-H ). Tomados em conjunto, esses resultados mostram que os esferoides derivados de hiPSC-CM são funcionalmente ótimos em torno das semanas 2 e 3 pós-geração.
A Figura 3 mostra o efeito do tamanho do esferoide sobre a taxa de batimento e o manuseio do cálcio. Os CSs foram gerados pela semeadura de 2,5 x 10 4, 5 x 10 4, 10 x 10 4 e 20 x 10 4 hiPSC-CMs em um poço de uma placa de 96 poços para um total de 24 CSs/poços por condição (Figura 3A). Como esperado, o tamanho do esferoide aumentou à medida que o número de células utilizadas aumentou, variando de 178 ± 36 μm a 351 ± 65 μm (Figura 3A, painel direito). Os transientes de Ca2+ foram medidos em CSs de 3 semanas de idade nas quatro diferentes densidades de semeadura (Figura 3B). As medidas de CSs de batimento indicaram que apenas cerca de 50% dos CSs de tamanho menor (2,5K e 5K-CSs) estavam batendo, enquanto a porcentagem de CSs de tamanho maior (10K e 20K-CSs) foi significativamente maior (cerca de 85%) (Figura 3C). Uma taxa de batimento semelhante (aproximadamente 28 bpm) foi mostrada por 5K-, 10K-, e 20K-CSs, que foi significativamente maior em comparação com 2.5K-CSs (Figura 3D). Os valores de pico das imagens de cálcio foram semelhantes em todas as condições testadas (Figura 3E), no entanto, o tempo de elevação (Figura 3F), o tempo de decaimento (Figura 3G) e o CTD90 (Figura 3H) foram significativamente aumentados em CSs de tamanho maior (10K- e 20K-CSs) em comparação com os menores (2,5K- e 5K-CSs). Tomados em conjunto, esses resultados mostram que os esferoides derivados de hiPSC-CM são ideais para triagem de manuseio de cálcio quando uma densidade de semeadura entre 10K e 20K hiPSC-CMs/poço é usada.
Em seguida, avaliou-se o impacto da criopreservação na viabilidade e função da CS. Antes da análise, os CSs descongelados foram mantidos em cultura por 1 semana (Figura 4A). Como demonstrado pelos testes de viabilidade celular de citometria de fluxo (Figura 4B) e Calcein-AM (Figura 4C), a criopreservação não afetou a viabilidade celular dentro dos CSs. Além disso, os CSs descongelados mostraram níveis de expressão semelhantes de proteínas sarcômeras em comparação com os CSs pareados por idade fresca (Figura 4D). Esses dados indicam que os CSs podem ser eficientemente criopreservados para posterior análise da função cardíaca e triagem de alto rendimento.
Por fim, a atividade de batimento e o manuseio de Ca2+ foram medidos em CSs frescos e criopreservados (Figura 5). A porcentagem de espancamento de CSs foi medida em diferentes momentos após o descongelamento, respectivamente, aos 2, 5 e 7 dias. Enquanto a maioria dos CSs frescos mostrou atividade de batimento ao longo do tempo, claramente os CSs criopreservados precisaram de até 1 semana de cultura para recuperar sua atividade de batimento (Figura 5B). Não houve mudança significativa na taxa de batimento de CSs descongelados versus frescos; no entanto, nenhuma atividade espontânea de batimento foi observada em alguns CSs congelados (Figura 5C). Embora os valores de pico tenham sido significativamente reduzidos em CSs congelados/descongelados em comparação com os frescos (Figura 5D), não foram observadas mudanças significativas no tempo de subida, no tempo de decaimento e no CTD90 de CSs congelados/descongelados em comparação com os frescos (Figura 5E-G). Esses dados indicam que, após o descongelamento, é importante deixar os CSs se recuperarem na incubadora por pelo menos 1 semana antes de medir a atividade de batimento e o Ca2+ transitório.
Tomados em conjunto, esses resultados mostram que a criopreservação de esferoides derivados de hiPSC-CM preserva a viabilidade dos cardiomiócitos, a estrutura sarcômera e suas características funcionais, como atividade de batimento espontâneo e manuseio de cálcio. Assim, os esferoides derivados de hiPSC-CM representam um modelo adequado para recapitular com precisão a eletrofisiologia cardíaca in vitro.
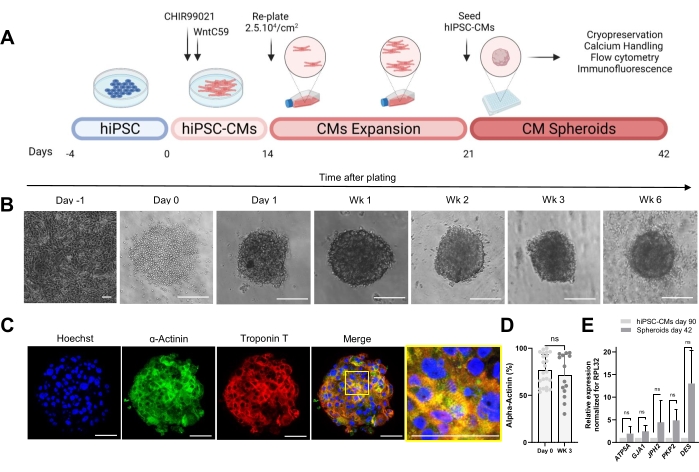
Figura 1: Geração de esferoides cardíacos . (A) Representação esquemática da diferenciação cardíaca dirigida baseada em Wnt, a subsequente expansão de CMs-hiPSC e a geração de CSs. Criado com biorender.com. (B) Imagens de campo brilhante em diferentes pontos de tempo da cultura CS. Barra de escala, 200 μm. Wk representa a semana. (C) Imagens representativas de imunofluorescência para proteínas sarcômeras cardíacas α-actinina e troponina T em CSs de 3 semanas de idade. Imunofluorescência: Hoechst (azul), α-actinina (verde) e troponina T (vermelho). Barra de escala, 200 μm. A imagem mesclada ampliada à direita exibe a organização do sarcômero. Barra de escala, 50 μm. (D) Quantificação por citometria de fluxo de células positivas para α-actinina antes (dia 0) e 3 semanas após a formação de CSs. (n = 14-23 por condição. (E) RT-QPCR realizada em hiPSC-CMs cultivados por 90 dias (2D) e amostras esferoides cultivadas por 42 dias para estabelecer níveis de expressão de diferentes genes cardíacos relacionados a junções celulares, filamentos intermediários e mitocôndrias. (n = 1-3 lotes). Os dados são representados como média ± DP. NS (não significativo) calculado por um teste t não pareado. Por favor, clique aqui para ver uma versão maior desta figura.
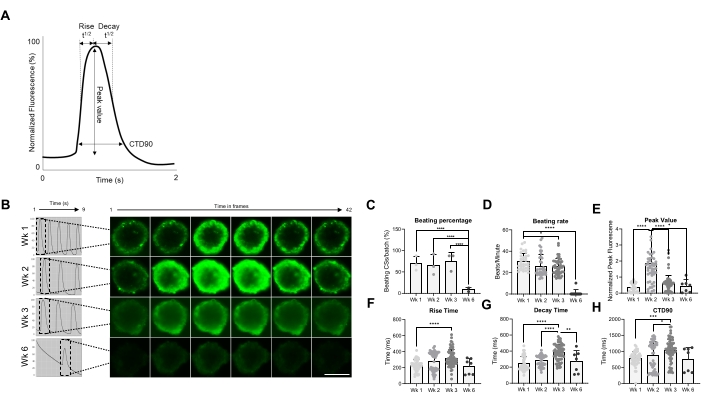
Figura 2: Taxa de batimento e manuseio de cálcio em CSs em diferentes semanas após a geração. (A) Exemplos de parâmetros transitórios de cálcio calculados pelo algoritmo de análise de ciências Vala no Cyteseer Software. (B) Traços transientes de cálcio representativos e imagens de lapso de tempo dos CSs em diferentes pontos de tempo (semanas) após a geração. Barra de escala, 200 μm. (C) A quantificação do tempo de atividade de espancamento espontâneo é expressa como a porcentagem de espancamento de CSs. (D) Taxa de espancamento de CSs durante o tempo de cultivo. (E-H) Quantificação dos transientes de cálcio mostrando valor de pico, tempo de subida, tempo de decaimento e CTD90. Os dados apresentados são médios ± DP. Replicações biológicas = três, replicações técnicas = 38, 50, 66 e 7, respectivamente. *p < 0,05, ****p < 0,001; ANOVA unidirecional seguida pelo teste post hoc de comparações múltiplas de Tukey. Abreviaturas; CTD = duração transitória do cálcio, Wk = semana, CSs = esferoides cardíacos humanos. Por favor, clique aqui para ver uma versão maior desta figura.
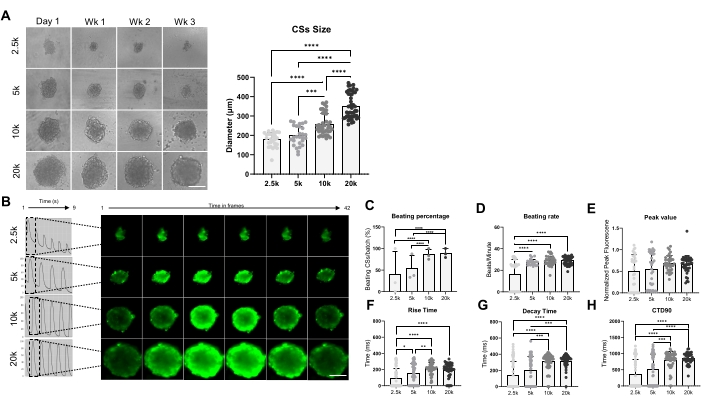
Figura 3: Taxa de batimento e manuseio de cálcio em CSs gerados usando diferentes densidades de semeadura celular. (A) Imagens de campo brilhante (esquerda) e medidas de tamanho (direita) de CSs geradas usando diferentes números de hiPSC-CMs. Barra de escala, 200 μm. (B) Traços transientes de cálcio representativos e imagens de lapso de tempo dos 2,5K-20K-CSs. (C,D) Porcentagem de batidas e taxa de batida de 2,5K-20K-CSs. (E-H) Valor de pico, tempo de subida, tempo de decaimento e CTD90 em 2,5K-20K-CSs. Os dados são médios ± DP. Replicações biológicas = três, replicações técnicas = 28-39. *p < 0,05, ****p < 0,001; ANOVA unidirecional seguida pelo teste post hoc de comparações múltiplas de Tukey. Abreviaturas: CTD = duração transitória do cálcio, Wk = semana, k = x 1.000 células, CSs = esferoides cardíacos. Por favor, clique aqui para ver uma versão maior desta figura.
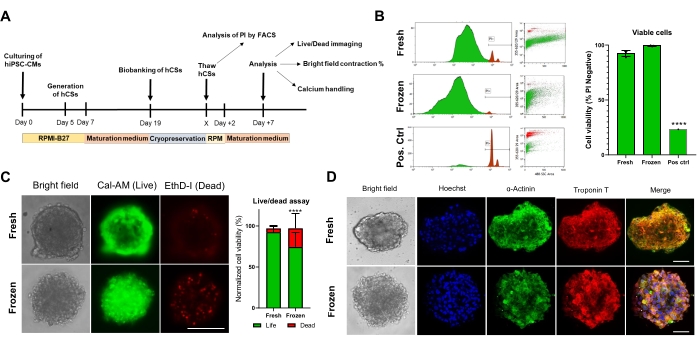
Figura 4. Efeito da criopreservação na viabilidade e estrutura de esferoides cardíacos. (A) Representação esquemática da geração de CS, subsequente biobanca e descongelamento. (B) Teste de viabilidade celular por citometria de fluxo em CSs frescos e criopreservados. Como controle positivo, foi utilizado um tratamento com solução de Triton-X a 10% por 5 min. (n = 4 por condição). Os dados são representados como média ± DP. ** **p < 0,001; ANOVA unidirecional seguida pelo teste post hoc de comparações múltiplas de Tukey. (C) Teste de viabilidade celular de Calcein-AM em CSs frescos versus descongelados após 7 dias de cultura (n = 15-17 por condição, ****p < 0,001, pelo teste t pareado; barra de escala, 200 μm). (D) Coloração representativa de campo brilhante (esquerda) e imunofluorescência para expressão de α-actinina e troponina T em CSs frescos e descongelados. Imunofluorescência: Hoechst (azul), α-actinina (verde) e troponina T (vermelho). As imagens mescladas à direita exibem estrias de sarcômero nos CSs. Barra de escala, 50 μm. Abreviações: X = dia de descongelamento de escolha, PI = iodeto de propídio, Cal-AM = calceína-AM, EthD-I = Ethidium Homodimer I. Clique aqui para ver uma versão maior desta figura.
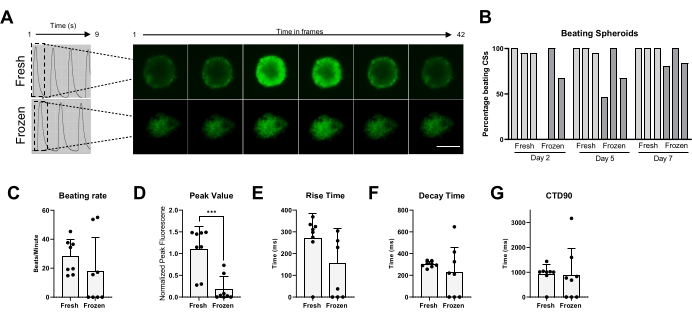
Figura 5: Transientes de cálcio em CSs frescos versus descongelados. (A) Traços transientes de cálcio representativos e imagens de lapso de tempo dos CSs antes da criopreservação e 1 semana após o descongelamento. (B) Porcentagem de espancamento de esferoides cardíacos frescos e congelados/descongelados. As barras representam experimentos individuais. (C) Taxa de batimento de esferoides cardíacos frescos e congelados/descongelados. (D-G) Quantificação de parâmetros transitórios de cálcio: valor de pico, tempo de subida, tempo de decaimento e CTD90. Os dados são médios ± DP. *p < 0,05, ****p < 0,001; ANOVA unidirecional seguida pelo teste post hoc de comparações múltiplas de Tukey. Abreviaturas; CTD = duração transitória do cálcio, CSs = esferoides cardíacos. Por favor, clique aqui para ver uma versão maior desta figura.
Figura 1 Suplementar: Estratégias representativas de gating para análise de citometria de fluxo. (A) Estratégia de gating representativa para hiPSC-CMs positivos para α-actinina em uma população pura versus controle negativo e controle isotipo. O número de células analisadas positivas para α-actinina é de 25 x 105. Abreviaturas; CSC = dispersão lateral, PI+ = iodeto de propídio positivo. (B) Estratégia de decantação representativa para a análise de viabilidade tanto no fresco, descongelado, no controle positivo (Triton-X) quanto no controle negativo (não corado). Clique aqui para baixar este arquivo.
Discussão
A descoberta de medicamentos cardíacos é dificultada por uma dependência de modelos celulares e animais não humanos com rendimento inadequado e fidelidade fisiológica para realizar leituras com precisão. A biologia hiPSC-CM, juntamente com a instrumentação HT e sondas fisiológicas, tem o potencial de reintroduzir modelos humanos nos estágios iniciais da modelagem de doenças cardíacas e da descoberta de medicamentos. Desenvolvemos um método de geração de tecido cardíaco 3D que produz CSs funcionais e de alta qualidade para uma plataforma ideal de modelagem de doenças cardíacas e triagem de medicamentos. Além disso, a combinação da tecnologia esferoide em sistemas de biorreatores 3D para a produção industrial de EV permite um passo necessário em direção à tradução clínica da terapia baseada em EV. O método aqui descrito baseia-se em vários fatores cruciais e é uma variante dos protocolos existentes 9,10,28,29. Esses métodos incluem: 1) a geração de construções de tecido 3D, 2) o número ideal de células e o tempo antes da triagem, 3) melhorar a sensibilidade e a capacidade de alto rendimento dos instrumentos e 4) ser capaz de congelar os esferoides antes de qualquer análise funcional. Ao contrário dos protocolos descritos anteriormente, o protocolo proposto descreve a geração de até 1.500 esferoides por dia e a adequação para HTS. A análise convencional de uma centena de compostos com mais de 6 x 0,5 log doses para 10 replicações usando sistemas de imagem de cálcio de 96 poços existentes ou tecidos cardíacos modificados multiplexados de 24 poços requer aproximadamente 500 milhões a 3 bilhões de CMs hiPSC-31,32. A aplicação proposta torna os rastreios cardíacos menos dispendiosos e eficazes em termos de tempo em comparação com os sistemas convencionais, uma vez que as placas de 96 poços exigiram apenas 10% da densidade de semeadura em comparação com o método descrito. Além disso, em comparação com protocolos anteriores, como o método hanging-drop, a geração de esferoides por autoagregação em placas de fixação ultrabaixa permite imagens automatizadas de alta qualidade de microtecidos únicos33.
Este pequeno modelo 3D imita o fenótipo biológico e fisiológico do ambiente cardiovascular in vivo. Como demonstrado anteriormente, os transientes de cálcio aumentam drasticamente nos construtos de tecido cardíaco 3D em comparação com as culturas de células monocamada 2D34.
Em seguida, descobrimos que a densidade de semeadura e o tempo de cultivo adequado também são fatores críticos para uma triagem de CS bem-sucedida. As densidades de 10K-20K hiPSC-CMs por esferoide e triagem entre as semanas 2-3 após a geração foram ótimas, enquanto esferoides muito pequenos ou muito velhos mostram manuseio de cálcio perturbado (Figura 2 e Figura 3). Portanto, é importante manter as densidades de semeadura o mais consistentes possível, uma vez que o tamanho influencia os parâmetros funcionais. Além disso, embora este método óptico forneça bons resultados para culturas 3D vivas como um todo o tecido, a obtenção de dados dentro de esferoides maiores a nível (sub)celular é um desafio sem depender de métodos histológicos demorados. Recentemente, várias abordagens foram publicadas que usaram "limpeza óptica", que permite a aquisição de esferoides 3D inteiros com a oportunidade de quantificação de marcadores de célula única. Aqui, adaptamos um protocolo de 3 dias da coleta de CS para a análise de imagens, que é otimizado para imagens 3D usando microscopia confocal29 (Figura 1C e Figura 4D).
Por fim, com o aumento das aplicações de tecido cardíaco 3D e aplicações comerciais, a demanda por armazenamento a longo prazo e biobanco específico do paciente de vários doadores está aumentando. A criopreservação é uma estratégia eficaz para gerar placas HTS a partir de vários lotes ao longo do tempo. O congelamento de CME-hiPSC já foi descrito anteriormente e não é diferente em comparação com outros tipos de células cultivadas 10,35,36. Recentemente, abordagens para congelamento de placas com células 2D têm sido descritas37. Aqui, descobrimos que o kit de criopreservação PSC é a condição mais ideal em comparação com três outros (dados não mostrados) e usamos esse meio para o congelamento eficiente de esferoides. Após a criopreservação, a viabilidade permanece elevada (Figura 4B,C), mas as propriedades eletrofisiológicas dos CSs são afetadas e é necessário um período de incubação após o descongelamento. De fato, 1 semana após o descongelamento, os CSs apresentaram atividade espontânea de batimento e manuseio de cálcio. No entanto, tem sido descrito que os CM-hiPSC frescos e recuperados nem sempre apresentam propriedades moleculares e fisiológicas idênticas38. Essa limitação precisa ser considerada quando os CM-hiPSC criopreservados são usados para avaliar leituras cardíacas induzidas por medicamentos. Além disso, embora efetivamente modulemos o número de células por esferoide e o momento ideal da imagem transitória de cálcio, os esferoides cardíacos poderiam ser melhorados pela mistura de células cardiomiócitos derivadas de hiPSC com células endoteliais, fibroblastos, junções célula-célula e matrizes extracelulares, como quitosana, colágeno IV, fibronectina, matrigel ou laminina, imitando o ambiente cardíaco in vivo 39, 40. No geral, propomos um protocolo passo-a-passo para gerar eficientemente CSs que são adequados para aplicações a jusante, como modelagem de doenças e triagem de medicamentos HT.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Gostaríamos de agradecer às ciências da VALA pelo pacote de software Cyteseer e pela otimização da análise automatizada de cálcio 3D. Queremos agradecer o apoio da Fundação PLN (RM). P.A.D. e F.S. são suportados pelo CUREPLaN Leducq. A J.P.G.S. é apoiada pelo H2020-EVICARE (#725229) do Conselho Europeu de Investigação (ERC). A J.W.B. é apoiada pela UMC Utrecht Clinical Fellowship, Netherlands Heart Institute Fellowship e pela bolsa de jovens talentos CVON-Dosis; Fundação do Coração dos Países Baixos (CVON-Dosis 2014-40). N.C. é apoiada pelo Programa de Gravitação "Regeneração Impulsionada por Materiais" da Organização Holandesa de Pesquisa Científica (RegmedXB #024.003.013) e pelas Ações Marie Skłodowska-Curie (Contrato de Subvenção RESCUE #801540). V.S.-P. é apoiado pelo Fundo de Aliança (UMCU, UU, TU/e). A A.V.M. é apoiada pelo projeto BRAVE, financiado pela UE (H2020, ID:874827)
Materiais
| Name | Company | Catalog Number | Comments |
| 24 wells suspenion plate | Corning | 3738 | |
| 96 wells Ultra-Low Attachment Multiple Well Plate | Corning | CLS3474-24EA | |
| Albumax | Thermo Fisher Scientific | 11020021 | |
| Anti-α-Actinin (Sarcomeric) antibody | Sigma-Aldrich | A7811 | Dilution: 1:200 |
| Anti-Cardiac Troponin T antibody (ab45932) | Abcam | ab45932 | Dilution: 1:200 |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| B-27 supplement | Thermo Fisher Scientific | 17504-044 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Bovine serum albumin fraction V (BSA) | Roche | 10735086001 | |
| Cal-520, AM | Abcam | ab171868 | |
| Confocal microscope | Leica | DMi8 | |
| Confocal microscope software | Leica | Las X | |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Creatine monohydrate | Sigma-Aldrich | C3630 | |
| DAPI | Thermo Fisher Scientific | D3571 | Concentration: 1 µg/mL |
| DMEM no glucose | Thermo Fisher Scientific | 11966025 | |
| EDTA | Thermo Fisher Scientific | 15575020 | |
| Fructose | Sigma-Aldrich | 76050771.05 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glycerol | Boom | 76050771.05 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11029 | Dilution: 1:500 |
| Goat anti-rabbit Alexa Fluor 568 | Invitrogen | A11011 | Dilution: 1:500 |
| Horizontal shaker | IKA | 4003000 | |
| Human induced pluripotent stem cell lines | (Stanford Cardiovascular Institute (S-CVI) Biobank) | CVI-273 (control 1) | |
| Human induced pluripotent stem cell lines | Germany | 141 (control 2) 144 (control 3) | |
| Hydrochloric acid (HCl) | Ajax Firechem | 265.2.5L-PL | 10 M stock solution, corrosive |
| Isotype control, FITC mouse IgM κ isotype | BD | 556652 | |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828 | Protect from light |
| L-carnitine | Sigma-Aldrich | C0283 | |
| Myocyte calcium and contractility system | Leica | Thunder, DMi8 | |
| Non essential amino acids (NEAA) | Thermo Fisher Scientific | 11140 | |
| Paraformaldehyde solution 4% in 1x PBS, pH 7.0–7.6 | Santa Cruz | SC281692 | Hazardous |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010023 | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140 | |
| PES Membrane Vacuum Filter system | Corning | 431097 | |
| PI/RNase Staining Solution | Invitrogen | F10797 | Dilution: 1:1000 |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| PSC Cryopreservation Kit | Thermo Fisher Scientific | A2644601 | |
| RevitaCell | Thermo Fisher Scientific | A2644501 | |
| RPMI 1640 medium | Thermo Fisher Scientific | 11875 | |
| Silicone Elastomer Kit | SYLGARD | 184 | |
| Sodium dodecyl sulfate solution (10%) | Sigma-Aldrich | 71736 | |
| Sodium L-Lactate | Sigma-Aldrich | 71718 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Tris Fisher | Scientific | 11486631 | |
| Triton X-100 | Merck | X100-1L | Hazardous |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Fisher Scientific | A1217701 | |
| Tween-20 | Sigma-Aldrich | P1379 | |
| Urea | Sigma-Aldrich | 51456 | |
| Vitamin B12 | Sigma-Aldrich | V6629 | |
| Y-27632 dihydrochloride (Rho-kinase inhibitor) | Tocris | 1254 | Protect from light |
Referências
- Burridge, P. W., et al. Chemically defined and small molecule-based generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell Stem Cell. 8 (2), 228-240 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences. 109 (27), 1848-1857 (2012).
- Paige, S. L., et al. Endogenous Wnt/beta-catenin signaling is required for cardiac differentiation in human embryonic stem cells. PLoS One. 5 (6), 11134 (2010).
- Gintant, G., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes in preclinical cancer drug cardiotoxicity testing: A scientific statement from the American Heart Association. Circulation Research. 125 (10), 75-92 (2019).
- Ahmed, R. E., et al. A brief review of current maturation methods for human induced pluripotent stem cells-derived cardiomyocytes. Frontiers in Cell and Developmental Biology. 19 (8), 178 (2020).
- Liu, C., et al. Generating 3D human cardiac constructs from pluripotent stem cells. EBioMedicine. 76, 103813 (2022).
- Musunuru, K., et al. Induced pluripotent stem cells for cardiovascular disease modeling and precision medicine: A scientific statement from the American Heart Association. Circulation: Genomic and Precision Medicine. 11 (1), 000043 (2018).
- Buikema, J. W., et al. Wnt activation and reduced cell-cell contact synergistically induce massive expansion of functional human iPSC-derived cardiomyocytes. Cell Stem Cell. 27 (1), 50-63 (2020).
- Maas, R. G. C., et al. Massive expansion and cryopreservation of functional human induced pluripotent stem cell-derived cardiomyocytes. Cell STAR Protocols. 2 (1), 100334 (2021).
- Tremblay, C., et al. A new construction technique for tissue-engineered heart valves using the self-assembly method. Tissue Engineering Part C: Methods. 20 (11), 905-915 (2014).
- Lewis-Israeli, Y. R., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12 (1), 5142 (2021).
- Goldfracht, I., et al. Engineered heart tissue models from hiPSC-derived cardiomyocytes and cardiac ECM for disease modeling and drug testing applications. Acta Biomaterialia. 1 (92), 145-159 (2019).
- Fleischer, S., et al. Comprehensive human stem cell differentiation in a 2D and 3D mode to cardiomyocytes for long-term cultivation and multiparametric monitoring on a multimodal microelectrode array setup. Biosensors and Bioelectronics. 126, 624-631 (2019).
- Branco, M. A., et al. Transcriptomic analysis of 3D cardiac differentiation of human induced pluripotent stem cells reveals faster cardiomyocyte maturation compared to 2D culture. Science Reports. 9 (1), 9229 (2019).
- Ergir, E., et al. Generation and maturation of human iPSC-derived cardiac organoids in long term culture. bioRxiv. , (2022).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scienctific Reports. 7 (1), 5464 (2017).
- Kofron, C. M., et al. A predictive in vitro risk assessment platform for pro-arrhythmic toxicity using human 3D cardiac microtissues. Science Reports. 11 (1), 10228 (2021).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Tenreiro, M. F., et al. Next generation of heart regenerative therapies: progress and promise of cardiac tissue engineering. npj Regenerative Medicine. 6 (1), 30 (2021).
- Hansen, A., et al. Development of a drug screening platform based on engineered heart tissue. Circulation Research. 107 (1), 35-44 (2010).
- McDermott-Roe, C., et al. Investigation of a dilated cardiomyopathy-associated variant in BAG3 using genome-edited iPSC-derived cardiomyocytes. Journal of Clinical Investigation Insight. 4 (22), 128799 (2019).
- National Library of Medicine (U.S.). Safety and efficacy of induced pluripotent stem cell-derived engineered human myocardium as biological ventricular assist tissue in terminal heart failure. National Library of Medicine. , (2020).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Oh, J. G., et al. Generation of ventricular-like HiPSC-derived cardiomyocytes and high-quality cell preparations for calcium handling characterization. Journal of Visualized Experiments. 155, 60135 (2020).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Feyen, D. A. M., et al. Metabolic maturation media improve physiological function of human iPSC-derived cardiomyocytes. Cell Reports. 32 (3), 107925 (2020).
- van Ineveld, R. L., et al. Single-cell resolution three-dimensional imaging of intact organoids. Journal of Visualized Experiments. (160), e60709 (2020).
- Guo, Y., Pu, W. T. Cardiomyocyte maturation: New phase in development. Circulation Research. 126 (8), 1086-1106 (2020).
- Ding, B., et al. Three-dimensional renal organoids from whole kidney cells: Generation, optimization, and potential application in nephrotoxicology in vitro. Cell Transplantation. 29, 963689719897066 (2020).
- Denning, C., et al. Cardiomyocytes from human pluripotent stem cells: From laboratory curiosity to industrial biomedical platform. Biochimica Biophysica Acta. 1863, 1728-1748 (2016).
- Amaral, R. L. F., et al. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Daily, N. J., et al. Improving cardiac action potential measurements: 2D and 3D cell culture. Journal of Bioengineering and Biomedical Science. 5 (3), 168 (2015).
- Preininger, M. K., et al. Cryopreservation of human pluripotent stem cell-derived cardiomyocytes: Strategies, challenges, and future directions. Advances in Experimental Medicine and Biology. 951, 123-135 (2016).
- Kim, Y. Y., et al. Cryopreservation of human embryonic stem cells derived-cardiomyocytes induced by BMP2 in serum-free condition. Reproductive Science. 18 (3), 252-360 (2011).
- Daily, M. I., et al. Cryopreservation of primary cultures of mammalian somatic cells in 96-well plates benefits from control of ice nucleation. Cryobiology. 93, 62-69 (2020).
- Zhang, J. Z., et al. Effects of cryopreservation on human induced pluripotent stem cell-derived cardiomyocytes for assessing drug safety response profiles. Stem Cell Reports. 16 (1), 168-181 (2021).
- Yeh, H. -. Y., et al. The calcium-dependent regulation of spheroid formation and cardiomyogenic differentiation for MSCs on chitosan membranes. Biomaterials. 33 (35), 8943-8954 (2012).
- Scalise, M., et al. From spheroids to organoids: The next generation of model systems of human cardiac regeneration in a dish. International Journal of Molecular Sciences. 22 (24), 13180 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados