É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Controlando a Fração de Partículas em Andaimes de Partículas Microporosas Recozidos para Cultura de Células 3D
Neste Artigo
Resumo
Minimizar a variabilidade na fração de partículas dentro de andaimes granulares facilita a experimentação reprodutível. Este trabalho descreve métodos para a geração de andaimes granulares com frações de partículas controladas para aplicações de engenharia de tecidos in vitro .
Resumo
Os microgéis são os blocos de construção de andaimes de partículas microporosas recozidas (MAP), que servem como uma plataforma para a cultura de células in vitro e reparação de tecidos in vivo. Nesses andaimes granulares, a porosidade inata gerada pelo espaço vazio entre os microgéis permite a infiltração e migração celular. Controlar a fração do vazio e a fração de partículas é fundamental para o projeto do andaime MAP, pois a porosidade é uma sugestão bioativa para as células. Microgéis esféricos podem ser gerados em um dispositivo microfluídico para tamanho e forma controlados e, posteriormente, liofilizados usando métodos que impedem o fraturamento da rede polimérica. Após a reidratação, os microgéis liofilizados levam a frações de partículas controladas em andaimes MAP. A implementação desses métodos para a liofilização em microgel levou a estudos reprodutíveis mostrando o efeito da fração de partículas na difusão de macromoléculas e na disseminação celular. O protocolo a seguir abrangerá a fabricação, liofilização e reidratação de microgéis para controle da fração de partículas em andaimes MAP, bem como o recozimento dos microgéis através de reticulação bio-ortogonal para cultura de células 3D in vitro.
Introdução
Andaimes de partículas microporosas recozidos (MAP) são uma subclasse de materiais granulares em que os blocos de construção de microgel (μgel) estão interligados para formar um andaime poroso a granel. Com a microarquitetura única desses andaimes granulares, a porosidade inata gerada pelo espaço vazio entre o microgel esférico interligado suporta infiltração e migração celular acelerada1. Os blocos de construção de microgel dos andaimes MAP podem ser fabricados a partir de polímeros sintéticos e naturais com modificações químicas2. Os métodos aqui descritos destacam especificamente o uso de microgéis compostos por uma espinha dorsal de ácido hialurônico (AH) modificada com alças funcionais de norborneno (NB). A alça funcional NB no polímero HA suporta reações químicas de clique para formar microgéis e ligá-los para gerar andaimes MAP 3,4. Numerosos esquemas têm sido empregados para ligar os microgéis juntos (ou seja, recozimento), como reações enzimáticas1, 5,6 à base de luz e química de clique livre de aditivos 3,7. A química do clique livre de aditivos é descrita neste trabalho, utilizando a conjugação inversa de demanda eletrônica Diels-Alder tetrazina-norborneno para interligar os microgéis HA-NB.
Para fabricar andaimes MAP, os usuários primeiro geram os blocos de construção de microgel usando emulsões reversas em sistemas de lote ou em dispositivos microfluídicos, bem como com pulverização eletrohidrodinâmica, litografia ou fragmentação mecânica2. A produção de microgéis esféricos HA-NB tem sido bem descrita e relatada anteriormente utilizando técnicas de emulsão em batelada2 e geração de gotículas microfluídicas 8,9,10,11. Neste trabalho, microgéis esféricos de HA-NB foram gerados em uma plataforma microfluídica com foco de fluxo para tamanho e forma controlados, conforme descrito anteriormente 8,9,10. Após a purificação, os microgéis existem em suspensão aquosa e devem ser concentrados para induzir um estado encravado. Quando encravados, os microgéis exibem propriedades de afinamento por cisalhamento, que lhes permitem funcionar como materiais injetáveis e de preenchimento de espaço1. Um método de induzir um estado atolado é secar os microgéis via liofilização, ou liofilização, e posteriormente reidratar o produto seco em um volume controlado12. Alternativamente, o excesso de tampão pode ser removido da pasta de microgel por centrifugação sobre um filtro ou com a remoção manual do tampão do pellet de microgel, seja por aspiração ou usando um material absorvente. No entanto, o uso da centrifugação para secar os microgéis pode gerar uma faixa altamente variável de frações de partículas e frações vazias ao fazer andaimes granulares12. Técnicas de liofilização de microgéis têm sido descritas utilizando IPA a 70% para microgéis de polietilenoglicol (PEG)13, óleos fluorados para microgéis de metacriloíla gelatina (GelMa)14 e etanol a 70% para microgéis de AH12. Este protocolo destaca métodos para liofilização de microgéis esféricos de AH usando etanol a 70%, um reagente de laboratório padrão, para reter as propriedades originais do microgel durante o processo de secagem. Os microgéis de AH liofilizados podem ser pesados e reidratados em porcentagens de peso definidas pelo usuário para controlar as frações finais de partículas em andaimes MAP12.
A etapa final na formação do andaime MAP depende do recozimento dos microgéis para criar um andaime poroso a granel1. Utilizando componentes da matriz extracelular nativa e empregando esquemas de recozimento bio-ortogonal, os andaimes MAP servem como uma plataforma biocompatível tanto para a cultura de células in vitro quanto para o reparo tecidual in vivo 3. Por meio dessas abordagens, os andaimes MAP podem ser fabricados a partir de blocos de construção HA-NB com frações de partículas definidas pelo usuário para seu emprego em aplicações de engenharia de tecidos12. O protocolo a seguir descreve a produção microfluídica de microgéis HA-NB seguida de liofilização e reidratação para controle da fração de partículas em andaimes MAP. Por fim, as etapas para o recozimento dos microgéis são descritas usando química bio-ortogonal para experimentos de cultura de células 3D in vitro .
Protocolo
1. Fabricação de dispositivos microfluídicos
- Litografia suave
NOTA: Este protocolo descreve a fabricação de dispositivos de um projeto de dispositivo microfluídico com foco de fluxo de Wilson et al.9. No entanto, este protocolo pode ser usado com qualquer projeto de dispositivo em uma bolacha SU-8. A bolacha pode ser colada a uma placa de Petri e, em seguida, precisa ser silanizada para evitar a aderência do PDMS às características da bolacha15.- Misturar a base de elastômero de polidimetilsiloxano (PDMS) com o agente de cura (ver Tabela de Materiais) na proporção de 10:1. Prepare aproximadamente 100 g para cobrir a bolacha com PDMS de ~5 mm. Deite a mistura PDMS sobre a bolacha e desgaseifique num exsicador durante aproximadamente 30 min. Uma vez que todas as bolhas tenham desaparecido, coloque em um forno a 60 °C por pelo menos 2 h para curar o PDMS.
- Use uma faca para traçar suavemente em torno do parâmetro do dispositivo sem quebrar a bolacha; em seguida, retire cuidadosamente o PDMS da bolacha. Use um punção de biópsia de 1 mm (consulte Tabela de materiais) para criar os canais de entrada e saída.
NOTA: Seja gentil ao perfurar o dispositivo microfluídico. Rasgos ou rasgos ao redor dos canais de entrada ou saída podem causar vazamentos durante a produção de microgel. - Use fita adesiva para remover a poeira do dispositivo no lado do recurso. Coloque os dispositivos e limpe as lâminas de vidro sobre uma placa quente a 135 °C durante, pelo menos, 15 minutos para remover a humidade.
- Em um exaustor, use uma pistola de plasma corona (consulte Tabela de materiais) no alto das lâminas de vidro e dos dispositivos (lado do recurso exposto) por aproximadamente 30 s e, em seguida, una-os rapidamente. Aplique pressão suavemente para garantir uma boa vedação entre o dispositivo e a lâmina de vidro. Coloque os dispositivos num forno a 60 °C durante a noite para fixar a ligação.
2. Produção microfluídica de microgéis de ácido hialurônico (AH) com alças funcionais de norborneno (NB)
- Síntese de HA-NB
NOTA: A síntese de HA-norborneno (HA-NB) foi adaptada de Darling et al.3 usando HA sódico de 79 kDa com equivalentes molares de 1:1,5:2,5 de unidades de repetição de HA para 4-(4,6-dimetoxi-1,3,5-triazina-2-il)-4-cloreto de metilmorfolínio (DMTMM) para 5-norborneno-2-metilamina (NMA).- Pese os reagentes. Dissolver o AH a 20 mg/ml em tampão MES de 200 mM (pH ~6) agitando num copo ou balão numa placa de agitação. Uma vez dissolvido, adicione o DMTMM à solução de AH e deixe reagir por aproximadamente 20 minutos à temperatura ambiente. Por exemplo, 1 g de AH + 1,09 g de DMTMM + 845 μL de NMA podem ser usados.
- Adicione NMA gota à solução HA/DMTMM. Adicione parafilme à abertura do recipiente de reação para minimizar a evaporação e cubra o recipiente de reação com folha. Continue mexendo enquanto permite que a reação prossiga por aproximadamente 24 h.
- Após 24 h, resfrie 200 etanol à prova (aproximadamente 10x o volume de reação). Em uma placa de agitação, transfira a reação gota a gota para o etanol resfriado para precipitar o HA-NB e continue mexendo a 200-300 rpm por 20 min.
- Transferir a solução para tubos cônicos de 50 mL e, em seguida, centrifugar a 5.000 x g por 10 min. Despeje o excesso de etanol para descartar como resíduo. Neste ponto, o produto HA-NB deve ser pellets brancos nos tubos cônicos. Puxe o vácuo no HA-NB em um dessecador para secar durante a noite.
- Purificar o HA-NB utilizando tubos de diálise de celulose de corte de peso molecular de 12-14 kDa (ver Tabela de Materiais). Dissolva o HA-NB em solução de NaCl 2 M e transfira para a tubulação de diálise. Amarre a tubulação e prenda com grampos, se necessário. Transfira o tubo de diálise cheio para um balde com 5 L de água ultrapura e dialize o HA-NB contra a água durante a noite.
- No dia seguinte, retire a água e substitua por 1 M de solução de NaCl por 30 min. Retire a solução de NaCl e, em seguida, dialize contra a água ultrapura por 3 dias, substituindo a água diariamente.
- Filtre o produto dialisado utilizando um filtro acionado a vácuo de 0,2 μm e, em seguida, transfira o produto filtrado para tubos cónicos de 50 ml.
- Adicione nitrogênio líquido a um recipiente criogênico e congele rapidamente os tubos HA-NB por 10 min. Em seguida, remova os tubos cônicos com pinça e remova rapidamente a tampa e a tampa com um tecido de nível de laboratório (consulte Tabela de materiais). Prenda o tecido com um elástico e transfira para um recipiente ou câmara de liofilização (ver Tabela de Materiais) e liofilize. Conservar o produto liofilizado a -20 °C.
CUIDADO: O nitrogênio líquido é uma substância perigosa. Use o equipamento de proteção individual apropriado ao trabalhar com nitrogênio líquido. - Quantificar a modificação do norborneno dissolvendo o RN-AH a 10 mg/mL em D2O e analisando via RMN de prótons (Figura 1A)16.
- Para determinar a quantidade de funcionalização, primeiro calibre o pico do solvente D2O para 4,8 PPM. Integre o pico para os prótons metil HA (δ2,05) e calibre a integração para 3,0. Em seguida, integre os picos para os grupos de pingente norborneno em δ6,33 e δ6,02 (prótons de vinil, endo). Normalizar a integração desses picos ao número correspondente de prótons para determinar o grau médio de modificação3.
- Preparação do precursor do microgel HA-NB
- Prepare o tampão HEPES de 50 mM (pH 7,5) e filtre o tampão estéril usando um filtro acionado a vácuo de 0,2 μm. Usando o tampão HEPES, prepare os respectivos estoques de 50 mM de foto-iniciador de fenil(2,4,6,-trimetilbenzoil)fosfinato (LAP) de lítio e agente redutor de tris(2-carboxietil)fosfina (TCEP). Mantenha a solução LAP longe da luz.
- Preparar os outros componentes precursores do microgel preparando os respectivos estoques de 50 mM de ligador de di-tiol e peptídeo RGD em água destilada estéril. Pesar os HA-NB e dissolver em tampão HEPES para preparar uma unidade populacional de 10 mg/ml.
NOTA: Diferentes ligadores di-tiol podem ser usados para a reticulação interna dos microgéis com base na preferência do usuário. Tanto um ligador degradável (ou seja, MMP-clevable) quanto um não degradável (ditiothreitol ou TDT) foram listados na Tabela de Materiais. O peptídeo RGD está incluído na formulação do microgel para promover a adesão celular em andaimes MAP, mas este componente pode ser removido e substituído por um volume igual de tampão HEPES. - Combinar os componentes precursores com concentrações finais de 9,9 mM LAP, 0,9375 mM TCEP (4 tiol/TCEP), ligador di-tiol 2,8 mM, peptídeo RGD 1 mM e 3,5% em peso (p/v) HA-NB adicionando tampão HEPES extra para atingir o volume final desejado. Misture bem o precursor usando uma pipeta de deslocamento positivo.
- Usando uma pipeta P1000, puxe lentamente toda a mistura. Coloque a ponta na extremidade de uma seringa de 1 ml e ejete a ponta da pipeta. Puxe o êmbolo da seringa para carregar a mistura na seringa e, em seguida, adicione um filtro de 0,2 μm na extremidade da seringa e filtre para um novo tubo de microcentrífuga de 1,5 ml. Centrifugar a solução precursora filtrada para remover as bolhas produzidas durante a filtragem.
- Novamente, usando uma pipeta P1000, puxe lentamente o precursor filtrado tomando cuidado para não criar bolhas. Se houver bolhas, toque suavemente na ponta para que elas se desalojem e flutuem até o topo.
- Coloque a ponta na extremidade de uma seringa de 1 ml e ejete a ponta da pipeta. Mantenha a seringa vertical e puxe o êmbolo da seringa lentamente até que toda a solução precursora esteja na seringa. Adicione uma agulha de ponta contundente à seringa e empurre o precursor através da ponta da agulha. Envolva a seringa em papel alumínio para manter fora de luz.
- Preparação de solução de pinçamento de microgel
- Prepare 5% v/v Span-80 em óleo mineral branco pesado e misture bem. Desidratar para remover bolhas. Mantenha a mistura de surfactante/óleo à temperatura ambiente envolta em papel alumínio. Misture bem e desidrate antes de cada utilização.
- Utilize uma seringa de 5 ml para extrair a mistura óleo/tensioactivo (minimizar bolhas) até que a distância entre o êmbolo e o dedo seja aproximadamente igual à distância da seringa precursora. Adicione uma agulha contundente à seringa e empurre o óleo através da ponta da agulha.
- Configuração do dispositivo microfluídico
- Adicione uma agulha contundente a uma seringa de 1 ml e encha com solução de tratamento hidrofóbico sintético (ver Tabela de Materiais). Fluir suavemente a solução através do dispositivo microfluídico até que se acumule em cada entrada/saída. Deixe a solução secar no dispositivo na bancada por aproximadamente 30 minutos e, em seguida, puxe o vácuo na saída para remover o excesso de solução. Prenda o dispositivo com grampos em um microscópio de mesa.
- Envolva um tubo cônico de 15 mL com papel alumínio e coloque em um rack de tubos para servir como recipiente de coleta de microgel. Use um suporte de anel com um grampo para colocar a sonda de luz UV na abertura do tubo de coleta. Use um detector de UV (ver Tabela de Materiais) para medir a intensidade UV, movendo a sonda até que 20 mW/cm2 sejam alcançados. Desligue a luz UV até mais tarde.
- Corte a tubulação em um comprimento que alcance desde o dispositivo microfluídico até o recipiente de coleta. Em uma extremidade da tubulação, corte um ângulo de 45°. Insira suavemente a extremidade angular da tubulação no canal de saída.
NOTA: Seja gentil ao inserir a tubulação no dispositivo microfluídico. Rasgos ou rasgos ao redor dos canais de entrada ou saída podem causar vazamentos durante a produção de microgel. - Fixe as seringas precursoras e a fase oleosa numa bomba de seringa dupla (ver Tabela de Materiais). Corte mais dois pedaços de tubo em um comprimento que alcance desde as pontas da seringa até o dispositivo microfluídico. Em uma extremidade de cada tubo, corte um ângulo de 45°. Fixe cuidadosamente a tubulação (extremidade romba) em ambas as pontas da seringa.
- Altere as definições na bomba para a seringa de 1 ml e inclua o volume aproximado do precursor. Empurre lentamente a bomba para a frente até que seja aplicada pressão suficiente aos êmbolos da seringa para empurrar o óleo e o precursor para as extremidades da tubulação, removendo qualquer ar do sistema. Deixe a pressão equalizar 5-10 min antes de passar para a etapa 2.4.6.
- Insira suavemente a extremidade angular da tubulação nos canais de entrada do dispositivo microfluídico com a solução precursora de microgel na entrada frontal e o óleo de compressão na entrada traseira. Mova a bomba para a frente em pequenos incrementos até que o fluxo comece no dispositivo e os microgéis esféricos comecem a se formar na região de foco de fluxo. Ligue a bomba com um caudal de 0,4 μL/min e deixe o dispositivo funcionar até estabilizar. Se necessário, ajuste a taxa de fluxo ±0,1 μL/min em pequenos incrementos para estabilizar a produção de microgel.
- Uma vez que a produção de microgel se estabilize, como mostrado na Figura 1B, substitua o tubo de coleta por um novo tubo e ligue a luz UV. Verifique a execução periodicamente para garantir que a produção de microgel seja estável durante a duração da corrida.
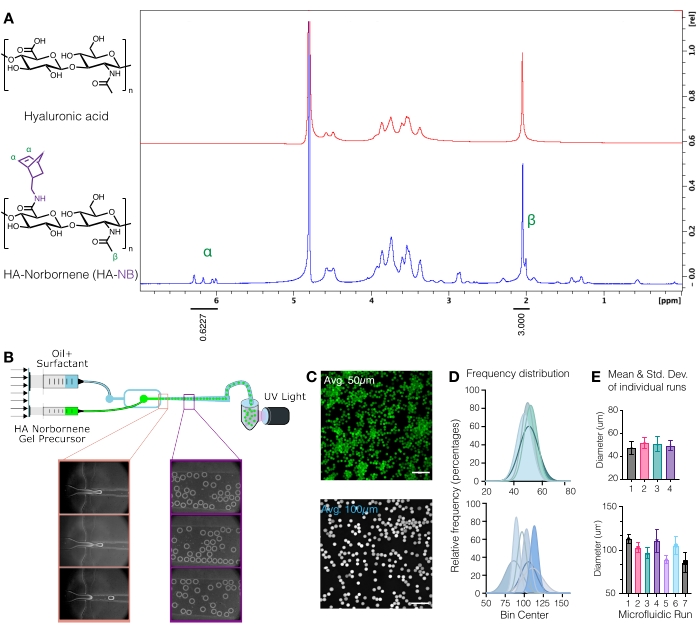
Figura 1: Produção microfluídica de microgéis de ácido hialurônico (AH) com alças funcionais de norborneno (NB). (A) Aproximadamente 31% das unidades de repetição de AH foram modificadas com sucesso com NB, conforme determinado pela análise de RMN de prótons realizada em óxido de deutério. 1 Mudanças de RMN H de norbornenos pendentes em δ6,33 e δ6,02 (prótons de vinil, endo) e δ6,26 e δ6,23 ppm (prótons de vinila, exo) foram comparados com o grupo metil HA δ2,05 ppm para determinar a funcionalização. Reimpresso de Anderson et al.12 com permissão da Elsevier. (B) Esquema do dispositivo microfluídico de focalização de fluxo usado para gerar μgéis HA-NB. (C) Projeções de intensidade máxima da microscopia confocal foram utilizadas para visualizar μgéis marcados fluorescentemente (barra de escala = 500 μm). (D) As distribuições de frequência do diâmetro do microgel a partir de execuções independentes na configuração microfluídica demonstram controle sobre o tamanho do microgel ~50 μm ou ~100 μm, dependendo do dispositivo usado. (E) O diâmetro do microgel é relatado como a média e o desvio padrão para cada corrida independente. Reimpresso de Wilson et al.9 com permissão de Wiley. Por favor, clique aqui para ver uma versão maior desta figura.
3. Microgéis purificadores e de secagem
- Purificação de microgéis
- Preparar o tampão de lavagem em microgel (300 mM HEPES, 50 mM NaCl, 50 mM CaCl 2), bem como a2% (p/v) de solução surfactante Pluronic F-127 em tampão de lavagem. Esterilizar as soluções utilizando um filtro acionado a vácuo de 0,2 μm.
- Centrifugar o tubo de coleta de microgel (5.000 x g) por 5 min. Em um capuz estéril, aspirar cuidadosamente a fase de óleo sobrenadante. Combine os μgéis 1:1 com solução surfactante Pluronic F-127 a 2% e vórtice para misturar bem. Centrifugar (5.000 x g) durante 5 min e aspirar a solução de lavagem sobrenadante.
- Adicione o tampão de lavagem a 4x o volume de microgel e o vórtice para misturar bem. Centrifugar (5.000 x g) a mistura durante 5 min e aspirar a solução de lavagem. Complete 4-8 lavagens com o tampão de lavagem até que o surfactante seja removido do sistema (ou seja, não restam bolhas).
- Marcação fluorescente de microgéis HA-NB
NOTA:A síntese interna de uma tetrazina marcada fluorescentemente baseia-se em duas reações de adição de tiol-Michael catalisadas por base em séries que foram bem descritas e previamente relatadas3. Para este trabalho, Alexa Fluor-488 foi conjugado com tetrazina para a marcação de μgéis modificados com norborneno. O produto liofilizado (Alexa Flour 488-Tet) foi dissolvido em dimetilformamida a 1 mg/mL e armazenado a -20 °C.- Para rotular fluorescentemente os μgels, primeiro prepare uma solução de trabalho de Alexa Fluor 488-Tet diluindo o estoque de 1 mg/mL 1:14 em PBS estéril 1x. Num exaustor estéril, misture os μgéis com a solução de trabalho (2:1 em volume).
- Use uma pipeta de deslocamento e misture bem. Incubar a mistura durante 1 h à temperatura ambiente ou durante a noite a 4 °C.
- Centrifugar (5.000 x g) e aspirar a solução de coloração. Lave os μgéis duas vezes com 1x PBS (1:1 por volume) para remover o Alexa Fluor 488-Tet não reagido.
NOTA: Neste ponto, os μgels marcados fluorescentemente podem ser fotografados em um microscópio confocal para quantificar o tamanho do microgel (Figura 1C-E)9. Métodos de mensuração do tamanho do microgel foram minuciosamente descritos por Roosa et al.17.
- Microgéis HA-NB de secagem
- Transfira μgéis purificados (Figura 2A) para um tubo de tampa de rosca crio-seguro usando uma pipeta de deslocamento positivo. Adicione 70% de etanol aos μgéis purificados a 50% (v/v) e misture bem com uma pipeta de deslocamento. Centrífuga por 5 min a 5.000 x g.
CUIDADO: O etanol é uma substância altamente inflamável.
NOTA: O tubo de tampa de rosca crio-seguro pode ser pesado antes da adição de μgéis e, em seguida, pesado novamente após a liofilização para determinar a massa de μgels. Isso é recomendado para minimizar o erro ao usar quantidades inferiores a 1 mg. Certifique-se de que a balança seja ajustada internamente ou calibrada antes do uso. - Aspirar o líquido sobrenadante e substituir por etanol a 70% (50% v/v) (Figura 2B). Misture bem com uma pipeta de deslocamento. Incubar durante a noite a 4 °C.
NOTA: Os microgéis podem ser armazenados em etanol a 70% a 4 °C antes da liofilização para armazenamento a longo prazo, se necessário. Os microgéis liofilizados são mostrados na Figura 2C. Outros meios de liofilização podem ser utilizados nesta etapa se a formação de criogel for desejada (Figura 2D). - Centrifugar brevemente para garantir que os μgéis estejam na parte inferior do tubo da tampa de rosca. Adicione nitrogênio líquido a um recipiente criogênico e, em seguida, adicione o tubo de μgels para congelar rapidamente.
- Após 5-10 min, remova o tubo de μgels com fórceps. Remova rapidamente a tampa e cubra com um tecido de nível de laboratório. Prenda o tecido com um elástico e transfira para um recipiente ou câmara de liofilização.
- Carregue a amostra no liofilizador seguindo as instruções do fabricante. Liofilizar a 0,066 Torr e -63 °C. Armazenar os μgels liofilizados (lyo-μgels) bem selados à temperatura ambiente.
NOTA: A liofilização é completa quando todo o líquido é removido do tubo e um produto seco permanece. Os solventes orgânicos podem diminuir a longevidade dos acessórios de borracha em sistemas comuns de liofilização.
- Transfira μgéis purificados (Figura 2A) para um tubo de tampa de rosca crio-seguro usando uma pipeta de deslocamento positivo. Adicione 70% de etanol aos μgéis purificados a 50% (v/v) e misture bem com uma pipeta de deslocamento. Centrífuga por 5 min a 5.000 x g.
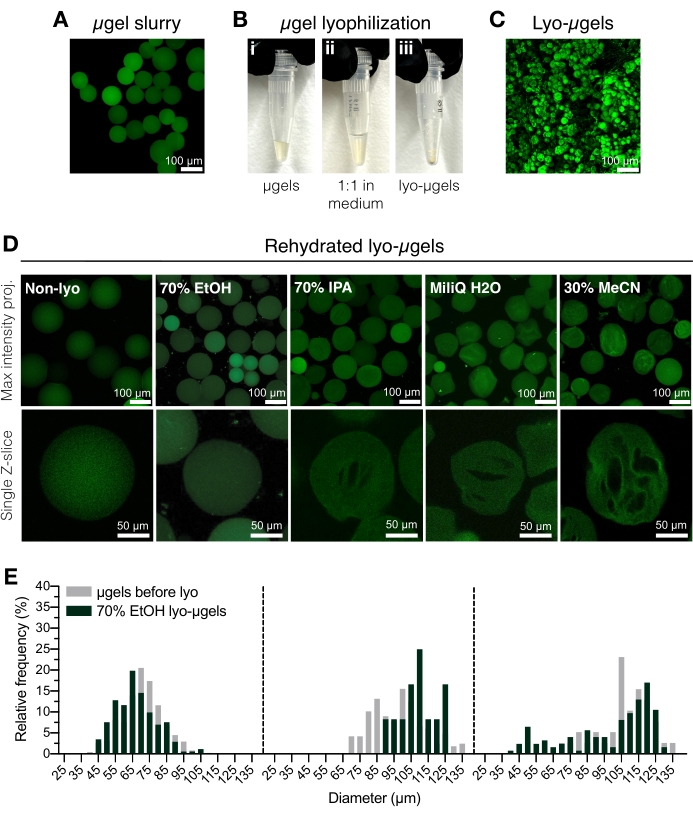
Figura 2: Secagem de microgéis HA-NB. (A) Projeção de intensidade máxima de μgéis em solução aquosa (barra de escala = 100 μm). (B) Os μgéis purificados podem ser incubados 1:1 em volume no meio de liofilização de escolha e liofilizados. (C) Projeção de intensidade máxima de lyo-μgels secos (barra de escala = 100 μm). (D) Os microgéis são ressuspensos após a liofilização. EtOH (70%) é recomendado para manter as propriedades originais dos μgéis durante todo o processo de liofilização; no entanto, outros meios, como álcool isopropílico (IPA), água e acetonitrila (MeCN), podem ser usados de forma intercambiável para facilitar a formação de criogel (barra de escala = 100 ou 50 μm, conforme observado). (E) Medida do diâmetro do microgel HA-NB antes (cinza) e após a liofilização (verde) em EtOH a 70% mostrada como distribuições de frequência para três populações de microgel. Reimpresso de Anderson et al.12 com permissão da Elsevier. Por favor, clique aqui para ver uma versão maior desta figura.
4. Fabricação de andaimes MAP
- Síntese do ligador de tetrazina
NOTA: Ligadores de tetrazina podem ser usados para interligar μgéis contendo grupos norbornenos livres (Figura 3A). O procedimento de síntese de HA-tetrazina (HA-Tet) foi adaptado de Zhang et al.18 utilizando HA sódico de 79 kDa com equivalentes molares de 1:1:0,25 de unidades de repetição de AH para DMTMM para tetrazina-amina (Figura 3B)12.- Pese os reagentes. Dissolver o AH a 20 mg/ml em tampão MES de 200 mM (pH ~6) agitando num copo ou balão numa placa de agitação. Uma vez dissolvido, adicione o DMTMM à solução de AH e deixe reagir por aproximadamente 20 minutos à temperatura ambiente. Por exemplo, 100 mg de HA + 72,8 mg de DMTMM + 14,14 mg de tetrazina-amina podem ser usados.
- Dissolva a tetrazina-amina a 15 mg/mL em tampão MES de 200 mM e adicione gota a gota à solução de HA/DMTMM. Consulte a Figura 3C para a configuração da reação HA-Tet.
- Adicione parafilme à abertura do recipiente de reação para minimizar a evaporação e cubra o recipiente de reação com folha. Continue mexendo enquanto permite que a reação prossiga por aproximadamente 24 h.
- Após 24 h, resfrie 200 etanol à prova (aproximadamente 10x o volume de reação). Em uma placa de agitação, transfira a reação gota a gota para o etanol resfriado para precipitar o HA-Tet (Figura 3D) e continue mexendo por 20 min.
- Transferir a solução para tubos cônicos de 50 mL e, em seguida, centrifugar a 5.000 x g por 10 min. Despeje o excesso de etanol para descartar como resíduo. Puxe o vácuo no HA-Tet em um dessecador para secar durante a noite. Um exemplo do produto seco nesta etapa do protocolo pode ser encontrado na Figura 3E.
- Purificar o HA-Tet usando diálise. Dissolver HA-Tet em solução de NaCl 2 M e transferir para tubos de diálise de celulose com um corte de peso molecular de 12-14 kDa. Transfira a tubulação de diálise cheia para um balde com 5 L de água ultrapura e dialize o HA-Tet contra a água durante a noite.
- No dia seguinte, retire a água e substitua por 1 M de solução de NaCl por 30 min. Retire a solução de NaCl e, em seguida, dialize contra a água ultrapura por 3 dias, substituindo a água diariamente.
- Filtre o produto dialisado utilizando um filtro acionado a vácuo de 0,2 μm e, em seguida, transfira o produto HA-Tet filtrado para tubos cónicos de 50 ml.
- Congele rapidamente os tubos cônicos em nitrogênio líquido por 10 minutos e, em seguida, remova os tubos cônicos com pinças. Remova rapidamente a tampa e cubra com um tecido de nível de laboratório. Prenda o tecido com um elástico e transfira para um recipiente ou câmara de liofilização e liofilize. Conservar o produto liofilizado (figura 3F) a -20 °C.
- Quantificar a modificação da tetrazina dissolvendo o HA-Tet a 10 mg/mL em D2O e analisando via RMN de prótons (Figura 3G)16.
- Para determinar a quantidade de funcionalização, primeiro calibre o pico do solvente D2O para 4,8 PPM. Integre o pico para os prótons metil HA (δ2,05) e calibre a integração para 3,0. Em seguida, integre os picos para os grupos de tetrazinas pendentes em δ8,5 (2H) e δ7,7 (2H) (prótons aromáticos). Normalizar a integração desses picos ao número correspondente de prótons para determinar o grau médio de modificação12.
- Interligando lyo-μgels para formar andaimes MAP para caracterização
- Prepare os componentes do andaime MAP (ou seja, μgels, HA-Tet, volume de reidratação). Pesar os lyo-μgels (Figura 4A) e reconstituir em 84% do volume final de PAM de 1x PBS. Deixe os microgéis incharem por aproximadamente 20 min (Figura 4B,C). O MAP wt% usado para reidratação pode ser escolhido com base na preferência do usuário pela fração final da partícula (consulte a Figura 4D, E).
- Dissolver o HA-Tet em 1x PBS na concentração escolhida (ver NOTA abaixo).
NOTA: Alterar a fração de embalagem (via MAP de % em massa), bem como a concentração de HA-Tet, alterará as propriedades mecânicas do andaime a granel. Por exemplo, um andaime MAP de 3,4% em peso reticulado com HA-Tet de 0,02 mg/mL (razão de recozimento de 2,6 mol de Tet:mol HA-NB) gera andaimes MAP com módulo de armazenamento de cisalhamento12 de aproximadamente 700 Pa. - Use uma pipeta de deslocamento para combinar o HA-Tet e os lyo-μgels e misture bem. Neste ponto, a mistura pode ser transferida através de pipeta de deslocamento para lâminas de vidro, placas de poço ou um recipiente de escolha do usuário. Deixe os μgels recozidos a 37 °C por 25 minutos e, em seguida, use uma espátula para transferir os andaimes MAP para placas de poço cheias com 1x PBS. Mantenha os andaimes MAP em 1x PBS até que estejam prontos para caracterização.
- Calculando a fração de partículas do andaime MAP
- Para melhorar a qualidade da imagem, transfira o andaime MAP para uma tampa de vidro usando uma espátula. Andaimes MAP de imagem em um microscópio confocal usando o laser para excitação e emissão de FITC. O MAP de imagem andaimes em uma objetiva de 20x e obtém uma pilha Z atravessando 250-300 μm na direção Z com um tamanho de passo de 2,5 μm. Anote a calibração μm/pixel da imagem.
- Importe a imagem da pilha Z para o software de análise (consulte Tabela de materiais). Selecione o botão Adicionar Novas Superfícies . Marque a caixa para Segmentar apenas uma região de interesse e selecione o botão de seta azul Avançar: Região de interesse.
- Defina uma região de interesse, acompanhando as dimensões X, Y e Z do volume que está sendo analisado. Selecione o botão de seta azul Avançar: Canal de origem.
NOTA: As dimensões X e Y estão em unidades de pixels, enquanto a dimensão Z é o número de etapas. Uma altura Z recomendada para a região de interesse deve incluir um mínimo de dois μgéis. - Use a lista suspensa Canal de origem para selecionar o canal FITC. Marque a caixa ao lado de Liso e insira um detalhe de superfície de 2,50 μm. Em Limiar, selecione Intensidade Absoluta e, em seguida, selecione o botão de seta azul Seguinte: Limiar.
- Use o valor de limite sugerido para o canal FITC. Gire a projeção 3D para avaliar a qualidade de renderização e ajustar conforme necessário. Selecione Avançar: Classificar superfícies.
Observação : O botão Voltar pode ser usado para editar etapas anteriores no processo, como a dimensão Z, conforme necessário. - Verifique se Número de Voxels é 10.0 e selecione o botão verde de seta dupla Concluir: Execute todas as etapas de criação e encerre o assistente.
NOTA: Os parâmetros de renderização de volume podem ser armazenados para análise em lote para que as mesmas configurações sejam aplicadas para analisar todos os andaimes. - Para exportar os dados, selecione a guia Estatísticas e, em seguida, a guia Detalhado . Use a segunda caixa suspensa para selecionar a variável Volume. Selecione o botão de disquete Exportar estatísticas na exibição de guias para arquivo e salve como um arquivo de planilha (.xls) quando solicitado.
- Abra o arquivo e use a função SOMA no Volume da Coluna A para determinar o volume total (μm3) dos μgéis na região de interesse.
- Converta as dimensões da região de interesse que foi analisada de pixels para μm. Use a calibração μm/pixel da imagem da etapa 4.3.1 para converter as dimensões X e Y. Multiplique a dimensão Z (número de passos) pelo tamanho da etapa para que a imagem converta a dimensão Z em μm. Calcule o volume da região de interesse (μm3) multiplicando as dimensões X, Y e Z.
- Para determinar a fração de partículas do andaime, divida o volume total dos μgéis na região de interesse (encontrado na etapa 4.3.8) pelo volume da região de interesse (encontrado na etapa 4.3.9).
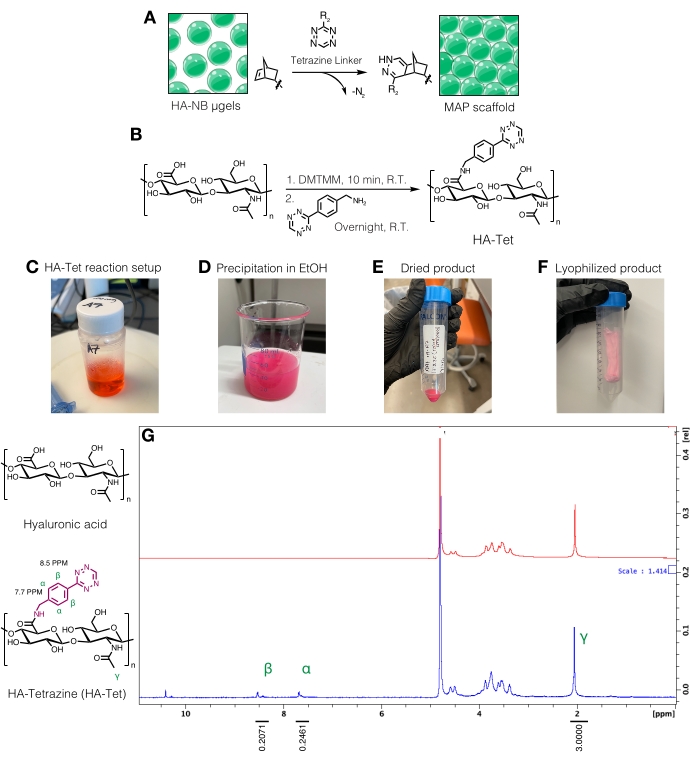
Figura 3: Síntese do ligador de tetrazina para a fabricação de andaimes microporosos de partículas recozidas (MAP). (A) Esquema de μgels HA-NB sendo interligados com um ligador de tetrazina para formar andaimes MAP. (B) Esquema de reação para a síntese de HA-Tet. (C) A reação HA-Tet foi configurada e deixada reagir durante a noite seguida de (D) precipitação de HA-Tet em etanol. (E) Uma vez purificado e seco, o HA-Tet foi reidratado e liofilizado para produzir (F) um produto seco e rosa claro. (G) A análise de RMN de prótons mostra modificação bem-sucedida de 11% das unidades de repetição de AH. Reimpresso de Anderson et al.12 com permissão da Elsevier. Por favor, clique aqui para ver uma versão maior desta figura.
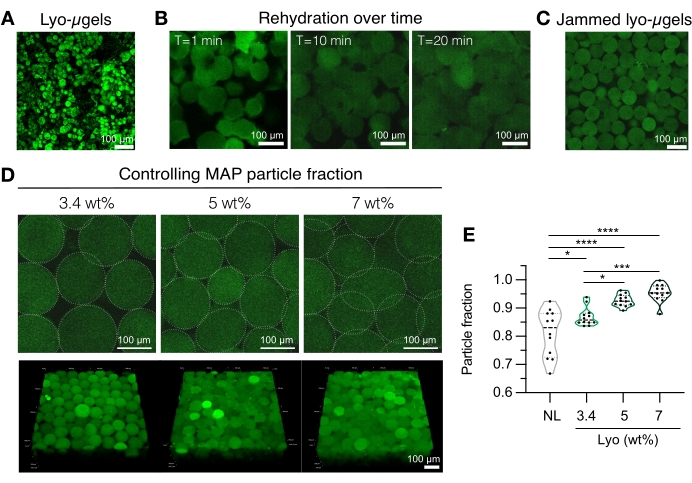
Figura 4: Reidratação de microgéis liofilizados para fabricação de andaimes MAP. (A) Projeção de intensidade máxima de lyo-μgels secos (barra de escala = 100 μm). (B) Após a liofilização, a reidratação dos lyo-μgels leva aproximadamente 20 min (barra de escala = 100 μm). (C) Os lyo-μgels podem ser reidratados a uma PAM variável em peso para produzir μgéis emperrados (barra de escala = 100 μm). (D) O aumento da PAM em peso ao reidratar os lyo-μgels altera a fração de partículas em andaimes MAP, como mostrado por fatias Z únicas de andaimes MAP e projeções de volume (barra de escala = 100 μm). (E) Usando esses andaimes wt% MAP definidos pelo usuário, frações de partículas únicas podem ser alcançadas (NL = μgéis não liofilizados). Uma ANOVA one-way com HSD de Tukey foi realizada nas amostras (n = 3), com significância relatada em p < 0,05 (*), p < 0,01 (**), p < 0,005 (***) e p < 0,001 (****). Reimpresso de Anderson et al.12 com permissão da Elsevier. Por favor, clique aqui para ver uma versão maior desta figura.
5.3D cultura de células em andaimes de mapas
- Preparar dispositivos de cultura celular
- Para criar um dispositivo de cultura de células personalizado para esses experimentos (Figura 5A-C), use uma impressora 3D para imprimir um molde negativo usando o arquivo CAD encontrado no Arquivo de Codificação Suplementar 1.
NOTA: As dimensões do dispositivo de cultura de células são as seguintes: 94,9 mm x 94,9 mm x 4,8 mm com altura total do poço de 2,6 mm. O diâmetro dos poços internos e externos é de 4 mm e 6 mm, respectivamente. - Misture a base de elastômero de polidimetilsiloxano (PDMS) com o agente de cura em uma proporção de 10:1 em massa. Despeje a mistura PDMS em uma grande placa de Petri de plástico e desgaseifique em um exsicador por aproximadamente 30 minutos ou até que todas as bolhas tenham desaparecido.
- Uma vez que todas as bolhas tenham desaparecido, coloque cuidadosamente o molde impresso em 3D no PDMS para minimizar a formação de novas bolhas. Colocar no forno a 60 °C durante, pelo menos, 2 h para curar o PDMS.
- Use uma faca ou lâmina de barbear para traçar suavemente em torno do parâmetro do dispositivo de cultura e, em seguida, remova cuidadosamente o molde. Use um soco de biópsia de 4 mm para remover qualquer PDMS do fundo dos poços. Corte os dispositivos para caber em uma tampa de vidro.
NOTA: Os dispositivos de cultura de células também podem ser colados a lâminas de vidro, mas as lâminas de vidro melhoram a imagem da amostra. - Use fita adesiva para remover a poeira do lado inferior dos dispositivos de cultura. Coloque as tampas de vidro limpas e os dispositivos de cultura (de baixo para cima) numa placa quente a 135 °C durante, pelo menos, 15 minutos para remover a humidade.
- Em um exaustor, use uma pistola de plasma corona no alto da tampa de vidro e no lado inferior do dispositivo por 30 s e, em seguida, una rapidamente as superfícies tratadas. Aplique pressão suavemente para garantir uma boa vedação entre o dispositivo de cultura e a tampa de vidro.
- Repita o passo 5.1.6 para todos os dispositivos e, em seguida, coloque num forno a 60 °C durante a noite para fixar a ligação. Autoclave os dispositivos para esterilizar antes de usar in vitro.
- Para criar um dispositivo de cultura de células personalizado para esses experimentos (Figura 5A-C), use uma impressora 3D para imprimir um molde negativo usando o arquivo CAD encontrado no Arquivo de Codificação Suplementar 1.
- Cultura de células em andaimes MAP
- Prepare os componentes do andaime MAP (ou seja, μgels, HA-Tet, volume de mídia) com base na fração de partículas desejada (consulte a Figura 4D-E). Pesar os lyo-μgels em um exaustor estéril e reconstituir em 84% do volume final de PAM do meio celular com base no MAP wt% escolhido. Deixe os μgels incharem por aproximadamente 20 min.
NOTA: Estes métodos requerem que o utilizador pese o produto lyo-microgel para reidratação. Para pequenas massas (1 mg ou menos), sugere-se primeiro pesar o criotubo antes de adicionar e liofilizar μgéis e, em seguida, repesar o tubo após a liofilização para determinar a massa do produto para minimizar o erro. - Dissolva o HA-Tet em meio celular em 16% do volume final do MAP.
Observação : as etapas a seguir para preparar células para semeadura em andaimes MAP podem ser alteradas dependendo do tipo de célula que está sendo usado. Neste protocolo, células mesenquimais de camundongos D1 foram cultivadas em meio Eagle modificado (DMEM) da Dulbecco, suplementado com 1% de penicilina-estreptomicina (pen-estreptococo) e 10% de soro fetal bovino (FBS) (ver Tabela de Materiais). Protocolos padrão de cultura de células aderentes devem ser seguidos para essas células, com as culturas mantidas a 37 °C e 5% de CO2 em vasos de cultura tratados com cultura de tecidos. - Uma vez que as células mesenquimais de camundongo D1 tenham atingido 70% a 80% de confluência, aspirar o meio e lavar as células com 1x PBS. Levante as células adicionando volume suficiente de 1% de tripsina-EDTA para cobrir a superfície do vaso de cultura de tecidos. Incubar a 37 °C por 1-3 min e, em seguida, extinguir a tripsinização adicionando meios DMEM suplementados com 1% de práceps de caneta e 10% de FBS a 2x o volume de tripsina-EDTA.
- Centrifugar a suspensão celular a 100 x g durante 5 min à temperatura ambiente para peletizar as células. Aspirar o meio sobrenadante e ressuspender as células em 1 mL de meio DMEM suplementado com 1% de estreptococos e 10% de FBS.
- Certifique-se de que a suspensão da célula esteja bem misturada e, em seguida, transfira 20 μL para um novo tubo de microcentrífuga. Adicione 20 μL de solução de azul de tripano e misture bem. Use 20 μL desta mistura para contar as células usando um hemocitômetro ou um contador de células automatizado com lâminas de câmara de contagem de células.
- Transfira o número de células necessárias para semear 10.000 células/μL MAP para um novo tubo de microcentrífuga. Centrifugar a 100 x g durante 5 min à temperatura ambiente para peletizar as células. Aspirar cuidadosamente o meio sobrenadante do pellet celular sem aspirar as células.
- Adicione os μgéis e o reticulante ao pellet celular com uma pipeta de deslocamento. Misture bem com uma pipeta de deslocamento e, em seguida, semeie 10 μL da mistura por poço. Ao revestir, pipetar em um movimento circular para distribuir uniformemente a mistura no poço.
- Deixe os μgels recozidos a 37 °C na incubadora de células por 25 minutos antes de adicionar meios celulares para encher os poços (~50 μL de meio por poço). Mantenha as culturas 3D a 37 °C e altere o meio conforme necessário. Para evitar aspirar o andaime ao mudar de meio, estabilize a ponta da pipeta ao longo da crista do poço superior.
NOTA: Ao adicionar ou remover líquido dos poços de cultura, apoie a extremidade da ponta da pipeta na borda acima do andaime MAP para minimizar a chance de interromper ou aspirar o andaime do poço. - Nos momentos desejados, fixe as amostras removendo o meio e adicionando 50 μL de paraformaldeído a 4% por poço por 30 min à temperatura ambiente. Lave as amostras 3x com 50 μL de 1x PBS ou tampão preferido. Neste ponto do protocolo, métodos padrão para imunofluorescência ou coloração por fluorescência podem ser seguidos, usando 50 μL por poço e o volume de trabalho.
NOTA: Estes métodos de fixação e coloração celular descrevem especificamente o uso de corantes fluorescentes; no entanto, a imunocoloração com conjugações de anticorpos primários e/ou secundários também pode ser realizada nesses andaimes, seguindo as instruções do fabricante, usando 50 μL como volume de trabalho por poço. - Células de imagem em andaimes MAP em um microscópio confocal usando uma objetiva de 20x e obter uma pilha Z atravessando 200-250 μm na direção Z com um tamanho de passo de 2,5 μm. Um exemplo de coloração por fluorescência com DAPI (coloração nuclear diluída 1:1000 em Tritão-X a 0,15% em PBS 1x) e faloidina-647 (coloração de F-actina diluída 1:40 em Tritão-X a 0,15% em 1x PBS) é mostrado na Figura 5E, F com células D1 fixas cultivadas em andaimes MAP por 3 dias.
NOTA: O tratamento com plasma de superfícies de vidro resulta em aumento da hidrofilicidade, o que demonstrou aumentar a adesão celular. As células provavelmente serão observadas se espalhando ao longo do fundo dos poços de cultura celular, mas não devem ser incluídas na contagem de células ou quantificação do volume celular para avaliar a resposta celular em andaimes MAP.
- Prepare os componentes do andaime MAP (ou seja, μgels, HA-Tet, volume de mídia) com base na fração de partículas desejada (consulte a Figura 4D-E). Pesar os lyo-μgels em um exaustor estéril e reconstituir em 84% do volume final de PAM do meio celular com base no MAP wt% escolhido. Deixe os μgels incharem por aproximadamente 20 min.
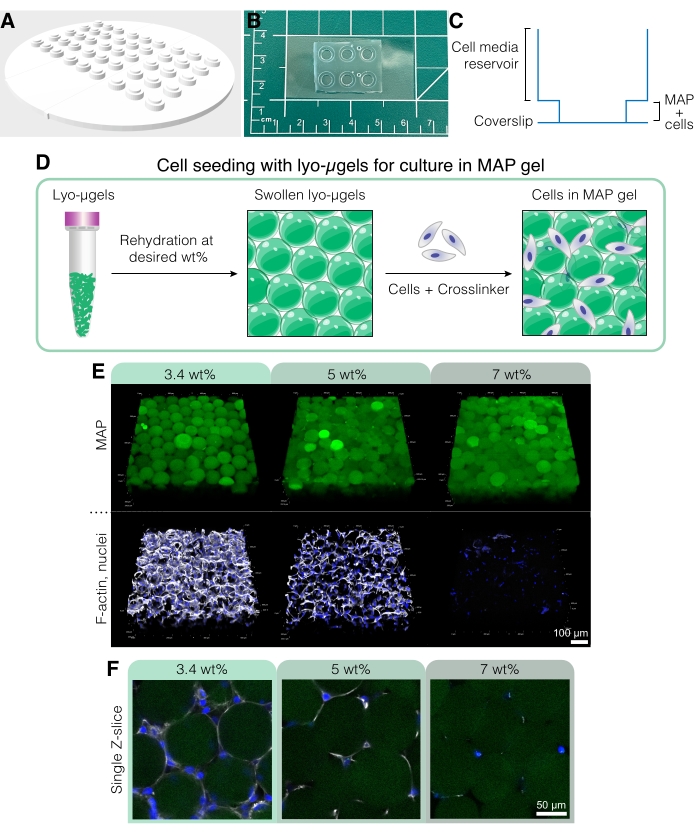
Figura 5: Cultura de células em andaimes MAP. (A) O molde para a criação de poços de cultura de células pode ser impresso em 3D e fundido com PDMS. Todo o molde tem 95 mm de diâmetro, os grandes poços têm 6 mm de diâmetro e os pequenos poços internos têm 4 mm de diâmetro. (B) Uma vez fundidos com PDMS, os dispositivos de cultura de células são ligados a plasma a folhas de cobertura para melhorar as capacidades de microscopia. (C) A seção transversal de um poço de cultura celular representa o reservatório para o meio celular (~50 μL) e um reservatório menor para semear o andaime MAP com células (~10 μL). (D) O processo de semeadura de células em andaimes MAP baseia-se primeiro na reidratação de lyo-μgels no peso desejado pelo usuário, seguido pela mistura com células e o reticulador para interligar os μgels. (E) As células podem ser encapsuladas em andaimes MAP (verde) com MAP em peso variável. As imagens representativas são do dia 5 da cultura de células D1 em andaimes MAP (barra de escala = 100 μm). (F) Fatias Z simples mostram diferenças no crescimento celular em andaimes que compreendem diferentes PAMm_wt% (barra de escala = 50 μm). Reimpresso de Anderson et al.12 com permissão da Elsevier. Por favor, clique aqui para ver uma versão maior desta figura.
Resultados
O objetivo deste protocolo é demonstrar a preparação de andaimes de partículas microporosas recozidos (MAP) com um esquema de reticulação bio-ortogonal, bem como frações de partículas controladas para cultura de células 3D. Primeiro, o AH foi modificado com grupos de pingente norborneno para ser usado tanto na formação de microgel quanto na interligação para formar andaimes MAP. Utilizando esses métodos, aproximadamente 31% das unidades de repetição de AH foram modificadas com sucesso com uma alça funci...
Discussão
Demonstrou-se que a produção microfluídica de microgéis HA-NB gera microgéis com uma faixa mais estreita de distribuição de tamanho do que a produção em lote de emulsão 3,9. Os microgéis descritos neste protocolo foram formulados utilizando um reticulador MMP-clevable (Ac-GCRDGPQGIWGQDRCG-NH2) para suportar a degradação do material. No entanto, os microgéis HA-NB também podem ser reticulados usando um ligador de di-tiol alternativo, com...
Divulgações
A ARA e a TS registraram uma patente provisória sobre essa tecnologia.
Agradecimentos
Os autores gostariam de agradecer aos Institutos Nacionais de Saúde, aos Institutos Nacionais de Distúrbios Neurológicos e Derrame (1R01NS112940, 1R01NS079691, R01NS094599) e ao Instituto Nacional de Alergia e Doenças Infecciosas (1R01AI152568). Este trabalho foi realizado em parte na Duke University Shared Materials Instrumentation Facility (SMIF), membro da North Carolina Research Triangle Nanotechnology Network (RTNN), que é apoiada pela National Science Foundation (número de prêmio ECCS-2025064) como parte da National Nanotechnology Coordinated Infrastructure (NNCI). Os autores gostariam de agradecer ao ex-pós-doutor do laboratório, Dr. Lucas Schirmer, bem como a Ethan Nicklow, por sua assistência na geração do dispositivo impresso em 3D para experimentos de cultura celular.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309628 | |
| 5 mL Luer-Lok syringe sterile, single use, polycarbonate | BD | 309646 | |
| Alexa Fluor 488 C5 maleimide | Invitrogen | A10254 | For synthesis of fluorescently-labeled tetrazine |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | For staining cell culture samples |
| Aluminum foil | VWR | 89107-726 | |
| Biopsy punch with plunger, 1.0 mm | Integra Miltex | 69031-01 | |
| Biopsy punch, 4 mm | Integra Miltex | 33-34 | |
| Blunt needle, 23 G 0.5", Non-Sterile, Capped | SAI Infusion Technologies | B23-50 | |
| Bottle-top vacuum filter, 0.22 μm | Corning | CLS430521 | |
| Calcium chloride | VWR | 1B1110 | For microgel washing buffer |
| Capillary-piston assemblies for positive-displacement pipettes, 1000 μL max. volume | Rainin | 17008609 | |
| Capillary-piston assemblies for positive-displacement pipettes, 25 μL max. volume | Rainin | 17008605 | |
| Capillary-piston assemblies for positive-displacement pipettes, 250 μL max. volume | Rainin | 17008608 | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10228 | |
| Countess II FL Automated Cell Counter | Invitrogen | AMQAF1000 | |
| Centrifuge tube, 15 mL | CELLTREAT | 667015B | |
| Centrifuge tube, 50 mL | CELLTREAT | 229421 | |
| Chloroform, ACS grade, Glass Bottle | Stellar Scientific | CP-C7304 | For synthesis of fluorescently-labeled tetrazine |
| Corona plasma gun, BD-10A High Frequency Generator | ETP | 11011 | |
| CryoTube Vials, Polypropylene, Internal Thread with Screw Cap | Nunc | 368632 | |
| D1 mouse mesenchymal cells | ATCC | CRL-12424 | Example cell line for culture in MAP gels |
| DAPI | Sigma-Aldrich | D9542 | For staining cell culture samples |
| Deuterium oxide, 99.9 atom% D | Sigma-Aldrich | 151882 | For NMR spectroscopy |
| Dialysis tubing, regenerated cellulose membrane, 12-14 kDa molecular weight cut-off | Spectra/Por | 132703 | For purifying HA-NB and HA-Tet |
| Diethyl ether | VWR | BDH1121-4LPC | For synthesis of fluorescently-labeled tetrazine |
| Dimethylformamide | Sigma-Aldrich | 277056 | For synthesis of fluorescently-labeled tetrazine |
| 4-(4,6-dimethoxy-1,3,5-triazin-2-yl)-4-methylmorpholinium chloride (DMTMM) | TCI-Chemicals | D2919 | For modifying HA |
| Dithiothreitol (DTT) | Thermo Scientific | R0861 | Non-degradable dithiol linker (substitute for MMP-cleavable peptide) |
| Dulbecco's Modified Eagle's Medium (DMEM), high glucose, w/ 4500 mg/L glucose, L-glutamine, sodium pyruvate, and sodium bicarbonate, liquid, sterile-filtered, suitable for cell culture | Sigma-Aldrich | D6429-500ML | For D1 cell culture |
| EMS Paraformaldehyde, Granular | VWR | 100504-162 | For making 4% PFA |
| Ethanol absolute (200 proof) | KOPTEC | 89234-850 | |
| Fetal bovine serum (FBS) | ATCC | 30-2020 | For D1 cell culture |
| Heating Plate | Kopf Instruments | HP-4M | |
| Hemacytometer with coverglass | Daigger Scientific | EF16034F | |
| 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375 | |
| Sodium hyaluronate, 79 kDa average molecular weight, produced in bacteria Streptococcus zooepidemicus, pharmaceutical grade, microbial contamination <100 CFU/g, bacterial endotoxins <0.050 IU/mg | Contipro | N/A | 79 kDa average molecular weight was used for HA-Tet synthesis, but these methods could be adapted for other molecular weights. |
| IMARIS Essentials software package | Oxford Instruments | N/A | Microscopy image analysis software |
| Infusion pump, dual syringe | Chemyx | N/A | |
| Kimwipe | Kimberly-Clark | 34120 | |
| Laboratory stand with support lab clamp | Geyer | 212100 | |
| Liquid nitrogen | Airgas | NI 180LT22 | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate | TCI-Chemicals | L0290 | |
| Lyophilizer | Labconco | N/A | Labconco FreeZone 6 plus has been discontinued, but other lab grade console freeze dryers could be used for this protocol. |
| Methyltetrazine-PEG4-maleimide | Kerafast | FCC210 | For synthesis of fluorescently-labeled tetrazine |
| 2-(4-Morpholino)ethane Sulfonic Acid (MES) | Fisher Scientific | BP300-100 | For modifying HA |
| Micro cover glass, 24 x 60 mm No. 1 | VWR | 48393-106 | |
| Microfluidic device SU8 master wafer | FlowJem | Custom design made either in-house in clean room or outsourced | |
| Mineral oil, heavy | Sigma-Aldrich | 330760 | |
| MMP-cleavable dithiol crosslinker peptide (Ac-GCRDGPQGIWGQDRCG-NH2) | GenScript | N/A | |
| 5-Norbornene-2-methylamine | TCI-Chemicals | 95-10-3 | For HA-NB synthesis |
| Packing tape | Scotch | 3M 1426 | |
| Parafilm | Bemis | PM996 | |
| PEG(thiol)2 | JenKem Technology USA | A4001-1 | For synthesis of fluorescently-labeled tetrazine |
| Penicillin-Streptomycin, 10,000 units/mL | Thermo Fisher Scientific | 15140122 | For D1 cell culture |
| Petri dish, polystyrene, disposable, Dia. x H=150 x 15 mm | Corning | 351058 | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | For washing HMPs |
| Phosphate buffered saline (PBS) 1x | Gibco | 10010023 | |
| RainX water repellent glass treatment | Grainger | 465D20 | Synthetic hydrophobic treatment solution for microfluidic device treatment |
| RGD peptide (Ac-RGDSPGERCG-NH2) | GenScript | N/A | |
| Rubber bands | Staples | 112417 | |
| Sodium chloride | Chem-Impex | 30070 | For dialysis |
| Span 80 for synthesis | Sigma-Aldrich | 1338-43-8 | |
| Sylgard 184 Silicone Elastomer | Electron Microscopy Science | 4019862 | polydimethylsiloxane (PDMS) elastomer for making microfluidic devices and tissue culture devices |
| Syringe filter, Whatman Uniflo, 0.2 μm PES, 13 mm diameter | Cytvia | 09-928-066 | |
| Tetraview LCD digital microscope | Celestron | 44347 | |
| Tetrazine-amine HCl salt | Chem-Impex | 35098 | For HA-Tet synthesis |
| Triethylamine | Sigma-Aldrich | 471283 | For synthesis of fluorescently-labeled tetrazine |
| Tris(2-carboxyethyl)phosphine (TCEP) | Millipore Sigma | 51805-45-9 | |
| Triton X-100 | VWR | 97063-864 | |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| Trypsin EDTA (0.25%), Phenol red | Fisher Scientific | 25-200-056 | For lifting adherent cells to seed in MAP gels |
| Tygon ND-100-80 Non-DEHP Medical Tubing, Needle Gauge=23, Wall Thickness=0.020 in, Internal diameter = 0.020, Outer diameter = 0.060 in | Thomas Scientific | 1204G82 | |
| UV curing system controller, LX500 LED | OmniCure | 010-00369R | |
| UV curing head, LED spot UV | OmniCure | N/A | |
| UV light meter, Traceable | VWR | 61161-386 | |
| Vacuum dessicator | Bel-Art | 08-594-15C | |
| X-Acto Z Series Precision Utility Knife | Elmer's | XZ3601W |
Referências
- Griffin, D. R., Weaver, W. M., Scumpia, P. O., Di Carlo, D., Segura, T. Accelerated wound healing by injectable microporous gel scaffolds assembled from annealed building blocks. Nature Materials. 14 (7), 737-744 (2015).
- Daly, A. C., Riley, L., Segura, T., Burdick, J. A. Hydrogel microparticles for biomedical applications. Nature Reviews Materials. 5 (1), 20-43 (2020).
- Darling, N. J., et al. Click by click Microporous Annealed Particle (MAP) scaffolds. Advanced Healthcare Materials. 9 (10), 1901391 (2020).
- Truong, N. F., et al. Microporous annealed particle hydrogel stiffness, void space size, and adhesion properties impact cell proliferation, cell spreading, and gene transfer. Acta Biomaterialia. 94, 160-172 (2020).
- Pfaff, B. N., et al. Selective and improved photoannealing of Microporous Annealed Particle (MAP) scaffolds. ACS Biomaterials Science & Engineering. 7 (2), 422-427 (2021).
- Sideris, E., et al. Particle hydrogels based on hyaluronic acid building blocks. ACS Biomaterials Science & Engineering. 2 (11), 2034-2041 (2016).
- Caldwell, A. S., Campbell, G. T., Shekiro, K. M. T., Anseth, K. S. Clickable microgel scaffolds as platforms for 3D cell encapsulation. Advanced Healthcare Materials. 6 (15), 1700254 (2017).
- Qazi, T. H., et al. Anisotropic rod-shaped particles influence injectable granular hydrogel properties and cell invasion. Advanced Materials. 34 (12), 2109194 (2022).
- Wilson, K. L., et al. Stoichiometric post modification of hydrogel microparticles dictates neural stem cell fate in microporous annealed particle scaffolds. Advanced Materials. 34 (33), 2201921 (2022).
- Muir, V. G., Qazi, T. H., Shan, J., Groll, J., Burdick, J. A. Influence of microgel fabrication technique on granular hydrogel properties. ACS Biomaterials Science & Engineering. 7 (9), 4269-4281 (2021).
- Highley, C. B., Song, K. H., Daly, A. C., Burdick, J. A. Jammed microgel inks for 3D printing applications. Advanced Science. 6 (1), 1801076 (2018).
- Anderson, A. R., Nicklow, E., Segura, T. Particle fraction as a bioactive cue in granular scaffolds. Acta Biomaterialia. 150, 111-127 (2022).
- Pruett, L., Ellis, R., McDermott, M., Roosa, C., Griffin, D. R. Spatially heterogeneous epidermal growth factor release from microporous annealed particle (MAP) hydrogel for improved wound closure. Journal of Materials Chemistry B. 9 (35), 7132-7139 (2021).
- Sheikhi, A., et al. Microengineered emulsion-to-powder technology for the high-fidelity preservation of molecular, colloidal, and bulk properties of hydrogel suspensions. ACS Applied Polymer Materials. 1 (8), 1935-1941 (2019).
- Brower, K., White, A. K., Fordyce, P. M. Multi-step variable height photolithography for valved multilayer microfluidic devices. Journal of Visualized Experiments. (119), e55276 (2017).
- JoVE. Nuclear Magnetic Resonance (NMR) Spectroscopy. JoVE Science Education Database. Organic Chemistry. JoVE. , (2022).
- Roosa, C., et al. Microfluidic synthesis of microgel building blocks for microporous annealed particle scaffold. Journal of Visualized Experiments. (184), e64119 (2022).
- Zhang, H., Dicker, K. T., Xu, X., Jia, X., Fox, J. M. Interfacial bioorthogonal crosslinking. ACS Macro Letters. 3 (8), 727-731 (2014).
- Welzel, P. B., et al. Cryogel micromechanics unraveled by atomic force microscopy-based nanoindentation. Advanced Healthcare Materials. 3 (11), 1849-1853 (2014).
- Plieva, F., Huiting, X., Galaev, I. Y., Bergenståhl, B., Mattiasson, B. Macroporous elastic polyacrylamide gels prepared at subzero temperatures: control of porous structure. Journal of Materials Chemistry. 16 (41), 4065-4073 (2006).
- Rommel, D., et al. Functionalized microgel rods interlinked into soft macroporous structures for 3D cell culture. Advanced Science. 9 (10), 2103554 (2022).
- Kurt, E., Segura, T. Nucleic acid delivery from granular hydrogels. Advanced Healthcare Materials. 11 (3), 2101867 (2021).
- Isaac, A., et al. Microporous bio-orthogonally annealed particle hydrogels for tissue engineering and regenerative medicine. ACS Biomaterials Science & Engineering. 5 (12), 6395-6404 (2019).
- Truong, N. F., Lesher-Pérez, S. C., Kurt, E., Segura, T. Pathways governing polyethylenimine polyplex transfection in Microporous Annealed Particle scaffolds. Bioconjugate Chemistry. 30 (2), 476-486 (2019).
- Koh, J., et al. Enhanced in vivo delivery of stem cells using microporous annealed particle scaffolds. Small. 15 (39), 1903147 (2019).
- Li, F., et al. Cartilage tissue formation through assembly of microgels containing mesenchymal stem cells. Acta Biomaterialia. 77, 48-62 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados