Method Article
Transferências diárias, arquivamento de populações e medição da aptidão no experimento de evolução de longo prazo com Escherichia coli
Neste Artigo
Resumo
Este protocolo descreve como manter o Experimento de Evolução de Longo Prazo (LTEE) de Escherichia coli realizando suas transferências diárias e congelamentos periódicos e como conduzir ensaios de competição para medir melhorias de aptidão em bactérias evoluídas. Esses procedimentos podem servir como um modelo para pesquisadores que iniciam seus próprios experimentos de evolução microbiana.
Resumo
O Long-Term Evolution Experiment (LTEE) acompanhou doze populações de Escherichia coli que se adaptaram a um ambiente de laboratório simples por mais de 35 anos e 77.000 gerações bacterianas. O arranjo e os procedimentos utilizados no LTEE sintetizam métodos confiáveis e reprodutíveis para o estudo da evolução microbiana. Neste protocolo, primeiramente descrevemos como as populações de LTEE são transferidas para meio fresco e cultivadas a cada dia. Em seguida, descrevemos como as populações de LTEE são regularmente verificadas quanto a possíveis sinais de contaminação e arquivadas para fornecer um "registro fóssil" congelado permanente para estudo posterior. Várias salvaguardas incluídas nesses procedimentos são projetadas para evitar contaminação, detectar vários problemas quando eles ocorrem e se recuperar de interrupções sem atrasar sensivelmente o progresso do experimento. Uma maneira pela qual o tempo geral e o caráter das mudanças evolutivas são monitorados no LTEE é medindo a aptidão competitiva de populações e linhagens do experimento. Descrevemos como os ensaios de competição de co-cultura são conduzidos e fornecemos uma planilha e um pacote R (fitnessR) para calcular a aptidão relativa a partir dos resultados. Ao longo do LTEE, os comportamentos de algumas populações mudaram de maneiras interessantes, e novas tecnologias, como o sequenciamento do genoma inteiro, forneceram caminhos adicionais para investigar como as populações evoluíram. Terminamos discutindo como os procedimentos LTEE originais foram atualizados para acomodar ou aproveitar essas mudanças. Este protocolo será útil para pesquisadores que usam o LTEE como um sistema modelo para estudar conexões entre evolução e genética, biologia molecular, biologia de sistemas e ecologia. Mais amplamente, o LTEE fornece um modelo testado e comprovado para aqueles que estão começando seus próprios experimentos de evolução com novos micróbios, ambientes e perguntas.
Introdução
Em fevereiro de 1988, Richard Lenski inoculou doze frascos contendo um meio de crescimento definido limitado por glicose com culturas clonais de Escherichia coli na Universidade da Califórnia, Irvine1. No dia seguinte, transferiu 1% da cultura de cada frasco para um conjunto de frascos novos contendo meio de crescimento fresco. Essa diluição de 1:100 permitiu que as populações bacterianas se expandissem 100 vezes antes de esgotar a glicose disponível, correspondendo a aproximadamente 62/3 gerações de divisões celulares. Esse procedimento foi repetido no dia seguinte e tem sido todos os dias desde então, com algumas interrupções. Essas transferências diárias continuaram, mesmo quando o experimento foi realocado, primeiro para a Universidade Estadual de Michigan, em 1992, e depois para a Universidade do Texas, em Austin, em 2022. Enquanto isso, novas mutações têm gerado continuamente variação genética nessas populações de E. coli e a seleção natural levou a células evoluídas a superarem seus ancestrais.
Lenski projetou esse experimento, agora conhecido como Long-Term Evolution Experiment (LTEE), para investigar a dinâmica e a repetibilidade da evolução. Para responder a essas perguntas, ele incluiu várias características importantes no planejamento do arranjo experimental e seusprotocolos2. Uma dessas características foi a escolha criteriosa de um organismo modelo. As doze populações originais foram todas iniciadas a partir de colônias únicas que compartilhavam um ancestral comum imediato, Escherichia coli B cepa REL606. Essa cepa foi escolhida porque já havia sido comumente usada em laboratório, reproduzida completamente assexuada e não continha plasmídeos ou prófagos intactos 3,4, o que torna o estudo de sua evolução mais simples. Outra escolha que simplificou o experimento foi usar uma concentração muito baixa de glicose no meio de crescimento para limitar a densidade de células em cada frasco após o crescimento. O uso de uma baixa densidade celular teve como objetivo facilitar a análise de mudanças na aptidão populacional, reduzindo o potencial de evolução de interações ecológicas dentro das populações (por exemplo, por alimentação cruzada)5.
REL606 é incapaz de usar ʟ-arabinose como fonte de carbono e energia (Ara−) devido a uma mutação pontual no gene araA . Antes de iniciar o LTEE, um mutante espontâneo com uma sequência araA restaurada, designada REL607, foi isolado de REL6066. REL607 é capaz de crescer em ʟ-arabinose (Ara+). REL606 foi usado para iniciar seis das populações de LTEE, e REL607 foi usado para iniciar as outras seis. A arabinosese não está presente no meio de crescimento usado durante o LTEE, então REL607 se comporta da mesma forma que REL606 nessas condições. No entanto, quando plaqueadas em ágar tetrazólio arabinose (TA), as células Ara− e Ara+ formam colônias vermelhas e brancas, respectivamente. Este método para discriminar as duas cepas ancestrais de E. coli e seus descendentes é bastante útil. Ele pode ser usado para detectar contaminação cruzada entre populações LTEE. Também ajuda a medir a aptidão de uma cepa ou população Ara− em relação a uma Ara+ quando elas são competidas entre si. A aptidão é medida através da criação de uma co-cultura de competidores com marcas opostas e, em seguida, monitorando como as frequências de colônias vermelhas e brancas (obtidas pela dispersão de diluições da cultura em placas TA) mudam entre quando os competidores são inicialmente misturados e após um ou mais ciclos de crescimento nas mesmas condições que o LTEE. A representação do tipo celular mais ajustado aumentará durante cada ciclo de crescimento.
Outra característica crítica do LTEE é que as amostras das populações em evolução são periodicamente arquivadas. Quando misturadas a um crioprotetor como o glicerol, as células de E. coli podem ser congeladas e posteriormente revividas7. Como parte do protocolo LTEE, a cada 75 dias (o que equivale a cerca de 500 gerações), uma parcela de cada população que não foi transferida para um novo frasco é misturada com glicerol, dividida entre vários frascos e armazenada em um freezer. Esse "registro fóssil" congelado permitiu que os pesquisadores realizassem os primeiros estudos do LTEE, nos quais eles reviveram as populações evoluídas de E. coli de vários pontos de tempo e as competiram contra as cepas ancestrais para rastrear a rapidez com que a aptidão estava aumentando1. A evolução da aptidão física tem sido remedida periodicamente à medida que mais "estratos" do "registro fóssil" congelado foram preservados. A conclusão geral dessas medidas é que a aptidão continua a melhorar no LTEE até hoje, mesmo após tantas gerações de evolução no mesmo ambiente 8,9,10.
O que permitiu que o LTEE continuasse por tanto tempo? Muitos dos mesmos recursos que permitiram que suas perguntas originais fossem feitas e respondidas também serviram como medidas de segurança e à prova de falhas contra interrupções inevitáveis devido a azar, erro humano e eventos mundiais. Diariamente, quando as culturas são transferidas para meio de crescimento fresco, o pesquisador que realiza as transferências alterna entre as populações Ara− e Ara+. Então, quando as populações são congeladas, elas podem ser plaqueadas em ágar seletivo e indicador para verificar se alguma população "vizinha" foi acidentalmente contaminada ou misturada (por exemplo, colônias brancas estão em uma população que só deveria formar colônias vermelhas) ou contaminada com micróbios estranhos (por exemplo, morfologias inesperadas de colônias ou densidades celulares). No caso de uma população ter sido comprometida, seu progenitor pode ser revivido do freezer e levado adiante em seu lugar. Os marcadores Ara e o arquivo congelado servem, portanto, a dois propósitos como recursos experimentais e medidas de segurança.
Como sua história é tão bem preservada e de fácil acesso, amostras de LTEE foram estudadas usando tecnologias que não existiam quando o experimento começou. Por exemplo, o sequenciamento do genoma completo tem sido usado para examinar a dinâmica de mutações nas populações de LTEE 11,12,13,14,15, e a transcriptômica e o perfil ribossomal têm sido usados para examinar mudanças na expressão gênica 16,17. Ferramentas genéticas têm sido utilizadas para reconstruir cepas que diferem por mutações únicas ou combinações de várias mutações evoluídas para entender seus efeitos sobre a aptidão e vários fenótipos 18,19,20,21. Amostras do "registro fóssil" congelado são facilmente reabastecidas para que partes ou cópias inteiras da história do experimento possam ser enviadas para outros laboratórios. As amostras LTEE já existem em todos os continentes, exceto na Antártida, e estão sendo estudadas por pesquisadores mais jovens do que o próprio experimento. Os métodos robustos do LTEE e amostras e cepas evoluídas de E. coli a partir de seu registro histórico também serviram como pontos de partida para experimentos evolutivos examinando outras questões e ambientes 22,23,24,25,26,27,28,29.
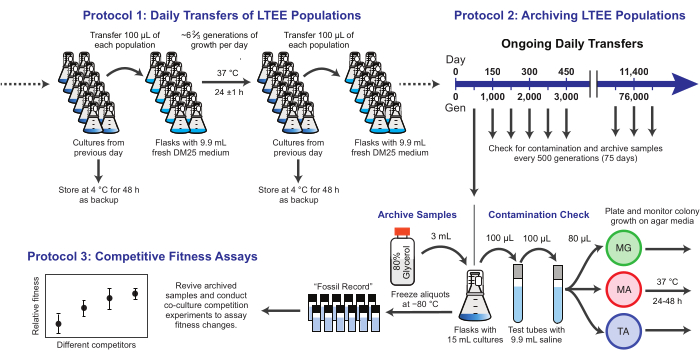
Figura 1: Visão geral dos procedimentos LTEE. Clique aqui para ver uma versão maior desta figura.
Aqui, demonstramos três protocolos centrais usados no experimento de evolução de longo prazo de E. coli (Figura 1). Nós descrevemos: (1) como realizar as transferências diárias, (2) como arquivar amostras populacionais e isolados clonais, e (3) como realizar e analisar ensaios de competição de co-cultura para medir diferenças de aptidão. Nossa esperança é que esses protocolos promovam o uso contínuo de recursos de LTEE e informem o planejamento de novos experimentos de evolução microbiana.
Protocolo
1. Transferências diárias de populações LTEE
NOTA: As doze populações de LTEE são transferidas diariamente inoculando meio fresco com 1% das culturas dos frascos do dia anterior. As etapas desse processo estão resumidas na Figura 1. As seis populações Ara− iniciadas a partir da cepa REL606 são designadas A−1 a A−6, e as seis populações Ara+ iniciadas a partir da cepa REL607 são designadas A+1 a A+6. A estrita adesão à técnica asséptica e a um cronograma e ordem de transferência das populações minimiza o risco de contaminação e outras interrupções.
- Desinfete a superfície na qual as transferências de LTEE serão conduzidas, limpando-a com etanol a 70% ou uma solução de água sanitária a 10%. Acenda um queimador de Bunsen para criar uma corrente ascendente local e permitir a queima de vidraria.
OBS: Usar luvas de laboratório para evitar contaminação. Para a segurança ao redor de uma chama aberta, é fundamental usar apenas luvas que sejam feitas de um material como a nitrílica que não seja inflamável. - Preparar treze frascos de 50 mL de borossilicato de Erlenmeyer tampados com 20 mL de borossilicato ou copos de polipropileno que tenham sido lavados e esterilizados em autoclave. Verifique se há detritos visíveis nos frascos e substitua os que não estiverem perfeitamente limpos.
- Rotular seis frascos A−1 a A−6 usando um marcador vermelho e os outros seis frascos A+1 a A+6 usando um marcador preto. Rotular o último frasco restante, que estará em branco, com a data em formato mês/dia e o dia da semana.
- Preencher cada um dos 13 frascos com 9,9 mL de meio DM25 utilizando uma pipeta sorológica estéril de 10 mL. Inflamar a boca de cada frasco depois de retirar o copo que serve de tampa e antes de substituir o copo. Chame a ponta da pipeta entre o enchimento de cada frasco.
NOTA: As instruções para fazer o DM25 estão disponíveis on-line30. Se estiver usando uma pipeta sorológica de plástico, renuncie a inflamar sua ponta ou limite o tempo na chama para evitar derreter o plástico. - Retire os frascos LTEE do dia anterior da incubadora de agitação.
- Examinar cada frasco segurando-o até à luz para avaliar a sua turbidez e cor, verificar a integridade do frasco e procurar a presença de matéria estranha.
NOTA: A olho nu, todas as culturas Ara− e Ara+ parecerão ligeiramente turvas em comparação com o branco, exceto A−3, que será ~10 vezes mais turvo do que as outras devido ao crescimento de citrato no meio. Muitos contaminantes microbianos externos também são capazes de crescer em citrato, então o aumento da turbidez em populações diferentes de A−3 provavelmente indica contaminação. Consulte a seção Resultados Representativos para obter imagens das culturas LTEE antes de uma transferência. - OPCIONAL: Confirmar se cada cultura LTEE tem a turbidez esperada pipetando 1 mL do branco e 1 mL de cada cultura em cubetas plásticas de 1 cm e fazendo leituras de densidade óptica a 600 nm (OD600) usando um espectrofotômetro após a cobertura do instrumento.
NOTA: Esta etapa extra pode ser útil para pesquisadores que são novos em trabalhar com o LTEE e não têm certeza sobre julgar a turbidez por olho, bem como para documentar e investigar anomalias suspeitas. Recolher amostras para medir OD600 dos frascos do dia anterior apenas depois de completar as transferências normais do dia para novos frascos (os passos seguintes) para minimizar o risco de contaminação das populações celulares que continuarão a ser propagadas se os valores OD600 forem os esperados. Consulte a seção Resultados representativos para obter valores OD600 típicos para culturas LTEE. - Usando um micropipetor P200 com uma ponta de filtro estéril, transferir 100 μL de cultura de cada frasco LTEE para o frasco correspondente contendo DM25 fresco. Comece com A−1 e, em seguida, transfira A+1. Depois disso, continue alternando entre as populações − e +. Para acompanhar quais culturas foram transferidas, desloque os frascos para a esquerda depois de pipetar de ou para eles.
NOTA: A ordem estrita de transferências e alternância entre as populações Ara− e Ara+ auxilia na prevenção e detecção de contaminação cruzada e misturas. Observe a técnica asséptica rigorosa: use uma ponta de pipeta fresca para cada transferência, chame as bocas dos frascos imediatamente após o desencape e antes de reencapar e limpe o barril e o ejetor do micropipettor com um lenço de papel sem fiapos umedecido com etanol 70% entre cada transferência. A água sanitária nunca deve ser usada para desinfetar micropipetadores, pois mesmo vestígios podem matar as culturas. - Incubar os frascos recém-inoculados a 37 °C durante 24 ± 1 h com agitação orbital a 120 rpm sobre um diâmetro de 1 polegada.
- Conservar as culturas do dia anterior a 4 °C. Retenha essas culturas de backup por dois dias. Descarte culturas mais antigas que foram salvas a 4 °C três dias antes neste momento.
NOTA: As culturas dos dois dias anteriores fornecem dois conjuntos completos de backups com os quais reiniciar o experimento, se necessário, se ocorrer algum problema ou acidente, ou se a contaminação das culturas do dia anterior for descoberta antes da transferência (por exemplo, coloração estranha ou partículas inesperadas). - Digite a hora, data, número da transferência, nome ou iniciais do pesquisador que realizou as transferências, se as culturas estavam ou não corretas e qualquer outra informação relevante no caderno de registro de transferência. Passe para os passos 1.12-1.14 se ocorrer qualquer uma das seguintes situações: (1) o branco do dia anterior estiver contaminado, (2) um frasco ou sua tampa estiver rachado ou quebrado, (3) um frasco contiver material estranho, (4) um frasco for tombado ou caído durante as transferências, ou (5) houver qualquer outro evento ou observação que torne questionável a continuação desses frascos.
- Se houver algum problema, acidente ou suspeita de contaminação com as culturas LTEE do dia anterior, não transfira delas. Em vez disso, armazene todo o conjunto de doze culturas a 4 °C para posterior exame e caracterização adicional.
- Recuperar os frascos contendo as culturas de reserva que foram transferidos do dia anterior e armazenados a 4 °C. Coloque-os na bancada para aquecer até à temperatura ambiente. Agitar suavemente cada frasco para ressuspender as células.
- Transferir dos frascos de reserva para o novo conjunto de frascos contendo meio fresco e continuar a experiência normalmente, tal como descrito nos pontos 1.6-1.11. Anote no log de transferência que as culturas de backup foram usadas e registre o mesmo número de transferência do dia anterior.
NOTA: Mesmo que se observe um problema em apenas um frasco populacional, transfira todas as doze populações dos frascos de reserva para que o número de gerações decorridas em todas as populações permaneça em fase. Se for observada contaminação nos frascos de reserva armazenados a 4 °C, as populações LTEE afectadas devem ser reiniciadas a partir de existências congeladas utilizando o procedimento descrito nos passos 3.1-3.2 para amostras populacionais. O número de transferência para o LTEE não deve ser incrementado até o crescimento das primeiras culturas em DM25 após o renascimento.
2. Arquivamento das populações LTEE
NOTA: As amostras das populações LTEE são congeladas a cada 75 transferências. As populações crescem ~6 2/3 gerações a cada dia após a diluição de transferência de 100 vezes, então esse período corresponde a ~500 gerações. Durante o arquivamento, as populações LTEE também são plaqueadas em diferentes tipos de meios de ágar para verificar se há contaminação. Opcionalmente, clones representativos podem ser retirados dessas placas e arquivados neste momento. Essas etapas estão resumidas na Figura 1.
- No dia anterior ao congelamento planejado ou alguns dias antes, prepare três tipos de placas de ágar: Glicose Mínima (MG), Arabinose Mínima (MA) e Tetrazolium Arabinose (TA). Faça doze pratos de cada tipo de ágar, além de alguns extras. Preparar também pelo menos 250 mL de solução salina estéril a 0,85% (p/v) e 50 mL de glicerol estéril a 80% (v/v).
NOTA: Receitas para todas as mídias e soluções estão disponíveis on-line30. O dia antes de o LTEE atingir uma geração que é um múltiplo de 500 para o cronograma de arquivamento regular é o74º dia desde o último congelamento, mais quaisquer dias que foram adicionados devido a transferências dos frascos de backup de 4 °C quando problemas foram detectados ou suspeitos. - OPCIONAL: Se o arquivamento de isolados clonais das populações LTEE, prepare suprimentos adicionais: isolar três clones de cada população requer 72 placas de MG, 80 mL de glicerol 80% (v/v) e 370 mL de DM1000.
- Preparar um conjunto extra de doze frascos ao executar a etapa 1.2 das transferências diárias de LTEE no dia anterior ao congelamento planejado. Rotular seis dos frascos adicionais xA−1 a xA−6 usando um marcador vermelho e os outros seis xA+1 a xA+6 usando um marcador preto.
NOTA: O "x" indica que o conjunto extra de frascos será utilizado para arquivamento e os diferencia do outro conjunto de frascos que será utilizado para continuar as transferências diárias do LTEE em paralelo. - Preencher cada um dos frascos adicionais que serão utilizados para arquivamento com 14,85 mL de DM25 usando uma pipeta sorológica de 25 mL ao realizar a etapa 1,4 das transferências diárias de LTEE.
- Conclua a transferência LTEE normal conforme descrito nas etapas 1.5 a 1.11. Em seguida, repita as instruções para o passo 1.8, mas desta vez transfira 150 μL de cada uma das culturas LTEE do dia anterior para os frascos adicionais de 14,85 mL de DM25 fresco que serão usados para arquivamento.
NOTA: Nesta e em todas as etapas subsequentes, evite contaminações e misturas seguindo estas orientações. Comece com a população A−1, depois transfira A+1 e, em seguida, continue alternando − e + populações. Limpe o barril e o ejetor do micropipetador com um lenço de papel sem fiapos umedecido com etanol 70% ao mudar de população. Deslocar frascos e tubos de ensaio em suas bandejas ou racks após pipetar de ou para eles para acompanhar quais transferências foram concluídas. - Incubar o conjunto de doze frascos para arquivamento a 37 °C durante 24 ± 1 h com agitação orbital de 120 rpm sobre um diâmetro de 1 polegada ao lado das doze culturas LTEE e do espaço em branco, conforme descrito no passo 1.9.
- Preparar suprimentos para plaqueamento das populações de LTEE pelo menos uma hora antes que as transferências de LTEE sejam realizadas no dia do congelamento.
- Selecione doze placas de ágar MG, doze MA e doze TA. Inspecione visualmente cada um para ter certeza de que não há nenhuma contaminação óbvia.
- Rotule um de cada tipo de placa para cada uma das doze populações LTEE (A−1 a A+6).
OBS: Ao rotular placas, escreva nas laterais do fundo da placa de Petri. Isso é importante para não obscurecer colônias quando se quer examiná-las ou fotografá-las de baixo do ágar. Não escreva nas tampas, pois estas podem ser misturadas. - Colocar as placas de ágar numa incubadora a 37 °C durante, pelo menos, 20 minutos para as aquecer antes de as utilizar no passo 2.10.
- Preparar 24 tubos de ensaio contendo 9,9 mL de solução salina. Disponha em doze conjuntos de dois tubos cada.
- Rotular cada um dos dois conjuntos de doze tubos de ensaio da mesma forma que as placas, adicionando um "1" ou um "2" abaixo do identificador da população LTEE para designar a ordem em que serão usados para fazer diluições dessa população.
- Execute as etapas 1.1-1.11 usando os frascos que continuarão as transferências diárias do LTEE como de costume. Durante a etapa 1.5, remova também os doze frascos contendo as culturas extras para arquivamento da incubadora de agitação.
- Pipetar 100 μL da cultura de cada um dos doze frascos adicionais para arquivamento no primeiro tubo de ensaio de solução salina do par para essa população LTEE. Vórtice os tubos com essas diluições de 100 vezes completamente. Em seguida, pipetar 100 μL de cada um para o segundo tubo de solução salina correspondente. Vórtice as diluições finais de cultura de 10.000 vezes completamente.
- Pipetar 80 μL de cada um dos tubos contendo uma diluição de cultura de 10.000 vezes para as placas marcadas de AT, MG e MA para essa população. Espalhe o líquido uniformemente pela superfície do ágar usando uma haste de espalhamento estéril ou contas estéreis, conforme preferir. Repita até que todas as doze populações tenham sido plaqueadas em todos os três tipos de mídia.
- Se necessário, deixe as placas secarem até que nenhum líquido seja visível no ágar. Coloque as placas de cabeça para baixo (com o lado do ágar para cima) em uma incubadora de convecção por gravidade regulada para 37 °C.
NOTA: Incubar placas de cabeça para baixo evita que o ágar seque e evita que a condensação escorra para a superfície do ágar. O movimento de células em líquido na superfície do ágar durante a incubação pode manchar colônias e produzir contagens incorretas de colônias. - Adicionar 3 mL de glicerol estéril a 80% (v/v) a cada um dos doze frascos extras destinados ao arquivamento. Misture bem, girando e vomitando suavemente.
- Distribuir a mistura de cada frasco por crióscos estéreis que tenham sido rotulados com um identificador único para a amostra, a população LTEE à qual a amostra pertence, a geração em que foi congelada, que é uma amostra mista (população) e a data. Pipetar 6 ml para um frasco para injetáveis grande e 1,25 ml para cada um dos seis frascos para injetáveis pequenos.
NOTA: O frasco grande é o material de trabalho. Um pequeno frasco é um backup caso o estoque de trabalho se esgote ou fique contaminado. Os outros cinco frascos pequenos são cópias que podem ser enviadas para outros laboratórios. - Congelar os frascos para injetáveis cheios a -80 °C.
- Examinar e documentar o crescimento e as morfologias das colônias nas placas TA, MG e MA após 24 h e 48 h de incubação.
NOTA: Consulte a seção Resultados Representativos para imagens e descrições de colônias formadas pelos ancestrais REL606 e REL607 e cada uma das doze populações LTEE quando foram plaqueadas em 76.000 gerações. - OPCIONAL: Execute as seguintes etapas ao arquivar isolados clonais.
- Escolher três isolados clonais (colônias) para cada população LTEE das placas MG, riscar cada uma separadamente em uma nova placa MG e incubar essas placas por 16-24 h a 37 °C.
NOTA: Se colônias com morfologias diferentes estiverem presentes, a prática padrão no LTEE é coletar amostras para a diversidade máxima, primeiro escolhendo o tipo mais comum e, em seguida, selecionando mais colônias de tipos minoritários. Pode-se também usar uma estratégia de amostragem aleatória marcando pontos na parte inferior do fundo da placa de Petri antes de espalhar as células e, em seguida, escolhendo a colônia isolada mais próxima de cada marca após o crescimento. - No dia seguinte, risque uma colônia representativa de cada placa em uma nova placa MG e incube essas placas por 16-24 h a 37 °C.
- No dia seguinte, inocular uma colônia isolada de cada placa de MG em um frasco contendo 10 mL de DM1000 fresco. Além disso, encher um frasco adicional com 10 mL de DM1000 para servir como um branco não inoculado para testar a contaminação do meio.
- Incubar os frascos a 37 °C durante 16-24 h com agitação orbital a 120 rpm num diâmetro de 1 polegada.
- Após a incubação, adicionar 2 mL de glicerol estéril a 80% (v/v) a cada frasco e agitar para misturar.
- Distribuir alíquotas de 1,25 mL de cada frasco em frascos pequenos e estéreis rotulados com um identificador único para cada clone, sua população LTEE e geração de origem, que se trata de uma amostra clonal e a data.
- Congelar os frascos para injetáveis cheios a -80 °C.
- Escolher três isolados clonais (colônias) para cada população LTEE das placas MG, riscar cada uma separadamente em uma nova placa MG e incubar essas placas por 16-24 h a 37 °C.
3. Ensaios de aptidão competitiva
NOTA: No LTEE, a aptidão reprodutiva é quantificada em termos do número relativo de duplicações que diferentes bactérias atingem ao longo de um ou mais ciclos de cultura de 24 h nas mesmas condições que as transferências diárias. Especificamente, a aptidão relativa de um concorrente para outro é a proporção de suas taxas de duplicação realizadas quando eles competem frente a frente em uma co-cultura. Cada competidor em um par pode ser uma população completa ou um isolado clonal que foi previamente arquivado como parte do "registro fóssil" congelado do LTEE. Alternativamente, um ou ambos os concorrentes podem ser um clone que foi geneticamente modificado para adicionar ou remover mutações específicas para testar seus efeitos. Os dois competidores devem ter estados Ara+/Ara− opostos porque esse marcador genético é usado para diferenciá-los durante este ensaio. O fluxo de trabalho geral para um ensaio de competição é mostrado na Figura 2. A duração da fase de co-cultivo pode ser estendida de um a três (ou mais) dias para melhorar a precisão das estimativas de aptidão ao testar diferenças entre competidores que são quase iguais. Consulte a Disussão para outras considerações críticas e possíveis modificações deste protocolo.
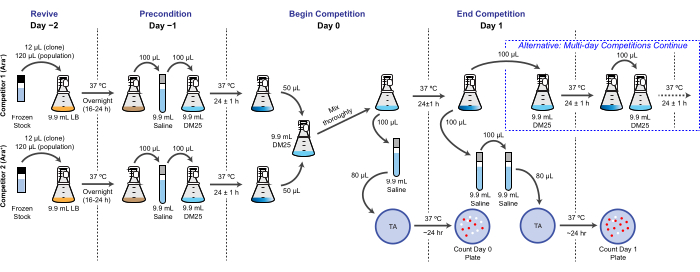
Figura 2: Fluxograma do ensaio de competição. O procedimento completo para um ensaio de competição de um dia é mostrado. O procedimento de três dias continua com o caminho alternativo no Dia 1 e Dia 2 até o dia 3 da mesma forma que está retratado para o Dia 1 da competição de um dia. Clique aqui para ver uma versão maior desta figura.
- Preparar suprimentos
- Decida quantas cepas e/ou populações LTEE concorrentes serão usadas e quantos ensaios de competição de replicação serão realizados para cada par de competidores. Prepare os suprimentos necessários conforme descrito nas etapas a seguir.
NOTA: Receitas para todas as mídias e soluções estão disponíveis on-line30. Os frascos e tubos de ensaio necessários para todos os dias de um experimento de competição podem ser preenchidos previamente ou conforme a necessidade nos dias em que serão usados. Se os frascos e tubos de ensaio estiverem cheios antes do tempo, guarde-os à temperatura ambiente no escuro para minimizar a evaporação. As placas TA precisam ser preparadas com pelo menos dois dias de antecedência de quando serão usadas para que possam secar o suficiente após serem derramadas para permitir a dispersão das diluições da cultura. Sempre prepare alguns frascos extras, tubos de ensaio e placas TA para que um experimento possa continuar se houver erros de pipetagem, placas contaminadas ou outros pequenos percalços. - Para o dia de renascimento (Dia −2), encher um frasco Erlenmeyer estéril de 50 mL tampado com um copo de 20 mL com 9,9 mL de DM1000 ou Caldo de Lisogenia (LB) por cepa ou população de E. coli que será usada como competidora. Encher mais um frasco com 9,9 mL do mesmo meio para servir como branco não inoculado.
- Para o dia de pré-condicionamento (Dia −1), preencher um tubo de ensaio com 9,9 mL de solução salina estéril a 0,85% (p/v) por competidor, dois frascos com 9,9 mL de DM25 por ensaio de repetição entre um par de competidores e mais um frasco com 9,9 mL de DM25 para um branco.
- Para o dia de início da competição (Dia 0), preencher um frasco com 9,9 mL de DM25, preencher um tubo de ensaio com 9,9 mL de solução salina estéril a 0,85% (p/v) e preparar uma placa TA por repetição do ensaio de competição. Preencher mais um frasco com 9,9 mL de DM25 para servir em branco.
- ALTERNATIVA: Para cada dia de competição de vários dias após o primeiro, encher um frasco com 9,9 mL de DM25 por repetição de competição e preencher mais um frasco com 9,9 mL de DM25 para um branco.
- Para o último dia da competição (por exemplo, Dia 1 ou Dia 3), encha dois tubos de ensaio com 9,9 mL de solução salina estéril a 0,85% (p/v) e prepare uma placa TA por repetição da competição.
- Decida quantas cepas e/ou populações LTEE concorrentes serão usadas e quantos ensaios de competição de replicação serão realizados para cada par de competidores. Prepare os suprimentos necessários conforme descrito nas etapas a seguir.
- Dia −2: Reviva os concorrentes separadamente no DM1000 ou LB
- Para cada um dos competidores, rotular um frasco preenchido com 9,9 mL de DM1000 ou LB. Rotular um frasco adicional preenchido com 9,9 mL do mesmo lote de meio para servir como um branco não inoculado para testar a contaminação.
NOTA: Os estoques congelados são revividos em LB ou DM1000 para uma recuperação mais uniforme e previsível das células criopreservadas. O glicerol usado como crioprotetor pode ser metabolizado por E. coli, o que levará a densidades celulares mais altas do que o esperado se as amostras forem revividas no DM25. LB e DM1000 suportam o crescimento a densidades celulares tão altas que esta complicação torna-se desprezível. - Retire os criósculos que contêm as existências congeladas das estirpes concorrentes do congelador a -80 °C. Mantenha os frascos refrigerados em um balde de gelo enquanto os usa.
- Depois que cada estoque congelado tiver descongelado, vomite-o completamente para ressuspender as células de E. coli. Se reviver um clone, inocular o balão contendo meio fresco com 12 μL do estoque congelado. Se reanimar uma população, inocular o balão com 120 μL do estoque congelado.
NOTA: O volume de 120 μL do estoque congelado é usado para populações de modo que o número de células que são revividas é aproximadamente o mesmo que o gargalo diário quando 1% da população LTEE é transferida para um novo frasco. O descongelamento e o vórtice de estoques congelados várias vezes podem estressar as células e reduzir a viabilidade dos estoques ao longo do tempo. Se uma determinada população LTEE ou clone vai ser usado em competições várias vezes, é uma boa prática regenerar e congelar várias cópias do estoque para que ninguém seja descongelado e recongelado muitas vezes. - Incubar os frascos de reavivamento e o branco a 37 °C durante a noite (16-24 h) com agitação orbital de 120 rpm sobre um diâmetro de 1 polegada.
- Para cada um dos competidores, rotular um frasco preenchido com 9,9 mL de DM1000 ou LB. Rotular um frasco adicional preenchido com 9,9 mL do mesmo lote de meio para servir como um branco não inoculado para testar a contaminação.
- Dia −1: Pré-condicionar competidores separadamente no DM25
- Para cada competidor, rotular um tubo de ensaio preenchido com 9,9 mL de solução salina. Para cada ensaio de competição de réplicas entre um par de competidores, rotular dois frascos de 50 mL preenchidos com 9,9 mL de DM25, cada um com o número da réplica e o nome de um dos competidores. Rotular um frasco adicional preenchido com 9,9 mL de DM25 para servir como um branco.
- Retire da incubadora os frascos contendo as culturas dos competidores revividos. Examine sua turbidez a olho nu para confirmar que eles cresceram e que não há contaminação óbvia.
- Pipetar 100 μL de cada frasco para o tubo de ensaio de soro fisiológico para esse competidor.
NOTA: Esta etapa dilui a cultura em 100 vezes, o que é necessário porque a densidade de células é muito maior no LB e DM1000 do que no ambiente DM25 usado no LTEE (consulte Resultados Representativos). - Vórtice completamente cada tubo de diluição imediatamente antes de pipetar 100 μL da cultura diluída para um balão com DM25 fresco. Inocular dois desses frascos de pré-condicionamento para cada ensaio de réplica, um para cada um dos competidores.
- Incubar os frascos de pré-condicionamento e o branco a 37 °C durante 24 ± 1 h com agitação orbital a 120 rpm sobre um diâmetro de 1 polegada.
- Dia 0: Comece a competição misturando competidores e placa para as contagens iniciais
- Para cada repetição do ensaio de competição, rotular um frasco preenchido com 9,9 mL de DM25 e um tubo de ensaio preenchido com 9,9 mL de solução salina. Rotule os frascos e tubos de forma a identificar de forma única cada par de competidores e o número replicado do ensaio de competição. Rotular um frasco adicional preenchido com 9,9 mL de DM25 para servir como um branco.
- Retire os frascos de pré-condicionamento da incubadora. Examine sua turbidez a olho nu para confirmar que eles cresceram e que não há contaminação óbvia.
- Transfira 50 μL do competidor Ara− para o primeiro frasco de competição de réplica preenchido com DM25 fresco. Imediatamente, transfira 50 μL do concorrente Ara+ para o mesmo frasco de competição e misture-o girando suavemente.
- Repita a etapa 3.4.3 para todas as réplicas de todos os pares de concorrentes.
NOTA: Os frascos de competição agora têm uma diluição global de 100 vezes das culturas de E. coli cultivadas em DM25, as mesmas células de condição na experiência LTEE após cada transferência diária. A ordem de realizar transferências e misturas é importante. Adicione ambos os concorrentes a cada frasco imediatamente, um após o outro, para que nenhum deles tenha uma vantagem de crescimento no meio fresco. Por exemplo, não adicione as culturas Ara− a todos os frascos de competição e depois volte e adicione todas as cepas Ara+ . - Pipetar 100 μL de cada frasco de competição recém-inoculado para o tubo de ensaio de solução salina marcada para esse ensaio de competição replica de modo que cada um desses tubos contenha uma diluição total de 10.000 vezes das culturas de DM25 pré-condicionadas que foram combinadas.
- Coloque os frascos de competição e em branco na incubadora de agitação. Incubar os frascos de competição a 37 °C durante 24 ± 1 h com agitação orbital a 120 rpm sobre um diâmetro de 1 polegada.
- No mesmo dia, imediatamente após a colocação dos frascos de competição na incubadora, agite cuidadosamente cada tubo de ensaio do passo 3.4.5 e espalhe 80 μL dessas diluições de 10.000 vezes em placas AT, conforme descrito no passo 2.10. Rotule o lado do fundo de cada placa com o par de cepas que foram misturadas, o número da réplica e "Dia 0" para indicar que será usado para determinar a representação inicial de cada competidor.
- Incubar as placas TA de cabeça para baixo em uma incubadora de convecção gravitacional a 37 °C até que as colônias dos competidores Ara− e Ara+ sejam visíveis e distinguíveis. Geralmente, isso ocorre dentro de 16-24 h, mas pode levar mais tempo para algumas cepas evoluídas. Conte os números das colônias Ara− (vermelha) e Ara+ (branca) em cada placa eregistre os resultados.
NOTA: As diferenças entre as cores das colônias Ara- e Ara+ nas placas TA tornam-se menos distintas ao longo do tempo, mesmo quando as placas são armazenadas a 4 °C, por isso precisam ser contadas o mais rápido possível depois de retiradas da incubadora. Imagens de placas TA mostrando as aparências típicas de colônias formadas por células Ara− e Ara+ estão incluídas nos Resultados Representativos. Essa seção também tem imagens de colônias comuns de "casos de borda" (por exemplo, sobreposição ou crescimento de diferentes tipos de colônias) e explica como contá-las. Se as taxas de crescimento e morfologias das colônias formadas em placas TA por qualquer um dos competidores não tiverem sido previamente caracterizadas, espalhe 80 μL de uma diluição de 10.000 vezes em soro fisiológico dos frascos de pré-condicionamento no Dia 0, quando os competidores ainda estão separados uns dos outros. Em seguida, examinar as colônias nessas placas de controle após incubação a 37 °C por 16-24 h ou mais.
- ALTERNATIVA: Dias 1 e 2: Continuar a competição de três dias
- Para cada repetição do ensaio de competição, rotular um frasco preenchido com 9,9 mL de DM25. Rotule os frascos de forma a identificar de forma única cada par de competidores, o número de réplica e o dia do ensaio de competição. Rotular um frasco adicional preenchido com 9,9 mL de DM25 para servir como um branco.
- Tire os frascos de competição do dia anterior da incubadora. Examine sua turbidez a olho para verificar o crescimento esperado e detectar contaminação.
- Transferir 100 μL de cada frasco de competição para o frasco correspondente de meio fresco para o dia seguinte da competição.
- Coloque os novos frascos de competição e em branco na incubadora de agitação. Incubá-los a 37 °C por 24 ± 1 h com agitação orbital de 120 rpm sobre um diâmetro de 1 polegada.
- Repita as etapas 3.5.1-3.5.4 no Dia 2 da competição antes de prosseguir.
- Dia 1 ou 3: Terminar a competição e placa para as contagens finais
- Para cada frasco de competição, preparar dois tubos de ensaio preenchidos com 9,9 mL de solução salina. Rotule-os de uma forma que identifique exclusivamente cada par de concorrentes, o número de réplica e se eles são para a primeira ou segunda diluição.
- Tire os frascos de competição da incubadora. Examine sua turbidez a olho nu para detectar que eles cresceram e não houve contaminação óbvia.
- Pipetar 100 μL de cada frasco de competição para o primeiro tubo de solução salina para essa repetição. Os tubos resultantes contêm diluições de 100 vezes das culturas de DM25.
- Vórtice cada tubo de diluição de 100 vezes para misturá-lo completamente e pipetar 100 μL para o segundo tubo de soro fisiológico para essa replicação. Os tubos resultantes contêm diluições de 10.000 vezes das culturas de DM25.
- Vórtice cada tubo de ensaio contendo uma diluição de 10.000 vezes e espalhe 80 μL do mesmo numa placa AT, conforme descrito no passo 2.10. Rotule o lado do fundo de cada placa com o par de cepas que foram misturadas, o número da réplica e "Dia 1" para uma competição de um dia ou "Dia 3" para uma competição de três dias para indicar que será usado para determinar a representação final de cada competidor.
- Incubar as placas TA a 37 °C e contar as colónias Ara− e Ara+ após o crescimento, conforme descrito no passo 3.4.8.
NOTA: Acompanhe o número de réplicas de cada ensaio da competição ao longo de todas as transferências e etapas de chapeamento. Confundir quais contagens finais e iniciais correspondem entre diferentes ensaios de replicação — mesmo quando os mesmos dois competidores foram misturados em cada um — resultará em estimativas de aptidão incorretas.
- Cálculo e adequação da parcela
- Se estiver usando o Excel para calcular e plotar a aptidão relativa, baixe a planilha XLS (Arquivo Suplementar 1). Se estiver usando R, instale o pacote fitnessR31 e baixe o modelo de valores separados por vírgulas (CSV) (Arquivo Suplementar 2) ou gere uma nova cópia desse arquivo seguindo as instruções em sua vinheta.
- Insira uma "diluição de transferência" de 100 para os ensaios de competição realizados na célula ou coluna designada no arquivo baixado. Insira o número total de ciclos de crescimento diários durante os quais os competidores foram co-cultivados como o "número de transferências" (por exemplo, 3 para uma competição de três dias).
- Introduza os nomes de cada par de concorrentes nas células ou colunas designadas com a estirpe de referência como "concorrente1" e a estirpe ou população de ensaio como "concorrente2".
- Para cada réplica de ensaio de competição, insira as respectivas contagens de colônias iniciais e finais nas colunas designadas do arquivo baixado.
- Se estiver usando a planilha do Excel, ela exibirá agora o valor médio de aptidão relativa e os limites de confiança de 95% nessa estimativa. Copie os resultados de diferentes combinações de concorrentes para outra planilha e crie um gráfico que resuma os resultados. Se estiver usando R para analisar os dados, siga as instruções na vinheta do pacote fitnessR para executar esses cálculos, gerar um arquivo CSV com os valores calculados e plotar os resultados.
Resultados
Aparência e turbidez das culturas LTEE
Devido à baixa concentração de glicose no DM25, a turbidez das populações de LTEE totalmente crescidas é pouco visível em onze dos doze frascos. Ao examinar as culturas de LTEE por olho em busca de crescimento normal e sinais de contaminação (passo 1.6), cada frasco contendo uma população de LTEE deve ser comparado lado a lado com o branco (Figura 3A). A exceção é a população A−3, que evoluiu para usar citrato como fonte adicional de carbono e energia e, portanto, atinge maior densidade celular32. A turbidez das culturas de DM25 das linhagens ancestrais REL606 e REL607 é semelhante à de uma população evoluída típica (Figura 3B). Cepas e populações de LTEE crescem para uma maior densidade no DM1000 devido à maior concentração de glicose, e uma densidade muito maior no LB (Figura 3B). A densidade de culturas de DM25 da população de LTEE A−3 é intermediária entre as densidades de culturas de REL606 em DM25 e DM1000 (Figura 3C).

Figura 3: Aparecimento das culturas LTEE. (A) Frascos contendo as doze populações de LTEE após 24 h de crescimento em DM25 no dia em que o experimento atingiu 76.253 1/3 gerações são retratados ao lado do branco. (B) Frascos contendo culturas dos ancestrais REL606 e REL607 cultivados por 24 h em DM25, DM1000 e LB são retratados ao lado de espaços em branco. (C) Ampliado em fotos dos mesmos frascos lado a lado mostrando como a turbidez do frasco da população A−3 no DM25 se compara ao ancestral REL606 no DM25 e DM1000. Clique aqui para ver uma versão maior desta figura.
As leituras em espectrofotômetro das densidades ópticas a 600 nm (OD600) das culturas cultivadas em DM25 (passo 1.7) correspondem a essas observações visuais tanto para as populações LTEE (Figura 4A) quanto para seus ancestrais (Figura 4B). Essas leituras podem ser usadas para comparar quantitativamente e documentar o crescimento quando há suspeita de contaminação ou erro. Para medições das populações LTEE entre 76.000 e 76.500 gerações, descobrimos que o OD600 de A−3, a população que evoluiu para crescer em citrato, foi de 0,223 em média (0,218-0,227, intervalo de confiança de 95%). O OD600 das outras onze populações foi de 0,0252 em média (0,0239-0,0265, intervalo de confiança de 95%). Houve uma pequena, mas significativa variação nas leituras de OD600 entre as onze populações normais (F 10,88 = 5,1035, p = 7,5×10−6). As populações de LTEE atingem a fase estacionária após cerca de 5-6 horas de incubação. Se forem transferidos pela manhã, o crescimento será visível no meio da tarde do mesmo dia. Muitas espécies de micróbios são capazes de crescer aerobicamente em citrato. Portanto, o aumento da turbidez em populações diferentes de A−3 é provavelmente um sinal de contaminação externa.
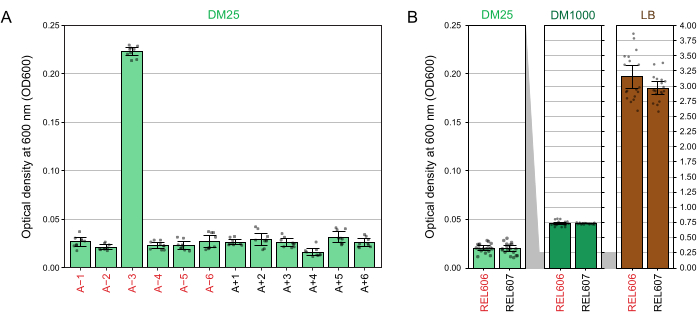
Figura 4: Turbidez das culturas LTEE . (A) Densidade óptica a 600 nm (OD600) das doze populações de LTEE após o ciclo de crescimento de 24 h em três dias diferentes entre 76.000 e 76.500 gerações do experimento. Os valores de OD600 de três alíquotas de 1 mL em cada um dos três dias diferentes são plotados como pontos. O valor médio de OD600 de três alíquotas diferentes do branco do mesmo dia foi subtraído desses valores. As barras preenchidas mostram médias. As barras de erro são limites de confiança de 95%. (B) OD600 de culturas dos ancestrais REL606 e REL607 em DM25, DM1000 e LB. Os valores de OD600 de três alíquotas de 1 mL em cada um dos três dias diferentes de duas culturas separadas para cada condição e cepa são plotados como pontos. O valor médio de OD600 de três alíquotas diferentes do branco do mesmo dia foi subtraído desses valores. As barras preenchidas mostram médias e as barras de erro são limites de confiança de 95%. As áreas sombreadas em cinza entre os painéis mostram como o eixo OD600 é redimensionado entre o painel DM25 e os painéis DM1000 e LB. Clique aqui para ver uma versão maior desta figura.
Crescimento e morfologia de colônias LTEE
Ao verificar a contaminação das populações por meio de plaqueamento em diferentes meios (etapa 2.15), os ancestrais REL606 e REL607 e todas as populações evoluídas formam colônias brancas com bordas translúcidas e um tanto irregulares em placas de ágar com glicose mínima (MG) (Figura 5A). A composição do ágar MG é a mesma do DM25 usado nas transferências diárias de LTEE, exceto com uma maior concentração de glicose, de modo que as populações evoluídas de LTEE frequentemente formam colônias maiores em MG do que os ancestrais. Devido à sua maior densidade celular no DM25, a população A−3 terá várias vezes mais colônias se o mesmo volume for plaqueado para ela como para as outras populações, e isso pode limitar o tamanho das colônias. Os tipos mais comuns de micróbios contaminantes formam colônias brancas, opacas e perfeitamente circulares em MG.
No ágar arabinose mínima (MA), o ancestral REL607 e as populações Ara+ tipicamente formam colônias brancas levemente translúcidas. Esse padrão típico de crescimento persistiu para as populações Ara+ ao longo de 76.000 gerações, exceto A+6, que desenvolveu um defeito no crescimento da arabinose e não mais forma colônias na MA (Figura 5B). Não há seleção para manter o crescimento em arabinose durante as transferências de LTEE no DM25, então outras populações Ara+ também podem eventualmente parar de formar colônias em placas de ágar MA à medida que o experimento continua. Com exceção de A−3, as populações Ara− não formam colônias em ágar MA, embora um exame minucioso possa revelar microcolônias devido a traços de nutrientes no ágar. A população A−3 forma numerosas pequenas colônias no MA, pois essas células podem crescer sobre o citrato que também está presente neste meio. Colônias contaminantes em MA são raras.
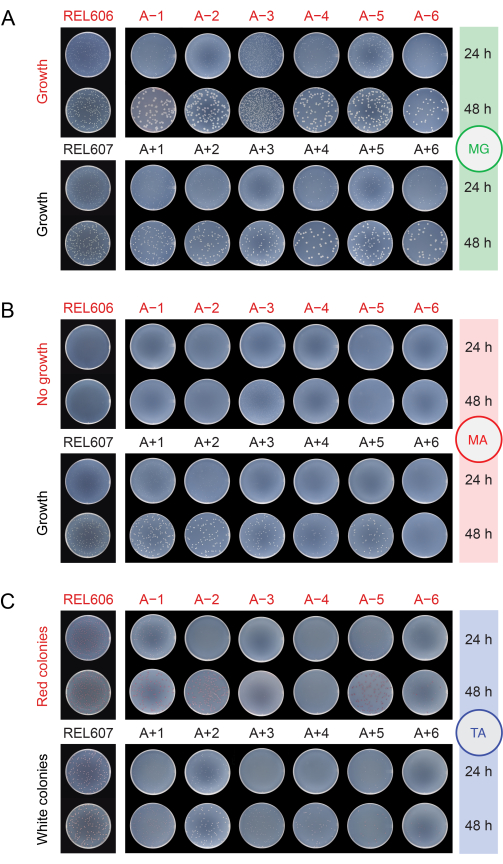
Figura 5: Plating populações de LTEE para detectar contaminação. As diluições dos ancestrais REL606 e REL607 e das doze populações LTEE no dia em que o experimento atingiu 76.026 2/3 gerações foram plaqueadas em placas de ágar (A) MG, (B) MA e (C) TA e fotografadas após 24 h e 48 h. As mesmas diluições foram feitas para todas as culturas, mas metade do volume foi plaqueado para os ancestrais como é descrito no protocolo para as populações LTEE, para explicar um pouco por suas densidades celulares mais altas. Clique aqui para ver uma versão maior desta figura.
No ágar tetrazólio arabinose (TA), espera-se que o ancestral REL606 e todas as populações Ara− formem colônias vermelhas, enquanto o ancestral REL607 e todas as populações Ara+ geralmente devem formar colônias brancas (que podem incluir tons rosa claro ou pêssego) (Figura 5C). Os ancestrais LTEE formam colônias robustas, que são facilmente identificáveis como Ara− e Ara+ em ágar TA dentro de 16-24 horas. Originalmente, essa diferença poderia ser usada para detectar contaminação cruzada entre populações Ara− e Ara+ . No entanto, o ágar TA tem uma composição nutricional mais complexa do que o meio DM25 quimicamente definido usado nas transferências diárias, e não houve uma pressão evolutiva para que E. coli no LTEE mantenha uma capacidade de crescimento robusto nessas condições. Consequentemente, algumas populações evoluídas de LTEE agora exibem baixo crescimento em placas de AT, levando 48 horas para formar colônias ou não crescendo de forma confiável. As cores e morfologias das colônias formadas na AT pelas populações LTEE evoluídas também mudaram em relação aos ancestrais e divergiram umas das outras. A presença de algumas colônias aberrantes nem sempre é um indicativo de contaminação. Mutações espontâneas podem ocorrer que mudam o estado marcador Ara de cepas LTEE, especialmente de Ara+ para Ara− devido à maior probabilidade de mutações de perda de função que afetam a utilização de arabinose versus mutações de reversão que restauram a atividade de araA. Mutações que alteram estados marcadores de Ara são mais comuns em populações que evoluíram com hipermutação (A−1, A−2, A−3, A−4, A+3 e A+6)13. Em ágar TA, micróbios contaminantes de outras espécies frequentemente (mas nem sempre) formam pequenas colônias perfeitamente circulares com centros vermelhos circundados por limites brancos distintos que são diferentes daqueles formados por quaisquer cepas ou populações LTEE.
Resultados da competição de co-cultura
Competições entre todos os pares Ara− e Ara+ dos dois ancestrais LTEE (REL606 e REL607, respectivamente) e as amostras populacionais A−5 e A+5 arquivadas em 20.000 gerações (REL8597 e REL8604, respectivamente) mostram como colônias com diferentes estados marcadores Ara podem ser diferenciadas e contadas com ágar TA (passos 3.4.8 e 3.6.6) (Figura 6). As colônias foram contadas para seis frascos repetidos para cada par de competidores antes e após ensaios de um e três dias, que se iniciaram com o renascimento no DM1000 (Tabela 1). Os números totais de colônias observadas para a mesma diluição e volume plaqueado variam com os competidores misturados, pois culturas de populações evoluídas de LTEE atingem densidades celulares mais baixas do que culturas de cepas ancestrais em DM25. Essa diferença é consequência da evolução do aumento do tamanho celular, que ocorreu em todas as populações de LTEE durante os primeiros milhares de gerações do experimento 8,33.
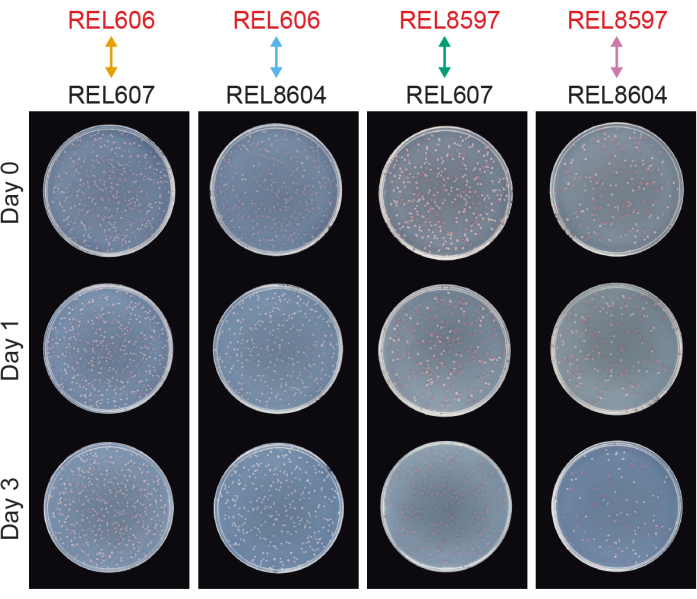
Figura 6: Ensaios de competição plaqueados em placas de ágar TA. Exemplos de placas de ágar TA de ensaios de competição. REL606 e REL607 são os ancestrais Ara− e Ara+ do LTEE, respectivamente. REL8597 e REL8604 são as 20.000 populações das gerações A−5 e A+5, respectivamente, do "registro fóssil" congelado do LTEE. As placas TA correspondentes a um ensaio de repetição entre cada par de cepas são mostradas para o Dia 0, Dia 1 e Dia 3 da competição. As placas foram fotografadas após 24 h de crescimento a 37°C. As células dos competidores REL606 e REL8597 são Ara− e formam colônias vermelhas. As células dos competidores REL607 e REL8604 são Ara+ e formam colônias brancas. Clique aqui para ver uma versão maior desta figura.
A maioria das colônias em uma placa TA de competição típica estará bem separada ou se sobreporá de maneiras para as quais é fácil contar quantas colônias inicialmente circulares de diferentes tipos cresceram juntas (Figura 7A). No entanto, podem surgir algumas situações em que não é óbvio como contar uma colônia atípica ou crescimento que é uma mistura das duas cores. Primeiro, quando uma colônia Ara+ branca e uma colônia Ara− vermelha se sobrepõem, a colônia Ara+ tende a crescer demais e envolver a colônia Ara−. Nessa situação, deve-se contar uma pequena mancha vermelha ou "lacuna" translúcida na colônia Ara+ maior como uma colônia Ara− (Figura 7B). Em segundo lugar, mutantes Ara+ espontâneos ocasionalmente surgirão em colônias Ara−. Esses mutantes tipicamente aparecem como setores brancos (papilas) se espalhando mais rapidamente para fora do interior de uma colônia vermelha porque crescem mais rapidamente quando ganham acesso à arabinose como um nutriente adicional (Figura 7C). Essas colônias de setor branco são contadas como uma colônia Ara− e nenhuma colônia Ara+. Essa situação torna-se mais comum se as placas forem incubadas por 48 h ou mais. Em terceiro lugar, observam-se colônias róseas às vezes translúcidas (Figura 7D). Estes são formados pelo concorrente Ara-. Finalmente, um pequeno número de colônias circulares com interiores que são um tom ligeiramente diferente de vermelho às vezes crescem em placas TA quando são contaminadas por algumas células microbianas externas durante a preparação do ágar ou quando espalham diluições de cultura em suas superfícies (Figura 7E). Essas colônias contaminantes não devem ser contadas. Se houver suspeita de contaminação de uma cultura de competição porque há muitas colônias atípicas em qualquer uma de suas placas AT, essa replicação deve ser excluída.
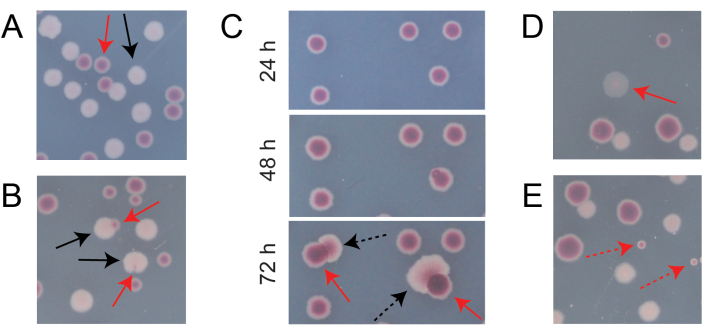
Figura 7: Casos de borda encontrados na contagem das colônias Ara− e Ara+ em ágar TA. Em cada painel, algumas colônias Ara− e Ara+ que devem ser contadas são marcadas com setas vermelhas e pretas sólidas, respectivamente. As colônias que não devem ser contadas são indicadas com setas tracejadas correspondentes ao tipo que parecem ser. Todas as fotos foram tiradas após 24 h de incubação, exceto no painel C. (A) Exemplos de colônias Ara− e Ara+ normais. (B) Exemplos de colônias Ara+ que crescem nas proximidades das colônias Ara− , incluindo uma que é apenas pouco visível como uma lacuna transparente no exterior da colônia branca. Conte cada um desses casos como duas colônias, uma de cada tipo. (C) Exemplos de colônias Ara− dando origem a setores mutantes Ara+ . Conte cada caso como apenas uma única colônia Ara− . O setor branco (papila) que surge é devido a um mutante Ara+ que surge dentro da colônia. O mesmo campo de colônias é mostrado após 24 h, 48 h e 72 h de crescimento. (D) Exemplo de colônia rosa translúcida. Conte como Ara−. (E) Exemplos de colônias formadas por contaminação externa por um micróbio que não é E. coli. Estes são vermelhos, mas menores e perfeitamente circulares com um limite branco distinto. Clique aqui para ver uma versão maior desta figura.
Analisando as contagens de colônias dessas competições usando a planilha Excel (Arquivo Suplementar 1) ou executando as funções do pacote fitnessR em R em contagens de colônias inseridas no modelo CSV (Arquivo Suplementar 2) mostra que os dois ancestrais são indistinguíveis em termos de sua aptidão dentro da precisão do ensaio, que as populações de 20.000 gerações A−5 e A+5 são significativamente mais aptas do que os ancestrais, e que nenhuma das populações evoluídas é significativamente mais apta que a outra (teste t de Welch, p > 0,05) (Figura 8). A precisão da estimativa de aptidão relativa melhora nas competições de três dias versus as competições de um dia para um dos pares mais próximos (REL606 vs. REL607). A precisão dessas medidas poderia ser aumentada ainda mais com a realização de competições mais longas com mais ciclos de crescimento, se assim desejado. No entanto, os resultados de competições de vários dias não são informativos, uma vez que um competidor se torna tão abundante em relação ao outro após os dias adicionais de competição que a proporção das duas cepas não pode ser determinada com precisão porque há muito poucas ou nenhuma colônia do tipo menos apto para contar. Este é o caso das competições de três dias dos ancestrais contra as populações evoluídas de 20.000 gerações (REL606 vs. REL8604 e REL607 vs. REL8597) (Figura 6 e Tabela 1).
Tabela 1: Contagem de colônias a partir de ensaios de aptidão competitiva. Ensaios de competição de um e três dias com seis repetições foram realizados para todas as combinações pareadas de dois competidores Ara− e Ara+ . REL606 e REL607 são os ancestrais Ara− e Ara+ do LTEE, respectivamente. REL8597 e REL8604 são as populações de 20.000 gerações A−5 e A+5, respectivamente, do "registro fóssil" congelado do LTEE. Clique aqui para baixar esta tabela.
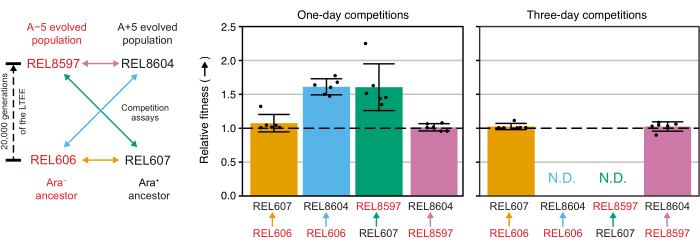
Figura 8: Aptidão relativa medida por meio de ensaios de competição. Resultados de ensaios de competição de um e três dias entre ancestrais LTEE e as 20.000 populações LTEE das gerações A−5 e A+5. O diagrama à esquerda mostra as quatro competições pareadas como setas de duas pontas codificadas por cores. Cada combinação dos dois concorrentes Ara− (rótulos vermelhos) e Ara+ (rótulos pretos) foi testada com seis vezes de replicação. As contagens de colônias da Tabela 1 foram analisadas em R utilizando o pacote fitnessR31, e os resultados foram plotados utilizando o pacote ggplot2 (versão 3.4.0)34. A aptidão é exibida como o concorrente para o qual a seta no rótulo está indo em relação ao concorrente de onde a seta está vindo (por exemplo, REL8604 em relação a REL606). São mostrados os valores de aptidão relativa estimados a partir das contagens de colônias para cada réplica de ensaio de competição (pontos), os valores médios de aptidão relativa para o par de competidores (barras preenchidas com a mesma codificação de cores do diagrama) e os intervalos de confiança de 95% (barras de erro). Os valores relativos de aptidão não puderam ser determinados (N.D.) para as competições de três dias entre os ancestrais e as populações evoluídas porque havia zero ou muito poucas colônias dos ancestrais nas placas do Dia 3 (ver Tabela 1). Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1. Arquivo de planilha do Excel para calcular a aptidão relativa. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2. Modelo de arquivo de entrada de valores separados por vírgulas para calcular a aptidão relativa em R usando o pacote fitnessR. Clique aqui para baixar este arquivo.
Discussão
Resiliência a longo prazo do LTEE e seus métodos
O Experimento de Evolução de Longo Prazo (LTEE) de E. coli está agora em sua quarta década. Para um experimento de evolução microbiana de qualquer duração, é fundamental manter um ambiente reprodutível, evitar contaminação, arquivar amostras e medir com precisão a aptidão. O LTEE demonstra várias estratégias testadas pelo tempo para alcançar esses objetivos, incluindo o uso de frascos bem agitados que criam um ambiente homogêneo e um meio de crescimento quimicamente definido que suporta uma baixa densidade celular. Além disso, o LTEE emprega cepas ancestrais que diferem em um marcador genético que dá um fenótipo (cor da colônia) que é facilmente rastreado e seletivamente neutro no ambiente de evolução. Este recurso de planejamento experimental fornece um meio de identificar contaminação interna e externa e facilita a medição da aptidão. No entanto, nem todos os procedimentos e salvaguardas utilizados pelo LTEE desde 1988 se mostraram igualmente robustos. Alguns métodos que eram confiáveis quando a LTEE começou tornaram-se menos eficazes à medida que as populações de E. coli evoluíram. Felizmente, esses métodos problemáticos agora podem ser aumentados ou substituídos usando tecnologias desenvolvidas desde o início do experimento.
Detecção de contaminação
A detecção de contaminação é fundamental para o LTEE. A contaminação pode ser de dois tipos: entre populações LTEE (contaminação cruzada) e com micróbios do ambiente (contaminação externa). Na maioria das vezes, o uso cuidadoso de técnicas assépticas e atenção especial durante a preparação do meio e as transferências diárias evitam ambos os tipos de contaminação, mas eles acontecem. No início do experimento, o plaqueamento em ágar TA poderia ser usado para detectar casos de contaminação cruzada, porque as transferências sempre alternaram entre as populações Ara− e Ara+. A impressão digital da sensibilidade e resistência dessas E. coli a certos bacteriófagos também pretendia ser uma característica de projeto que pudesse diferenciar as populações de LTEE de cepas de laboratório de E. coli comumente usadas que pudessem contaminá-las4. No entanto, esses marcadores genéticos tornaram-se pouco confiáveis à medida que o experimento progrediu (por exemplo, algumas populações não formam mais colônias em ágar TA)10,35. Felizmente, as populações divergiram geneticamente, pois experimentaram histórias evolutivas separadas durante o experimento, o que criou novos marcadores genéticos que agora podem ser usados para detectar contaminação cruzada. Por exemplo, cada população desenvolveu uma combinação única de mutações nos genes pykF e nadR 14,36,37. Às vezes, amplificamos a PCR e sequenciamos esses dois genes para testar se colônias com morfologias ou cores incomuns são devidas à contaminação cruzada. À medida que os custos do sequenciamento do genoma completo e da população inteira continuam a diminuir, o sequenciamento rotineiro das populações LTEE pode ser possível em breve, apresentando assim novas oportunidades para monitorá-las em busca de sinais de contaminação.
Medindo a aptidão competitiva
Outro caso em que o LTEE ultrapassou seus métodos originais é que a aptidão da E. coli evoluída aumentou no ambiente experimental a tal ponto que não se pode mais medir diretamente a aptidão das populações de hoje em relação a seus ancestrais usando o protocolo descrito aqui. As populações evoluídas superam os ancestrais a tal ponto que poucas ou nenhumas colônias ancestrais permanecem para contar após uma competição de um dia. Uma abordagem para lidar com essa grande diferença de aptidão é usar razões iniciais desiguais das cepas, ponderando os volumes iniciais que são misturados em direção ao competidor menos apto (por exemplo, ancestral de 90 μL e competidor evoluído de 10 μL). Uma segunda abordagem é identificar um clone Ara− evoluído que tenha uma aptidão maior do que o ancestral LTEE, isolar um mutante Ara+ espontâneo por seleção em ágar MA e, em seguida, verificar se a cepa reversor tem a mesma aptidão que seu pai usando um ensaio de competição 6,38. Este novo par Ara−/Ara+ pode então ser usado como um conjunto de cepas concorrentes comuns em vez de REL606/REL607. Idealmente, o clone Ara− evoluído escolhido como um competidor comum (e seu reversor Ara+) terá aptidão intermediária em relação a todas as cepas de interesse em um experimento. Ao longo das primeiras 50.000 gerações do LTEE, essas duas abordagens (usando razões de partida desiguais ou um concorrente comum) não produziram medidas de aptidão significativamente diferentes em relação à abordagem típica39.
Estas alterações ao protocolo de concorrência estabelecem certos pressupostos simplificadores que nem sempre podem ser verdadeiros. Uma delas é que as medidas de aptidão são transitivas. Ou seja, se competirmos duas populações cada uma contra uma cepa competidora comum separadamente, então podemos inferir a aptidão relativa das duas populações uma para a outra. Essa relação foi encontrada para o LTEE40, em sua maioria, mas não para outros experimentos41. Uma razão para essa discrepância pode ser a evolução de efeitos negativos da aptidão dependente da frequência. Essa situação ocorre quando cepas isoladas de duas linhagens diferentes divergentes da população A−2 do LTEE competem entre si19,42. Cada um tem uma vantagem quando raro, devido à alimentação cruzada, que estabiliza sua convivência. Dados de sequenciamento mostrando a coexistência a longo prazo de linhagens com diferentes conjuntos de mutações sugerem que interações semelhantes também podem ter surgido em outras populações de LTEE14,43, embora não esteja claro se elas são fortes o suficiente para alterar visivelmente as estimativas de aptidão. Finalmente, a evolução do crescimento aeróbio sobre citrato na população A−3 do LTEE32 significa que a aptidão dessas células agora incorpora o uso de um recurso "privado" quando elas são competidas contra células que não podem usar citrato, o que dificulta a interpretação desses resultados. Apesar dessas exceções, o uso de uma baixa concentração de glicose e ambiente bem agitado sem dúvida simplificou as comparações de aptidão entre cepas de LTEE e populações.
Nas gerações posteriores, algumas populações de LTEE não formam mais colônias em ágar TA, o que dificulta ou impossibilita a realização de experimentos de competição usando protocolos modificados10. Métodos alternativos que não requerem crescimento de colônias podem potencialmente ser usados para determinar a representação relativa de dois competidores, como o FREQ-seq que usa sequenciamento de próxima geração para contar a proporção de leituras contendo dois alelos alternativos em um amplicon44. Este método ou similar poderia potencialmente ser usado com os alelos Ara ou com mutações recém-evoluídas, como as de pykF e nadR, versus a sequência ancestral. A realização de modificações genéticas que introduzem outros tipos de marcadores neutros também pode ser usada para medir a aptidão relativa. Por exemplo, genes de proteínas fluorescentes foram inseridos nos cromossomos das células em experimentos de ramificação LTEE para que os competidores possam ser contados usando citometria de fluxo45. Outra abordagem, que abre a possibilidade de misturar mais de duas cepas no mesmo frasco de competição, é inserir códigos de barras que podem ser amplificados por PCR e sequenciados nos genomas de diferentes concorrentes. Essa abordagem tem sido utilizada para o rastreamento de linhagens em experimentos evolutivos46. Tanto a citometria de fluxo quanto o sequenciamento de código de barras podem medir com precisão proporções muito mais extremas de duas cepas versus contagem de colônias (porque eles podem consultar > 10.000 células/genomas versus os < 500 que podem ser contados em uma placa de ágar), então o uso desses métodos também promete aumentar o alcance dinâmico em termos de diferenças de aptidão que podem ser medidas em relação a um concorrente comum.
Desenhos alternativos para experimentos de evolução microbiana de longo prazo
Apesar de todas as suas virtudes, o LTEE não é perfeito. Certos aspectos de seu projeto o tornam trabalhoso e suscetível a erros humanos. Por exemplo, todos os dias um pesquisador deve entrar no laboratório e pipetar entre os frascos de Erlenmeyer para continuar o experimento. Os experimentos de competição também podem representar obstáculos logísticos assustadores, uma vez que os requisitos para vidraria estéril, mídia, espaço de incubadora e contagem de colônias aumentam rapidamente quando até mesmo um pequeno número de concorrentes está sendo testado com replicação modesta. Muitas vezes nos perguntam por que não aproveitamos os sistemas de automação laboratorial, como robôs pipetadores que operam em microplacas de 96 poços, ou sistemas de cultura contínua, como quimiostáticos ou turbidostatos. A resposta é simples: o LTEE é, de certa forma, prisioneiro de sua própria longa história. Não ousamos desviar-nos de culturas de 10 mL agitando a uma velocidade específica em frascos de Erlenmeyer de 50 mL, pois isso correria o risco de alterar fundamentalmente o experimento. Aspectos sutis do ambiente ao qual essas populações vêm se adaptando há décadas (por exemplo, a quantidade de aeração), seriam alterados em microplacas ou sistemas de cultura contínua. O gargalo populacional a cada transferência também pode ser diferente (menor em microplacas, por exemplo), alterando a dinâmica evolutiva. Em suma, desviar-se dos métodos aqui descritos tornaria o LTEE um experimento diferente, ou pelo menos arriscaria introduzir uma descontinuidade que interromperia as trajetórias evolutivas.
Os pesquisadores que projetam novos experimentos de evolução devem considerar essas outras maneiras de propagar populações microbianas, ao mesmo tempo em que estão cientes de seus potenciais benefícios e desvantagens. O uso de robôs pipetadores para transferir populações em placas de micropoços é logisticamente mais simples em alguns aspectos e pode se mostrar bastante poderoso devido ao alto número de populações replicadas que podem ser propagadas dessa forma47,48,49. No entanto, as transferências automatizadas na maioria das configurações atuais não ocorrem em condições completamente estéreis, o que aumenta a probabilidade de contaminação externa. Para evitar a contaminação, o meio de crescimento é frequentemente suplementado com antibióticos, que se tornam uma característica do ambiente que afeta a evolução. Transferências em placas de micropoços também são mais propensas a eventos de contaminação cruzada. Finalmente, o ambiente das placas de micropoços – particularmente se elas não forem agitadas – tende a selecionar para o crescimento da parede, agregação e outros fenômenos que podem complicar a evolução criando vários nichos em um poço. O uso de meios ricos ou altas concentrações de nutrientes para manter o tamanho da população grande em pequenos poços provavelmente exacerbará essas complexidades. Se essas interações surgirem, elas podem tornar a medição e a interpretação da aptidão muito mais difíceis.
Os sistemas de cultura contínua para a evolução microbiana incluem quimiostáticos, nos quais o meio fresco é constantemente bombeado e a cultura é bombeada para fora, e turbidostatos, nos quais as culturas são periodicamente diluídas através de sensoriamento automatizado e bombeamento para manter as células em um estado de crescimento constante. Esses sistemas são muito úteis quando se quer modelar a fisiologia e a evolução microbiana, pois evitam que os micróbios façam a transição entre o crescimento e a fome, mantendo-os em um ambiente que sempre tenha nutrientes50. Pode-se até adicionar sensores que fazem medições em tempo real da densidade óptica, consumo de O2, pH e outros aspectos do ambiente e crescimento de uma cultura. No entanto, os sistemas atuais de cultura contínua requerem compras dispendiosas de equipamentos ou conhecimentos especializados para construir configurações personalizadas51,52,53,54. Além disso, o crescimento da parede, no qual as células escapam da diluição aderindo à câmara de cultura, prejudica a dinâmica evolutiva em sistemas de cultura contínua, a menos que sejam periodicamente esterilizadas. Devido a essas restrições, a maioria dos experimentos de evolução de chemostat e turbidostat até o momento foram de duração limitada e/ou envolveram relativamente poucas populações em evolução independente em comparação com experimentos de evolução de transferência seriada.
Conclusão
Os métodos que demonstramos aqui para o LTEE são críticos para estudar seu registro histórico único e continuar a evolução aberta dessas populações de E. coli. Eles também fornecem um ponto de partida para outros que estão considerando novos experimentos de evolução que podem tirar proveito da automação laboratorial ou adicionar de volta vários elementos da complexidade encontrada em ambientes naturais que foram propositalmente omitidos do LTEE. Desde 1988, a evolução experimental floresceu como um campo. Durante esse tempo, pesquisadores em laboratórios de todo o mundo demonstraram a imensa flexibilidade dessa abordagem para estudar a evolução, inovando introduzindo designs experimentais criativos e monitorando os resultados usando novas tecnologias. Os métodos do LTEE não representam um ponto final, mas esperamos que continuem a inspirar e fornecer uma base para o campo no futuro.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos a Richard Lenski e aos muitos pesquisadores que estudaram e contribuíram para manter o Experimento de Evolução de Longo Prazo com E. coli, incluindo especialmente Neerja Hajela. O LTEE é atualmente apoiado pela National Science Foundation (DEB-1951307).
Materiais
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride (TTC) | Sigma-Aldrich | T8877 | |
| 20 mL Glass Beaker | Sigma-Aldrich | CLS100020 | |
| 50 mL Erlenmeyer Flasks | Sigma-Aldrich | CLS498050 | |
| Agar | Sigma-Aldrich | A1296 | |
| Ammonium Sulfate | Sigma-Aldrich | AX1385 | |
| Antifoam | Sigma-Aldrich | A5757 | |
| Arabinose | Sigma-Aldrich | A3256 | |
| Freezer Box (2") | VWR | 82007-142 | |
| Freezer Box (3") | VWR | 82007-144 | |
| Freezer Box Cell Divider (49-place) | VWR | 82007-150 | |
| Freezer Box Cell Divider (81-place) | VWR | 82007-154 | |
| Freezer Vials (1/2-Dram) | VWR | 66009-816 | |
| Freezer Vials (2-Dram) | VWR | 66010-560 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Glycerol | Fisher Scientific | G33 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Metal Tray | Winco | SPJP-202 | |
| Petri Dish | Fisher Scientific | FB0875712 | |
| Potassium Phosphate Dibasic Trihydrate | Sigma-Aldrich | P5504 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5379 | |
| Sodium Chloride | Sigma-Aldrich | M7506 | |
| Sodium Citrate Tribasic Dihydrate | Sigma-Aldrich | C7254 | |
| Test Tube Cap (18mm) | VWR | 10200-142 | |
| Test Tube Rack (18mm, steel) | Adamas-Beta | N/A | Test Tube Racks Stainless Steel Grid Arrangement 72 Holes (17-19 mm) |
| Test Tubes (18 x 150 mm) | VWR | 47729-583 | |
| Thiamine, Hydrochloride | Millipore | 5871 | |
| Tryptone | Gibco | 211705 | |
| Yeast Extract | Gibco | 212750 |
Referências
- Lenski, R. E., Rose, M. R., Simpson, S. C., Tadler, S. C. Long-term experimental evolution in Escherichia coli. I. Adaptation and divergence during 2,000 generations. The American Naturalist. 138 (6), 1315-1341 (1991).
- Fox, J. W., Lenski, R. E. From here to eternity-the theory and practice of a really long experiment. PLoS Biology. 13 (6), e1002185(2015).
- Daegelen, P., Studier, F. W., Lenski, R. E., Cure, S., Kim, J. F. Tracing ancestors and relatives of Escherichia coli B, and the derivation of B strains REL606 and BL21(DE3). Journal of Molecular Biology. 394 (4), 634-643 (2009).
- Studier, F. W., Daegelen, P., Lenski, R. E., Maslov, S., Kim, J. F. Understanding the differences between genome sequences of Escherichia coli B strains REL606 and BL21(DE3) and comparison of the E. coli B and K-12 genomes. Journal of Molecular Biology. 394 (4), 653-680 (2009).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nature Reviews Genetics. 14 (12), 827-839 (2013).
- Lenski, R. E. Experimental studies of pleiotropy and epistasis in Escherichia coli. II. Compensation for maladaptive pleiotropic effects associated with resistance to virus T4. Evolution. 42 (3), 425-432 (1988).
- Calcott, P. H., Gargett, A. M. Mutagenicity of freezing and thawing. FEMS Microbiology Letters. 10 (2), 151-155 (1981).
- Lenski, R. E., Travisano, M. Dynamics of adaptation and diversification: a 10,000-generation experiment with bacterial populations. Proceedings of the National Academy of Sciences of the United States of America. 91 (15), 6808-6814 (1994).
- Wiser, M. J., Ribeck, N., Lenski, R. E. Long-term dynamics of adaptation in asexual populations. Science. 342 (6164), New York, N.Y. 1364-1367 (2013).
- Lenski, R. E., et al. Sustained fitness gains and variability in fitness trajectories in the long-term evolution experiment with Escherichia coli. Proceedings of the Royal Society B: Biological Sciences. 282 (1821), 20152292(2015).
- Barrick, J. E., et al. Genome evolution and adaptation in a long-term experiment with Escherichia coli. Nature. 461 (7268), 1243-1247 (2009).
- Blount, Z. D., Barrick, J. E., Davidson, C. J., Lenski, R. E. Genomic analysis of a key innovation in an experimental Escherichia coli population. Nature. 489 (7417), 513-518 (2012).
- Tenaillon, O., et al. Tempo and mode of genome evolution in a 50,000-generation experiment. Nature. 536 (7615), 165-170 (2016).
- Good, B. H., McDonald, M. J., Barrick, J. E., Lenski, R. E., Desai, M. M. The dynamics of molecular evolution over 60,000 generations. Nature. 551 (7678), 45-50 (2017).
- Consuegra, J., et al. Insertion-sequence-mediated mutations both promote and constrain evolvability during a long-term experiment with bacteria. Nature Communications. 12 (1), 980-980 (2021).
- Cooper, T. F., Rozen, D. E., Lenski, R. E. Parallel changes in gene expression after 20,000 generations of evolution in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 100 (3), 1072-1077 (2003).
- Favate, J. S., Liang, S., Cope, A. L., Yadavalli, S. S., Shah, P. The landscape of transcriptional and translational changes over 22 years of bacterial adaptation. eLife. 11, e81979(2022).
- Khan, A. I., Dinh, D. M., Schneider, D., Lenski, R. E., Cooper, T. F. Negative epistasis between beneficial mutations in an evolving bacterial population. Science. 332 (6034), 1193-1196 (2011).
- Plucain, J., et al. Epistasis and allele specificity in the emergence of a stable polymorphism in Escherichia coli. Science. 343 (6177), 1366-1369 (2014).
- Quandt, E. M., Deatherage, D. E., Ellington, A. D., Georgiou, G., Barrick, J. E. Recursive genomewide recombination and sequencing reveals a key refinement step in the evolution of a metabolic innovation in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2217-2222 (2014).
- Leon, D., D'Alton, S., Quandt, E. M., Barrick, J. E. Innovation in an E. coli evolution experiment is contingent on maintaining adaptive potential until competition subsides. PLoS Genetics. 14 (4), e1007348(2018).
- Bennett, A. F., Lenski, R. E., Mittler, J. E. Evolutionary adaptation to temperature. I. Fitness responses of Escherichia coli to changes in its thermal environment. Evolution. 46 (1), 16-30 (1992).
- Kibota, T. T., Lynch, M. Estimate of the genomic mutation rate deleterious to overall fitness in E. coli. Nature. 381 (6584), 694-696 (1996).
- Friesen, M. L., Saxer, G., Travisano, M., Doebeli, M. Experimental evidence for sympatric ecological diversification due to frequency-dependent competition in Escherichia coli. Evolution. 58 (2), 245-260 (2004).
- Cooper, T. F. Recombination speeds adaptation by reducing competition between beneficial mutations in populations of Escherichia coli. PLoS Biology. 5 (9), e225(2007).
- Cooper, T. F., Lenski, R. E. Experimental evolution with E. coli in diverse resource environments. I. Fluctuating environments promote divergence of replicate populations. BMC Evolutionary Biology. 10, 11(2010).
- Quan, S., et al. Adaptive evolution of the lactose utilization network in experimentally evolved populations of Escherichia coli. PLoS Genetics. 8 (1), e1002444(2012).
- Deatherage, D. E., Kepner, J. L., Bennett, A. F., Lenski, R. E., Barrick, J. E. Specificity of genome evolution in experimental populations of Escherichia coli evolved at different temperatures. Proceedings of the National Academy of Sciences of the United States of America. 114 (10), E1904-E1912 (2017).
- Izutsu, M., Lake, D. M., Matson, Z. W. D., Dodson, J. P., Lenski, R. E. Effects of periodic bottlenecks on the dynamics of adaptive evolution in microbial populations. BioRixv. , 4457(2021).
- Chavarria-Palma, J. E., Blount, Z. D., Barrick, J. E. LTEE Media Recipes. , (2022).
- Barrick, J. E., Lake, D. M. fitnessR: fitnessR-v1.0.0. barricklab. , (2023).
- Blount, Z. D., Borland, C. Z., Lenski, R. E. Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 105 (23), 7899-7906 (2008).
- Grant, N. A., Magid, A. A., Franklin, J., Dufour, Y., Lenski, R. E. Changes in cell size and shape during 50,000 generations of experimental evolution with Escherichia coli. Journal of Bacteriology. 203 (10), 22(2021).
- Wickham, H. ggplot2: Elegant Graphics for Data Analysis. , Springer-Verlag. New York. (2016).
- Meyer, J. R., et al. Parallel changes in host resistance to viral infection during 45,000 generations of relaxed selection. Evolution. 64 (10), 3024-3034 (2010).
- Woods, R., Schneider, D., Winkworth, C. L., Riley, M. A., Lenski, R. E. Tests of parallel molecular evolution in a long-term experiment with Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 103 (24), 9107-9712 (2006).
- Barrick, J. E., Deatherage, D. E., D'Alton, S. LTEE-Ecoli: genomics resources for the Long-Term Evolution Experiment with Escherichia coli. , Available from: https://github.com/barricklab/LTEE-Ecoli (2022).
- Izutsu, M., Lenski, R. E. Experimental test of the contributions of initial variation and new mutations to adaptive evolution in a novel environment. Frontiers in Ecology and Evolution. 10, 958406(2022).
- Wiser, M. J., Lenski, R. E. A comparison of methods to measure fitness in Escherichia coli. PLoS One. 10 (5), 0126210(2015).
- de Visser, J. A. G. M., Lenski, R. E. Long-term experimental evolution in Escherichia coli. XI. Rejection of non-transitive interactions as cause of declining rate of adaptation. BMC Evolutionary Biology. 2 (1), 19(2002).
- Paquin, C. E., Adams, J. Relative fitness can decrease in evolving asexual populations of S. cerevisiae. Nature. 306 (5941), 368-371 (1983).
- Rozen, D. E., Lenski, R. E. Long-Term Experimental Evolution in Escherichia coli. VIII. Dynamics of a balanced polymorphism. The American Naturalist. 155 (1), 24-35 (2000).
- Quandt, E. M., Gollihar, J., Blount, Z. D., Ellington, A. D., Georgiou, G., Barrick, J. E. Fine-tuning citrate synthase flux potentiates and refines metabolic innovation in the Lenski evolution experiment. eLife. 4, e09696(2015).
- Chubiz, L. M., Lee, M. -C., Delaney, N. F., Marx, C. J. FREQ-Seq: a rapid, cost-effective, sequencing-based method to determine allele frequencies directly from mixed populations. PLoS One. 7 (10), e47959(2012).
- Gallet, R., Cooper, T. F., Elena, S. F., Lenormand, T. Measuring selection coefficients below 10-3: method, questions, and prospects. Genetics. 190 (1), 175-186 (2012).
- Levy, S. F., et al. Quantitative evolutionary dynamics using high-resolution lineage tracking. Nature. 519 (7542), 181-186 (2015).
- Lang, G. I., Botstein, D., Desai, M. M. Genetic variation and the fate of beneficial mutations in asexual populations. Genetics. 188 (3), 647-661 (2011).
- Frenkel, E. M., et al. Crowded growth leads to the spontaneous evolution of semistable coexistence in laboratory yeast populations. Proceedings of the National Academy of Sciences. 112 (36), 11306-11311 (2015).
- Jordt, H., et al. Coevolution of host-plasmid pairs facilitates the emergence of novel multidrug resistance. Nature Ecology and Evolution. 4 (6), 863-869 (2020).
- Gresham, D., Dunham, M. J. The enduring utility of continuous culturing in experimental evolution. Genomics. 104 (6), 399-405 (2014).
- Miller, A. W., Befort, C., Kerr, E. O., Dunham, M. J. Design and use of multiplexed chemostat arrays). Journal of Visualized Experiments. (72), e50262(2013).
- Toprak, E., et al. Building a morbidostat: an automated continuous-culture device for studying bacterial drug resistance under dynamically sustained drug inhibition. Nature Protocols. 8 (3), 555-567 (2013).
- Wong, B. G., Mancuso, C. P., Kiriakov, S., Bashor, C. J., Khalil, A. S. Precise, automated control of conditions for high-throughput growth of yeast and bacteria with eVOLVER. Nature Biotechnology. 36 (7), 614-623 (2018).
- Ekkers, D. M., Branco Dos Santos, F., Mallon, C. A., Bruggeman, F., Van Doorn, G. S. The omnistat: A flexible continuous-culture system for prolonged experimental evolution. Methods in Ecology and Evolution. 11 (8), 932-942 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados