Projeto e Construção de um Microscópio de Fluorescência de Lâmina de Luz Personalizável, de Objetiva Única para a Visualização de Redes de Citoesqueleto
Neste Artigo
Resumo
Este protocolo descreve em detalhes como construir um microscópio de fluorescência de lâmina de luz de objetiva única e seu uso para visualizar redes de citoesqueleto.
Resumo
Compósitos reconstituídos do citoesqueleto têm emergido como um valioso sistema modelo para o estudo da matéria mole fora do equilíbrio. A captura fiel da dinâmica dessas redes densas e 3D exige seccionamento óptico, que é frequentemente associado a microscópios confocais de fluorescência. No entanto, desenvolvimentos recentes na microscopia de fluorescência de folhas de luz (LSFM) estabeleceram-na como uma alternativa econômica e, às vezes, superior. Para tornar o LSFM acessível aos pesquisadores do citoesqueleto menos familiarizados com a óptica, apresentamos um guia passo a passo para iniciantes para a construção de um microscópio de fluorescência versátil de folhas de luz a partir de componentes prontos para uso. Para permitir a montagem de amostras com amostras de lâminas tradicionais, este LSFM segue o design de folha de luz de objetivo único (SOLS), que utiliza uma única objetiva para a coleta de excitação e emissão. Descrevemos a função de cada componente do SOLS em detalhes suficientes para permitir que os leitores modifiquem a instrumentação e a projetem para atender às suas necessidades específicas. Finalmente, demonstramos o uso deste instrumento SOLS personalizado visualizando asters em redes de microtúbulos acionadas por cinesina.
Introdução
A microscopia de fluorescência de folha de luz (LSFM) representa uma família de técnicas de imagem de fluorescência de alta resolução em que a luz de excitação é moldada em uma folha 1,2, incluindo microscopia de iluminação plana seletiva (SPIM), excitação planar confocamente alinhada varrida (SCAPE) e microscopia de plano oblíquo (OPM)3,4,5,6,7. Ao contrário de outras modalidades de microscopia, como epifluorescência, microscopia de fluorescência por reflexão interna total (TIRFM) ou microscopia confocal, a fototoxicidade é mínima no LSFM e as amostras podem ser imageadas em escalas de tempo mais longas, pois apenas o plano da amostra que está sendo ativamente fotografada é iluminado 8,9,10. Portanto, as técnicas de LSFM são extremamente úteis para a obtenção de imagens de amostras 3D em longos períodos de tempo, notadamente mesmo aquelas muito espessas para técnicas de microscopia confocal. Por essas razões, desde seu desenvolvimento original em 2004, o LSFM tornou-se a técnica de imagem de escolha para muitos fisiologistas, biólogos do desenvolvimento e neurocientistas para a visualização de organismos inteiros, como zebrafish vivo e embriões de Drosophila 3,4,6,11 . Nessas duas últimas décadas, as vantagens do LSFM têm sido aproveitadas para visualizar estrutura e dinâmica em escalas progressivamente menores, incluindo as escalastecidual11,12, celular e subcelular, tanto in vivo quanto in vitro13,14,15,17.
Apesar dos relatos de casos de uso bem-sucedidos na literatura, o alto custo dos sistemas comerciais de LSFM (~0,25 milhões de dólares até o momento em que este artigo foi escrito)18,19 impede o uso generalizado da técnica. Para tornar o DIY uma alternativa viável para pesquisadores, vários guias de construção foram publicados 8,13,20,21, incluindo o esforço de acesso aberto OpenSPIM 22. No entanto, até o momento, pesquisadores com experiência óptica mínima só podem usar desenhos LSFM anteriores, que são incompatíveis com amostras tradicionais montadas em lâminas (Figura 1A). A recente implementação de um único objetivo, light-sheet (SOLS) utiliza um único objetivo tanto para a excitação quanto para a detecção (Figura 1C), superando assim a limitação relacionada à compatibilidade 5,6,8,13,20. No entanto, o custo para a versatilidade do projeto SOLS é um aumento substancial na complexidade da construção devido à exigência de duas objetivas adicionais para retransmitir, desinclinar e recriar imagens do plano do objeto na câmera para geração de imagens (Figura 1D). Para facilitar o acesso às configurações complexas no estilo SOLS, este artigo apresenta um guia passo a passo sobre o projeto, construção, processo de alinhamento e uso de um sistema SOLS compatível com slides, que seria útil para pesquisadores com conhecimento de apenas um curso de óptica de nível básico.
Embora o protocolo em si seja sucinto, os leitores devem consultar outros recursos durante as etapas de preparação para saber mais sobre partes específicas do design ou considerações de hardware. No entanto, se um leitor pretende seguir as especificações deste projeto, pode não ser necessário entender como selecionar componentes ópticos específicos.
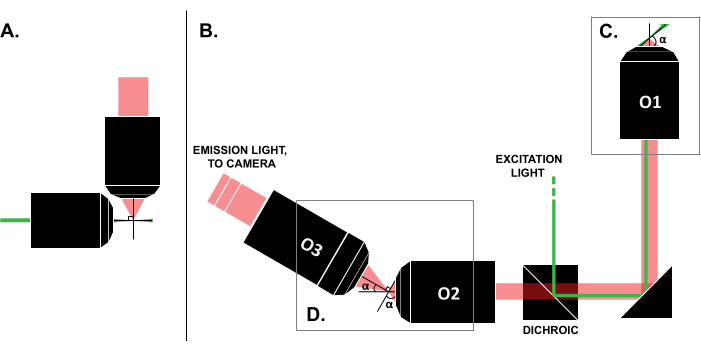
Figura 1: Características das diferentes configurações do LSFM. (A) A configuração com dois objetivos ortogonais comuns nos primeiros projetos de LSFM. Nesta configuração, um tubo capilar ou um cilindro de gel é usado para conter a amostra, o que não é compatível com as técnicas tradicionais de montagem por lâmina. (B) Um esquema de um desenho de folha luminosa SOLS mostrando o seguinte: (C) o objetivo único usado tanto para a excitação quanto para a coleta de emissões no plano da amostra (O1); isso permite que uma corrediça tradicional seja montada na parte superior, e (D) o sistema de objetiva do relé no caminho de emissão SOLS. O O2 coleta a luz de emissão e desamplia a imagem. O O3 fotografa o plano no ângulo de inclinação correto no sensor da câmera. Abreviações: LSFM = microscopia de fluorescência de folhas; SOLS = folha luminosa de objetivo único; O1-O3 = objetivos. Clique aqui para ver uma versão maior desta figura.
Protocolo
1. Preparação para o alinhamento
- Antes de iniciar a construção, realize todas as revisões de literatura necessárias para ter uma ideia clara do caso de uso pretendido (por exemplo, os fluoróforos a serem fotografados, o volume de imagem necessário, os requisitos de resolução). Em particular, consulte a seção de resultados representativos abaixo para decidir se seguir o design exato descrito aqui é apropriado. Se estiver, pule para a etapa 1.2. Caso contrário, encontre sugestões e orientações para a seleção de hardware no Sheunglab SOLS Build Guide23.
NOTA: O usuário pode encontrar mais informações sobre as especificações deste sistema específico na seção de discussão. - Colete todos os componentes ópticos, optomecânicos e elétricos necessários, conforme detalhado na Tabela de Materiais. Para usuários modificando o sistema, colete todas as partes equivalentes.
- Construa o laser de alinhamento conforme ilustrado na Figura 2A. Verifique se a viga está colimada usando a placa de cisalhamento.
- Construa a gaiola de alinhamento de disco de vidro fosco duplo conforme ilustrado na Figura 2B.
- Preparar a amostra de teste revestida com corante fluorescente.
- Crie uma solução saturada de corante de rodamina adicionando gradualmente 1 mL de água destilada a 0,2 g de pó liofilizado até que esteja tudo dissolvido. Vórtice para homogeneizar.
NOTA: Esta solução é sensível à luz. Embora não haja precauções necessárias durante a preparação, certifique-se de que a solução seja armazenada em uma área escura depois de ter sido preparada.
CUIDADO: Use sempre luvas e máscara ao manusear o pó de rodamina. - Pipetar 10 μL para o centro de uma lâmina de teste.
- Coloque um vidro de cobertura de 22 mm x 22 mm sobre o líquido, garantindo que a camada de fluorescência seja a mais fina possível.
- Selo com esmalte transparente.
Observação : este exemplo é sensível à luz. Para maximizar a vida útil da amostra, certifique-se de que a lâmina esteja armazenada em uma área escura quando não estiver em uso.
- Crie uma solução saturada de corante de rodamina adicionando gradualmente 1 mL de água destilada a 0,2 g de pó liofilizado até que esteja tudo dissolvido. Vórtice para homogeneizar.
- Prepare a amostra de contas 3D (contas de 1 μm embutidas em gel).
- Use fita dupla face para criar um canal vertical de 4 a 5 mm de largura em um slide de amostra com três camadas de fita alta.
- Coloque um vidro de cobertura de 22 mm x 22 mm sobre a fita no centro da corrediça. Pressione firmemente as regiões coladas para garantir uma boa vedação entre a fita e o vidro da tampa.
- Use uma lâmina de barbear para remover o excesso de fita.
- Preparar 125 mL de solução saturada de goma gelana adicionando gradualmente água DI a 1 g de goma gelana em pó. Esta solução será sólida à temperatura ambiente e líquida a 65 °C.
- Introduzir 1 ml de solução de goma gelana num tubo de microcentrífuga. Aqueça um recipiente de água numa placa quente a 65 °C e aqueça o tubo de microcentrífuga até que a goma gelana esteja visivelmente viscosa.
- Preparar 10 μL de uma diluição de 1:1.000 de contas em solução de goma gelana aquecida.
- Pipetar cuidadosamente a solução para dentro da câmara até ficar cheia. Use um palito para passar uma pequena quantidade de epóxi em ambos os lados do canal, cobrindo totalmente as aberturas para selar. Para garantir a vedação adequada, inspecione visualmente ambas as extremidades para se certificar de que o epóxi penetrou ligeiramente em cada extremidade do canal.

Figura 2: Fotos das ferramentas de alinhamento. (A) Laser de alinhamento colimado. AL1: Lente de alinhamento 1, −50 mm; AL2: Lente de alinhamento 2, 100 mm (B) Gaiola de alinhamento de disco de vidro fosco duplo. Abreviações: RMS CP = RMS placa de gaiola roscada; SM1 CP = placa de gaiola rosqueada SM1. Clique aqui para ver uma versão maior desta figura.
2. Alinhando o caminho de excitação
- Esboce o layout do microscópio na superfície da mesa óptica. Meça todas as distâncias com a maior precisão possível.
Observação : consulte a Figura 3 para obter a localização dos componentes dentro do sistema. - Monte o laser de excitação sobre a mesa. Ajuste duas íris para a altura pretendida do laser e monte-as a 2-3 pés de distância na linha desejada de furos atrás da localização do Espelho 1 (M1). Use essas íris para garantir que o feixe esteja nivelado com a superfície da mesa e centralizado na linha de furos na mesa óptica.
NOTA: Use óculos de segurança a laser para proteção ocular e bloqueie quaisquer feixes de laser perdidos com telas de segurança a laser como precaução de segurança. Até que todos os componentes sejam permanentemente apertados, a deriva na ordem de horas é possível. Configure uma íris no ponto mais distante do alinhamento no final de cada dia como uma verificação visual rápida de desvio ao retornar à construção. Vibrações, uma mesa óptica flutuada inadequadamente e correntes de ar são as causas mais comuns de deriva óptica. - Monte o obturador laser o mais próximo possível do laser de excitação. Utilize este obturador para bloquear rapidamente a luz laser durante o alinhamento, em vez de ligar e desligar repetidamente o laser.
- Monte os filtros ND na roda do filtro ND (ND 0.5, 1.0. 2.0, 3.0, 4.0 e um slot em branco) e monte após o obturador a laser.
- Alterne o atuador motorizado para um estágio de translação (TS1) e, em seguida, insira o estágio sob a localização de M1. Certifique-se de que o estágio se traduz axialmente ao longo da mesma linha de furos que a luz laser segue. Defina o palco no meio de sua faixa para a colocação inicial.
- Nas etapas a seguir, 2.6-2.10, insira os componentes ópticos reflexivos no caminho do feixe, um de cada vez, para direcionar o laser ao longo do caminho conforme desenhado na tabela. Use o par de íris ajustado à altura exata para definir o caminho desejado do feixe de saída e orientar a colocação e o alinhamento de cada elemento refletivo. Para cada elemento, ajuste a altura e a posição do suporte para garantir que o feixe de entrada atinja o centro. Em seguida, gire a base do suporte para direcionar o feixe ao longo do caminho do feixe arrastado na mesa para que ele passe por ambas as íris e ajuste finamente a inclinação do feixe de saída com os botões na parte de trás de cada suporte.
NOTA: Depois que cada elemento estiver alinhado à altura correta, adicione um colar deslizante ao poste para fixar a altura.
- Nas etapas a seguir, 2.6-2.10, insira os componentes ópticos reflexivos no caminho do feixe, um de cada vez, para direcionar o laser ao longo do caminho conforme desenhado na tabela. Use o par de íris ajustado à altura exata para definir o caminho desejado do feixe de saída e orientar a colocação e o alinhamento de cada elemento refletivo. Para cada elemento, ajuste a altura e a posição do suporte para garantir que o feixe de entrada atinja o centro. Em seguida, gire a base do suporte para direcionar o feixe ao longo do caminho do feixe arrastado na mesa para que ele passe por ambas as íris e ajuste finamente a inclinação do feixe de saída com os botões na parte de trás de cada suporte.
- Monte e alinhe o M1 sobre o TS1.
- Monte e alinhe o dicroico sobre a mesa.
- Seguindo as instruções do fabricante, conecte o galvo à fonte de alimentação e ao gerador de funções.
- Monte o galvo de tal forma que o laser incida no centro exato do espelho. Ligue o galvo e, em seguida, pressione e segure o botão AM no gerador de forma de onda para definir a inclinação do espelho para a corrente de 0 V DC (centro do intervalo). Agora, alinhe o galvo às íris.
- Monte e alinhe o Espelho 2 (M2).
- Insira o espelho cilíndrico grande no suporte do espelho cilíndrico. Use 1 em hastes de gaiola para conectar um adaptador de gaiola de 30-60 mm acima do espelho 3 (M3). Use os botões no suporte do espelho para achatar a inclinação do espelho M3 para a colocação inicial.
- Monte a gaiola de alinhamento de vidro fosco duplo no adaptador da gaiola acima de M3; Certifique-se de apertar os parafusos ajustados no adaptador da gaiola que mantêm a gaiola de alinhamento no lugar sempre que ela for usada para alinhamento. Monte M3 na mesa e ajuste a altura e a posição até que o feixe esteja aproximadamente centralizado em ambos os discos de alinhamento de vidro fosco. Grampo M3 à mesa e use um suporte de poste, 3 em poste, braçadeira de 90° e 2 em poste em ambos os lados do M3 para adicionar suporte usando os orifícios colados em ambos os lados do suporte de espelho. Use os botões na parte de trás do espelho para ajustar o feixe.
NOTA: Todos os elementos reflexivos no caminho de excitação agora estão definidos e não devem ser tocados. - Monte a lente 1 (L1) sobre a mesa. Para todos os posicionamentos iniciais da lente, use um alvo de lente rosqueada para centralizar o feixe de entrada na frente da lente. Ajuste a inclinação e a posição lateral da lente 1 (L1) até que o feixe esteja centrado em ambas as placas de vidro fosco na gaiola de alinhamento acima de M3.
- Monte a lente 2 (L2) em sua respectiva posição para criar um sistema 4f com L1. Mover L2 axialmente para obter um feixe colimado e usar o laser de excitação e a placa de cisalhamento para verificar a colimação. Ajuste a inclinação e a posição lateral de L2 para centralizar o feixe em ambos os discos de vidro fosco acima de M3.
- Monte o pinhole em uma montagem de tradução xy. Monte isso em cima de um estágio de tradução 1D para fornecer uma tradução axial fina. Monte o pinhole e o palco em um poste e poste mount, e coloque-o no ponto focal compartilhado entre L1 e L2. Ajuste o orifício manualmente até que a luz laser possa ser vista através do orifício.
- Monte o sensor do medidor de energia imediatamente após o orifício e use o botão de comprimento de onda no console digital do medidor de energia para selecionar o comprimento de onda do laser de excitação. Ajuste a posição xy do orifício para maximizar a transmissão e obter um perfil de feixe próximo ao TEM00. Em seguida, ajuste o pinhole axialmente com o estágio 1D para maximizar ainda mais a transmissão.
- Monte a lente 4 (L4) na mesa em sua posição e ajuste a montagem para a altura correta. Ajuste L4 axialmente para que o feixe de excitação seja focado na superfície da luva. Ajuste a inclinação e a posição lateral de L4 para centralizar o feixe em ambos os discos de vidro fosco acima de M3.
- Monte a lente 3 (L3) na mesa em sua posição e ajuste a montagem para a altura correta. Use o laser de excitação e a placa de cisalhamento para verificar a colimação de L3 e L4. Ajuste a inclinação e a posição lateral de L3 para centralizar o feixe em ambos os discos de vidro fosco acima de M3.
- Remova temporariamente L3. Monte a lente de varredura 1 (SL1) sobre a mesa e ajuste a distância axial para formar um telescópio colimado com L4, conforme medido com a placa de cisalhamento. Ajuste a inclinação e a posição lateral do SL1 para centralizar o feixe em ambos os discos de vidro fosco acima de M3.
- Reinsira L3. Monte a lente do tubo 1 (TL1) e use o feixe de excitação e a placa de cisalhamento para colimar SL1 e TL1. Ajuste a inclinação e a posição lateral do TL1 para centralizar o feixe em ambos os discos de vidro fosco acima de M3.
- Usando um anel adaptador, rosqueie a Objetiva 1 (O1) na placa da gaiola acima de M3. Remova SL1 temporariamente e deixe a viga bater no teto. Ajuste a altura (distância axial) de O1 no sistema de gaiola até que o feixe forme um disco Airy no teto e, em seguida, continue ajustando até que o tamanho do disco seja minimizado.
- Com o O1 no lugar, monte o estágio da amostra na posição apropriada.
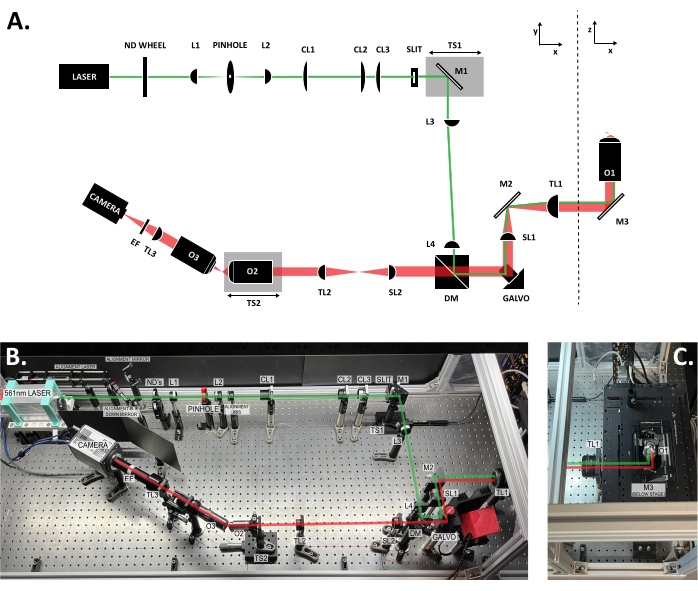
Figura 3: Localização dos componentes dentro do sistema SOLS. (A) Layout esquemático do sistema SOLS com todos os componentes rotulados. (B) Foto de cima para baixo do sistema físico SOLS na mesa óptica, excluindo a área do estágio da amostra. (C) Foto de cima para baixo da área do estágio da amostra (extensão para a Figura 3B). O caminho de excitação é mostrado em verde. O caminho de emissão é mostrado em vermelho. Distâncias focais das lentes: L1: 100 mm; L2: 45 mm; CL1: 50 mm; CL2: 200 mm; CL3: 100 mm; L3: 150 milímetros; L4: 100 milímetros; CB1: 75 mm; TL1: 200 mm; CB2: 150 mm; TL2: 125 mm; TL3: 200 milímetros. Consulte a Tabela de materiais para obter especificações mais detalhadas da peça. Abreviaturas: SOLS = folha luminosa de objetivo único; Roda ND = roda de filtro de densidade neutra variável; L1-L4 = plano concôncavo acromático; CL1-CL3 = lentes cilíndricas; M1-M3 = espelhos; ST1-ST2 = etapas da tradução; DM = espelho dicroico; Galvo = galvanômetro de varredura; SL1-SL2 = lentes de varredura; TL1-TL2 = lentes de tubo; O1-O3 = objetivos; EF = filtro de emissão. Clique aqui para ver uma versão maior desta figura.
3. Alinhamento da trajetória de emissão
- Configure o laser de alinhamento.
- Monte duas placas de gaiola vazias ao lado do laser de excitação na mesma altura que o laser. Use essas placas de gaiola para montar o laser de alinhamento deslizando as hastes da gaiola do laser de alinhamento nos orifícios vazios nas duas placas de gaiola. Certifique-se de que o laser pode ser ajustado para a posição ligada, tocando ao redor do botão liga/desliga ou conectando um interruptor liga/desliga.
- Remova o O1 e reinsira a gaiola de alinhamento de vidro fosco. Use um suporte de espelho cinemático e um espelho suspenso para alinhar o feixe de alinhamento ao caminho do feixe de excitação.
- Use o medidor de energia para maximizar o sinal do feixe de alinhamento após o orifício, ajustando finamente os dois espelhos. Certifique-se de que o feixe permaneça centralizado na gaiola de alinhamento de vidro fosco.
- Remova a gaiola de alinhamento e reinsira O1. Coloque o espelho quadrado no estágio de amostra de O1 e ajuste o espelho axialmente até que o tamanho do perfil do feixe seja minimizado após o dicroico.
- Monte uma íris no caminho de emissão e volte o suficiente para que a Lente de Varredura 2 (SL2), a Lente de Tubo 2 (TL2) e a Objetiva 2 (O2) possam ser inseridas sem interferência. Alinhe essa íris ao laser de alinhamento. Monte um disco de vidro fosco pelo menos 1 atrás da íris e certifique-se de que este também esteja alinhado à luz laser.
- Insira SL2 na distância correta, medida a partir do galvo com uma régua. Ajuste a inclinação e a posição lateral do SL2 de modo que o feixe de alinhamento de entrada esteja centrado no SL2 e o feixe de saída passe através da íris e do disco de vidro fosco.
- Insira TL2 na distância correta, medida a partir de SL2 com uma régua. Ajuste a inclinação e a posição lateral do TL2 de modo que o feixe de alinhamento de entrada fique centrado no TL2 e o feixe de saída passe através da íris e do disco de vidro fosco.
- Monte TS2 na mesa. Certifique-se de que o estágio se traduza ao longo do eixo óptico de O2.
- Rosqueie o O2 em um suporte de tradução xy. Conecte um poste sob o suporte xy para montar o O2 no palco de tradução. Use um alvo de parafuso para centralizar a parte de trás do O2 no laser vermelho.
- Ajuste os botões xy e a inclinação do O2 para que o feixe de alinhamento vermelho passe através da íris e do disco de vidro fosco.
- Mova o laser de alinhamento para acima de O1 e direcione para baixo no caminho de emissão. Ligue o laser e certifique-se de que esse feixe esteja centralizado em todas as lentes no caminho de emissão.
- Conjugar os planos pupilares de O1 e O2 abrindo a íris e removendo o disco de vidro fosco de modo que o feixe de alinhamento que sai de O2 continue desobstruído até uma superfície ou parede distante (>0,5 m) (Figura 4). Ajuste o TS2 até que o feixe forme um pequeno disco Airy na superfície e, em seguida, continue ajustando o TS2 para minimizar o tamanho do disco Airy.
NOTA: Um feixe fortemente divergente indica o posicionamento incorreto de O2. No entanto, como esse feixe passa por dois objetivos, uma pequena quantidade de divergência é inerente. Como tal, o disco Airy é o melhor guia. - Otimize o galvo para varredura invariante de inclinação: Pressione o botão FSK no gerador de forma de onda para selecionar um sinal de onda triangular para o galvo, e defina para uma frequência baixa (~1 Hz). Observe o feixe de alinhamento na mesma superfície ou parede distante.
NOTA: Se o galvo for colocado incorretamente, o feixe varrerá horizontalmente na superfície junto com o movimento do galvo. Isso pode ser resolvido através de ajustes finos (manualmente) da inclinação e posição xy da base do galvo até que o deslocamento do feixe seja indetectável a olho. - Verifique a qualidade do sistema por imagem a 0°.
- Rosqueie o O3 em um suporte de tradução xy. Rosqueie um tubo de lente de 1 no estágio de translação da gaiola e rosqueie o estágio de translação xy no tubo. Use duas hastes de gaiola para conectar a frente do estágio de translação da gaiola a uma placa de gaiola e monte a placa da gaiola em um poste. Monte a Objetiva 3 (O3) perto da frente de O2 (~4-5 mm) a 0° e ajuste a altura para corresponder.
- Monte um disco de alinhamento de vidro fosco no plano focal compartilhado entre SL2 e TL2, conforme medido com uma régua. Monte a lâmina de teste fluorescente acrílica no palco e ilumine a lâmina com o laser de excitação. Olhe através da parte de trás do O3, ajuste a altura e a posição axial do O3 para encontrar a luz de emissão e, em seguida, ajuste o O3 axialmente até que a luz de emissão preencha a abertura traseira (Figura 5).
- Rosqueie duas hastes de gaiola 8 na parte de trás do estágio de translação de O3. Deslize uma placa de gaiola com um disco de vidro fosco montado nas hastes e, em seguida, ajuste finamente o O3 usando o suporte xy para garantir que a luz de emissão saia do O3 centralizada. Em seguida, remova as hastes da gaiola.
- Monte um disco de vidro fosco na posição áspera do sensor da câmera e alinhe a altura e a posição do disco à luz de emissão.
- Parafuse a lente de tubo 3 (TL3) em uma placa de gaiola e monte-a imediatamente atrás de O3. Centralize o TL3 na luz de emissão de entrada e, em seguida, ajuste a inclinação do TL3 para alinhar a luz de saída ao disco de vidro fosco.
- Monte a câmera na distância correta da lente do tubo, medida com uma régua.
- Rosqueie os tubos da lente 2 e o filtro de emissão na câmera.
- Remonte o disco de alinhamento de vidro fosco no plano focal compartilhado entre SL2 e TL2. Monte a amostra de teste de corante fluorescente e ilumine a amostra com o feixe de excitação.
- Ligue a câmera e abra o programa Micromanager no computador conectado. Clique em Ao vivo para entrar na visualização ao vivo. Clique em Auto Once para definir as configurações de exposição inicial e, em seguida, redefina a exposição conforme necessário durante a geração de imagens.
NOTA: O Micromanager não funcionará correctamente, a menos que seja aberto depois de a câmara ter sido ligada. - Ajuste os botões de translação xy no suporte O3 até que o pequeno orifício no disco de alinhamento de vidro esteja centralizado no campo de visão (FoV). Ajustar o O3 axialmente com o estágio de translação da gaiola até que o orifício esteja em foco; as bordas devem aparecer nítidas (Figura 6).
- Imagem de esferas fluorescentes para verificar a qualidade do sistema.
- Remova o disco de alinhamento de vidro fosco, monte a amostra de esferas 3D e ilumine a amostra com o feixe de excitação.
- Ajustar a altura da amostra em relação ao O1 até que as esferas fluorescentes preencham uma região circular no centro da FoV.
- Ajuste fino da posição do O3 usando o estágio xy e o estágio de translação axial até que as funções de dispersão pontual (PSFs) sejam redondas (indicativas de aberrações mínimas) e brilhantes (indicativas de uma boa relação sinal-ruído) (Figura 7). Se isso não puder ser alcançado ajustando o O3, é altamente provável que o sistema óptico entre os componentes O1 e O2 esteja sub-idealmente alinhado; Siga as verificações de diagnóstico na etapa 3.13 abaixo.
- Se for possível obter PSFs redondas , pule a etapa de diagnóstico e passe para a inclinação do sistema de imagem.
- Execute verificações de diagnóstico, se necessário.
NOTA: Uma vez que boas PSFs são obtidas, o resto das etapas de diagnóstico podem ser ignoradas.- Monte a luz de campo brilhante (BF) acima de O1. Monte o alvo de teste de grade positivo no estágio de amostra na mesma altura axial que o espelho de alinhamento. Centralize a grade de 10 μm e ilumine a grade com a luz BF.
- Crie imagens da grade na câmera e traduza a amostra até que a grade esteja em foco. Use a imagem de grade para confirmar que o campo no FoV é plano: se não, a grade aparecerá distorcida e curvada. Para corrigir uma imagem de grade incorreta, ajuste a posição xyz e a inclinação de O3 e, em seguida, ajuste o TL3 e a câmera de acordo.
Observação : se uma grade plana pode ser alcançada, repita a etapa 3.12.10 e, em seguida, passe para inclinar o sistema de imagem. - Configure a câmera de alinhamento ou a câmera de imagem na distância correta para que o SL2 concentre a imagem no sensor. Imagine o alvo da grade no plano intermediário (Figura 8). Se essa grade também estiver enviesada, é altamente provável que o sistema óptico entre os componentes O1 e SL2 esteja sub-idealmente alinhado e deva ser revisitado. Otimize o alinhamento conforme necessário antes de progredir.
NOTA: Se a câmera não se encaixar entre SL2 e TL2, use um espelho extra para devolver a imagem 90° após SL2 e para a câmera. - Verifique as PSFs no plano intermediário: Depois de verificar a grade, outra boa verificação diagnóstica é verificar as PSFs no mesmo plano intermediário. Uma boa imagem nesse plano, semelhante à Figura 7 , mas com aumento diferente (Figura 9), indica bom alinhamento através do CB2.
Observação : se uma grade plana e PSFs redondas podem ser obtidas no plano intermediário, repita a etapa 3.13.2, em seguida, a etapa 3.12.10 e, em seguida, passe para inclinar o sistema de imagem.
- Incline o subsistema de imagem de O3 para 30°.
- Remova O3, TL3 e a câmera.
- Reinsira o O3 a 30° no eixo óptico do O2 usando as linhas da tabela como guia.
- Monte um disco de alinhamento de vidro fosco no plano focal compartilhado entre SL2 e TL2. Monte a lâmina de teste fluorescente acrílica no palco e ilumine a lâmina com o laser de excitação. Mais uma vez, olhe através da parte de trás do O3, ajuste a altura e a posição axial do O3 para encontrar a luz de emissão a 30° e, em seguida, ajuste o O3 axialmente até que a luz de emissão preencha a abertura traseira.
- Remova o disco de alinhamento de vidro fosco entre SL2 e TL2 para obter um sinal de emissão mais forte.
- Rosqueie duas hastes de gaiola 8 na parte de trás do estágio de translação de O3. Deslize uma placa de gaiola com um disco de vidro fosco montado nas hastes e, em seguida, ajuste finamente o O3 usando o suporte xy para garantir que a luz de emissão saia do O3 centralizada. Em seguida, remova as hastes da gaiola.
- Monte um disco de vidro fosco na posição áspera do sensor da câmera e alinhe a altura e a posição do disco à luz de emissão.
- Monte TL3 imediatamente atrás do O3. Centralize o TL3 na luz de emissão de entrada e, em seguida, ajuste a inclinação do TL3 para alinhar a luz de saída ao disco de vidro fosco.
- Para definir com mais precisão a distância da câmera TL3, desaparafuse cuidadosamente o O3 e monte o laser de alinhamento para que ele seja focado pelo TL3 na câmera. Use filtros ND conforme necessário para que a intensidade do laser seja de <1 mW. Inicie a visualização ao vivo da câmera e ajuste o TL3 axialmente para minimizar o ponto laser na câmera.
- Remonte o disco de alinhamento de vidro fosco no plano focal compartilhado entre SL2 e TL2. Monte a amostra de teste de corante fluorescente e ilumine a amostra com o feixe de excitação. Ajuste os botões de tradução xy no suporte O3 até que o pequeno orifício no disco de alinhamento de vidro esteja dentro do FoV na câmera. Ajustar o estágio de translação da gaiola para mover o O3 axialmente até que o orifício esteja em foco; Certifique-se de que o buraco pareça semelhante ao que fez a 0°.
- Remonte o alvo de teste de grade positivo na mesma altura axial e ilumine a grade com a luz BF. Confirme se apenas uma seção vertical está em foco (devido à inclinação de 30°). Mais uma vez, use a imagem de grade para confirmar que o campo em todo o FoV é plano, mesmo quando fora de foco. Quando o slide for traduzido axialmente, confirme se a parte em foco do FoV (destino da grade) varre a tela horizontalmente, enquanto os quadrados da grade mantêm um tamanho consistente (Figura 10).
Observação : devido à inclinação do plano de imagem na amostra, a grade pode aparecer ligeiramente esticada no plano x.
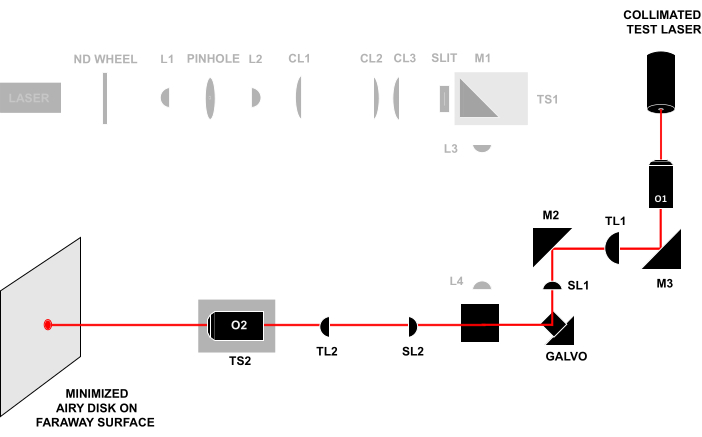
Figura 4: Técnica de laser-in-laser-out. Enviar um feixe de teste colimado através da frente de O1 e observar o feixe que sai de O2 em uma superfície distante. Se todos os componentes estiverem alinhados na distância correta, o feixe formará um pequeno disco Airy na superfície distante. Todas as abreviaturas são as mesmas da Figura 3. Clique aqui para ver uma versão maior desta figura.

Figura 5: Utilização de luz de emissão para alinhamento. (A) Luz de emissão de uma lâmina fluorescente de acrílico sobre um alvo rosqueado atrás do PBF de O2. (B) Encontrar a luz de emissão pela visão através da parte de trás do O3. Abreviações: O2-O3 = objetivos; PGC = plano focal posterior. Clique aqui para ver uma versão maior desta figura.

Figura 6: Imagem na câmera do disco de alinhamento de vidro fosco focalizado corretamente. O disco foi posicionado no plano intermediário entre o CP2 e o TL2. Barra de escala = 50 μm. Abreviações: SL2 = lente de varredura; TL2 = lente tubular. Clique aqui para ver uma versão maior desta figura.

Figura 7: Imagem da câmera da amostra de contas 3D. A imagem mostra contas de 1 nm com o módulo de imagem ajustado para 0° e iluminado por um feixe circular antes da inserção das lentes cilíndricas. Barra de escala = 50 μm. Clique aqui para ver uma versão maior desta figura.

Figura 8: Alvo de teste de grade positivo corretamente focado no plano intermediário entre SL2 e TL2. As grades planas ao longo de todo o campo indicam bom alinhamento dos componentes SL2 e anterior. Barra de escala = 30 μm. Abreviações: SL2 = lente de varredura; TL2 = lente tubular. Clique aqui para ver uma versão maior desta figura.
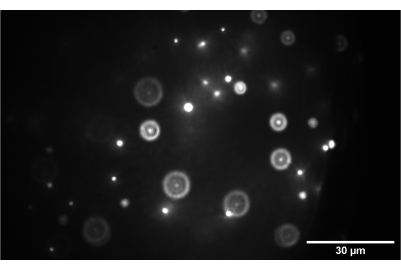
Figura 9: Imagem da câmera da amostra de contas 3D. A imagem mostra contas de 1 nm corretamente focadas no plano intermediário entre SL2 e TL2. Barra de escala = 30 μm. Abreviações: SL2 = lente de varredura; TL2 = lente tubular. Clique aqui para ver uma versão maior desta figura.

Figura 10: Alvo de teste de grade positivo com um quadrado amarelo de tamanho consistente sobreposto para corresponder aos quadrados da grade. (A) Grade em foco no lado esquerdo. (B) Grade em foco no lado direito. O quadrado amarelo corresponde ao tamanho das caixas de grade em ambos os lados do FoV. Barras de escala = 30 μm. Abreviação = FoV = campo de visão. Clique aqui para ver uma versão maior desta figura.
4. Alinhamento da folha de luz oblíqua
- Remova o O1 e insira novamente a gaiola de alinhamento de vidro fosco duplo em seu lugar. Confirme se o feixe está colimado e centrado em ambos os discos de vidro fosco.
- Parafuso da lente cilíndrica 1 (CL1) em um suporte de lente rotativa. Monte CL1 no caminho óptico e gire o suporte para que o feixe seja expandido na direção vertical para a mesa óptica. Ajuste a inclinação e a posição lateral do CL1 de modo que o feixe fique centralizado na frente e mantenha uma posição centralizada em ambos os discos de vidro fosco.
- Parafuse a lente cilíndrica 2 (CL2) em uma montagem de lente giratória e monte CL2 no caminho óptico na distância correta para formar um sistema 4f com CL1. Gire CL2 para a mesma orientação que CL1 para que o feixe seja esticado na direção vertical para a mesa óptica e colimado. Use um cartão de teste para medir a altura do perfil cilíndrico do feixe em vários locais para garantir que o feixe seja colimado. Ajustar a inclinação e a posição lateral da CL2, conforme realizado no passo 4.2.
- Parafuse a lente cilíndrica 3 (CL3) em uma montagem de lente giratória e monte CL3 no caminho óptico na distância correta para formar um sistema 4f com L3. Gire CL3 para a mesma orientação que CL1 e CL2 para que o feixe seja focalizado até um perfil de folha horizontal no plano focal. Ajustar a inclinação e a posição lateral da CL3, conforme realizado no passo 4.2.
- Insira a fenda: Usando quatro hastes de gaiola 4 e o suporte de gaiola CL3, monte a fenda em uma orientação vertical no plano focal entre CL3 e L3, conforme medido com uma régua. Use o perfil do feixe de excitação esticado para ajustar a altura e a posição lateral da fenda até que ela fique centralizada na viga.
- Reinsira O1, monte a amostra de teste de corante fluorescente e ilumine a amostra com a folha de luz de excitação. No sensor da câmera, confirme se a folha de luz de 0° aparece como uma folha vertical fina (Figura 11A).
- Remova a amostra de teste de corante fluorescente e limpe o O1. Deixe a folha clara expandir-se acima de O1 desobstruída. Usando o controle de estágio de translação motorizado, traduza M1 em direção às lentes cilíndricas para ajustar o ângulo da folha de luz para aproximadamente 60° em relação ao eixo óptico de O1.
NOTA: É crucial que a folha de luz esteja inclinada na direção correta para se alinhar com o plano de imagem igualmente inclinado (Figura 12); Se um sistema é disposto de forma diferente deste projeto específico, a direção correta da inclinação pode ser descoberta através do traçado geométrico de raios.
NOTA: Para referência, a tradução do M1 2.647 mm em direção à fenda define a folha de luz para a inclinação correta nesta configuração. - Reinsira a amostra de teste de corante fluorescente para obter imagens da folha inclinada. Certifique-se de que a folha de luz tenha mantido uma forma de feixe vertical na câmera, mas seja mais larga e mais fraca (Figura 11B).
- Traduza a amostra axialmente com o estágio para que o corante fluorescente seja iluminado pela folha de luz em cinco profundidades diferentes entre o centro do FoV e o lado direito da tela. Salve cada imagem.
- Abra as imagens em Fiji. Para cada imagem, selecione a ferramenta Linha e desenhe uma linha horizontal do centro do FoV até o centro da folha de luz. Para medir o deslocamento, acesse Analisar | Meça para ver o comprimento das linhas. Em seguida, plote o deslocamento da folha de luz em função da profundidade da amostra para calcular o ângulo da folha de luz acima de O1.
- Traduza M1 ligeiramente. Repita as etapas 4.9 e 4.10 até que o ângulo da folha de luz esteja a 60° do eixo óptico de O1, correspondendo ao ângulo do plano da imagem.

Figura 11: Imagens da câmera da amostra de teste de corante fluorescente iluminada por uma folha de luz de forma correta. (A) A folha a 90°, reta ao longo do eixo óptico de O1, e (B) inclinada a 30° (60° em relação ao eixo óptico de O1). Barras de escala = 50 μm. Abreviação: O1 = objetivo. Clique aqui para ver uma versão maior desta figura.
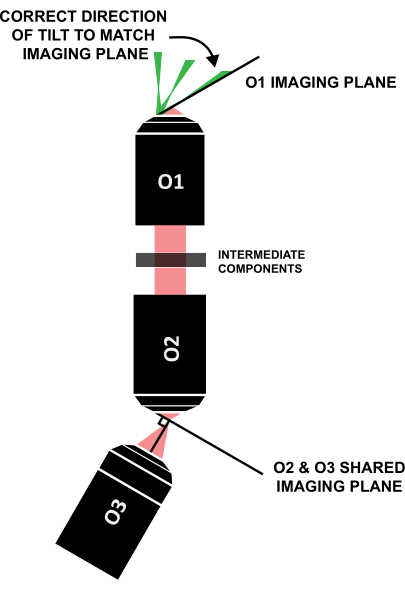
Figura 12: Direção correta da inclinação da folha de luz para alinhar com o plano de imagem de O1. Abreviação: O1-O3 = objetivos. Clique aqui para ver uma versão maior desta figura.
5. Ajuste fino do sistema de geração de imagens e coleta de dados
- Monte o slide de contas 3D e traduza a amostra axialmente com o palco até que as contas preencham o FoV na câmera.
- Ajustar o O3 utilizando o estágio xy e o estágio de translação do cage, visando minimizar aberrações e otimizar a relação sinal-ruído na imagem (Figura 13).
- Ajuste do colar de correção de O1, visando minimizar aberrações e otimizar a relação sinal-ruído na imagem.
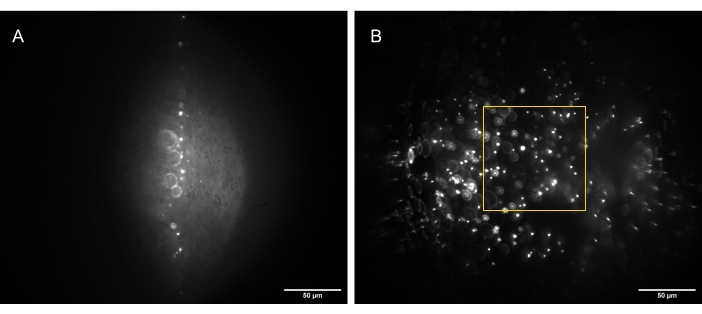
Figura 13: Imagens da câmera da amostra de contas 3D (contas de 1 μm) iluminadas por uma folha de luz de forma correta. (A) Folha a 90°, em linha reta ao longo do eixo óptico de O1, e (B) inclinada a 30° em relação ao eixo óptico de O1. A caixa amarela indica a porção do FoV que é plana, consistente e utilizável (80 μm x 80 μm) e na qual dados confiáveis podem ser capturados. Barras de escala = 50 μm. Abreviações: O1 = objetivo; FoV = campo de visão. Clique aqui para ver uma versão maior desta figura.
6. Calibrando a ampliação do sistema
- Monte o alvo de teste de grade positivo no estágio de amostra e ilumine com a luz de campo brilhante.
- Traduza o slide de grade axialmente com o palco para colocar o slide de grade em foco. Coloque o centro da grade em foco.
- Capture e salve a imagem e abra-a em Fiji.
- Use a ferramenta Linha e a função Medir em Fiji para medir com precisão a distância entre duas linhas de grade em pixels. Divida este valor pela distância conhecida (10 μm), para determinar a calibração pixel-a-mícron.
- Calcule a ampliação (M) do sistema usando o tamanho medido do pixel e o tamanho conhecido de um pixel com a equação (1).
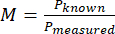 (1º)
(1º)
7. Aquisição de varreduras volumétricas
- Posicione a amostra.
- Ligue a visualização da câmera, o galvo, o gerador de funções, a fonte de alimentação, o palco e o laser de excitação.
- Monte o exemplo e, em seguida, clique no botão FSK no gerador de função para definir uma onda triangular. Para encontrar a amostra, use o gerador de funções para definir o seguinte: amplitude pico-a-pico de 400 mV (usando o botão Ampl. ), 0 deslocamento (usando o botão Offset ) e frequência de 200 mHz. Use a janela Micromanager para definir um tempo de exposição de 100 ms.
- Role em z manualmente até que o plano de amostra seja atingido. Otimize a configuração z para que a região desejada para a varredura volumétrica passe pela tela durante um ciclo.
- Selecione os parâmetros de varredura.
- Certifique-se de que a amplitude de pico a pico esteja definida corretamente, verificando visualmente se a visualização parece estar em foco durante a varredura. Se a qualidade da imagem se degradar mais cedo aproximando-se de uma extremidade da varredura do que da outra, edite o deslocamento no gerador de funções para mover o centro da varredura em direção à melhor região.
- No programa Micromanager, selecione um tempo de exposição e clique em Multi-D Acq. Use a caixa Contagem para escolher o número de quadros, que definirá o tempo total de aquisição. O intervalo entre quadros (taxa de quadros) será definido pelo tempo de exposição, a menos que um intervalo maior seja especificado na caixa Intervalo. No gerador de funções, defina a frequência para criar uma varredura de volume completo pela metade do período da função de onda triangular (varredura linear em uma direção).
Observação : se a taxa de quadros e a frequência forem muito baixas, poucos quadros serão adquiridos para uma varredura de volume e o número de quadros baixo criará artefatos visíveis no pós-processamento. Para referência, a Figura 13 foi composta por ~100 quadros na varredura, e a Figura 14 foi composta por ~800. Também é fundamental considerar a própria amostra ao selecionar os parâmetros. Certifique-se de que o tempo de exposição está definido de modo a que a amostra esteja suficientemente excitada, mas não saturada. A intensidade do laser de excitação também pode ser ajustada para este fim. Se o usuário estiver adquirindo uma série de varreduras volumétricas para caracterizar um processo de variação de tempo em 3D, certifique-se de que a escala de tempo de digitalização exceda a dinâmica de escala de tempo do sistema.
- Coleta de vídeos: Adquira um time-lapse que capture pelo menos a duração de uma rampa completa para cima ou para baixo da onda triangular, correspondendo a uma varredura completa do volume.
8. Procedimentos pós-processamento
- Pilhas de imagens volumétricas Deskewing
- Deskew o volume digitaliza para converter a pilha de imagens em planos inclinados para uma série de imagens em coordenadas xyz reais.
NOTA: Existem muitos guias excelentes sobre pós-processamento de imagens de folhas leves e software de código aberto para realizar o deskewing de varreduras de volume existentes, bem como para executar deskewing e salvar imagens deskewed durante a aquisição24. - Para examinar o volume, obtenha os dois parâmetros a seguir: a distância real entre dois quadros em pixels (d) e o ângulo entre o plano do quadro e o plano x-y (θ é definido pelo ângulo da folha de luz oblíqua (neste sistema, 30°). A distância entre os quadros dependerá da óptica de imagem e das configurações de aquisição.
- Deskew o volume digitaliza para converter a pilha de imagens em planos inclinados para uma série de imagens em coordenadas xyz reais.
- Localizando o parâmetro d
- Calibre a distância entre quadros para cada vez que o sistema for substancialmente realinhado. Realize essa calibração com uma pilha de imagens de contas fluorescentes, pois estas são as mais fáceis de usar para diagnosticar problemas.
- Adquira uma pilha de imagens e execute o código deskewing usando qualquer palpite inicial para o parâmetro d . Abra a pilha de imagens deskewed no ImageJ e role pela pilha. Se d foi definido substancialmente longe de seu verdadeiro valor, observe que as contas aparecerão artificialmente alongadas em x ou y, e contas individuais parecerão se mover no plano xy à medida que o usuário rola pelos quadros em z (em vez de focar e desfocar a partir do mesmo ponto central). Itere sobre o parâmetro d várias vezes até que esses problemas não sejam mais aparentes.
- Quando o parâmetro d parecer estar razoavelmente próximo do valor verdadeiro, calcule as projeções de intensidade máxima da pilha de imagens ao longo das direções x e y. Note que contas de um diâmetro próximo ao limite de difração podem aparecer alongadas em z, mas idealmente não devem parecer cônicas ou alongadas diagonalmente. Ajuste os parâmetros do deskewing até que esses critérios não melhorem substancialmente com novas iterações. Para referência, os dados mostrados na Figura 13 foram analisados em d = 2,50 pixels, e os dados na Figura 14 foram redigidos em d = 1,0 pixels.
NOTA: A distância entre quadros dependerá linearmente da amplitude de varredura, frequência e taxa de quadros.
Resultados Representativos
Foram realizadas varreduras volumétricas de esferas de 1 μm embebidas em goma gelana. A Figura 14 mostra as projeções de intensidade máxima das varreduras volumétricas escriturosas ao longo das direções x, y e z.

Figura 14: Imagem volumétrica de esferas fluorescentes de 1 μm em goma gelana. Projeções de intensidade máxima de varreduras volumétricas escriturosas são mostradas. Barras de escala = 30 μm. Clique aqui para ver uma versão maior desta figura.
Demonstramos o uso do microscópio de lâmina de luz de objetiva única para caracterizar redes de citoesqueleto reconstituídas através da realização de varreduras volumétricas de amostras de asters de microtúbulos. Em resumo, microtúbulos estabilizados com taxol marcados com rodamina foram polimerizados a partir de dímeros reconstituídos por GTP; em seguida, após a polimerização, clusters motores de cinesina à base de estreptavidina foram misturados em amostras juntamente com ATP para concentrações finais de microtúbulos de 6 μM, dímeros de cinesina 0,5 μM e ATP 10 mM. Extensos protocolos e guias para a preparação de microtúbulos estabilizados com taxol e clusters motores de cinesinas podem ser encontrados nos sites do Mitchson Lab e do DogicLab25,26. As amostras foram pipetadas suavemente em lâminas de microscópio, seladas e deixadas descansar por 8 h antes da obtenção de imagens para permitir que a atividade motora cessasse de modo que as amostras atingissem um estado estrutural estável que se assemelhasse a ásteres.
Estudos de sistemas de citoesqueleto reconstituído empregam mais frequentemente microscopia confocal ou de epifluorescência para obtenção de imagens de filamentos marcados. No entanto, ambas as técnicas são limitadas em sua capacidade de obter imagens de amostras 3D densas27. Embora muito progresso tenha sido feito na pesquisa de matéria ativa baseada em citoesqueleto in vitro, restringindo as amostras a serem quase 2D28,29, as redes de citoesqueleto são inerentemente 3D, e muitos esforços atuais estão na compreensão dos efeitos que só podem surgir em amostras 3D29,30, criando assim uma necessidade de imagens 3D de alta resolução.
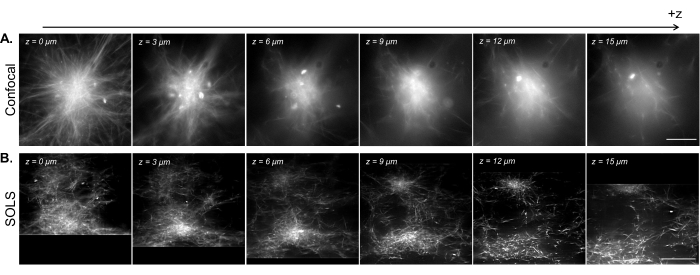
Figura 15: Facilitação da visualização 3D de amostras reconstituídas do citoesqueleto por microscopia óptica de objetivo único. (A) Imagens de asters de microtúbulos fluorescentes adquiridas em microscópio confocal de varredura a laser Leica DMi8. As imagens mostram diferentes planos de um z-scan. Barra de escala = 30 μm. (B) Imagens desconvolvidas de uma varredura volumétrica realizada na configuração de folha de luz de objetivo único da mesma amostra. Barra de escala = 30 μm. A área da imagem com costura corresponde ao FoV utilizável (caixa amarela) demonstrado na Figura 13B. Enquanto o confocal se destaca na obtenção de imagens de planos únicos perto da lamínula, a densidade da amostra fluorescente introduz complicações ao obter imagens em planos mais altos devido ao sinal adicional vindo de abaixo do plano da imagem. A folha de luz contorna esse problema iluminando apenas o plano da imagem, permitindo assim imagens uniformemente nítidas em diferentes planos em z. Abreviaturas: SOLS = folha luminosa de objetivo único; FoV = campo de visão. Clique aqui para ver uma versão maior desta figura.
Na Figura 15, demonstramos a imagem volumétrica de uma rede de microtúbulos reconstituída contraída em estruturas aster-like por aglomerados motores de cinesina. Como mostrado em pesquisas anteriores 28,31, essas estruturas 3D tendem a crescer densas em direção ao centro, resultando em regiões brilhantes de fluorescência que são predominantes no sinal. Em planos de imagem próximos à lamínula (nível z baixo), a microscopia confocal (Figura 15A) pode resolver filamentos únicos ao redor da periferia da aster, com fundo adicional em direção ao centro devido a sinais de fluorescência fora de foco vindos de cima. No entanto, mover alguns mícrons em z reduz rapidamente a qualidade das imagens devido às seções densas fora de foco do aster serem predominantes no sinal no plano da imagem. A iluminação monoplanar da folha de luz (Figura 15B) elimina os sinais fora de foco das partes densas do aster acima e abaixo do plano de imagem, permitindo assim uma qualidade de imagem comparável entre os planos. A capacidade da folha de luz de produzir dados de varredura volumétrica confiáveis e de alta qualidade abre a possibilidade de visualizar e caracterizar fenômenos 3D em sistemas de citoesqueleto reconstituídos.
Discussão
Dois detalhes importantes sobre esse protocolo são o custo geral do sistema e o tempo esperado de construção e alinhamento. Embora o custo exato seja variável, podemos confortavelmente estimar que o custo in toto deste SOLS ou de um sistema DIY semelhante cairia na faixa de US$ 85.000. Observamos que esta estimativa considera o preço de varejo de todos os componentes, portanto, esse preço global pode ser bastante reduzido pelo fornecimento de componentes usados. Em termos de tempo de construção, seria razoável esperar que um usuário com pouca experiência óptica construísse e alinhasse todo esse sistema SOLS dentro de 1-2 meses, desde que todos os componentes estejam disponíveis e prontos. Apesar da extensão e complexidade do protocolo, acreditamos que a quantidade de detalhes no manuscrito escrito, pareado com o protocolo de vídeo, deve tornar este protocolo simples e rápido de seguir.
Há duas etapas críticas neste protocolo. Primeiro, a colocação do galvo determina o posicionamento de muitas lentes, pois faz parte de três pares de lentes 4f separados. É crucial que o galvo seja conjugado com os planos focais traseiros de O1 e O2 e centralizado corretamente para garantir a varredura invariante de inclinação. Em segundo lugar, a qualidade da imagem é extremamente sensível ao alinhamento de O2 e O3 em relação um ao outro. Aqui, deve-se tomar cuidado para garantir que, primeiro, o ângulo de alinhamento de O3 a O2 corresponda à inclinação da folha de luz de excitação, fornecendo assim iluminação plana máxima em todo o FoV igualmente inclinado. Em segundo lugar, o O3 deve ser colocado na distância axial correta para manter um FoV plano com a maior área possível. Terceiro, o O3 deve ser colocado na distância lateral correta do O2 para maximizar o sinal que passa pela interface O2-O3.
Em termos de FoV utilizável, este sistema alcançou um campo plano e confiável com iluminação consistente em uma área de 80 μm x 80 μm. Essa área é menor do que o FoV máximo fornecido pela câmera, de modo que o FoV utilizável é indicado pela caixa amarela na Figura 13. Em termos de poder de resolução, esse sistema alcançou uma distância mínima resolúvel de 432 nm ao longo do eixo x e 421 nm ao longo do eixo y, que foi medida encontrando o sigma x e y médios das funções gaussianas de dispersão pontual (PSFs) no bom FoV e multiplicando por dois. Observamos que este sistema não foi otimizado em termos de seu NA total, o que significa que há espaço para melhorias significativas se os usuários desejarem um poder de resolução maior do que o que este sistema alcançou. Há uma infinidade de opções objetivas compatíveis para esse tipo de construção SOLS, muitas das quais contribuiriam para uma maior resolução do sistema, mas com as desvantagens de um custo mais alto, um FoV menor ou técnicas de alinhamento mais complicadas na interface do relé 8,11,13,20. Separadamente, se os usuários desejarem um FoV maior, a incorporação de um segundo galvo para permitir a digitalização 2D atingiria esse objetivo, mas exigiria óptica e mecânica de controle adicionais para serem integradas ao projeto32. Fornecemos mais detalhes sobre as modificações no sistema em nossa página do site, juntamente com links para outros recursos úteis sobre o processo de design23.
Além de melhorar os componentes específicos para este projeto em particular, seria muito viável adicionar outras técnicas ou modalidades de microscopia de alta resolução a esta construção. Uma dessas melhorias seria incorporar a iluminação multicomprimento de onda, o que envolveria o alinhamento de lasers de excitação adicionais ao caminho de excitação original8. Além disso, como esse tipo de desenho do SOLS deixa a amostra acessível, a adição de funções adicionais ao microscópio, incluindo, mas limitadamente, tweezing óptico, microfluídica e reometria, é relativamente simples 2,33.
Em comparação com a miríade de guias de folha de luz que foram publicados, este protocolo fornece instruções em um nível de compreensão que um usuário sem experiência óptica significativa pode achar útil. Ao tornar uma construção SOLS fácil de usar com recursos tradicionais de montagem de lâminas de amostra acessível a um público maior, esperamos permitir uma expansão ainda maior das aplicações da pesquisa baseada em SOLS em todos os campos em que o instrumento tem ou poderia ser utilizado. Mesmo com as aplicações dos instrumentos SOLS crescendo rapidamente em número 2,34,35, acreditamos que muitos benefícios e utilizações de instrumentos do tipo SOLS ainda permanecem inexplorados e expressam entusiasmo com as possibilidades desse tipo de instrumento avançar.
Divulgações
Os autores não têm nada a revelar. Todas as pesquisas foram realizadas na ausência de relações comerciais ou financeiras que pudessem ser interpretadas como conflito de interesses.
Agradecimentos
Este trabalho foi apoiado pelo National Science Foundation (NSF) RUI Award (DMR-2203791) para J.S. Somos gratos pela orientação fornecida pelo Dr. Bin Yang e pelo Dr. Manish Kumar durante o processo de alinhamento. Agradecemos à Dra. Jenny Ross e K. Alice Lindsay pelas instruções de preparação para os motores de cinesina.
Materiais
| Name | Company | Catalog Number | Comments |
| 1" Plano-Concave Lens f = -50 mm | Thorlabs | LC1715-A-ML | For alignment laser Estimated Cost: $49.5 |
| 1" Achromatic Doublet f = 100 mm (x3) | Thorlabs | AC254-100-A-ML | L2, L4 and alignment laser Estimated Cost: $342.42 |
| 1" Achromatic Doublet f = 125 mm | Thorlabs | AC254-125-A-ML | SL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | L3 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 150 mm | Thorlabs | AC254-150-A-ML | TL2 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 45 mm | Thorlabs | AC254-045-A-ML | L1 Estimated Cost: $114.14 |
| 1" Achromatic Doublet f = 75 mm | Thorlabs | AC254-075-A-ML | SL1 Estimated Cost: $114.14 |
| 1" Cylindrical Lens f = 100 mm | Thorlabs | LJ1567RM | CL3 Estimated Cost: $117.62 |
| 1" Cylindrical Lens f = 200 mm | Thorlabs | LJ1653RM | CL2 Estimated Cost: $111.22 |
| 1" Cylindrical Lens f = 50 mm | Thorlabs | LJ1695RM | CL1 Estimated Cost: $117.62 |
| 1" Mounted Pinhole, 30 µm Pinhole Diameter | Thorlabs | P30K | Estimated Cost: $77.08 |
| 1" Silver Mirror (x3) | Thorlabs | PF10-03-P01 | M1, M2, one for alignment Estimated Cost: $168.78 |
| 2" Elliptical Mirror | Thorlabs | PFE20-P01 | M3 Estimated Cost: $179.98 |
| 2" Post Holder (x11) | Thorlabs | PH2 | For custom laser mount, ND wheel, safety screens Estimated Cost: $98.45 |
| 2" Posts (x47) | Thorlabs | TR2 | For custom laser mount and optical components Estimated Cost: $277.3 |
| 3" Posts (x4) | Thorlabs | TR3 | For M3 supports and other mounts Estimated Cost: $24.6 |
| 3" Post Holder (x4) | Thorlabs | PH3 | Estimated Cost: $38.48 |
| 30 to 60 mm Cage Adapter | Thorlabs | LCP33 | To mount O1 Estimated Cost: $45.42 |
| 30mm Cage Filter Wheel | Thorlabs | CFW6 | To mount ND filters Estimated Cost: $172.36 |
| 30mm Cage Plate (x6) | Thorlabs | CP33 | To build alignment cage and alignment laser Estimated Cost: $114.54 |
| 30mm Right-Angle Kinematic Mirror Mount (x3) | Thorlabs | KCB1 | To mount M1 and M2 and for alignment laser Estimated Cost: $463.95 |
| 4" Post Holder (x30) | Thorlabs | PH4 | Estimated Cost: $320.1 |
| 561 nm Laser and Power Supply | Opto Engine LLC | MGL-FN-561-100mW | Excitation laser Estimated Cost: $6000 |
| 60mm Cage Plate (x2) | Thorlabs | LCP01 | To mount TL1 and M3 mount Estimated Cost: $88.52 |
| 60mm Right-Angle Kinematic Mirror Mount | Thorlabs | KCB2 | To mount M3 Estimated Cost: $187.26 |
| 90° Flip Mount | Thorlabs | TRF90 | For alignment laser Estimated Cost: $95.5 |
| Adapter with External C-Mount Threads and Internal SM1 Threads | Thorlabs | SM1A9 | To connect lens tube to camera Estimated Cost: $20.96 |
| Adapter with External SM1 Threads and Internal C-Mount Threads | Thorlabs | SM1A10 | To connect tube lens to lens mount Estimated Cost: $21.82 |
| Adapter with External SM1 Threads and Internal M25 Threads (x2) | Thorlabs | SM1A12 | To mount O1 and O2 Estimated Cost: $47.06 |
| Adapter with External SM1 Threads and Internal M26 Threads | Thorlabs | SM1A27 | To mount O3 Estimated Cost: $22.38 |
| Alignment Disk | Thorlabs | SM1A7 | Estimated Cost: $20.45 |
| Alignment Laser | BISKEE | https://www.amazon.com/Tactical-Presentation-Teaching-Interactive-Adjustable/dp/B09B1VXPNM Estimated Cost: $16.98 | |
| Autoluorescent Plastic Slide, Red | Chroma | 92001 | Estimated Cost: $20 |
| Beam Shutter | Thorlabs | SM1SH1 | To block laser light Estimated Cost: $65.8 |
| Cage Rotation Mount (x3) | Thorlabs | CRM1T | To mount CL1-3 Estimated Cost: $282.15 |
| Cage System Rods 1" (x8) | Thorlabs | ER1 | To mount M3 and O1 Estimated Cost: $44.8 |
| Cage System Rods 3" (x2) | Thorlabs | ER3 | To mount O3 Estimated Cost: $14.28 |
| Cage System Rods 4" (x4) | Thorlabs | ER4 | To mount slit Estimated Cost: $30.76 |
| Cage System Rods 8" (x2) | Thorlabs | ER8 | For tube lens alignment Estimated Cost: $25.3 |
| Cage System Rods 12" (x8) | Thorlabs | ER12 | For alignment cage Estimated Cost: $145.36 |
| Camera | Andor | Zyla 4.2 sCMOS | Estimated Cost: ~$14,000 |
| Clamping Fork (x35) | Thorlabs | CF125 | To clamp down post mounts Estimated Cost: $338.8 |
| Cover Glass, 22 x 22 mm | Corning | 2850-22 | For slide samples Estimated Cost: $265 |
| Dichroic | AVR | DI01-R405/488/561/635-25x36 | To split exciation/emission paths Estimated Cost: $965 |
| Dovetail Translation Stage | Thorlabs | DT12 | To translate pinhole Estimated Cost: $90.55 |
| Emission Filter | Thorlabs | FELHO600 | Estimated Cost: $140.99 |
| Frosted Glass Alignment Disk (x2) | Thorlabs | DG10-1500-H1 | For alignment cage and intermediate plane Estimated Cost: $75.14 |
| Function Generator | Hewlett-Packard | HP 33120A 15 MHz | To control galvo Estimated Cost: $900 |
| Galvanometer - 1D Large Beam Diameter System | Thorlabs | GVS011 | Estimated Cost: $1715.78 |
| Galvanometer Power Supply | Siglent | SPD3303C | Estimated Cost: $300 |
| Gelrite | Research Products International | G35020-100.0 | Gellan gum for 3D bead sample Estimated Cost: $68.25 |
| FIJI Software | Open-source | Download from https://imagej.net/software/fiji/downloads Estimated Cost: Free | |
| Hot Plate/ Stirrer | Corning | 6795-220 | For preparing sample solutions Estimated Cost: $550 |
| K-Cube Brushed Motor Controller | Thorlabs | KDC101 | Drives Z825B Estimated Cost: $757.51 |
| Kinematic Mount | Thorlabs | KM100S | To mount dichroic Estimated Cost: $92.01 |
| Kinesis Software | Thorlabs | Download from https://www.thorlabs.com/newgrouppage9.cfm?objectgroup_id=10285 Estimated Cost: Free | |
| Laser Light Blocker | Thorlabs | LB1 | For ND filter reflections Estimated Cost: $57.65 |
| Laser Mount | custom made | 3D printed Estimated Cost: N/A | |
| Laser Safety Screen (x2) | Thorlabs | TPS4 | For blocking stray laser light Estimated Cost: $92.02 |
| Laser Scanning Tube Lens | Thorlabs | TTL200MP | TL1 Estimated Cost: $1491 |
| Lens Mount (x10) | Thorlabs | LMR1 | To mount all lens and extra alignment mirror. Estimated Cost: $164.7 |
| Magnetic Ruler | Thorlabs | BHM4 | To check alignment Estimated Cost: $52.74 |
| Micro-Manager Software | Open-source | Download from https://micro-manager.org/Download_Micro-Manager_Latest_Release Estimated Cost: Free | |
| Microscope Slides | Thermo Fisher Scientific | 12550400 | For slide samples Estimated Cost: $123.9 |
| Microscope Stage | ASI | FTP-2000 with custom parts | To fine-translate samples Estimated Cost: ~$16,000 |
| Mini Vortex Mixer | VWR | 10153-688 | For sample preparation Estimated Cost: $152.64 |
| Motorized Actuator | Thorlabs | Z825B | To fine-translate M1 Estimated Cost: $729.07 |
| Mounted Standard Iris (x2) | Thorlabs | ID20 | At least 2 for alignment Estimated Cost: $118.02 |
| ND Filter Set | Thorlabs | NDK01 | To reduce excitation intensity Estimated Cost: $726.73 |
| Objective Lens 1 | Nikon | Plan Apo 60X/ 1.20 WI | O1 Estimated Cost: ~$15,000 |
| Objective Lens 2 | Nikon | TU Plan Fluor 100X/0.90 | O2 Estimated Cost: ~$6,000 |
| Objective Lens 3 | Mitutoyo | Plan Apo HR 50X/0.75 | O3 Estimated Cost: ~$6,800 |
| OPM Deskewing Software | Open-source | For image processing. Download from https://github.com/QI2lab/OPM Estimated Cost: Free | |
| Photodiode Power Sensor | Thorlabs | S121C | For measuring laser intensity Estimated Cost: $379.68 |
| Positive Grid Distortion Target | Thorlabs | R1L3S3P | Brightfield alignment Estimated Cost: $267.87 |
| Power Meter Digital Console | Thorlabs | PM100D | For measuring laser intensity Estimated Cost: $1245.48 |
| Rhodamine 6G | Thermo Scientific | J62315.14 | For fluorescent coated slide sample Estimated Cost: $27.7 |
| Right-Angle Clamp for Posts | Thorlabs | RA90 | For M3 support and flip down mirror Estimated Cost: $32.46 |
| RMS-Threaded Cage Plate (x2) | Thorlabs | CP42 | For alignment laser Estimated Cost: $70.56 |
| Shear Plate 2.5-5.0 mm | Thorlabs | SI050P | Estimated Cost: $182.85 |
| Shear Plate 5.0-10.0 mm | Thorlabs | SI100P | Estimated Cost: $201.47 |
| Shear Plate 10.0-25.4 mm | Thorlabs | SI254P | Estimated Cost: $236.42 |
| Shear Plate Viewing Screen | Thorlabs | SIVS | Estimated Cost: $337.74 |
| Shearing Interferometer with 1-3 mm Plate | Thorlabs | SI035 | For checking collimation Estimated Cost: $465.85 |
| Slip-On Post Collar (x35) | Thorlabs | R2 | To maintain post height Estimated Cost: $208.25 |
| Slit | Thorlabs | VA100 | Estimated Cost: $294.64 |
| Slotted Lens Tube, 3" | Thorlabs | SM1L30C | For alignment laser Estimated Cost: $77.45 |
| Square Mirror, 1 x 1" | https://www.amazon.com/Small-Square-Mirror-Pieces-Mosaic/dp/B07FBNMDC1/ref=asc_df_B07FBNMDC1/?tag=hyprod-20&linkCode=df0&hva did=642191768069&hvpos=&hvne tw=g&hvrand=1336734911900437 4691&hvpone=&hvptwo=&hvqmt= &hvdev=c&hvdvcmdl=&hvlocint=& hvlocphy=9031212&hvtargid=pla-1 943952718742&gclid=Cj0KCQiA6L yfBhC3ARIsAG4gkF_AYBpn5EdGL q3mc-RU-nanT5vM4ac9r3-obbzqJoWKPkIPIJU6e1caAjWmEA Lw_wcB&th=1 Estimated Cost: $14.76 | ||
| Stackable Lens Tube 1/2" (x3) | Thorlabs | SM1L05 | To mount CL1-3 Estimated Cost: $40.86 |
| Stackable Lens Tube 1" | Thorlabs | SM1L10 | To mount O3 Estimated Cost: $15.41 |
| Stackable Lens Tube 2" (x2) | Thorlabs | SM1L20 | For camera path Estimated Cost: $35.7 |
| Studded Pedestal Base Adapter (x37) | Thorlabs | BE1 | To attach post mounts to table Estimated Cost: $400.71 |
| Translating Lens Mount (x3) | Thorlabs | LM1XY | To fine-translate pinhole, O2 and O3 Estimated Cost: $441 |
| Translation Stage with Standard Micrometer (x2) | Thorlabs | PT1/M | TS1-2 Estimated Cost: $647.54 |
| Travel Manual Translation Stage | Thorlabs | CT1A | O3 cage translation mount Estimated Cost: $497.3 |
| Tube Lens | Nikon | MXA20696 | TL3 Estimated Cost: $359 |
| White Mounted LED | Thorlabs | MNWHL4 | Brightfield light source Estimated Cost: $171.28 |
| TOTAL ESTIMATED COST: $84,858.98 | |||
| The authors note that many parts were bought used. Here, we have attempted to reflect the retail price of all items, so the total cost can be greatly reduced by buying particular items used, especially the more expensive ones. | |||
| OPTIONAL COMPONENTS | |||
| Grasshopper3 USB3 | FLIR | GS3-U3-23S6C-C | For diagnostic checks during alignment. Acquisiton camera can be used instead, but requires realignment afterwards. Estimated Cost: $1089 |
Referências
- Girkin, J. M., Carvalho, M. T. The light-sheet microscopy revolution. Journal Optics. 20 (5), 053002 (2018).
- You, R., McGorty, R. Light sheet fluorescence microscopy illuminating soft matter. Frontiers in Physics. 9, 760834 (2021).
- Fuchs, E., Jaffe, J. S., Long, R. A., Azam, F. Thin laser light sheet microscope for microbial oceanography. Optics Express. 10 (2), 145-154 (2002).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical sectioning deep inside live embryos by selective plane illumination microscopy. Science. 305 (5686), 1007-1009 (2004).
- Dunsby, C. Optically sectioned imaging by oblique plane microscopy. Optics Express. 16 (25), 20306-20316 (2008).
- Bouchard, M. B., et al. Swept confocally-aligned planar excitation (SCAPE) microscopy for high-speed volumetric imaging of behaving organisms. Nature Photonics. 9 (2), 113-119 (2015).
- Smith, C. W., Botcherby, E. J., Wilson, T. Resolution of oblique-plane images in sectioning microscopy. Optics Express. 19 (3), 2662-2669 (2011).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Wu, Y., et al. Simultaneous multiview capture and fusion improves spatial resolution in wide-field and light-sheet microscopy. Optica. 3 (8), 897-910 (2016).
- Sahasrabudhe, A., Vittal, V., Ghose, A. Peeping in on the cytoskeleton: Light microscopy approaches to actin and microtubule organization. Current Science. 105 (11), 1562-1570 (2013).
- Kumar, M., Kishore, S., Nasenbeny, J., McLean, D. L., Kozorovitskiy, Y. Integrated one- and two-photon scanned oblique plane illumination (SOPi) microscopy for rapid volumetric imaging. Optics Express. 26 (10), 13027-13041 (2018).
- Kim, J., et al. Oblique-plane single-molecule localization microscopy for tissues and small intact animals. Nature Methods. 16 (9), 853-857 (2019).
- Sapoznik, E., et al. A versatile oblique plane microscope for large-scale and high-resolution imaging of subcellular dynamics. eLife. 9, e57681 (2020).
- Bernardello, M., Marsal, M., Gualda, E. J., Loza-Alvarez, P. Light-sheet fluorescence microscopy for the in vivo study of microtubule dynamics in the zebrafish embryo. Biomedical Optics Express. 12 (10), 6237-6254 (2021).
- Shelden, E. A., Colburn, Z. T., Jones, J. C. R. Focusing super resolution on the cytoskeleton. F1000Res. 5, (2016).
- Wulstein, D. M., Regan, K. E., Garamella, J., McGorty, R. J., Robertson-Anderson, R. M. Topology-dependent anomalous dynamics of ring and linear DNA are sensitive to cytoskeleton crosslinking. Science Advances. 5 (12), (2019).
- Sheung, J. Y., Garamella, J., Kahl, S. K., Lee, B. Y., McGorty, R. J., Robertson-Anderson, R. M. Motor-driven advection competes with crowding to drive spatiotemporally heterogeneous transport in cytoskeleton composites. Frontiers in Physics. 10, 1055441 (2022).
- Zeiss Lightsheet 7. Light-Sheet Multiview Imaging of Living and Cleared Specimens. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lightsheet-7.html (2023)
- Zeiss Lattice Lightsheet 7. Long-Term Volumetric Imaging of Living Cells. Zeiss Available from: https://www.zeiss.com/microscopy/en/products/light-microscopes/light-sheet-microscopes/lattice-lightsheet-7.html (2023)
- Kumar, M., Kishore, S., McLean, D. L., Kozorovitskiy, Y. Crossbill: An open access single objective light-sheet microscopy platform. bioRxiv. , (2021).
- Olarte, O. E., Andilla, J., Gualda, E. J., Loza-Alvarez, P. Light-sheet microscopy: A tutorial. Advances in Optics and Photonics. 10 (1), 111-179 (2018).
- Pitrone, P. G., et al. OpenSPIM: An open-access light-sheet microscopy platform. Nature Methods. 10 (7), 598-599 (2013).
- Single Objective Light Sheet Microscope (SOLS) Guide. Sheung Lab Available from: https://sites.google.com/view/sheunglab/microscopy/single-objective-light-microscope-sols (2023)
- Lamb, J. R., Ward, E. N., Kaminski, C. F. Open-source software package for on-the-fly deskewing and live viewing of volumetric lightsheet microscopy data. Biomedical Optics Express. 14 (2), 834-845 (2023).
- . Harvard University. Mitchison Lab Available from: https://mitchison.hms.harvard.edu/home (2023)
- Watkins, S. C., St. Croix, C. M. Light sheet imaging comes of age. Journal of Cell Biology. 217 (5), 1567-1569 (2018).
- Ndlec, F. J., Surrey, T., Maggs, A. C., Leibler, S. Self-organization of microtubules and motors. Nature. 389 (6648), 305-308 (1997).
- Sanchez, T., Chen, D. T. N., DeCamp, S. J., Heymann, M., Dogic, Z. Spontaneous motion in hierarchically assembled active matter. Nature. 491 (7424), 431-434 (2012).
- Berezney, J., Goode, B. L., Fraden, S., Dogic, Z. Extensile to contractile transition in active microtubule-actin composites generates layered asters with programmable lifetimes. Proceedings of the National Academy of Sciences of the United States of America. 119 (5), e2115895119 (2022).
- Kim, K., et al. Isomorphic coalescence of aster cores formed in vitro from microtubules and kinesin motors. Physical Biology. 13 (5), 056002 (2016).
- Millett-Sikking, A., et al. . High NA single-objective lightsheet. , (2019).
- Bourgenot, C., Saunter, C. D., Taylor, J. M., Girkin, J. M., Love, G. D. 3D adaptive optics in a light sheet microscope. Optics Express. 20 (12), 13252-13261 (2012).
- Bernardello, M., Gualda, E. J., Loza-Alvarez, P. Modular multimodal platform for classical and high throughput light sheet microscopy. Scientific Reports. 12 (1), 1969 (2022).
- Crombez, S., Leclerc, P., Ray, C., Ducros, N. Computational hyperspectral light-sheet microscopy. Optics Express. 30 (4), 4856-4866 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
SOBRE A JoVE
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados