É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Cultura não fracionada em massa de músculo esquelético de camundongo para recapitular nicho e quiescência de células-tronco
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O músculo esquelético compreende vários tipos celulares, incluindo células-tronco residentes, cada uma com uma contribuição especial para a homeostase e regeneração muscular. Aqui, a cultura 2D de células-tronco musculares e o nicho de células musculares em um ambiente ex vivo que preserva muitas das características fisiológicas, in vivo e ambientais são descritas.
Resumo
O músculo esquelético é o maior tecido do corpo e desempenha múltiplas funções, desde a locomoção até o controle da temperatura corporal. Sua funcionalidade e recuperação de lesões dependem de uma infinidade de tipos celulares e de sinais moleculares entre as células musculares centrais (miofibras, células-tronco musculares) e seu nicho. A maioria dos cenários experimentais não preserva esse microambiente fisiológico complexo, e tampouco permite o estudo ex vivo de células-tronco musculares em quiescência, um estado celular crucial para elas. Aqui, um protocolo é delineado para o cultivo ex vivo de células-tronco musculares com componentes celulares de seu nicho. Através da quebra mecânica e enzimática dos músculos, obtém-se uma mistura de tipos celulares, que é colocada em cultura 2D. A imunomarcação mostra que, dentro de 1 semana, várias células de nicho estão presentes em cultura ao lado de miofibras e, importante, células Pax7-positivas que exibem as características de células-tronco musculares quiescentes. Essas propriedades únicas tornam este protocolo uma ferramenta poderosa para amplificação celular e geração de células-tronco quiescentes que podem ser usadas para abordar questões fundamentais e translacionais.
Introdução
O movimento, a respiração, o metabolismo, a postura corporal e a manutenção da temperatura corporal dependem do músculo esquelético, e o mau funcionamento do músculo esquelético pode, portanto, causar patologias debilitantes (por exemplo, miopatias, distrofias musculares, etc.) 1. Dadas suas funções essenciais e abundância, o músculo esquelético tem chamado a atenção de laboratórios de pesquisa em todo o mundo que se esforçam para entender os principais aspectos que suportam a função muscular normal e podem servir como alvos terapêuticos. Além disso, o músculo esquelético é um modelo amplamente utilizado para estudar a regeneração e a função das células-tronco, uma vez que o músculo saudável pode se auto-reparar completamente após lesão e degeneração completas, principalmente devido às suas células-troncoresidentes2; São também chamadas de células satélites e estão localizadas sob a lâmina basal, na periferia das fibrasmusculares3.
As células centrais do músculo esquelético adulto são as miofibras (células multinucleares sinciciais longas) e as células satélites (células-tronco com potencial miogênico que ficam quiescentes até que uma lesão as ative). Estas últimas células são as células centrais da regeneração muscular, e esse processo não pode ocorrer na sua ausência 4,5,6,7. Em seu microambiente imediato, existem múltiplos tipos celulares e fatores moleculares que sinalizam para eles. Esse nicho vai se estabelecendo ao longo do desenvolvimento e até a idadeadulta8. O músculo adulto contém vários tipos celulares (células endoteliais, pericitos, macrófagos, progenitores fibroadipogênicos-FAPs, células T reguladoras, etc.) 9,10 e componentes da matriz extracelular (lamininas, colágenos, fibronectina, fibrilinas, periostina, etc.) 11 que interagem entre si e com as células satélites no contexto da saúde, doença e regeneração.
Preservar esse nicho complexo em ambientes experimentais é fundamental, mas desafiador. Igualmente difícil é manter ou retornar à quiescência, um estado celular crítico para as células satélites9. Vários métodos foram introduzidos para enfrentar parcialmente esses desafios, cada um com suas vantagens e desvantagens (detalhado na seção de discussão). Aqui, é apresentado um método que pode superar parcialmente essas duas barreiras. Os músculos são inicialmente colhidos e, em seguida, quebrados mecânica e enzimaticamente antes que a mistura de células heterogêneas seja colocada em cultura. Ao longo da cultura, muitos tipos celulares do nicho são detectados, e células satélites que retornaram à quiescência são observadas. Como última etapa do protocolo, são apresentadas as etapas de imunofluorescência que permitem a detecção de cada tipo celular por meio do uso de marcadores universalmente aceitos.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todas as experiências cumpriram os regulamentos animais franceses e da UE no Institut Mondor de Recherche Biomédicale (INSERM U955), nomeadamente a diretiva 2010/63/UE. Os animais foram mantidos em ambiente controlado e enriquecido nos biotérios com os números de certificação A94 028 379 e D94-028-028; Eles foram manuseados apenas por pesquisadores autorizados e cuidadores de animais, e foram inspecionados visualmente pelo pessoal do alojamento de animais em busca de sinais de desconforto durante sua vida. Foram eutanasiados por luxação cervical antes da dissecção. Nenhum procedimento intervencionista foi realizado durante a vida dos animais; assim, não era necessária a aprovação do procedimento por um Comitê de Ética e pelo Ministério do Ensino Superior, Pesquisa e Inovação da França. De fato, nenhuma autorização ética é necessária para a eutanásia e dissecção post-mortem, de acordo com a diretiva 2010/63/UE. Os resultados apresentados neste manuscrito são da linhagem selvagem C57BL/6NRj (ver Tabela de Materiais) e da linhagem transgênica Tg:Pax7-nGFP 12 (criada por nossa equipe). O protocolo foi aplicado em camundongos machos e fêmeas com idades entre 8 e 12 semanas de idade.
1. Pré-digestão da preparação de reagentes e equipamentos
- Borrife as ferramentas de dissecção (tesouras retas e curvas, pinças, ver Tabela de Materiais) com etanol 70% e seque-as com papel. Revestir uma placa de cortiça com papel alumínio e manter placas de Petri de 10 cm (uma por animal) por perto. Ter papel e 70% de etanol ao alcance.
OBS: Ao final da dissecção, enxágue as ferramentas de dissecção com água, pulverize-as com etanol 70% e seque-as com papel. - Definir um banho-maria rotativo a 37 °C e preparar a mistura de digestão (20 mL/animal) combinando DMEM com penicilina-estreptomicina a 1%, colagenase a 0,5 U/mL, dispase de 3 U/mL (ver Tabela de Materiais) e BSA a 0,2% em tubo(s) de 50 mL.
- Passar a mistura de digestão através de um filtro de 0,22 μm em uma capela de cultura celular.
NOTA: Recomenda-se preparar a mistura de digestão fresca sempre.
2. Preparação de reagentes e equipamentos pós-digestão
- Após a digestão, a mistura pode ser congelada ou cultivada. Para congelamento, preparar DMSO a 10%: soro fetal bovino (SFB) a 90%, bem como um conjunto de criotubos (1 mL de suspensão celular por 2 mL de criotubo). Para a cultura, preparar meio de cultura (DMEM suplementado com penicilina-estreptomicina a 1%, 4 ng/mL de bFGF e SFB a 20%) e um conjunto de placas de 8 poços. As placas devem ser revestidas antes de chapear as células (os pormenores são fornecidos na etapa 7.1).
- Para a coloração, preparar paraformaldeído (PFA) a 4% em solução salina tamponada com fosfato (PBS) (0,15 mL/poço da placa de 8 poços) e solução de bloqueio (albumina de soro bovino livre de IgG a 5% [BSA] em PBS; 0,15 mL/poço da placa de 8 poços).
CUIDADO: Não respire o pó de PFA; Prepare-o e manuseie-o sob um capô químico.
3. Dissecção
- Borrifar o animal eutanasiado com etanol 70%. Faça uma incisão horizontal (lado esquerdo do corpo para o lado direito) com tesouras grandes ao nível do abdômen, e corte ao redor da cintura. Retirar a pele dos membros pélvicos para revelar a musculatura (Figura 1A).
- Coloque o animal sobre a placa de cortiça coberta de papel alumínio e fixe o membro anterior e o membro posterior opostos. Remova rapidamente todos os músculos dos membros posteriores (frente e costas) em uma placa de Petri de 10 cm colocada sobre gelo (Figura 1B,C). Tome especial cuidado para remover o tecido adiposo das áreas ao redor do quadríceps e dos músculos posteriores. Fáscia, nervos e tendões também podem ser removidos neste momento se isso não comprometer o tempo total gasto na dissecção.
NOTA: Um tempo ideal de dissecção para ambos os membros posteriores deve ser em torno de 15-20 min. Aconselha-se que o tempo de dissecção não exceda 30 min. - Adicione gotas de DMEM aos músculos ocasionalmente para mantê-los úmidos, mas não muito, pois isso tornará o corte difícil. Repita para o outro membro posterior. Uma vez que todos os músculos de um animal estejam na placa de Petri (Figura 1D), pique-os finamente com tesoura por 7-10 min para obter um homogeneizado liso (Figura 1E).
NOTA: Neste protocolo, DMEM suplementado com L-glutamina, piruvato, e 4,5 g/L D-glicose é usado.
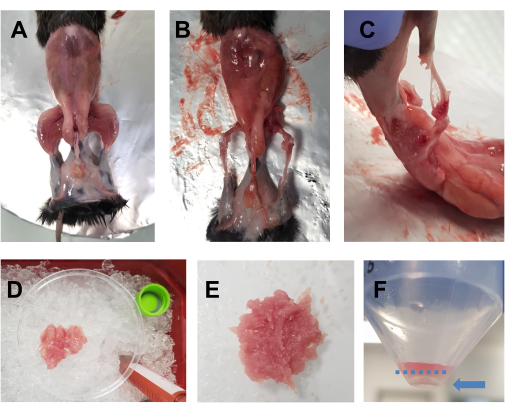
Figura 1: Preparo muscular pré-cultura. (A) A pele é removida para revelar os músculos dos membros posteriores, conforme descrito no passo 3.1. (B,C) Todos os músculos dos membros posteriores são colhidos (B) ao redor e (C) entre os ossos, conforme descrito no passo 3.2. (D) Os músculos colhidos são colocados em uma placa de Petri de 10 cm sobre gelo com gotas de DMEM para mantê-los úmidos, conforme descrito no passo 3.3. (E) Os músculos são finamente picados com tesoura até obter uma pasta lisa com a consistência retratada nesta imagem. (F) Imagem do pellet após a centrifugação final; A seta azul destaca a pelota, que está contra o tubo, sob a linha azul tracejada. Clique aqui para ver uma versão maior desta figura.
4. Digestão
NOTA: No final da digestão, é necessária uma centrífuga a 4 °C, um balde de gelo, três filtros de células (100 um, 70 um, 40 um) e três tubos de 50 ml (por animal) para a secção 5.
- Preparar e filtrar a mistura de digestão conforme descrito na etapa 1.2. Mantenha a mistura no gelo.
- Depois de cortados todos os músculos, coloque o homogeneizado num tubo de 50 ml com 20 ml de mistura de digestão. Embrulhe as bordas da tampa com filme flexível para evitar vazamentos e coloque o tubo em banho-maria de agitação a 37 °C em velocidade baixa a média (50 rpm).
- Após 1 h a 37 °C, abra a tampa e misture pipetando suavemente sete vezes para cima e para baixo com uma pipeta de 10 mL para obter uma mistura homogênea. Aplique uma nova película ao redor da tampa e coloque-a novamente no banho de água agitada. Após 1 h, retire o tubo e desligue o banho.
NOTA: Para cultura, utilize este tempo de incubação para revestir as placas conforme descrito no passo 7.1 antes de passar para o ponto 5.
5. Filtração
- Encher o tubo de digestão com DMEM frio (suplementado com penicilina-estreptomicina a 1%) até 50 mL. Misture invertendo o tubo três vezes. Mantenha o DMEM em um balde de gelo para as próximas etapas.
- Coloque um filtro celular de 100 μm em um novo tubo de 50 mL. Passe a mistura digerida através do filtro de células para o novo tubo. Centrifugar a 600 x g durante 5 min a 4 °C. Despeje o sobrenadante em um recipiente de resíduos líquidos.
- Ressuspender o pellet em 1 mL de DMEM gelado (suplementado com penicilina-estreptomicina a 1%). Encher o tubo até 50 mL com o mesmo DMEM. NOTA: Se a centrifugação for ignorada, a próxima pastilha será mais difícil de identificar e manter.
- Coloque um filtro celular de 70 μm em um novo tubo de 50 mL. Passe a mistura centrifugada/ressuspensa através do filtro de células para o novo tubo. Centrifugar a 80 x g durante 5 min a 4 °C.
NOTA: Esta etapa não é obrigatória, mas é recomendada para eliminar detritos celulares. - Coloque um filtro celular de 40 μm em um novo tubo de 50 mL. Passe o sobrenadante através do filtro celular para o novo tubo. Centrifugar a 600 x g por 5 min a 4 °C, despejar o sobrenadante em um recipiente de resíduos líquidos e ressuspender o pellet em FBS sob o capô de cultura. O pellet é muito pequeno nesta etapa (Figura 1F).
NOTA: A filtragem através do filtro de 40 μm remove detritos, o que daria um sinal inespecífico na coloração posterior das culturas.
6. Congelamento (opcional)
NOTA: A secção 6 é opcional. O protocolo pode ser pausado após a filtragem, mas isso pode reduzir a sobrevivência celular e o sucesso da cultura.
- Adicionar DMSO para obter uma relação DMSO:90% FBS de 10% e transferir para criotubos (1 mL de pellet ressuspendido por 2 mL de criotubo).
- Coloque o criotubo a -80 °C numa caixa de poliestireno durante a noite. Passe para -150 °C no dia seguinte para armazenamento de longo prazo.
NOTA: O armazenamento de curto prazo a -80 °C também é possível. - Ao iniciar a cultura, descongelar rapidamente o criotubo em banho-maria a 37 °C até que a suspensão celular tenha descongelado. Misturar com 4 mL de DMEM sob a coifa de cultura. Gire a 600 x g por 5 min a 4 °C. Pipetar o sobrenadante e continuar como descrito no passo 7.2.
7. Cultivo
NOTA: Espera-se que as suspensões de células congeladas ou frescas encham de 24 a 32 poços de três a quatro placas de 8 poços.
- Revestir placas de 8 poços com a solução de revestimento, que deve ser descongelada a 4 °C ou no gelo (a solução de revestimento de estoque é normalmente mantida a -20 °C). Adicione 0,4 mL de solução de revestimento a um poço e pipete-o de poço para poço. Depois de transferir a solução de revestimento através de todos os poços, ela pode ser recolhida e recongelada para culturas futuras. Manter as placas revestidas a 37 °C durante 30 minutos antes de plaquear as células.
- Adicionar DMEM (suplementado com 1% de penicilina-estreptomicina) suplementado com 4 ng/mL de bFGF (ver Tabela de Materiais) à suspensão de células FBS para obter uma relação FBS:80% DMEM de 20%.
NOTA: Embora a adição de bFGF possa ser benéfica em culturas primárias de mioblastos e na produção de células satélites em culturas a granel, sua adição é opcional, pois sua omissão em culturas em massa de ~7 dias não compromete severamente o rendimento celular. - Placa de 0,4 mL da suspensão por poço (a partir do passo 7.2) nas placas revestidas de 8 poços.
NOTA: Calcular 30cm2 de cultura por animal para preparações congeladas e frescas. - Incubar as culturas a 37 °C com 5% de CO2 por até 10 dias, trocando o meio todos os dias após a cultura começar a mudar para uma cor amarelada (geralmente 5-7 dias).
NOTA: Para quantificar as células na fase S do ciclo celular13, adicionar 10 μM EdU 2 h antes da fixação. Para capturar a primeira fase S, adicione 10 μM de EdU do revestimento e fixe em 40 h de cultura.
8. Fixação
NOTA: As secções 8-10 devem ser conduzidas à temperatura ambiente, salvo indicação em contrário.
- Pipetar o meio de cultura e fixar as células com PFA a 4% (0,15 mL/poço).
CUIDADO: Adicione PFA sob uma capa química.
NOTA: Se todos os poços estiverem fixados ao mesmo tempo, incubar com PFA à temperatura ambiente por 10 min. Se os poços forem fixados em momentos diferentes, adicione PFA aos poços a serem fixados e mantenha a placa na incubadora a 37 °C por 5 min. - Pipetar o PFA e adicionar PBS por 10 s (0,15 mL/poço). Pipetar o PBS e adicionar PBS fresco por 5 min (0,15 mL/poço).
NOTA: Se todos os poços estiverem fixados ao mesmo tempo, incubar com PBS à temperatura ambiente. Se os poços forem fixados em pontos de tempo diferentes, adicione PBS aos poços fixos e mantenha a placa na incubadora a 37 °C por 5 min. Em seguida, adicione 0,4 mL de PBS e mantenha a placa na incubadora por até 1 semana.
9. Permeabilização e bloqueio
- Quando estiver pronto para manchar, pipetar o PBS e permeabilizar com TritonX 100 a 0,5% em PBS (0,15 mL/poço) por 8 min. Pipetar o TritonX 100, enxaguar com PBS por 10 s (0,15 mL/poço), pipetar o PBS e lavar com PBS por 5 min (0,15 mL/poço).
- Bloqueio com BSA livre de IgG a 5% em PBS por 30-60 min (0,15 mL/poço).
10. Coloração
- Pipetar a BSA e adicionar a mistura de anticorpos primários diluída em PBS (0,15 mL/poço) (ver Tabela de Materiais; diluições: anti-CD31 1:100, anti-FOSB 1:200, anti-GFP 1:1.000, anti-KI67 1:1.000, anti-MyHC 1:400, anti-MYOD 1:200, anti-MYOG 1:150, anti-PAX7 1:100, anti-PDGFRa 1:50) para incubação noturna a 4 °C.
NOTA: Após a incubação do anticorpo, recolher a mistura de anticorpos, adicionar azida sódica e manter a 4 °C ou -20 °C (de acordo com as instruções do fabricante do anticorpo) para futura reutilização. - Pipetar a mistura de anticorpos, enxaguar com PBS por 10 s (0,15 mL/poço), pipetar o PBS e lavar com PBS por 5 min (0,15 mL/poço).
- Pipetar o PBS de lavagem, adicionar a mistura de anticorpos secundários (cabra anti-rato Alexa Fluor 488, cabra anti-coelho Alexa Fluor 555, cabra anti-rato Alexa Fluor 647, cabra anti-rato Alexa Fluor 555, cabra anti-frango Alexa Fluor 488, todos usados em diluições de 1:500-1.000) e marcador de núcleo (por exemplo, DAPI) diluído em PBS (0,15 mL/poço) (ver Tabela de Materiais), e incubar por 1 h em temperatura ambiente, protegido da luz.
- Pipetar a mistura de anticorpos secundários, enxaguar com PBS por 10 s (0,15 mL/poço), pipetar o PBS, lavar com PBS por 5 min (0,15 mL/poço), pipetar o PBS e montar.
NOTA: Se forem usadas placas de 8 poços com separadores removíveis, descasque os separadores antes de montar.
Access restricted. Please log in or start a trial to view this content.
Resultados
Este protocolo permite o cultivo de células musculares, preservando as células satélites e a maioria das células de seu nicho endógeno. A Figura 2 resume as principais etapas do protocolo, enquanto partes essenciais da dissecção e digestão são apresentadas na Figura 1. A dissecção da musculatura dos membros pélvicos é recomendada (Figura 1A-C), pois esse grupo muscular é bem estudado e...
Access restricted. Please log in or start a trial to view this content.
Discussão
A função muscular esquelética adulta é sustentada por um conjunto finamente orquestrado de interações celulares e sinais moleculares. Aqui, é apresentado um método que permite o estudo desses parâmetros em um ambiente ex vivo que se assemelha muito ao microambiente fisiológico.
Vários grupos têm relatado métodos in vitro para cultivo de células miogênicas. Estes métodos visavam isolar células satélites para estudar suas propriedades progenitoras miogênicas....
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram não haver conflitos de interesse.
Agradecimentos
Para a Figura 2, foram utilizados modelos da Servier Medical Art (https://smart.servier.com/). O laboratório FR é apoiado pela Association Française contre les Myopathies - AFM via TRANSLAMUSCLE (subsídios 19507 e 22946), pela Fondation pour la Recherche Médicale - FRM (EQU202003010217, ENV202004011730, ECO201806006793), pela Agence Nationale pour la Recherche - ANR (ANR-21-CE13-0006-02, ANR-19-CE13-0010, ANR-10-LABX-73) e pela La Ligue Contre le Cancer (IP/SC-17130). Os financiadores acima não tiveram nenhum papel na concepção, coleta, análise, interpretação ou relato deste estudo ou na redação deste manuscrito.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| anti-CD31 | BD | 550274 | dilution 1:100 |
| anti-FOSB | Santa Cruz | sc-7203 | dilution 1:200 |
| anti-GFP | Abcam | ab13970 | dilution 1:1000 |
| anti-Ki67 | Abcam | ab16667 | dilution 1:1000 |
| anti-MyHC | DSHB | MF20-c | dilution 1:400 |
| anti-MYOD | Active Motif | 39991 | dilution 1:200 |
| anti-MYOG | Santa Cruz | sc-576 | dilution 1:150 |
| anti-Pax7 | Santa Cruz | sc-81648 | dilution 1:100 |
| anti-PDGFRα | Invitrogen | PA5-16571 | dilution 1:50 |
| b-FGF | Peprotech | 450-33 | concentration 4 ng/mL |
| Bovine serum albumin (BSA) – used for digestion | Sigma Aldrich | A7906-1006 | concentration 0.2% |
| BSA IgG-free, protease-free – used for staining | Jackson ImmunoResearch | 001-000-162 | concentration 5% |
| Cell strainer 40 um | Dominique Dutscher | 352340 | |
| Cell strainer 70 um | Dominique Dutscher | 352350 | |
| Cell strainer 100 um | Dominique Dutscher | 352360 | |
| Collagenase | Roche | 10103586001 | concentration 0.5 U/mL |
| Culture plate | Sarstedt | 94.6140.802 | |
| Dimethyl sulfoxide (DMSO) | Euromedex | UD8050-05-A | |
| Dispase | Roche | 4942078001 | concentration 3 U/mL |
| Dissection forceps size 5 | Fine Science Tools | 91150-20 | |
| Dissection forceps size 55 | Fine Science Tools | 11295-51 | |
| Dissection scissors (big, straight) | Fine Science Tools | 9146-11 | ideal for chopping |
| Dissection scissors (small, curved) | Fine Science Tools | 15017-10 | |
| Dissection scissors (small, straight) | Fine Science Tools | 14084-08 | |
| Dulbecco's Modified Eagle's Medium (DMEM) | ThermoFisher | 41966-029 | |
| EdU Click-iT kit | ThermoFisher | C10340 | |
| Fetal bovine serum – option 1 | Eurobio | CVF00-01 | |
| Fetal bovine serum – option 2 | Gibco | 10270-106 | |
| Matrigel | Corning Life Sciences | 354234 | coating solution |
| Parafilm | Dominique Dutscher | 090261 | flexible film |
| Paraformaldehyde – option 1 | PanReac AppliChem ITW Reagents | 211511.1209 | concentration 4% |
| Paraformaldeyde – option 2 | ThermoFisher | 28908 | concentration 4% |
| Penicillin streptomycin | Gibco | 15140-122 | |
| Shaking water bath | ThermoFisher | TSSWB27 | |
| TritonX100 | Sigma Aldrich | T8532-500 ML | concentration 0.5% |
| Wild-type mice | Janvier | C57BL/6NRj |
Referências
- Frontera, W. R., Ochala, J. Skeletal muscle: A brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Forcina, L., Cosentino, M., Musarò, A. Mechanisms regulating muscle regeneration: Insights into the interrelated and time-dependent phases of tissue healing. Cells. 9 (5), 1297(2020).
- Mauro, A. Satellite cell of skeletal muscle fibers. Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Lepper, C., Partridge, T. A., Fan, C. -M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- McCarthy, J. J., et al. Effective fiber hypertrophy in satellite cell-depleted skeletal muscle. Development. 138 (17), 3657-3666 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Hicks, M. R., Pyle, A. D. The emergence of the stem cell niche. Trends in Cell Biology. 33 (22), 112-123 (2022).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692(2021).
- Gama, J. F. G., et al. Role of regulatory T cells in skeletal muscle regeneration: A systematic review. Biomolecules. 12 (6), 817(2022).
- Loreti, M., Sacco, A. The jam session between muscle stem cells and the extracellular matrix in the tissue microenvironment. NPJ Regenerative Medicine. 7 (1), 16(2022).
- Sambasivan, R., et al. Distinct regulatory cascades govern extraocular and pharyngeal arch muscle progenitor cell fates. Developmental Cell. 16 (6), 810-821 (2009).
- Pereira, P. D., et al. Quantification of cell cycle kinetics by EdU (5-ethynyl-2'-deoxyuridine)-coupled-fluorescence-intensity analysis. Oncotarget. 8 (25), 40514-40532 (2017).
- Bismuth, K., Relaix, F. Genetic regulation of skeletal muscle development. Experimental Cell Research. 316 (18), 3081-3086 (2010).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Lertkiatmongkol, P., Liao, D., Mei, H., Hu, Y., Newman, P. J. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31). Current Opinion in Hematology. 23 (3), 253-259 (2016).
- Scholzen, T., Gerdes, J. The Ki-67 protein: From the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Abou-Khalil, R., Le Grand, F., Chazaud, B. Human and murine skeletal muscle reserve cells. Stem Cell Niche. 1035, 165-177 (2013).
- Pasut, A., Oleynik, P., Rudnicki, M. A. Isolation of muscle stem cells by fluorescence activated cell sorting cytometry. Methods in Molecular Biology. 798, 53-64 (2011).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Qu, Y., Edwards, K., Barrow, J. Isolation, culture, and use of primary murine myoblasts in small-molecule screens. STAR Protocols. 4 (2), 102149(2023).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: Background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2011).
- Saclier, M., Theret, M., Mounier, R., Chazaud, B. Effects of macrophage conditioned-medium on murine and human muscle cells: analysis of proliferation, differentiation, and fusion. Methods in Molecular Biology. 1556, 317-327 (2017).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Molecular Cell. 74 (3), 609-621 (2019).
- Tabula Muris Consortium et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Brunetti, J., Koenig, S., Monnier, A., Frieden, M. Nanopattern surface improves cultured human myotube maturation. Skeletal Muscle. 11 (1), 12(2021).
- Denes, L. T., et al. Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation. Skeletal Muscle. 9 (1), 17(2019).
- LaFramboise, W. A., et al. Effect of muscle origin and phenotype on satellite cell muscle-specific gene expression. Journal of Molecular and Cellular Cardiology. 35 (10), 1307-1318 (2003).
- Azhar, M., Wardhani, B. W. K., Renesteen, E. The regenerative potential of Pax3/Pax7 on skeletal muscle injury. Journal of Generic Engineering and Biotechnology. 20 (1), 143(2022).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198(2016).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados