É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Quantificando a complacência e a distensibilidade da veia cava inferior em um modelo ovino in vivo usando angiografia 3D
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo permite a quantificação in vivo da complacência venosa e da distensibilidade usando cateterismo e angiografia 3D como procedimento de sobrevida, permitindo uma variedade de aplicações potenciais.
Resumo
Os enxertos vasculares sintéticos superam alguns desafios de aloenxertos, autoenxertos e xenoenxertos, mas geralmente são mais rígidos e menos complacentes do que o vaso nativo no qual são implantados. A correspondência de complacência com o vaso nativo está emergindo como uma propriedade fundamental para o sucesso do enxerto. O padrão ouro atual para avaliar a conformidade do vaso envolve a excisão do vaso e o teste mecânico biaxial ex vivo . Desenvolvemos um método in vivo para avaliar a complacência e a distensibilidade venosa que reflete melhor a fisiologia natural e leva em consideração o impacto de uma mudança de pressão causada pelo fluxo sanguíneo e por quaisquer alterações morfológicas presentes.
Este método é projetado como um procedimento de sobrevivência, facilitando estudos longitudinais e potencialmente reduzindo a necessidade de uso de animais. Nosso método envolve a injeção de um bolus de soro fisiológico de 20 mL/kg na vasculatura venosa, seguida da aquisição de angiografias 3D pré e pós-bolus para observar alterações induzidas pelo bolus, concomitantemente com medidas de pressão intravascular nas regiões-alvo. Podemos então medir a circunferência e a área da seção transversal do vaso pré e pós-bolo.
Com esses dados e a pressão intravascular, podemos calcular a complacência e a distensibilidade com equações específicas. Este método foi usado para comparar a complacência e a distensibilidade da veia cava inferior em ovinos nativos não operados com o conduto de ovinos implantados com enxerto de politetrafluoretileno expandido (PTFE) de longo prazo. O vaso nativo mostrou-se mais complacente e distensível do que o enxerto de PTFE em todos os locais medidos. Concluímos que este método fornece com segurança medidas in vivo de complacência e distensibilidade venosa.
Introdução
Pacientes com anomalias cardíacas críticas requerem cirurgia reconstrutiva. A maioria das operações reconstrutivas requer o uso de materiais protéticos, incluindo enxertos vasculares. Os possíveis canais para preencher esse espaço incluem materiais sintéticos ou biológicos. Inicialmente, os homoenxertos foram usados como conduto de Fontan, mas desde então foram abandonados devido à alta incidência de calcificação e incidentes de fase aguda1. Atualmente, são utilizados enxertos vasculares sintéticos derivados de polímeros inorgânicos. Permanece o desafio de que esses enxertos sejam menos complacentes do que o vaso nativo no qual são implantados e tenham complicações a longo prazo, como estenose, oclusão e calcificação 1,2,3,4,5.
A estrutura dos enxertos vasculares sintéticos se presta à resistência à tração mecânica, levando à sua complacência invariavelmente menor em comparação com o tecido nativo2. A complacência vascular, que define a mudança de volume do vaso sobre uma mudança na pressão, serve como um indicador da capacidade de resposta de um vaso a cargas mecânicas. A diferença entre o material do enxerto e as propriedades do vaso nativo cria uma incompatibilidade de complacência, que demonstrou interromper os padrões de fluxo sanguíneo, resultando em áreas de recirculação e separação de fluxo 2,6,7,8,9. Esse fenômeno altera a tensão de cisalhamento na parede endotelial e induz hiperplasia intimal 2,7,8,9. Tais respostas podem levar a complicações relacionadas ao enxerto, necessitando de substituição ou reintervenção do enxerto6.
Como a complacência vascular assume um papel fundamental na determinação dos resultados do enxerto, a medição precisa dessa propriedade é essencial. O padrão-ouro atual para medir a complacência vascular é o teste mecânico biaxial tubular ex vivo . Este método envolve a excisão de um enxerto ou vaso de interesse, conectando-o a tubos de látex e pressurizando-o para avaliar o comportamento circunferencial de estiramento por estresse em várias pressões. A conformidade é determinada comparando a pressão com uma medição do diâmetro interno10. No entanto, os métodos ex vivo têm algumas desvantagens. Ao avaliar a funcionalidade dos enxertos implantados pelo método ex vivo , é necessário sacrificar os animais e explantar os enxertos, impossibilitando a realização de exames prolongados. Portanto, desenvolvemos um protocolo de medição de conformidade in vivo .
Nosso grupo se concentra no desenvolvimento de enxertos vasculares de engenharia de tecidos (TEVGs) para uso na cirurgia de Fontan para melhorar a síndrome do coração esquerdo hipoplásico congênito (SHCE). Desenvolvimentos recentes no campo da cirurgia cardíaca congênita melhoraram os resultados pós-operatórios, levando a uma expectativa de vida mais longa. Isso torna as propriedades de longo prazo e o sucesso do conduto vascular implantado cada vez mais cruciais. Atualmente, não existe nenhum modelo animal de SHCE, portanto, avaliamos nossos enxertos em um modelo acelerado de enxerto de interposição de veia cava inferior (VCI) de grandes animais. Embora este modelo não tente criar o fluxo da circulação de Fontan, ele efetivamente recapitula as condições hemodinâmicas únicas. Nosso uso recente deste protocolo in vivo demonstrou diferenças significativas na adesão do enxerto entre nosso TEVG e enxertos convencionais de politetrafluoretileno expandido (PTFE)11. Como este estudo anterior não se concentrou na metodologia, realizamos experimentos adicionais detalhando este novo método in vivo .
Implantamos o enxerto sintético atualmente servindo como padrão de tratamento, composto de politetrafluoretileno expandido (PTFE), em animais de estudo de ovinos Dorset e o comparamos com a VCI nativa em animais controle virgens de cirurgia. Este protocolo foi realizado no grupo PTFE 5-7 anos após o implante de um tubo de PTFE e animais controle não operados de idades variadas. Assim, nas seções subsequentes que descrevem o protocolo e os resultados representativos, ocasionalmente nos referiremos à região de interesse como, por exemplo, o meio da região do enxerto (enxerto médio) do enxerto de interposição da VCI.
Este protocolo nos permite analisar a complacência in vivo do tubo de PTFE, sabidamente não compatível em um ponto de tempo de longo prazo, com o veio nativo. Optou-se por comparar o material padrão clínico, PTFE, com a veia nativa não operada. Selecionamos um ponto de tempo de longo prazo porque o conduíte de PTFE é conhecido por permanecer não compatível e propenso a calcificar, reduzindo ainda mais sua conformidade11. Optou-se por realizar todas as comparações in vivo, pois as alterações hemodinâmicas sistêmicas são refletidas com precisão nas medidas obtidas por meio de métodos in vivo. A partir dessa comparação, verificamos que esse protocolo é capaz de confirmar a não conformidade do PTFE e obter medidas de complacência venosa in vivo de forma segura e reprodutível. Este método foi implementado com sucesso em um estudo publicado para demonstrar diferenças estatisticamente significativas entre condutos de PTFE e enxertos vasculares de engenharia de tecidos (TEVGs) in vivo11.
O objetivo geral deste protocolo é calcular a complacência e a extensibilidade da VCI torácica em um modelo animal ovino de grande porte usando medições in vivo de um procedimento de sobrevivência. Para tanto, visualizamos e medimos as mudanças na circunferência e na área de secção transversa da VCI torácica para um bolo de fluido. Medimos simultaneamente a mudança intravascular na pressão e usamos essas medidas para calcular a complacência e a distensibilidade. O uso de imagens de angiografia 3D nos permite várias vantagens, incluindo a capacidade de ajustar a visualização da imagem após a captura para garantir que nossas medições sejam feitas a partir de uma seção transversal da veia, além de nos permitir medir vários locais ao longo do vaso. As três áreas de interesse neste estudo foram a região do enxerto médio, bem como os dois locais de anastomose adjacentes do enxerto de PTFE e as áreas comparáveis na VCI nativa. Ao realizar experimentos in vivo, há vantagens em avaliar a funcionalidade dos enxertos dentro do fluxo real de sangue e cercados por tecidos e órgãos. Acredita-se que as medições obtidas por meio desse método reflitam a funcionalidade real dos enxertos em um organismo vivo.
O protocolo é dividido em seis seções principais, incluindo preparação pré-procedimento das ovelhas, cateterismo, coleta de dados pré-bolus de linha de base, coleta de dados do estudo, recuperação de animais e análise de dados. Na seção de preparação animal, discutimos sedação, início da anestesia e colocação de equipamentos de monitoramento usados durante o procedimento de cateterismo. Na segunda seção, explicamos o processo de colocação das duas bainhas de cateter necessárias para a aquisição de dados. Para este protocolo, ambas as bainhas são colocadas na veia jugular interna direita (IJV) para permitir que dois cateteres multipista sejam introduzidos no vaso. Um será posicionado na região de interesse para registrar a mudança na pressão e o outro será colocado mais abaixo na veia para injeção de contraste. Uma vez que os cateteres são colocados, um angiógrafo 3D pré-bolus basal é feito para comparação. A coleta de dados do estudo começa com a preparação do bolus salino em um sistema de bolsa pressurizada para administração, fornecendo o bolus salino com registro de pressões intravasculares e fazendo o angiógrafo 3D pós-bolus. Em seguida, descrevemos o processo para facilitar a recuperação dos ovinos após o protocolo. Por fim, discutimos o método para obter as imagens adequadas e medidas transversais para análise e comparação estatística.
Access restricted. Please log in or start a trial to view this content.
Protocolo
O protocolo do estudo foi aprovado pelo Comitê Institucional de Cuidados e Uso de Animais do Nationwide Children's Hospital Abigail Wexner Research Institute (AR22-0004). Todos os animais receberam cuidados humanitários em conformidade com o Guia para o Cuidado e Uso de Animais de Laboratório, publicado pelo National Institutes of Health.
1. Preparação animal
- Peça a uma equipe veterinária que avalie as ovelhas 1 semana antes do cateterismo, incluindo um exame físico e análise dos sinais vitais, para garantir que o animal possa receber anestesia com segurança.
- Jejue o animal durante a noite, ou até 12 h antes do procedimento, para limitar o risco de aspiração do conteúdo estomacal após a indução da anestesia.
- Pressione o botão liga / desliga no painel de controle para ligar o arco cirúrgico e o sistema de angiografia 3D (Figura 1A). Aguarde até que o sistema esteja totalmente carregado.
NOTA: Certifique-se de que a fluoroscopia esteja pausada até que esteja pronta para a imagem e que todo o pessoal esteja usando chumbo protetor. - Prepare a solução salina heparinizada para uso no procedimento adicionando 1 mL de heparina (concentração de 1.000 unidades USP/mL) a 1.000 mL de solução salina a 0,9%.
- Raspe o lado esquerdo do pescoço e esfregue com álcool. Administre sedação injetando uma combinação de cetamina (4 mg / kg), butorfanol (0,1 mg / kg) e diazepam (0,5 mg / kg) na veia jugular esquerda.
- Coloque a ovelha sedada em uma cama de hospital e posicione-a em decúbito esternal para intubação. Intubar com um tubo endotraqueal (TE) de 9-14 mm, com base no tamanho da ovelha, pressionando a língua e a epiglote com um laringoscópio e inserindo o tubo ET na traqueia.
- Posicione as ovelhas em uma posição lateral direita. Conecte o tubo ET a um ventilador e ventile mecanicamente com oxigênio a 100% a 1-3 L/min.
- Mantenha a anestesia com isoflurano inalado a 1-3%. Defina a frequência respiratória em 15-30 respirações/min e o volume corrente final em 8-10 mL/kg.
- Coloque o equipamento de monitoramento padrão, incluindo um manguito de pressão arterial na perna dianteira direita, um clipe de orelha para monitorar a saturação de oxigênio na orelha direita, uma sonda de temperatura no esôfago e um monitor de CO2 expirado no tubo ET. Raspe a lã do aspecto caudal de cada casco entre os ergôs e o calcanhar. Coloque os nódulos de eletrocardiograma (ECG) e prenda os nódulos de ECG com fita adesiva.
- Lubrifique os dois olhos aplicando pomada oftálmica e insira um tubo orogástrico para garantir a evacuação de gases e alimentos.
- Estabeleça uma linha IV na VJI esquerda para permitir a administração de infusão de taxa constante de propofol (IRC) (20-40 mg∙kg-1∙h-1), fluidos de manutenção (10 mL∙kg-1∙h-1) e o bolus salino.
- Posicione as ovelhas em decúbito lateral esquerdo. Raspe o lado direito do pescoço para ter acesso ao local do cateterismo (Figura 2A). Limpe a área com clorexidina e álcool.
- Desconecte-se do equipamento de monitoramento e do ventilador e mova as ovelhas para a mesa do laboratório de cateterismo. Novamente, posicione o animal em decúbito lateral esquerdo (Figura 3A).
- Reconecte ao ventilador e ao equipamento de monitoramento (eletrodos de ECG, sonda de temperatura, manguito de pressão arterial, oxímetro de pulso).
- Mantenha a anestesia durante o procedimento administrando isoflurano inalatório a 1-3% com 100% de O2 e/ou propofol CRI (20-40 mg∙kg-1∙h-1).
NOTA: Avalie o plano da anestesia medindo o movimento do animal, a resposta a estímulos dolorosos, a frequência respiratória, a frequência cardíaca e a pressão arterial. Faça ajustes na sedação conforme apropriado, como usar um bolus de 5-10 mL de propofol para induzir um plano mais profundo de anestesia. - Meça a largura da ovelha na área do coração usando paquímetros grandes. Divida a largura por 2 para definir o transdutor de pressão.
- Limpe assepticamente o local da cirurgia e drapeje-o de forma estéril (Figura 2B, C).
2. Cateterismo
- Mova o arco cirúrgico da posição estacionada para o baú da ovelha e levante a mesa conforme necessário. Pressione os botões 7 e 3 no painel de controle e, em seguida, segure o botão Iniciar para usar as configurações pré-programadas para posicionar automaticamente a mesa e o arco cirúrgico no lado esquerdo da mesa (Figura 1A).
- Acesse o IJV direito usando uma agulha de micropunção de 21 G e uma seringa Luer Slip de 10 cc; acessar a VJI na direção cranial/caudal através da pele enquanto puxa o êmbolo da seringa para trás. Certifique-se de que o sangue seja aspirado para confirmar que a agulha está no vaso (Figura 2A, B).
- Desconecte cuidadosamente a seringa enquanto segura a agulha com firmeza.
- Insira um guia de fio de aço inoxidável (SS) de 0.018 polegadas através da agulha no recipiente aproximadamente na metade. Remova a agulha sobre o fio SS.
- Coloque um dilatador de 5 French (Fr) sobre o fio SS e no recipiente. Remova a parte interna do dilatador e do fio SS. Passe um fio-guia de 0,038 polegada através do dilatador até a metade e remova o dilatador.
- Use um bisturi de 11 lâminas para cortar a pele acima da veia por onde o fio entra. Passe uma bainha de 9 Fr sobre o fio-guia e no recipiente. Remova a seção interna da bainha e o fio-guia.
- Confirme a colocação adequada da bainha aspirando sangue e, em seguida, lavando a bainha com solução salina heparinizada.
- Repita as etapas 2.2-2.7 para que haja duas bainhas de 9-Fr no IJV direito.
- Administre 150 U/kg de heparina através do IV para evitar a coagulação.
- Use o pedal para iniciar a fluoroscopia (Figura 1B). Insira um cateter Judkins Right (JR) através da bainha, seguindo a VCI torácica através do diafragma até a VCI abdominal.
- Passe um fio de Rosen pelo cateter JR até atingir a VCI abdominal e a ponta emergir do cateter JR. Enquanto segura o fio Rosen no lugar, remova cuidadosamente o cateter JR.
- Repita as etapas 2.10-2.11 com a segunda bainha.
- Passe um cateter Multitrack de 7 Fr sobre cada fio Rosen.
- Sob orientação de fluoroscopia, coloque um cateter angiográfico multipista na VCI abdominal para injeção de contraste.
- Usando fluoroscopia, coloque outro cateter angiográfico multipista na região específica de interesse (por exemplo, o centro do enxerto) para medição da pressão (Figura 2C).

Figura 1: Painel de controle. (A) Painel de controle do sistema de angiografia 3D (B) Pedais de fluoroscopia Clique aqui para ver uma versão maior desta figura.
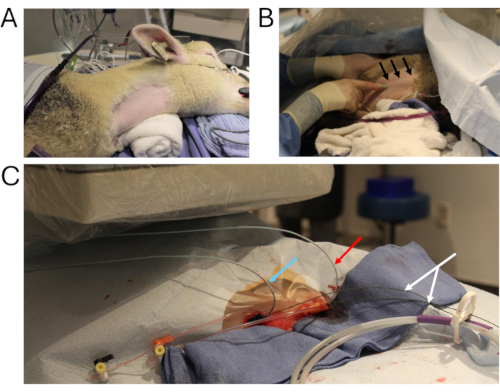
Figura 2: Cateterismo animal. (A) O principal local cirúrgico, preparado para o cateterismo. (B) Técnica para visualização da veia jugular interna direita (setas pretas). (C) Dois cateteres angiográficos multipistas são colocados através da veia jugular interna direita (seta azul: medida da pressão no enxerto; seta vermelha: injeção de contraste na VCI abdominal; seta branca: fios rígidos). Abreviatura: IVC = veia cava inferior. Clique aqui para ver uma versão maior desta figura.
3. Reunindo os pré-dados
- Conecte o multipista centralizado na região de interesse ao transdutor de pressão usando uma torneira de três vias. Com a torneira aberta para a multipista, puxe para trás com uma seringa de 10 mL até que as bolhas de ar sejam removidas e o sangue seja visto.
- Com a seringa de 10 mL virada de cabeça para baixo, devolva o sangue às ovelhas com cuidado para não empurrar o ar de volta para a multipista. Lave o multitrack com solução salina heparinizada.
- Vire a posição desligada da torneira para a seringa de modo que o transdutor de pressão e o multitrack fiquem abertos um para o outro.
- Prepare o injetor de contraste adicionando um agente de contraste. O volume mínimo para uma angiografia 3D é de 60 mL e o contraste total não pode exceder 5 mL/kg ou 250 mL.
- Conecte o injetor de contraste ao multitrack centralizado na VCI abdominal. Usando o injetor de contraste, gire o botão no sentido anti-horário lentamente para puxar as bolhas de ar do multitrack até que o sangue seja visto. Gire o botão no sentido horário para empurrar o contraste lentamente para a frente no multitrack.
- Use fluoroscopia para confirmar quando o contraste atingiu a ponta do multitrack.
- Pegue o contraste total usado para o angiograma 3D e divida por 5 para obter mL / s. Defina o aumento da taxa para 0 e 600 psi.
- Defina o arco cirúrgico para o modo pré-programado clicando no botão Programa na parte superior direita da tela e no botão 3D DSA 110 8'' (Angiografia 3D com SID de 110 cm e Field View em 8 polegadas).
- Afaste todos os objetos e pessoas da frente ou dos lados da mesa. Inicie o programa C-Arm clicando no botão número 3 no painel de controle. Posicione a região alvo (por exemplo, enxerto médio) no centro do plano xy (Figura 3A-C).
- Avance para o segundo programa clicando no botão numerado 4 no painel de controle. Ajuste a altura da mesa de acordo com o centro da região de interesse.
- Pressione o botão numerado 5 e tire a imagem de teste.
- Pré-teste a amplitude de movimento do arco cirúrgico clicando no botão Confirmar condições | Início (Figura 3D,E).
- Peça ao anestesiologista para manter a ventilação e fazer uma angiografia rotacional 3D com injeção de contraste, iniciando o programa com o pedal de aquisição do meio. Medir e registrar simultaneamente a pressão média da região alvo.
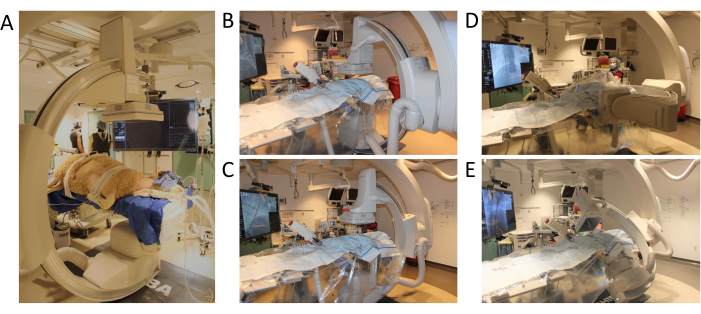
Figura 3: Posicionamento do braço em C e amplitude de movimento. (A) Posicionamento das ovelhas para o início do procedimento (B) Primeira posição para o programa de angiografia 3D (C) Arco C movido no eixo xy (D) Braço C movido no eixo z (E) Arco C completando o teste de giro com amplitude total de movimento. Clique aqui para ver uma versão maior desta figura.
4. Administração do bolo salino e coleta de dados
- Prepare 20 mL/kg de soro fisiológico a 0,9%.
- Para preparar a bolsa pressurizada em bolus, adicione uma bolsa de 1.000 mL de solução salina a 0,9% em uma unidade de bolsa pressurizada. Use uma segunda unidade, se necessário, para atingir o volume total a ser administrado.
- Aperte o bulbo de enchimento até que o manômetro suba para a zona verde, imediatamente antes da linha vermelha (pressão 250-300 mmHg). Lave a solução salina através da linha e remova as bolhas de ar.
- Conecte a bolsa salina pressurizada a uma bainha de 9 Fr e mantenha 250-300 mmHg para manter uma velocidade constante do bolus. Deixar fluir até que os ovinos tenham recebido um bolo alimentar equivalente a 20 ml/kg ou a pressão média atinja 15 mmHg.
- Enquanto o bolo está fluindo, registre as pressões intravasculares da região-alvo a cada minuto.
- Tenha o arco cirúrgico pronto para uma segunda angiografia rotacional 3D repetindo as etapas 3.9-3.12. Assim que o bolo terminar, antes que a pressão comece a cair, faça a segunda angiografia 3D e a medição simultânea da pressão intravascular iniciando conforme descrito na etapa 3.13.
5. Recuperação
- Após a conclusão da imagem, coloque o arco cirúrgico de volta na posição estacionada pré-programada digitando o número 77 e segurando o botão Iniciar até que o arco cirúrgico se posicione.
- Remova os cateteres de angiografia multipista e os fios de Rosen.
- Remova ambas as bainhas enquanto aplica pressão direta sobre os locais de inserção com um adesivo de hemostasia por pelo menos 7 min para parar o sangramento.
- Enrole um rolo estéril de gaze ao redor dos adesivos e do pescoço, de modo que o envoltório fique seguro para manter a pressão, mas não muito apertado para correr o risco de cortar a circulação ou impedir a respiração.
- Desligue os anestésicos (isoflurano e/ou propofol CRI).
- Mantenha as ovelhas no ventilador com 100% de O2 até que respirem consistentemente por conta própria.
NOTA: Os sinais de que a ovelha está acordando incluem movimento, piscar, resposta a estímulos dolorosos, tônus da mandíbula ou tentativas de mastigar e respirar sem a ajuda de um ventilador. - Assim que a ovelha for capaz de respirar por conta própria, extube (remova o tubo ET) e remova o tubo orogástrico.
- Remova todo o equipamento de monitoramento e transfira as ovelhas para uma cama de hospital. Mova-o de volta para a sala de alojamento.
- Ajude as ovelhas a permanecerem em decúbito esternal ou ao tentar ficar em pé até que as ovelhas consigam manter o equilíbrio por conta própria. Evite que eles batam nas paredes.
- Quando eles parecerem acordados o suficiente, dê pequenas quantidades de feno ou grãos.
6. Análise dos dados
- Exporte os dados brutos originais de angiografia 3D do software de imagem de angiografia no formato de arquivo DICOM.
- Inicie o software DICOM viewer. Arraste e solte o arquivo de angiografia 3D no visualizador para abrir (Figura 4A).
- No software DICOM viewer, selecione a ferramenta 3D MPR (Multi-Planar Reconstruction) para gerar uma visão reconstruída em 3D dos dados da angiografia. Isso apresentará três vistas 2D distintas de três ângulos diferentes: planos axial, sagital (Figura 4B) e coronal (Figura 4C).
- Ajuste o posicionamento e a orientação da região-alvo nos planos sagital e coronal para obter a posição vertical desejada, colocando a região-alvo no centro e girando a direção das linhas de referência em cada plano com uma ferramenta manual (Figura 4D).
- Utilize a ferramenta lápis no visualizador DICOM para delinear a parede do vaso na visualização axial da região alvo (Figura 4E). O software calcula e mostra automaticamente a área e o perímetro (Circunferência) da região no meio da vista axial.
- Utilize a equação (1) para calcular a complacência, onde A é a área da seção transversal (cm2) e P é a pressão (mmHg):
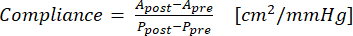 Características (1)
Características (1) - Empregue a equação (2) para calcular a extensibilidade onde C é a circunferência (cm) e P é a pressão (mmHg):
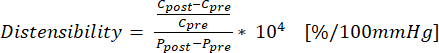 (2)
(2)
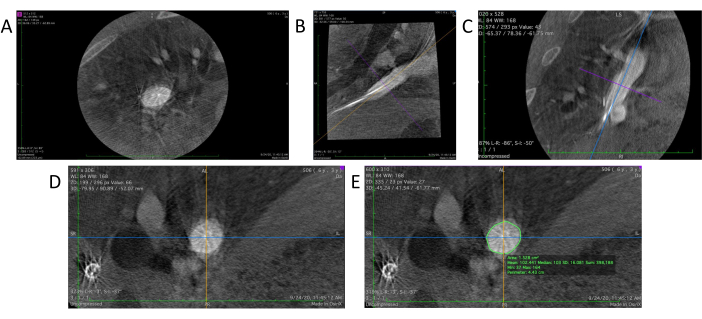
Figura 4: Análise de dados no visualizador DICOM. (A) Dados brutos do angiograma 3D carregados no visualizador DICOM. (B) A seção sagital do enxerto. (C) A seção coronal. (D) Uma seção transversal verdadeira é visualizada após o ajuste do ângulo nas seções sagital e coronal. (E) A ferramenta lápis é usada para delinear o vaso alvo para fazer medições da circunferência e da área da seção transversal. Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Realizamos com sucesso este procedimento com mais de 25 ovelhas. É importante ressaltar que não houve casos de morbidade e mortalidade relacionados a esse procedimento. Todas as ovelhas exibiram recuperações sem complicações. Esses resultados representativos foram obtidos de três ovelhas implantadas com enxertos de PTFE e três ovelhas nativas não operadas. A Figura 5 fornece as medidas de pressão intravascular realizadas em ambos os grupos de animais do estudo durante o protocolo. ...
Access restricted. Please log in or start a trial to view this content.
Discussão
A complacência e a distensibilidade são propriedades-chave para a função dos vasos sanguíneos, servindo como indicadores de possíveis complicações e intervenções. Quantificar e comparar com precisão as alterações nesses parâmetros é importante para avaliar a eficácia do enxerto. Nosso método in vivo supera as limitações da análise ex vivo e mantém resultados comparáveis. Comparando nossos dados in vivo com os dados ex vivo apresentados por Blum et al., ambos os m?...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Este estudo foi patrocinado em parte pela Gunze Ltd.
Agradecimentos
Este trabalho foi apoiado por R01 HL163065 e W81XWH1810518. Estendemos nossa gratidão à equipe dedicada do Animal Research Core. Também desejamos expressar nossa gratidão a Carmen Arsuaga por sua inestimável experiência e cuidado vigilante durante todo o estudo.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.035" x 260 cm Rosen Curved Wire Guide | Cook Medical | G01253 | Guide for holding placement swapping caths (Multi-track, IVUS, etc) |
| 0.035"x 150 cm Glidewire | Terumo | GR3507 | Guide for JR cath |
| 0.9% Sodium Chloride Saline | Baxter Healthcare Corporation | NCH pharmacy | For diluting norepinpherine, pressure monitoring |
| 10.0 Endotracheal tube | Coviden | 86117 | To secure airway |
| 16 G IV catheter | BD | 382259 | To administer fluids and anesthetic drugs |
| 22 G IV catheter | BD | 381423 | For invasive blood pressure |
| 5Fr x .35" JR2.5 | Cook Medical | G05035 | Guide for rosen wire |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| 7Fr x 100 cm Multi-track | B. Braun | 615001 | Collecting pressure, Administering contrast to specific intravascular location |
| 9Fr Introducer sheath | Terumo | RSS901 | Access catheter through skin into vessel for wires to pass through |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated Clotting Time |
| Angiographic syringe w/ filling spike | Guerbet | 900103S | For contrast injector |
| Bag decanter | Advance Medical Designs, LLC | 10-102 | Punctures saline bag to pour and fill sterile bowl with saline |
| Butorphanol | Zoetis | NCH pharmacy | Sedation drug: Concentration 10 mg/mL, Dosage 0.1 mg/kg |
| Cath Research Pack | Cardinal Health | SAN33RTCH6 | Cath pack with misc. supplies |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray |
| Chloraprep | BD | 930825 | Topical cleaning solution |
| Chlorhexidine 2% solution | Vedco INC | VINV-CLOR-SOLN | Topical cleaning solution |
| Conform stretch bandage | Coviden | 2232 | Neck wrap to prevent bleeding |
| Connection tubing | Deroyal | 77-301713 | Connects t-port to fluid/drug lines |
| Diazepam | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 5 mg/mL, Dosage 0.5 mg/kg |
| EKG monitoring dots | 3M | 2570 | |
| Fluid administration set | Alaris | 2420-0007 | |
| Fluid warming set | Carefusion | 50056 | |
| Hemcon Patch | Tricol Biomedical | 1102 | Patch for hemostasis |
| Heparin | Hospira, Inc | NCH pharmacy | Angicoagulant: 1,000 USP units/mL |
| Infinix-i INFX-8000C | Toshiba Medical Systems | 2B308-124EN*E | Interventional angiography system |
| Invasive pressure transducer | Medline | 23DBB538 | For invasive blood pressure |
| Isoflurane | Baxter Healthcare Corporation | NCH pharmacy | Anesthetic used in prep room |
| Ketamine | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 100 mg/mL, Dosage 4 mg/kg |
| Lubricating Jelly | MedLine | MDS0322273Z | ET tube lubricant |
| Micropuncture Introducer Set | Cook Medical | G47945 | Access through skin into vessel |
| Needle & syringes | Cardinal Health | 309604 | For sedation |
| Norepinpherine Bitartrate Injection, USP | Baxter Healthcare Corporation | NCH pharmacy | 1 mg/mL |
| Optiray 320 | Liebel-Flarsheim Company, LLC | NCH pharmacy | Contrast |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| OsiriX MD | Pixmeo SARL | - | DICOM Viewer and Analysis software |
| Pressure infusor bag | Carefusion | 64-10029 | To maintain invasive blood pressure |
| Propofol | Fresenius Kabi | NCH pharmacy | Anesthetic drug: Concentration 10 mg/mL, Dosage 20-45 mg·kg-1·h-1 |
| Silk suture 3-0 | Ethicon | C013D | To secure IV catheter |
| SoftCarry Stretcher | Four Flags Over Aspen | SSTR-4 | |
| Stomach tube | Jorgensen Lab, INC | J0348R | To release gastric juices and gas and prevent bloat |
| T-port | Medline | DYNDTN0001 | Connects to IV catheter |
| Urine drainage bag | Coviden | 3512 | Connects to stomach tube to collect gastric juices |
| Warming blanket | Jorgensen Lab, INC | J1034B |
Referências
- Hagler, D. J., et al. Fate of the Fontan connection: Mechanisms of stenosis and management. Congenit Heart Dis. 14 (4), 571-581 (2019).
- Nezerati, R. M., Eifert, M. B., Dempsey, D. K., Cosgriff-Hernandez, E. Electrospun vascular grafts with improved compliance matching to native vessels. J Biomed Mater Res B Appl Biomater. 103 (2), 313-323 (2015).
- Bates, O., Semple, T., Krupickova, S., Bautisa-Rodriguez, C. Case report of a Gore-Tex TCPC conduit dissection causing severe stenosis. Eur Heart J Case Rep. 5 (11), 1-6 (2021).
- Sathananthan, G., et al. Clinical importance of Fontan Circuit thrombus in the adult population: Significant association with increased risk of cardiovascular events. Can J Cardiol. 35 (12), 1807-1814 (2019).
- Kumar, P., Bhatia, M. Computed tomography in the evaluation of Fontan Circulation. J Cardiovasc Imaging. 29 (2), 108-122 (2021).
- Abbott, W. M., Megerman, J., Hasson, J. E., L'Italien, G., Warnock, D. F. Effect of compliance mismatch on graft patency. J Vasc Surg. 5 (2), 376-382 (1987).
- Weston, M. W., Rhee, K., Tarbell, J. M. Compliance and diameter mismatch affect the wall shear rate distribution near an end-to-end anastomosis. J Biomech. 29 (2), 187-198 (1996).
- Ballyk, P. D., Walsh, C., Butany, J., Ojha, M. Compliance mismatch may promote graft-artery intimal hyperplasia by altering suture-line stress. J Biomech. 31 (3), 229-237 (1997).
- Lemson, M. S., Tordoir, J. H. M., Daemen, M. J. A. P., Kitslaar, P. J. E. H. M. Intimal hyperplasia in vascular grafts. Eur J Vasc Endovasc Surg. 19 (4), 336-350 (2000).
- Blum, K. M., et al. Tissue engineered vascular grafts transform into autologous neovessels capable of native function and growth. Commun Med. 2, 3(2022).
- Turner, M. E., et al. Tissue engineered vascular grafts are resistant to the formation of dystrophic calcification. Nat Commun. 15, 2187(2024).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados