É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Desenvolvimento de um eletrodo de eletromiografia epimísia de baixo custo: um fluxo de trabalho simplificado para fabricação e teste
Neste Artigo
Resumo
Nosso objetivo era fornecer um guia atualizado e fácil de seguir sobre a fabricação e teste de eletrodos de eletromiografia epimísia. Para esse fim, fornecemos instruções para o fornecimento de materiais e um passo a passo detalhado do processo de fabricação e teste.
Resumo
A eletromiografia (EMG) é uma ferramenta diagnóstica valiosa para detectar anormalidades neuromusculares. Eletrodos epimísios implantáveis são comumente usados para medir sinais EMG em modelos pré-clínicos. Embora existam recursos clássicos que descrevem os princípios da fabricação de eletrodos epimísios, há uma escassez de informações ilustrativas que traduzem a teoria dos eletrodos para a prática. Para remediar isso, fornecemos um guia atualizado e fácil de seguir sobre como fabricar e testar um eletrodo epimísio de baixo custo.
Os eletrodos foram feitos dobrando e inserindo duas folhas de platina-irídio em uma base de silicone pré-cortada para formar as superfícies de contato. Em seguida, fios de aço inoxidável revestidos foram soldados a cada superfície de contato para formar os fios do eletrodo. Por fim, uma mistura de silicone foi usada para selar o eletrodo. Testes ex vivo foram conduzidos para comparar nosso eletrodo fabricado sob medida com um eletrodo padrão da indústria em um banho salino, onde altos níveis de concordância de sinal (seno [correlação intraclasse - ICC = 0,993], quadrado [ICC = 0,995], triângulo [ICC = 0,958]) e sincronia temporal (seno [r = 0,987], quadrado [r = 0,990], triângulo [r = 0,931]) foram encontrados em todas as formas de onda. Baixos níveis de impedância do eletrodo também foram quantificados por espectroscopia de impedância eletroquímica.
Uma avaliação de desempenho in vivo também foi realizada onde o músculo vasto lateral de um rato foi instrumentado cirurgicamente com o eletrodo fabricado sob medida e a sinalização foi adquirida durante a caminhada em subidas e descidas. Como esperado, o pico de atividade EMG foi significativamente menor durante a descida (0,008 ± 0,005 mV) do que em subidas (0,031 ± 0,180 mV, p = 0,005), apoiando a validade do dispositivo. A confiabilidade e a biocompatibilidade do dispositivo também foram apoiadas pela sinalização consistente durante a caminhada nivelada aos 14 dias e 56 dias após o implante (0,01 ± 0,007 mV, 0,012 ± 0,007 mV, respectivamente; p > 0,05) e a ausência de inflamação histológica. Coletivamente, fornecemos um fluxo de trabalho atualizado para a fabricação e teste de eletrodos epimísios de baixo custo.
Introdução
A eletromiografia (EMG) é uma ferramenta poderosa para estudar a atividade elétrica do músculo. Os registros EMG podem ser especialmente úteis em modelos animais pré-clínicos para avaliar a eficácia das intervenções para tratar a disfunção neuromuscular. Nesses modelos, eletrodos biocompatíveis implantáveis são comumente usados para avaliar a interface neurofisiológica entre neurônios motores e fibras musculares. Esses eletrodos implantáveis podem fornecer medições localizadas de excitação muscular e podem ser diversos em termos de configuração, forma e material, com o design ideal ditado pela localização e uso pretendido.
Apesar de sua adequação para avaliar a excitação muscular em modelos pré-clínicos, o uso de eletrodos epimísios pode ser limitado pelo custo. Como resultado, muitos investigadores usam eletrodos epimísios fabricados sob medida que são produzidos internamente. Embora existam recursos detalhando as considerações fundamentais de fabricação, teste e uso de eletrodos 1,2, há necessidade de um guia instrucional atualizado detalhando o fornecimento, fabricação e validação de eletrodos epimísios usando métodos modernos. Informados pelos trabalhos fundamentais de Loeb e Gans3 e outros na teoria dos eletrodos, apresentamos instruções modernas sobre o fornecimento e fabricação de eletrodos epimísios de baixo custo e testamos seu desempenho em uma série de experimentos ex vivo e in vivo. O objetivo é oferecer um guia amigável para outros membros da comunidade científica obterem, fabricarem e testarem eletrodos epimísios internos de baixo custo para uso animal, permitindo a quantificação mais ampla da excitação muscular em modelos pré-clínicos.
Neste protocolo, fornecemos um guia de instruções para o fornecimento, fabricação e teste de eletrodos epimísios para uso animal no moderno laboratório de eletrofisiologia. Os parâmetros do eletrodo escolhidos para fabricação, como forma, dimensões, área de superfície de contato, distância entre eletrodos, comprimento do eletrodo, etc., foram selecionados para atender às nossas necessidades experimentais e eram comparáveis a um eletrodo epimísio padrão da indústria disponível comercialmente (consulte a Tabela de Materiais). Incentivamos outros grupos a modificar esses parâmetros para atender às suas necessidades, além de selecionar um eletrodo padrão da indústria confiável que corresponda ao seu caso de uso.
Em um esforço para dar aos leitores uma noção relativamente rápida do desempenho do eletrodo, também fornecemos um exemplo de um protocolo de teste ex vivo com a opção de medir a impedância do eletrodo. Além disso, damos um exemplo de avaliação do desempenho do eletrodo in vivo. O experimento ex vivo comparou o eletrodo fabricado sob medida com um padrão da indústria em um banho de solução salina para imitar condições fisiológicas estáveis. A impedância também foi avaliada ex vivo por meio de espectroscopia de impedância eletroquímica (EIS). O experimento in vivo consistiu na implantação cirúrgica do eletrodo fabricado sob medida no músculo vasto lateral (VL) de uma rata Long Evans fêmea de 16 semanas de idade (HsdBlu: LE, Envigo) para medir o sinal EMG durante condições conhecidas por provocar um sinal alto ou baixo (caminhada em subida, descida). Para avaliar a confiabilidade do eletrodo fabricado sob medida, a sinalização EMG foi adquirida durante a caminhada nivelada após a recuperação cirúrgica completa e antes do sacrifício (14 dias e 56 dias após o implante, respectivamente). A coloração com hematoxilina-eosina (H&E) foi realizada no músculo instrumentado para avaliar a biocompatibilidade do eletrodo fabricado sob medida.
Access restricted. Please log in or start a trial to view this content.
Protocolo
O procedimento in vivo foi conduzido sob a aprovação do Comitê Institucional de Cuidados e Uso de Animais da Universidade de Michigan (#PRO00010765 de aprovação da IACUC) e de acordo com as diretrizes do National Institutes of Health sobre o cuidado e uso de animais de laboratório.
1. Fornecimento e fabricação de eletrodos
NOTA: A Figura 1 fornece um resumo de alto nível de todas as principais etapas de fabricação com um link QR que fornece instruções visuais adicionais.
- Obtenha materiais de eletrodos biocompatíveis diretamente do fabricante a granel para fabricação. Consulte a Tabela de Materiais, que contém todos os componentes do eletrodo e detalhes sobre o fornecimento.
NOTA: Certifique-se de que a base de silicone, o selante de silicone e as folhas de contato de platina-irídio sejam biocompatíveis para evitar uma resposta imune adversa e permitir a implantação crônica. Para apoiar as vantagens econômicas da fabricação interna, apresentamos uma análise detalhada do custo do eletrodo epimísio fabricado sob medida em comparação com o padrão da indústria (Tabela de Materiais). - Prepare o gabarito de corte e dobragem (arquivo suplementar 1, arquivo suplementar 2). Use o software de impressão 3D selecionado para projetar gabaritos de corte e dobra para a produção em lote de eletrodos epimísios idênticos.
- Projete o gabarito de corte para garantir perfurações consistentemente dimensionadas e espaçadas da base de silicone para igual área de superfície de contato e distância entre eletrodos em todos os eletrodos.
- Crie o gabarito dobrável para dobrar as superfícies de contato platina-irídio e simplificar a colocação das folhas na base de silicone.
NOTA: Arquivos Gcode são fornecidos; modificar as dimensões e especificações do gabarito de corte e dobragem para atender às necessidades experimentais.
- Perfure a base de silicone. Coloque a base de silicone no gabarito de corte e prenda-a com fita adesiva. Perfure o silicone usando as guias no gabarito de corte usando uma faca X-acto para colocação das folhas de contato.
- Insira as películas na base de silicone para formar as superfícies de contato. Dobre as folhas de contato de platina-irídio pré-cortadas biocompatíveis (1.25 mm x 5 mm) em forma de U usando o gabarito dobrável. Em seguida, guie os braços das folhas dobradas nas ranhuras perfuradas na base de silicone para construir as superfícies de contato do eletrodo. Desta forma, insira todas as 12 folhas na base de silicone; Deixe uma única coluna aberta entre os eletrodos para garantir o espaçamento adequado.
NOTA: Esta configuração permitirá a fabricação de 6 eletrodos epimísios bipolares; A edição do gabarito de corte pode expandir a capacidade, se necessário. - Remova a base de silicone do gabarito de corte. Coloque um pedaço de fita cirúrgica sobre as superfícies de contato para manter as lâminas no lugar. Em seguida, remova a base de silicone do gabarito de corte, vire para que os braços da folha em forma de U fiquem expostos e dobre um braço da folha em forma de U nivelado com a base de silicone.
- Conecte os cabos do eletrodo. Prepare um fio de aço inoxidável revestido com perfluoroalcoxi (PFA) cortando-o no comprimento desejado. Em seguida, desnude uma extremidade do fio de aço inoxidável em ~ 1 cm usando um isqueiro disponível comercialmente. Posicione a extremidade desnuda do fio de aço inoxidável na parte interna do braço desdobrado da folha. Solde o fio de aço inoxidável no braço da folha usando um soldador Micro TIG (largura de pulso = 0, energia de solda = 25).
- Inspecione a interface de folha de chumbo. Teste a conexão fio-folha aplicando tensão ao fio de aço inoxidável. Se a conexão for mantida, dobre o braço da folha para baixo nivelado com a base de silicone e remova a fita que contorna a folha de silicone.
NOTA: Aplique tensão que seja representativa da tensão aplicada no caso de uso especificado. - Sele o eletrodo. Para obter uma consistência mais fina, misture 1 g de silicone líquido biocompatível com 0,75 mL de tolueno. Retirar a mistura com uma seringa de ponta romba de 18 G e aplicá-la no lado soldado de cada eléctrodo para selar a parte posterior dos eléctrodos.
CUIDADO: O tolueno é inflamável, pode ser fatal se ingerido ou entrar nas vias aéreas e causar irritação na pele. Trabalhe sob a hotte e mantenha-a afastada de chamas. - Separe o lote em eletrodos individuais. Deixe o silicone-tolueno endurecer por 72 h antes de manusear o eletrodo. Em seguida, use uma tesoura para cortar a base de silicone em eletrodos individuais com um tamanho de 10 x 5 mm.
NOTA: O tamanho do eletrodo dependerá das dimensões do gabarito de corte e do caso de uso específico. Autoclave e/ou eletrodos limpos em banho ultrassônico.
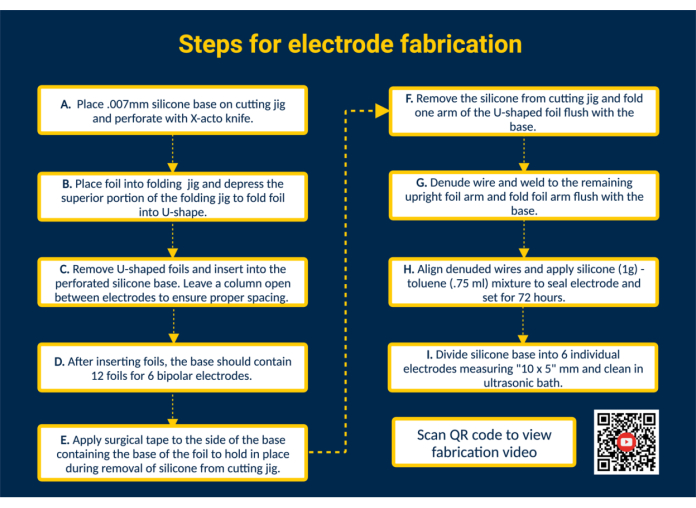
Figura 1. Etapas para fabricação de eletrodos. (A) Perfure a base de silicone. (B) Forme folhas em forma de U usando o gabarito dobrável. (C) Insira as folhas em forma de U na base de silicone perfurada. (D) A base de silicone contém 12 folhas para formar 6 eletrodos bipolares. (E) Aplique fita cirúrgica na base para prender as folhas durante a remoção do gabarito de corte. (F) Remova a base de silicone do gabarito de corte. (G) Desnude o fio de aço inoxidável revestido com PFA e solde no braço vertical da folha usando um soldador Micro TIG. (H) Alinhe os fios desnudados, aplique selante de silicone-tolueno e deixe endurecer. (I) Divida a base de silicone em eletrodos individuais e limpe em um banho ultrassônico. Clique aqui para ver uma versão maior desta figura.
2. Testes ex vivo
- Conecte eletrodos a um dispositivo de gravação. Prenda cada fio condutor do eletrodo a um canal em uma placa de interface de eletrodo (EIB). Repita esta etapa (usando o mesmo EIB) para um eletrodo padrão da indústria selecionado para comparação. Conecte o EIB a uma plataforma de aquisição de dados por meio de um sistema de cabo magnético amarrado.
NOTA: O eletrodo padrão da indústria pode ser qualquer eletrodo considerado confiável e que atenda às necessidades experimentais. - Aterre o BEI. Desnude uma extremidade de um aço inoxidável revestido com PFA e solde por pontos em uma fonte de aterramento (por exemplo, um parafuso de aço inoxidável). Prenda o fio terra na mesma placa de interface do eletrodo na posição "terra" designada.
- Configure o banho de solução salina. Encha um copo de vidro (250 mL) com 180 mL de solução salina fisiológica (solução salina estéril a 0,9%)4. Mergulhe os eletrodos epimísios fabricados sob medida e padrão da indústria no banho salino e prenda-os em uma posição estável. Em seguida, mergulhe a fonte de aterramento no banho de solução salina e fixe sua posição. Por fim, mergulhe e fixe dois eletrodos de agulha estimulante no banho de solução salina e conecte os eletrodos de estimulação ao gerador de sinal.
- Use um gerador de sinais para avaliar a concordância do sinal e a sincronia temporal. Use um gerador de sinal para fornecer formas de onda repetidas em uma tensão e frequência selecionadas (0.1 V e 5 Hz) no banho de solução salina por meio dos eletrodos de estimulação (Figura 2). Forneça várias formas de onda (seno, quadrada e triangular) para comparar os sinais gravados entre o eletrodo epimísio fabricado sob medida em relação ao padrão da indústria.
- Avalie o desempenho informal e visualmente em tempo real para avaliar o grau em que os sinais entre os eletrodos variam. Realizar correlações intraclasse (ICCs) e correlações de Pearson para avaliar a concordância do sinal e a sincronia temporal, respectivamente.
NOTA: Para fins de nossa análise, 8.000 amostras foram adquiridas a 4.000 Hz e filtradas em tempo real com um filtro Butterworth passa-alta e passa-baixa (passa-alta = 75 Hz; passa-baixa = 2 kHz). - Meça a impedância do eletrodo. Para medir a impedância do eletrodo, colete EIS nos eletrodos fabricados sob medida (por exemplo, 10 eletrodos) em frequências de 10 Hz-31 kHz5 com um potenciostato usando o procedimento descrito abaixo por Richie et al.6. Consulte Sarolic et al. para obter informações adicionais sobre a medição da impedância do eletrodo em eletrodos bipolares7.
- Seguindo o procedimento de Richie et al., mergulhe o eletrodo epimísio 1 mm em solução salina tamponada com fosfato 1x (PBS). Use um cloreto de prata-prata (Ag |AgCl) e uma haste de aço inoxidável como contra-eletrodo para completar o circuito.
- Suspenda o Ag|Eletrodo de referência AgCl e a haste de aço inoxidável no 1x PBS usando uma braçadeira de béquer. Conecte o eletrodo de referência à referência do sistema de impedância que está sendo usado e conecte à entrada do contra-eletrodo do sistema de impedância que está sendo usado.
- Use um potenciostato para executar uma varredura de impedância de 1 kHz. Defina para uma frequência de varredura de 1 kHz a 0.01 Vrms em uma única forma de onda senoidal. Durante os primeiros 5 segundos da varredura, ajuste o potenciostato para 0 V para estabilizar o sinal gravado. Use o software associado ao potenciostato para registrar as medições.
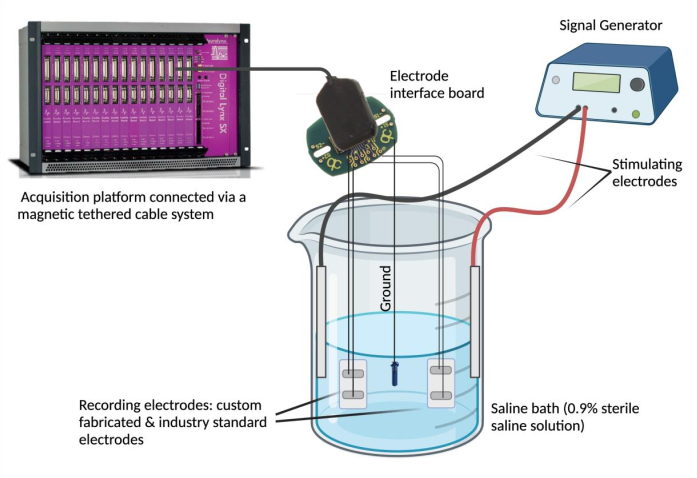
Figura 2: Teste ex vivo : banho de solução salina contendo o eletrodo fabricado sob medida, eletrodos padrão da indústria, dois eletrodos estimulantes e uma fonte de aterramento. A concordância do sinal e a sincronia temporal foram avaliadas entregando ondas senoidais, quadradas e triangulares no banho salino a partir do gerador de sinal e registrando as formas de onda detectadas pelos respectivos eletrodos usando uma plataforma de aquisição de dados. NOTA: A espectroscopia de impedância eletroquímica não está retratada. Clique aqui para ver uma versão maior desta figura.
3. Testes in vivo
NOTA: O procedimento de teste in vivo descreve nosso caso de uso experimental. Recomenda-se que os eletrodos epimísios fabricados sob medida sejam testados in vivo de uma forma que corresponda às condições experimentais pretendidas pelo usuário.
- Revisar informações cirúrgicas; Consulte informações para cirurgiões que estão aprendendo o processo de implantação de eletrodos de registro neural crônico usando os seguintes recursos 8,9.
NOTA: Dado que o foco de nosso manuscrito é a fabricação e teste de eletrodos, aqui fornecemos apenas uma breve visão geral das técnicas cirúrgicas usadas em nosso laboratório para testes de eletrodos in vivo . - Selecione um rato a ser instrumentado (por exemplo, uma rata Long Evans fêmea com 16 semanas de idade). Faça com que o rato seja submetido a um período de 1 semana de aclimatação laboratorial antes da aclimatação em esteira. Após a aclimatação laboratorial, exponha gradualmente o rato a uma esteira de roedores em velocidades crescentes de até 16 m/min.
- Prepare o EIB conectando primeiro um eletrodo epimísio fabricado sob medida ao EIB, fixando cada cabo do eletrodo em um canal no EIB. Para aterrar o EIB, desnude uma extremidade de um fio de aço inoxidável revestido com PFA e solde a ponto em um aterramento selecionado (por exemplo, parafuso de aço inoxidável). Em seguida, prenda o fio terra no mesmo EIB na posição "terra" designada.
NOTA: Para proteger o eletrodo durante a instrumentação, envolva-o com uma capa protetora (por exemplo, parafilme). - Desinfete todas as ferramentas cirúrgicas, bem como a área cirúrgica antes de começar. Use suprimentos cirúrgicos selados e assépticos e autoclave todos os instrumentos cirúrgicos que não estejam em embalagens estéreis. Crie um campo cirúrgico estéril usando uma cortina cirúrgica.
- Anestesiar o animal usando uma câmara de indução com 3-5% de isoflurano e 1 L/min de oxigênio e manter através de um cone nasal com 2% de isoflurano e 500 mL de oxigênio enquanto prepara o rato. Depois de atingir o plano cirúrgico da anestesia, avaliado por pinça do dedo do pé, aplique pomada ocular, monitore a frequência respiratória (70-110 respirações/min) e avalie a temperatura central usando uma sonda retal.
- Em seguida, raspe o local da cirurgia com uma tosquiadeira para animais e remova os detritos do local da cirurgia. Uma vez raspada a área cirúrgica, desinfete o local da cirurgia com clorexidina, álcool isopropílico e iodopovidona, esfregando do centro para fora da área cirúrgica. Administre analgésicos conforme apropriado e aprovado e forneça calor para manter a temperatura corporal central (37,5-38,5 ° C). Após a preparação, posicione o rato em uma estrutura estereotáxica e estabeleça o campo estéril.
- Para o preparo cirúrgico adequado do cirurgião, lave bem as mãos com sabão e/ou desinfetante (clorexidina). Use EPI adequado: máscara, luvas estéreis e um avental descartável. Use luvas novas e estéreis se a técnica asséptica for violada por qualquer motivo.
- Para instrumentar o VL direito, use um bisturi para fazer uma incisão de 3-5 cm na porção anterolateral do membro posterior direito e use dissecção romba para identificar o músculo VL.
- Faça uma incisão no plano sagital de 1 cm ao longo da sutura coronal e exponha o crânio. Usando uma pinça fina, faça um túnel subdérmico do membro posterior direito até a base do crânio. Use a pinça para pegar o eletrodo e encaminhar o eletrodo para o VL.
- Use uma broca de osso para criar um furo na calvária (certifique-se de que as especificações da broca correspondam às do parafuso de aterramento). Prenda o parafuso de aterramento e prenda o EIB ao crânio usando cimento dental.
NOTA: Pequenas quantidades de peróxido de hidrogênio podem ser aplicadas para aumentar a porosidade do crânio e melhorar a aderência do cimento dentário. - Tendo identificado o músculo VL, implante o eletrodo epimísio fabricado sob medida implantado em linha com as fibras musculares usando monofilamento inabsorvível 4-0. Feche a incisão usando clipes de ferida ou suturando.
- Após o fechamento, retire o animal da anestesia e o aloje individualmente em uma gaiola limpa e seca. Deixe o rato se recuperar em uma almofada aquecida e monitore a temperatura e a frequência respiratória do rato a cada 15 minutos até que o animal esteja deambulando. Trate a dor pós-cirúrgica administrando um analgésico aprovado nos dias seguintes à instrumentação.
NOTA: o rato precisa ser alojado individualmente até que esteja totalmente recuperado. - Após um período de 14 dias, realize testes de eletrodos in vivo para avaliar a validade do eletrodo epimísio fabricado sob medida para capturar alterações fisiológicas na atividade muscular. Coloque o rato instrumentado em uma esteira de roedores e exponha-o aleatoriamente a condições de caminhada em subidas e descidas que provocam um aumento ou redução na sinalização VL EMG (inclinação de 16 °, declínio de 16 ° a 16 metros / minuto). Colete dados longitudinais (por exemplo, 14 dias e 56 dias após a instrumentação) para garantir a confiabilidade ao longo do tempo.
NOTA: As avaliações de 14 e 56 dias foram selecionadas, pois um período de 14 dias permite a recuperação cirúrgica completa e o de 56 dias excede nosso cronograma experimental. Incentivamos outras pessoas a testar o desempenho e a confiabilidade do eletrodo usando um período de tempo que reproduza seu cronograma experimental antes do uso. As condições de velocidade (16m/min) e caminhada (inclinação de 16°, declínio de 16°) foram selecionadas para corresponder às condições estabelecidas de excitação aumentada e diminuída da LV neste modelo10. - Modifique os parâmetros de aquisição para atender às necessidades experimentais. Capture a sinalização EMG durante a caminhada a uma taxa de 2.000 Hz usando a plataforma de aquisição de dados e sincronize com um sistema de captura de movimento.
NOTA: Se estiver usando um dispositivo de aquisição diferente, colete EMG e captura de movimento de acordo com as instruções do fabricante e para atender às necessidades experimentais. - Extraia 25 s de dados de marcha de cada condição de caminhada e exporte para um script Python personalizado para processamento e análise de sinais adicionais. Ajuste da linha de base (zero), retifique e suavize usando um algoritmo quadrático médio com uma largura de compartimento de 50 ms. Aplique um algoritmo de detecção de pico para selecionar picos RMS-EMG a serem utilizados para análises de dados subsequentes.
NOTA: Descrevemos brevemente os métodos para pré-processar e analisar os dados de EMG, pois esta etapa varia muito devido às linguagens de programação e ao software e hardware de aquisição de EMG. Encorajamos os autores a consultar os seguintes recursos para obter informações adicionais 3,11,12,13.
4. Testes de biocompatibilidade
- Após o término das coletas longitudinais de EMG (ou em um ponto de tempo selecionado), eutanasiar o rato usando métodos apropriados e aprovados (por exemplo, asfixia com CO2 seguida de toracotomia bilateral).
- Após a eutanásia, extraia os músculos VL bilaterais criando uma incisão nos membros posteriores anterolaterais direito e esquerdo. Congelar rapidamente em nitrogênio líquido e armazenar a -80 °C.
NOTA: Tome cuidado para manter o eletrodo na posição no músculo instrumentado (por exemplo, o VL direito) durante a extração. Alternativamente, marque a região do subeletrodo ou extraia apenas o músculo da região do subeletrodo. Isso não se aplica ao músculo contralateral/controle. - Use um criostato para cortar seções transversais musculares seriais (7 μm) da região diretamente abaixo da interface eletrodo-fascial. Corte seções do ventre muscular do VL contralateral para servir como controle. Veja Kumar et al. para detalhes sobre criossecção14.
- Mancha com Hematoxilina e Eosina (H&E); consulte Wang et al. para obter detalhes sobre a coloração H & E em seções transversais do músculo esquelético15.
- Examine as seções coradas (instrumentadas e controle) usando um microscópio óptico com ampliação de 20x. Analise as alterações histológicas cegamente para a origem das amostras. Avalie a saúde do tecido avaliada usando as seguintes características patológicas: infiltração de células imunes, acúmulo mionuclear interno, fibrogênese e fragmentação do sarcolema.
5. Análises estatísticas sugeridas
- Para avaliar o desempenho do eletrodo epimiisal fabricado sob medida em comparação com o padrão da indústria, importe os dados ex vivo para um pacote estatístico selecionado. Aplique os seguintes testes estatísticos aos dados ex vivo coletados dos eletrodos fabricados sob medida e padrão da indústria (por exemplo, 8.000 amostras representativas das formas de onda senoidal, triangular e quadrada). Defina o nível alfa a priori em p ≤ 0,05.
- Para testar o nível de concordância do sinal entre os eletrodos, use correlações intraclasse (ICCs) e gráficos de Bland-Altman. Calcule as estimativas do ICC e seus intervalos de confiança de 95% com base em um modelo de classificação única (k = 2), concordância absoluta e efeitos aleatórios de 2 vias.
- Para testar o grau em que o registro das formas de onda covariou ao longo do tempo, também conhecido como sincronia temporal, execute a correlação de Pearson nos valores coletados com os eletrodos fabricados sob medida e padrão da indústria.
- Compare a impedância média do eletrodo para ambas as superfícies de contato (medida a 1 kHz) de eletrodos fabricados sob medida selecionados (por exemplo, 10 eletrodos) com a impedância do eletrodo padrão da indústria.
NOTA: Os valores de impedância do eletrodo serão diferentes com base no caso de uso e nos materiais usados durante a fabricação do eletrodo.
- Para avaliar a qualidade das gravações in vivo , importe os dados coletados durante a caminhada na esteira para um pacote estatístico selecionado.
- Para avaliar a validade do eletrodo fabricado sob medida durante o teste in vivo (onde a marcha do rato foi perturbada por meio de caminhada em subidas e descidas para induzir alterações fisiológicas na atividade muscular), realize o teste t de Welch para comparar os valores médios de pico para condições de caminhada em subidas e descidas.
NOTA: Os leitores são encorajados a realizar testes e análises adicionais (por exemplo, avaliações da relação sinal-ruído (SNR); consulte Conceitos Fundamentais de Delysys na Aquisição de Sinal EMG) que não são apresentados aqui para brevidade16. - Para avaliar a confiabilidade da sinalização do eletrodo ao longo do tempo, avalie os dados longitudinais coletados durante condições consistentes (caminhada nivelada a 16 m/min em intervalos de 14 e 56 dias após o implante) por meio de testes t pareados.
- Para avaliar a validade do eletrodo fabricado sob medida durante o teste in vivo (onde a marcha do rato foi perturbada por meio de caminhada em subidas e descidas para induzir alterações fisiológicas na atividade muscular), realize o teste t de Welch para comparar os valores médios de pico para condições de caminhada em subidas e descidas.
Access restricted. Please log in or start a trial to view this content.
Resultados
Desempenho ex vivo
Os ICCs revelaram altos níveis de concordância entre os eletrodos fabricados sob medida e os padrões da indústria em todas as formas de onda (seno [ICC = 0,993], quadrado [ICC = 0,995], triângulo [ICC = 0,958]; p < 0,001). Os gráficos de Bland-Altman também revelaram um alto grau de concordância de sinal entre os eletrodos. Os gráficos de Bland Altman e as correlações de Pearson estão resumidos na Figura 3
Access restricted. Please log in or start a trial to view this content.
Discussão
Nosso objetivo era agilizar o processo de fabricação de EMG, permitindo uma adoção e implementação mais amplas de projetos de eletrodos epimísios, promovendo assim a acessibilidade e avançando na pesquisa neuromuscular. Para isso, apresentamos um guia fácil de usar para fornecimento, fabricação e teste de eletrodos epimísios de baixo custo internamente. Na esperança de apoiar outros grupos de pesquisa, também fornecemos modelos suplementares de impressão 3D para facilitar ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes conhecidos ou relacionamentos pessoais que possam ter influenciado o trabalho relatado neste artigo.
Agradecimentos
Este trabalho foi apoiado pelo Instituto Nacional de Artrite e Doenças Musculoesqueléticas e de Pele Grant R01AR081235 (para LK Lepley). Os autores agradecem aos seguintes indivíduos por sua contribuição para a fabricação e teste de nosso eletrodo biocompatível: Joel Pingel, Grant Gueller, Akhil Ramesh, Joe Letner, Jacky Tian e Ross Brancati.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
Referências
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), discussion 799 794-799 (2014).
- Loeb, G. E., Gans, C. Electromyography for Experimentalists. , University of Chicago Press. Chicago, IL. (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009(2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099(2021).
- Impedance measurement of bipolar stimulation electrodes immersed in medium. Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. 2018 EMF-Med 1st World Conf. Biomed. Appl. Electromagn. Fields EMF-Med, , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586(2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345(2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793(2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279(2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010(2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694(2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. Koch, K. P., Leinenbach, C., Stieglitz, T. IFESS 5th Conf, , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33(2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados