Method Article
Um ensaio in vitro para estudar a migração plaquetária usando amarras Avidina-Biotina Funcionalizadas por RGD
Neste Artigo
Resumo
Um protocolo detalhado para imagens de plaquetas migratórias únicas usando amarras avidina-biotina funcionalizadas por RGD com densidade ajustável é fornecido, revelando que as plaquetas geram força suficiente para romper a ligação avidina-biotina.
Resumo
Apesar de serem fragmentos de células anucleadas, as plaquetas são agora amplamente reconhecidas por suas habilidades multifacetadas. Eles não apenas formam coágulos sanguíneos para prevenir o sangramento após a lesão, mas também combatem infecções e mantêm a integridade vascular durante doenças inflamatórias. Embora os tampões hemostáticos exijam a ativação coletiva e a agregação de plaquetas, seu papel na proteção dos vasos sanguíneos inflamados é desempenhado no nível de uma única célula. Nesse contexto, dados recentes têm mostrado que as plaquetas podem migrar de forma autônoma, processo dependente da mecanosenização de seu ambiente adesivo. Aqui, é apresentado um protocolo detalhado para a geração de imagens de migração plaquetária única, utilizando um sistema de revestimento de três camadas que consiste em um enxerto de poli-L-lisina poli(etilenoglicol) (PLL-PEG)-estrutura de biotina (1), um ligante de avidina fluorescente (2) e biotina-Arg-Gly-Asp cíclico (cRGD) (3) como motivo de ligação à integrina plaquetária. Essa abordagem reducionista permite o controle preciso das propriedades de adesão do substrato e serve como um ensaio in vitro simples e padronizado para estudar os mecanismos subjacentes à migração plaquetária. Os resultados indicam que a ligação de plaquetas migratórias à cRGD exerce forças capazes de romper a ligação avidina-biotina. Além disso, a densidade da biotina-cRGD influencia significativamente a disseminação e a migração plaquetária.
Introdução
As plaquetas são pequenos fragmentos de células anucleadas derivadas de megacariócitos na medula óssea. As plaquetas ativadas se reúnem em agregados que formam a base de um coágulo sanguíneo para selar lesões vasculares na hemostasia fisiológica ou para ocluir vasos sanguíneos doentes na trombose patológica1. Nas últimas décadas, no entanto, ficou claro que as plaquetas também desempenham um papel central na fisiopatologia da inflamação, infecção e malignidade, onde interações multifacetadas com células imunes, células cancerígenas e patógenos invasores são críticas para moldar a resposta imune do hospedeiro 2,3. Dados recentes mostraram que as plaquetas têm a capacidade de migrar de forma autônoma4. Em resposta à bacteremia sistêmica, as plaquetas são recrutadas para os sinusóides hepáticos, onde aderem e migram. A migração permite que as plaquetas capturem e se liguem às bactérias, o que, por sua vez, suporta a ativação de leucócitos. Notavelmente, as plaquetas permanecem intravasculares durante esse processo e não migram para o tecido subendotelial4. Além disso, as plaquetas são sentinelas da inflamação vascular, examinando os vasos sanguíneos inflamados em busca de microlesões causadas pelo extravasamento de células imunes5 e empregando a migração para proteger os vasos sanguíneos inflamados 6,7. Aqui, as plaquetas usam suas integrinas para se ligar ao fibrinogênio depositado no endotélio inflamado. As plaquetas então formam saliências lameloidiais que lhes permitem escanear as propriedades adesivas de seu ambiente. As plaquetas então se polarizam e migram para densidades mais altas de fibrinogênio, um processo conhecido como haptotaxia. A migração plaquetária direcionada, em última análise, suporta o posicionamento em microlesões endoteliais que evitam sangramento em tecidos inflamados, incluindo músculos e pulmões.
A migração plaquetária é criticamente dependente das propriedades mecânicas do substrato adesivo 4,8. A tarefa de detectar e transduzir as propriedades mecânicas do ambiente é mediada principalmente por receptores de integrina, que são proteínas heterodiméricas transmembranares compostas por uma subunidade α e β com o domínio extracelular ligando ao ligante na matriz extracelular e o domínio intracelular ligando ao citoesqueleto de actina via proteínas adaptadoras 9,10. A integrina plaquetária mais abundante é αIIbβ3, e seu principal ligante é a fibrina (ogênio)11. O envolvimento integrina-ligante desencadeia eventos de sinalização que culminam na formação de um lamelipódio acionado por Arp2/3 que forma a borda de ataque de uma plaqueta aderente7. As plaquetas aderentes sondam instantaneamente as propriedades mecânicas de seu ambiente adesivo puxando-o4. Quando as forças de tração dependentes da miosina IIa superam a estabilidade mecânica da matriz extracelular (por exemplo, fibrina (ogênio)), as plaquetas rompem mecanicamente os ligantes enfraquecidos e usam suas saliências lamelipodiais para escanear o microambiente em busca de ligantes adesivos, estabelecer novas ligações de substrato e migrar para longe do ambiente empobrecido do ligante6. A migração celular impulsionada pela depleção mecânica não proteolítica do ligante provavelmente desempenha um papel além da função plaquetária, pois parece ser um fenômeno geral observado em células capazes de remodelar mecanicamente sua matriz adesiva8. A taxa de depleção do ligante determina a velocidade de migração e depende da estabilidade do ligante e da densidade do ligante do substrato8. As plaquetas com baixa densidade de ligantes são capazes de interromper mecanicamente os ligantes de integrina modificados (Arg-Gly-Asp cíclico (cRGD)))6,7 ligados a lamínulas de vidro com amarras de biotina-avidina com uma força de desligação de cerca de 160 piconewtons (pN)12,13,14,15.
Aqui, essas observações são exploradas para desenvolver um protocolo in vitro simples para geração de superfícies adesivas lábeis de ligantes, facilitando o estudo dos mecanismos de migração plaquetária. O revestimento adesivo descrito neste protocolo consiste em três elementos essenciais: (1) uma estrutura PLL-PEG-biotina e (2) um ligante de isotiocianato de neutravidina-fluoresceína (NA-FITC) que facilita a ligação de (3) biotina-cRGD (um ligante adesivo) à estrutura PLL-PEG-biotina (veja também a Figura 1B). A estabilidade dessa construção depende da força da ligação biotina-avidina, que pode quebrar na interface (A) PLL-PEG-biotina-NA-FITC ou (B) FITC-NA-biotina-cRGD. Além disso, a densidade dos ligantes adesivos pode ser ajustada adaptando a proporção de PLL-PEG-biotina para PLL-PEG na camada inferior. A ruptura da ligação (A) resulta na liberação de FITC do revestimento, levando a uma diminuição no sinal de fluorescência sob as plaquetas migratórias. Juntos, o revestimento descrito neste protocolo, portanto, permite o ajuste preciso das propriedades mecânicas e adesivas do substrato e fornece uma leitura fácil baseada em fluorescência da migração plaquetária.
Protocolo
Os experimentos em animais conduzidos neste estudo foram realizados em conformidade com todos os regulamentos éticos relevantes para estudos envolvendo camundongos e foram aprovados pela legislação local sobre a proteção de animais (Regierung von Oberbayern, Munique, 190-15, 2015). Camundongos C57BL/6 fêmeas e machos, com 8-10 semanas de idade (peso corporal de 20-25 g), foram utilizados neste estudo. Os detalhes dos reagentes e equipamentos usados estão listados na Tabela de Materiais.
1. Revestimento cRGD de biotina-neutravidina-biotina
- Sonicar lamínulas de vidro (24 mm x 24 mm; # 1,5) dentro de 20% HNO3 por 1 min, seguido de sonicação em isopropanol, etanol e H2O por 1 min. Após cada sonicação, enxágue as lamínulas em água destilada (ddH2O) extensivamente e, finalmente, seque-as na incubadora.
- Trate as lamínulas pré-limpas com plasma de O2 em um limpador de plasma por 2 min e, em seguida, monte com lâminas adesivas conforme descrito anteriormente16. Lâminas adesivas e lamínulas de vidro formarão um canal entre elas (como mostrado na Figura 1A).
NOTA: O tratamento eficiente com plasma é importante. Use O2 como fonte de plasma. - Encha o canal com 2,5 μL de PLL-PEG-biotina (1 mg / mL) diluído em 97,5 μL de PLL-PEG (1 mg / mL) e incube por 30 min em temperatura ambiente (RT), depois lave três vezes com PBS. PLL-PEG-biotina se liga à neutravidina na etapa seguinte, enquanto a estrutura PLL-PEG forma um substrato inerte que impede a ligação inespecífica de proteínas e plaquetas.
NOTA: A concentração de PLL-PEG-biotina nas soluções de revestimento define a densidade final dos ligantes cRGD. - Adicione 100 μL de Neutravidina-FITC (25 μg / mL) e incube por 30 min no escuro em RT, depois lave três vezes com PBS.
NOTA: Ajuste a concentração de Neutravidina-FITC para a concentração de PLL-PEG-biotina. Aumente a concentração de Neutravidina-FITC se densidades mais altas de PLL-PEG-biotina forem revestidas. - Adicione 100 μL de ciclo[Arg-Gly-Asp-D-Phe-Lys (Biotina-PEG-PEG)] (cRGD-biotina) (0,1-1 μM), incube por 30 min em RT e lave três vezes com PBS. As lamínulas estão prontas para uso. Um esquema do revestimento é representado na Figura 1B.
2. Isolamento de plaquetas de camundongo do sangue
- Prepare o tampão de Tyrode modificado, que contém 136,9 mM de NaCl, 12,1 mM de NaHCO3, 2,6 mM de KCl, 5,5 mM de glicose, 10 mM de HEPES e ajuste o pH para 7,4 e 6,5.
- Anestesiar os camundongos (seguindo protocolos aprovados institucionalmente) por injeção intraperitoneal de 0,5 mg/kg de fentanil, 5 mg/kg de midazolam e 0,05 mg/kg de medetomidina. Depois de confirmar a profundidade da anestesia por pinça do dedo do pé, remova a pele torácica com uma tesoura.
- Prepare uma seringa de 2 mL (agulha de 26 G) com 150 μL de ácido citrato-dextrose (ACD) como anticoagulante. Insira a agulha entre a segunda e a terceira costelas no lado esquerdo do esterno para tirar sangue do coração. Em seguida, eutanasiar o camundongo por luxação cervical.
NOTA: (1) Composição do tampão ACD: 85 mM de citrato de sódio tribásico desidratado e 65 mM de ácido cítrico monohidratado em 111 mM de glicose. (2) A coleta de sangue deve ser feita sem problemas para evitar a formação de coágulos. Cerca de 1 mL de sangue pode ser obtido de camundongos de 8 a 10 semanas de idade. - Misture o sangue com 1 mL de tampão de Tyrode (pH 6,5) em um tubo FACS (fundo redondo de poliestireno) de 5 mL e centrifugue a 70 x g por 20 min em RT com o freio desligado.
- Após a centrifugação, tome a parte superior (cerca de 1 mL) contendo plasma rico em plaquetas (PRP). Misture com 3 mL de tampão de Tyrode (pH 6,5) e adicione 100 ng/mL de prostaciclina (PGI2) para evitar a ativação plaquetária.
- Centrifugue a 1200 x g por 5 min em RT, descarte o sobrenadante, ressuspenda o pellet em 500 μL de tampão de Tyrode (pH 6,5) e meça a contagem de plaquetas usando um hemocitômetro.
3. Migração de plaquetas de camundongo no revestimento cRGD de biotina-neutravidina-biotina
- Complemente o tampão de Tyrode modificado (pH 7,4) com 10 x 103 / μL de plaquetas de camundongo, 1 mM de CaCl2, 2 μM de U46619 e 4 μM de sal de adenosina 5'-difosfato de sódio (ADP) e pipete um volume total de 240 μL nos canais preparados na etapa 1.
- Registre a migração de plaquetas vivas usando um microscópio invertido equipado com uma incubadora de platina. Em alternativa, incubar o canal durante 1 h a 37 °C numa incubadora.
- Fixe a amostra com paraformaldeído a 4% por 10 min em RT e lave cinco vezes com PBS.
- Permeabilize as plaquetas com Triton-X (0,2% em PBS) por 5 min e lave-as cinco vezes com PBS.
- Diluir 2,5 μL de faloidina Alexa Fluor 594 (estoque metanólico 40x) em 100 μL de PBS. Incube com plaquetas por 30 min no escuro e depois lave cinco vezes com PBS.
- Visualize as lâminas sob um microscópio de fluorescência.
4. Quantificação
NOTA: As plaquetas que formam filopódios (saliências em forma de dedo) ou lamelipódios (saliências em forma de folha) foram contadas como plaquetas aderentes4. Plaquetas com distância migratória superior a um de seu diâmetro foram definidas como plaquetas migratórias.
- Fração de plaquetas migratórias: conte os números de adesão ou migração plaquetária com a ferramenta Multiponto em Fiji. Clique com o botão direito do mouse no menu suspenso da Ferramenta Ponto na barra de ferramentas para selecionar a ferramenta Multiponto . Calcule a fração de plaquetas migratórias dividindo o número de plaquetas migratórias pelo número de plaquetas adesivas.
- Distância média de migração: Extraia a distância de migração de amostras fixas medindo o comprimento do caminho de migração "impresso" no revestimento neutravidina-FITC usando a ferramenta Linha de mão livre . Clique com o botão direito do mouse no menu suspenso de Linha reta na barra de ferramentas para selecionar a ferramenta Linha de mão livre .
- Descritores de forma de plaquetas: Gere máscaras binárias segmentando plaquetas fluorescentes (Alexa594-Faloidina) usando a função Limiar . Selecione Imagem > Ajustar > Limite na barra de ferramentas.
- Descritores de forma como área, perímetro, circularidade e proporção podem ser obtidos na análise de partículas. Selecione descritores de forma em Analisar > Definir medidas e, em seguida, selecione Exibir resultados em Analisar > Analisar partículas.
Resultados
As plaquetas ativadas aderem e se espalham prontamente em lâminas revestidas com PLL-PEG-biotina-neutravidina-FITC-biotina-cRGD (Figura 1C e Figura 2A; 0 min e 5 min) e subsequentemente polarizam formando um lamelipódio na borda de ataque (Figura 2A; 10 min). Durante esse processo, o pseudonúcleo (área escura no centro das plaquetas) se moveu do centro para a parte posterior da plaqueta (Figura 2A). As plaquetas polarizadas então começam a migrar sem direcionalidade óbvia (Figura 2A; 15 min e 20 min e Figura 2B). Observamos que as plaquetas migrando nos revestimentos PLL-PEG-biotina-neutravidina-FITC-biotina-cRGD podem quebrar a ligação neutravidina-FITC-biotina-PLL-PEG, como evidenciado pela redução da intensidade de fluorescência ao longo do caminho de migração (Figura 1C e Figura 2A,B). Além disso, o complexo neutravidina-FITC-biotina-cRGD interrompido se acumula na superfície plaquetária ( Figura 2A, B ). Esse fenômeno é semelhante a achados anteriores, onde as plaquetas migratórias removeram o fibrinogênio do substrato e o acumularam dentro de seu sistema canalicular aberto (OCS)4.
Para investigar como a densidade do ligante influencia a migração plaquetária, a densidade de cRGD foi ajustada variando a proporção de PLL-PEG-biotina para PLL-PEG na primeira camada de revestimento. Esses dados revelam que as plaquetas de camundongo atingem a migração ideal em uma concentração de 2,5% de PLL-PEG-biotina. A migração é reduzida em concentrações mais baixas (1%) e mais altas (10%) de PLL-PEG-biotina (Figura 3A, B). Essas mudanças dependentes do substrato no comportamento migratório são acompanhadas por alterações na morfologia plaquetária (Figura 3C). Em baixas densidades de ligantes (1%), as plaquetas não se espalham adequadamente, como evidenciado por uma baixa área e perímetro plaquetários projetados (Figura 3C). Isso sugere ativação insuficiente da integrina e sinalização de fora para dentro7. Consequentemente, as plaquetas são incapazes de exercer forças sobre os ligantes cRGD, não conseguem remodelar o substrato e não migram (Figura 3A, B).
Em uma densidade intermediária de ligantes (2,5%), há um aumento significativo na área e no perímetro plaquetário (Figura 3C). As plaquetas se espalham de forma eficaz, interrompendo mecanicamente os ligantes cRGD lábeis e migram ( Figura 3A, B ). No entanto, em altas densidades de ligantes (10%), embora o espalhamento aumente, as plaquetas não conseguem polarizar, indicadas por uma proporção reduzida (Figura 3C). Nessas condições, as plaquetas permanecem presas ao substrato pegajoso e não migram porque não podem quebrar os ligantes lábeis do cRGD ( Figura 3A , B ).
Esses achados demonstram que a migração plaquetária é criticamente dependente das propriedades adesivas do substrato. As plaquetas só podem migrar quando se envolvem suficientemente com ligantes adesivos e, simultaneamente, geram forças de tração fortes o suficiente para superar a tolerância à tensão do substrato adesivo 4,6,7,8.
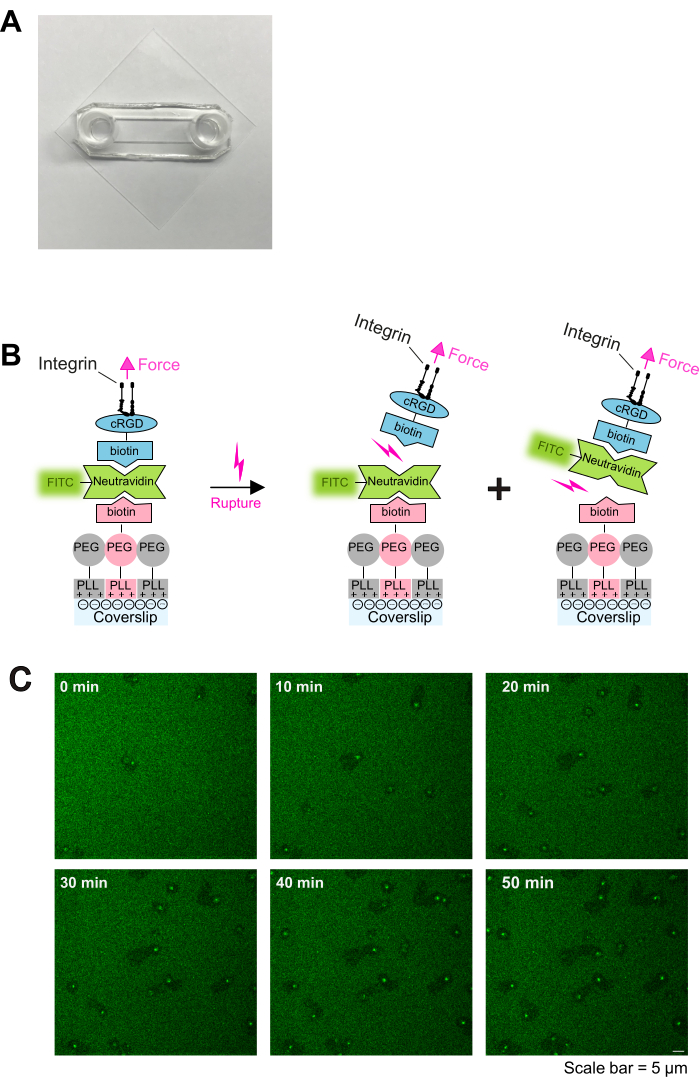
Figura 1: Procedimento de revestimento e imagem ao vivo da interação plaqueta-substrato. (A) Fotografia da câmara montada. (B) Princípio do protocolo. Esquerda: Esquema do revestimento. As lamínulas de vidro tratadas com plasma foram revestidas com três camadas. A primeira camada é a mistura de PLL-PEG e PLL-PEG-biotina (a estrutura PLL-PEG é inerte às células e evita ligações inespecíficas). A segunda camada é neutravidina-FITC e a terceira camada é biotina-cRGD. Neutravidina-FITC une PLL-PEG-biotina e biotina-cRGD. As plaquetas se ligam à biotina-cRGD por meio de integrinas na membrana plasmática. Direita: Ilustração da desligação da biotina-avidina por integrinas plaquetárias. As plaquetas exercem forças sobre o substrato por meio do envolvimento integrina-cRGD e rompem a ligação cRGD-biotina superior - neutravidina-FITC - ou a ligação neutravidina-FITC - PLL-PEG-biotina inferior. A ruptura da ligação inferior entre neutravidina-FITC e biotina-PLL-PEG resulta em um sinal fluorescente reduzido, enquanto a ruptura da ligação superior entre biotina-cRGD e neutravidina-FITC não. (C) Séries temporais mostrando migração plaquetária e depleção de ligantes cRGD lábeis. Áreas de fluorescência reduzida indicam os rastros de migração de plaquetas (ver também Figura 2A), e áreas de fluorescência aumentada indicam acúmulo de FTIC-neutravidina-biotina-cRGD em plaquetas migratórias. Barra de escala: 5 μm. Clique aqui para ver uma versão maior desta figura.

Figura 2: Imagem de imunofluorescência da migração plaquetária codificada pelo substrato remodelado. (A) Sequência de filme representativa da migração plaquetária única. Esquerda: Imagens de contraste de fase de plaquetas migratórias. As plaquetas se polarizam formando um lamelipódio na borda de ataque e subsequentemente migram. Direita: Neutravidina-FITC foi removido do substrato, deixando a "pegada" da migração plaquetária. A ruptura de cRGD-biotina-neutravidina-FITC se acumula no centro das plaquetas migratórias. (B) Imagens representativas da migração plaquetária em revestimentos de ligante lábil cRGD-biotina-avidina. Superior: Plaquetas coradas com faloidina (Alexa FluorTM 594) mostraram grande formação de lamelipódio e uma forma polarizada que lembra plaquetas migratórias. As plaquetas migratórias rompem a ligação cRGD-biotina-neutravidina-FITC, gerando caminhos de migração no substrato indicados pelo sinal FITC reduzido. Inferior: imagem recortada com ampliação maior. (C) As trilhas de migração foram desenhadas manualmente em Fiji com linhas amarelas. Barras de escala: 5 μm. Clique aqui para ver uma versão ampliada desta figura.

Figura 3: A proporção de PLL-PEG-biotina para PLL-PEG determina a migração e a forma das plaquetas. (A) Imagens representativas de plaquetas em revestimentos de PLL-PEG-biotina a 1%, 2,5% e 10%, barra de escala: 5μm. (B) Quantificação da adesão plaquetária, eficiência de migração e distância de migração, n = 4 experimentos independentes; Média/DP; ANOVA unidirecional/Tukey; **p < 0,01; p < 0,001; p < 0,0001, ns: não significativo (C) Quantificação dos descritores de forma plaquetária (área, perímetro, circularidade e proporção), n = 4 experimentos independentes; Média/Min-Máx; ANOVA unidirecional/Tukey; **p < 0,01; p < 0,001; p < 0,0001, NS: não significativo. Clique aqui para ver uma versão maior desta figura.
Discussão
Neste protocolo, é apresentado um procedimento de revestimento de três camadas que consiste em (1) uma estrutura PLL-PEG-biotina e (2) um ligante neutravidina-FITC que facilita a ligação de (3) biotina-cRGD (um ligante adesivo) à estrutura PLL-PEG-biotina (veja também a Figura 1B) que permite o ajuste preciso das propriedades mecânicas e adesivas do substrato, variando a proporção de PLL-PEG-biotina para PLL-PEG e fornece uma leitura fácil baseada em fluorescência da migração plaquetária. Embora este protocolo use neutravidina conjugada com FITC e faloidina conjugada com Alexa Fluor 594 para rastrear a migração e a forma das plaquetas, outras avidinas e faloidinas conjugadas com fluoróforo podem ser usadas. Como todos os reagentes de revestimento, incluindo PLL-PEG, PLL-PEG-biotina, neutravidina-FITC e cRGD-biotina, bem como os ativadores plaquetários, estão disponíveis comercialmente, esse experimento pode ser realizado sem muito esforço adicional. A etapa crítica é o tratamento com plasma porque o tratamento ineficiente com plasma leva à ligação inadequada de PLL-PEG / PLL-PEG-biotina ao substrato, resultando em falha na adesão e migração plaquetária. O desempenho do limpador de plasma é importante. Em geral, os limpadores de plasma com geradores de 13,6 MHz têm um desempenho melhor do que aqueles com 40 KHz ou 100 KHz. Além disso, uma fonte de plasma de oxigênio é mais adequada do que o ar ambiente. Após o tratamento bem-sucedido com plasma, as etapas de revestimento quase não são propensas a erros.
As plaquetas já demonstraram usar o modo mesenquimal de migração, que é altamente dependente de aderências de substrato 4,17. Análoga aos fibroblastos, as baixas densidades de ligantes impedem a migração, pois as plaquetas lutam para aderir ao substrato, enquanto as altas densidades de ligantes dificultam a migração, impedindo o desengate de aderências firmes18 (Figura 3). Em densidades intermediárias, as plaquetas aderem enquanto as forças de tração dependentes da miosina IIA por ligação de integrina ainda são suficientes para quebrar as aderências. Vale ressaltar que a alta afinidade entre a integrina αIIbβ3 e seu ligante fibrina (ogênio) resulta na desmontagem das aderências não pela liberação do ligante adesivo, mas sim por sua ruptura ou desprendimento do substrato subjacente, como células endoteliais in vivo ou lamínulas in vitro 4,6. A força de desligação necessária para separar o fibrinogênio do substrato subjacente é fortemente influenciada por propriedades físicas e (bio) químicas que muitas vezes são difíceis de controlar, o que pode levar a uma variabilidade significativa na eficiência da migração. O ensaio apresentado aqui oferece uma abordagem reducionista para abordar esse problema. No entanto, a força de ruptura da ligação avidina-biotina é fixada em torno de 160 pN, portanto, sensores de tensão mais sofisticados, como aqueles baseados em uma corda de DNA de fita dupla, devem ser usados para estudar a adesão plaquetária em regimes de força mais baixos19.
Estudos anteriores descobriram que a migração plaquetária está envolvida na infecção bacteriana e na inflamação vascular in vivo. Consequentemente, plaquetas com defeitos de migração, como contratilidade de miosina prejudicada, polimerização de actina ou sinalização de fora para dentro da integrina, apresentam comprometimento da depuração bacteriana e integridade vascular 4,6,7. O ensaio aqui apresentado é simples, estável e, portanto, adequado para a triagem de pequenos inibidores moleculares e seus efeitos na migração plaquetária. Ele fornece uma nova ferramenta in vitro para explorar alvos terapêuticos na inflamação ou trombose.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pela Deutsche Forschungsgemeinschaft (DFG; Fundação Alemã de Pesquisa) 514478744 e 514477451 para F.G. O projeto é financiado pela União Europeia (ERC, MEKanics, 101078110). Os pontos de vista e opiniões expressos são apenas do(s) autor(es) e não refletem necessariamente os da União Europeia ou da Agência de Execução do Conselho Europeu de Investigação. Nem a União Europeia nem a autoridade que concede o auxílio podem ser responsabilizadas por eles.
Materiais
| Name | Company | Catalog Number | Comments |
| Adenosine 5′-diphosphate sodium salt (ADP) | Sigma-Aldrich | A2754 | |
| Alexa Fluor 594 phalloidin | Thermofisher | A12381 | |
| Blood counter | Sysmex | XN-1000 | |
| Bottomless 6 channel sticky slide | IBIDI, sticky slides VI0.4 | 80608 | |
| Centrifuge | Eppendorf | 5804 | |
| Confocal microscope | Zeiss | LSM880 | |
| cyclo [Arg-Gly-Asp-D-Phe-Lys(Biotin-PEG-PEG)] | Peptide international | PCI-3697-PI | |
| FACS tubes | Corning Brand | 352052 | |
| FITC conjugate neutravidin | Thermofisher | A2662 | |
| Formaldehyde | Thermofisher | 28908 | |
| HEPES solution | Sigma-Aldrich | H0887 | |
| Phase contrast and epifluorescent microscope | Olympus | IX83 | |
| Plasma cleaner | Diener | 116531 | |
| PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin(50%) | Susos | PLL(20)-g[3.5]-PEG(2)/PEG(3.4)-biotin (50%) | |
| Poly(L-lysine)-graft-poly(ethylene glycol) co-polymer | Susos | PLL(20)-g[3.5]-PEG(2) | |
| Prostaglandin I2 sodium salt (PGI2) | Abcam | ab120912 | |
| Sonicator | BANDELIN | SONNOREX RK514M | |
| Ttriton X-100 20% v/v | Cayman Chemical | 600217 | |
| U46619 | Enzo Life Sciences | BML-PG023-0001) |
Referências
- Jackson, S. P. Arterial thrombosis--insidious, unpredictable and deadly. Nat Med. 17, 1423-1436 (2011).
- Kaiser, R., Escaig, R., Nicolai, L. Hemostasis without clot formation: how platelets guard the vasculature in inflammation, infection, and malignancy. Blood. 142 (17), 1413-1425 (2023).
- Gaertner, F., Massberg, S. Patrolling the vascular borders: Platelets in immunity to infection and cancer. Nat Rev Immunol. 19 (12), 747-760 (2019).
- Gaertner, F., et al. Migrating platelets are mechano-scavengers that collect and bundle bacteria. Cell. 171 (6), 1368-1382.e23 (2017).
- Gros, A., et al. Single platelets seal neutrophil-induced vascular breaches via GPVI during immune-complex-mediated inflammation in mice. Blood. 126 (8), 1017-1026 (2015).
- Nicolai, L., et al. Vascular surveillance by haptotactic blood platelets in inflammation and infection. Nature Comm. 11, 5778 (2020).
- Kaiser, R., et al. Mechanosensing via a GpIIb/Src/14-3-3zeta axis critically regulates platelet migration in vascular inflammation. Blood. 141 (24), 2973-2992 (2023).
- Sarkar, A., LeVine, D. N., Kuzmina, N., Zhao, Y., Wang, X. Cell migration driven by self-generated integrin ligand gradient on ligand-labile surfaces. Curr Biol. 30 (20), 4022-4032 (2020).
- Hynes, R. O. Integrins: Bidirectional, allosteric signaling machines. Cell. 110 (6), 673-687 (2002).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nat Rev Mol Cell Biol. 20, 457-473 (2019).
- Shattil, S. J., Newman, P. J. Integrins: Dynamic scaffolds for adhesion and signaling in platelets. Blood. 104 (6), 1606-1615 (2004).
- Yuan, C., Chen, A., Kolb, P., Moy, V. T. Energy landscape of streptavidin-biotin complexes measured by atomic force microscopy. Biochemistry. 39 (33), 10219-10223 (2000).
- Florin, E. L., Moy, V. T., Gaub, H. E. Adhesion forces between individual ligand-receptor pairs. Science. 264 (5157), 415-417 (1994).
- Merkel, R., Nassoy, P., Leung, A., Ritchie, K., Evans, E. Energy landscapes of receptor-ligand bonds explored with dynamic force spectroscopy. Nature. 397, 50-53 (1999).
- Jurchenko, C., Chang, Y., Narui, Y., Zhang, Y., Salaita, K. S. Integrin-generated forces lead to streptavidin-biotin unbinding in cellular adhesions. Biophys J. 106 (7), 1436-1446 (2014).
- Fan, S., Lorenz, M., Massberg, S., Gaertner, F. Platelet migration and bacterial trapping assay underflow. Bio-Protocol. 8 (18), e3018 (2018).
- Lauffenburger, D. A., Horwitz, A. F. Cell migration: A physically integrated molecular process. Cell. 84 (3), 359-369 (1996).
- Palecek, S. P., Loftus, J. C., Ginsberg, M. H., Lauffenburger, D. A., Horwitz, A. F. Integrin-ligand binding properties govern cell migration speed through cell-substratum adhesiveness. Nature. 385, 537 (1997).
- Zhao, Y., Wetter, N. M., Wang, X. Imaging integrin tension and cellular force at submicron resolution with an integrative tension sensor. J Vis Exp. (146), e59476 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados