Formação de organoides do timo humano em hidrogéis de fibrina tridimensionais
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, descrevemos um protocolo para a formação de organoides de timo derivados de iPSC humanos cultivados em hidrogéis de fibrina 3D com o objetivo de apoiar a maturação e manutenção prolongada das células epiteliais tímicas (TEC), bem como a timopoiese in vitro.
Resumo
A geração de um repertório de células T funcional e autotolerante é um processo complexo dependente do microambiente tímico e, principalmente, das propriedades de sua matriz extracelular (MEC). As células epiteliais tímicas (TECs) são cruciais na timopoiese, nutrindo e selecionando células T em desenvolvimento filtrando clones auto-reativos. Os TECs demonstraram empiricamente ser particularmente sensíveis às pistas físicas e químicas fornecidas pela ECM e a cultura de células monocamada clássica leva a uma rápida perda de funcionalidade até sua morte. Devido a essa manutenção delicada combinada com a relativa raridade, e apesar dos altos riscos na modelagem da biologia do timo in vitro, ainda faltam modelos capazes de imitar fielmente o nicho TEC em escala e ao longo do tempo. Aqui, descrevemos a formação de um modelo organoide tímico humano multicelular, no qual o compartimento TEC é derivado de células-tronco pluripotentes induzidas por humanos (iPSC) e reagregado com progenitores primários de timócitos iniciais em um hidrogel tridimensional (3D) à base de fibrina. Este modelo responde às necessidades atuais de um sistema de cultura escalável que reproduza o microambiente tímico ex vivo e demonstre funcionalidade, ou seja, a capacidade de produzir células T e apoiar o crescimento do organoide do timo ao longo de várias semanas. Assim, propomos um modelo prático in vitro da funcionalidade do timo por meio de organoides derivados de iPSC que beneficiaria a pesquisa em biologia TEC e geração de células T ex vivo.
Introdução
O timo é um órgão linfóide primário que desempenha um papel essencial na geração de um sistema imunológico competente e tolerante 1,2,3. Os primeiros progenitores tímicos (ETPs) migram da medula óssea para o timo, onde se expandem e se diferenciam em células T funcionais 1,2,4,5. Esses processos são mediados por uma população especializada, as células epiteliais tímicas (TEC)2,6,7. Os TECs derivam de progenitores epiteliais tímicos (TEPs) 8 , 9 e compreendem TECs corticais (cTECs) e TECs medulares (mTECs) que desempenham papéis específicos na criação do microambiente 3D especializado necessário para a migração, expansão e maturação de células T. As TECs medeiam o desenvolvimento de células T principalmente fornecendo fatores de crescimento e diferenciação 1,10,11 e selecionando negativamente timócitos não funcionais e não tolerantes por meio da apresentação de autoantígenos 5,7,12. As complexas interações entre células T em desenvolvimento e TECs também desempenham um papel central na maturação e organização 3D das populações TEC em um processo conhecido como crosstalk tímico 1,11. As interações entre as populações de células do timo dependem profundamente do microambiente específico moldado pela matriz extracelular (MEC). A MEC tímica está em um estado de reciprocidade dinâmica com as populações de células tímicas, impactando a regulação gênica e sendo constantemente remodelada em troca pela secreção de enzimas ou proteínas da matriz13. A MEC influencia as células por meio da modificação da biodisponibilidade de fatores de crescimento e citocinas, sinalização direta por meio de receptores ligados à membrana, como integrinas, e modelagem de citoesqueletos por meio de forças físicas14. Os componentes da ECM tímica, como colágenos e laminina, demonstraram ter uma alta afinidade pelos fatores de crescimento TGFb e FGFs, que são cruciais para a manutenção do TEC e para fixá-los formando complexos. A plasticidade, o módulo de elasticidade e a densidade da ECM tímica também desempenham um papel crucial na instrução do destino do TEC e na formação da compartimentalização do timo, que é essencial para sua funcionalidade. Essas pistas destacam a importância de levar em consideração a ECM e sua estrutura 3D para mimetizar o timo ex vivo. Este ponto é apoiado pelo fato de que os TECs primários se desdiferenciam rapidamente, perdem sua funcionalidade e, eventualmente, morrem quando cultivados em configurações clássicas de cultura de células15 , 16 , 17 .
Modelos de cultura foram desenvolvidos para expandir as populações de TEC funcionais a partir de explantes tímicos humanos, a fim de conservar a estrutura da ECM e as pistas cruciais que ela fornece aos TECs 18,19,20. Este sistema de cultura foi capaz de expandir e manter com sucesso uma população de TECs funcionais in vitro, mas não pôde ser sustentado após 7 a 8 dias de cultura18. Assim, o desenvolvimento de um sistema de cultura 3D acessível e prático capaz de reproduzir o microambiente tímico e sua funcionalidade in vitro e a longo prazo é uma aposta crucial no campo. Recentemente, o desenvolvimento de sistemas de cultura 3D baseados em hidrogel levou ao surgimento de vários sistemas organoides tímicos artificiais, constituindo um grande progresso para a modelagem tímica in vitro 15,16,21,22. Desenvolvemos um sistema de co-cultura de organoide tímico humano (hTO) por meio da reagregação de ETPs primárias humanas com TEPs humanas derivadas de células-tronco pluripotentes induzidas (iPSC) em esferoides e sua semeadura em um hidrogel de fibrina.
A escolha do material e da configuração do hidrogel neste estudo teve como objetivo reproduzir a estrutura nativa da ECM tímica, mantendo a praticidade e a capacidade de ampliar o processo para obter uma fonte de material acessível e abundante para experimentos15. Este sistema hTO mostra potencial de diferenciação de múltiplas linhagens e pode suportar uma timopoiese produtiva de ETPs23. Este sistema organoide constitui uma ferramenta confiável para o estudo das interações celulares intratímicas e a modelagem da linfopoiese humana normal e patológica. O uso de células iPS também introduz recursos de edição de genes no modelo. A diferenciação efetiva de iPSC em tecido tímico funcional tem sido um objetivo de longa data do campo nos últimos 15 anos, e um progresso significativo foi feito com a decifração da sinalização do destino da linhagem TEC 21,24,25,26,27. Para responder à necessidade de tal modelo tímico 3D in vitro, esta nota técnica descreve os métodos e detalhes técnicos para a geração passo a passo de organoides de timo humano derivados de iPSC, com foco na formação de andaimes de hidrogel, reagregação e semeadura de micromassa celular e cultura e colheita de organoides.
Protocolo
A linha hiPSC hiN.Fm.m.Lon71.019 foi gerada a partir de fibroblastos adultos masculinos e reprogramada via transfecção de mRNA. A linha hiPSC hiN.Fm.f.Lon80.002 foi gerada a partir de fibroblastos adultos femininos e reprogramada via transfecção de mRNA. A linha hiPSC hiN.Fs.f.MIPS203.003 foi gerada a partir de fibroblastos adultos femininos e reprogramada via infecção por vetor viral Sendai recombinante. Todas as linhagens celulares foram fornecidas pela plataforma Nantes iPSC. Os pacientes deram consentimento informado para que suas células fossem usadas para fins de pesquisa (coleção anônima, Lonza, cat # CC-2511). As ETPs primárias são isoladas por dissociação de amostras tímicas humanas pós-natais obtidas como resíduos descartados anonimizados de pacientes submetidos a cirurgia cardíaca pediátrica no Hospital de Nantes (CHU Nantes) no mesmo dia, em conformidade com o regulamento francês CODECOH sob a declaração DC-2017-2987.
1. Diferenciação direcionada de iPSCs para uma identidade TEP
NOTA: Desde os primeiros trabalhos publicados por Lai e Jin demonstrando a diferenciação de células-tronco embrionárias murinas (EScs) em direção a uma identidade epitelial tímica28, vários estudos desenvolveram e otimizaram protocolos descrevendo a diferenciação direcionada de células iPS humanas para uma identidade TEP21 , 24 , 25 , 26 , 27 , 29. Esses estudos levam à diferenciação de TEPs que expressam marcadores de identidade epitelial tímica, como FOXN1 e PAX9 24,25,28,30, bem como marcadores de funcionalidade, como DLL4 e AIRE26, mas sem marcadores de maturação TEC24,25. Duas abordagens demonstraram apoiar a maturação dos TEPs diferenciados para uma identidade TEC madura: transplante em um modelo in vivo, como camundongos29, e reagregação em sistemas organoides tímicos 3D cultivados em uma configuração de interface ar-líquido21. Ambos os sistemas demonstraram o papel crucial desempenhado pela estrutura 3D na manutenção e suporte à maturação de populações TEC funcionais capazes de suportar a linfopoiese T in vivo ou in vitro 15,24,25,31.
- Para o sistema organoide tímico utilizado neste estudo, realizar a diferenciação de células iPS em direção a uma identidade TEP seguindo um protocolo desenvolvido e detalhado em Provin et al.23.
2. Isolamento de ETPs primárias de uma amostra tímica pediátrica
NOTA: As ETPs são progenitores originários da medula óssea que dão origem à linhagem de células T e às células dendríticas dentro do timo e exibem o seguinte fenótipo: CD3- CD4- CD8- CD14- CD19- CD56- CD45+ CD34+ CD7+32,33.
- Preparação das contas de esgotamento
- No dia anterior, transfira os grânulos de isolamento de células magnéticas (Tabela de Materiais) para um tubo de 15 mL e lave com 4 mL de tampão de isolamento (PBS + 0.1% BSA + 2 mM EDTA).
- Coloque o tubo no suporte magnético, remova o sobrenadante e adicione 2 mL de tampão de isolamento.
- Adicione anticorpos anti-CD3, CD4 e CD8 humanos de camundongo às esferas e incube por 45 min a 4 ° C sob agitação. Coloque o tubo no suporte magnético, lave-o várias vezes em tampão de isolamento e ressuspenda-o em 20 mL de tampão de isolamento.
- Dissociação da amostra de timo
- Transfira amostras frescas de timo para uma placa de Petri cheia de RPMI1640 (Tabela de Materiais). Corte-o com tesoura de dissecação estéril e alicate em pedaços de cerca de 1 mme 3 de tamanho.
- Com uma pipeta de 25 mL, lave o meio e os fragmentos várias vezes (o meio deve ficar turvo), depois deixe os fragmentos sedimentarem e coletar metade do meio em um tubo de 50 mL. Adicione mais meio e repita até que o meio fique claro.
- Colete o meio em quantos tubos de 50 mL forem necessários e gire os tubos a 200 x g por 5 min.
- Remova o sobrenadante e ressuspenda os grânulos em 10 mL de solução de lise de glóbulos vermelhos (Tabela de Materiais). Incube em temperatura ambiente (RT) por 5 min e adicione 20 mL de tampão de lavagem (PBS + 0,5% BSA + 4 mM EDTA + 1% de penicilina/estreptomicina).
- Gire a 200 x g por 5 min e remova o sobrenadante. Ressuspenda os pellets em 10 mL de tampão de lavagem, passe por um filtro de malha de 70 μm e conte as células.
- Enriquecimento de ETP
- Depois de contar as células, ajuste o volume para 10 mL por tubo com o tampão de lavagem. Adicione a quantidade necessária de grânulos de isolamento celular (por 200 milhões de células, use 500 μL de grânulos em 20 mL de tampão de isolamento) e incube a 4 ° C sob agitação por 30 min.
- Coloque o tubo no suporte magnético por 2 min e colete cuidadosamente o sobrenadante em um tubo limpo. Remova o tubo e limpe os grânulos com 20 mL de tampão de isolamento. Vortex o tubo, coloque-o de volta no suporte magnético e colete o sobrenadante. Repita esta etapa duas vezes.
- Girar os sobrenadantes a 200 x g durante 5 min. Ressuspenda os pellets em 2 mL de tampão de isolamento e conte as células.
- Isolamento de ETP
- Ajuste a concentração para 200 milhões de células por mL e colete um pequeno volume como controle não corado.
- Rotule as células com anticorpos anti-linhagem humana de camundongo (Lin) (CD3, CD4, CD8, CD14, CD19, CD56), CD7 e CD34 (use o mesmo fluorocromo para todos os marcadores Lin). Incubar a 4 °C durante 45 min.
- Lave as células em um volume igual de tampão de lavagem. Gire as células a 200 x g por 5 min, ressuspenda o pellet em 1 mL e conte as células.
- Ajuste o volume para uma concentração de 50 milhões de células por mL e coe as células através de um filtro de malha de 70 μm.
- Adicione o marcador de viabilidade de escolha e classifique as células vivas Lin-CD34+ CD7+ por citometria de fluxo usando um bico de 70 μm.
3. 3D cultura de organoides tímicos
- Preparação TEP
- Imediatamente após o isolamento da ETP, controlar a qualidade da cultura da PTE nos dias 13-15. Certifique-se de que as células atinjam a confluência e formem uma monocamada densa com protuberâncias (Figura 1).
- Para colher os TEPs diferenciados, lave as células com DPBS-/-, remova-as, adicione 1 mL de TrypLE (Tabela de Materiais) por poço e incube a 37 ° C por 5-7 min.
- Adicione 1 mL de XVIVO10 (Tabela de Materiais) por poço, lave várias vezes para separar as células, transfira para um tubo de 15 mL e gire a 200 x g por 5 min.
- Remova o sobrenadante, ressuspenda o pellet em 1 mL de XVIVO10 e conte as células.
NOTA: Para avaliar a eficácia da diferenciação antecipadamente, use um poço de cultura separadamente e verifique a expressão de FOXN1 e PAX9 por RT-qPCR e o rendimento da diferenciação por citometria de fluxo (calculado como a fração de células EPCAM+ CD205+, que deve estar acima de 50%) (Figura 1). Nesse estágio de diferenciação, quase todas as células EPCAM+ também são positivas para CD205, atestando sua identidade precursora11.
- Preparação da ETP
- Imediatamente após o isolamento da ETP, gire o tubo de coleta a 200 x g por 5 min. Ressuspenda o pellet em 1 mL de XVIVO10 e conte as células.
- Agregação de organoides tímicos
- Pipetar os volumes adequados e agrupar ambas as suspensões celulares a uma concentração de 2,00,000 TEP e 40,000 ETP por ml, pipetar suavemente para cima e para baixo uma vez para homogeneizar.
- Adicione os suplementos adequados de acordo com a Tabela 1 e coloque 100 μL da suspensão de células mistas por poço em placas de 96 poços com fundo em U de baixa ligação. Use uma pipeta multicanal para aumentar a produção; no entanto, uma pipeta clássica de ponta única limita a perda de volumes de células preciosas. Incubar as placas a 37 °C e 5% de CO2 durante a noite.
- Preparação dos hidrogéis
NOTA: A configuração experimental usada para formação de hidrogel, semeadura de organoides e distribuição do meio de cultura é mostrada na Figura 2.- No dia seguinte (dia 1 da fase de cultura organoide), descongele alíquotas de trombina (10 U / mL), aprotinina (26.000 U / mL) e fibrinogênio (8 mg / mL) (Tabela de Materiais). Descongele a trombina e a aprotinina no gelo e o fibrinogênio em banho-maria a 37 °C (não coloque no gelo, pois precipitará). Não vórtice, mas coloque as alíquotas sob o capô e homogeneize-as por pipetagem suave.
- Prepare quantas inserções suspensas forem necessárias para o número de organoides produzidos seguindo as proporções apresentadas na Tabela 2. Coloque as inserções nos poços de cultura usando um alicate estéril e deixe pelo menos uma coluna ou linha vazia na placa de cultura.
- Prepare tantos tubos de 1,5 mL quanto géis a serem fundidos. Em cada tubo, pipete primeiro os volumes necessários de Fibrinogênio e Aprotinina, conforme detalhado na Tabela 2.
- Em uma segunda vez, adicione o volume de trombina necessário em um único tubo, lave rapidamente 2 vezes sem criar bolhas para homogeneizar os reagentes, depois retire todo o conteúdo do tubo e lave rapidamente a mistura no inserto suspenso. Posicione a pipeta verticalmente acima do centro do inserto e lave suavemente a mistura de reagentes sem gerar bolhas.
NOTA: Nesta etapa, a velocidade de execução é crucial, pois os reagentes irão polimerizar em poucos segundos, e é importante misturá-los corretamente para evitar a formação de grumos ou densidade irregular no gel. Proceda um poço de cada vez usando um tubo diferente de 1,5 mL para cada poço (se um tubo for reutilizado para vários poços, os pedaços de gel sólido restantes podem bloquear a ponta da pipeta). Se a polimerização ocorrer muito rapidamente devido à alta atividade da trombina, use uma diluição de 1:2. Logo após a fundição, os géis devem ser transparentes a ligeiramente translúcidos e ainda fluir após alguns segundos quando a placa é inclinada verticalmente. - Incubar durante, pelo menos, 1 h a 37 °C até que a solução transparente solidifique e se torne branca opaca, e os géis permaneçam firmemente no lugar quando a placa é inclinada verticalmente (figura 2A).
- Semeadura de organoides
- Verifique a qualidade da etapa de agregação. Certifique-se de que as micromassas formem massas celulares esféricas, com um núcleo compacto cercado por um halo de ETPs de menor densidade (Figura 3).
- Corte a ponta de um cone P200 e lave-o com uma solução antiaderente (Tabela de Materiais). Para colher as massas celulares, incline a placa para uma posição quase vertical: as micromassas afundarão na parede inferior dos poços e podem ser facilmente recuperadas empurrando progressivamente a ponta da pipeta para o fundo do poço durante a aspiração.
- Semeie a massa no topo dos hidrogéis, depositando-os delicadamente sem tocar no gel com a ponta da pipeta, seguindo as proporções apresentadas na Tabela 1 (Figura 2B). Mesmo que os organoides pareçam flutuar livremente nesta fase, quando inchados com meio de cultura, o gel amolecerá e os organoides se aninharão na camada superior. Verifique ao microscópio se nenhum organoide foi deixado nos poços P96.
- Prepare o volume necessário de meio de cultura de acordo com a Tabela 1 e a Tabela 2 e, em cada poço, adicione lentamente um quarto do volume no topo dos hidrogéis sem tocá-los pipetando ao longo das paredes do inserto e os três quartos restantes no fundo do poço, posicionando a pipeta entre os braços do inserto suspenso (Figura 2C).
- Coloque 1 mL de PBS nos poços de cultura vazios para manter a umidade na placa. Incubar a 37 °C e 5% de CO2.
- Cultura de organoides tímicos
- No dia 2, verifique se os organoides estão bem semeados: os hidrogéis devem ter permanecido no lugar e os organoides não devem ter sedimentado na parte inferior da inserção.
- Preparar a quantidade necessária de meio de cultura seguindo as tabelas 1 e 2. Remova o meio direcionando a ponta do cone de aspiração entre os braços da inserção suspensa, certificando-se de não tocar no gel. Adicione o novo meio posicionando a pipeta da mesma maneira.
- Troque o meio a cada 2 dias, mudando para o meio de segunda fase (Tabela 1) após 2 a 4 dias (no dia 18 após o início da diferenciação TEP).
NOTA: O lote organoide pode ser mantido em cultura desta forma até 6 semanas.
- Colheita de organoides
- Prepare um tubo de 15 mL com 1 mL de TrypLE por poço para colher.
- Corte a ponta de um cone P1000 e cubra-o com uma solução antiaderente. Pipete suavemente o gel colocando a ponta da pipeta verticalmente no centro das inserções (cuidado para não perfurar a membrana) e transfira para o tubo TrypLE. Lave a membrana do inserto com TrypLE e transfira também para o tubo.
- Incubar a 37 °C durante 15 min, agitando suavemente em intervalos de 5 min. Certifique-se de que os géis e organoides se dissociam.
- Após 15 min, coe em um filtro de malha de 70 μm e gire a 200 x g por 5 min. Ressuspender o pellet no tampão de lavagem e proceder ao método analítico escolhido.
Resultados Representativos
O fluxo de trabalho do protocolo está resumido na Figura 4. Para este modelo de cultura organoide 3D, adotamos um hidrogel de trombina e fibrinogênio que já havia sido usado por nossa equipe para manter mTECs primários de camundongos por alguns dias, graças às pistas físicas e mecânicas que forneceu34. Após a polimerização, o gel deve apresentar uma estrutura de malha solta e esponjosa (Figura 5).
Após a fase inicial de semeadura e fixação, os organoides cresceram e se desenvolveram progressivamente tanto na superfície quanto nas camadas superiores do gel. Dependendo das propriedades do gel, das condições de semeadura e do número de organoides semeados no gel, os organoides formaram estruturas esféricas a oblongas (Figura 6) e ocasionalmente se fundiram para formar estruturas maiores. Dois subníveis específicos da organização foram observados dentro dos organoides após a primeira semana de cultura: primeiro, observamos estruturas longas semelhantes à projeção da superfície celular formadas por grandes células irradiando dos organoides e colonizando o hidrogel em todas as direções (Figura 6 e Figura 7). Em segundo lugar, observamos estruturas semelhantes a aglomerados formadas por células menores concentradas em torno dessas projeções celulares. Embora não tenhamos sido capazes de isolar os dois tipos de células para confirmar a hipótese do estudo, esse fenômeno é uma reminiscência dos arranjos 3D encontrados no córtex tímico, formados pela interação de cTECs individuais com um grande número de células T em desenvolvimento muito menores, conhecidas como complexos de células tímicas11 (Figura 8).
Em vários momentos durante a fase de cultura de organoides, avaliamos a composição celular dos organoides tímicos por citometria de fluxo e identificamos vários compartimentos principais: TEC (caracterizado como EPCAM+ CD45-), timócitos (EPCAM-CD45+ CD3+) (Figura 9), bem como um compartimento EPCAM-CD45+ CD3- compreendendo subconjuntos de não-timócitos hematopoiéticos tímicos. Mais detalhes podem ser encontrados em Provin et al.23.
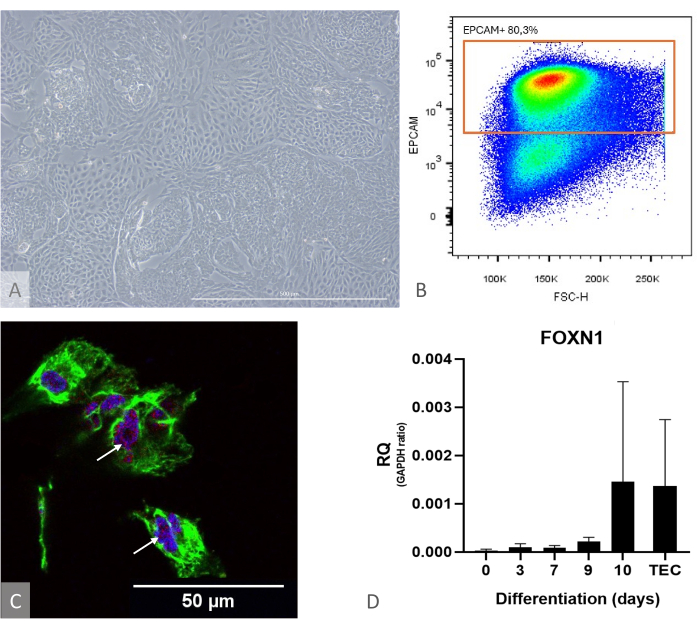
Figura 1: Caracterização da diferenciação de iPSC para TEP. (A) Exemplo de diferenciação de iPSC para TEP em D13, microscópio de contraste de fase invertida, 400x. Barra de escala: 500 μm. (B) Exemplo de gráfico de pontos, a proporção de células EPCAM+ entre as células DAPI- no dia 14 de diferenciação, imagem de FlowJo 10.0.7. (C) Imunocoloração contra DAPI (azul), PAX9 (vermelho) e KRT8 (verde), imunofluorescência e imagem confocal no dia 16 de diferenciação de iPSC para TEP. Setas brancas apontam para exemplos de coloração anti-PAX9. Barra de escala: 50 μm (D) Nível de expressão de FOXN1 (RQ a GAPDH) durante a diferenciação de iPS para TEP. TEC: Referência de controlo positivo, TEC humanos primários isolados de amostras de timo pediátrico. Gráfico do Prism (GraphPad versão 8.0.1). Clique aqui para ver uma versão maior desta figura.
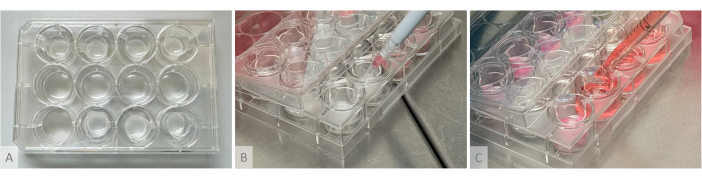
Figura 2: Configuração experimental para formação de hidrogel, semeadura de organoides e distribuição do meio de cultura. (A) Placa de cultura com hidrogéis fundidos em inserções suspensas colocadas nas linhas superior e inferior. (B) Semeadura organoide: o cone da pipeta cortada contendo 1 organoide é colocado acima do hidrogel sem tocá-lo, e o organoide é suavemente semeado na superfície do gel. (C) O meio de cultura é depositado no poço de cultura posicionando a ponta da pipeta entre os braços do inserto suspenso. Clique aqui para ver uma versão maior desta figura.
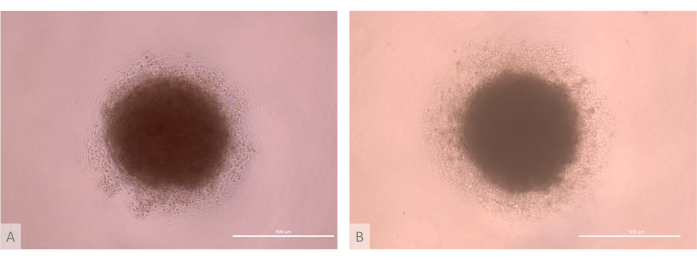
Figura 3: D0 da cultura de organoide tímico antes da semeadura (dias 13-15 do protocolo completo). (A) organoide produzido com TECs derivados da linha Lon71.019 iPS. (B) Organoide produzido com TECs derivados da linha MIPS203.003 iPS. Microscópio de contraste de fase invertida, 1000x. Barras de escala: 500 μm. Clique aqui para ver uma versão maior desta figura.
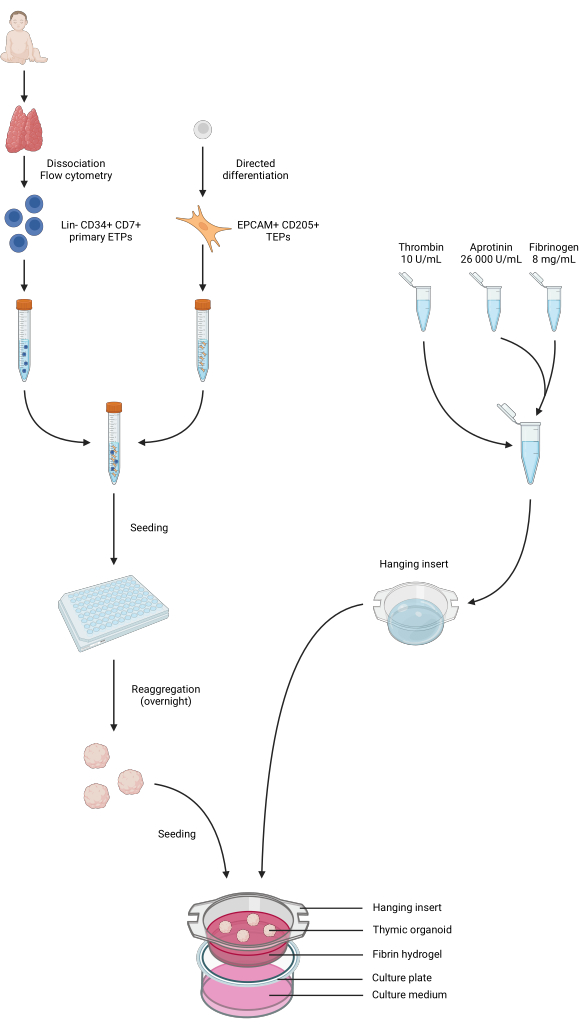
Figura 4: Representação resumida de todas as etapas do protocolo. Amostras de timo pediátrico foram coletadas e dissociadas, e ETPs primárias de Lin-CD34+ CD7+ foram classificadas por citometria de fluxo. A diferenciação de células iPS foi conduzida em direção a uma identidade TEP. ETPs e TEPs derivados de iPS foram agrupados e semeados em placas de 96 poços de baixa ligação e agregados em organoides tímicos durante a noite. Os hidrogéis de fibrina foram preparados a partir de aprotinina, fibrinogênio e trombina e fundidos em inserções suspensas. Após a polimerização, os organoides foram semeados sobre os hidrogéis, e o meio de cultura da fase 1 foi adicionado aos poços. Os organoides foram mantidos em cultura por até 6 semanas. Criado em BioRender, licença de publicação AG26EFCZOM. Clique aqui para ver uma versão maior desta figura.
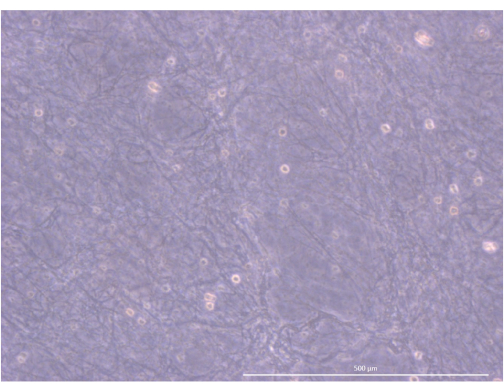
Figura 5: Organização e estrutura do hidrogel. Microscópio de contraste de fase invertida, 1000x. Barra de escala: 500 μm. Clique aqui para ver uma versão maior desta figura.
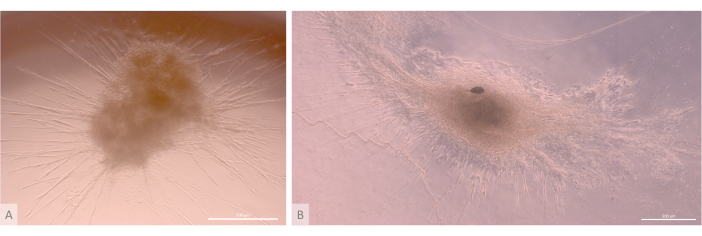
Figura 6: Organoides maduros e estrutura tridimensional. (A) Organoide tímico no dia 24 da cultura 3D, MIPS203,003 linha iPS. (B) Imagem composta de um organoide tímico no dia 32 da cultura 3D, linha Lon71.019 iPS. Microscópio de contraste de fase invertida. Barras de escala: 500 μm. Clique aqui para ver uma versão maior desta figura.
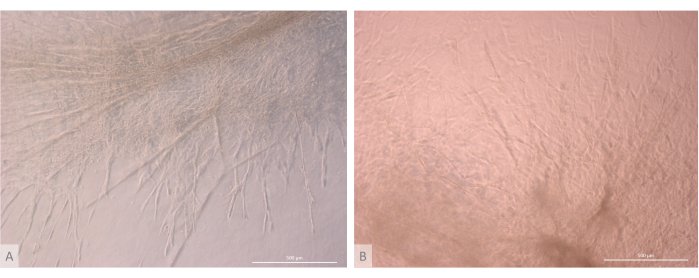
Figura 7: Detalhe da estrutura dos organoides tímicos. (A) Organoide tímico no dia 32 da cultura 3D, linha L71.019 iPS. (B) Organoide tímico no dia 27 da cultura 3D, linha L80.002 iPS. Microscópio de contraste de fase invertida, 400x. Barras de escala: 500 μm. Clique aqui para ver uma versão maior desta figura.
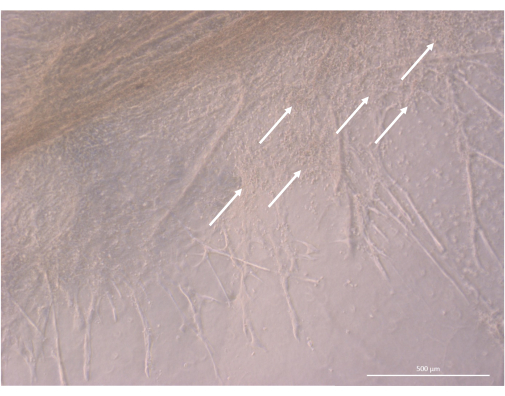
Figura 8: Detalhe da estrutura de um organoide tímico no dia 32 da cultura 3D. As setas brancas apontam para aglomerados de pequenos timócitos proliferando nas proximidades das células TEC. Microscópio de contraste de fase invertida, 400x. Barra de escala: 500 μm. Clique aqui para ver uma versão maior desta figura.
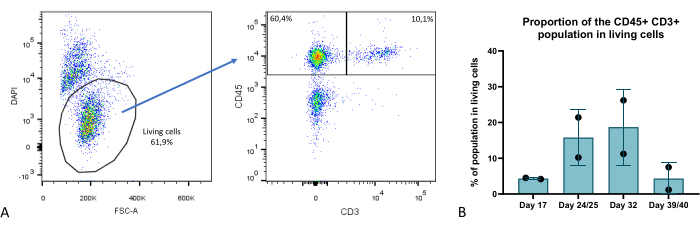
Figura 9: Proporção do compartimento de células T dentro dos organoides tímicos. (A) Exemplo de gráfico de pontos, proporção de células CD45 + CD3 + dentro das células vivas (DAPI-) em organoides tímicos no dia 35 da cultura 3D, imagem de FlowJo 10.0.7. A fração CD45+ CD3- compreende células hematopoiéticas não timócitos. (B) A proporção de células CD45 + CD3 + dentro de células vivas em organoides tímicos nos dias 17, 24/25, 32 e 39/40 da cultura 3D, n = 2 em duplicata técnica ou triplicada, gráfico do Prism (GraphPad versão 8.0.1). Clique aqui para ver uma versão maior desta figura.
| Unidade | Fase 1 médio Dia 14 até o Dia 18 | Fase 2 médio Dia 19 em diante | |
| Base | XVIVO10 | XVIVO10 | |
| BMP4 | ng/mL | 50 | |
| FGF8 | ng/mL | 10 | |
| FGF10 | ng/mL | 10 | |
| IGF1 | ng/mL | 10 | |
| FEG | ng/mL | 10 | |
| CLASSIFICAÇÃO L | ng/mL | 50 | 50 |
| IL7 | ng/mL | 5 | 5 |
| FLT3 L | ng/mL | 5 | 5 |
| CCAH | ng/mL | 10 | 10 |
| Glutamamax | ng/mL | 1% | 1% |
Tabela 1: Suplementos e suas respectivas concentrações.
| Aprotinina (μL) | Trombina (μL) | Fibrinogênio (μL) | Fase 1 média | Organoides (unidade) | |
| Placa de 24 poços | 5 | 75 | 75 | 1 | 3 a 5 |
| Placa de 12 poços | 9.2 | 138.2 | 138.2 | 1.8 | 5 |
| Placa de 6 poços | 16 | 240.8 | 240.8 | 3.2 | 8 a 9 |
Tabela 2: Proporções necessárias de componentes para preparação de hidrogéis e organoides de semeadura em placas de 6, 12 e 24 poços.
Discussão
Comparado com a cultura clássica de monocamada em 2D ou modelos 3D de última geração ainda mais avançados, como RTOC (cultura de órgãos de timo reagregado), o modelo que descrevemos aqui apresenta melhorias significativas. Do ponto de vista técnico, este modelo oferece escalabilidade e reprodutibilidade aprimoradas, pois os TECs são derivados de células iPS auto-renováveis. Ele também permite a edição de genes no estágio iPSC para facilitar os estudos knock in ou knock out em TECs. A capacidade de sobrevivência dos organoides tímicos mostrada neste estudo é notável e fornece uma melhora significativa comparativamente às culturas 2D ou RTOC, com geração de células T demonstrada durante até 6 semanas (Figura 9). Assim, a reconstituição da estrutura tímica 3D e das propriedades da ECM leva à funcionalidade tímica sustentada em nossos organoides tímicos, ou seja, a capacidade de gerar células T a partir do compartimento timócito mais maduro, emigrantes tímicos recentes por volta da semana 4 da cultura 3D, com geração de células T CD4+ e CD8+23.
Como o microambiente tímico suporta uma intensa atividade de expansão e diferenciação, a troca gasosa adequada é um parâmetro crucial em qualquer modelo de timo in vitro. De fato, melhores resultados foram observados em modelos mantidos em uma atmosfera de dioxigênio enriquecida ou em interfaces ar-líquido21,35. Nossas observações apóiam esse ponto e destacam a importância de uma semeadura organoide correta no topo do hidrogel, logo abaixo da interface de ar. Defeitos na polimerização que levam a hidrogéis viscosos a líquidos causarão o afundamento de organoides na parte inferior das inserções e impedirão seu crescimento. A cocultura com células endoteliais on-chip é uma alternativa promissora que pode quebrar essa barreira adicionando vascularização. O tamanho dos organoides do timo produzidos neste estudo é limitado a cerca de 5 mm, supostamente devido à falta de trocas de gases e nutrientes nas áreas centrais. A vascularização permitiria, portanto, o aumento de escala da cultura e, combinada com a otimização do processo, permitiria a produção de organoides contendo milhões de TECs e células T. A densidade do hidrogel também é um parâmetro crucial, e sua reprodutibilidade entre lotes é uma das principais limitações do protocolo, dada a sensibilidade das enzimas aos ciclos de congelamento e descongelamento. A etapa de fundição de hidrogel é uma etapa crítica no protocolo; Recomendamos a realização de um teste lançando um hidrogel 1 h antes de qualquer experimento planejado para verificar a atividade do reagente. Em caso de atividade enzimática insuficiente que leve à polimerização prejudicada e dado o custo dos TEPs derivados de iPSC, não aconselhamos outra solução de problemas além de iniciar o protocolo novamente com alíquotas de reagentes novos. Os TECs são importantes produtores de ECM; No entanto, dados os recentes avanços na compreensão do papel dos fibroblastos tímicos, pode ser interessante adicionar uma população de fibroblastos irradiados ao modelo organoide. Essa população poderia secretar fatores de crescimento e ECM que participariam da reprodução do ambiente tímico com efeitos positivos na diferenciação e manutenção de TEC e células T. Outra limitação importante desse modelo organoide do timo é a falta de segregação corticomedular adequada. Como os fibroblastos capsulares do timo demonstraram moldar a formação do córtex, sua adição ao modelo de cultura pode ajudar a resolver essa limitação. Assim, este protocolo introduz a base de modelos in vitro complexos do timo. Ele combina os recentes avanços feitos nos campos de diferenciação tímica iPSC, culturas 3D baseadas em hidrogel e linfopoiese in vitro. Este modelo pode ser refinado ainda mais para abordar a escalabilidade e aumentar sua complexidade, por exemplo, adicionando compartimentos mesenquimais e vasculares. Poderia, portanto, resultar em valiosas plataformas de pesquisa sobre imunidade ou aplicações em terapia celular personalizada baseada em células T.
Divulgações
Os autores declaram não ter conflito de interesses.
Agradecimentos
Queremos agradecer aos membros da instalação central do iPSC de Nantes, França, chefiada por Laurent David. Este trabalho foi apoiado pelo programa de JTC2019 de doenças raras do JP Projeto TARID (EJPRD19-208) financiado pela ANR (ANR-19-RAR40011-5) a M.G. pela bolsa RFI Bioregate (ThymIPS) da Région Pays de la Loire a M.G., pela ANR (ANR-22-CE15-0045) a M.G. e pelo projeto "SATT Ouest Valorisation" OrgaTreg a M.G. N.P. foi apoiado pela "la fondation d'entreprise ProGreffe". M.d.A. foi apoiado pela "la Fondation pour la Recherche Médicale". Agradecemos à instalação central do iPSC de Nantes, apoiada pelo IBiSA e Biogenouest, pelo uso de seus recursos e suporte técnico. Este trabalho foi parcialmente financiado pelo programa Labex IGO apoiado pela Agência Nacional de Pesquisa através do investimento do futuro programa ANR-11-LABX-0016-01.
Materiais
| Name | Company | Catalog Number | Comments |
| Aprotinin | Sigma Aldrich | 616370 | |
| BMP4 | Miltenyi | 130-111-165 | |
| CCR7 (CD197) | BD Biosciences | PE | Clone: 3D12; Dilution: 1: 200 |
| CD14 | BD Biosciences | FITC | Clone: M5E2; Dilution: 1: 200 |
| CD19 | BD Biosciences | PE | Clone: HIB19; Dilution: 1: 200 |
| CD205 | BioLegend | FITC | Clone: MG38; Dilution: 1: 200 |
| CD3 | BD Biosciences | PE | Clone: HIT3a; Dilution: 1: 200 |
| CD34 | BD Biosciences | FITC | Clone: 8G12; Dilution: 1: 100 |
| CD4 | BD Biosciences | PE | Clone: RPA-T4; Dilution: 1: 100 |
| CD4 | BD Biosciences | BV711 | Clone: L200; Dilution: 1: 200 |
| CD45 | BD Biosciences | PerCP | Clone: HI30; Dilution: 1: 200 |
| CD56 | BD Biosciences | PE | Clone: B159; Dilution: 1: 200 |
| CD62L | BD Biosciences | BV605 | Clone: DREG-56; Dilution: 1: 200 |
| CD69 | BD Biosciences | BV510 | Clone: FN50; Dilution: 1: 200 |
| CD7 | BD Biosciences | APC | Clone: M-T701; Dilution: 1: 200 |
| CD8 | BD Biosciences | PeCy7 | Clone: RPA-T8; Dilution: 1: 200 |
| CD8 | BD Biosciences | PE | Clone: HIT8a; Dilution: 1: 200 |
| Dynabeads Pan Mouse IgG | Invitrogen | 11041 | |
| EGF | Miltenyi | 130-097-751 | |
| EPCAM (CD326) | BD Biosciences | PE | Clone: HEA-125; Dilution: 1: 200 |
| EPCAM (CD326) | Miltenyi | BV711 | Clone: EBA-1; Dilution: 1: 200 |
| FGF10 | Miltenyi | 130-127-858 | |
| FGF8 | Biotechne R&D | 423-F8 | |
| Fibrinogen | Sigma Aldrich | 341578 | |
| FLT3 L | Peprotech | AF-300-19 | |
| Glutamax | Gibco | 35050-61 | |
| IGF1 | Miltenyi | 130-093-886 | |
| IL7 | Peprotech | AF-200-07 | |
| RANK L | Biotechne R&D | 6449-TEC | |
| Red blood cell lysis solution | Miltenyi | 130-094-183 | |
| RPMI1640 | Gibco | 11875093 | |
| SCF | Peprotech | AF-300-07 | |
| Thrombin | Sigma Aldrich | 605190 | |
| TrypLE | Gibco | 2605010 | |
| XVIVO10 | Lonza | LONBE04-380Q |
Referências
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annu Rev Immunol. 21, 139-176 (2003).
- Carpenter, A. C., Bosselut, R. Decision checkpoints in the thymus. Nat Immunol. 11 (8), 666-673 (2010).
- Miller, J. F. A. P. The function of the thymus and its impact on modern medicine. Science. 369 (6503), (2020).
- Haddad, R., et al. Dynamics of thymus-colonizing cells during human development. Immunity. 24 (2), 217-230 (2006).
- Cumano, A., et al. New molecular insights into immune cell development. Annu Rev Immunol. 37, 497-519 (2019).
- Bautista, J. L., et al. Single-cell transcriptional profiling of human thymic stroma uncovers novel cellular heterogeneity in the thymic medulla. Nat Commun. 12 (1), 1096 (2021).
- Kadouri, N., Nevo, S., Goldfarb, Y., Abramson, J. Thymic epithelial cell heterogeneity: TEC by TEC. Nat Rev Immunol. 20 (4), 239-253 (2020).
- Alves, N. L., et al. Serial progression of cortical and medullary thymic epithelial microenvironments. Eur J Immunol. 44 (1), 16-22 (2014).
- Baik, S., Jenkinson, E. J., Lane, P. J. L., Anderson, G., Jenkinson, W. E. Generation of both cortical and Aire+ medullary thymic epithelial compartments from CD205+ progenitors. Eur J Immunol. 43 (3), 589-594 (2013).
- Tavian, M., Peault, B. Embryonic development of the human hematopoietic system. Int J Dev Biol. 49 (2-3), 243-250 (2005).
- Abramson, J., Anderson, G. Thymic epithelial cells. Annu Rev Immunol. 35 (1), 85-118 (2017).
- Anderson, M. S., et al. Projection of an immunological self shadow within the thymus by the aire protein. Science. 298 (5597), 1395-1401 (2002).
- Sharma, H., Moroni, L. Recent advancements in regenerative approaches for thymus rejuvenation. Adv Sci. 8 (14), 2100543 (2021).
- Alenghat, F. J., Ingber, D. E. Mechanotransduction: all signals point to cytoskeleton, matrix, and integrins. Sci STKE. 2002 (119), 6 (2002).
- Pinto, S., Schmidt, K., Egle, S., Stark, H. -. J., Boukamp, P., Kyewski, B. An organotypic coculture model supporting proliferation and differentiation of medullary thymic epithelial cells and promiscuous gene expression. J Immunol. 190 (3), 1085-1093 (2013).
- Hun, M., Barsanti, M., Wong, K., Ramshaw, J., Werkmeister, J., Chidgey, A. P. Native thymic extracellular matrix improves in vivo thymic organoid T cell output, and drives in vitro thymic epithelial cell differentiation. Biomaterials. 118, 1-15 (2017).
- Asnaghi, M. A., et al. Thymus extracellular matrix-derived scaffolds support graft-resident thymopoiesis and long-term in vitro culture of adult thymic epithelial cells. Adv Funct Mater. 31 (20), 2010747 (2021).
- Villegas, J. A., et al. Cultured human thymic-derived cells display medullary thymic epithelial cell phenotype and functionality. Front Immunol. 9, 1663 (2018).
- Hauri-Hohl, M., Zuklys, S., Holländer, G. A., Ziegler, S. F. A regulatory role for TGF-β signaling in the establishment and function of the thymic medulla. Nat Immunol. 15 (6), 554-561 (2014).
- Campinoti, S., et al. Reconstitution of a functional human thymus by postnatal stromal progenitor cells and natural whole-organ scaffolds. Nat Commun. 11 (1), 6372 (2020).
- Ramos, S. A., et al. Generation of functional thymic organoids from human pluripotent stem cells. Stem Cell Reports. 18 (4), 829-840 (2023).
- Fan, Y., et al. Bioengineering thymus organoids to restore thymic function and induce donor-specific immune tolerance to allografts. Mol Ther. 23 (7), 1262-1277 (2015).
- Provin, N., et al. Combinatory differentiation of human induced pluripotent stem cells generates thymic epithelium that supports thymic crosstalk and directs dendritic- and CD4/CD8 T-cell full development. bioRxiv. 2023, 572664 (2023).
- Parent, A. V., et al. Generation of functional thymic epithelium from human embryonic stem cells that supports host T cell development. Cell Stem Cell. 13 (2), 219-229 (2013).
- Sun, X., et al. Directed differentiation of human embryonic stem cells into thymic epithelial progenitor-like cells reconstitutes the thymic microenvironment in vivo. Cell Stem Cell. 13 (2), 230-236 (2013).
- Inami, Y., et al. Differentiation of induced pluripotent stem cells to thymic epithelial cells by phenotype. Immunol Cell Biol. 89 (2), 314-321 (2011).
- Gras-Pena, R., et al. Human stem cell-derived thymic epithelial cells enhance human T cell development in a xenogeneic thymus. J Allergy Clin Immunol. 149 (5), 1755-1771 (2022).
- Lai, L., Jin, J. Generation of thymic epithelial cell progenitors by mouse embryonic stem cells. Stem Cells. 27 (12), 3012-3020 (2009).
- Ramos, S. A., et al. Generation of functional human thymic cells from induced pluripotent stem cells. J Allergy Clin Immunol. 149 (2), 767-781 (2022).
- Provin, N., Giraud, M. Differentiation of pluripotent stem cells into thymic epithelial cells and generation of thymic organoids: Applications for therapeutic strategies against APECED. Front Immunol. 13, 930963 (2022).
- Montel-Hagen, A., et al. In vitro recapitulation of murine thymopoiesis from single hematopoietic stem cells. Cell Rep. 33 (4), 108320 (2020).
- Park, J. -. E., et al. A cell atlas of human thymic development defines T cell repertoire formation. Science. 367 (6480), 3224 (2020).
- Flippe, L., et al. Rapid and reproducible differentiation of hematopoietic and T cell progenitors from pluripotent stem cells. Front Cell Dev Biol. 8, 577464 (2020).
- Padonou, F., et al. Aire-dependent transcripts escape Raver2-induced splice-event inclusion in the thymic epithelium. EMBO Rep. 23 (3), e53576 (2022).
- Han, J., Zúñiga-Pflücker, J. C. High-oxygen submersion fetal thymus organ cultures enable FOXN1-dependent and -independent support of T lymphopoiesis. Front Immunol. 12, 652665 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados