Medição da respiração mitocondrial em fibras musculares esqueléticas humanas e de camundongos por respirometria de alta resolução
Neste Artigo
Resumo
Aqui, descrevemos um método abrangente para medir a fosforilação oxidativa mitocondrial em fibras musculares esqueléticas permeabilizadas frescas de músculos humanos ou de camundongos. Este método permite a quantificação em tempo real da respiração mitocondrial e a avaliação da preferência de combustível e flexibilidade metabólica, preservando as redes mitocondriais existentes e a integridade da membrana.
Resumo
A função mitocondrial, uma pedra angular da produção de energia celular, é fundamental para manter a homeostase metabólica. Sua disfunção no músculo esquelético está ligada a distúrbios metabólicos prevalentes (por exemplo, diabetes e obesidade), distrofias musculares e sarcopenia. Embora existam muitas técnicas para avaliar o conteúdo e a morfologia mitocondrial, o método característico para avaliar a função mitocondrial é a medição da fosforilação oxidativa mitocondrial (OXPHOS) por respirometria. A quantificação do OXPHOS mitocondrial fornece informações sobre a eficiência da produção de energia oxidativa mitocondrial e da bioenergética celular. Um respirômetro de alta resolução fornece medições robustas e altamente sensíveis do OXPHOS mitocondrial em fibras musculares permeabilizadas, medindo as mudanças em tempo real na taxa de consumo de oxigênio mitocondrial. O uso de fibras musculares permeabilizadas, ao contrário das mitocôndrias isoladas, preserva as redes mitocondriais, mantém a integridade da membrana mitocondrial e, em última análise, permite medições fisiologicamente mais relevantes. Este sistema também permite a medição da preferência de combustível e flexibilidade metabólica - aspectos dinâmicos do metabolismo energético muscular. Aqui, fornecemos um guia abrangente para medições mitocondriais de OXPHOS em fibras musculares esqueléticas humanas e de camundongos usando um respirômetro de alta resolução. Os grupos musculares esqueléticos são compostos por diferentes tipos de fibras que variam em sua preferência por combustível mitocondrial e bioenergética. Usando um respirômetro de alta resolução, descrevemos métodos para avaliar substratos glicolíticos aeróbicos e de ácidos graxos para avaliar a preferência de combustível e a flexibilidade metabólica de maneira dependente do tipo de fibra. O protocolo é versátil e aplicável a fibras musculares humanas e de roedores. O objetivo é aumentar a reprodutibilidade e a precisão das avaliações da função mitocondrial, o que melhorará nossa compreensão de uma organela importante para a saúde muscular.
Introdução
As mitocôndrias são a pedra angular da produção de energia celular, tornando-as indispensáveis para manter a homeostase celular e orgânica ideal. Essas organelas de membrana dupla são as principais responsáveis pela fosforilação oxidativa. Esse processo converte eficientemente nutrientes, como açúcares e ácidos graxos, em trifosfato de adenosina (ATP), a moeda celular para energia. Além de seu papel no metabolismo energético, as mitocôndrias também são reguladoras-chave de vários processos celulares, incluindo apoptose, homeostase do cálcio e espécies reativas de oxigênio (ROS)1,2. Devido ao seu papel fundamental na manutenção da homeostase celular e do organismo, as interrupções na função mitocondrial geralmente têm efeitos prejudiciais na saúde dos tecidos e do organismo. No músculo esquelético, a disfunção mitocondrial está associada a vários estados de doença, incluindo distúrbios metabólicos (por exemplo, obesidade, diabetes e doenças cardiovasculares), sarcopenia e distrofia muscular 3,4,5,6,7,8.
A disfunção mitocondrial pode se manifestar principalmente como conteúdo, número e morfologia mitocondriais alterados, bem como metabolismo interrompido. Assim, alcançar uma compreensão abrangente da disfunção mitocondrial requer uma abordagem integrativa e holística. Os estudos iniciais de caracterização envolvem o exame dos níveis de expressão de complexos de proteínas da cadeia respiratória como uma leitura do conteúdo mitocondrial, quantificando o DNA mitocondrial e marcadores de biogênese como uma medida da biogênese mitocondrial e imagens sofisticadas de microscopia eletrônica para avaliar a morfologia mitocondrial 9,10. Avaliações adicionais da função mitocondrial incluem a avaliação da produção celular de ROS e ATP e do potencial da membrana mitocondrial9.
Como as mitocôndrias são essenciais para a produção de energia celular e homeostase, uma marca registrada para avaliar a função mitocondrial é medir a fosforilação oxidativa mitocondrial (OXPHOS). A respirometria de alta resolução das fibras musculares permeabilizadas permite a medição das mudanças em tempo real na taxa de consumo de oxigênio mitocondrial como uma leitura das mudanças dinâmicas na atividade da cadeia respiratória mitocondrial OXPHOS 9,11,12. A aplicação de moduladores e inibidores químicos seletivos permite medir a atividade de diferentes complexos respiratórios de forma direta e sequencial. Embora mitocôndrias isoladas possam ser usadas em respirometria, o uso de fibras musculares frescas e permeabilizadas mantém as redes mitocondriais endógenas e a integridade da membrana - permitindo assim medidas mais fisiologicamente relevantes. Além disso, como diferentes tipos de fibras musculares têm diferentes preferências de substrato e taxas de respiração, esse sistema permite medir as mudanças na preferência de combustível e flexibilidade metabólica com base no tipode fibra 13.
Aqui, descrevemos um protocolo abrangente para medições mitocondriais de OXPHOS usando fibras musculares esqueléticas humanas ou de camundongos em um sistema de respirômetro de alta resolução. Estão incluídos métodos para quantificar a respiração mitocondrial de oxigênio em fibras oxidativas ou glicolíticas usando piruvato ou palmitoil-carnitina como substrato. Este protocolo permite o uso de outros substratos de combustível para abordar questões metabólicas específicas relacionadas a defeitos na utilização do substrato e preferência de combustível.
Protocolo
Todos os procedimentos com camundongos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Washington. Camundongos de qualquer sexo, idade e peso podem ser usados para esses experimentos e dependerão da natureza da questão experimental que se procura abordar. Os camundongos usados aqui são camundongos C57BL / 6 machos adultos (12-16 semanas de idade). Todos os procedimentos humanos foram aprovados pelo Conselho de Revisão Institucional da Universidade de Washington. Os sujeitos do estudo consentiram com o uso de dados, e os dados representativos do sujeito humano incluídos neste protocolo são de um estudo publicado14. Os dados aqui são de mulheres não diabéticas na pós-menopausa (55-75 anos). Os detalhes para a preparação dos reagentes necessários para o ensaio são apresentados na Tabela 1. As informações sobre os reagentes, ferramentas e máquinas específicos usados no ensaio estão listadas na Tabela de Materiais. Uma visão geral esquemática do protocolo é apresentada na Figura 1.
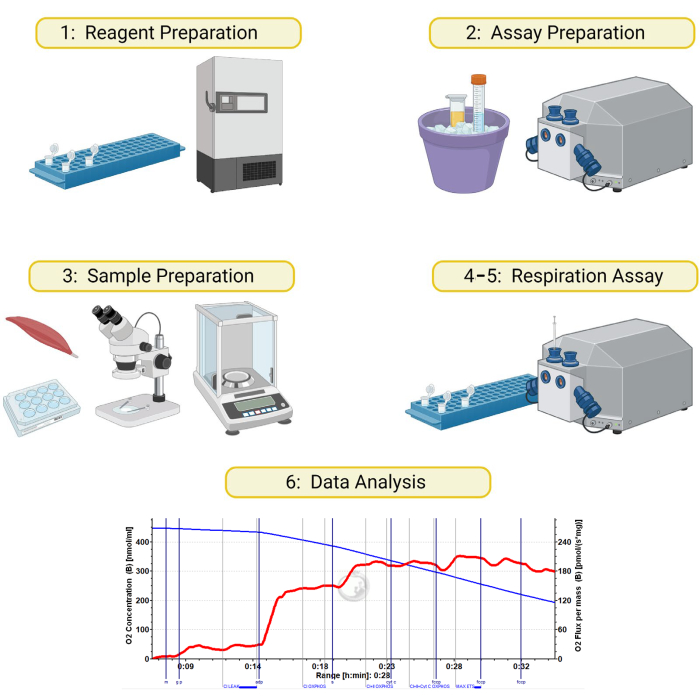
Figura 1: Esquema para respirometria de alta resolução em amostras de músculo esquelético permeabilizado. O método detalhado neste manuscrito é dividido em 6 seções: 1) preparação de tampões e reagentes respiratórios, 2) preparação de instrumentos e reagentes no dia do ensaio, 3) preparação e permeabilização de amostras musculares, 4) preparação de amostras musculares, 5) execução do ensaio respiratório e 6) análise de dados. Criado com BioRender.com Clique aqui para ver uma versão maior desta figura.
1. Preparação do ensaio e calibração do instrumento
- No dia do ensaio, remova o número necessário de alíquotas de cada composto respiratório (blebbistatina, palmitoil-carnitina, glutamato, malato, ADP, succinato, citocromo C, FCCP) e descongele no gelo. Descongele os frascos de BIOPS e MiR05 no gelo.
- Prepare soluções de saponina e piruvato conforme indicado na Tabela 1. Preparar uma solução de trabalho de MiR05 como indicado no quadro 1. Preparar 5 ml de solução de trabalho de MiR05 por instrumento (2 câmaras). Aumente a escala conforme necessário.
- Ligue o sistema de respirometria de alta resolução e o sistema de vácuo. Remova as rolhas, remova a solução de armazenamento de etanol a 70% por vácuo e reabasteça a câmara com grau molecular ultrapuro H2O. Remova H2O por vácuo e reabasteça. Repita para um total de 3 lavagens. Após a lavagem final, adicione 2 ml de MiR05 (sem creatina ou blebbistatina) a cada câmara.
- Abra o software de respirometria. Após o início do software, uma caixa pop-up será aberta para as configurações do instrumento. Defina a velocidade de agitação da câmara para 750 rpm, a temperatura para 37 °C e o intervalo de gravação de dados para 2 s. Defina o ganho para 1 e a tensão de polarização para 800 mV para os sensores de oxigênio. Clique em Conectar ao Oxígrafo para estabelecer comunicação com o instrumento.
- Depois que a comunicação for estabelecida, uma caixa de diálogo será aberta para nomear e salvar o arquivo experimental. Salve o arquivo com a data atual e a calibração. Depois de salvar o arquivo, uma caixa de diálogo pop-up aparecerá para detalhes experimentais. Nenhuma informação é necessária para a execução da calibração e a caixa pode ser fechada.
- Registre a concentração de oxigênio por pelo menos 30 minutos para permitir que as câmaras aqueçam e registre sinais para calibração do ar. Isso pode ser feito durante a preparação das fibras musculares, conforme detalhado na etapa 2 abaixo.
- No final do período de calibração, marque uma região de calibração na região onde a concentração de oxigênio (linha azul) é estável. Para fazer isso, mantenha pressionada a tecla Shift e o botão esquerdo do mouse e arraste por uma região na linha do tempo.
- Abra a janela de calibração acessando o Oxigraph > O2 Calibration. Para Calibração de ar, selecione a marca gerada na etapa 1.8. Clique em Calibrar e Copiar para a Área de Transferência.
- Repita as etapas 1.6-1.8 para a câmara restante. Realize a calibração do ar diariamente. Pare a gravação da calibração do ar e salve o file desconectando-o do instrumento. Depois que as amostras estiverem prontas, prossiga para a etapa 3 para realizar o ensaio.
2. Colheita e permeabilização de fibras musculares esqueléticas
- Isolamento de tecido de camundongo
- Para cada amostra a ser analisada, encha um poço de uma placa de cultura de 12 poços com 1 mL de BIOPS. Coloque o prato no gelo para esfriar.
- Após a eutanásia do camundongo por inalação de dióxido de carbono seguida de luxação cervical, colha o músculo esquelético de interesse, certificando-se de remover todo o tecido conjuntivo e gordura (Figura 2A). Coloque o músculo em um dos poços contendo BIOPS. Coloque no gelo até a preparação da fibra.
NOTA: Qualquer músculo esquelético pode ser examinado usando este protocolo - o tipo de músculo examinado dependerá da questão experimental que se procura abordar. No caso de músculos esqueléticos com tipos de fibras mistas, como o gastrocnêmio, é possível separar o tecido em cortes brancos e vermelhos para medir as fibras predominantemente de contração rápida (cortes brancos) e predominantemente de contração lenta (cortes vermelhos) (Figura 2B).
- Isolamento de tecido humano
- Colete tecido seguindo o protocolo clínico14. Enxágue rapidamente o tecido com PBS frio e estéril e coloque-o em um tubo cônico contendo 2 mL de solução BIOPS. Mantenha o tecido no gelo até a preparação da fibra.
- Preparação de fibras
- A permeabilização ocorrerá em uma placa de cultura de tecidos de 6 poços. Adicione 2 mL de solução BIOPS a um conjunto de poços e 2 mL de MiR05 a outro conjunto de poços. Um conjunto de poços será necessário para cada amostra que está sendo analisada.
- Embale uma bandeja com gelo e coloque uma placa de Petri de vidro de cabeça para baixo sobre o gelo. Certifique-se de sempre manter o músculo no gelo.
- Transfira amostras de músculo colhidas para a plataforma de placa de Petri resfriada usando uma pinça. Usando duas pinças de ponta fina e um microscópio de dissecação com uma fonte de luz, limpe suavemente o tecido removendo todos os tendões, fáscia e tecido adiposo que estão presos ao músculo.
- Depois que todo o tecido não muscular estranho tiver sido removido, separe suavemente as fibras musculares com a pinça de ponta fina até que sejam pequenos feixes de fibras translúcidas variando de 0,75 a 1,0 mm de comprimento (Figura 2C-D). Depois de separar as fibras, use a pinça para transferir os feixes de fibras para um poço na placa de 6 poços contendo solução BIOPS no gelo.
- Adicione 20 μL de solução de saponina de 5 mg / mL a cada poço BIOPS e incube a placa no gelo enquanto balança suavemente em uma câmara fria por 20 min.
- Após o tratamento com saponina, transfira as fibras musculares para o poço contendo MiR05 para enxaguar antes do ensaio. Incube no gelo enquanto balança suavemente em uma sala fria por 15 min.
- Após a conclusão da incubação das fibras no MiR05, reúna as fibras com uma pinça afiada e seque suavemente as fibras musculares em uma limpeza de tarefas. Tara um tubo de microcentrífuga de plástico de 1,5 mL em uma balança fina e coloque 2-3 mg de fibras no tubo. Registre o peso final da fibra na lateral de cada tubo. Coloque o tubo no gelo. Repita com outras amostras. Prossiga imediatamente para a etapa 3.
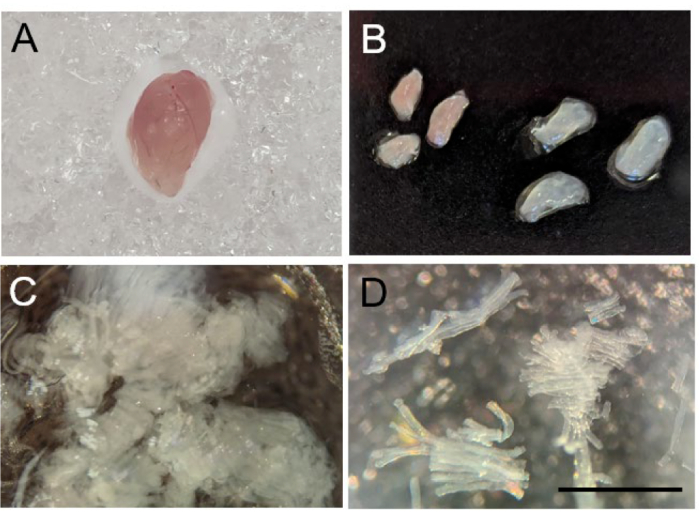
Figura 2: Separação das fibras musculares esqueléticas de camundongos. (A) Morfologia macroscópica do gastrocnêmio de camundongo após a colheita. (B) Dissecção do gastrocnêmio em segmentos vermelhos (esquerdos) e brancos (direitos). (C) Fibras musculares separadas mecanicamente. (D) Uma imagem 10x de fibras musculares separadas com sucesso. A barra de escala é de 1 mm. Clique aqui para ver uma versão maior desta figura.
3. Preparação de amostras musculares no respirômetro
- Aspire o MiR05 usado para calibração do instrumento, conforme detalhado na etapa 1 acima, e adicione 2.1 mL de solução de MiR05 de trabalho a cada câmara.
- Inicie um novo arquivo para o experimento usando as mesmas configurações do instrumento detalhadas na etapa 1.5. acima. Defina o nome do arquivo e salve as configurações.
- Após definir o nome do arquivo, a próxima caixa de diálogo da tela será para detalhes experimentais específicos. Insira as informações da amostra e o peso de cada amostra adicionada a cada câmara. Feche a caixa de diálogo.
- Uma vez no novo experimento file, defina a calibração abrindo a janela Calibração de O2. Clique em Copiar do arquivo e selecione o arquivo salvo na etapa 1.9. acima. Clique no botão Calibrar e copiar para a área de transferência . Repita o processo para a câmara restante.
- Usando uma pinça fina, transfira cuidadosamente os feixes de fibras musculares para a solução de respiração para a câmara apropriada. Repita para a câmara restante.
- Coloque as rolhas na câmara e feche cuidadosamente a câmara, empurrando-as até a metade do fundo. Assim que os anéis de vedação nas rolhas se encaixarem na parede da câmara e houver resistência, use um movimento de torção enquanto empurra para baixo para fechar. Quando a câmara está meio fechada, uma pequena bolha de ar pode ser observada no topo da câmara.
NOTA: As fibras permeabilizadas estão sujeitas a limitações de difusão de oxigênio em condições respiratórias regulares. Para contornar essa limitação, o ensaio é conduzido sob concentrações elevadas de oxigênio11. - Encha uma seringa de plástico de 10 mL com oxigênio puro de um tanque de oxigênio. Coloque a agulha longa e romba fornecida com o instrumento na seringa. Coloque a agulha na primeira câmara e forneça lentamente aproximadamente 1 mL de oxigênio na câmara.
- Monitore a concentração de oxigênio da câmara no software de respirometria. Quando a concentração de oxigênio da câmara atingir 350-400 nmol/mL, gire suavemente a rolha enquanto empurra para baixo para fechar totalmente a câmara. Olhe para a câmara e certifique-se de que não haja bolhas de ar. Se houver uma bolha de ar, reabra a câmara com cuidado e rapidez, adicione 100 μL de solução MiR05 de trabalho adicional e feche rapidamente a câmara novamente. Repita com as câmaras restantes.
- As concentrações de oxigênio devem ser mantidas acima de 250 nmol/mL durante o ensaio. Adicione oxigênio adicional conforme necessário, abrindo parcialmente a câmara, adicionando mais oxigênio da seringa na bolha de ar e fechando cuidadosamente a câmara novamente.
- Normalize os dados do fluxo de oxigênio para a massa de tecido usada para o experimento. Para ajustar os gráficos, altere o layout para refletir o fluxo de O2 (pmol O2 / (s x mg)). No menu de layout, selecione o layout 06 - Fluxo específico por unidade de amostra. Os dados agora serão apresentados normalizados para a quantidade de tecido em cada câmara.
4. Respirometria de alta resolução
- Quando a concentração de oxigênio (linha azul) e o fluxo de O2 (linha vermelha) se estabilizarem após a adição de oxigênio, inicie o protocolo de respiração. O oxigênio pode ser considerado estável quando a linha azul é plana ou diminui lentamente. O fluxode O 2 também deve ser plano e dentro de 5 pmol O2 / s x mg.
- Adicione todos os reagentes usando seringas de vidro. É importante não usar a mesma seringa para substratos, inibidores e desacopladores. Tenha uma seringa separada para cada um. Depois de adicionar cada composto, registre o fluxo de oxigênio por 1-2 minutos após a estabilização da taxa de respiração antes de adicionar o próximo reagente.
- Medição da respiração
- Usando uma seringa de vidro de 10 μL, adicione 2,5 μL de malato 0,8 M a cada câmara. Pressione F4 para marcar a linha do tempo e rotular a marca com M. Grave o fluxo estável de O2 por 1-2 min.
- Adicione reagentes específicos para nutrientes conforme descrito abaixo.
- Glicolítico aeróbico: Usando uma seringa de vidro de 10 μL, adicione 10 μL de glutamato 2 M e 5 μL de piruvato 2 M a cada câmara. Pressione F4 para marcar a linha do tempo e rotular a marca com G P. Grave o fluxo estável de O2 por 1-2 min.
- Ácido graxo: Usando uma seringa de vidro de 10 μL, adicione 10 μL de glutamato 2 M e 10 μL de palmitoil-carnitina 10 mM em cada câmara. Pressione F4 para marcar a linha do tempo e rotular a marca com G PC. Grave o fluxo estável de O2 por 1-2 min.
- Usando uma seringa de vidro de 25 μL, adicione 20 μL de ADP 0,5 M (com MgCl2) a cada câmara. Pressione F4 para marcar a linha do tempo e rotular a marca com ADP. Grave o fluxo estável de O2 por 1-2 min.
- Usando uma seringa de vidro de 25 μL, adicione 20 μL de succinato 1 M a cada câmara. Pressione F4 para marcar a linha do tempo e rotular a marca com S. Grave o fluxo estável de O2 por 1-2 min.
- Usando uma seringa de vidro de 10 μL, adicione 5 μL de citocromo C 4 mM a cada câmara. Pressione F4 para marcar a linha do tempo e rotular a marca com Cyt C. Grave o fluxo estável de O2 por 1-2 min.
- Titular em três bolus de 1 μL de FCCP 1 mM usando uma seringa de vidro de 10 μL. Geralmente, há um efeito de mistura ao adicionar FCCP que resulta em uma breve diminuição nos níveis de fluxo de O2 . Aguarde até que o fluxo de O2 aumente e se estabilize antes de prosseguir para a próxima etapa. Pressione F4 após cada adição para marcar a linha do tempo e marcar o rótulo com FCCP. Registre o fluxo estável de O2 por 1 min após cada adição.
- Quando o ensaio de respiração estiver concluído, remova suavemente as rolhas torcendo e puxando para cima. Enxágue as câmaras 3x com H2O ultrapuro de uma garrafa de esguicho, seguido de 3x com etanol 70% de uma garrafa de esguicho. Após o enxágue final com etanol, encha as câmaras com etanol 70% para armazenamento.
- Coloque as rolhas nas câmaras até sentir resistência. Não feche totalmente as rolhas. Coloque tampas sobre as rolhas, salve o arquivo de ensaio e desconecte o instrumento do software de respirometria. Desligue o instrumento.
5. Análise dos dados
- Abra o arquivo de análise no software de respirometria. Extrair dados de regiões estáveis de fluxo de oxigênio obtidas após a injeção de compostos respiratórios.
- Para marcar regiões de interesse, mantenha pressionada a tecla Shift , clique no botão esquerdo do mouse e arraste a caixa pela região estável da taxa de fluxo de O2 para os estágios de ensaio detalhados abaixo.
- Estágios do ensaio 14,15,16,17,18,19,20
- Marque a linha do tempo após a adição de malato / glutamato / piruvato (protocolo glicolítico aeróbico) ou malato / glutamato / palmitoil-carnitina (protocolo de ácidos graxos). Essa taxa representa a taxa de respiração do Complexo I Estado 2 (LEAK(n)).
- Marque a linha do tempo após a adição do ADP. Essa taxa representa a taxa de respiração do Complexo I Estado 3 (CI OXPHOS).
- Marque a linha do tempo após a adição de succinato. Essa taxa representa a taxa de respiração do Complexo I+II Estado 3 (CI+II OXPHOS).
- Marque a linha do tempo após adicionar o citocromo C. Esta taxa representa a taxa de respiração do Complexo I + II + Estado do Citocromo 3 (CI + II + Cyt C OXPHOS).
- Marque a linha do tempo para a titulação FCCP com a maior taxa de fluxo de O2 . Esta taxa representa a frequência respiratória máxima (MAX ETS).
- Recupere os valores de dados para as regiões marcadas na linha do tempo selecionando Marcar > Estatísticas. Copie a taxa de fluxo de O2 (pmol O2 / (s x mg)) para a câmara marcada para uma planilha.
- Repita a marcação e a extração de dados para as câmaras adicionais.
- Calcule a taxa de controle respiratório (RCR) dividindo o Complexo I + II Estado 3 (após a adição de succinato) pelo Complexo I Estado 2 (antes da adição de ADP).
Resultados Representativos
A Figura 3 e a Figura 4 mostram gráficos de oxigênio de protocolos de respirometria glicolítica aeróbica e de ácidos graxos, respectivamente, para fibras musculares murinas vermelhas e brancas adequadamente preparadas. Também são mostrados resultados quantificados representativos para referência. A Figura 5 mostra um gráfico de oxigênio da respirometria glicolítica aeróbica em amostras de biópsia muscular humana que foram devidamente preparadas. Resultados quantificados representativos também são mostrados. Observe que, para a Figura 3, Figura 4 e Figura 5, a adição do citocromo C após a adição de ADP não produz impacto no fluxo de oxigênio, indicando que a membrana mitocondrial externa da amostra está intacta. A Figura 6 mostra um gráfico de oxigênio da respirometria glicolítica aeróbica em que a adição de citocromo C após o ADP resulta em um pico (aumento de 40%) no fluxo de oxigênio, indicando que a membrana mitocondrial externa foi danificada e, portanto, a amostra não deve ser usada para respirometria - as possíveis razões para esse resultado podem ser manuseio inadequado ou congelamento/descongelamento do tecido, prolongar a permeabilização do tecido e não usar tecido recém-isolado.
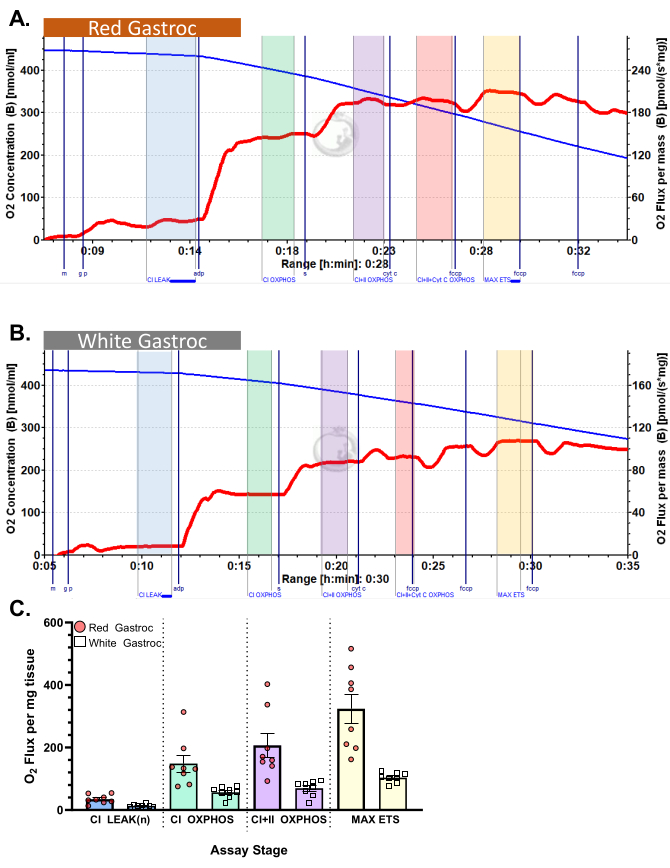
Figura 3: Consumo de oxigênio em camundongos. Os resultados mostram o consumo de oxigênio em (A) gastrocnêmio vermelho e (B) branco usando o protocolo de piruvato. Fluxo de estado 2 após a adição de malato, glutamato e piruvato (tonalidade azul, CI LEAK). Estimulação significativa do consumo de O2 é observada após a administração de ADP (tonalidade verde, CI OXPHOS), com a respiração impulsionada ainda mais após a adição de succinato (tonalidade roxa, CI+II OXPHOS). O citocromo C não induziu aumento significativo (<15%), indicando que a membrana mitocondrial externa está intacta (tonalidade laranja, CI+II+Cyt C OXPHOS). As mitocôndrias são desacopladas após a adição de FCCP (tom amarelo, MAX ETS). A linha azul representa a concentração de oxigênio em uma câmara fechada. A linha vermelha representa a taxa de consumo de oxigênio (fluxo de O2 ). Compostos adicionados: Malato (m), Glutamato (g), Piruvato (p), Difosfato de Adenosina (ADP), Citocromo C (cyt c), Carbonilcianeto-p-trifluorometoxifenilhidrazona (FCCP). (C) O gráfico de barras reflete resultados representativos (n = 8). Os dados são representados como ± SEM. Clique aqui para ver uma versão maior desta figura.
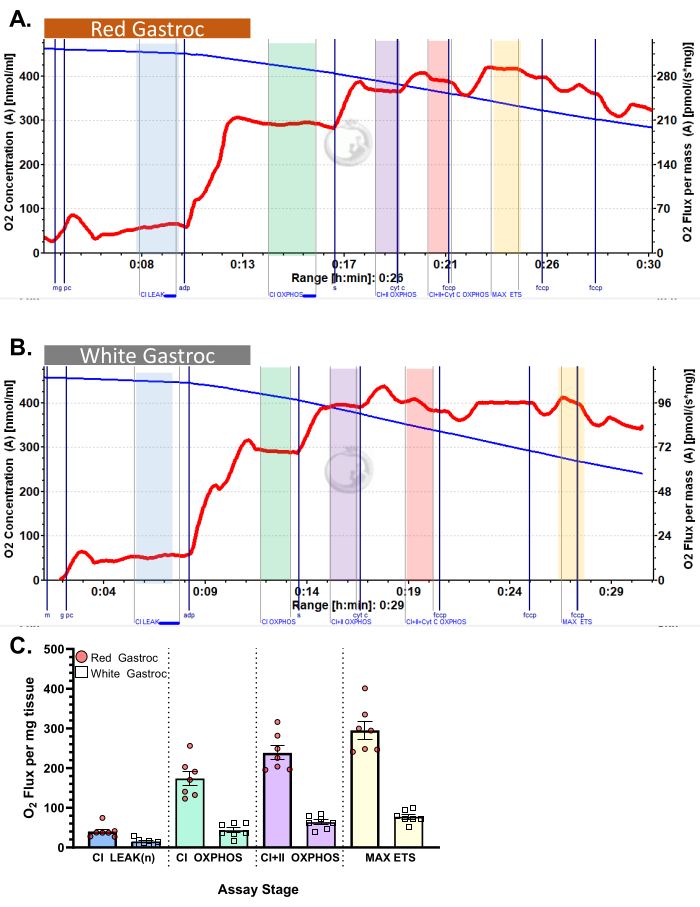
Figura 4: Consumo de oxigênio em camundongos. Os resultados mostram o consumo de oxigênio em (A) gastrocnêmio vermelho e (B) branco usando o protocolo palmitoil-carnitina. Fluxo de estado 2 após a adição de malato, glutamato e palmitoil carnitina (tonalidade azul, CI LEAK). Estimulação significativa do consumo de O2 é observada após a administração de ADP (tonalidade verde, CI OXPHOS), com a respiração impulsionada ainda mais após a adição de succinato (tonalidade roxa, CI+II OXPHOS). O citocromo C não induziu aumento significativo (<15%), indicando que a membrana mitocondrial externa está intacta (tonalidade laranja, CI+II+Cyt C OXPHOS). As mitocôndrias são desacopladas após a adição de FCCP (tom amarelo, MAX ETS). A linha azul representa a concentração de oxigênio em uma câmara fechada. A linha vermelha representa a taxa de consumo de oxigênio (fluxo de O2 ). Compostos adicionados: Malato (m), Glutamato (g), Palmitoil Carnitina (pc), Adenosina Difosfato (ADP), Citocromo C (cyt c), Carbonilcianeto-p-trifluorometoxifenilhidrazona (FCCP). (C) O gráfico de barras reflete resultados representativos (n = 7). Os dados são representados como ± SEM. Clique aqui para ver uma versão maior desta figura.
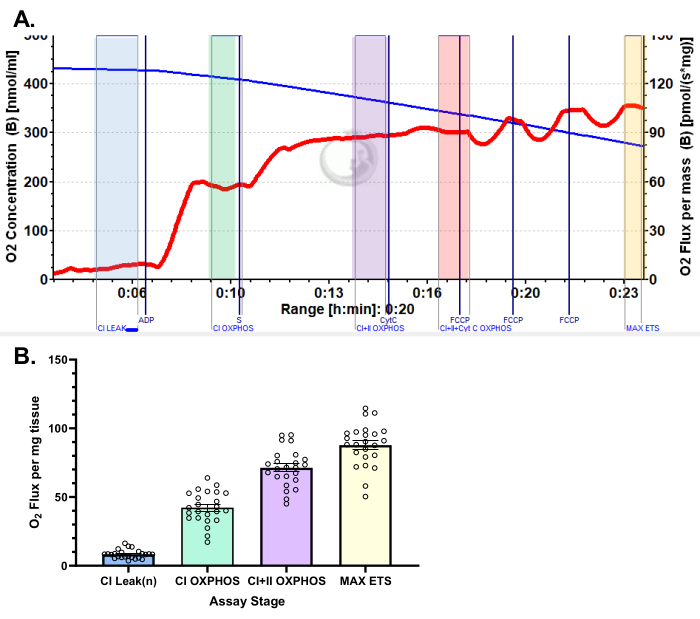
Figura 5: Resultados representativos do consumo de oxigênio no vasto lateral humano usando o protocolo de piruvato. (A) Fluxo de estado 2 após a adição de malato, glutamato e piruvato (sombra azul, CI LEAK). Estimulação significativa do consumo de O2 é observada após a administração de ADP (tonalidade verde, CI OXPHOS), com a respiração impulsionada ainda mais após a adição de succinato (tonalidade roxa, CI+II OXPHOS). O citocromo C não induziu aumento significativo (<15%), indicando que a membrana mitocondrial externa está intacta (tonalidade laranja, CI+II+Cyt C OXPHOS). As mitocôndrias são desacopladas após a adição de FCCP (tom amarelo, MAX ETS). A linha azul representa a concentração de oxigênio em uma câmara fechada. A linha vermelha representa a taxa de consumo de oxigênio (fluxo de O2 ). Compostos adicionados: Malato (m), Glutamato (g), Piruvato (p), Difosfato de Adenosina (ADP), Citocromo C (cyt c), Carbonilcianeto-p-trifluorometoxifenilhidrazona (FCCP). (B) O gráfico de barras reflete resultados representativos obtidos de biópsias do vasto lateral (n = 24). Os dados são representados como ± SEM. Clique aqui para ver uma versão maior desta figura.
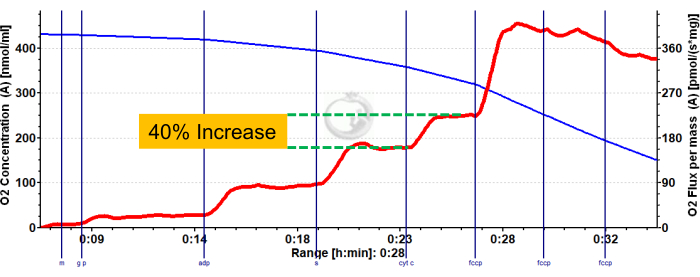
Figura 6: Resultado representativo demonstrando integridade comprometida da membrana mitocondrial externa em gastrocnêmio vermelho de camundongo. Fluxo de estado 2 após a adição de malato, glutamato e piruvato (tonalidade azul, CI LEAK). Estimulação significativa do consumo de O2 é observada após a administração de ADP (tonalidade verde, CI OXPHOS), com a respiração impulsionada ainda mais após a adição de succinato (tonalidade roxa, CI+II OXPHOS). O citocromo C induziu um aumento significativo no consumo de O2 (>15%), indicando danos à membrana mitocondrial externa. A linha azul representa a concentração de oxigênio em uma câmara fechada. A linha vermelha representa a taxa de consumo de oxigênio (fluxo de O2 ). Compostos adicionados: Malato (m), Glutamato (g), Piruvato (p), Difosfato de Adenosina (ADP), Citocromo C (cyt c), Carbonilcianeto-p-trifluorometoxifenilhidrazona (FCCP). Clique aqui para ver uma versão maior desta figura.
Tabela 1: Preparação de reagentes de compostos respiratórios e soluções respiratórias. São apresentados detalhes para a preparação dos reagentes necessários para o ensaio, incluindo as concentrações finais de estoque e como prepará-los e armazená-los. Clique aqui para baixar esta tabela.
Discussão
Este protocolo fornece um protocolo de modelo abrangente e direto para avaliar a função mitocondrial em fibras musculares esqueléticas permeabilizadas para amostras humanas e de camundongos. Existem várias vantagens em usar fibras permeabilizadas em vez de mitocôndrias isoladas. Uma vantagem importante é que o uso de fibras permeabilizadas requer pequenas quantidades (2-5 mg) de tecido, tornando esse método adequado tanto para amostras de biópsia muscular humana quanto para músculo de camundongo. Outra vantagem sobre as mitocôndrias isoladas é que a arquitetura celular permanece intacta, garantindo a preservação das interações estruturais e funcionais entre as mitocôndrias e os componentes celulares 12,21,22,23.
O uso de piruvato, malato e glutamato em nosso protocolo glicolítico aeróbico fornece uma avaliação abrangente e de amplo espectro do fornecimento de NADH para o Complexo I 24,25,26,27,28. Embora essa abordagem abrangente forneça uma avaliação da atividade do Complexo I em condições metabólicas holísticas e fisiologicamente relevantes, o uso de piruvato-malato ou glutamato-malato pode ser uma abordagem experimental mais apropriada. Por exemplo, o uso de glutamato-malato pode revelar diferenças na função mitocondrial relacionadas ao catabolismo de aminoácidos29. Incentivamos os investigadores a considerar cuidadosamente a abordagem apropriada a ser usada para seu modelo de pesquisa específico.
Embora este protocolo se concentre no uso de substratos para avaliar a atividade mitocondrial, o uso de inibidores específicos pode ser necessário para atingir objetivos experimentais. Por exemplo, a rotenona pode ser usada para inibir o Complexo I 12,21,30, a oligomicina usada para inibir o Complexo V (ATP Sintase)12,21 e a antimicina A para bloquear o Complexo III12,21 para avaliação da respiração não mitocondrial. O protocolo fornecido acima pode ser facilmente adaptado para incluir o uso de inibidores específicos. É importante notar que uma ressalva em relação ao uso de inibidores é que esses compostos são pegajosos e requerem limpeza extensiva para serem removidos da câmara do instrumento. Descobrimos que o uso de uma solução de 10% de BSA por 60 min é suficiente para a remoção de inibidores residuais.
A respiração LEAK refere-se à taxa de consumo de oxigênio que é independente da síntese de ATP. Essa taxa representa o fluxo de prótons de volta para a matriz mitocondrial através da membrana mitocondrial interna. Existem três métodos aceitos para avaliar o consumo de oxigênio independente da síntese de ATP (LEAK). O primeiro, LEAK(n), mede a taxa de consumo de oxigênio na presença de substratos, mas sem a adição de adenilatos (ADP ou ATP)31,32,33. Este estado LEAK representa o vazamento intrínseco da membrana mitocondrial. O segundo método, LEAK(t), é medido na presença de ATP34 e o terceiro, LEAK(o), é medido na presença do inibidor de ATP-sintase oligomicina 35,36,37. Este protocolo usa LEAK(n) para esta avaliação, mas dependendo dos objetivos e modelos experimentais, outros métodos para medir o fluxo de oxigênio LEAK podem ser apropriados.
Para este ensaio, o MiR05 é suplementado com creatina (3 mg / mL) e blebbitatina (10 μM). O transporte mitocondrial de ADP é facilitado pela creatina quinase (CK), e a creatina é adicionada à solução respiratória para saturar a atividade da CK38,39. As fibras musculares podem se contrair espontaneamente e também são sensíveis à contração induzida pelo ADP. Para avaliar a atividade respiratória mitocondrial sem a influência da contração, a blebbitatina foi adicionada para inibir a atividade contrátil das fibras38. Além disso, estudos em músculo humano sugerem que a capacidade respiratória pode ser influenciada pelo método de biópsia (microbiópsia versus agulha de Bergstrom) e que essa diferença pode ser devida a diferenças no comprimento das fibras obtidas 40,41. Fibras mais curtas podem ser mais suscetíveis a danos durante a preparação, e o uso de blebbitatina ajuda a preservar a função. Pode haver certas condições em que o relaxamento das fibras não se encaixa nos objetivos da pesquisa e, nesse caso, a blebbitatina pode ser excluída da solução MiR05.
A permeabilização das fibras musculares esqueléticas com saponina gera poros na membrana plasmática e permite que substratos e inibidores entrem livremente na célula. A saponina tem alta afinidade pelo colesterol, que é rico e abundante nas membranas plasmáticas celulares, enquanto as membranas mitocondriais são pobres em colesterol42,43. Espera-se que o tratamento com saponina usado para preparação de fibras neste protocolo preserve a integridade da membrana mitocondrial. Danos às mitocôndrias também podem ocorrer devido a forças de cisalhamento que resultam da separação mecânica do tecido em fibras. Sugerimos que a separação do tecido em feixes de fibras seja realizada rapidamente e com o mínimo de manuseio. Para avaliar o potencial dano mitocondrial, incluímos a titulação do citocromo C no protocolo de respiração. O citocromo C não pode passar por uma membrana mitocondrial externa intacta12, portanto, qualquer aumento no fluxo de O2 após a adição do citocromo C indica que ocorreu dano à membrana mitocondrial externa durante o processo de preparação da amostra. Em um de nossos estudos recentes, descobrimos que o fluxo de O2 aumentou 8%15 após a adição do citocromo C, validando que o uso de saponina sugerido neste protocolo não provoca danos mitocondriais. Sugerimos que qualquer amostra que demonstre um aumento superior a 15% no fluxo de O2 após a adição do citocromo C deve ser excluída da análise44. Esta etapa é incluída estritamente como uma medida de controle de qualidade e não como uma avaliação da atividade do Complexo IV.
Embora a respirometria de alta resolução se destaque por fornecer medições altamente sensíveis e confiáveis do consumo de oxigênio, uma limitação notável da instrumentação é que apenas duas amostras podem ser medidas simultaneamente por instrumento. Isso requer uma consideração cuidadosa ao projetar estudos envolvendo coortes com múltiplas amostras. Embora possa haver a tentação de realizar medições em vários conjuntos de amostras ao longo do dia, aconselhamos fortemente os investigadores a considerar a influência do ritmo circadiano no metabolismo. Pesquisas sobre o músculo esquelético humano e de roedores revelaram uma influência do relógio biológico na função mitocondrial45,46. Consequentemente, recomendamos a realização de medições ao longo de vários dias na mesma hora do dia para levar em conta essas flutuações circadianas.
Por fim, para garantir medições de respirometria reprodutíveis e robustas, o respirômetro deve receber limpeza, manutenção e calibração regulares. A calibração do ar, conforme detalhado no protocolo, deve ser realizada diariamente. Aconselhamos os usuários a também realizar uma calibração mensal completa (ar e zero) dos sensores polarográficos de oxigênio. Os usuários devem consultar a documentação e o site do fabricante para obter mais informações sobre este método de calibração e para obter instruções sobre a manutenção de rotina do instrumento.
A respirometria de alta resolução continua sendo o padrão-ouro para medir a respiração mitocondrial. O método detalhado neste protocolo facilita a avaliação robusta da capacidade mitocondrial em músculos esqueléticos de roedores e humanos. Esse protocolo tem sido aplicado a estudos que avaliam a função mitocondrial associada a modelos genéticos de camundongos15,16, no contexto de doença renal crônica19, após administração de suplemento dietético14,20 e exercício17,18.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
A pesquisa relatada nesta publicação foi apoiada pelo Nutrition Obesity Research Center, NIH grant P30 DK056341 e NIH grant K01 HL145326.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 µL Hamilton Syringe (glass syringe) | ThermoFisher | 14-813-125 | For respiration assay titration |
| 25 µL Hamilton Syringe (glass syringe) | ThermoFisher | 14-813-133 | For respiration assay titration |
| ADP | Merck | 117105 | Respirometry Assay |
| Black Glass Dissection Dish | Scintica | DD-90-S-BLK | For sample preparation |
| Blebbistatin | Sigma | B0560 | Working MiR05 Solution |
| BSA, fatty acid free | Sigma | A6003 | MiR05 Solution |
| Calcium Carbonate | Sigma | C4830 | BIOPS Solution |
| Creatine | Sigma | 27900 | Working MiR05 Solution |
| Cytochrome C | Sigma | C7752 | Respirometry Assay |
| DatLab | Oroboros Instruments | N/A | Respirometry Software |
| Dithiothreitol (DTT) | Sigma | D0632 | BIOPS Solution |
| D-Sucrose | Sigma | 84097 | MiR05 Solution |
| EGTA | Sigma | E4378 | BIOPS & MiR05 Solution |
| FCCP | Sigma | C2920 | Respirometry Assay |
| Glutamate | Sigma | G1626 | Respirometry Assay |
| HEPES | Sigma | H7523 | MiR05 Solution |
| Imidazole | Sigma | 56750 | BIOPS Solution |
| KH2PO4 | Sigma | P5379 | MiR05 Solution |
| Lactobionic acid | Sigma | 153516 | MiR05 Solution |
| Malate | Sigma | M1000 | Respirometry Assay |
| MES hydrate | Sigma | M8250 | BIOPS Solution |
| MgCl2 - 6 H2O | Sigma | M2670 | BIOPS & MiR05 Solution |
| Oroboros Oxygraph-2K (O2K) System | Oroboros Instruments | 10203-03 | High resolution respirometer |
| Palmitoyl-Carnitine | Sigma | P4509 | Respirometry Assay |
| Potassium Hydroxide | Sigma | P1767 | BIOPS Solution |
| Precision Tweezers | Fisher | 17-467-168 | For sample preparation |
| Saponin | Sigma | S2149 | For Fiber Permeabilization |
| Sodium ATP | Sigma | A2383 | BIOPS Solution |
| Sodium Phosphocreatine | Sigma | P7936 | BIOPS Solution |
| Sodium Pyruvate | Sigma | P2256 | Respirometry Assay |
| Succinate | Sigma | S2378 | Respirometry Assay |
| Taurine | Sigma | T0625 | BIOPS & MiR05 Solution |
Referências
- Rizzuto, R., De Stefani, D., Raffaello, A., Mammucari, C. Mitochondria as sensors and regulators of calcium signalling. Nat Rev Mol Cell Biol. 13 (9), 566-578 (2012).
- Ruegsegger, G. N., Creo, A. L., Cortes, T. M., Dasari, S., Nair, K. S. Altered mitochondrial function in insulin-deficient and insulin-resistant states. J Clin Invest. 128 (9), 3671-3681 (2018).
- Simoneau, J. A., Kelley, D. E. Altered glycolytic and oxidative capacities of skeletal muscle contribute to insulin resistance in NIDDM. J Appl Physiol. 83 (1), 166-171 (1997).
- Ryan, T. E., et al. Extensive skeletal muscle cell mitochondriopathy distinguishes critical limb ischemia patients from claudicants. JCI Insight. 3 (21), 123235 (2018).
- Sullivan, M. J., Green, H. J., Cobb, F. R. Skeletal muscle biochemistry and histology in ambulatory patients with long-term heart failure. Circulation. 81 (2), 518-527 (1990).
- Giebelstein, J., et al. The proteomic signature of insulin-resistant human skeletal muscle reveals increased glycolytic and decreased mitochondrial enzymes. Diabetologia. 55 (4), 1114-1127 (2012).
- Tezze, C., et al. Age-associated loss of OPA1 in muscle impacts muscle mass, metabolic homeostasis, systemic inflammation, and epithelial senescence. Cell Metab. 25 (6), 1374-1389 (2017).
- Hughes, M. C., et al. Early myopathy in Duchenne muscular dystrophy is associated with elevated mitochondrial H(2) O(2) emission during impaired oxidative phosphorylation. J Cachexia Sarcopenia Muscle. 10 (2), 643-661 (2019).
- Yin, Y., Shen, H. Common methods in mitochondrial research (Review). Int J Mol Med. 50 (4), 5182 (2022).
- Vue, Z., et al. 3D reconstruction of murine mitochondria reveals changes in structure during aging linked to the MICOS complex. Aging Cell. 22 (12), e14009 (2023).
- Doerrier, C., et al. High-resolution fluoRespirometry and OXPHOS protocols for human cells, permeabilized fibers from small biopsies of muscle, and isolated mitochondria. Methods Mol Biol. 1782, 31-70 (2018).
- Pesta, D., Gnaiger, E. High-resolution respirometry: OXPHOS protocols for human cells and permeabilized fibers from small biopsies of human muscle. Methods Mol Biol. 810, 25-58 (2012).
- Picard, M., Hepple, R. T., Burelle, Y. Mitochondrial functional specialization in glycolytic and oxidative muscle fibers: tailoring the organelle for optimal function. Am J Physiol Cell Physiol. 302 (4), C629-C641 (2012).
- Yoshino, M., et al. Nicotinamide mononucleotide increases muscle insulin sensitivity in prediabetic women. Science. 372 (6547), 1224-1229 (2021).
- Mousa, M. G., et al. Site-1 protease inhibits mitochondrial respiration by controlling the TGF-beta target gene Mss51. Cell Rep. 42 (4), 112336 (2023).
- Moon, S. H., et al. Genetic deletion of skeletal muscle iPLA(2)gamma results in mitochondrial dysfunction, muscle atrophy and alterations in whole-body energy metabolism. iScience. 26 (6), 106895 (2023).
- Bittel, A. J., et al. A single bout of premeal resistance exercise improves postprandial glucose metabolism in obese men with prediabetes. Med Sci Sports Exerc. 53 (4), 694-703 (2021).
- Bittel, A. J., et al. A single bout of resistance exercise improves postprandial lipid metabolism in overweight/obese men with prediabetes. Diabetologia. 63 (3), 611-623 (2020).
- Bittel, D. C., Bittel, A. J., Varadhachary, A. S., Pietka, T., Sinacore, D. R. Deficits in the skeletal muscle transcriptome and mitochondrial coupling in progressive diabetes-induced CKD relate to functional decline. Diabetes. 70 (5), 1130-1144 (2021).
- Mills, K. F., et al. Long-term administration of nicotinamide mononucleotide mitigates age-associated physiological decline in mice. Cell Metab. 24 (6), 795-806 (2016).
- Djafarzadeh, S., Jakob, S. M. High-resolution respirometry to assess mitochondrial function in permeabilized and intact cells. J Vis Exp. (120), e54985 (2017).
- Lemieux, H., Semsroth, S., Antretter, H., Hofer, D., Gnaiger, E. Mitochondrial respiratory control and early defects of oxidative phosphorylation in the failing human heart. Int J Biochem Cell Biol. 43 (12), 1729-1738 (2011).
- Gnaiger, E. Capacity of oxidative phosphorylation in human skeletal muscle: new perspectives of mitochondrial physiology. Int J Biochem Cell Biol. 41 (10), 1837-1845 (2009).
- Appelman, B., et al. Muscle abnormalities worsen after post-exertional malaise in long COVID. Nat Commun. 15 (1), 17 (2024).
- O'Rourke, A. R., et al. Impaired muscle relaxation and mitochondrial fission associated with genetic ablation of cytoplasmic actin isoforms. FEBS J. 285 (3), 481-500 (2018).
- Inigo, M. R., et al. Estrogen receptor-alpha in female skeletal muscle is not required for regulation of muscle insulin sensitivity and mitochondrial regulation. Mol Metab. 34, 1-15 (2020).
- Musci, R. V., et al. Phytochemical compound PB125 attenuates skeletal muscle mitochondrial dysfunction and impaired proteostasis in a model of musculoskeletal decline. J Physiol. 601 (11), 2189-2216 (2023).
- Englund, D. A., et al. p21 induces a senescence program and skeletal muscle dysfunction. Mol Metab. 67, 101652 (2023).
- Zhang, K., et al. Mitochondrial supercomplex assembly regulates metabolic features and glutamine dependency in mammalian cells. Theranostics. 13 (10), 3165-3187 (2023).
- Davis, M. S., Barrett, M. R. High-resolution fluoro-respirometry of equine skeletal muscle. J Vis Exp. (192), e65075 (2023).
- Schytz, C. T., et al. Skeletal muscle mitochondria demonstrate similar respiration per cristae surface area independent of training status and sex in healthy humans. J Physiol. 602 (1), 129-151 (2024).
- Hingst, J. R., et al. Inducible deletion of skeletal muscle AMPKalpha reveals that AMPK is required for nucleotide balance but dispensable for muscle glucose uptake and fat oxidation during exercise. Mol Metab. 40, 101028 (2020).
- Krumschnabel, G., Eigentler, A., Fasching, M., Gnaiger, E. Use of safranin for the assessment of mitochondrial membrane potential by high-resolution respirometry and fluorometry. Methods Enzymol. 542, 163-181 (2014).
- Gnaiger, E., Mendez, G., Hand, S. C. High phosphorylation efficiency and depression of uncoupled respiration in mitochondria under hypoxia. Proc Natl Acad Sci U S A. 97 (20), 11080-11085 (2000).
- Basse, A. L., et al. Nampt controls skeletal muscle development by maintaining Ca(2+) homeostasis and mitochondrial integrity. Mol Metab. 53, 101271 (2021).
- Flensted-Jensen, M., et al. Combined changes in temperature and pH mimicking exercise result in decreased efficiency in muscle mitochondria. J Appl Physiol. 136 (1985), 79-88 (2024).
- Porter, C., et al. Mitochondrial respiratory capacity and coupling control decline with age in human skeletal muscle. Am J Physiol Endocrinol Metab. 309 (3), E224-E232 (2015).
- Perry, C. G., et al. Inhibiting myosin-ATPase reveals a dynamic range of mitochondrial respiratory control in skeletal muscle. Biochem J. 437 (2), 215-222 (2011).
- Veksler, V. I., et al. Muscle creatine kinase-deficient mice. II. Cardiac and skeletal muscles exhibit tissue-specific adaptation of the mitochondrial function. J Biol Chem. 270 (34), 19921-19929 (1995).
- Isner-Horobeti, M. E., et al. Microbiopsies versus Bergstrom needle for skeletal muscle sampling: impact on maximal mitochondrial respiration rate. Eur J Appl Physiol. 114 (5), 885-889 (2014).
- Hughes, M. C., et al. Mitochondrial bioenergetics and fiber type assessments in microbiopsy vs. Bergstrom percutaneous sampling of human skeletal muscle. Front Physiol. 18 (6), 360 (2015).
- Kuznetsov, A. V., et al. Analysis of mitochondrial function in situ in permeabilized muscle fibers, tissues and cells. Nat Protoc. 3 (6), 965-976 (2008).
- Elustondo, P., Martin, L. A., Karten, B. Mitochondrial cholesterol import. Biochim Biophys Acta Mol Cell Biol Lipids. 1862 (1), 90-101 (2017).
- Ramos, P. M., Li, C., Elzo, M. A., Wohlgemuth, S. E., Scheffler, T. L. Mitochondrial oxygen consumption in early postmortem permeabilized skeletal muscle fibers is influenced by cattle breed. J Anim Sci. 98 (3), 044 (2020).
- van Moorsel, D., et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Mol Metab. 5 (8), 635-645 (2016).
- de Goede, P., et al. Time-restricted feeding during the inactive phase abolishes the daily rhythm in mitochondrial respiration in rat skeletal muscle. FASEB J. 36 (2), e22133 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
SOBRE A JoVE
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados