É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ressonância magnética e espectroscopia de pulmão hiperpolarizada 129Xe em camundongos ventilados mecanicamente
Neste Artigo
Resumo
A ressonância magnética de xenônio hiperpolarizada pode quantificar a microestrutura pulmonar regional (dimensões do espaço aéreo) e a fisiologia (ventilação e troca gasosa) em pesquisa translacional e atendimento clínico. Embora desafiador, pode fornecer insights pulmonares comparáveis em estudos pré-clínicos. Este protocolo descreve a infraestrutura e os procedimentos necessários para realizar ressonância magnética pulmonar de xenônio de rotina em camundongos.
Resumo
O xenônio-129 (129Xe) hiperpolarizado (HP) é um agente de contraste de ressonância magnética inalada (RM) com propriedades espectrais e físicas únicas que podem ser exploradas para quantificar a fisiologia pulmonar, incluindo ventilação, difusão restrita (tamanho do espaço aéreo alveolar) e troca gasosa. Em humanos, tem sido usado para avaliar a gravidade e a progressão da doença em uma variedade de distúrbios pulmonares e é aprovado para uso clínico nos Estados Unidos e no Reino Unido. Além de suas aplicações clínicas, a capacidade da ressonância magnética 129Xe de avaliar de forma não invasiva a fisiopatologia pulmonar e fornecer informações espacialmente resolvidas é valiosa para a pesquisa pré-clínica. Entre os modelos animais, os camundongos são os mais utilizados devido à acessibilidade dos modelos de doenças geneticamente modificadas. Aqui, a ressonância magnética 129Xe é promissora como uma técnica minimamente invasiva, livre de radiação e sensível para monitorar longitudinalmente a progressão da doença pulmonar e a resposta à terapia (por exemplo, na descoberta de medicamentos). Essa técnica pode se estender a aplicações pré-clínicas, incorporando um aparelho de respiração livre acionado por ressonância magnética ou ventilador mecânico para fornecer gás. Aqui, descrevemos as etapas e fornecemos listas de verificação para garantir uma coleta e análise de dados robustas, incluindo a criação de um simulador de gás xenônio polarizado termicamente para controle de qualidade, otimização da polarização, manuseio de animais (sedação, intubação, ventilação e cuidados com camundongos) e protocolos para ventilação, difusão restrita e dados de troca gasosa. Embora a ressonância magnética pré-clínica de 129Xe possa ser aplicada em vários modelos animais (por exemplo, ratos, porcos, ovelhas), este protocolo se concentra em camundongos devido aos desafios impostos por sua pequena anatomia, que são equilibrados por sua acessibilidade e a disponibilidade de muitos modelos de doenças.
Introdução
Embora os distúrbios pulmonares continuem sendo as principais causas de morbidade e mortalidade global1, a última década viu melhorias dramáticas nos resultados dos pacientes. Essas melhorias são impulsionadas em parte por dois fatores. Em primeiro lugar, os ensaios clínicos de Fase III agora priorizam as mudanças na função pulmonar como desfechos em vez da mortalidade, acelerando os testes de medicamentos 2,3,4,5. Em segundo lugar, os avanços em modelos animais aprimorados forneceram informações sobre os mecanismos da doença e ajudaram no desenvolvimento da terapia 6,7. Os modelos de camundongos são frequentemente favorecidos para pesquisa translacional porque oferecem paralelos fisiológicos com os humanos, acessibilidade e rápido desenvolvimento de doenças. A engenharia genética expandiu o alcance e a qualidade dos modelos disponíveis, com o International Mouse Strain Resource agora ostentando mais de 32.000 cepas de camundongos8, em comparação com apenas 4.218 cepas de ratos (Rat Genome Database9). Esses modelos abriram novos caminhos para investigar os fatores mecanicistas e as respostas terapêuticas para uma variedade de doenças pulmonares, incluindo doença pulmonar obstrutiva crônica (DPOC)10, fibrose cística (FC)11, fibrose pulmonar12,13, hipertensão pulmonar14,15 easma16.
Infelizmente, a pesquisa pulmonar envolvendo camundongos é limitada pelas técnicas disponíveis para quantificar a carga da doença. Os estudos geralmente dependem de procedimentos terminais que 1) fornecem informações de todo o pulmão (ensaios bioquímicos) ou informações localizadas (histologia) e 2) exigem desenhos transversais e grandes tamanhos de amostra. Assim, eles não capturam a dinâmica espacial nem temporal da doença. Em contraste, a imagem tridimensional não invasiva pode avaliar a estrutura, os processos moleculares e a função nos pulmões ao longo do tempo.
A estrutura pulmonar (por exemplo, anormalidades das vias aéreas e fibrose intersticial) pode ser visualizada com ressonância nuclear magnética (RNM) ultracurta (UTE) e tomografia computadorizada (μTC) em alta resolução. Informações funcionais e mecanicistas (por exemplo, ventilação, perfusão, metabolismo tumoral e processos inflamatórios) podem ser obtidas com agentes de contraste exógenos (por exemplo, TC com xenônio e UTE com oxigênio) e abordagens de medicina nuclear ionizante (ou seja, tomografia por emissão de pósitrons [PET] e tomografia computadorizada por emissão de fóton único [SPECT]). No entanto, a imagem funcional é desafiadora devido ao modesto contraste com ruído (particularmente para UTE com oxigênio aprimorado nas altas intensidades de campo magnético usadas para ressonância magnética pré-clínica, onde T1 é alongado) disponível sem empregar modalidades ionizantes com níveis de radiação mais altos do que o normal. Embora a imagem com essas modalidades seja bem tolerada em modelos animais usando doses convencionais, a radiação cumulativa pode confundir os resultados em estudos sobre imunologia, inflamação e câncer de pulmão17. No entanto, a ressonância magnética (MRI) de xenônio-129 (129Xe) hiperpolarizada (HP) fornece informações estruturais e funcionais minimamente invasivas, não irradiantes e altamente sensíveis. Embora essa técnica tenha sido empregada em pesquisas pré-clínicas para caracterizar condições como enfisema18,19, fibrose20, câncer de pulmão21, DPOC22 e lesão pulmonar induzida por radiação23 em pontos de tempo únicos ou múltiplos, ela permanece subutilizada no ambiente pré-clínico.
Para permitir a ressonância magnética pré-clínica de rotina de 129Xe, vários pré-requisitos são necessários, incluindo suporte regulatório institucional, um dispositivo de hiperpolarização, uma bobina de radiofrequência (RF) sintonizada em 129Xe e um scanner com capacidade multinuclear. Embora os aplicativos avançados 24,25,26,27,28,29,30,31,32,33 exijam programação de pulso específica do fornecedor que está fora do escopo deste protocolo, os aplicativos básicos podem ser alcançados com modificações modestas de software. Portanto, nos concentramos no controle de qualidade, manuseio de magnetização, coleta de dados e procedimentos de manuseio de animais - incluindo ventilação mecânica - que são exclusivos da ressonância magnética pré-clínica de 129Xe (Figura 1).
Até o momento, a imagem de 129Xe de pequenos animais empregou três abordagens de entrega de gás seguras para RM, cada uma com vantagens e desvantagens: respiração livre, acionada por pistão e queda de pressão. A respiração livre permite a inalação espontânea sem risco de lesão por intubação ou traqueostomia, mas consome significativamente mais gás HP e pode introduzir artefatos de movimento34,35. Dispositivos comerciais acionados por pistão são autocalibrados e fáceis de usar prontos para uso, mas podem ser proibitivamente caros36. A abordagem baseada em queda de pressão usada aqui é bem descrita na literatura, modular, personalizável e executada por código-fonte aberto 37,38,39,40. Além disso, é econômico, normalmente totalizando menos de US$ 10 mil e algumas semanas de tempo de construção dedicado. O ventilador de queda de pressão fornece 129Xe de uma bolsa de dose dentro de um recipiente pressurizado enquanto monitora a pressão das vias aéreas de um camundongo intubado.
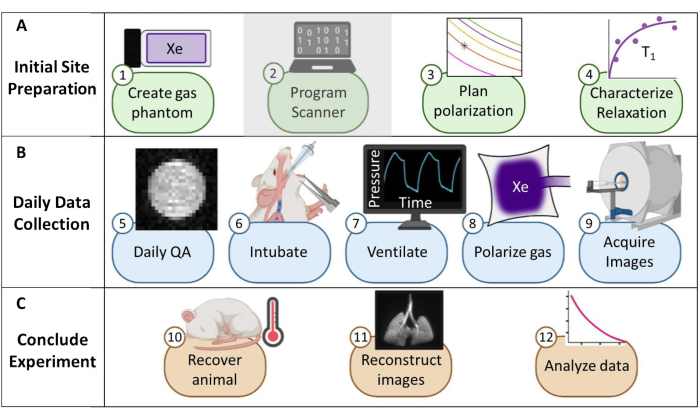
Figura 1: Visão geral do protocolo para coletar ressonância magnética (MRI) de rotina de xenônio-129 (129Xe) em camundongos. (A) Etapas para configuração inicial. (Observação: a programação do scanner é exclusiva para cada fornecedor e não está descrita neste protocolo). (B) Etapas para coletar dados diários de garantia de qualidade (QA) e animais. (C) Etapas para a conclusão bem-sucedida do experimento e análise de dados. Clique aqui para ver uma versão maior desta figura.
Aqui, coletamos e analisamos as três classes comuns de dados de ressonância magnética de 129Xe: ventilação, imagem ponderada por difusão (tamanho do espaço aéreo alveolar) e troca gasosa. As imagens de ventilação mostram a distribuição do gás 129Xe inalado. Regiões dos pulmões com fluxo de ar reduzido parecem escuras nas imagens de gás HP, e a patologia é quantificada pelo volume de ventilação defeituosa. Em humanos, o percentual de defeitos ventilatórios (VDP) tem apresentado forte repetibilidade41,42 e alta sensibilidade à obstrução pulmonar em doenças como DPOC 43,44,45 e asma 46,47.
A difusão restrita dos 129átomos de Xe no espaço aéreo pode ser medida através do coeficiente de difusão aparente (ADC) e serve como um substituto para o tamanho do espaço aéreo. O ADC é calculado adquirindo uma imagem de linha de base (b0) sem ponderação de difusão e uma ou mais imagens adquiridas na presença de ponderação de difusão induzida por gradiente bipolar (bN). Um ADC elevado reflete um aumento no tamanho do espaço aéreo devido ao envelhecimento ou remodelação enfisematosa18,48. Além disso, o uso de múltiplas imagens de valor b (≥4) permite que informações morfométricas mais detalhadas (por exemplo, intercepto linear médio) sejam calculadas49,50.
As trocas gasosas podem ser caracterizadas devido a 1) a solubilidade de 129Xe no tecido da membrana capilar, plasma e hemácias (glóbulos vermelhos) e 2) o deslocamento químico de >200 ppm no campo descendente de 129Xe quando dissolvido nesses compartimentos. Tanto os dados espectroscópicos quanto os de imagem fornecem informações sobre doenças cardiopulmonares (por exemplo, hipertensão pulmonar e insuficiência cardíaca esquerda 51,52,53). Enquanto muitas espécies (humanos, caninos e ratos) exibem picos espectrais únicos originados de cada compartimento, os camundongos não possuem um sinal único de hemácias devido a diferenças nas interações do local de ligação hemoglobina-xenônio. Em vez disso, todos os componentes dissolvidos são combinados em um único sinal em camundongos54. No entanto, é possível observar uma ressonância distinta de hemácias em camundongos transgênicos que expressam hemoglobina humana, como os usados em modelos de doença falciforme54. No geral, a espectroscopia e a imagem de Xe 129dissolvido fornecem informações únicas sobre a fisiopatologia cardiopulmonar em camundongos 55,56.
Antes de tentar este protocolo, é necessário entender as informações básicas sobre o scanner de ressonância magnética, ventilação mecânica e técnicas de manuseio de camundongos necessárias para estudos com camundongos. Antes de iniciar os estudos em animais, todos os procedimentos devem ser aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) local57. Como o momento magnético total disponível no pulmão do camundongo é intrinsecamente baixo (ou seja, volume corrente ~ 250 μL), o tamanho do voxel deve ser 1000 vezes menor do que em humanos para atingir uma resolução anatomicamente equivalente. A frequência respiratória murina também é extremamente rápida (>100 respirações/minuto). Como tal, os procedimentos de apneia única normalmente usados para imagens humanas não são viáveis. Em vez disso, apenas algumas excitações de RF podem ser aplicadas em cada respiração, portanto, 129imagens Xe devem ser codificadas em dezenas a centenas de respirações. A programação de pulso pode ser necessária para permitir o disparo externo de aquisições e para fazer um loop adequado de fatias, codificações de fase e/ou imagens ponderadas por difusão, equilibrando a relação sinal-ruído (SNR), a resolução e a duração da varredura. Aqui, o ventilador emite um pulso lógico transistor-transistor (TTL) uma vez por respiração para acionar a aquisição de dados (Figura 2).
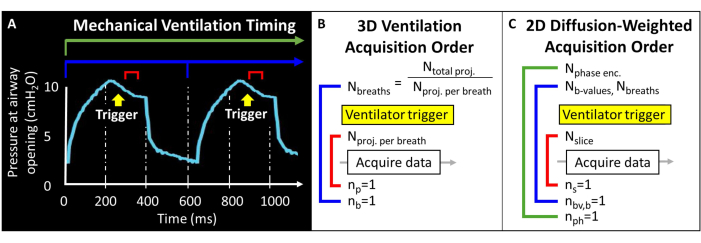
Figura 2: Ventilação mecânica representativa e tempo de aquisição de dados. (A) A ventilação controlada pelo usuário pode desencadear a aquisição de dados no final da inspiração, durante a apneia ou no final da expiração. (B) Para esta sequência de ventilação radial 3D, o usuário define o número total de projeções adquiridas e o número de projeções por respiração. (C) Para uma imagem ponderada por difusão 2D seletiva de fatias, o usuário define a ordem das fatias, imagens de valor b e codificações de fase. Clique aqui para ver uma versão maior desta figura.
Para permitir ventilação confiável e entrega de 129Xe, são necessários procedimentos robustos de sedação e intubação. Para cada estudo, os efeitos a jusante de cada anestésico devem ser considerados - incluindo alterações na ventilação-minuto, frequência cardíaca (FC) e pressão arterial 58,59,60,61,62,63,64,65,66. Embora uma variedade de sedativos tenha sido usada para ressonância magnética pré-clínica de gases HP, empregamos uma mistura de cetamina, xilazina e acepromazina, devido à sua disponibilidade, custo-benefício, confiabilidade e duração67,68. Uma vez sedados, os animais devem ser intubados para ventilação mecânica eficaz. A intubação de camundongos é difícil devido ao pequeno tamanho de sua anatomia e, portanto, é importante treinar minuciosamente nessa técnica. Encorajamos os investigadores a revisar os protocolos de vídeo publicados69,70. Como a maioria das cânulas de intubação comerciais contém aço inoxidável, introduzimos uma técnica para criar cânulas em forma de cunha sem metal (ou seja, compatíveis com ressonância magnética e gás HP) que podem ser personalizadas para corresponder ao diâmetro das vias aéreas para criar uma vedação hermética com a parede traqueal do camundongo.
Como 129imagens Xe são coletadas em muitas respirações, as configurações do ventilador são críticas. Estratégias de ventilação protetora devem ser cuidadosamente consideradas para prevenir lesões pulmonares 71,72,73,74. Em particular, o uso de baixo volume corrente (VC), pressão expiratória final positiva moderada (PEEP) e manobras de recrutamento alveolar (MRs) reduzem o risco de lesão pulmonar induzida por ventilador em pacientes humanos e modelos animais 75,76,77,78,79,80,81. Aqui, recomendamos uma técnica simples que seja compatível com a ventilação mecânica de queda de pressão 129Xe que seja protetora e forneça SNR de imagem 129Xe suficiente. Especificamente, aplicamos a PEEP adicionando uma válvula PEEP comercial à linha de expiração do ventilador. Para realizar RMs, a linha de expiração deve ser fechada para que o animal receba múltiplas inalações sem expiração até que uma pressão e duração alvo sejam atingidas.
Ao longo do tempo, fornecemos configurações gerais de ventilação, mas é aconselhável revisar a literatura para abordar os objetivos específicos do estudo82,83. Além de monitorar o pico de pressão inspiratória durante a ventilação mecânica, é importante monitorar a temperatura do animal, o que pode ser feito usando métodos padrão de monitoramento de temperatura em camundongos. Embora não seja necessário para imagens, o monitoramento da frequência cardíaca por meio de eletrocardiograma (ECG) pode ser vantajoso; O ECG pode indicar se um animal está acordando de sedação, overdose ou angustiado, permitindo que o pesquisador intervenha.
O protocolo que descrevemos foi projetado para coletar 129dados de ventilação radial Xe 3D61, dados ponderados por difusão 2D GRE76 e dados de troca gasosa de espectroscopia de aquisição de pulso dinâmico. Este protocolo visa preencher a lacuna entre a pesquisa pré-clínica em modelos de pequenos animais e o potencial da ressonância magnética de 129Xe para avançar nossa compreensão dos distúrbios pulmonares.
Protocolo
Todos os métodos descritos aqui foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) do Centro Médico do Hospital Infantil de Cincinnati.
1. Preparação inicial do site
- Crie e teste um fantasma de gás 129Xe polarizado termicamente (Figura 3).
- Obtenha um recipiente de vidro borossilicato (~ 60 mL), uma válvula de êmbolo com um O-ring de vedação frontal e uma haste de vidro borossilicato retificada, todos classificados em até 150 psig. Certifique-se de que não haja peças magnéticas. Conecte um encaixe de compressão à haste de vidro. Aperte para produzir uma vedação à prova de gás.
- Conecte o recipiente a uma bomba de vácuo e reservatório de oxigênio de acordo com a Figura 3A. Recipiente de vácuo a menos de 100 mTorr de pressão absoluta.
- Encha o recipiente com oxigênio até a pressão de 1.5 atm para reduzir o 129Xe T1 de > 30 min para ~ 2 s (com intensidade de campo magnético de 7 T; Para um scanner de 9,4 T, use oxigênio de 1,6 atm). Recipiente de vedação.
NOTA: Para intensidades de campo mais altas, será necessária uma pressão parcial de oxigênio um pouco mais alta para atingir T1≤ 2 s84. - Encha um reservatório impermeável a gás com 400 mL de xenônio enriquecido isotopicamente (85% 129Xe).
NOTA: O xenônio de abundância natural (26% 129Xe) também pode ser usado, mas a taveragem de sinal precisará ser aumentada para mitigar a redução de ~ 3 vezes no SNR. - Conecte a embarcação ao reservatório de 129Xe. Tubulação de vácuo com pressão absoluta inferior a 100 mTorr.
- Encha um líquido de bancada N2 Dewar de boca aberta a ~ 90%. Mergulhe o fundo do recipiente (~ 5 cm) em nitrogênio líquido para condensar O2 e criar um vácuo (Figura 3B). Enquanto estiver submerso, abra a válvula para permitir que 129Xe do reservatório flua para o vaso (Figura 3C).
- Vede a válvula de êmbolo puxando lentamente a haste até que o orifício de entrada no êmbolo seja puxado para além do O-ring. Imediatamente após o orifício passar pelo O-ring, aperte manualmente para vedar o recipiente. Remova o recipiente do nitrogênio líquido e deixe-o descongelar.
NOTA: Uma vez descongelado, o vaso pressurizará a ~ 4.5 atm (2 atm O2 + 2.5 atm 129Xe). - Proteja os copos (por exemplo, insira o recipiente no recipiente acolchoado de tubo de cloreto de polivinila (PVC), Figura 3D).
NOTA: Se mantido adequadamente, o simulador pode manter a pressão por uma década ou mais. - Meça o T1 do simulador (por exemplo, usando uma sequência de recuperação de inversão espectroscópica). Confirme T1 < 2 s para scanners de 7 T. Rastreie o sinal e o T1 ao longo do tempo para garantia de qualidade (QA).
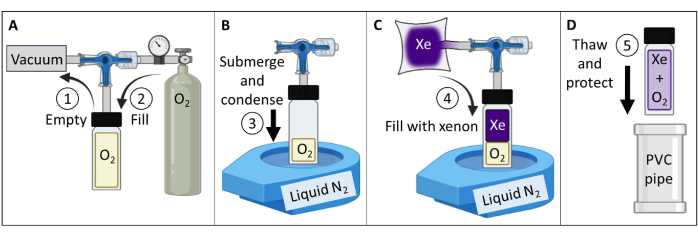
Figura 3: Criação de um simulador de gás 129Xe polarizado termicamente guiado pelo protocolo detalhado na Etapa 1.1. As pressões parciais de O2 e 129Xe podem ser alteradas para personalizar o T1 para produzir 129Xe T1 vezes apropriados e intensidade do sinal em uma determinada intensidade de campo84. Clique aqui para ver uma versão maior desta figura.
- Realize a garantia de qualidade com o simulador de gás polarizado termicamente (Tabela 1 e Figura 4).
- Coloque a bobina de 129Xe no isocentro do ímã e centralize o fantasma de gás 129Xe dentro da bobina. Em uma única sequência de pulso e aquisição ("pulso único"), defina a frequência de trabalho para corresponder à frequência aproximada de gás 129Xe no simulador (~ 83.07 MHz a 7T).
- Centralize as frequências de aquisição e excitação para a frequência 129Xe Larmor e use essa frequência para todas as varreduras 129Xe de calibração fantasma e controle de qualidade. Consulte a Tabela 1 para parâmetros experimentais para todas as varreduras de controle de qualidade. Confirme se o simulador está centralizado com um localizador fantasma (Figura 4A).
- Realize o experimento de nutação para calibrar o ângulo de inversão: Supondo que o SNR seja suficiente, use pulsos de RF únicos com espaçamento de tempo de repetição (TR) > 5 x T1. Para cada aquisição, aumente incrementalmente a potência de RF até que o sinal seja nulo e comece a inverter. O padrão usado aqui é: número de pulsos = 65; TR = 10 s; duração do pulso = 125 μs; Potência de RF = 1-13,8 W, incrementada em 0,2 W
- Transformada de Fourier e fase do primeiro espectro (ou seja, o espectro adquirido com a menor potência de RF). Aplique a mesma fase para todos os espectros. Plote os espectros reais em função da potência do pulso de RF (Figura 4B).
- A potência que produz um pico nulo (ou seja, altura mínima do pico) corresponde ao ângulo de inversão de 180°. Obtenha um ângulo de inversão de 90° usando a mesma potência na metade do comprimento de pulso necessário para produzir o ângulo de inversão de 180°. Supondo que o software do scanner permita, defina essa potência de referência de 90° e comprimento de pulso para o dimensionamento subsequente do ângulo de inversão.
- Use um único pulso para calço, minimizando a largura total na metade do máximo do espectro de 129Xe (TR ~ 1 s). Se necessário, centralize novamente a frequência após o calço. Registre a metade máxima da largura total.
- Execute a verificação de controle de qualidade 129Xe (Tabela 1 e Figura 4C). Registre os dados de controle de qualidade: SNR, sinal fantasma médio e desvio padrão do ruído.
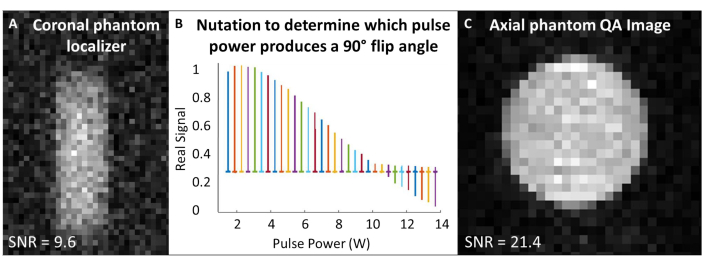
Figura 4: Garantia de qualidade pré-digitalização. (A) Um localizador de simulador coronal GRE 2D de baixa resolução garante que o simulador esteja centralizado no ímã. (B) Um experimento de nutação para definir um pulso de 90 ° mostra um pico nulo no pulso de 180 °. (C) Depois de localizar e calibrar o ângulo de inversão, adquira uma imagem de controle de qualidade 2D GRE de resolução mais alta. Clique aqui para ver uma versão maior desta figura.
| Nome abreviado do protocolo | Descrição da sequência | TR (ms) | TE (ms) | Médias / Repetições | Ângulo de inversão (°) | Tamanho da matriz ou Npts | FOV (mm2) | RF BW (kHz) | Espessura da fatia / laje (mm) | Duração da varredura |
| Pulso único | Aquisição de pulso | 1000 | 1 / 1 | 60 | 2048 | 10 | 1 s | |||
| Localizador fantasma | 2D GRE | 200 | 3.7 | 20 / 1 | 48 | 60 × 32 | 120 × 48 | 3 | 60 | 2 min |
| Calibração de ângulo de inversão | Aquisição de pulso | 7000 | 1 / 65 | 20 | 2048 | 5.12 | 7,5 min | |||
| 129Xe QA | 2D GRE | 5000 | 3.3 | 8 / 1 | 90 | 322 | 322 | 3 | 40 | 21 minutos |
Tabela 1: Parâmetros da sequência de garantia de qualidade da calibração fantasma. TR = tempo de repetição, TE = tempo de eco, Npts = número de pontos, FOV = campo de visão, BW = largura de banda. Clique aqui para baixar esta tabela.
- Polarização do plano (Figura 5A, B).
- Selecione o volume polarizado de 129Xe e o tempo de acumulação: 400 mL em 15 min é ideal para este protocolo (Figura 5), mas pode ser facilmente ajustado para outras aplicações e equipamentos.
- Assumindo um volume morto conhecido dentro do hiperpolarizador (por exemplo, V volume morto = 80 mL), calcule a taxa de fluxo (FXe em SLM) para um volume dispensado Vdesejado, fração de gás 129Xe f e tempo de acumulação tacc:
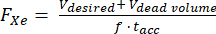 (1)
(1)
NOTA: Embora tempos de produção mais longos normalmente produzam maior polarização, eles podem não ser práticos para imagens in vivo. Use um modelo apropriado para o hiperpolarizador 85,86,87,88 para determinar uma taxa de fluxo que equilibrará o tempo de produção e a polarização. Aqui, foi utilizado o modelo de J. W. Plummer et al.89 (Figura 5A). Isso se aplica a polarizadores de fluxo contínuo e não é aplicável a hiperpolarizadores de fluxo interrompido90. - Polarize o gás de acordo com esses parâmetros, meça a polarização com um dispositivo comercial ou caseiro e compare-a com a polarização prevista para controle de qualidade.
- Meça a perda de polarização durante o transporte. Se a polarização diminuir em uma quantidade suficientemente grande (por exemplo, >10%), construa um estojo de transporte magnético para proteger a polarização durante o transporte. Consulte o Arquivo Suplementar 1: Gerenciando a polarização durante o transporte e a Figura Suplementar 1.
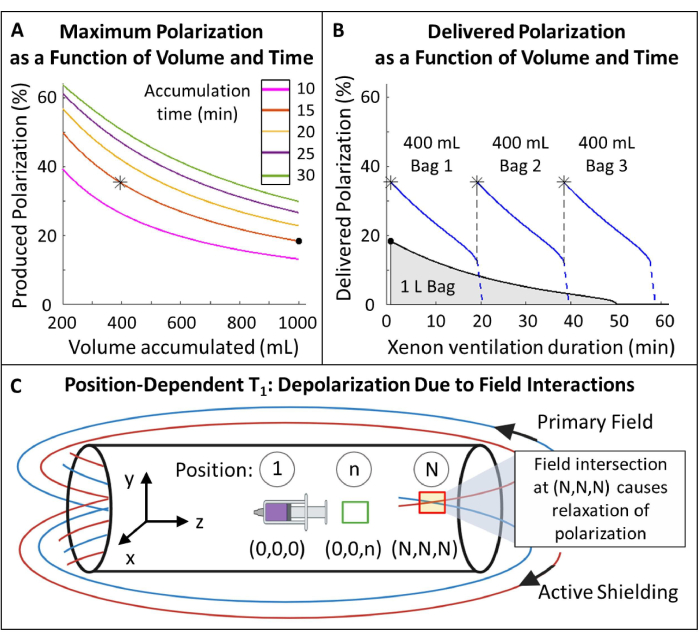
Figura 5: Gerenciamento de polarização. (A) A polarização e o volume produzido são uma função do tempo de acumulação e da taxa de fluxo. Uma bolsa de gás de 400 mL fornece alta polarização inicial (~ 35%) em 20 min. Embora o uso de 1 L de gás possa parecer atraente, ele terá uma polarização inicial mais baixa (~ 20%). (B) Após ~ 15 minutos de ventilação, um lote de 1 litro de HP 129Xe se esgotaria para < 10% de polarização, enquanto 600 mL de gás permaneceriam116. Assim, o uso de vários sacos de 400 mL de 129Xe mantém uma polarização média mais alta. C) Locais onde o campo primário e o campo de blindagem ativo se cruzam (caixa vermelha na posição (N,N,N)) podem causar relaxamento rápido do HP 129Xe. A caracterização do campo de franja do ímã ajuda a identificar zonas seguras onde os reservatórios de HP 129Xe podem ser colocados sem relaxamento rápido (caixa verde na posição (0,0,n)). Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Gerenciando a polarização durante o transporte. Clique aqui para baixar este arquivo.
- Meça o T1 dependente da posição de HP 129Xe dentro do campo de franja (Figura 5C).
- Crie pontos de referência com distâncias e posições conhecidas em relação ao isocentro magnético ao longo das dimensões X, Y e Z. Rotule o isocentro e rotule as outras posições de n a N. O número de posições a serem investigadas dependerá do espaço disponível.
- Hiperpolarize um pequeno volume de 129Xe (~250 mL) e transporte-o para a sala de controle de ressonância magnética. Encha uma seringa grande (50-100 mL) com 129Xe e coloque-a no isocentro dentro do ímã (Posição 1 na Figura 5C). Execute um pulso de ângulo de inversão de ~ 1 ° para medir o sinal.
- Deixe a seringa na posição por ~ 10 min e, em seguida, adquira outro espectro. Meça novamente o sinal a cada 10 minutos até que o sinal tenha decaído pelo menos 1 T1 (ou seja, o sinal decaiu para ~ 1/3 de seu valor inicial).
- Inicie um novo experimento T1 com uma nova seringa de 129Xe repetindo a Etapa 1.4.2.
- Mova a seringa para uma nova posição (por exemplo, Posição n na Figura 5C) e deixe-a lá por 10 min. Retorne a seringa ao isocentro para adquirir um espectro de ângulo de inversão adicional de ~ 1 °.
- Repita este processo: mova a seringa para a posição n, aguarde 10 min, coloque-a de volta no isocentro e meça novamente o sinal até que decaia pelo menos 1 T1.
- Repita as etapas 1.4.4 a 1.4.6 para as posições de referência restantes que cobrem as direções X, Y e Z.
- O sinal inicial (S0) decairá monoexponencialmente em n pulsos de RF com um ângulo de inversão θ. Ajuste o sinal (S) em função do tempo (t) no campo marginal para calcular o T1 em cada posição:
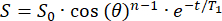 (2)
(2) - Identifique uma posição com T1 suficiente (>20 min) para a colocação do reservatório de 129Xe.
- Crie cânulas de intubação sem metal (Figura 6).
- Obtenha dois cateteres veianos de politetrafluoretileno (PTFE) com conectores Luer. Descarte as agulhas em um recipiente para descarte de objetos cortantes.
NOTA: Para camundongos >25 g, use cateteres 18 G e 20 G. Para animais menores, use cateteres 20 G e 22 G. - Corte o conector Luer dos cateteres. Alimente o cateter menor na extremidade superior do cateter maior para criar uma cânula mais acentuada e mais longa. Corte a cânula composta em ~ 4.6 cm com uma extremidade chanfrada, não incluindo a base Luer (Figura 6A, B).
- Corte a extremidade mais larga de uma ponta de pipeta de 200 μL em um comprimento de ~ 2.6 cm ( Figura 6C ).
- Cubra o interior da ponta da pipeta com lubrificante geral de desmoldagem. Use outra ponta de pipeta inserida no interior para distribuir finamente o lubrificante. Encha a ponta da pipeta com pasta de vulcanização de silicone acetóxi epóxi (Figura 6D, E).
- Conecte a cânula com um fio de 22 G que se estende para fora de ambas as extremidades. Passe o tubo da cânula através de silicone na ponta da pipeta. Estenda o tubo ~7 mm além da extremidade da ponta da pipeta (Figura 6F, G).
- Deslize o tubo da cânula no lado mais largo da ponta da pipeta através de um conector Luer de deslizamento macho de plástico, colando as peças com o epóxi. Tubulação de acabamento que se estende além do conector Luer (Figura 6H).
- Aguarde a secagem do epóxi (>24 h) e, em seguida, remova cuidadosamente a cânula de intubação de silicone do molde da ponta da pipeta. Remova o fio da cânula, certificando-se de que o tubo não tenha sido ocluído (Figura 6I).
- Para fazer uma alça para facilitar a intubação, conecte a tubulação (1/16" ou 1/8") a um conector Luer fêmea. Quando estiver pronto para a intubação, conecte este conector Luer fêmea à cânula de intubação Luer macho. Esta peça pode ser facilmente destacada após a intubação (Figura 6J).
- Higienize antes de cada uso em animais: limpe a parte externa da cânula com álcool 70%. Limpe o fio de 20 G com desinfetante e, em seguida, passe o fio pela cânula para higienizar o interior e garantir que não haja bloqueios.
- Obtenha dois cateteres veianos de politetrafluoretileno (PTFE) com conectores Luer. Descarte as agulhas em um recipiente para descarte de objetos cortantes.
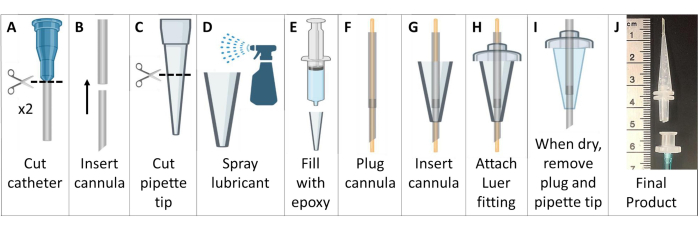
Figura 6: Criação de cânulas de intubação de mouse compatíveis com ressonância magnética e HP 129Xe. Essas cânulas são construídas com cateteres venosos, pontas de pipeta e selante de silicone, conforme descrito na Etapa 1.5. Clique aqui para ver uma versão maior desta figura.
2. Coleta diária de dados
NOTA: Consulte o Arquivo Suplementar 2: Lista de verificação de controle de qualidade de varredura pré-clínica.
Arquivo Suplementar 2: Lista de verificação de controle de qualidade de varredura pré-clínica. Clique aqui para baixar este arquivo.
- Controle diário completo de qualidade do scanner e ventilador de configuração (Figura 4).
- Com fantasmas, execute protocolos de controle de qualidade no scanner (consulte a Tabela 1 para obter os parâmetros de verificação de controle de qualidade e a Etapa 1.2 para obter as etapas diárias de controle de qualidade).
- Calibrar o ventilador de acordo com o método de J. Nouls et al.38. Consulte o Arquivo Suplementar 3: Calibração do ventilador, Figura Suplementar 2 e Figura Suplementar 3.
- Defina as configurações do ventilador para imagens no final da inspiração (Tabela 2). Coloque a cama do animal no rack do scanner e o módulo de suporte de vida (ou seja, peças do ventilador mecânico) na mesa ao lado do scanner.
- Ative o sistema de aquecimento animal específico do local. Defina um aquecedor para 35,5 - 40 °C, ligue o ar circulante e coloque a mangueira de ar a ~5" de onde a cabeça do animal descansará para pré-aquecer o orifício do scanner.
| Configuração de ventilação | Recomendação para HP 129Xe MRI | Anotações |
| Volume corrente (TV) | 8–10 mL/kg de peso corporal ideal | TV moderada; TV baixa requer BR mais alto, o que pode causar artefatos de movimento nas imagens |
| Pressão expiratória final positiva (PEEP) | 2–6 cmH2O | |
| Frequência respiratória (BR) | 80–120 br/min | |
| Manobras de recrutamento (RMs) | ~ 35 cmH2O por 6 s a cada 5 min | |
| Duração da ventilação; Posição | < 6 h; supino | Supino para ver melhor o movimento do peito |
| Fração inspirada de oxigénio(FIO2) | 0.3–0.5 | Previna a hipóxia em camundongos anestesiados |
| Relação inspiratória/expiratória (I:E) | 1:2–1:4 | |
| Duração do ciclo inspiratório para total | 0.2–0.4 | |
| Ventilação minuto | ≥0,57 mL·g-1·min-1 | |
| Nossos padrões: | ||
| BR = 80 br/min, duração da inspiração = 200 ms, FIO2 = 0,3 | ||
| Imagem no final da inspiração: apneia = 200 ms, atraso do gatilho = 200 ms após o início da inspiração | ||
| Exames de imagem durante a apneia: apneia = 250 ms, atraso do disparo = 250 ms após o início da inspiração | ||
| Imagem no final da expiração: apneia = 200 ms, atraso do disparo = 650 ms após o início da inspiração | ||
Tabela 2: Configurações recomendadas do ventilador para imagens 129Xe. Os parâmetros podem ser ajustados para objetivos de estudo específicos e condições experimentais 117,118,119,120,121,122,123,124. Clique aqui para baixar esta tabela.
Arquivo Suplementar 3: Calibração do ventilador. Clique aqui para baixar este arquivo.
- Sedar e intubar o animal.
- Ligue a incubadora a 27.7 °C e/ou a almofada de aquecimento elétrico a 37.7 °C. Meça e registre a massa corporal do animal. Calcule a dosagem de sedativo com base na massa. Consulte a Tabela 3 para um regime posológico típico.
- Injete o sedativo por via intraperitoneal. Anote o tempo de injeção e defina o cronômetro para a próxima dose de sedativo.
NOTA: Conclua as etapas restantes na Seção 2 (Coleta diária de dados) o mais rápido possível para minimizar o tempo sob sedação e o risco de overdose. - Aplique lubrificante ocular nos olhos do animal e coloque-o em uma gaiola na almofada de aquecimento ou dentro de uma incubadora para evitar hipotermia.
- Confirme se o animal está totalmente sedado realizando um teste de beliscão do dedo do pé 10-15 min após a injeção de sedativo68. Intubar seguindo os procedimentos descritos em Das et al.69.
NOTA: O artigo de Das et al.69 é acompanhado por uma demonstração abrangente em vídeo da técnica. As etapas são as seguintes: - Pendure o animal em decúbito dorsal pelos dentes em uma tábua inclinada. Use um abaixador de língua de roedor para puxar a língua.
- Para garantir que as cordas vocais estejam visíveis, forneça luz branca por meio de um cabo de fibra óptica dentro da cânula de intubação ou uma luz brilhante colocada na parte externa da garganta. Insira a cânula a menos de 5 mm após as cordas vocais.
- Certifique-se de que a cânula esteja na traqueia, não no esôfago, conectando-a a um pedaço de tubo com uma pequena gota de água dentro. Se a gota de água se mover no ritmo da respiração do animal, o posicionamento provavelmente está correto.
| Agente | Dose | Rota | Duração | Comentários | |||
| Agentes inalatórios | |||||||
| Isoflurano | Indução: 4% a 5% Manutenção: 1%– 3% ou para efeito | Inalado | Durante o fluxo contínuo | • Requer o uso de vaporizador calibrado | |||
| Agentes injetáveis | |||||||
| Recomendado: Cetamina + xilazina + acepromazina | 90 + 9 + 3 mg/kg | Intraperitoneal | 20–60 min | • Cria suscetibilidade à hipotermia | |||
| • Para doses repetidas, recomenda-se mudar para uma mistura de cetamina + xilazina para evitar sobredosagem | |||||||
| • Provoca tremores à medida que passa. Para imagens, siga rigorosamente o cronograma de dosagem | |||||||
| • Pode causar bradicardia | |||||||
| Cetamina + xilazina | 90 + 9 mg/kg | Intraperitoneal | 20–40 min | • Veja acima (Cetamina + xilazina + acepromazina) | |||
| Pentobarbital | 50 - 70 mg/kg | Intraperitoneal | 20–60 min | • Deprime a frequência respiratória e o movimento | |||
| • A despesa pode ser proibitiva | |||||||
| • O grau farmacêutico pode não estar disponível | |||||||
| Isenção de responsabilidade: estas são diretrizes gerais. Consulte um veterinário para obter mais informações antes da implementação. | |||||||
Tabela 3: Formulário anestésico comum para camundongos. Clique aqui para baixar esta tabela.
- Ventilar o animal (Tabela 2).
- Conecte o animal ao ventilador através do conector Luer na cânula de intubação. Monitore o movimento diafragmático e a pressão inspiratória de pico (~ 10-12 cm H2O para um volume corrente de 10 mL / kg de peso corporal). Se a pressão ou o movimento respiratório forem anormais, ajuste cuidadosamente o ângulo do pescoço e a profundidade da cânula conforme necessário.
- Certifique-se de que a cânula de intubação esteja hermética realizando uma manobra de recrutamento: evite a expiração (por exemplo, com um dedo, bloqueie a porta de expiração) de forma que o animal inspire várias vezes sem expirar.
NOTA: Se a pressão das vias aéreas atingir 35 cmH2O pico da pressão inspiratória em ~6 s, a vedação das vias aéreas está suficientemente apertada. Caso contrário, consulte a discussão para solução de problemas. - Permita que a expiração normal seja retomada. Realize manobras de recrutamento entre os exames e a cada ~5 minutos quando não estiver examinando para manter a complacência pulmonar e prevenir atelectasias. Conecte a válvula PEEP à linha de expiração. Defina a PEEP para 4 cmH2O. Observe o pico de pressão inspiratória aumentar nessa quantidade.
- Após a intubação bem-sucedida, planeje e inicialize a produção de HP 129Xe em torno do cronograma de redosagem de sedativos para evitar que o animal acorde durante um exame. Monitore a temperatura corporal durante todo o experimento.
- Aquisição de dados: Colete imagens de ventilação.
NOTA: As etapas de aquisição de dados 2.4, 2.5 e 2.6 podem ser feitas em qualquer ordem- Defina o ventilador de acordo com a Tabela 2 para imagens no final da inspiração.
- Carregue os seguintes protocolos de configuração: localizador de prótons para animais, pulso único para centralizar a frequência do gás nos pulmões do camundongo e localizador de animais 129Xe. Consulte a Tabela 4 para obter os parâmetros de varredura.
- Posicione o animal no isocentro e confirme se a cavidade torácica está no centro do campo de visão com localização de prótons. Se estiver usando bobinas de frequência única, substitua a bobina de prótons por uma bobina de RF sintonizada em 129Xe.
- Registre a polarização de 129Xe e transporte-a para o scanner de ressonância magnética. Consulte o Arquivo Suplementar 4: Lista de verificação de controle de qualidade da polarização de xenônio.
- Coloque um saco de 129Xe dentro do recipiente do ventilador e lacre. Conecte o recipiente alinhado com o ventilador e deixe o recipiente pressurizar (3 - 6 psig).
- Inicie a ventilação mecânica 129Xe. Cada vez que a ventilação 129Xe for ativada, permita que o animal complete ~ 5 respirações antes de iniciar uma varredura para transformar a capacidade residual funcional dos pulmões.
NOTA: Mude para a mistura N2/O2 entre 129varreduras de Xe para conservar o gás hiperpolarizado. - Usando um único pulso, ajuste a frequência de trabalho para corresponder à frequência de ressonância in vivo do gasoso 129Xe (~ 83,07 MHz a 7 T). Copie a frequência para todas as varreduras Xe subsequentes da fase gasosa 129. Execute a localização de 129Xe para confirmar que os pulmões estão no isocentro.
- Carregue e execute a sequência de ventilação radial 129Xe. Monitore a pressão inspiratória de pico.
NOTA: Se o gás 129Xe acabar antes do término do protocolo, o pico de pressão inspiratória diminuirá rapidamente. Um saco de 400 mL de 129Xe pode ventilar um camundongo de 30 g por ~ 24 min quando ventilado com 70% de 129Xe a 80 respirações por minuto com um volume corrente de 10 mL / kg de peso corporal ideal. - Quando a varredura terminar, mude para ventilação com a mistura N2/O2 e remova o saco vazio de 129Xe.
- Para imagens no final da expiração, altere a duração da apneia e o atraso do disparo de acordo com a Tabela 2 e repita as etapas 2.4.2 a 2.4.9.
- Exporte os dados brutos do scanner.
| Nome abreviado do protocolo | Descrição da sequência | Gatilho | TR (ms) | TE (ms) | Repetições | Ângulo de inversão (°) | Tamanho da matriz ou Npts | FOV (mm2) | RF BW (kHz) | Espessura da fatia/laje (mm) | Duração da varredura |
| Pulso único | Aquisição de pulso (fase gasosa) | Opcional | 1000 | 1 | 60 | 2048 | 10 | 1 s | |||
| Localizador de animais | 2D GRE | Sim | 50 | 1.7 | 1 | 60 | 642 | 322 | 3 | 25 | 60 s |
| Ventilação radial | Radial multi-eco 3D | Sim | 20 | Ver legenda | 1 | 30 | 613 | 223 | 32.05 | 30 | 16 min |
| Pulso único de fase dissolvida | Aquisição de pulso (fase dissolvida) | Não | 80 | 1 | 90 | 512 | 10.35 | 80 ms | |||
| Especificação dinâmica de fase dissolvida. | Aquisição de pulso (fase dissolvida) | Não | 50 | 1000 | 90 | 512 | 10.5 | 50 s | |||
| Ponderada por difusão | 2D GRE | Sim | 12.2 | 8.1 | 4 | 45 | 642 | 322 | 3 | 1.5 | 18 min |
Tabela 4: Parâmetros de sequência in vivo . A sequência de ventilação radial multi-eco 3D descrita anteriormente39 adquire imagens em 6 tempos de eco. Os resultados são mostrados para a primeira imagem de eco (TE = 1,12 ms, Figura 7). Clique aqui para baixar esta tabela.
Arquivo Suplementar 4: Lista de verificação de controle de qualidade da polarização de xenônio. Clique aqui para baixar este arquivo.
- Aquisição de dados: Execute espectroscopia dinâmica de fase dissolvida.
- Defina o ventilador de acordo com a Tabela 2 para imagens durante a apneia. Defina o BR para 100 respirações/min. Prepare-se para um novo saco de 129Xe como nas etapas 2.4.2 a 2.4.5.
- Inicie a ventilação mecânica 129Xe. Carregue e execute um único pulso para ajustar a frequência de trabalho para corresponder à frequência dissolvida (~ 83.084 MHz a 7 T). Copie a frequência de trabalho para a espectroscopia dinâmica de fase dissolvida.
NOTA: Este será um pico único em camundongos com hemoglobina54 do tipo selvagem. - Carregue e execute a sequência de espectroscopia dinâmica centrada na frequência dissolvida nos pulmões dos animais. Quando a varredura terminar, mude para ventilação com a mistura N2/O2 e remova o saco vazio de 129Xe. Exporte os dados brutos do scanner.
- Aquisição de dados: Colete imagens ponderadas por difusão.
- Defina o ventilador de acordo com a Tabela 2 para imagens durante a apneia. Prepare-se para um novo saco de 129Xe como nas etapas 2.4.2 a 2.4.7.
- Carregue e execute a sequência ponderada por difusão. Quando a varredura terminar, mude para ventilação com a mistura N2/O2 e remova o saco vazio de 129Xe. Exporte os dados brutos do scanner.
3. Concluindo o experimento
- Recuperar animal.
- Puxe a cânula de intubação diretamente para fora da boca do animal. Se o animal não começar a respirar imediatamente espontaneamente, administre leves compressões torácicas. Se disponível, administre um leve fluxo de oxigênio de grau médico perto do rosto do animal para apoiar a recuperação da sedação.
- Uma vez que o animal esteja respirando por conta própria e se o animal foi sedado por >2 h, administre 0,5 - 1 mL de solução salina normal por via subcutânea para evitar a desidratação.
- Devolva o animal a uma gaiola sozinho. Coloque a gaiola em uma incubadora ou em uma almofada de aquecimento.
NOTA: Animais sedados são vulneráveis ao canibalismo e não podem ser colocados em uma gaiola com companheiros de gaiola até que estejam totalmente recuperados (ou seja, deambulando de forma independente). Animais sedados não conseguem regular a temperatura corporal. Use as costas da mão para sentir a temperatura do animal a cada poucos minutos. - Monitore o animal de perto até que seu reflexo de endireitamento retorne (ou seja, ele pode virar independentemente de uma posição supina para uma posição prona).
- Remova o animal do suporte térmico assim que ele puder deambular de forma independente. Devolva o animal a uma gaiola com seus companheiros de gaiola.
NOTA: se o animal não tiver companheiros de gaiola, é mais suscetível à hipotermia induzida por sedação. Forneça ao animal roupa de cama extra e, se disponível, deixe-o em uma incubadora durante a noite. - Registre o peso do animal uma vez por semana durante 2 semanas para monitorar sua saúde.
NOTA: Se o animal sofreu uma lesão na boca ou no esôfago devido à intubação, ele pode parar de comer. Se o animal perder >20% do seu peso corporal inicial, consulte um veterinário sobre a eutanásia.
- Analise as imagens de ventilação (Figura 7).
- Carregue dados brutos em uma plataforma de programação. Baixe a estrutura de reconstrução de código aberto para imagens não cartesianas91.
- Reconstrua imagens de acordo com as instruções da estrutura de software livre. Normalize o primeiro ponto em cada projeção radial39.
- Segmente o parênquima pulmonar nas imagens, incluindo voxels com sinal 129Xe baixo ou inexistente. Não inclua grandes vias aéreas. Segmente o ruído de fundo na imagem, excluindo pulmões, vias aéreas e artefatos de imagem.
NOTA: A imagem do localizador de prótons pode ajudar a determinar os limites do parênquima. - Calcule a SNR usando a fórmula:
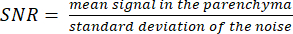 (3)
(3) - Quantifique a ventilação defeituosa.
NOTA: Vários métodos foram propostos para quantificar a ventilação prejudicada em modelos de pequenos animais. Os métodos de análise permanecem uma área aberta de investigação, mas as abordagens facilmente implementadas incluem: (i) Segmentação manual semiquantitativa92, (ii) Abordagem de histograma usando o sinal da traqueia para normalizar o sinal do parênquima47 e (iii) Segmentar o volume pulmonar total (TLV) e definir um limiar de sinal (por exemplo, <60% da média do pulmão total) para dividir os pulmões em volume defeituoso e volume pulmonar ventilado (VV). Quantificar VDP93,94 de acordo com:
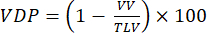 (4)
(4)
- Analise a espectroscopia dinâmica de fase dissolvida (Figura 8).
- Carregue dados brutos em uma plataforma de programação. Execute uma transformada rápida de Fourier e faseie os espectros (a fase manual simultânea de ordem zero dos espectros é suficiente para esta aplicação).
- Calcule os dados padrão de ressonância magnética nuclear (RMN) 95,96: SNR, largura total metade máxima, área integrada, deslocamento químico e fase de ambos os picos.
- A partir dos dados de magnitude, divida a amplitude do sinal do espectro dissolvido pela do espectro de gás para cada repetição para encontrar a razão entre o gás dissolvido e o gás ao longo do tempo.
- Analise as imagens ponderadas em difusão (Figura 9).
- Carregue dados brutos em uma plataforma de programação. Segmente o parênquima pulmonar da imagem b0 como na Etapa 3.2.3. Calcule o SNR para cada imagem de valor b.
- Calcule a relação sinal-valor-ruído, SVNR0, dividindo o sinal em cada voxel da imagem b0 pelo desvio padrão do ruído da imagem. Exclua voxels com SVNR0 < 2,5 vezes o ruído da imagem97.
NOTA: OSVNR 0 é uma métrica de voxel individual, enquanto o SNR parenquimatoso é uma métrica de pulmão inteiro. - Calcular ADC ajustando o decaimento do sinal sobre os valores b (bi) de acordo com a Equação 598,99:
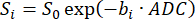 (5)
(5)
Resultados
Imagens de ventilação
Se os procedimentos de preparação e ventilação dos animais forem implementados adequadamente, a imagem radial 3D pode capturar com sucesso os padrões de ventilação quando a aquisição de dados é realizada na inspiração ou na expiração (Figura 7). Embora essas imagens sejam coletadas em muitas respirações, o método descrito aqui é semelhante ao método de imagem de respiraç...
Discussão
A ressonância magnética hiperpolarizada de 129Xe está emergindo como uma técnica sofisticada e poderosa para estudar a microestrutura e a função pulmonar em modelos de pequenos animais. Este protocolo destina-se a orientar a preparação inicial do local e descrever os procedimentos experimentais necessários para quantificar a ventilação, difusão e troca gasosa em pulmões de camundongos com HP 129Xe. Os principais pré-requisitos para experimentos incluem...
Divulgações
Peter Niedbalski é consultor da Polarean Imaging, Plc.
Agradecimentos
Os autores estendem sua sincera gratidão a Jerry Dalke por ser uma luz orientadora na construção de ventiladores. Gostaríamos de agradecer a Carter McMaster por fabricar o gás HP 129Xe. Também gostaríamos de agradecer ao Dr. Matthew Willmering e ao Dr. Juan Parra-Robles por suas discussões científicas instigantes. Figuras criadas com BioRender.com. Este trabalho foi financiado pelos Institutos Nacionais de Saúde (Grant Nos: NHLBI R01HL143011, R01HL151588)
Materiais
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | fisher scientific | Catalog No.14-955-464 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 |
| 10 mL graduated cylinder | Cole-Parmer | UX-34502-69 | https://www.coleparmer.com/i/cole-parmer-essentials-graduated-cylinder-glass-hexagonal-base-10-ml-2-pk/3450269?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7h3do -ssjascARuVviKd7V7kC5ztdIB6 _70DnMr-K3qk9RKeJ7-IrhoCeT 0QAvD_BwE |
| 18 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX1832CA | https://www.shopmedvet.com/product/iv-catheter-18-x-1-25inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 4oTvZkAgWQCda6ocVtQlulVrG 2536FNbu5soMVSFN8xK_g1Uh pXIRoCGwoQAvD_BwE |
| 20 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2051CA | https://www.shopmedvet.com/product/iv-catheter-20-x-2inch?r=GSS17&p=GSS17&utm_source =google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 87ggCkgToD_XF_UgpQBTpmN dgSNfCml6TkDKlW8k27Dq_daR itPuhoCnBQQAvD_BwE |
| 22 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2225CA | https://www.shopmedvet.com/product/iv-catheter-22-x-1inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid =CjwKCAiA0bWvBhBjEiwAtEso W9IM6mpee6m7e-lBfR8dZhSN KYbMUs7qgEU4gYCRTW_rJAs W_lGkthoCm30QAvD_BwE |
| 400 mL tedlar bags | Jensen Inert Products | GST-001S-3507TJC | NA |
| 60 mL syringe | fisher scientific | Catalog No.14-955-461 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955461 |
| 70% alcohol | Cole-Parmer | UX-80024-34 | https://www.coleparmer.com/i/labchem-isopropyl-alcohol-70-v-v-500-ml/8002434?PubID=UX&persist=true&ip= no&gad_source=1&gclid=CjwKC AiA6KWvBhAREiwAFPZM7gGh p8g7MBHBBKadaRCAwfEMgV gna5fhYRsuXIuqoqOiToCC4fem nhoCGMEQAvD_BwE |
| Dewar for liquid nitrogen | Terra Universal | 4LDB | https://www.laboratory-equipment.com/tw-4ldb-liquid-nitrogen-dewar-ic-biomedical.html?srsltid=AfmBOooxwMtOA1Z2TweR P8V5Iy5EvYT3alZuzoiY 3UF3Ib9RgFnDxVTfWP0 |
| Eye lubricant | Refresh | REFRESH P.M. | https://www.refreshbrand.com/Products/refresh-pm |
| Fiber optic light | AmScope | HL250-AY | https://amscope.com/products/hl250-ay?tw_source=google &tw_adid=&tw_campaign= 16705014684&gad_source= 1&gclid=CjwKCAiA6KWvBhA REiwAFPZM7p-DpyvHJaGxR pAD1385hzGf1oPdKHHLFDR Sp8yrtxry11SNJeJnKxoCtAoQ AvD_BwE |
| Gaussmeter | Apex Magnets | GMHT201 | https://www.apexmagnets.com/magnets/accessories/ht-digital-gaussmeter-with-peak-hold-can-display-gauss-or-tesla |
| Glass vessel (phantom) | Ace Glass | 8648-24 | https://aceglass.com/results.php?t=8648-24&t=8648-24 |
| Heating pad | Office Depot | 9206211 | Pure Enrichment PureRelief Express Designer Series Heating Pad 12 x 15 Palm Aqua - Office Depot |
| Hyperpolarizer | Polarean | 9820 | https://polarean.com/xenon-mri-platform/ |
| Intubation board | Hallowell EMC | 000A3467 | https://hallowell.com/product/rodent-tilting-workstand/ |
| Intubation supplies | Parts list published elsewhere | NA | https://app.jove.com/t/50318/a-simple-method-of-mouse-lung-intubation |
| Isotopically enriched xenon cylinder | Linde Isotopes | XE-129(1%)N2(10%)HE CGMP 302SZ | NA |
| Liquid nitrogen | Linde | NI LC160-22 | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_liquid _lc160_22_psi_ni_lc160_22 /ni-lc160-22?cat_id=shop&node=b89 |
| Male slip luer | Cole-Parmer | UX-21943-27 | https://www.coleparmer.com/i/diba-omnifit-t-series-solvent-waste-cap-adapter-polypropylene-male-luer-slip-x-1-16-id-hose-barb-5-pk/2194327 |
| Manometer | Grainger | 3T294 | https://www.grainger.com/product/3T294?gucid=N:N:PS: Paid:GGL:CSM-2295:4P7A1P: 20501231&gad_source=1&gclid =CjwKCAiAi6uvBhADEiwAWiyR dltxrPJmmcm0bFiYLuPrB25HV QFdEfKMBqvgJBNdQUs3DZ7b TLr8CRoCanAQAvD_BwE& gclsrc=aw.ds |
| Minivent ventilator | harvard apparatus | 73-0044 | https://www.harvardapparatus.com/minivent-ventilator-for-mice-single-animal-volume-controlled-ventilators.html |
| Mouse ear puncher | fisher scientific | 13-812-201 | https://www.fishersci.com/shop/products/fisherbrand-animal-ear-tag-punch/13812201 |
| Mouse tongue depressor | Medical Tools | VRI-617 | https://medical-tools.com/shop/rodent-tongue-depressor.html |
| Mouse weight scale | Cole-Parmer | UX-11712-12 | https://www.coleparmer.com/i/adam-equipment-cqt2000-core-portable-balance-2000g-x-1g-220-v/1171212?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7iYnAG5Ilc Z5DZWrdJ6wcLDZSCSfNJHOH m2PQOpyyWe0TjFa75R3tBoCjB sQAvD_BwE |
| MRI scanner | Bruker | 7T Biospec horizontal system | https://www.bruker.com/de/products-and-solutions/preclinical-imaging/mri/biospec.html |
| Multimeter | Home Depot | 1007898529 | https://www.homedepot.com/p/Klein-Tools-600-Volt-Digital-Multi-Meter-Manual-Ranging-MM325/320822947 |
| Natural abundance xenon | Linde Isotopes | UN 2036 | NA |
| Needle | fisher scientific | 305194 | https://www.fishersci.com/shop/products/bd-general-use-precisionglide-hypodermic-needles-20/148266C?keyword=true |
| Needle safe syringe holder | fisher scientific | NC2703873 | https://www.fishersci.com/shop/products/ndlsafe-ii-syr-uncap-deca/NC2703873#?keyword=needlesafe |
| Nitrogen cylinder | Linde | NI M-K | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_nf_k/ni-m-k?cat_id=shop&node=b89 |
| Oxygen cylinder | Linde | OX M-K | https://www.lindedirect.com/store/product-detail/oxygen_o2_oxygen_usp_k/ox-m-k?cat_id=shop&node=b90 |
| Oxygen sensor | Apogee instruments | MO-200 | https://www.apogeeinstruments.com/mo-200-oxygen-sensor-with-handheld-meter/ |
| Oxygen sensor inline flowhead | Apogee instruments | AO-002 | https://www.apogeeinstruments.com/ao-002-oxygen-meter-sensor-flow-through-head/ |
| PEEP valve | Hallowell EMC | 000A6556A | https://hallowell.com/product/adjustable-peep-valve-with-exhaust-port-range-5-20cm-disposable/ |
| Pipette tips | fisher scientific | Catalog No.02-707-108 | Fisherbrand Stack-Rack Space-Saver Tips: 101-1000 L Standard; Blue; Volume: | Fisher Scientific |
| Plunger valve | Ace glass | 8648-20 | https://www.aceglass.com/results.php?t=8648 |
| Preclinical coil | Doty scientific | custom built | https://dotynmr.com/products/bmax-xy-low-e/ |
| Pressure regulators | Cole-Parmer | UX-98202-11 | https://www.coleparmer.com/i/cole-parmer-single-stage-regulator-1500-scfh-capacity-346-cga-fitting/9820211?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7pruR xCAiaj52nA_8Y1nveQZRsD6B f0QO65o2DKFYqRoz0PopSkX QxoCxqcQAvD_BwE |
| Pressure-drop ventilator | Parts list published elsewhere | NA | https://sites.duke.edu/driehuyslab/resources/ |
| PVC pipe for phantom | Home Depot | 193682 | https://www.homedepot.com/p/IPEX-1-2-in-x-10-ft-White-PVC-SCH-40-Potable-Pressure-Water-Pipe-30-05010HD/319692959 |
| SAI animal heating system | SAII | Model 1030 | https://i4sa.com/product/model-1030-monitoring-gating-system/ |
| Saline | Farris Laboratories Inc. | 0409488820-1 | https://www.farrislabs.com/products/bacteriostatic-sodium-chloride-0-9-30ml-bottle?variant=42807174824167¤cy =USD&utm_medium=product_ sync&utm_source=google&utm_ content=sag_organic&utm_ campaign=sag_organic&utm_ campaign=gs-2021-09-24&utm _source=google&utm_medium =smart_campaign&gad_source =1&gclid=CjwKCAiA6KWvBh AREiwAFPZM7oS3-hFDETO_2f6OWOoKyBMb WuDuWqYxdWRYUWEkY M2Py73VfGzVtRoC2FQQAvD_BwE |
| Sharps container | fisher scientific | 22-730-455 | https://www.fishersci.com/shop/products/sharps-container-47/p-7250579#?keyword=needle%20safe |
| Silicone epoxy | Grainger | 3KMY7 | https://www.grainger.com/product/3KMY7?gucid=N:N:PS:Paid:GGL:CSM- 2295:4P7A1P:20501231&gad_ source=1&gclid=CjwKCAiA6KW vBhAREiwAFPZM7voahkm8tda t1Euql1A8DFhC6AZVJ0wXzCE PfE6iUzrIJXV-Hl8o4xoCQLYQA vD_BwE&gclsrc=aw.ds |
| Silicone mold release lubricant | Grainger | 19MW95 | https://www.grainger.com/product/CRC-Mold-Release-Agent-16-oz-19MW95 |
| Spirometer | ADInstruments | FE141 | https://www.adinstruments.com/products/spirometer |
| Spirometer - mouse flowhead | ADInstruments | MLT1L | https://www.adinstruments.com/products/respiratory-flow-heads |
| Tubing - 1/4 OD | Clippard | URH1-0402-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Tubing - 1/8 OD | Clippard | URH1-0804-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Vacuum pump | Cole-Parmer | UX-60062-11 | https://www.coleparmer.com/i/environmental-express-diaphragm-pump-high-volume-120v/6006211?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7uFGwmW pRelHNFgZVvJJV09vDUVyfyG HoKeZTiFNIiVTe-05IpJJPxoCO PoQAvD_BwE |
| Wire - 18 gauge | Digikey | 2328-18H240-ND | https://www.digikey.com/en/products/detail/remington-industries/18H240/15202027?s=N4 IgjCBcoOwBxVAYygMwIYBsDOB TANCAPZQDa4YATPAGwgC6h ADgC5QgDKLATgJYB2AcxAB fQmAAMAFkqIQKSBhwFiZEA GZNATi0SGzNpE48BwsSErqw 6uQqV5CJSOQCsMF%2Bq11 GIVuy58QqLmss4gALbogvy4L AAEAO683LgMIkA |
| Xenon polarization measurement station | Polarean | NA | https://polarean.com/xenon-mri-platform/ |
Referências
- World Health Organization. Global health estimates 2020: Deaths by cause, age, sex, by country and by region, 2000-2019. World Health Organization. , (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for cystic fibrosis with a single Phe508del allele. N Engl J Med. 381 (19), 1809-1819 (2019).
- Taylor-Cousar, J. L., et al. Tezacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del. N Engl J Med. 377 (21), 2013-2023 (2017).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Yong, K. S. M., Her, Z., Chen, Q. Humanized mice as unique tools for human-specific studies. Arch Immunol Ther Exp (Warsz. 66 (4), 245-266 (2018).
- Li, H., Auwerx, J. Mouse systems genetics as a prelude to precision medicine. Trends Genet. 36 (4), 259-272 (2020).
- Eppig, J. T., Motenko, H., Richardson, J. E., Richards-Smith, B., Smith, C. L. The International Mouse Strain Resource (IMSR): cataloging worldwide mouse and ES cell line resources. Mamm Genome. 26 (9-10), 448-455 (2015).
- Vedi, M., et al. 2022 updates to the rat genome database: A Findable, Accessible, Interoperable, and Reusable (FAIR) resource. Genetics. 224 (1), 042 (2023).
- Ghorani, V., Boskabady, M. H., Khazdair, M. R., Kianmeher, M. Experimental animal models for COPD: a methodological review. Tob Induc Dis. 15, 25 (2017).
- Semaniakou, A., Croll, R. P., Chappe, V. Animal models in the pathophysiology of cystic fibrosis. Front Pharmacol. 9, 1475 (2018).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Jenkins, R. G., et al. An official American thoracic society workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Dignam, J. P., Scott, T. E., Kemp-Harper, B. K., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2022).
- Woodrow, J. S., Sheats, M. K., Cooper, B., Bayless, R. Asthma: The use of animal models and their translational utility. Cells. 12 (7), 1091 (2023).
- Van de Velde, G., et al. Longitudinal in vivo microcomputed tomography of mouse lungs: No evidence for radiotoxicity. Am J Physiol Lung Cell Mol Physiol. 309 (3), L271-L279 (2015).
- Mata, J. F., et al. Evaluation of emphysema severity and progression in a rabbit model: comparison of hyperpolarized 3He and 129Xe diffusion MRI with lung morphometry. J Appl Physiol (1985). 102 (1985), 1273-1280 (2007).
- Boudreau, M., Xu, X., Santyr, G. E. Measurement of 129Xe gas apparent diffusion coefficient anisotropy in an elastase-instilled rat model of emphysema. Magn Reson Med. 69 (1), 211-220 (2013).
- Cleveland, Z. I., et al. 3D MRI of impaired hyperpolarized 129Xe uptake in a rat model of pulmonary fibrosis. NMR Biomed. 27 (12), 1502-1514 (2014).
- Kimura, A., et al. Inflammation during lung cancer progression and ethyl pyruvate treatment observed by pulmonary functional hyperpolarized 129Xe MRI in mice. Contrast Media Mol Imaging. 2021, 9918702 (2021).
- Kimura, A., et al. Treatment response of ethyl pyruvate in a mouse model of chronic obstructive pulmonary disease studied by hyperpolarized 129Xe MRI. Magn Reson Med. 78 (2), 721-729 (2017).
- Ouriadov, A., et al. Early stage radiation-induced lung injury detected using hyperpolarized 129Xe Morphometry: Proof-of-concept demonstration in a rat model. Magn Reson Med. 75 (6), 2421-2431 (2016).
- Willmering, M. M., et al. Improved pulmonary 129Xe ventilation imaging via 3D-spiral UTE MRI. Magn Reson Med. 84 (1), 312-320 (2020).
- Kaushik, S. S., et al. Single-breath clinical imaging of hyperpolarized 129Xe in the airspaces, barrier, and red blood cells using an interleaved 3D radial 1-point Dixon acquisition. Magn Reson Med. 75 (4), 1434-1443 (2016).
- Zanette, B., Munidasa, S., Friedlander, Y., Ratjen, F., Santyr, G. A 3D stack-of-spirals approach for rapid hyperpolarized 129Xe ventilation mapping in pediatric cystic fibrosis lung disease. Magn Reson Med. 89 (3), 1083-1091 (2023).
- Zanette, B., Stirrat, E., Jelveh, S., Hope, A., Santyr, G. Physiological gas exchange mapping of hyperpolarized 129Xe using spiral-IDEAL and MOXE in a model of regional radiation-induced lung injury. Med Phys. 45 (2), 803-816 (2018).
- Collier, G. J., et al. Dissolved 129Xe lung MRI with four-echo 3D radial spectroscopic imaging: Quantification of regional gas transfer in idiopathic pulmonary fibrosis. Magn Reson Med. 85 (5), 2622-2633 (2021).
- Qing, K., et al. Assessment of lung function in asthma and COPD using hyperpolarized 129Xe chemical shift saturation recovery spectroscopy and dissolved-phase MRI. NMR Biomed. 27 (12), 1490-1501 (2014).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Mugler, J. P. Probing lung physiology with xenon polarization transfer contrast (XTC). Magn Reson Med. 44 (3), 349-357 (2000).
- Kern, A. L., et al. Investigating short-time diffusion of hyperpolarized 129Xe in lung air spaces and tissue: A feasibility study in chronic obstructive pulmonary disease patients. Magn Reson Med. 84 (4), 2133-2146 (2020).
- Amzajerdian, F., et al. Simultaneous quantification of hyperpolarized xenon-129 ventilation and gas exchange with multi-breath xenon-polarization transfer contrast (XTC) MRI. Magn Reson Med. 90 (6), 2334-2347 (2023).
- Perron, S., et al. Application of a 2D frequency encoding sectoral approach to hyperpolarized 129Xe MRI at low field. J Magn Reson. 336, 107159 (2022).
- Loza, L. A., et al. Quantification of ventilation and gas uptake in free-breathing mice with hyperpolarized 129Xe MRI. IEEE Trans Med Imaging. 38 (9), 2081-2091 (2019).
- Imai, H., et al. Regional fractional ventilation mapping in spontaneously breathing mice using hyperpolarized 129Xe MRI. NMR Biomed. 28 (1), 24-29 (2015).
- Friedlander, Y., et al. Effect of inhaled oxygen concentration on 129Xe chemical shift of red blood cells in rat lungs. Magn Reson Med. 86 (3), 1187-1193 (2021).
- Virgincar, R. S., et al. A portable ventilator with integrated physiologic monitoring for hyperpolarized 129Xe MRI in rodents. J Magn Reson. 295, 63-71 (2018).
- Nouls, J., Fanarjian, M., Hedlund, L., Driehuys, B. A constant-volume ventilator and gas recapture system for hyperpolarized gas MRI of mouse and rat lungs. Concepts Magn Reson Part B Magn Reson Eng. 39B (2), 78-88 (2011).
- Niedbalski, P. J., et al. Preclinical hyperpolarized 129Xe MRI: ventilation and T2* mapping in mouse lungs at 7 T using multi-echo flyback UTE. NMR Biomed. 33 (7), e4302 (2020).
- Akinyi, T. G. . An Affordable Open-Source Small Animal MR and Hyperpolarized Gas Compatible Ventilator: Feasibility in Preclinical Imaging. , (2017).
- Smith, L. J., et al. The assessment of short and long term changes in lung function in CF using 129Xe MRI. Eur Respir J. 6, 2000441 (2020).
- Svenningsen, S., et al. Reproducibility of hyperpolarized 129Xe MRI ventilation defect percent in severe asthma to evaluate clinical trial feasibility. Acad Radiol. 28 (6), 817-826 (2021).
- Kirby, M., et al. Hyperpolarized 3He and 129Xe MR imaging in healthy volunteers and patients with chronic obstructive pulmonary disease. Radiology. 265 (2), 600-610 (2012).
- Virgincar, R. S., et al. Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease. NMR Biomed. 26 (4), 424-435 (2013).
- Ebner, L., et al. Multireader determination of clinically significant obstruction using hyperpolarized 129Xe-ventilation MRI. AJR Am J Roentgenol. 212 (4), 758-765 (2019).
- Driehuys, B., et al. 3He MRI in mouse models of asthma. Magn Reson Med. 58 (5), 893-900 (2007).
- Mistry, N. N., Thomas, A., Kaushik, S. S., Johnson, G. A., Driehuys, B. Quantitative analysis of hyperpolarized 3He ventilation changes in mice challenged with methacholine. Magn Reson Med. 63 (3), 658-666 (2010).
- Costa, M., et al. Noninvasive assessment of in vivo mouse lung microstructural changes due to aging and PEEP. Am J Respir Crit Care Med. 207, A4713 (2023).
- Sukstanskii, A. L., Yablonskiy, D. A. Lung morphometry with hyperpolarized 129Xe: theoretical background. Magn Reson Med. 67 (3), 856-866 (2012).
- Chan, H. F., Stewart, N. J., Norquay, G., Collier, G. J., Wild, J. M. 3D diffusion-weighted 129Xe MRI for whole lung morphometry. Magn Reson Med. 79 (6), 2986-2995 (2018).
- Bier, E. A., et al. Noninvasive diagnosis of pulmonary hypertension with hyperpolarised 129Xe magnetic resonance imaging and spectroscopy. ERJ Open Res. 8 (2), 00035 (2022).
- Bier, E. A., et al. A protocol for quantifying cardiogenic oscillations in dynamic 129Xe gas exchange spectroscopy: The effects of idiopathic pulmonary fibrosis. NMR Biomed. 32 (1), e4029 (2019).
- Wang, Z., et al. Diverse cardiopulmonary diseases are associated with distinct xenon magnetic resonance imaging signatures. Eur Respir J. 54 (6), 1900831 (2019).
- Freeman, M. S., Cleveland, Z. I., Qi, Y., Driehuys, B. Enabling hyperpolarized 129Xe MR spectroscopy and imaging of pulmonary gas transfer to the red blood cells in transgenic mice expressing human hemoglobin. Magn Reson Med. 70 (5), 1192-1199 (2013).
- Iguchi, S., et al. Direct imaging of hyperpolarized 129Xe alveolar gas uptake in a mouse model of emphysema. Magn Reson Med. 70 (1), 207-215 (2013).
- Imai, H., et al. Noninvasive detection of pulmonary tissue destruction in a mouse model of emphysema using hyperpolarized 129Xe MRS under spontaneous respiration. Magn Reson Med. 64 (4), 929-938 (2010).
- Silk, S. B., Hampton, L. L., Brown, P. A. What investigators need to know about the use of animals. ILAR J. 54 (3), 324-328 (2014).
- Cereda, M., et al. Mild loss of lung aeration augments stretch in healthy lung regions. J Appl Physiol. 120 (1985), 444-454 (2016).
- Constantinides, C., Murphy, K. Molecular and integrative physiological effects of isoflurane anesthesia: The paradigm of cardiovascular studies in rodents using magnetic resonance imaging. Front Cardiovasc Med. 3, 23 (2016).
- Irwin, M. R., Curay, C. M., Choi, S., Kiyatkin, E. A. Basic physiological effects of ketamine-xylazine mixture as a general anesthetic preparation for rodent surgeries. Brain Res. 1804, 148251 (2023).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., John Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am J Physiol Heart Circ Physiol. 282 (6), H2134-H2140 (2002).
- Massey, C. A., Richerson, G. B. Isoflurane, ketamine-xylazine, and urethane markedly alter breathing even at subtherapeutic doses. J Neurophysiol. 118 (4), 2389-2401 (2017).
- Janssen, B. J. A., et al. Effects of anesthetics on systemic hemodynamics in mice. Am J Physiol Heart Circ Physiol. 287 (4), H1618-H1624 (2004).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: A Doppler ultrasound study of the left coronary artery in mice. Ultrasound Med Biol. 42 (4), 999-1009 (2016).
- Mondonedo, J. R., et al. Volatile anesthetics and the treatment of severe bronchospasm: A concept of targeted delivery. Drug Discov Today Dis Models. 15, 43-50 (2015).
- Nolan, J. P. Anaesthesia and Neuromuscular Block. Clinical Pharmacology. , 295-310 (2012).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rülicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51 (5), 443-456 (2001).
- Navarro, K. L., et al. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. (86), e50269 (2014).
- Slutsky, A. S., Ranieri, V. M. Ventilator-induced lung injury. N Engl J Med. 369 (22), 2126-2136 (2013).
- Matute-Bello, G., et al. An official American thoracic society workshop report: features and measurements of experimental acute lung injury in animals. Am J Respir Cell Mol Biol. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: An official American thoracic society workshop report. Am J Respir Cell Mol Biol. 66 (2), e1-e14 (2022).
- Tsuchida, S., et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 174 (3), 279-289 (2006).
- Fan, E., et al. An official American thoracic society/European society of intensive care medicine/society of critical care medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 195 (9), 1253-1263 (2017).
- Santos, R. S., Silva, P. L., Pelosi, P., Rocco, P. R. Recruitment maneuvers in acute respiratory distress syndrome: The safe way is the best way. World J Crit Care Med. 4 (4), 278-286 (2015).
- Mekontso Dessap, A., et al. Conflicting physiological and genomic cardiopulmonary effects of recruitment maneuvers in murine acute lung injury. Am J Respir Cell Mol Biol. 46 (4), 541-550 (2012).
- García-Fernández, J., et al. Recruitment manoeuvres in anaesthesia: How many more excuses are there not to use them. Rev Esp Anestesiol Reanim (Engl Ed). 65 (4), 209-217 (2018).
- Allen, G. B., Suratt, B. T., Rinaldi, L., Petty, J. M., Bates, J. H. Choosing the frequency of deep inflation in mice: balancing recruitment against ventilator-induced lung injury. Am J Physiol Lung Cell Mol Physiol. 291 (4), L710-L717 (2006).
- da Silva, A. C. L., et al. Sigh maneuver protects healthy lungs during mechanical ventilation in adult Wistar rats. Exp Biol Med. 245 (15), 1404-1413 (2020).
- Riva, D. R., et al. Recruitment maneuver: RAMP versus CPAP pressure profile in a model of acute lung injury. Respir Physiol Neurobiol. 169 (1), 62-68 (2009).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Joelsson, J. P., Ingthorsson, S., Kricker, J., Gudjonsson, T., Karason, S. Ventilator-induced lung-injury in mouse models: Is there a trap. Lab Anim Res. 37 (1), 30 (2021).
- Jameson, C. J., Jameson, A. K., Hwang, J. K. Nuclear spin relaxation by intermolecular magnetic dipole coupling in the gas phase. 129Xe in oxygen. J Chem Phys. 89 (7), 4074-4081 (1988).
- Kelley, M., Branca, R. T. Theoretical models of spin-exchange optical pumping: Revisited and reconciled. J Appl Phys. 129 (15), 1-16 (2021).
- Norquay, G., Leung, G., Stewart, N. J., Wolber, J., Wild, J. M. 129Xe chemical shift in human blood and pulmonary blood oxygenation measurement in humans using hyperpolarized 129Xe NMR. Magn Reson Med. 77 (4), 1399-1408 (2017).
- Norquay, G., Collier, G. J., Rao, M., Stewart, N. J., Wild, J. M. 129Xe-Rb spin-exchange optical pumping with high photon efficiency. Phys Rev Lett. 121 (15), 153201 (2018).
- Ball, J. E., Wild, J. M., Norquay, G. Investigating Rubidium density and temperature distributions in a high-throughput 129Xe-Rb spin-exchange optical pumping polarizer. Molecules. 28 (1), 11 (2022).
- Plummer, J. W., et al. A semi-empirical model to optimize continuous-flow hyperpolarized 129Xe production under practical cryogenic-accumulation conditions. J Magn Reson. 320, 106845 (2020).
- Nikolaou, P., et al. Near-unity nuclear polarization with an open-source 129Xe hyperpolarizer for NMR and MRI. Proc Natl Acad Sci U S A. 110 (35), 14150-14155 (2013).
- Robertson, S. H., et al. Optimizing 3D noncartesian gridding reconstruction for hyperpolarized 129Xe MRI-focus on preclinical applications. Concepts Magn Reson Part A Bridg Educ Res. 44 (4), 190-202 (2015).
- Thomas, A. C., et al. A robust protocol for regional evaluation of methacholine challenge in mouse models of allergic asthma using hyperpolarized 3He MRI. NMR Biomed. 22 (5), 502-515 (2009).
- Niedbalski, P. J., et al. Protocols for multi-site trials using hyperpolarized 129Xe MRI for imaging of ventilation, alveolar-airspace size, and gas exchange: A position paper from the 129Xe MRI clinical trials consortium. Magn Reson Med. 86 (6), 2966-2986 (2021).
- Woodhouse, N., et al. Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers. J Magn Reson Imaging. 21 (4), 365-369 (2005).
- Brown, R. W., Cheng, Y. C. N., Haacke, E. M., Thompson, M. R., Venkatesan, R. . Magnetic Resonance Imaging: Physical Principles and Sequence Design. , (2014).
- Levitt, M. H. . Spin Dynamics: Basics of Nuclear Magnetic Resonance. , (2013).
- Salerno, M., et al. Emphysema: hyperpolarized helium 3 diffusion MR imaging of the lungs compared with spirometric indexes—initial experience. Radiology. 222 (1), 252-260 (2002).
- Niedbalski, P. J., et al. Validating in vivo hyperpolarized 129Xe diffusion MRI and diffusion morphometry in the mouse lung. Magn Reson Med. 85 (4), 2160-2173 (2021).
- Bdaiwi, A. S., et al. Improving hyperpolarized 129Xe ADC mapping in pediatric and adult lungs with uncertainty propagation. NMR Biomed. 35 (3), e4639 (2022).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Driehuys, B., Mugler, J. P. NMR of hyperpolarized 129Xe in the canine chest: spectral dynamics during a breath-hold. NMR Biomed. 13 (4), 220-228 (2000).
- Driehuys, B., et al. Imaging alveolar-capillary gas transfer using hyperpolarized 129Xe MRI. Proc Natl Acad Sci U S A. 103 (48), 18278-18283 (2006).
- Nakamura, K., et al. 129Xe spectra from the heads of rats with and without ligation of the external carotid and pterygopalatine arteries. Magn Reson Med. 53 (3), 528-534 (2005).
- Kershaw, J., et al. Confirming the existence of five peaks in 129Xe rat head spectra. Magn Reson Med. 57 (4), 791-797 (2007).
- Chen, R. Y., et al. Tissue-blood partition coefficient for xenon: temperature and hematocrit dependence. J Appl Physiol. 49 (2), 178-183 (1980).
- Möller, H. E., et al. Magnetic resonance angiography with hyperpolarized 129Xe dissolved in a lipid emulsion. Magn Reson Med. 41 (5), 1058-1064 (1999).
- Norquay, G., et al. Relaxation and exchange dynamics of hyperpolarized 129Xe in human blood. Magn Reson Med. 74 (2), 303-311 (2015).
- Zhang, L., et al. Absolute thermometry of human brown adipose tissue by magnetic resonance with laser polarized 129Xe. Commun Med. 3 (1), 147 (2023).
- Barshishat-Kupper, M., et al. Protein oxidation in the lungs of C57BL/6J mice following X-irradiation. Proteomes. 3 (3), 249-265 (2015).
- Olsson, L. E., et al. Measurement of MR signal and T2* in lung to characterize a tight skin mouse model of emphysema using single-point imaging. J Magn Reson Imaging. 25 (3), 488-494 (2007).
- Crowle, A. J. Delayed hypersensitivity in mice. J Allergy. 30 (2), 151-164 (1959).
- Guo, J., Cao, X., Cleveland, Z. I., Woods, J. C. Murine pulmonary imaging at 7T: T2* and T1 anisotropic UTE. Magn Reson Med. 79 (4), 2254-2264 (2018).
- Sonobe, T., et al. Imaging of the closed-chest mouse pulmonary circulation using synchrotron radiation microangiography. J Appl Physiol. 111 (1), 75-80 (2011).
- Wang, W., et al. Imaging lung microstructure in mice with hyperpolarized 3He diffusion MRI. Magn Reson Med. 65 (3), 620-626 (2011).
- Ouriadov, A. V., et al. Application of a stretched-exponential model for morphometric analysis of accelerated diffusion-weighted 129Xe MRI of the rat lung. Magn Reson Mater Phy. 34 (1), 73-84 (2021).
- O'Halloran, R. L., Holmes, J. H., Altes, T. A., Salerno, M., Fain, S. B. The effects of SNR on ADC measurements in diffusion-weighted hyperpolarized He-3 MRI. J Magn Reson. 185 (1), 42-49 (2007).
- Moller, H. E., Cleveland, Z. I., Driehuys, B. Relaxation of hyperpolarized 129Xe in a deflating polymer bag. J Magn Reson. 212 (1), 109-115 (2011).
- Reiss, L. K., Kowallik, A., Uhlig, S. Recurrent recruitment manoeuvres improve lung mechanics and minimize lung injury during mechanical ventilation of healthy mice. PLoS One. 6 (9), e24527 (2011).
- Cagle, L. A., et al. Effects of positive end-expiratory pressure and recruitment maneuvers in a ventilator-induced injury mouse model. PLoS One. 12 (11), e0187419 (2017).
- Cannizzaro, V., et al. Lung volume recruitment maneuvers and respiratory system mechanics in mechanically ventilated mice. Respir Physiol Neurobiol. 169 (3), 243-251 (2009).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Blevins, C. E., Celeste, N. A., Marx, J. O. Effects of oxygen supplementation on injectable and inhalant anesthesia in C57BL/6 mice. J Am Assoc Lab Anim Sci. 60 (3), 289-297 (2021).
- Cannizzaro, V., et al. Impact of supplemental oxygen in mechanically ventilated adult and infant mice. Respir Physiol Neurobiol. 165 (1), 61-66 (2009).
- Sembroski, E., Sanghavi, D. K., Bhardwaj, A. Inverse Ratio Ventilation. StatPearls Publishing. , (2023).
- Boros, S. J. Variations in inspiratory:expiratory ratio and airway pressure wave form during mechanical ventilation: the significance of mean airway pressure. J Pediatr. 94 (1), 114-117 (1979).
- Zheng, W., Cleveland, Z. I., Moller, H. E., Driehuys, B. Gradient-induced longitudinal relaxation of hyperpolarized noble gases in the fringe fields of superconducting magnets used for magnetic resonance. J Magn Reson. 208 (2), 284-290 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados