É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medições de Microscopia de Força Atômica de Cartilagem em Membros de Axolote Intactos e em Regeneração
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Neste protocolo, mostramos como preparar tecido de axolote para microscopia de força atômica (AFM) e realizar medições de indentação na cartilagem intacta e em regeneração.
Resumo
As forças mecânicas fornecem sinais importantes para a função celular normal e a formação de padrões nos tecidos em desenvolvimento, e seu papel tem sido amplamente estudado durante a embriogênese e patogênese. Comparativamente, pouco se sabe sobre esses sinais durante a regeneração animal.
O axolote é um importante organismo modelo para o estudo da regeneração, dada a sua capacidade de restaurar totalmente muitos órgãos e tecidos após a lesão, incluindo cartilagem e osso ausentes. Devido ao seu papel crucial como o principal tecido de suporte no corpo dos vertebrados, recuperar a função esquelética durante a regeneração requer tanto a restauração das estruturas ausentes quanto suas propriedades mecânicas. Este protocolo descreve um método para processar amostras de membros de axolotes para microscopia de força atômica (AFM), que é o padrão-ouro para sondar propriedades mecânicas de células e tecidos em alta resolução espacial.
Aproveitando as capacidades regenerativas do axolote, este estudo mediu a rigidez da cartilagem do membro durante a homeostase e dois estágios de regeneração do membro: histólise tecidual e condensação da cartilagem. Mostramos que o AFM é uma ferramenta valiosa para obter insights sobre a reestruturação dinâmica do tecido e as mudanças mecânicas que ocorrem durante a regeneração.
Introdução
O esqueleto, especialmente cartilagem e ossos, fornece o principal suporte mecânico para os tecidos moles do corpo em vertebrados. Portanto, qualquer dano no sistema esquelético provavelmente comprometerá muito a funcionalidade e até mesmo a sobrevivência. Em humanos, as fraturas ósseas são uma das lesões traumáticas mais comuns1, a maioria das quais se repara em questão de semanas, mas 5% a 10% delas terão atrasos na cicatrização ou nunca se recuperarão totalmente 2,3. Além disso, os seres humanos não são capazes de se recuperar de extensa perda óssea ou cartilaginosa 4,5. Algumas salamandras, no entanto, podem regenerar uma variedade de estruturas corporais, incluindo membros completos6, tornando-as um modelo ideal para o estudo da regeneração esquelética.
O axolote (Ambystoma mexicanum) é um tipo de salamandra onde a regeneração de membros tem sido extensivamente estudada. Este processo ocorre em quatro fases sequenciais principais, mas sobrepostas: 1) cicatrização de feridas, 2) inflamação / histolise, 3) formação de blastema e 4) crescimento / diferenciação de blastema (revisado em 7,8). Após a amputação, os queratinócitos que margeiam o local da lesão migram rapidamente, fechando a ferida e formando o epitélio da ferida (WE). Durante a inflamação e a histólise que se seguiram, os patógenos são eliminados, os detritos e as células danificadas são eliminados e a matriz extracelular (MEC) sob a superfície da amputação é remodelada9. A histólise tecidual é essencial para que ocorra a regeneração do membro10, onde a secreção de enzimas proteolíticas é crucial não apenas para o remodelamento geral da MEC, mas também para liberar as células que dão origem ao blastema e liberar moléculas bioativas sequestradas na própria MEC8. De fato, estudos em muitos contextos regenerativos e organismos modelo mostraram que as propriedades únicas do material da ECM durante a histólise são capazes de induzir processos de desdiferenciação ou direcionar a migração de células para o local da lesão (revisado em11). Além disso, a reabsorção do tecido calcificado durante os estágios tardios da histólise tem se mostrado fundamental para a integração adequada dos elementos esqueléticos dos membrosrecém-formados12. Após o estágio de histólise, o blastema é formado sob o epitélio da ferida (WE) como um acúmulo de progenitores indiferenciados e multi-linhagem resultantes de células de tecido maduro desdiferenciadas ou células-tronco residentes. As células de blastema proliferam e se diferenciam em todos os tipos de células ausentes. Finalmente, ocorre a morfogênese do membro, onde o tecido esquelético é regenerado através da condensação de condroprogenitores derivados de células periskeletais e fibroblastos dérmicos transdiferenciados 13,14,15.
Embora muitas das pistas bioquímicas que regulam as mudanças na identidade celular e na composição da MEC tenham sido identificadas 10,13,14,16,17,18, as propriedades mecânicas dos tecidos durante as diferentes fases da regeneração dos membros, bem como sua influência na regeneração, permaneceram amplamente inexploradas. Muitos estudos mostraram que as células sentem e integram pistas mecânicas que regulam seu destino e comportamento em vários contextos (revisado em19,20). Portanto, complementar nosso conhecimento celular e molecular da regeneração de membros com medições mecânicas de tecidos melhorará muito nossa compreensão desses processos.
Diferentes técnicas têm sido desenvolvidas que permitem a caracterização mecânica e a manipulação da força de amostras biológicas21. Dentre essas técnicas, a microscopia de força atômica (AFM) tornou-se o padrão-ouro em mecanobiologia, na qual as propriedades viscoelásticas de amostras biológicas são sondadas em alta resolução espacial por recuo com um sensor de força ultrassensível, o cantileverAFM 22. Como essa técnica requer contato direto com a amostra, normalmente são geradas fatias de tecido, o que pode ser desafiador em alguns casos. Assim, as condições de preparo precisam ser adaptadas e otimizadas para cada amostra em particular, para que ela possa permanecer o mais próximo possível das condições fisiológicas e artefatos mínimos sejam gerados23. Este protocolo descreve como medir a rigidez tecidual em membros de axolotes usando AFM, com foco em tecidos cartilaginosos em condições intactas, durante a histólise e nos estágios de condensação da cartilagem (Figura 1 e Figura 2). Este método também pode ser expandido para a medição de outros tipos de tecidos.
Protocolo
Os axolotes (Ambystoma mexicanum) foram cultivados nas instalações de axolotes do Centro de Terapias Regenerativas de Dresden (CRTD) da Universidade de Tecnologia de Dresden (TUD). Uma descrição completa das condições de criação pode ser encontrada em24. Resumidamente, os quartos foram mantidos a 20-22 °C com um ciclo dia/noite de 12/12 h. Todos os procedimentos cirúrgicos e de manipulação foram realizados de acordo com as diretrizes do comitê de ética local e foram aprovados pela Landesdirektion Sachsen, Alemanha.
Este estudo usou axolotes brancos (d / d) para todos os experimentos, uma cepa mutante natural sem pigmentação corporal (poucos ou nenhum melanóforo e xantóforo), com iridóforos apenas na íris dos olhos. Este estudo utilizou axolotes medindo 8-15 cm do focinho à cauda (5-7 meses de idade) sem viés específico do sexo.
1. Preparação
- Prepare uma solução estoque de benzocaína a 10% (p / v) que será usada para anestesia e eutanásia dos axolotes (veja abaixo). Para isso, misture em uma garrafa volumétrica 50 g de benzocaína com etanol 100% até atingir o limite de 500 mL.
- Prepare uma solução estoque de benzocaína a 0,03% (p / v).
- Para 1 L, misture 50 mL de solução salina 10x Tris-tamponada (TBS) com 30 mL de benzocaína a 10% (p/v) e 5 mL de soluções de Holtfreter a 4000% (p/v) com 915 mL de água destilada e misture durante a noite com uma barra de agitação magnética.
- Para 1 L de solução 10x TBS, misture 24,2 g de base Trizma e 90 g de NaCl com 990 mL de água deionizada. Misture bem com uma barra de agitação magnética. Em seguida, adicione aproximadamente 10 mL de HCl concentrado (12 M ou 37%) e ajuste para pH 8.
- Para 1 L de solução de Holtfreter a 4000% (p/v), misturar 158,4 g de NaCl, 11,13 g de MgSO4·7H2O, 5,36 g de CaCl2·2H2O e 2,88 g de KCl com água deionizada até 1 L.
- Prepare uma diluição de benzocaína a 0,01% (p / v) na água do tanque de retenção para anestesia, diluindo a solução estoque a 0,03% (p / v) 1: 3.
- Para 1 L de solução, use 333 mL da solução estoque de benzocaína mais 666 mL de água do tanque de retenção.
- Prepare uma solução estoque de tartarato de butorfanol 5 mg / mL para analgesia. Para isso, misture 100 mg de sal de butorfanol (+)-tartarato com 20 mL de água ultrapura. Conservar as alíquotas a 4 °C.
- No dia das amputações, prepare a solução de trabalho de tartarato de butorfanol 0,5 mg/L para diminuir a dor do animal após procedimentos cirúrgicos, diluindo a solução estoque 1:10.000 na água do tanque de retenção.
- Para animais com menos de 8 cm de comprimento, misture 20 μL de solução de reserva em 200 mL de água do tanque de retenção.
- Para animais maiores, misture 60 μL de solução estoque em 600 mL de água do tanque de retenção.
- Prepare solução salina estéril tamponada com fosfato anfíbio (APBS), uma solução de PBS a 80% (v/v) e mantenha-a em temperatura ambiente (RT) misturando 800 mL de DPBS com 200 mL de água deionizada.
- Prepare 1 mg/ml de solução-mãe de insulina. Para isso, misture 250 mg de insulina em pó com 25 mL de HCl 0,1 M e agite lentamente até dissolver. Enquanto agita, adicione 225 mL de APBS até que a solução esteja límpida. Filtro estéril e armazenar alíquotas de 4 ml a -20 °C.
- Prepare o meio de cultura estéril (todas as % (v / v): 62,5% L15 meio, 10% FBS inativado pelo calor, 1% Penicilina / Estreptomicina, 1% Insulina, 1% L-Glutamina) e mantenha a 4 ° C até o dia do uso. No dia experimental, equilibrar-se ao RT antes da utilização.
- Para 400 mL de meio de cultura, use 250 mL de meio L15, 40 mL de FBS inativado por calor, 4 mL de penicilina/estreptomicina, 4 mL de solução de insulina (da Etapa 1.7), 4 mL de L-glutamina e 98 mL de água estéril deionizada. Prepare em condições estéreis e um filtro estéril após misturar todos os componentes. Prepare alíquotas de 15 mL.
- Preparar 2,5% e 3% (p/v) de baixo ponto de fusão (lmp)-agarose em solução APBS e aquecer a 70 °C para dissolver completamente a agarose. Preparar alíquotas em tubos de 1,5 ml e conservar a 4 °C até ao dia da utilização.
- Para 20 ml de lmp-agarose a 2,5% (p/v), misturar 0,5 g de lmp-agarose com 20 ml de APBS num tubo de 50 ml e aquecer em banho-maria a 70 °C até à agave A solução tem de se tornar clara e transparente. Prepare alíquotas ainda quentes.
- Para 20 mL de lmp-agarose a 3% (p / v), misture 0,6 g de lmp-agarose com 20 mL de APBS e proceda como acima.
- (Opcional): Para 20 mL de lmp-agarose a 1% (p / v), misture 0,2 g de lmp-agarose com 20 mL de APBS e proceda como acima.
NOTA: O tempo de fusão depende da concentração da lmp-agarose e pode variar aproximadamente de 15 a 40 min.
- Para amputação e montagem de tecido, use um estereoscópio de campo claro.
- Monte placas de Petri de plástico de 100 mm de diâmetro, pinças, bisturi e tesouras cirúrgicas para amputações e coleta de tecidos.
- Preparar placas de Petri de plástico de 35 mm de diâmetro para as medições de indentação.
- Prepare cilindros de ~ 1 cm de comprimento de ~ 1 cm de diâmetro. Para isso, aqueça um cortador de papelão sob uma chama de bico de Bunsen e corte um tubo de 15 mL com a lâmina aquecida.
- Corte pequenos 1 cm2 quadrados de parafilme e guarde.
- Prepare um bloco metálico ou frio a -20 °C, deixando-o no freezer por pelo menos 1 h.
- Prepare pipetas de plástico Pasteur.
- (Opcional): Prepare a solução de MEMFa fixador (ácido 3-(N-morfolino)propanossulfônico [MOPS] 0,1 M pH 7,4, Etilenoglicol-bis (2-aminoetiléter)-N,N,N',N'-ácido tetracético [EGTA] 2 mM, MgSO4·7H2O 1 mM, 3,7% formaldeído). Para isso, adicione 10,465 g de MOPS, 0,123 g de MgSO4·7H2O, 2 mL de 0,5 M EDTA pH 8,0 e adicione água até 45 mL. Adicione 5 mL de formaldeído a 37% (p / v) a um volume total de 50 mL.
2. Reagentes
- Consulte a Tabela de Materiais para os reagentes usados para este trabalho, mas outros fornecedores comerciais também podem ser usados.
3. Amputação de axolotes e regeneração de membros
- Antes de todos os procedimentos experimentais, anestesiar o animal em benzocaína a 0,01% (p/v) diluída em água do tanque de retenção (etapa 1.3) por 20 min, certificando-se de que os animais estejam profundamente anestesiados e sem resposta a estímulos táteis.
- Remova o axolote da anestesia e coloque-o em cima de uma placa de Petri de 100 mm contendo um lenço de papel umedecido com água contendo anestesia. Oriente o membro perpendicularmente ao eixo do corpo e coloque a placa sob o estereoscópio para melhor visualização.
NOTA: Um estereoscópio com uma lâmpada compacta de pescoço de ganso foi usado aqui. - Amputar o membro com bisturi estéril afiado imediatamente distal à área calcificada da região zeugopodial (rádio/ulna) (Figura 1A).
NOTA: Aderindo ao princípio de bem-estar animal 3R, recomenda-se usar os membros que foram inicialmente removidos pela amputação como controles intactos. - Deixe o animal no prato e cubra-o com um lenço de papel umedecido embebido em água contendo benzocaína por 15 minutos para permitir a coagulação do sangue e o fechamento da ferida.
- Colocar os animais em causa num tanque contendo água fresca de retenção com analgésicos (tartarato de butorfanol, 0,5 mg/l, a partir do passo 1.5).
- Mover os animais para o tanque original contendo água fresca de retenção 24 h após o tratamento analgésico pós-operatório.
- Permita que os animais se regenerem até o estágio desejado de interesse.
NOTA: Os membros analisados foram coletados no dia da amputação para a fase intacta e 5 dias pós-amputação (dpa) para a fase de histólise em animais com 5 meses de idade. O estágio de condensação da cartilagem foi medido a 21 dpa em animais de 7 meses de idade.
4. Montagem e processamento de tecidos para medições
- Aqueça os tubos de 1,5 mL contendo 2,5% ou 3% (p / v) lmp-agarose (da etapa 1.9) em um termobloco a 70 ° C até que a agarose derreta completamente. Troque os tubos para um termobloco diferente a 37 °C e deixe a temperatura se equilibrar antes de usar.
NOTA: Aqui, 2,5% de lmp-agarose foi usado para medir tecidos em regeneração e 3% para tecidos intactos. - Cubra um lado dos cilindros de 1 cm de comprimento (a partir do passo 1.13) com uma das peças de parafilme (passo 1.14) para que fiquem completamente selados na parte inferior.
- Equilibre alíquotas de 15 mL de meio de cultura para RT (da etapa 1.8)
- Anestesiar os animais imergindo-os em água contendo anestésico (benzocaína a 0,01% (p/v) diluída na água do tanque de retenção) por pelo menos 20 min.
- Visualize os membros sob um estereoscópio com software que permite medições quantitativas. Meça o comprimento da estrutura de interesse e calcule quanto tecido precisa ser removido da extremidade distal do membro até que a seção de interesse seja alcançada.
- Para regenerar membros, colete-os cortando com bisturi e/ou tesoura cirúrgica na altura do cotovelo e dissecando o excesso de tecido do membro. Deixe o tecido na solução de APBS enquanto prepara a próxima etapa. Certifique-se de que o corte seja transversal (90°) ao eixo do braço inferior para criar uma superfície uniforme. Para os membros intactos, remova a mão cortando a região do carpo.
- Eutanásia dos animais expondo-os a uma dose letal de anestesia (benzocaína a 0,1%) por pelo menos 20 min. Para isso, adicione o volume necessário de solução de benzocaína a 10% (p/v) para atingir uma concentração de 0,1% (p/v).
- Se os animais foram anestesiados em 100 mL de solução de benzocaína a 0,01% (p/v), adicionar 900 μL da solução de benzocaína a 10% (p/v).
- Enxágue os membros submergindo-os na solução APBS.
- Certifique-se de que as pipetas Pasteur e o termobloco (estabilizado a 37 °C com alíquotas de agarose) estejam próximos à estação de trabalho. Retire o bloco frio do congelador a -20 °C e coloque o cilindro com a extremidade coberta com o parafilme voltada para baixo em cima dele.
- Pegue o membro dissecado e remova suavemente o excesso de líquido com papel de seda. Coloque o membro em um prato limpo, adicione a lmp-agarose derretida por cima e mova brevemente o membro na agarose para deslocar qualquer APBS restante da superfície da pele.
- Trabalhando rapidamente, coloque o membro dentro do cilindro, garantindo que ele esteja orientado verticalmente, com a área de interesse voltada para cima.
- Enquanto segura suavemente o membro com uma pinça, adicione lmp-agarose dentro do cilindro até que o tecido esteja totalmente coberto. Remova suavemente a pinça antes que a agarose se solidifique.
- Remova o cilindro do bloco frio e deixe a agarose solidificar completamente em RT por aproximadamente 30 s.
- Leve o bloco de agarose contendo tecido imediatamente para a sala de vibratomo, juntamente com alíquotas de meio de cultura estéril e APBS, em RT.
- Remova o parafilme do fundo do cilindro e prenda a agarose contendo o tecido ao estágio de vibratomo com cola de cianoacrilato. Certifique-se de que a agarose e a amostra estejam coladas ao palco.
- Mergulhe o estágio no APBS para seccionamento.
NOTA: Os tecidos intactos incluem o osso/cartilagem mais rígido, enquanto os tecidos em regeneração são mais macios. Portanto, os parâmetros do vibratomo devem ser ajustados de acordo. Este estudo utilizou os seguintes parâmetros: Tecidos íntegros (amplitude de 1,2 mm e velocidade de 0,1 mm/s) e tecidos em regeneração (amplitude de 0,9 mm e velocidade de 0,4 mm/s). - Comece a seccionar a agarose em etapas curtas (por exemplo, em etapas de 100 μm) até que a ponta do tecido seja alcançada. Em seguida, corte o bloco de tecido até que a porção distal do tecido (calculada na etapa 4.5) seja removida. Desta forma, uma seção transversal da área de interesse será facilmente acessível.
NOTA: A seção de tecido removida conterá a superfície imediatamente adjacente à sondada com AFM e pode servir como referência para a estrutura do tecido. Portanto, pode ser usado para análise complementar direta ou fixado para coloração subsequente (consulte a seção 6). - Remova cuidadosamente o bloco contendo tecido do estágio de vibratomo com uma lâmina de barbear e remova todos os vestígios de cola. Cole imediatamente o bloco em uma placa de Petri de plástico de 35 mm com cola adesiva de tecido cirúrgico e adicione aproximadamente 2 mL de meio de cultura em RT para garantir que o tecido esteja totalmente coberto.
NOTA: A superfície do tecido exposto no bloco de agarose é a superfície a ser sondada.
5. Medições com AFM
- Pelo menos 1 dia antes das medições, prepare o cantilever para as medições.
NOTA: Para este trabalho, os balanços de silicone sem ponta foram funcionalizados com grânulos de poliestireno (diâmetro de 20 μm), e a ligação cordão-cantilever foi deixada para fortalecer por pelo menos 1 dia antes de ser usada para medições de indentação.- Prenda as contas aos balanços usando cola epóxi com um tempo de processamento de 5 min.
- Abaixe rapidamente o cantilever com o mínimo de contato em uma lâmina de vidro revestida com cola para que uma pequena gota de cola se forme em sua extremidade e coloque-a imediatamente em contato com um cordão adequado.
- Segure o contato do cordão do balanço por ~ 10 min antes de levantar o cantilever com um cordão amarrado da superfície.
- Calibre o cantilever antes das medições.
NOTA: O cantilever modificado foi calibrado antes de cada conjunto de experimentos pelo método de ruído térmico usando procedimentos integrados do software AFM. - Insira a placa de Petri com o bloco de tecido (da etapa 4.18) e o meio de cultura no suporte da placa de Petri do AFM e adquira uma imagem geral em microscopia de campo claro (Figura 1B).
NOTA: Para testes de indentação, é usada uma configuração equipada com um motorstage em cima de um microscópio de luz vertical. Monte a cabeça do AFM e posicione o cantilever sobre o tecido e aproxime-o da superfície. - Escolha a região específica de interesse e registre uma matriz de curvas de força-distância (Figura 2A).
NOTA: Pontos de ajuste de força relativa de 2-25 nN foram usados para atingir profundidades de indentação comparáveis de ~ 1-4 μm para tecidos de rigidez diferente, com uma velocidade de aproximação e retração de 7,5 μm / s, comprimento z de 50 μm, tamanho da grade 70 μm x 70 μm com 3 x 3 pontos. - Para cada região sondada, adquira uma imagem de microscopia de campo claro para associar os valores obtidos a cada região específica na seção do membro.
- Para todas as amostras, sondar pelo menos 3 regiões diferentes por tipo de tecido.
NOTA: Em todos os casos, este estudo mediu 4 regiões no centro da cartilagem e 3 regiões na periferia da região da cartilagem e manteve o tecido ao microscópio por no máximo 1 h. - Assim que as medições de indentação terminarem, descarte ou fixe o tecido para análise posterior.
NOTA: As amostras foram fixadas após a conclusão das medições, colocando-as em tubos de 2 mL contendo solução de MEMFa e fixadas durante a noite a 4 ° C. MEMFa (etapa 1.17) foi usado, mas a solução de formaldeído a 4% (p / v) em PBS também pode ser usada.
6. (Opcional) Processamento de seções de tecido adjacentes
- Se as secções de tecido adjacentes forem utilizadas para coloração subsequente, coloque-as imediatamente após a secção num pequeno tubo de 2 ml contendo fixador e fixe-as durante a noite a 4 °C.
- Para revelar a arquitetura do tecido através da marcação do citoesqueleto e núcleos de actina, lave 3 vezes com PBS por 5 min cada para remover o fixador e core com uma solução contendo Alexa Fluor 488 conjugada Faloidina (1:250) e Hoechst 33258 (1:10000) em PBS por 1 h em RT em uma plataforma de balanço.
- Em seguida, imobilize as amostras coradas em cima de pratos com fundo de vidro usando 1% (p / v) lmp-agarose em APBS estabilizado a 37 ° C (a partir da etapa 1.9). Certifique-se de que a superfície de interesse esteja voltada para o vidro. Assim que a agarose solidificar, cubra as amostras com PBS para evitar a desidratação.
NOTA: As amostras intactas e de histólise são visualizadas com um microscópio confocal invertido (ampliação de 10x e seções ópticas de 8 μm). As imagens na Figura 1C são projeções máximas de 8 seções ópticas.
- Se a seção de tecido adjacente for usada para análise imediata a jusante que requer tecido fresco (como extração de RNA, incubação com corantes vivos, etc.), certifique-se de trabalhar rapidamente e usar um meio de cultura de células (da etapa 1.8) para garantir a maior integridade possível do tecido.
7. Análise e exibição de dados
- Para calcular o módulo de Young aparente, analise as curvas força-distância usando o modelo Hertz/Sneddon (Eq.1) para um penetrador esférico usando o software de processamento de dados JPK/Bruker, assumindo um coeficiente de Poisson de 0,5.
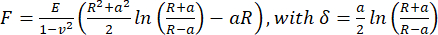 (Eq.1)
(Eq.1)
Onde R: raio do penetrador, E: módulo de elasticidade, ν: razão de Poisson, a: raio da área de contato circular entre o penetrador e a amostra, δ: profundidade de indentação. - Para análise viscoelástica, analise as partes de abordagem das curvas de força-indentação no PyJibe 0.15.0 com a extensão "Modelo Hertz corrigido para viscoelasticidade usando Kelvin-Voigt-Maxwell (KVM)" (escrito por Paul Müller, https://github.com/AFM-analysis/PyJibe)25. A função de ajuste é baseada em um modelo descrito por Abuhattum et al.26, integrando elementos do modelo de Kelvin-Voigt-Maxwell.
- Pré-processe as curvas de indentação de força para estimar o ponto de contato usando um ajuste por partes com uma linha (linha de base) e uma função de ajuste polinomial para a peça de aproximação.
- Ajuste as curvas de força-indentação ao "Modelo Hertz corrigido para viscoelasticidade usando o modelo Kelvin-Voigt-Maxwell (KVM)". A partir do ajuste, obtenha o módulo de Young não relaxado, o módulo de Young aparente e a viscosidade aparente. O modelo também oferece tempos de relaxamento e recuo de Maxwell.
NOTA: Em várias curvas de indentação de força analisadas (em particular o tecido intacto), os tempos de relaxamento de Maxwell foram significativamente maiores ou menores do que o tempo de indentação, o que indica um comportamento bastante elástico ou comportamento mecânico de Kelvin-Voigt, respectivamente.
- Exporte todas as medições para uma planilha e calcule a mediana dos módulos de Young aparentes por tipo de tecido e amostra.
- Plote e analise estatisticamente os dados com o software apropriado.
NOTA: O GraphPad Prism é usado aqui e, ao descrever os resultados, o estudo se refere à média ± DP da mediana dos módulos de Young aparentes medianos por amostra (exibidos na Figura 2D-F). - Exiba fatias ópticas de imagens confocais projetando-as com a função de projeção máxima de Fiji. Ajuste o brilho e o contraste de cada canal individual para uma visualização ideal de colorações fluorescentes.
- Gere um painel de figuras com o software apropriado.
NOTA: O Affinity Designer é usado para gerar os painéis e o modelo na Figura 1A é desenhado usando o Affinity Designer.
Resultados
Usando o protocolo descrito acima, medimos o módulo de Young aparente dos tecidos cartilaginosos dos membros do axolote em condições homeostáticas ("Intactas"), durante a histólise inicial da cartilagem e estágios posteriores de condensação da cartilagem (Figura 1A). Também investigamos as propriedades mecânicas dos elementos esqueléticos em diferentes regiões, incluindo seu centro e periferia, conforme mostrado nas imagens que descrevem a posiç...
Discussão
Aqui, demonstramos uma técnica para a medição da rigidez da cartilagem em membros de axolotes com AFM. No entanto, esse método também pode ser expandido para sondar outros tipos de tecido. Uma etapa fundamental para medições bem-sucedidas de AFM é a preparação da amostra, que provou ser particularmente desafiadora com amostras de axolotes. Descobrimos que sondar a superfície do tecido que ainda estava embutida no bloco de agarose era a melhor maneira de preservar a integridade...
Divulgações
Os autores declaram não haver conflitos de interesse
Agradecimentos
Agradecemos a todos os membros do laboratório Sandoval-Guzmán pelo apoio e companheirismo contínuos durante o desenvolvimento deste trabalho. Também somos gratos a Anja Wagner, Beate Gruhl e Judith Konantz por sua dedicação ao cuidado do axolote. Também agradecemos a Paul Müller por fornecer códigos para análise de dados AFM. Este trabalho foi apoiado pela Instalação de Microscopia de Luz da Plataforma Tecnológica CMCB da TU Dresden. AT é bolsista do Mildred Scheel Early Career Center Dresden P2, financiado pelo German Cancer Aid (Deutsche Krebshilfe). A RA é financiada por uma posição temporária de PI (Eigene Stelle) da Deutsche Forschungsgemeinschaft (DFG, Fundação Alemã de Pesquisa) - AI 214/1-1.
Materiais
| Name | Company | Catalog Number | Comments |
| Affinity Designer | Affinity | version 1.10.4 | For figure assembling |
| Agarose Low Melt | Roth | 6351.1 | For sample preparation |
| Alexa Fluor 488 Phalloidin | Invitrogen | A12379 | To stain tissue |
| Axiozoom | Zeiss | To image samplea under the AFM | |
| Benzocaine | Sigma-Aldrich | E1501 | To anesthetize the animals |
| Butorphanol (+)-tartrate salt | Sigma-Aldrich | B9156 | As analgesic |
| Cantilever | NanoWorld | Arrow TL1 | For AFM indentation measurements |
| Cellhesion 200 setup equipped with a motorstage | JPK/Bruker | For AFM indentation measurements | |
| CellSense Entry | For imaging in Stereoscope Olympus UC90 | ||
| Dulbecco’s Phosphate Buffered Saline (DPBS, 1x) | Gibco | 14190-144 | To clean samples and section under vibratome |
| FIJI (ImageJ2) | https://imagej.net/software/fiji | version 2.9.0/1.53t | For image processing |
| GraphPad Prism | GraphPad Software | (version 8.4.3) | To graph and statistically analyze the data |
| Heat-inactivated FBS | Gibco | 10270-106 | For cell culture medium |
| Histoacryl glue (2-Butyl-Cyanoacrylate) | Braun | To glue sample to petri dishes | |
| Hoechst 33258 | Abcam | ab228550 | To stain tissue |
| Insulin | Sigma-Aldrich | I5500 | For cell culture medium |
| Inverted confocal microscope | Zeiss | 780 LSM | To image tissue sections |
| Inverted confocal microscope | Zeiss | 980 LSM | To image tissue sections |
| JPK/Bruker data processing software | JPK/Bruker | SPM 6.4 | To analyze force-distance curves |
| L15 medium (Leibovitz) | Sigma | L1518 | For cell culture medium |
| L-Glutamine | Gibco | 25030-024 | For cell culture medium |
| Penicillin/Streptomycin | Gibco | 15140-122 | For cell culture medium |
| polystyrene beads ( 20 µm diameter); ) | microParticles | For AFM indentation measurements | |
| Pyjibe | written by Paul Müller https://github.com/AFM-analysis/PyJibe | 0.15.0 | For viscoelastic analysis |
| Stereoscope Olympus SX10 | Olympus | SX10 | For limb amputations and tissue mounting |
| Stereoscope Olympus UC90 | Olympus | UC90 | For imaging |
| Vibratome Leica | Leica | VT 1200S | For tissue sectioning |
Referências
- Mills, L. A., Aitken, S. A., Simpson, A. H. R. W. The risk of non-union per fracture: current myths and revised figures from a population of over 4 million adults. Acta Orthop. 88 (4), 434-439 (2017).
- Calori, G. M., et al. Non-unions. Clin Cases Miner Bone Metab. 14 (2), 186-188 (2017).
- Nandra, R., Grover, L., Porter, K. Fracture non-union epidemiology and treatment. Trauma. 18 (1), 3-11 (2016).
- Nauth, A., Schemitsch, E., Norris, B., Nollin, Z., Watson, J. T. Critical-size bone defects: Is there a consensus for diagnosis and treatment. J Orthop Trauma. 32 (3 Suppl), S7-S11 (2018).
- Schemitsch, E. H. Size matters: Defining critical in bone defect size. J Orthop Trauma. 31 (10), S20-S22 (2017).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: Salamanders. Development (Cambridge). 146 (14), 0 (2019).
- Aires, R., Keeley, S. D., Sandoval-Guzmán, T. Basics of Self-Regeneration. Cell Engineering and Regeneration. , (2020).
- Stocum, D. L. Mechanisms of urodele limb regeneration. Regeneration. 4 (4), 159-200 (2017).
- Bassat, E., Tanaka, E. M. The cellular and signaling dynamics of salamander limb regeneration. Curr Opin Cell Biol. 73, 117-123 (2021).
- Vinarsky, V., Atkinson, D. L., Stevenson, T. J., Keating, M. T., Odelberg, S. J. Normal newt limb regeneration requires matrix metalloproteinase function. Dev Biol. 279 (1), 86-98 (2005).
- Godwin, J., Kuraitis, D., Rosenthal, N. Extracellular matrix considerations for scar-free repair and regeneration: Insights from regenerative diversity among vertebrates. International J Biochem Cell Biol. 56, 47-55 (2014).
- Riquelme-Guzmán, C., et al. Osteoclast-mediated resorption primes the skeleton for successful integration during axolotl limb regeneration. ELife. 11, e79966 (2022).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. 362 (6413), aaq0681 (2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- Currie, J. D., et al. Live Imaging of Axolotl Digit Regeneration Reveals Spatiotemporal Choreography of Diverse Connective Tissue Progenitor Pools. Dev Cell. 39 (4), 411-423 (2016).
- Qin, T., et al. Single-cell RNA-seq reveals novel mitochondria-related musculoskeletal cell populations during adult axolotl limb regeneration process. Cell Death Differ. 28 (3), 1110-1125 (2021).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14, 174-187 (2014).
- Currie, J. D., et al. The Prrx1limb enhancer marks an adult subpopulation of injury-responsive dermal fibroblasts. Biol Open. 8, bio043711 (2019).
- Wagh, K., Ishikawa, M., Garcia, D. A., Stavreva, D. A., Upadhyaya, A., Hager, G. L. Mechanical regulation of transcription: Recent advances. Trends Cell Biol. 31 (6), 457-472 (2021).
- d'Angelo, M., et al. The role of stiffness in cell reprogramming: A potential role for biomaterials in inducing tissue regeneration. Cells. 8 (9), 1036 (2019).
- Akhtar, R., Sherratt, M. J., Cruickshank, J. K., Derby, B. Characterizing the elastic properties of tissues. Mater Today (Kidlington). 14 (3), 96-105 (2011).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nat Rev Phys. 1 (1), 41-57 (2019).
- El Kirat, K., Burton, I., Dupres, V., Dufrene, Y. F. Sample preparation procedures for biological atomic force microscopy. J Microsc. 218 (3), 199-207 (2005).
- Riquelme-Guzmán, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2021).
- López-Alonso, J., Eroles, M., Janel, S., et al. PyFMLab: Open-source software for atomic force microscopy microrheology data analysis [version 2; peer review: 2 approved]. Open Res Europe 2024. 3 (187), (2024).
- Abuhattum, S., Mokbel, D., Müller, P., Soteriou, D., Guck, J., Aland, S. An explicit model to extract viscoelastic properties of cells from AFM force-indentation curves. iScience. 25 (4), 104016 (2022).
- Glorieux, L., et al. In-depth analysis of the pancreatic extracellular matrix during development for next-generation tissue engineering. Int J Mol Sci. 24 (12), 10268 (2023).
- Hiratsuka, S., et al. Power-law stress and creep relaxations of single cells measured by colloidal probe atomic force microscopy. Jpn J Appl Phys. 48 (8 PART 3), 08JB17 (2009).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface energy and the contact of elastic solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Kondiboyina, V., Duerr, T. J., Monaghan, J. R., Shefelbine, S. J. Material properties in regenerating axolotl limbs using inverse finite element analysis. J Mech Behav Biomed Mater. 150, 106341 (2024).
- Calve, S., Simon, H. Biochemical and mechanical environment cooperatively regulate skeletal muscle regeneration. FASEB J. 26 (6), 2538-2545 (2012).
- Calve, S., Simon, H. G. Extracellular control of limb regeneration. IUTAM Symposium on Cellular, Molecular and Tissue Mechanics. IUTAM Bookseries. 16, 257-266 (2010).
- Kaufmann, R. A., Kozin, S. H., Barnes, A., Kalluri, P. Changes in strain distribution along the radius and ulna with loading and interosseous membrane section. J Hand Surg Am. 27 (1), 93-97 (2002).
- Martin, A. R., et al. Measurement of distal forearm bone mineral density: Can different forearm segments be used interchangeably. J Clin Densitom. 2 (4), 381-387 (1999).
- Riquelme-Guzmán, C., et al. In vivo assessment of mechanical properties during axolotl development and regeneration using confocal Brillouin microscopy. Open Biol. 12 (6), 220078 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados