É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo de rato de remodelamento cardíaco do lado direito e arritmia usando bandagem da artéria pulmonar
Neste Artigo
Resumo
A insuficiência cardíaca direita (ICD) é caracterizada por dilatação e hipertrofia cardíaca do lado direito, levando a disfunção ventricular e atrial. As condições cardiopulmonares associadas à ICD são acompanhadas por um risco aumentado de arritmias cardíacas. Este artigo descreve um modelo padronizado de FTE induzida por bandagem da artéria pulmonar associada a arritmogênese ventricular e atrial aumentada.
Resumo
Condições clínicas, incluindo doença pulmonar obstrutiva crônica ou hipertensão arterial pulmonar (HAP), podem levar à sobrecarga crônica da pressão do ventrículo direito e insuficiência cardíaca direita progressiva (ICD). A ICD pode ser identificada por hipertrofia cardíaca direita e dilatação associada à função miocárdica anormal que afeta o VD e o átrio direito (AR). Recentemente, demonstramos que a ICD grave é acompanhada por um risco aumentado de inflamação atrial, fibrose atrial e fibrilação atrial (FA), o tipo mais comum de arritmia cardíaca (AC). Estudos recentes mostraram que a inflamação do VD e da AR desempenha um papel importante na arritmogênese da CA, incluindo a FA. No entanto, o impacto da inflamação no desenvolvimento de AC e FA na ICD é pouco descrito.
Modelos experimentais de ICD são necessários para entender melhor a associação entre inflamação miocárdica direita e AC. O modelo de rato de hipertensão pulmonar (HP) induzida por monocrotalina (MCT) está bem estabelecido para provocar ICD. No entanto, o TCM desencadeia pneumotoxicidade grave e inflamação pulmonar. Portanto, a FTR induzida por TCM não ajuda a distinguir se a inflamação miocárdica subsequente se origina da ICD per se ou de sinais inflamatórios circulantes secretados pelo pulmão lesado.
Neste artigo, um método mecânico envolvendo bandagem do tronco da artéria pulmonar (PAB) foi usado para provocar arritmogênese cardíaca à direita. O PAB consiste na realização de uma sutura permanente do tronco da artéria pulmonar por 3 semanas. Tal abordagem gera maior sobrecarga de pressão do lado direito. No D21 pós-PAB, a sutura resulta em VD e AR hipertrofiados, dilatados e inflamados. A FTD induzida por PAB também é acompanhada por vulnerabilidade a arritmias ventriculares e atriais, incluindo FA.
Introdução
A insuficiência cardíaca direita (ICD) é caracterizada por hipertrofia e dilatação do ventrículo direito (VD) e do átrio (AR), levando ao mau funcionamento cardíaco do lado direito em resposta à sobrecarga pressórica crônica do VD devido à constrição das artérias pulmonares (AP)1. Assim, as condições que provocam o estreitamento da AF podem ser responsáveis por um risco aumentado de FCR 1,2,3,4. Os dados clínicos revelaram que a ICD é a principal causa de hospitalização (56%) em pacientes com hipertensão arterial (HAP)2. Estudos clínicos mostraram que, independentemente da causa da HAP, incluindo hipertensão pulmonar (HP) tromboembólica e HAP idiopática, os pacientes são frequentemente afetados por ICD e são 20% mais suscetíveis a desenvolver arritmias cardíacas, incluindo taquiarritmias supraventriculares e fibrilação atrial (FA)2,5,6.
Para melhor compreensão da associação entre HAP e ICD, estudos em animais, incluindo o modelo de dose única de monocrotalina (TCM), têm sido utilizados para provocar inflamação pulmonar grave e ICR 7,8. Recentemente, observamos que a ICD induzida por TCM foi associada à inflamação da AR e FA9. No entanto, devido à importância da inflamação pulmonar induzida por TCM e citocinas circulantes, foi difícil descrever se a inflamação da AR induzida por TCM é uma consequência apenas da ICD9. Assim, um novo modelo de arritmia cardíaca induzida por ICD foi necessário para estudar o estado inflamatório da AR.
O modelo experimental de bandagem do tronco do PA (PAB) tem sido utilizado em várias espécies animais para mimetizar doenças obstrutivas do PA e estudar o remodelamento cardíaco patológico associado ao lado direito do coração10. A PAB tem sido relatada como um método eficaz para induzir disfunção e falha do VD direito em vários estudos que mimetizam a sobrecarga do VD 10,11,12,13,14,15,16. Tecnicamente, o PAB é a colocação de uma sutura permanente no tronco do AP, provocando uma redução mecânica do diâmetro do tronco do AP10. O PAB gera uma sobrecarga de pressão aumentada para o VD10. Primeiro, como uma adaptação compensatória ao aumento súbito da pós-carga do VD, a cavidade do VD é dilatada, levando à hipertrofia crônica do VD10,13. A dilatação e hipertrofia do VD acometem as valvas tricúspide, que se tornam permeáveis13. Mais precisamente, a dilatação pronunciada do VD combinada com alta pós-carga do VD tem o efeito de alongamento do anel da valva tricúspide localizado entre o VD e o AR 13,17. Devido à oclusão incompleta da válvula, uma porção do sangue ejetado do VD durante a sístole será direcionada para a cavidade da AR17. O extravasamento da valva tricúspide pode ser observado através do ecocardiograma e é denominado regurgitação tricúspide17. Em seguida, a AR recebe pressão arterial inadequadamente elevada, contribuindo para o aumento da dilatação e hipertrofia da AR13. O remodelamento crônico do VD e da AR é acompanhado por reações inflamatórias miocárdicas locais, levando à fibrose do VD e da AR e perda de função 9,13. A fibrose cardíaca é caracterizada pelo desenvolvimento de zonas de baixa voltagem, menos contráteis e mais suscetíveis a provocar bloqueios de condução e circuitos de reentrada envolvidos no desenvolvimento de arritmias cardíacas, incluindo fibrilação ventricular eFA18,19.
A originalidade deste artigo reside na utilização de um método padronizado de remodelamento cardíaco do lado direito induzido por PAB para provocar e estudar a indutibilidade de arritmias cardíacas em 3 semanas pós-PAB. As principais vantagens dessa abordagem cirúrgica são: i) o controle direto sobre a redução do diâmetro do tronco do AP e ii) a prevenção da inflamação pulmonar para focar na inflamação miocárdica induzida por ICD para estudar arritmias cardíacas, incluindo FA.
A abordagem aqui descrita envolve um procedimento microcirúrgico preciso para criar o PAB, avaliação do aumento da pós-carga do VD, ecocardiografia para observar o remodelamento estrutural e funcional miocárdico induzido pelo PAB e estudo eletrofisiológico para avaliar a vulnerabilidade a arritmias cardíacas, incluindo FA.
Protocolo
Todos os procedimentos descritos abaixo foram aprovados pelo comitê de ética do Montreal Heart Institute (números de protocolo: 2021-2938-2021-47-01 e 2024-3412-2024-48-01) e seguiram rigorosamente as diretrizes do Conselho Canadense de Cuidados com Animais (CCAC). Ratos Wistar machos (225-275 g) com idade entre 6-8 semanas foram utilizados para os procedimentos. Todos os animais foram alojados na unidade de cuidados com animais do Montreal Heart Institute, com acesso gratuito a água e comida.
1. Preparo pré-operatório
- Esterilize todos os instrumentos e materiais cirúrgicos antes da cirurgia usando uma autoclave de vapor saturado de alta pressão a temperaturas entre 121 °C e 134 °C abaixo de 15-30 psi por 30-40 min, seguido por um ciclo de secagem de 25 min.
- Prepare todos os volumes de medicamentos necessários para a cirurgia. Use uma abordagem analgésica multimodal envolvendo buprenorfina (0,05 mg / kg) e cetoprofeno (5 mg / kg) injetados por via subcutânea 30 minutos antes da cirurgia e repetidos 6 h (buprenorfina) e 24 h pós-cirurgia (buprenorfina e cetoprofeno). Além disso, realizar uma analgesia local no local da incisão (lidocaína 5 mg/mL).
- Realize uma ecocardiografia transtorácica basal antes da cirurgia (consulte o procedimento detalhado para ecocardiografia transtorácica nas etapas 6.1-6.13.) para determinar o diâmetro do PA e selecione a agulha de medição apropriada que será usada como eletrodo para gerar a redução esperada de 60% do diâmetro do PA durante o PAB.
NOTA: Neste trabalho, foram utilizados ratos Wistar machos de 225-275 g, e a utilização de uma agulha de 19 G foi adequada para gerar uma redução de 60% do diâmetro do PA. - Prepare uma agulha de 19 G (ou o calibre apropriado, conforme determinado na etapa 1.3) que será usada como eletrodo (veja abaixo: etapas 4.18 e 4.19) para obter uma constrição ideal do tronco da AP, provocando remodelação severa do coração do rato. Usando uma pinça, dobre o 19 G para 90-110° (Figura 1A).
NOTA: A flexão do 19 G facilita i) o posicionamento próximo ao tronco do PA e ii) a aplicação da ligadura durante o procedimento. O 19 G é usado como eletrodo em torno do qual a sutura será instalada para reduzir o diâmetro do PA para 1,0 mm (redução de 60% para ratos com peso de 225-275 g), o que induz uma sobrecarga pressórica significativa do VD responsável pelo remodelamento grave do VD em 3 semanas.
2. Indução da anestesia e preparação do animal
NOTA: As análises foram realizadas em ratos Wistar machos (225-275 g) com idade entre 6 e 8 semanas. Use uma almofada de aquecimento durante todas as etapas dos procedimentos a seguir para manter a temperatura corporal do animal em torno de 37 °C. Aplique uma sonda retal para monitorar a temperatura corporal.
- Anestesiar o animal com isoflurano 3% inalado continuamente e oxigênio 100% 2-3 L/min.
- Aplique gel lubrificante para os olhos para proteger a córnea da dessecação.
- Verifique o nível de anestesia usando o reflexo de pinça do dedo do pé.
3. Intubação
NOTA: A intubação foi realizada conforme descrito anteriormente20.
- Transfira o animal para uma estação de intubação inclinada em decúbito dorsal. Segure o rato pelos incisivos superiores usando um laço de fio para manter o corpo em posição suspensa a 45° para obter uma melhor visualização da garganta.
- Direcione uma fonte de luz flexível para a superfície do pescoço para transiluminar através da região faringoepiglótica.
- Estenda a língua usando um cotonete e estabilize-a na maxila com uma espátula de pesagem curva como abaixador da língua.
- Visualize a traqueia e as cordas vocais.
- Use um angiocateter de 16 G para realizar a intubação. Use o cateter como tubo traqueal e embote a agulha de ponta chanfrada para usar como introdutor.
- Avançar o tubo endotraqueal (angiocateter 16 G) montado no introdutor (agulha de ponta chanfrada) na traqueia e, uma vez posicionado, remover o introdutor (Figura 1B).
- Confirme a posição correta do tubo observando um padrão respiratório normal (cerca de 80 respirações/min para ratos com peso de 225 g e cerca de 70 respirações/min para ratos com peso de 275 g) e a presença de névoa na superfície da espátula de metal (ou pequeno espelho) quando colocada no flange do cubo da cânula.
- Uma vez intubado corretamente, transfira rapidamente o animal para a estação cirúrgica em decúbito dorsal sobre uma almofada de aquecimento homeotérmico.
- Ajuste o volume corrente e a taxa do ventilador de acordo com o peso corporal do rato. Ratos em torno de 225-275 g recebem um volume corrente de 2,0-2,5 mL e 70-80 respirações/min com o ventilador.
- Conecte o tubo endotraqueal ao ventilador para iniciar a ventilação mecânica. Coloque a ponta de saída do ventilador em um cilindro de água. As bolhas de ar que saem do fluxo de saída após cada respiração indicam uma intubação bem-sucedida.
- Uma vez estabelecida a respiração constante, prenda o tubo endotraqueal com fita cirúrgica e fixe a sonda retal ao longo da cauda para monitorar a temperatura corporal.
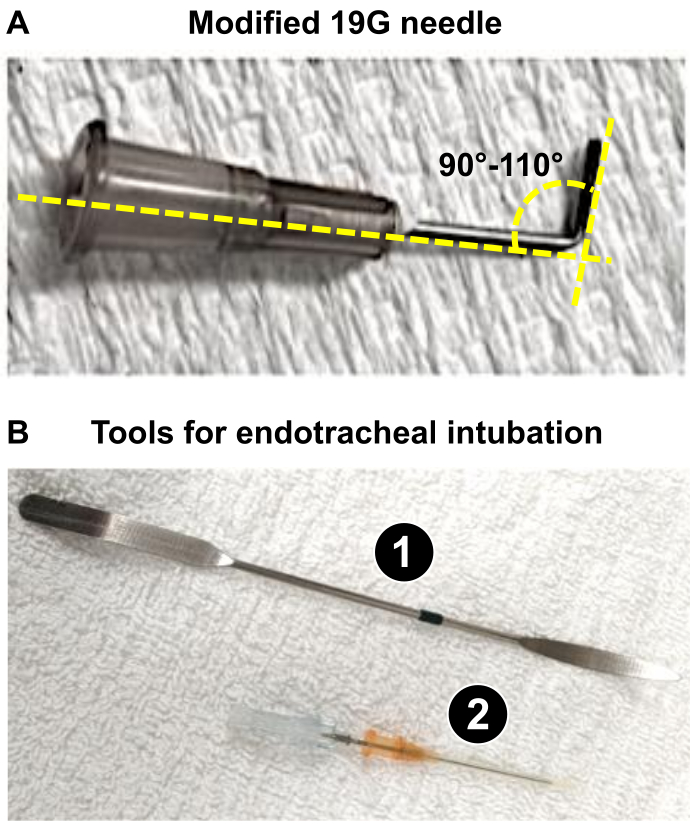
Figura 1: Principais instrumentos necessários para a preparação do procedimento microcirúrgico de PAB. (A) Agulha modificada de 19 G usada como eletrodo para obtenção de um diâmetro de 1 mm do tronco do AP após PAB. (B) Ferramentas endotraqueais usadas ou intubação bem-sucedida de ratos. 1. A espátula é usada como abaixador de língua em ratos anestesiados para expor a traqueia. 2. O cateter 16G atua como um tubo endotraqueal após embotar a ponta de sua caneta. Clique aqui para ver uma versão maior desta figura.
4. Cirurgia PAB (Figura 2)
NOTA: Todos os procedimentos devem ser realizados de acordo com técnicas rigorosas de cirurgia asséptica.
- Raspe o lado esquerdo do tórax usando um aparador e creme depilatório e prepare a pele com aplicações de clorexidina a 2% seguidas de esfoliações com álcool a 70% (repetidas três vezes).
- Imobilize os membros anteriores em posição aberta com fita adesiva, tomando cuidado para não estender demais os membros para evitar afetar a respiração.
- Puxe o membro posterior direito ligeiramente para baixo e fixe-o ao longo da cauda.
- Estenda e aduza o membro posterior esquerdo e fixe-o no lado direito do animal para gerar uma leve posição lateral direita, expondo o lado esquerdo do tórax.
- Use luvas estéreis nesta etapa para o restante da cirurgia.
- Posicione uma cortina estéril sobre o animal e faça uma incisão na pele de 2-3 cm no lado esquerdo do tórax, começando cerca de 2 cm acima do processo xifóide e orientada diagonalmente em direção à base do membro anterior esquerdo do rato.
- Sob a pele, separe os músculos peitorais subsequentemente (peitoral menor e maior) e mova-os para o lado por dissecção romba usando uma tesoura de ponta redonda. Use afastadores magnéticos para segurar os músculos, para permitir a visualização adequada da caixa torácica localizada embaixo.
- Desinfle os pulmões removendo o tubo de saída (conectado ao ventilador) do cilindro de água (consulte a etapa 3.10). A remoção do tubo de saída da água diminui a pressão nos pulmões, o que gera a desinflação dos lóbulos.
- Realize uma toracotomia do lado esquerdo com pinça de dissecação curva. Faça um pequeno orifício na linha clavicular média do músculo localizado entre a3ª e a4ª costelas.
- Introduza a pinça curva na abertura e deslize-a ao longo da parede interna esquerda do músculo entre as duas costelas para levantar levemente a parede torácica esquerda e evitar tocar nos pulmões ao cortar o músculo.
- Use a pinça introduzida como guia e faça uma incisão longitudinalmente às costelas em aproximadamente 1 cm com uma tesoura de íris. Mantenha a parede torácica esquerda levantada e manipule a tesoura com cuidado para evitar danificar os lobos pulmonares esquerdos diretamente abaixo.
- Expanda a incisão intercostal para 1-2 cm à esquerda do animal usando uma tesoura de ponta redonda.
- Reposicione os afastadores sob as costelas para manter a ferida aberta.
- Observe a parte inferior do timo e uma porção do lobo esquerdo do pulmão.
- Afaste o timo e os pulmões neste nível, dado o espaço significativo ocupado por esses órgãos. Separe os lobos do timo usando dissecção romba com fórceps e segure o pulmão do lado esquerdo usando gaze úmida. Em seguida, exponha a porção superior do coração, o átrio esquerdo (AE), bem como o tronco pulmonar e o arco aórtico.
- Disseque cuidadosamente a fina camada de pericárdio que cobre o coração nesta área, juntamente com qualquer tecido adiposo aderido, para ajudar a localizar a porção onde a aorta e o tronco pulmonar ainda estão presos. Disseque minimamente o pericárdio e evite tocar na membrana pleural.
- Insira a pinça curva em posição fechada no espaço entre o apêndice AE e o tronco pulmonar, no meio da porção visível do vaso, para alcançar o outro lado do vaso (Figura 2A).
CUIDADO: Evite trabalhar muito perto da raiz aórtica do coração para evitar o risco de ruptura do vaso e hemorragia. - Visualize a ponta da pinça através da membrana conjuntiva cranialmente ao tronco pulmonar. Use a segunda pinça para dissecar sobre a ponta e perfure cuidadosamente a membrana para criar uma pequena abertura. As pinças curvas posicionadas sob o tronco pulmonar são então ligeiramente abertas para agarrar um fio de seda 5-0. Retraia a pinça para trazer o fio de um lado para o outro do tronco pulmonar (Figura 2B, C).
- Realize a constrição do tronco pulmonar. Em primeiro lugar, pratique um nó duplo solto do 5-0 Silk perto da artéria. Insira a agulha de 19 G ao longo do recipiente e sob o fio. Aperte este primeiro nó e fixe-o com um segundo nó simples antes de remover o 19 G (Figura 2D).
CUIDADO: Trabalhe rápida e cuidadosamente para minimizar a duração da obstrução completa do tronco pulmonar. - Faça um último nó simples e corte o fio de seda 5-0 restante a cerca de 0,5-1 cm do nó (Figura 2D).
- Reposicione os lobos do timo e remova os afastadores do tórax.
- Encha novamente os pulmões beliscando a saída do ventilador por 2 s.
- Feche a caixa torácica executando um padrão de ponto de cruz com um fio de sutura sintético absorvível 5-0.
- Aplique algumas gotas de soro fisiológico a 0,9% sobre a área da ferida e comprima cada lado da parede torácica para remover bolhas de ar e restabelecer a pressão negativa torácica.
- Reposicione os músculos peitorais e limpe o soro fisiológico restante com uma gaze estéril.
- Use uma seringa para aplicar um bloco de lidocaína na superfície e na área circundante da ferida.
- Feche a pele usando um fio de sutura sintético absorvível 5-0 com agulha em um padrão subcuticular contínuo.
NOTA: Os ratos simulados recebem o mesmo procedimento sem as etapas 4.18 e 4.19.
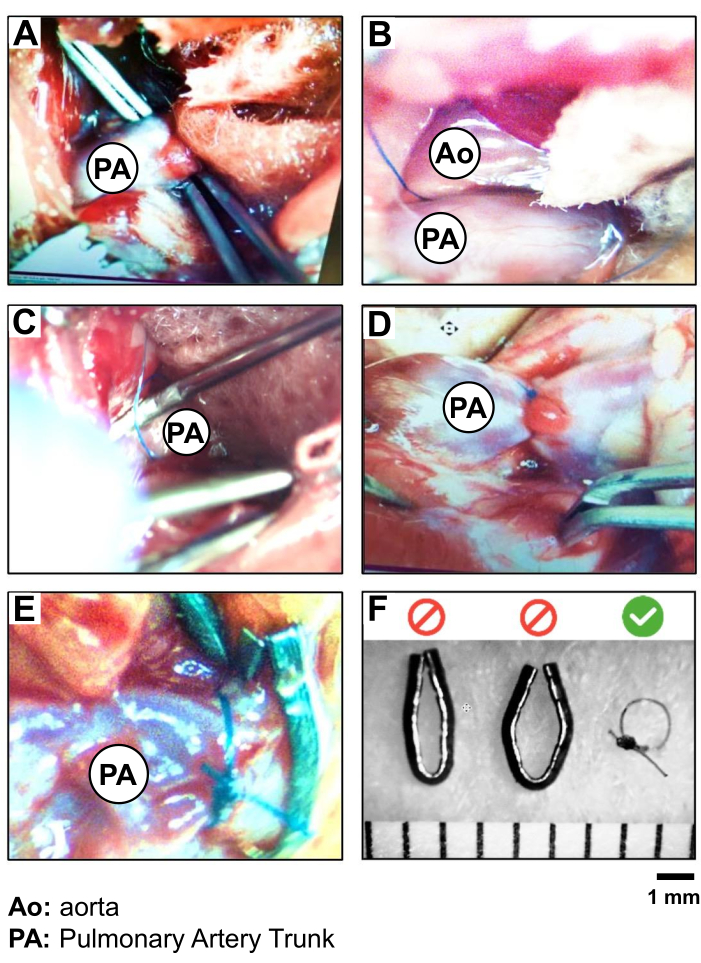
Figura 2: Procedimento PAB e validação da sutura de seda 5.0 versus clipes metálicos. Fotografia do isolamento e ligadura passo a passo do tronco do AP, mostrando (A) a exposição e isolamento do tronco do PA, (B) o posicionamento da sutura (seda 5.0) ao redor do tronco do AP, (C) a ligadura do PA (PAB) (usando uma agulha 19G como eletrodo); (D) a verificação do movimento cardíaco e da sobrecarga da raiz do AP e do VD após o PAB; (E) uma comparação do PAB realizado com sutura de seda versus um clipe de metal; e (F) a validação da escolha da sutura de seda para PAB para criar um diâmetro mais reprodutível de 1 mm ao redor do tronco do PA. Clique aqui para ver uma versão maior desta figura.
5. Recuperação pós-operatória
- Remova o isoflurano enquanto mantém o rato sob ventilação mecânica apenas com fluxo de oxigênio. Vire o rato para o lado direito ou ventral para facilitar a respiração.
- Injete um volume de soro fisiológico a 0,9% por via subcutânea na região dorsal do pescoço para promover a recuperação de fluidos (calculado como 10 mL/kg/h de anestesia).
- Assim que a respiração autônoma for confirmada, remova suavemente o tubo endotraqueal.
- Observe quando o rato começa a se mover sozinho e transfira o animal da almofada de aquecimento para uma nova gaiola estéril para recuperação. Forneça água e comida úmida ad libitum.
- Durante o período pós-operatório (4-6 h), coloque a gaiola sobre uma almofada de aquecimento (metade da gaiola) para ajudar a manter a temperatura corporal e monitorar de perto o animal.
- Gerencie prontamente quaisquer sinais de dor, dificuldade respiratória ou comportamento anormal.
- Nos cuidados pós-operatórios, 6 h após a cirurgia, injetar uma segunda dose de 0,05 mg/kg de buprenorfina. No dia seguinte, 24 h após a cirurgia, injetar uma terceira dose de 0,05 mg/kg de buprenorfina e uma segunda dose de 5 mg/kg de cetoprofeno.
- Monitore os ratos até sua recuperação completa da saúde.
6. Ecocardiografia transtorácica
NOTA: Este trabalho mostra os dados obtidos no 21º dia de pós-operatório, quando os ratos foram submetidos ao ecocardiograma transtorácico. No entanto, dependendo dos objetivos da pesquisa e dos requisitos do desenho do estudo, os pesquisadores podem definir outros pontos de tempo para a ecocardiografia transtorácica pré e pós-PAB.
- Realize uma ecocardiografia transtorácica basal antes da cirurgia para determinar o diâmetro do PA e selecionar a agulha de calibre apropriada usada como eletrodo para gerar a redução esperada de 60% do diâmetro do PA durante o PAB.
NOTA: Neste estudo, foram utilizados ratos Wistar machos de 225-275 g e a utilização de uma agulha de 19 G foi adequada para gerar uma redução de 60% do diâmetro do PA. - Pesar e anestesiar os ratos com isoflurano continuamente inalado (3% e 2 L/min O2).
- Realizar ecocardiografia transtorácica em cada animal usando uma sonda setor/multielemento 12S (4,5-11,5 MHz) e um sistema de aquisição de imagem.
- Use o mapeamento de cores em uma visão de eixo curto paraesternal bidimensional (2D) posicionando a sonda 12S no nível da válvula aórtica. Clique no botão Doppler colorido na máquina de eco para visualizar o padrão de fluxo sanguíneo cruzando a área de bandagem da artéria pulmonar (PAB) no tronco pulmonar.
- Realize o Doppler de onda contínua (CW) cruzando o PAB guiado por mapeamento colorido na visão paraesternal de eixo curto 2D para registrar as propriedades do fluxo sanguíneo que atravessa a área do PAB, incluindo a velocidade de pico (cm/s) e o gradiente de pressão média (mmHg). Para obter as curvas de Doppler, ajustar o volume da amostra ao nível da bandagem da artéria pulmonar.
- Aplique uma visão apical 2D de 4 câmaras posicionando a sonda 12S ao nível do ápice do coração para demonstrar o aumento da AR e do VD após a cirurgia e determine a dimensão horizontal da AR no final da sístole cardíaca (RADs) expressa em milímetros (mm).
- Aplique o mapeamento de cores na visualização apical 2D de 4 câmaras para revelar a regurgitação tricúspide devido ao PAB adquirindo cine-loops na máquina de eco.
- Realize a ecocardiografia do modo M na visão apical de 4 câmaras cruzando a conjunção do anel tricúspide e da parede lateral do VD para estudar a excursão sistólica do plano do anel tricúspide (TAPSE) expressa em mm.
- Use a imagem Doppler tecidual (TDI) na visão apical de 4 câmaras ao nível da conjunção do anel tricúspide e da parede lateral do VD para a medição da contratilidade sistólica (Sr) da parede lateral do VD expressa em centímetros por segundo (cm/s) para avaliar o desempenho sistólico do VD.
- Registre o fluxo transtricúspide diastólico (TTF) usando Doppler de onda pulsada na visão apical de 4 câmaras para estudar as propriedades diastólicas do VD, incluindo velocidade de pico na onda de enchimento inicial (E), onda de enchimento atrial (A) e a proporção de E/A no TTF.
- Realize a ecocardiografia do modo M na visão paraesternal do eixo longo ao nível da válvula aórtica para medir a via de saída do VD no final da diástole cardíaca (VSVD, expressa em milímetros) e a dimensão do átrio esquerdo no final da sístole cardíaca (LADs, expressa em milímetros).
- Realizar ecocardiografia 2D M-Mode na visão paraesternal de eixo curto ao nível dos músculos papilares para avaliar as dimensões do VE no final da sístole e diástole (LVDs e LVDd); e espessura da parede anterior do VE no final da diástole (VDVEd), todos expressos em milímetros.
- Execute o modo M 2D na visão paraesternal de eixo curto para determinar o encurtamento fracionário do VE (LVFS, expresso em porcentagem) e a fração de ejeção do VE (LVEF, expressa em porcentagem).
7. Estudo eletrofisiológico (Figura 3)
- Manter os ratos sob anestesia após ecocardiografia in vivo para estudo eletrofisiológico transesofágico (EPS) in vivo .
- Insira os eletrodos de ECG sob a pele dos ratos (1 perto do membro anterior esquerdo, 1 perto do membro posterior direito e 1 perto do membro posterior esquerdo).
- Introduza suavemente um cateter quadripolar 4F com uma distância interpolar de 5 mm no esôfago (Figura 3A).
- Ajuste a posição do cateter transesofágico próximo à AR, determinando com precisão quando a onda P, que representa as contrações atriais no ECG de superfície, corresponde à onda P obtida com o ECG do cateter transesofágico (Figura 3A, B).
- Determine o limiar de estimulação para cada animal. Esse limite é a voltagem mínima na qual o estimulador influencia diretamente a frequência cardíaca.
- Avalie a vulnerabilidade da FA aplicando uma rajada de tensão equivalente a 4 vezes a tensão limite seguindo um protocolo de 3 séries de 12 rajadas de estimulação, cada uma com duração de 3 s a 50 Hz, seguidas de 2 s de repouso (1 min/série). Entre cada série, os ratos tiveram um período de repouso de 1 min 9,13,21.
- Identificar e quantificar, após cada explosão, a ocorrência de taquiarritmias cardíacas, incluindo FA ou flutter atrial.
NOTA: A FA é definida como batimentos atriais irregulares e ultrarrápidos (>800 bpm). O flutter atrial é definido como um ritmo atrial regular, mas rápido, associado à ausência da onda P ou à presença de um padrão regular de múltiplas ondas P entre intervalos RR regularmente consecutivos. Apenas episódios arrítmicos com duração superior a 1 s são considerados. - Evite interromper episódios contínuos de FA ou flutter atrial interrompendo o próximo conjunto de estímulos se o ritmo sinusal não for recuperado por conta própria dentro do período de repouso entre duas estimulações consecutivas.
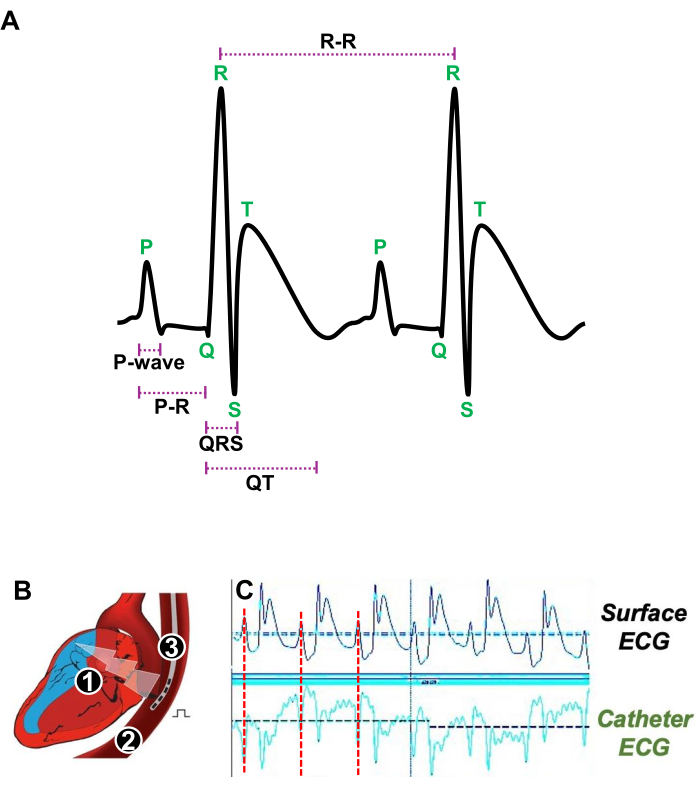
Figura 3: Ilustração dos batimentos cardíacos em repouso e a posição apropriada de um cateter transesofágico para estudo eletrofisiológico in vivo . (A) ECG representativo de dois batimentos cardíacos consecutivos em repouso mostrando a onda P, o intervalo PR, o complexo QRS, o intervalo QT e o intervalo RR. (B) Esquema de uma seção longitudinal do coração (1) e do esôfago (2) em que um cateter quadripolar (3) é introduzido para estimular e adquirir ECG atrial. (C) Sinais de ECG representativos mostrando a posição preferida do cateter transesofágico quando o sinal atrial (linha vermelha) do ECG de superfície (traços superiores) coincide com o sinal atrial do ECG do cateter (traços inferiores). Clique aqui para ver uma versão maior desta figura.
8. Análise de ECG
NOTA: Os registros e estímulos de ECG foram realizados usando um software de aquisição de ECG. As análises foram realizadas por meio de um software de análise de ECG (Figura 3A).
- Meça a duração da onda P correspondente à contração atrial expressa em milissegundos (ms).
- Determine o intervalo PR (expresso em milissegundos) correspondente à duração da condução elétrica através do nó atrioventricular (AV).
- Relate a duração do complexo QRS (expressa em milissegundos) correspondente à despolarização ventricular.
- Avaliou-se o intervalo QT (expresso em milissegundos) refletindo a duração total da despolarização e repolarização ventricular.
- Quantifique o intervalo RR (expresso em milissegundos) indicando a duração entre dois batimentos cardíacos consecutivos e determinando a frequência cardíaca.
9. Análises histológicas
- Eutanasiar os ratos por exsanguinação sob anestesia com isoflurano (5%, 2 L/min O2) no dia 21 pós-PAB.
- Isolar a AR e o AE para analisar o remodelamento histológico atrial associado ou não à ICD e às arritmias cardíacas.
- Realizar um corte transversal dos corações recém-excisados, a 5 mm do ápice, para avaliar o remodelamento ventricular associado ou não à ICD e arritmias cardíacas.
- Fixar as amostras miocárdicas em formalina e corar as lâminas histológicas com solução tricrômica de Masson22 para quantificar a espessura e dilatação da parede ventricular e fibrose atrial em D21 pós-PAB.
10. Análises estatísticas
- Avalie a normalidade das distribuições pelo teste de Shapiro-Wilk. Compare os dados normalmente distribuídos usando o teste t de Student.
- Se os dados forem distribuição não paramétrica, execute um teste de Mann-Whitney. Analise variáveis categóricas como indutibilidade de FA usando o teste exato de Fisher.
- Expresse os resultados como média ± erro padrão para a média (S.E.M.). Considere as diferenças estatisticamente significativas em valores de P bicaudal < 0,05.
Resultados
Confirmação visual da ligadura adequada do tronco PA durante a cirurgia
Durante o procedimento de PAB, uma indicação de bom posicionamento da sutura é um aumento imediato da pressão arterial e dilatação imediata do VD e da raiz do tronco do PA na junção com o VD. A sutura não deve se mover para garantir uma sobrecarga de pressão constante e permanente por 3 semanas. Neste estudo, o uso de um Silk 5-0 foi validado como mais estável do que um clipe de metal...
Discussão
O desempenho bem-sucedido do PAB é a parte mais crucial deste protocolo. É importante distinguir adequadamente a aorta e o tronco da AP. O isolamento do PA deve ser realizado meticulosamente para evitar lacrimejamento, sangramento e morte durante o procedimento. A aplicação da sutura ao redor do eletrodo 19G deve ser realizada rapidamente e seguida pela remoção imediata do eletrodo, para evitar "obstrução completa" do AP por muito tempo devido à presença do eletrodo.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores agradecem a Colombe Roy, YanFen Shi, Sandra Querry e Josiane Deslandes pelo desempenho técnico da ecocardiografia transtorácica e a Nathalie L'Heureux pela assistência técnica preliminar durante a padronização do método PAB. Somos gratos aos membros do centro de cuidados com animais do Montreal Heart Institute.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chlorine Injection USB (100 ml) | Baxter | JB1302P | Solution used for drugs (analgesic and anti-inflammatory) dilution and for preparing saline water syringes dedicated to rehydrating the animal after the surgery |
| 19 G x 1 1/2 PrecisionGlide Needle | BD | 305187 | Needle modified (bent and blunted) to be used as a spacer during for the partial constriction of the pulmonary trunk |
| 2" x 2" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply | AMD-Ritmed | A2101-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 4" x 4" Non Woven Non-Sterile Ritmed Gauze Sponge, 4-Ply (x200) | AMD-Ritmed | A2100-CH | Gauze sponges used to absorb blood from the wound or to gently push organs (ex: thymus) aside. |
| 5-0 Vicryl Violet Suture RB-1 1/2 Circle Needle 17mm 27" | Ethicon | J303H | Synthetic absorbable sterile surgical suture with a taperpoint needle used for muscle and skin wounds closure. |
| Anafen (100 mg/mL) | Merial Canada, Inc. | 1938126 | Diluted injectable solution of ketoprofen administered as a nonsteroidal anti-inflammatory, analgesic and antipyretic drug. |
| AutoClip System | FST | 12020-00 | Can be used to close the skin wound. Includes a clip applier, wound clips (9 mm) and a clip remover. |
| Dumont #5/45 Forceps | FST | 11251-35 | Dumoxel forceps with tips angled at 45°. Used to tighten the knots around the spacer placed on the pulmonary trunk. |
| Fine Scissors - Sharp | FST | 14060-10 | Stainless steel iris scissors dedicated to intercostal muscles incision and suture cutting. |
| Forane (Isoflurane) 100 mL | Baxter Canada | BAXCA2L9100 | Inhalation anesthetic used for rodents during their PAB surgery. |
| IV Catheter 16 G x 1.77 " (Straight) | BD Insyte | 381257 | Catheter used as an endotracheal tube with its metal stylet blunted. |
| Light LED 130 F - DrMach | Eickemeyer | M130300 | LED wall mounted light. |
| Magnetic Fixator Retraction System: Base plate | FST | 18200-50 | Metal plate on which the associated fixtures are installed. It is placed around the heating plate. |
| Magnetic Fixator Retraction System: Elastomer (2 m Roll) | FST | 18200-07 | Used to attach the retractors to the fixators. |
| Magnetic Fixator Retraction System: Fixators | FST | 18200-02 | Movable anchors that can be placed on the base plate. |
| Magnetic Fixator Retraction System: Retractors | FST | 18200-11 | Retractors allowing to maintain the surgical wound with the desired opening |
| Metzenbaum Scissors (Curved) | FST | 14017-14 | Stainless steel blunt scissors used for blunt dissection of the skin and muscles. |
| Micro-Adson Forceps | FST | 11018-12 | Stainless steel serrated forceps used to grasp skin and other tissues. |
| Oster Golden A5 2-Speed Clipper | Oster Professional | 34264416949 | Pet grooming clipper used to prepare the surgical field. Since it's meant to be used with large animals, the user needs to be careful with rats. |
| Rodent heating plate or warming system | Custom made | N/A | Plate connected to a unit equipped with a LED screen displaying the temperature detected by the rectal probe as well as the target temperature. |
| Rodent Ventilator Model 683 | Harvard Apparatus | 74240-2 | Mechanical ventilator used for small laboratory animals (max 5 kg). |
| Semken Forceps with Serrations (Curved) | FST | 11009-13 | Stainless steel forceps used for tissue dissection. |
| Semken Forceps with Serrations (Straight) | FST | 11008-13 | Stainless steel forceps used for tissue dissection. |
| Silky Fresh Hair removal Cream | Veet | 62200825036 | Hair removal product used to prepare the surgical site after shaving. |
| Soluprep | 3M | 103.26 | Bottled antiseptic solution tinted with 2% chlorhexidine and 70 % alcohol 225 mL. |
| Stainless steel spatula 195 mm | Heathrow Scientific | HS15907 | Spatula used as a tongue depressor during rat intubation. |
| Stereomicroscope System SZ61TR | Olympus | 88-126 | Microscope equipped with binoculars and a built-in camera allowing for video filming. |
| Sterile Sodium Chloride 0.9% Irrigation Bottle (60 mL) | Saline H2O | 25-6048SA-L | Solution used to keep the wound moist throughout the surgery. |
| Surgical Scissors - Sharp-Blunt (Straight) | FST | 14001-12 | Stainless steel scissors used to make the initial skin incision. |
| Suture 5-0 Silk No Needle | Henry Schein | 102-6344 | Silk thread used to do the constriction of the pulmonary trunk |
| Systane Ointment | Alcon | 2444062 | Eyes lubricant providing a temporary relief of burning and irritation caused by the dryness of the eyes during surgery. |
| SZ2-STU2 stereomicroscope stand | Olympus | N1198900 | The arm attached to the base provides a great freedom of movement to the microscope head. |
| Tissue forceps - 1X2 Teeth | FST | 11021-15 | Stainless steel forceps allowing to grasp, hold and manipulate tissues (skin and muscles). |
| Transpore Surgical Tape | 3M | 1527-1 | Medical tape used to immobilized the rats' forelimbs and hindlimbs. |
| Vetbond Tissue Adhesive (3 mL) | 3M | 1469SB | Surgical glue that can be applied in small amounts on the skin It can be used as a complement to subcutaneous sutures. |
| Vetergesic Multidose (0.3 mg/mL) 10 mL | Ceva Canada | 2342510 | Diluted injectable solution of buprenorphine administered as an analgesic drug. |
| Veterinary anesthesia evaporator Tec 4 | Dispomed | 34001 Iso | Enables vaporization of isoflurane and concentration at 0–5%. |
Referências
- Cassady, S. J., Ramani, G. V. Right heart failure in pulmonary hypertension. Cardiol Clin. 38 (2), 243-255 (2020).
- Campo, A., et al. Outcomes of hospitalization for right heart failure in pulmonary arterial hypertension. Eur Respir J. 38 (2), 359-367 (2011).
- Naeije, R., Manes, A. The right ventricle in pulmonary arterial hypertension. Eur Respir Rev. 23 (134), 476-487 (2014).
- Vonk-Noordegraaf, A., et al. Right heart adaptation to pulmonary arterial hypertension: physiology and pathobiology. J Am Coll Cardiol. 62 (25 Suppl), D22-D33 (2013).
- Olsson, K. M., Nickel, N., Tongers, J., Hoeper, M. M. Atrial flutter and fibrillation in patients with pulmonary hypertension. Int J Cardiol. 167 (5), 2300-2305 (2013).
- Mercurio, V., et al. Pulmonary arterial hypertension and atrial arrhythmias: incidence, risk factors, and clinical impact. Pulm Circ. 8 (2), 2045894018769874 (2018).
- Dignam, J. P., Scott, T., Kemp-Harper, B., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2021).
- Silva, A. L., et al. Monocrotaline induces acutely cerebrovascular lesions, astrogliosis and neuronal degeneration associated with behavior changes in rats: A model of vascular damage in perspective. Neurotoxicology. 94, 59-70 (2023).
- Hiram, R., et al. Right atrial mechanisms of atrial fibrillation in a rat model of right heart disease. J Am Coll Cardiol. 74 (10), 1332-1347 (2019).
- Hirata, M., et al. Novel model of pulmonary artery banding leading to right heart failure in rats. Biomed Res Int. 2015, 753210 (2015).
- Jalal, Z., et al. Unexpected internalization of a pulmonary artery band in a porcine model of tetralogy of Fallot. World J Pediatr Congenit Heart Surg. 8 (1), 48-54 (2017).
- Akazawa, Y., et al. Pulmonary artery banding is a relevant model to study the right ventricular remodeling and dysfunction that occurs in pulmonary arterial hypertension. J Appl Physiol. 129 (2), 238-246 (2020).
- Le Quilliec, E., et al. Atrial cardiomyocytes contribute to the inflammatory status associated with atrial fibrillation in right heart disease. Europace. 26 (4), euae082 (2024).
- Cheng, H. W., et al. Assessment of right ventricular structure and function in mouse model of pulmonary artery constriction by transthoracic echocardiography. J Vis Exp. (84), e51041 (2014).
- Cheng, T. C., Philip, J. L., Tabima, D. M., Hacker, T. A., Chesler, N. C. Multiscale structure-function relationships in right ventricular failure due to pressure overload. Am J Physiol Heart Circ Physiol. 315 (3), H699-H708 (2018).
- Mamazhakypov, A., Veith, C., Schermuly, R. T., Sydykov, A. Surgical protocol for pulmonary artery banding in mice to generate a model of pressure-overload-induced right ventricular failure. STAR Protoc. 4 (4), 102660 (2023).
- Prihadi, E. A., et al. Morphologic types of tricuspid regurgitation. Characteristics and prognostic implications. JACC: Cardiovasc Imaging. 12 (3), 491-499 (2019).
- Samson, N., Paulin, R. Epigenetics, inflammation and metabolism in right heart failure associated with pulmonary hypertension. Pulm Circ. 7 (3), 572-587 (2017).
- Liu, Z., et al. Low-voltage zones as the atrial fibrillation substrates: Relationship With initiation, perpetuation, and termination. Front Cardiovasc Med. 8, 705510 (2021).
- Tomasello, G., et al. Simple and fast orotracheal intubation procedure in rats. Acta Biomed. 87 (1), 13-15 (2016).
- Halațiu, V. B., Perian, M., Balan, A. I., Scridon, A. Transesophageal atrial burst pacing for atrial fibrillation induction in rats. J Vis Exp. (180), e63567 (2022).
- Prophet, E. B., Mills, B., Arrington, J. B., Sobin, L. H. . Laboratory Methods in Histotechnology. , (1992).
- Silva, J. M. A., et al. Hypertrophy of the right ventricle by pulmonary artery banding in rats: a study of structural, functional, and transcriptomics alterations in the right and left ventricles. Front Physiol. 14, 1129333 (2023).
- Camacho, P., Fan, H., Liu, Z., He, J. Q. Small mammalian animal models of heart disease. Am J Cardiovasc Dis. 6 (3), 70-80 (2016).
- Andersen, S., et al. A pulmonary trunk banding model of pressure overload induced right ventricular hypertrophy and failure. J Vis Exp. (141), e58050 (2018).
- Ukita, R., et al. A large animal model for pulmonary hypertension and right ventricular failure: Left pulmonary artery ligation and progressive main pulmonary artery banding in sheep. J Vis Exp. (173), e62694 (2021).
- Myers, P. O., et al. Impact of age and duration of banding on left ventricular preparation before anatomic repair for congenitally corrected transposition of the great arteries. Ann Thorac Surg. 96 (2), 603-610 (2013).
- Liu, C., et al. Reverse remodeling of pulmonary arterioles after pulmonary artery banding in patients ≥ 2 years old with severe pulmonary arterial hypertension and congenital heart disease. Pediatr Cardiol. 40 (5), 958-964 (2019).
- Roy, B., Vacas, S., Ehlert, L., McCloy, K., Saggar, R., Kumar, R. Brain structural changes in patients with pulmonary arterial hypertension. J Neuroimaging. 31 (3), 524-531 (2021).
- Hiram, R. Resolution-promoting autacoids demonstrate promising cardioprotective effects against heart diseases. Mol Biol Rep. 49 (6), 5179-5197 (2022).
- Hiram, R. Cardiac cytokine therapy? Relevance of targeting inflammatory mediators to combat cardiac arrhythmogenic remodeling. Int J Cardiol Heart Vasc. 37, 100918 (2021).
- Al-U'datt, D. G. F., et al. Implications of enigmatic transglutaminase 2 (TG2) in cardiac diseases and therapeutic developments. Biochem Pharmacol. 201, 115104 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados