Method Article
Mecanismo de inibição da apoptose de podócitos por Kemeng Fang em ratos com nefropatia membranosa através da via de sinalização PI3K/AKT
Neste Artigo
Resumo
O presente protocolo descreve o estabelecimento de um modelo animal de nefropatia membranosa (MN) e como a inibição de Kemeng Fang reduz a apoptose de podócitos de ratos MN ativando a via de sinalização PI3K / AKT.
Resumo
A nefropatia membranosa (NM) é um tipo patológico comum de síndrome nefrótica do adulto. Até 20% dos pacientes com NM desenvolvem doença renal terminal (DRT). Os podócitos têm uma função importante na manutenção da barreira de filtração glomerular e desempenham um papel crucial na ocorrência e desenvolvimento de proteinúria e NM. A via de sinalização PI3K / AKT está envolvida em todo o processo de crescimento, diferenciação e apoptose de podócitos. Kemeng Fang (KMF) é uma fórmula da medicina tradicional chinesa que tem sido usada para retardar a lesão renal. No entanto, o mecanismo terapêutico do KMF no NM não é claro. Aqui, o modelo de rato MN foi estabelecido por injeções axilares, inguinais e de veia caudal de albumina sérica bovina catiônica (C-BSA) e, em seguida, KMF e inibidor de PI3K (LY294002) foram administrados. Os dados de função hepática, função renal, lipídios no sangue, patologia renal, função podocitária, nível de expressão da via de sinalização PI3K / AKT e transcriptômica de ratos demonstraram que o KMF tem um efeito protetor nos podócitos de ratos MN ativando a via de sinalização PI3K / AKT, e pode efetivamente prevenir a progressão do MN.
Introdução
A nefropatia membranosa (MN) é um tipo patológico comum de síndrome nefrótica do adulto, com uma taxa de incidência anual de aproximadamente 5-10 por 100.000 indivíduos. Ocorre principalmente entre as idades de 30 e 50 anos e é raro em crianças (cerca de 5%). É significativamente mais prevalente em homens do que em mulheres (2:1). Além disso, até 20% dos pacientes com NM desenvolvem a doença renal terminal (DRT). Além disso, há uma tendência crescente em que pacientes com NM desenvolvem DRT ano a ano 1,2,3. A característica patológica da NM é que a imunoglobina G granular (IgG) e o complexo de ataque à membrana do sistema complemento (MAC) são fortemente depositados na membrana basal glomerular (GBM) adjacente aos podócitos. Essa deposição leva ao espessamento do GBM e à ruptura da integridade da barreira de filtração glomerular, levando à proteinúria4.
Terapia de suporte, imunossupressores e anticorpos monoclonais direcionados são os principais métodos para o tratamento da NM. Embora essas intervenções possam reduzir significativamente a proteinúria e retardar a progressão da deterioração renal, elas também apresentam muitas deficiências. Primeiro, a terapia de suporte é adequada apenas para pacientes de baixo risco5. Em segundo lugar, os imunossupressores podem causar reações adversas, como necrose da cabeça do fêmur, infecção secundária e inibição da função hematopoiética da medula óssea6. Em terceiro lugar, uma extensa pesquisa de ensaios clínicos randomizados é necessária para fornecer medicamentos baseados em evidências para o uso de anticorpos monoclonais, como ofamizumabe, otuzumabe, daretozumabe e isatuximabe 7,8,9. Portanto, a busca ativa de métodos eficazes de tratamento para NM tem grande importância para retardar o início da DRCT e melhorar a qualidade de vida dos pacientes com NM.
Os podócitos, também conhecidos como células epiteliais viscerais glomerulares, estão ligados ao lado externo do GBM, e o endotélio capilar do GBM forma a barreira de filtração sanguínea glomerular. Têm funções importantes, como manter a barreira de filtração de proteínas glomerulares, sintetizar a membrana basal normal e fornecer suporte estrutural para o plexo capilar glomerular10,11. A pesquisa mostrou que a apoptose de podócitos desempenha um papel crucial na ocorrência e desenvolvimento de proteinúria e NM, e a via de sinalização PI3K / AKT está envolvida em todo o processo de crescimento, diferenciação e apoptose de podócitos12 , 13 , 14 .
Um número crescente de estudos tem mostrado que a medicina chinesa tem vantagens significativas no tratamento da NM, o que pode reduzir significativamente a creatinina sanguínea, a proteinúria e a lesão renal tardia15,16. KMF é um composto da medicina tradicional chinesa com ingredientes derivados de 13 plantas: Codonopsis pilosula (Franch.) Nannf. (Dangshen, DS); Astragalus membranaceus (Fisch.) Bunge. (Huangqi, QG); Coptis chinensis Franch. (Huanglian, HL); Perilla frutescens (L.) Britt. (Suye, SY); Rehmannia glutinosa (Gaertn.) DC. (Shudihuang, SDH); Ligusticum chuanxiong Hort. (Chuanxiong, CX); Euryale ferox Salisb. (Qianshi, QS); Sabia japonica Máxima. (Qinfengteng, QFT); Rhus chinensis Moinho (Wubeizi, WBZ); Lobelia chinensis Lour. (Banbianlian, BBL); Oldenlandia diffusa (Willd.) Roxb. (Baihuasheshecao, BHSSC; Tabela 1). O KFM tem muitas funções, como tonificar o rim (aumento da função renal), aumentar o qi (fortalecer a imunidade), promover a diurese e dragar colaterais (promover a circulação sanguínea). No entanto, o mecanismo terapêutico do KMF no NM não é claro 17,18.
Atualmente, existem muitas maneiras de construir modelos de MN, incluindo modelo de nefrite de Heymann, modelo de nefrite C-BSA, modelo de camundongo α3NC1, no qual o modelo de nefrite de Heymann, a principal proteína megalina do antígeno patogênico não é encontrada em MN humano, por isso é diferente da patogênese do MN humano, modelo de camundongo α3NC1, apenas o histórico genético DBA / 1 da taxa de sucesso do modelo de camundongo é maior, o resto dos camundongos teve menos sucesso na modelagem, ou mesmo incapazes de serem modelados 19,20,21. O modelo de nefrite C-BSA é custo-efetivo e simples de operar, e sua patogênese é altamente semelhante à do modelo animal humano MN19. O princípio básico é que, como o GBM é carregado negativamente e o C-BSA é carregado positivamente, ele pode facilmente atravessar o GBM para se tornar um antígeno plantado, que induz os anticorpos circulantes a se acumularem lá para formar um complexo imune in situ, construindo assim um modelo MN22,23. O objetivo deste estudo foi observar o efeito terapêutico do KMF no NM e seu mecanismo molecular por uma combinação de transcriptômica e biologia molecular e fornecer uma base científica confiável para o tratamento do NM com KMF.
Protocolo
Este estudo foi revisado e aprovado pelo Comitê de Manejo e Uso de Animais Experimentais do Centro Provincial de Controle e Prevenção de Doenças de Hubei (número de identificação: 202220144). Os ratos foram submetidos a um ciclo claro/escuro de 12 h sob condições não patogênicas de 23 ± 1 °C e 50%-60% de umidade atmosférica. Adquirimos 100 ratos Sprague-Dawley machos de 8 semanas de idade do Centro Provincial de Controle e Prevenção de Doenças de Hubei (número de licença: SYXK [E] 2022-0065), e eles foram submetidos à alimentação adaptativa em um ambiente específico livre de patógenos por 1 semana com uma alimentação de manutenção normal e bebendo água estéril.
1. Preparação de medicamentos
- Preparação do KMF
- Os medicamentos chineses utilizados foram fornecidos pelo hospital afiliado à Universidade de Medicina Tradicional Chinesa de Changchun, a composição e dosagem específicas são mostradas na Tabela 1. Para preparar, use um total de 147 g de medicamentos crus - Codonopsis pilosula (20 g), Astragalus membranaceus (30 g), Coptis chinensis (3 g), Perilla frutescens (6 g), Rehmannia glutinosa (15 g), Ligusticum chuanxiong (15 g), Euryale ferox (15 g), Sabia japonica (10 g), Rhus chinensis (3 g), Lobelia chinensis (15 g), Oldenlandia diffusa (15 g). Misture e mergulhe em 1470 mL de água destilada por 30 min.
- Coloque a mistura de ervas em uma panela de cerâmica e aqueça a 100 °C por 90 min para decocção. Filtre através de duas camadas de gaze médica e armazene em temperatura ambiente.
- Adicione água destilada (1470 mL) novamente à mistura de ervas restante e repita a operação de decocção acima mais uma vez, conforme descrito na etapa 1.1.2. Conservar o filtrado à temperatura ambiente.
- Misturar os dois filtrados acima referidos e secar em estufa a 80 °C durante 10 h até que a solução aquosa tenha evaporado completamente e apenas o soluto seja retido sob a forma de pó.
- Pese o pó e dissolva-o em solução salina para fazer uma solução contendo 1,323 g, 2,646 g e 5,292 g do medicamento por 4 mL (as concentrações foram 0,331 g/mL, 0,662 g/mL e 1,323 g/mL, respectivamente), que é a dosagem diária do medicamento administrado a ratos.
- Preparação de cloridrato de Benadryl
- Adicione o comprimido de cloridrato de Benadryl (90 g) em 100 mL de solução salina e agite bem para dissolver completamente.
- Preparação do inibidor de PI3K LY294002
- Adicione 82,3 mg de pó de LY294002 em 1,1 mL de DMSO e agite bem para dissolvê-lo completamente. Em seguida, adicione 198,9 mL de solução salina para diluí-lo para obter uma concentração de 0,41 mg/mL.
- Preparação do emulsificante C-BSA
- Adicione 67 mL de etilenodiamina anidra a 500 mL de água bidestilada e misture. Adicione lentamente 350 mL de ácido clorídrico 6 M e ajuste o pH para 4,75. Manter a temperatura da solução final a 25 °C.
- Dissolver 5 g de albumina natural de soro bovino em 25 ml de água bidestilada e manter a solução a uma temperatura constante de 25 °C, agitando constantemente. Adicionar 1,8 g de cloridrato de carbodiimida e 30 ml de tampão ácido acético 4 M com pH 4,75 após 2 h para obter a solução de C-BSA.
- Diálise da solução obtida em água bidestilada a 4 °C durante 72 h (com a água mudada de 3 em 3 a 5 h) utilizando um papel de selenito e liofilizado para obter o pó liofilizado C-BSA, conservar a -80 °C24.
- Adicione 100 mg de pó seco C-BSA em 50 mL de solução salina para formar uma solução de C-BSA. Misture isso com um volume igual de adjuvante de Freund Incompleto para emulsificação completa; sua concentração é de 1 mg/mL.
- Preparação da solução C-BSA
- Adicione 640 mg de pó seco C-BSA em 100 mL de PBS e agite bem para dissolvê-lo completamente; sua concentração é de 6,4 mg/mL.
2. Estabelecimento do modelo animal MN
NOTA: O experimento foi dividido em oito grupos: grupo controle normal (CON), grupo modelo (MOD), grupo cloridrato de benazepril (BEN), grupo KMF de baixa dose (KM-L), grupo de dose média de KMF (KM-M), grupo de alta dose de KMF (KM-H), grupo inibidor de PI3K (PI3K) e grupo inibidor de PI3K + grupo de dose média de KMF (PI3K + KM-M). Com exceção do grupo controle normal, todos os grupos receberam C-BSA para produzir o modelo MN.
- Na nona semana, realize a pré-imunização: Múltiplas injeções subcutâneas de emulsificante C-BSA na axila e virilha.
NOTA: A nuca do pescoço (interescapular) é um local alternativo para administração subcutânea do emulsificante C-BSA.- Segure a pele posterior dos ratos com a mão esquerda e vire o abdômen para cima com a pele abdominal apertada. Injete o emulsificante C-BSA por via subcutânea nas axilas e virilhas dos ratos usando uma seringa de 2,5 mL na dose de 1 mL / 400 g uma vez em dias alternados durante 1 semana.
- Imunização formal: injeção na veia da cauda da solução C-BSA
- Na décima semana, remova os ratos de suas gaiolas e coloque-os na tampa da barra de arame com as caudas voltadas para o experimentador.
- Limpe a cauda do rato com uma bola de algodão com álcool e aperte os dois lados da cauda do rato com o polegar e o indicador da mão esquerda para preencher a veia e mantê-la voltada para cima.
- Segure uma seringa de 1 mL na mão direita de modo que a agulha fique a 30° da veia da cauda. Mantenha a ponta da agulha chanfrada para cima e a agulha paralela ao vaso imediatamente após picar suavemente na pele. Se houver algum retorno de sangue da agulha, injete-o de volta junto com uma dose de C-BSA de 2,5 mL / kg 3x por semana durante 4 semanas.
- Após a conclusão da injeção, use uma bola de algodão seca para pressionar o ponto de injeção por aproximadamente 1 min para estancar o sangramento. Remova os ratos do imobilizador e retorne à gaiola.
3. Análise do KMF
- Pesar 1 g de amostra em um tubo de centrífuga de 2 mL, adicionar 600 μL de MeOH (armazenado a -20 ° C contendo ácido 2-amino-3-(2-cloro-fenil) -propiônico (4 ppm)) e vortex a mistura por 30 s.
- Adicione aproximadamente 100 mg de esferas de vidro e coloque a mistura em um moedor de lenços de papel por 90 s a 60 Hz.
- Realize ultrassom a 40 kHz por 15 min em temperatura ambiente.
- Centrifugue por 10 min a 15.984 x g, 4 ° C e filtre o sobrenadante através de uma membrana de 0,22 μm. Transfira um frasco de detecção para detecção de LC-MS.
4. Tratamentos medicamentosos
NOTA: Humanos adultos precisam de 147 g KMF por dia. De acordo com a fórmula de conversão da dose experimental de rato e humano, a dose experimental equivalente para rato (g / kg) = dose humana (g) / peso corporal (70 kg) x 6,3, a dose diária do rato foi de aproximadamente 13,23 g / kg.
- Na 14ª semana, usando a mão esquerda, segure a pele do dorso dos ratos, vire o abdômen para cima e aperte a pele abdominal. Segure a agulha de uma seringa de 10 mL na mão direita e insira-a na boca de um lado, deslizando ao longo do palato e da parede posterior da faringe e mais adiante até o estômago usando a ação de deglutição.
- Administre o medicamento lentamente usando o dedo indicador da mão direita e puxe a agulha gástrica para fora após a administração estar completa. A dosagem do medicamento administrado é de 10 mL / kg por um período total de 4 semanas.
- Para os grupos CON e MOD, administrar 10 mL/kg/dia de soro fisiológico por gavagem.
- Para o grupo BEN, administrar 9 mg/kg/dia de solução aquosa de cloridrato de Benadryl por sonda gástrica.
- Para o grupo KM-L, administrar 3,3075 g/kg/dia de extrato aquoso de KMF por gavagem. Para o grupo KM-M, administrar 6,615 g/kg/dia de extrato aquoso de KMF por gavagem. Para o grupo KM-H, administrar 13,23 g/kg/dia de extrato aquoso de KMF por gavagem.
- Para o grupo PI3K, administrar 2,1 mg/kg/dia LY294002 por sonda gástrica.
- Para o grupo PI3K + KM-M, administrar 2,1 mg / kg / dia LY294002 (5 mL / kg) + 6,615 g / kg / dia de extrato aquoso KMF (5 mL / kg) por gavagem.
5. Avaliação da eficácia do KMF
- Detecção de índices bioquímicos de sangue e urina
- A partir da 14ª semana, colete urina a cada 2 semanas após o início do experimento. Coloque um único rato em uma gaiola metabólica por 24 horas. Restrinja a dieta e forneça acesso gratuito à água potável. Colete a urina usando um tubo de centrífuga de 50 mL colocado abaixo da gaiola metabólica.
- Centrifugue a urina a 15.984 x g por 10 min e use o sobrenadante para estimar o nível de proteína urinária de acordo com as instruções do Kit de Teste de Proteína Urinária.
- Na 18ª semana, eutanasiar ratos por inalação de isoflurano a 5%. Use pomada veterinária nos olhos para evitar o ressecamento. Confirme a morte usando o método de luxação cervical. Segure a pele das costas dos ratos com a mão esquerda e apare os bigodes dos ratos com uma tesoura.
- Desinfete a pele ao redor dos globos oculares com etanol e remova rapidamente os globos oculares usando uma pinça hemostática. Colete o sangue caído no tubo da centrífuga e centrifugue por 10 min a 15.984 x g depois de ficar em temperatura ambiente por 30 min. Colete o sobrenadante.
- Detecte alanina aminotransferase (ALT), aspartato transaminase (AST), albumina (ALB), triglicerídeos (TG), colesterol total (TC), nitrogênio ureico no sangue (BUN), creatinina sérica (Scr), TotalProtein (TP) e outros índices sanguíneos usando um analisador bioquímico automático.
- Separação dos tecidos renais
- Após a retirada do sangue dos ratos, fixe-os na placa cirúrgica e corte lentamente o pelo e a camada muscular na linha média do abdome, abrindo os tubos intestinais para expor a aorta abdominal e os rins25.
- Bloqueie a aorta abdominal acima do rim direito usando pinças cirúrgicas de artéria. Conecte uma agulha do couro cabeludo a uma seringa de 5 mL para perfurar abaixo do bloco e perfunda o tampão PBS para irrigar os rins até que ambos os rins fiquem brancos ou pálidos.
- Remova os rins e separe o periósteo sem rodeios. Divida o rim direito em tubos de congelamento e guarde na geladeira a -80 °C. Fixe o rim esquerdo em solução de paraformaldeído a 4%.
- Após 24 h de fixação, remova o rim. Realize desidratação, transparência e incorporação de parafina. Depois que o bloco de cera solidificar, corte com um cortador de tecido com uma espessura de 3 μm, pesque com uma lâmina anti-deiscência, asse as fatias a 98 ° C por 20 min e guarde para26 sobressalentes.
- Análise histopatológica renal
- Submeter as secções à desparafinação por xileno gradiente e à desidratação por etanol anidro e enxaguar com água destilada. Sujeito a xileno por 15 min, seguido de solução fresca de xileno por 15 min. Mude para etanol anidro por 5 min, mude para etanol anidro fresco por 5 min, seguido de etanol a 90% por 5 min, depois etanol a 80% por 5 min, depois etanol a 70% por 5 min e, finalmente, lave com água destilada.
- Siga as instruções para coloração de hematoxilina-eosina (H & E), ácido periódico-Schiff (PAS) e kits de coloração de Masson para coloração de amostras.
- Execute a desidratação do etanol anidro gradiente e o xileno limpo novamente.
- Coloque as fatias em uma incubadora de temperatura constante, ajuste a temperatura para 90 °C e leve ao forno por 20 min. Após o cozimento, retire as fatias e adicione a goma neutra gota a gota. Cubra-os com uma tampa de vidro.
- Observe sob um microscópio óptico com uma ampliação de 200x e colete imagens.
- Análise de imunofluorescência (IF) de tecidos renais
- Desparafine as seções e desidrate conforme descrito na etapa 5.3.1. Colocar as amostras em solução tampão EDTA 0,01 M para fixação a alta pressão e alta temperatura (125 °C a 103 KPa) durante 15 min. Deixe a amostra esfriar naturalmente e lave 3x por 3 min cada em PBS.
- Coloque as seções em uma solução de peróxido de hidrogênio a 3% e incube por 10 min. Lave as amostras 3x por 5 min cada em PBS. Em seguida, coloque as seções em soro de cabra a 10%, incube por 30 min e lave 3x por 3 min cada em PBS.
- Adicionar os anticorpos primários IgG (1:100) e C3 (1:100) gota a gota e incubar numa caixa húmida a 4 °C durante a noite. A razão de diluição do anticorpo primário é mostrada na Tabela 2. Retire as seções da geladeira e lave com TBST 3x por 3 min cada.
- Adicione o anticorpo secundário fluorescente (1:100) gota a gota, incube a 37 °C por 1 h e lave com TBST 3x por 3 min cada.
NOTA: Esta etapa e todas as etapas subsequentes devem ser realizadas no escuro 27,28. - Incube com 4',6-diamidino-2-fenilindol (DAPI) por 5 min em temperatura ambiente e evite a luz, lave com solução salina tamponada com tween 20 (TBST) 3x por 5 min cada para remover o excesso de DAPI.
- Adicione o extintor de autofluorescência em um círculo, incube por 5 min e enxágue com água corrente por 10 min. Seque as seções e sele com selante de têmpera antifluorescência. Observe sob um microscópio de fluorescência a 200x e colete imagens.
- Análise imuno-histoquímica (IHQ) do tecido renal
- Desparafine as seções e desidrate conforme descrito na etapa 5.3.1. Repare sob alta pressão (125 °C · 103KPa) em solução tampão EDTA 0,01M por 15 minutos. Após o resfriamento natural, lave com PBS 3x por 3 min cada.
- Método de operação de bloqueio da peroxidase endógena e selagem sérica conforme descrito na etapa 5.4.2.
- Adicione o anticorpo primário WT-1 (1:200) e Nefrina (1:100) gota a gota e incube em uma caixa úmida na geladeira a 4 ° C durante a noite29.
- Retire as secções do frigorífico a 4 °C, lave com PBS 3x durante 5 min cada. Adicione o anticorpo secundário (1:200) gota a gota, incube a 37 °C por 30 min e lave com PBS 3x por 3 min cada.
- Adicione gotas de solução cromogênica de diaminobenzidina (DAB) recém-preparada e observe ao microscópio óptico a 200x. O sinal positivo é amarelo acastanhado ou marrom acastanhado. Lave a solução de coloração imediatamente com água da torneira quando for observada uma mudança de cor na seção.
- Use hematoxilina para recolorir por 3 min, depois adicione álcool de ácido clorídrico a 1% para diferenciação e enxágue com água da torneira por 10 min.
- Desidrate as seções, transparentes, e vede, conforme descrito na etapa 5.2.4. Observe ao microscópio óptico a 200x e colete imagens.
- Análise da coloração terminal de tunelo (TUNEL) com dUTP mediada por desoxinucleotidiltransferase
- Use a etapa 5.3.1 para desparafinizar e desidratar as seções. Desenhe círculos ao redor dos tecidos usando uma caneta de imuno-histoquímica e adicione 100 μL de solução de trabalho de proteinase K gota a gota a cada amostra. Incubar a 37 °C durante 20 min, lavar com PBS 3x durante 5 min cada e armazenar as amostras tratadas numa caixa húmida.
- Coloque as seções em solução de peróxido de hidrogênio a 3%, incube por 10 min e lave com PBS 3x por 5 min cada.
- Adicione tampão de equilíbrio (100 μL) gota a gota ao círculo para cobrir o tecido e incube por 20 min em temperatura ambiente.
- Adicione 50 μL de solução de trabalho de marcação (solução de equilíbrio: solução de marcação fluorescente: enzima TDT = 35 μL: 10 μL: 5 μL) gota a gota a cada amostra, incube em uma caixa úmida a 37 ° C por 60 min, protegida da luz, e lave com PBS 3x por 5 min cada.
- Adicione DAPI e incube com DAPI por 5 min em temperatura ambiente sob luz, lave com PBS 3x por 5 min cada.
- Depois que as seções foram sacudidas e seladas com selante antifluorescência, observe em microscópio de fluorescência a 200x e colete imagens.
- Preparo de amostras para análise microscópica eletrônica de tecido renal
- Fixe os tecidos renais com glutaraldeído a 2,5% a 4 ° C por 2-4 h e lave 3x por 15 min cada em PBS.
- Fixe em ácido ósmio (1%) em temperatura ambiente longe da luz por 2 h e lave com PBS 3x por 15 min cada.
- Realize a desidratação gradiente de álcool e acetona, usando acetona e agente de inclusão Mergulhe em gradientes 1:1, 1:2 e 1:31 por 2 h, 4 h e 8 h, respectivamente. Depois disso, use agente de incorporação puro e incorpore as amostras a 37 ° C durante a noite.
- Após 8 h, coloque a placa embutida em um forno a 60 °C para polimerização por 48 h. Corte o bloco de resina processado acima em um fatiador ultrafino, com uma espessura de corte definida para 60-80 nm; Use malha de cobre para desalojar fatias.
- Use uma solução de acetato de peróxido de hidrogênio a 2% e álcool para coloração por 8 min, seguida de etanol a 70% e lavagem com água ultrapura 3x. Complete lavando com 2,6% de etanol e água ultrapura.
- Observe e adquira imagens sob um microscópio eletrônico de transmissão.
- Análise quantitativa do ensaio de reação em cadeia da polimerase em tempo real (qRT-PCR)
- Adicione 20 mg de tecido renal congelado ao tubo de microcentrífuga e triture bem com um triturador de tecido de alta velocidade até que não haja massa de tecido visível.
- Coletar o sobrenadante após centrifugação a 15,984 x g por 10 min. Adicione 250 μL de clorofórmio e inverta o tubo por 15 s; A solução é bem misturada. Deixar repousar à temperatura ambiente durante 3 min e, em seguida, centrifugar a 15,984 x g durante 10 min a 4 °C.
- Colete a fase aquosa superior e transfira para um novo tubo de centrífuga livre de RNase. Adicione um volume igual de etanol a 70% (preparação de água sem RNase), inverta e misture.
- Adicione a solução à coluna adsorvente carregada no tubo de coleta para lavagem do RNA. Após a lavagem do tampão RW, deixe a coluna em temperatura ambiente por 5 min para secar.
- Coloque a coluna em um novo tubo de centrífuga sem RNase, adicione 30-50 μL de água sem RNase no meio da coluna, deixe repousar em temperatura ambiente por 1 min e, em seguida, centrifugue a 15.984 x g por 1 min. Recolha a solução de ARN e conserve-a a -80 °C.
- Retirar a solução de ARN do congelador e pré-desnaturar a 90 °C durante 10 min, seguindo-se 40 ciclos a 95 °C durante 15 s, 60 °C durante 35 s e 72 °C durante 25 s e, finalmente, lisada na ordem dos 95 °C durante 15 s, 60 °C durante 60 s, 95 °C durante 15 s (Quadro Suplementar 1).
- Usando β-actina como referência interna, calcular a expressão relativa de WT-1 e Nefrina usando o método 2¬-ΔΔCt com base no valor de Ct de cada amostra (ΔΔCt = valor de Ct do gene alvo - valor de Ct do gene de referência interno)30. Informações detalhadas sobre primers são mostradas na Tabela 3.
- Análise de Western blot (WB)
- Preparar o lisado de acordo com a proporção de inibidor de protease:inibidor da fosfatase:RIPA= 1:1:100 e adicionar 500 μL de lisado a um tubo de microcentrífuga.
- Adicione 100 mg de tecido renal congelado ao tubo de microcentrífuga e triture bem com um triturador de lenços de papel de alta velocidade até que não haja massa de tecido visível.
- Remova o tubo da microcentrífuga, lise no gelo por 30 min e, em seguida, centrifugue a 15.984 x g por 10 min. Aspirar o sobrenadante e conservá-lo a -80 °C.
- Detecte a concentração de proteína de acordo com as instruções do Kit de Ensaio de Concentração de Proteína de ácido bicinconínico (BCA) e adicione a solução de PBS gota a gota para garantir uma concentração de proteína consistente em cada grupo.
- Adicione 5x tampão de amostragem de proteína ao tubo da microcentrífuga, incube a 100 °C por 15 min para desnaturá-lo totalmente e remova após o resfriamento.
- Separe as proteínas por eletroforese em gel SDS-PAGE a 12,5%, primeiro usando 80 V, fazendo com que todas as amostras sejam pressionadas em uma linha azul plana e, em seguida, ajustando a voltagem para 130 V, até que o azul de bromofenol saia do fundo da placa de gel. Pare a eletroforese.
- Remova o gel. Molhe o papel de filtro com tampão de transferência de membrana. Ative a membrana de fluoreto de polivinilideno (PVDF) em metanol por 30 segundos. Em seguida, organize tudo na seguinte ordem: malha de esponja / papel de filtro / gel / membrana de PVDF / papel de filtro / papel de filtro / malha de esponja no clipe usado para transferir a membrana.
- Coloque o gel no pólo negativo, a membrana de PVDF no pólo positivo e transfira a membrana com uma corrente de 200 MA por 90 min.
- Remova a membrana de PVDF e lave com TBST uma vez por 5 min. Adicione a solução de fechamento à temperatura ambiente, agitando por 90 min. Lave com TBST 3x por 5 min cada.
- Adicione os anticorpos primários PI3K (1:1000), PIK3CA (1:1000), AKT (1:1000), P-AKT (1:1000), BAD (1:1000), P-BAD (1:1000), BCL-2 (1:1000), bax (1:4000) e c-caspase3 (1:1000) e incube em uma caixa úmida durante a noite a 4 °C na geladeira31,32.
- Remova a membrana de PVDF da geladeira a 4 ° C, lave com TBST 3x por 5 min cada. Adicione o anticorpo secundário (1:10.000) gota a gota, incube a 37 ° C por 90 min e lave com TBST 3x por 3 min cada.
- Prepare a solução de revelação de acordo com a proporção (A: B=1:1) e desenvolva-a na máquina de acordo com as instruções.
Resultados
Resultados da análise dos componentes do KMF
Nos modos de íons positivos e negativos analisados por LC-MS/MS, 147 e 120 compostos foram identificados, respectivamente (Figura 1A-B). Alguns compostos e seu peso molecular calculado por MF, valor m/z, tempo de retenção e íons parentais são mostrados na Tabela Suplementar 2.
KMF melhorou distúrbios do metabolismo lipídico e lesão hepática e renal em ratos MN
Usando ratos SD e C-BSA, estabelecemos um modelo MN. Após 1 semana de injeções de C-BSA na veia da cauda, os ratos MN exibiram vários graus de fadiga mental, diminuição do apetite, crescimento lento, cor de cabelo opaca, pêlo fofo, resposta retardada e perda de peso, com alguns ratos desenvolvendo edema escrotal. Após 4 semanas de administração, diferentes doses de KMF reduziram significativamente os níveis de expressão de proteína total urinária de 24 h (24 h-UTP), Scr e BUN, melhorando a função renal ( Figura 2A-C ); redução dos níveis de expressão de ALT e AST e aumento dos níveis de expressão de TP e ALB, melhora a função hepática (Figura 2D-G); reduziu os níveis de expressão de CT e TG e melhorou a função de regulação lipídica (Figura 2H-I). Esses resultados sugerem que o KMF tem um efeito protetor na função renal; no entanto, seu mecanismo de ação específico ainda não está claro.
KMF melhora o dano histopatológico do tecido renal em ratos MN
Para testar se o KMF poderia melhorar a lesão renal em ratos MN, o uso de H&E, PAS, MASSON e IF detectou danos histopatológicos do tecido renal. As colorações de H&E e PAS mostraram hipertrofia glomerular, proliferação discreta de células mesangiais, dilatação tubular renal e degeneração vacuolar de células epiteliais tubulares renais no grupo MOD (Figura 3A). A coloração de Masson mostrou um aumento significativo na área de fibrose renal no grupo MOD (Figura 3B-C). A imunofluorescência mostrou que a intensidade relativa de fluorescência de IgG e C3 no grupo MOD foi significativamente maior do que no grupo CON (Figura 3D-F). Após a administração de inibidores de KMF, BEN ou PI3K + KM-M, o grau de hipertrofia glomerular, bem como o grau de proliferação de células presas, foi reduzido, a área de fibrose renal foi significativamente reduzida e a intensidade relativa de fluorescência de IgG e C3 foi significativamente menor. Esses resultados indicam que o KMF pode aliviar o dano patológico renal em ratos MN.
O KMF alivia os danos aos podócitos ativando a via de sinalização PI3K/AKT
O dano dos podócitos-chave no NM também foi observado usando os métodos descritos aqui, ou seja, IHC, PCR, TUNEL e TEM. Os resultados de IHQ e PCR mostraram que, em comparação com o grupo CON, o grupo MOD teve uma diminuição significativa nos níveis de expressão de proteínas marcadoras funcionais e específicas de podócitos, WT-1 e Nefrina, indicando danos aos podócitos, enquanto o tratamento com KMF aumenta os níveis de expressão de WT-1, Nefrina e alivia os danos aos podócitos (Figura 4A-E). Os resultados da coloração TUNEL mostraram apoptose severa de podócitos no grupo MOD, enquanto o tratamento com KMF diminuiu significativamente a intensidade da fluorescência e reduziu a incidência de apoptose (Figura 4F-G). Os resultados do MET mostraram que a membrana basal do glomérulo no grupo MOD foi significativamente espessada de forma desigual, e as mitocôndrias dos podócitos mostraram inchaço severo, matriz esparsa e bombardeio vazio da matriz, com cristas reduzidas ou ausentes. Após a administração de KMF, o espessamento da membrana basal glomerular foi significativamente reduzido e a morfologia das mitocôndrias dos podócitos foi significativamente restaurada (Figura 4H). Esses resultados indicam que o KMF pode aliviar os danos dos podócitos em ratos MN.
A detecção adicional da expressão de proteínas relacionadas à via de sinalização PI3K / AKT26,27 por WB revelou que, em comparação com o grupo CON, o grupo MOD mostrou um aumento significativo nos níveis de expressão de PI3K, PIK3CA, AKT, P-AKT, BAD, BAX e C-caspase3, enquanto os níveis de expressão de P-BAD e BCL-2 diminuíram significativamente. Enquanto o tratamento com KMF reduz os níveis de expressão de PI3K, PIK3CA, AKT, P-AKT, BAD, BAX e C-caspase3, ele aumenta os níveis de expressão de P-BAD e BCL-2 (Figura 4I-J). Esses resultados indicam ainda que o KMF pode melhorar os danos aos podócitos em ratos MN, ativando a via de sinalização PI3K / AKT.
Explorando os possíveis mecanismos da terapia com KMF para NM com base na transcriptômica
Para revelar ainda mais os alvos e mecanismos potenciais do KMF no tratamento do NM, uma análise transcriptômica foi conduzida com base no Tandem Mass Tag (TMT). Os resultados mostraram que havia 898 genes diferencialmente expressos (DEGs) entre os grupos CON e MOD, incluindo 372 genes regulados positivamente e 526 regulados negativamente (Figura 5A-B). Da mesma forma, houve 360 DEGs entre os grupos KM-L e MOD, incluindo 202 genes regulados positivamente e 158 regulados negativamente (Figura 5C-D). Para identificar os genes e vias de sinalização que podem ser afetados, foi realizada uma análise funcional de enriquecimento da Gene Ontology (GO) e da Kyoto Encyclopedia of Genes and Genomes (KEGG) (Figura 5E-H). Os resultados mostraram que os processos biológicos do DEG se concentram principalmente em processos celulares e regulação biológica, enquanto as funções do DEG se concentram principalmente nas interações ligante-receptor neuroativas, como as vias de sinalização CAMP, PPAR, PI3K-AKT e p53. Esses resultados sugerem que o KMF pode tratar o NM afetando essas vias de sinalização, com a via de sinalização PI3K / AKT validada em experimentos. Finalmente, os 100 principais DEGs foram selecionados em ordem de valor de grau para construir a rede de interação proteína-proteína (PPI) (Figura 5I-J).
Figura 1: Cromatograma de íons de pico LC-MS/MS. (A) Modo de íons positivos. (B) Modo de íon negativo. Clique aqui para ver uma versão maior desta figura.
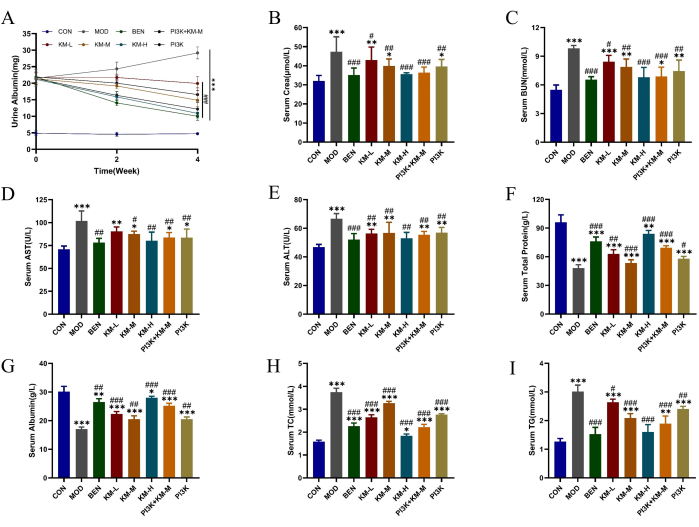
Figura 2: KMF melhora o distúrbio do metabolismo lipídico e lesão hepática e renal em ratos MN. (AC) Os efeitos de Kemeng Fang na função renal, incluindo albumina na urina de 24 horas, Cera sérica e ureia sérica. (DG) Os efeitos do Kemeng Fang na função hepática incluem alanina aminotransferase (ALT), aspartato transaminase (AST), proteína total e albumina sérica. (HI) O efeito do Kemeng Fang na regulação do metabolismo lipídico do sangue, incluindo triglicerídeos (TG) e colesterol total (TC). Os dados são expressos como médias ± desvios-padrão de 3-6 amostras independentes, usando ANOVA de uma via no teste T, em comparação com o grupo em branco, *p<0,05, **p<0,01, ***p<0,001, e comparado com o grupo modelo, #p < 0,05, ##p < 0,01, ###p < 0,001. Clique aqui para ver uma versão maior desta figura.
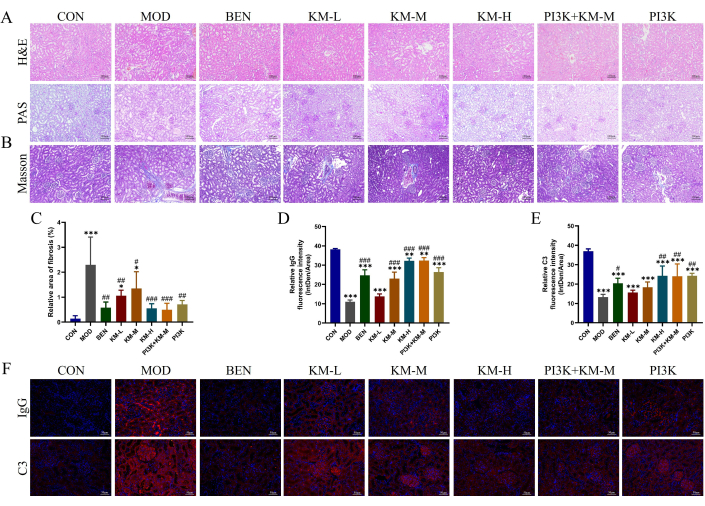
Figura 3: Kemeng Fang melhora o dano histopatológico aos rins de ratos MN. (A) Exame histológico renal, incluindo H&E e PAS (200x). (B-C) Análise semiquantitativa da área relativa da fibrose renal (fibras colágenas azuis) usando a coloração de Masson e o software Image J. (D-F) Análise semiquantitativa da intensidade relativa de fluorescência (Intden/Área; onde Intden é a intensidade de fluorescência regional total, a área é a área regional) de IgG e C3 no tecido renal usando os softwares IF e Image J. Clique aqui para ver uma versão maior desta figura.
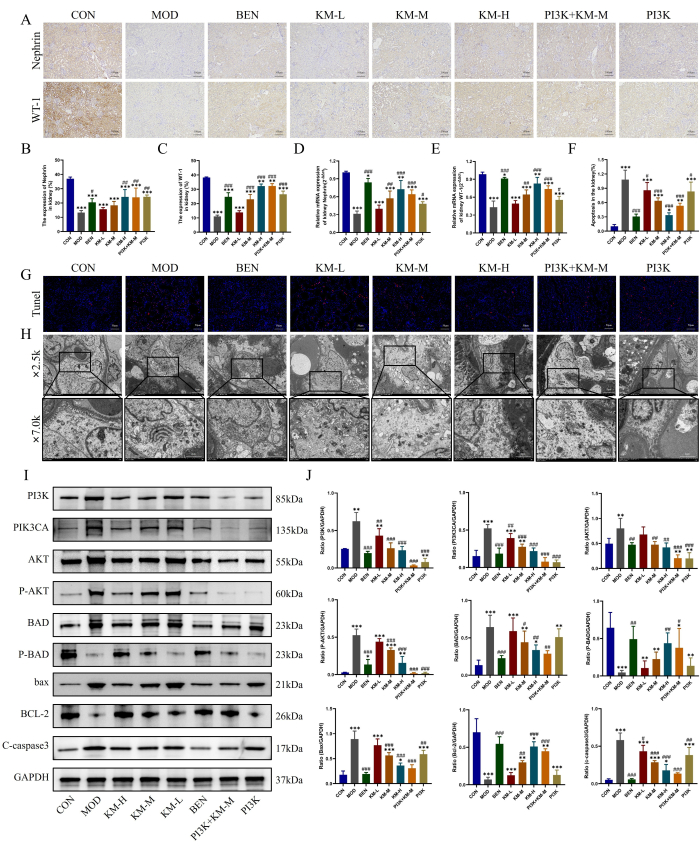
Figura 4: Kemeng Fang alivia os danos aos podócitos ativando a via de sinalização PI3K / AKT. (A-C) A IHQ foi usada para detectar os níveis relativos de expressão de duas proteínas marcadoras de podócitos, WT-1 e nefrina, no tecido renal. (D-E) Detecção por PCR da expressão relativa de mRNA de duas proteínas marcadoras de podócitos, WT-1 e Nefrina, no tecido renal. (F-G) A coloração TUNEL foi usada para detectar a incidência de apoptose no tecido renal. (H) Observação da membrana basal glomerular e da estrutura mitocondrial dos podócitos usando TEM (2.500x, bar = 5 μM; 7.000x, bar = 2 μM). (I-J) Detecção de WB dos níveis relativos de expressão proteica de PI3K, PIK3CA, AKT, P-AKT, BAD, P-BAD, BCL-2, bax e C-caspase3 no tecido renal. Clique aqui para ver uma versão maior desta figura.
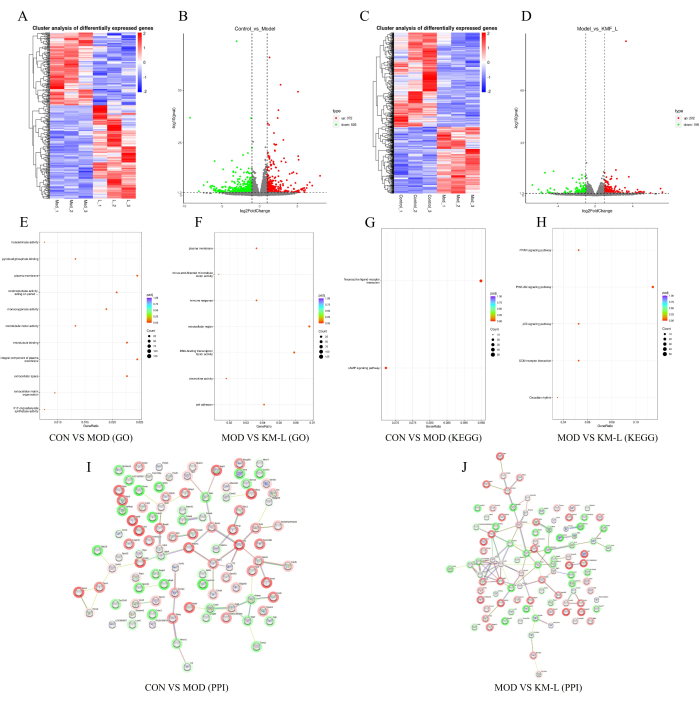
Figura 5: Explorando o possível mecanismo de Kemeng Fang no tratamento de MN com base na transcriptômica. (AB) Mapas de calor de genes diferenciais e gráficos de vulcões entre os grupos CON e MOD, com azul representando regulação negativa e vermelho representando regulação positiva. (CD) Mapas de calor de genes diferenciais e gráficos de vulcões entre os grupos MOD e KM-L, com azul representando regulação negativa e vermelho representando regulação positiva. (E) Enriquecimento de GO entre os grupos CON e MOD. (F) Enriquecimento de GO entre os grupos MOD e KM-L. (G) Enriquecimento KEGG entre os grupos CON e MOD. (H) Enriquecimento KEGG entre os grupos MOD e KM-L. (I) Gráfico de interação proteína-proteína (PPI) dos 100 principais genes diferencialmente expressos entre os grupos CON e MOD. (J) Gráfico PPI dos valores de grau de 100 graus entre os grupos MOD e KM-L. Clique aqui para ver uma versão maior desta figura.
| NÃO. | Nome chinês | Nome latino | Família | Parte usada | Dose(g) |
| 1 | Dangshen (DS) | Codonopsis pilosula (Franch.) Nannf. | Campanulaceae | Raiz | 20 |
| 2 | Huangqi (QG) | Astragalus membranaceus (Fisch.) Bunge. | Leguminosas | Raiz | 30 |
| 3 | Huanglian (HL) | Coptis chinensis Franch. | Ranunculaceae | Raiz e tubérculo | 3 |
| 4 | Suye (SY) | Perilla frutescens (L.) Britt | Labiatae | folha | 6 |
| 5 | Shudihuang (SDH) | Rehmannia glutinosa (Gaertn.) DC. | Scrophulariaceae | Raiz e tubérculo | 15 |
| 6 | Chuanxiong (CX) | Ligusticum chuanxiong Hort. | Umbelliferae | Raiz e tubérculo | 15 |
| 7 | Qianshi (QS) | Euryale ferox Salisb. | Nymphaeaceae | Semente | 15 |
| 8 | Qinfengteng (QFT) | Sabia japonica Máxima. | Sabiaceae | Raiz, tubérculo e folha | 10 |
| 9 | Wubeizi (WBZ) | Rhus chinensis Moinho. | Anacardiaceae | folha | 3 |
| 10 | Banbianliano (BBL) | Lobelia chinensis Lour. | Campanulaceae | Tubérculo e folha | 15 |
| 11 | Baihuasheshecao (BHSSC) | Oldenlandia diffusa (Willd.) Roxb. | Rubiaceae | Tubérculo e folha | 15 |
Tabela 1: Composição de Kemeng Fang (KMF).
| Anticorpo | Diluição múltipla |
| IgG | 1:100 |
| C3 | 1:100 |
| WT-1 | 1:200 |
| Nefrina | 1:100 |
| PI3K | 1:1000 |
| PI3K3CA | 1:1000 |
| AKT | 1:1000 |
| P-AKT | 1:1000 |
| MAU | 1:1000 |
| P-RUIM | 1:1000 |
| BCL-2 | 1:1000 |
| Bax | 1:4000 |
| c-caspase3 | 1:1000 |
| GAPDH | 1:1000 |
Tabela 2: Múltiplos de diluição de anticorpos.
| Gene | Cartilha | Sequência (5'-3') | Produtos PCR | |
| Rato GAPDH | Encaminhar | ACAGCAACAGGGTGGTGGAC | 253 pb | |
| Inverter | TTTGAGGGTGCAGCGAACTT | |||
| Rato WT-1 | Encaminhar | AATGGACAGAAGGGCAGAGCA | 209 pb | |
| Inverter | TGGGTACGCACACATGAAAGG | |||
| Nefrina de rato | Encaminhar | CGGAGAACAAGAACGTGACC | 177 pb | |
| Inverter | ATTGTCTTCTCTCCGCACCA | |||
Tabela 3: Informações detalhadas dos primers qRT-PCR.
Tabela suplementar 1: Reação de PCR. Clique aqui para baixar este arquivo.
Tabela suplementar 2: Lista quantitativa de identificação de metabólitos. ID: Número de série de peso molecular de primeira ordem; Nome: Resultado de identificação; Mz: relação massa/núcleo; Rt: tempo de retenção (S); Massa exata: Peso molecular exato; Ppm: O erro entre o peso molecular detectado e o peso molecular teórico, medido em ppm; precursor_type: Modo de ionização, [M+H]+ é o modo de íon positivo, [MH]- é o modo de íon negativo; classe: Classificação tríplice no banco de dados HMDB; sub_class: Classificação de quatro níveis no banco de dados HMDB; KEGG: Número composto KEGG; KEGG_Pathway: via de sinalização KEGG; CAS: Número de registro do Chemical Abstracts Service; HMDB: número do banco de dados HMDB; Biblioteca: Banco de dados; Fórmula: Fórmula molecular teórica; KEGG: Número composto KEGG; Biblioteca: Banco de dados; nível: Nível de identificação de metabólitos; POS: modo de íon positivo; neg: modo de íon negativo; KMF_1/2/3: intensidade total de íons de três experimentos. Clique aqui para baixar este arquivo.
Discussão
Este estudo teve como objetivo observar os efeitos farmacológicos do KMF e explorar seu mecanismo específico de inibição da apoptose de podócitos de ratos MN. Primeiro, demonstrou in vivo que o KMF pode aliviar a apoptose de podócitos e retardar a progressão do NM ativando a via de sinalização PI3K / AKT. Em segundo lugar, os resultados transcriptômicos mostraram que o KMF pode exercer seus efeitos através das vias de sinalização PPAR, PI3K / AKT e p53, interação do receptor ECM, etc. Dentre eles, a via de sinalização PI3K/AKT foi validada em experimentos. Esses achados podem fornecer uma base científica para o uso clínico do KMF como uma opção de tratamento potencial para pacientes com NM.
A pesquisa mostrou que a apoptose de podócitos é um dos principais fatores que levam à progressão gradual da NM. Além disso, o MN limita a capacidade de divisão e proliferação dos podócitos; Consequentemente, uma vez danificada ou perdida, essa sequela afeta seriamente a função renal. Quando o número de podócitos diminui a ponto de não poderem cobrir totalmente o GBM, o GBM é completamente exposto e adere à cápsula de Bowman, causando compressão ou mesmo colapso da alça capilar glomerular, promovendo o desenvolvimento de NM para DRT 33,34,35,36. Portanto, mais pesquisas sobre o mecanismo específico da apoptose de podócitos e métodos para bloquear ou inibir a apoptose de podócitos são fundamentais para retardar a progressão da NM. A pesquisa mostrou que a via de sinalização PI3K / AKT tem múltiplas funções na regulação da apoptose celular, estresse oxidativo e resposta inflamatória e desempenha um importante papel regulador na ocorrência e desenvolvimento de NM. WT-1 e Nefrina são proteínas da membrana dos poros expressas nos podócitos, que não apenas desempenham um papel importante na manutenção da estrutura e função normais da membrana dos poros, mas também iniciam as vias de sinalização dependentes de PI3K / AKT e participam da sinalização de podócitos. A diminuição dos níveis de expressão dessas proteínas frequentemente indica danos aos podócitos 37,38,39.
PI3K é um dímero composto por uma subunidade reguladora, p85, e uma subunidade catalítica, p110, que pode ser ativada por vários fatores de crescimento e complexos. É um fator chave e iniciador neste caminho40. O gene PIK3CA está localizado no cromossomo 3 e tem um total de 20 éxons. Sua principal função é codificar uma das subunidades catalíticas da enzima PI3K, a proteína p110 α; portanto, mudanças no PIK3CA podem fazer com que a enzima PI3K permaneça em um estado ativado sustentado41. Uma vez que o PI3K é ativado, o segundo mensageiro, PIP3, irá gerar e estimular continuamente a via de sinalização AKT a jusante, enquanto o p-AKT promove a fosforilação da molécula pró-apoptótica, Bad, dissociando o complexo pró-apoptótico de Bad com Bcl-2 e Bcl-xL, e formando um complexo com a proteína 14-3-3 no citoplasma, perdendo assim sua função pró-apoptótica. As moléculas antiapoptóticas, BCL-2 e Bcl-xL, podem ser totalmente dissociadas e exercer um efeito inibitório sobre a apoptose de podócitos42,43. A caspase-3 é uma protease que desempenha um papel central na fase de execução da apoptose celular, levando à apoptose celular pela clivagem da enzima de reparo do DNA PARP em pequenos fragmentos44. A indução da liberação do citocromo c das mitocôndrias para o citoplasma pela proteína pró-apoptótica Bad é uma etapa fundamental na ativação da caspase, e o complexo de ligação do P-Bad à proteína 14-3-3 inibe esse processo, impedindo a ocorrência da cascata apoptótica 45,46,47.
Os resultados transcriptômicos indicam que o tratamento com KMF para MN está intimamente relacionado às vias de sinalização PI3K/AKT, PPAR e p53. Validou a via de sinalização PI3K/AKT por meio da análise WB. Os resultados experimentais mostraram que a via de sinalização PI3K/AKT em ratos MN foi significativamente inibida, enquanto o KMF pode ativar significativamente a via de sinalização PI3K/AKT, reduzindo a geração das moléculas pró-apoptóticas Bad e Bax e promovendo a geração da molécula antiapoptótica BCL-2, aumentando assim os níveis de expressão das proteínas da membrana hiatal dos podócitos, WT-1 e Nefrina, e reduzir a incidência de apoptose de podócitos. Portanto, o KMF reduz a apoptose de podócitos ativando a via de sinalização PI3K / AKT e descobriu-se que tem um efeito protetor em ratos modelo MN.
No entanto, este estudo apresenta algumas limitações. Primeiro, este estudo explorou apenas o mecanismo de inibição do KMF da apoptose de podócitos no nível de experimentos em animais in vivo, o que precisa ser verificado por experimentos celulares in vitro, bem como explorações aprofundadas do mecanismo; segundo, a lesão podocitária também está intimamente relacionada à autofagia, imunoinflamação e piroptose, e precisa ser mais explorado se o KMF pode afetar o NM regulando a autofagia, imunoinflamação e piroptose48,49.
A família PPAR (PPAR α, PPAR β/δ, PPAR γ) é um receptor de hormônio nuclear que depende da ativação do ligante e tem funções importantes, como participar do metabolismo energético, regular a apoptose celular e a resposta inflamatória50,51. Eles afetam a transcrição gênica formando heterodimerização com o receptor X do ácido retinóico (RXR), onde o PPAR γ regular o fator inflamatório NF-κB. A chave para a ativação do B está em sua função de proteger os podócitos de danos 52,53,54. Vários estudos mostraram que os agonistas do γ PPAR (TZD, como a pioglitazona) têm efeitos protetores renais independentes dos efeitos hipoglicêmicos, protegendo diretamente os podócitos de danos e reduzindo a proteinúria e o dano glomerular em vários modelos animais de doença renal 55,56,57,58,59. Há também relatos indicando que o PPAR pode reduzir a apoptose de podócitos inibindo a ativação da Caspase-360. As pesquisas mais recentes indicam que um novo tipo de γ PPAR, o regulador seletivo GQ-16, é mais eficaz do que o TZD na redução da proteinúria e das complicações relacionadas à síndrome nefrótica, o que também traz o amanhecer para o tratamento da doença renal61. O KMF tem um efeito protetor na apoptose de podócitos de ratos MN, ativando a via de sinalização PI3K / AKT. Com base no importante papel da via de sinalização PPAR nos rins, é necessária uma exploração mais aprofundada da relação entre KMF, PPAR e MN no futuro.
Divulgações
Todos os autores não têm conflitos de interesse a declarar.
Agradecimentos
Este trabalho foi apoiado pela Fundação Provincial de Ciências Naturais de Jilin (No.YDZJ202301ZYTS145 e No. YDZJ202301ZYTS208).
Materiais
| Name | Company | Catalog Number | Comments |
| 2-Amino-3-(2-chloro-phenyl)-propionic acid | Aladdin | 103616-89-3 | |
| 30% H2O2 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011218 | |
| 812 embedding agent | SPI | 90529-77-4 | |
| Acetone | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000418 | |
| Acetonitrile | Thermo | 75-05-8 | |
| Ammonia | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10002118 | |
| Ammonium formate | Sigma | 540-69-2 | |
| Analytical balance | Changzhou Lucky Electronic Equipment Co., Ltd | FA | |
| Anhydrous ethanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10009218 | |
| Anti fluorescence quenching and sealing agent | southernbiotech | 0100-01 | |
| Automatic biochemical analyzer | Rayto Life and Analytical Sciences | Chemray240 | |
| BCA Protein Assay Kit | Solarbio | PC0020 | |
| Benazepril hydrochloride tablets | Xinya Minhang | H20044840 | |
| Blender | Kylin-Bell | BE-2600 | |
| Brick and stone cutting blade | Daitome | Ultra45 | |
| BSA | ZSGB-BIO | ZLI-9027 | |
| Buffer RW | Beijing Baiao Leibo | WK191 | |
| Carbodiimide hydrochloride | Hubei Xinghengye Technology | 25952-53-8 | |
| Cell apoptosis detection kit | Elabscience | E-CK-A322 | |
| Chemiluminescence imaging system | Hangzhou Shenhua Technology Co., Ltd | SH-523 | |
| Chloroform | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10006818 | |
| Constant temperature drying oven | Thermo Fisher | Heto PowerDiy LL3000 | |
| Cover glass slide | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212450C | |
| CY3 Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1032 | |
| DAB reagent kit | Servicebio | G1212-200T | |
| DAPI | Blue Cloud Sky | C1002 | |
| Decolorization shaker | Wuhan Lingsi Biotechnology Co., Ltd | TSY-B | |
| Dehydration machine | Wuhan Junjie Electronics Co., Ltd | JJ-12J | |
| DL2000 DNA Marker | TIANGEN | MD114 | |
| DMSO | MCE | HY-Y0320 | |
| dNTP | TIANGEN | CD117 | |
| EBlot L1 Rapid Wet Rotation Instrument | Kingsray Biotechnology Co., Ltd | L00686C | |
| ECL substrate solution | affinity | KF8003 | |
| Electric constant temperature water bath pot | Fisaff Instrument (Hebei) Co., Ltd | DK-20000-IIIL | |
| Electrophoresis instrument power supply | Beijing Longfang Technology Co., Ltd | LF-600S | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd | JB-P5 | |
| Equilibrium buffer | Wuhan Lingsi Biotechnology Co., Ltd | E8090 | |
| Ethylenediamine | Ruichengkang Pharmaceutical Technology | 107-15-3 | |
| FA series multifunctional analytical electronic balance | Changzhou Lucky Electronic Equipment Game Company | FA1204 | |
| Filter membrane | Jinteng | Nylon6-0.22μm | |
| Formaldehyde solution | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10010018 | |
| Formic acid | TCI | 64-18-6 | |
| Freezing centrifuge | Xiangyi | H1850-R | |
| Frozen platform | Wuhan Junjie Electronics Co., Ltd | JB-L5 | |
| Glacial acetic acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Glass bead | Sigma | G8772-500G | |
| Glass slide | Nantong Meiweide Life Science Co., Ltd | PC2-301 | |
| glycine | Biofroxx | 30166428 | |
| Hematoxylin | Wuhan Lingsi Biotechnology Co., Ltd | G1140 | |
| High speed refrigerated centrifuge | Hunan Kecheng Instrument Equipment Co., Ltd | H1-16KR | |
| Horizontal agarose electrophoresis tank | Long Fang | LF-31DS | |
| Horizontal shaker | Jiangsu Haimen Qilin Bell Instrument Manufacturing Co., Ltd | TS-1 | |
| HRP Conjugated AffiniPure Goat Anti-rabbit IgG (H+L) | BOSTER | BA1054 | |
| hydrochloric acid | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10011028 | |
| Imaging system | Nikon | Nikon DS-U3 | |
| Incomplete Freund's adjuvant | MCE | ISA-51 | |
| Intelligent digital magnetic heating stirrer | Hangzhou Miou Instrument Co., Ltd | TP-350E+ | |
| Isoflurane | Sigma | 26675-46-7 | |
| Isopropanol | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 80109218 | |
| KCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10020318 | |
| KH2PO4 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 1115GR500 | |
| Liquid chromatograph | Thermo | IQLAAAGABHFAPUMBJC | |
| marker(10-250KD) | Mei5bio | MF028-plus-01 | |
| marker(20-120KD) | GenScript | M00521 | |
| Mass spectrometer | Thermo | IQLAAEGAAPFALGMBDK | |
| Masson staining kit | BASO | BA4079B | |
| Methanol | Thermo | 67-56-1 | |
| microscope | Nikon | ECLIPSE Ci | |
| microwave oven | Galanz Microwave Oven Electrical Appliance Co., Ltd | P70D20TL-P4 | |
| Multi sample tissue grinder | Shanghai Jingxin Industrial Development Co., Ltd | Tissuelyser-24L | |
| Multiskan FC ELISA reader | Thermo scientific | 1410101 | |
| Na2HPO4.12H2O | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10017618 | |
| NaCl | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10000218 | |
| Neutral resin | Wuhan Lingsi Biotechnology Co., Ltd | G8590 | |
| Normal Goat Serum | Solarbio | SL038 | |
| Organizational spreading machine | Zhejiang Jinhua Kedi Instrument Equipment Co., Ltd | KD-P | |
| Osmic acid | Ted Pella Inc | 18450 | |
| oven | Shanghai Huitai Instrument Manufacturing Co., Ltd | DHG-9140A | |
| Palm centrifuge | Wuhan Lingsi Biotechnology Co., Ltd | D1008E | |
| Paraformaldehyde | Solarbio | P1110 | |
| PAS staining kit | BASO | BA4114B | |
| Pathological slicer | Shanghai Leica Instrument Co., Ltd | RM2016 | |
| PBS | Solarbio | P1020 | |
| PCR instrument | Hangzhou Miou Instrument Co., Ltd | PR-96 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | PB-10 | |
| PH meter | Sedolis Scientific Instruments (Beijing) Co., Ltd | 2018C132-11 | |
| PI3K inhibitor LY294002 | MCE | HY-10108 | |
| Pipette gun | Dragon | KE0003087/KA0056573 | |
| Protein phosphatase inhibitor complex | Meilunbio | MB12707-1 | |
| PVDF membrane (0.22 μm) | Solarbio | ISEQ00010 | |
| PVDF membrane (0.45 μm) | Solarbio | YA1701 | |
| Quick primary/secondary antibody diluent | Solarbio | A1811 | |
| Rabbit anti-AKT | Affinity | AF0836 | |
| Rabbit anti-BAD | Affinity | AF6471 | |
| Rabbit anti-C3 | Affinity | DF13224 | |
| Rabbit anti-GAPDH | Hangzhou Xianzhi | AB-P-R 001 | |
| Rabbit anti-IgG | CST | 3900S | |
| Rabbit anti-Nephrin | bioss | bs-10233R | |
| Rabbit anti-P-AKT | Affinity | AF0016 | |
| Rabbit anti-p-BAD | invitrogen | PA5-105023 | |
| Rabbit anti-PI3K | Affinity | AF6241 | |
| Rabbit anti-PIK3CA | Bioss | Bs-2067R | |
| Rabbit anti-WT-1 | Affinity | DF6331 | |
| Real-Time PCR System | ABI | QuantStudio 6 | |
| RIPA Lysis Buffer | Meilunbio | MA0151 | |
| SDS | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10019318 | |
| Slide and cover glass | Jiangsu Shitai Experimental Equipment Co., Ltd | 10212432C | |
| Super pure water instrument | Zhiang Instrument (Shanghai) Co., Ltd | Clever-S15 | |
| SYBR Green Master Mix | VAZYME | Q111-02 | |
| Taq Plus DNA Polymerase | TIANGEN | ET105-02 | |
| Tissue grinder | Beautiful Wall | MB-96 | |
| Transmission electron microscope | HITACHI | HT7800/HT7700 | |
| Tris-base | Biofroxx | 10019318 | |
| Trizol | Ambion | 15596-026 | |
| TUNEL Cell Apoptosis Detection Kit (FITC) | Beijing Baiao Leibo | SY0475 | |
| Tween 20 | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 30189328 | |
| Ultra micro UV visible spectrophotometer | Hangzhou Miou Instrument Co., Ltd | ND-100 | |
| Ultra thin slicer | Leica | Leica UC7 | |
| Ultrasonic cleaner | shumei | KQ- 800DE | |
| Upright optical microscope | Nikon | Nikon Eclipse CI | |
| Urinary Protein Test Kit | Nanjing Jiancheng Bioengineering Research Institute | C035-2 | |
| Vertical electrophoresis tank | Beijing 61 Instrument Factory | DYCZ-24DN | |
| Vortex mixer | Wuhan Lingsi Biotechnology Co., Ltd | MX-F | |
| Western Blocking Buffer | Solarbio | SW3010 | |
| xylene | China National Pharmaceutical Group Chemical Reagent Co., Ltd | 10023418 |
Referências
- McQuarrie, E. P., Mackinnon, B., Stewart, G. A., Geddes, C. C., Registry, S. R. B. Membranous nephropathy remains the commonest primary cause of nephrotic syndrome in a northern European Caucasian population. Nephrol Dial Transplant. 25 (3), 1009-1011 (2010).
- Ronco, P. H., Debiec, H. Pathophysiological advances in membranous nephropathy: time for a shift in patient's care. Lancet. 385 (9981), 1983-1992 (2015).
- Xu, X., et al. Long-term exposure to air pollution and increased risk of membranous nephropathy in China. J Am Soc Nephrol. 27 (12), 3739-3746 (2016).
- Fogo, A. B., Lusco, M. A., Najafian, B., Alpers, C. E. AJKD atlas of renal pathology: Membranous nephropathy. Am J Kidney Dis. 66 (3), e15-e17 (2015).
- Li, X., Zhang, X. Comments on the 2021 Kidney Disease: Improving Global Outcomes (KDIGO) clinical practice guideline for anticoagulant therapy in patients with membranous nephropathy. Kidney Int. 101 (1), 186-187 (2022).
- Ruggenenti, P., Fervenza, F. C., Remuzzi, G. Treatment of membranous nephropathy: time for a paradigm shift. Nat Rev Nephrol. 13 (9), 563-579 (2017).
- Klomjit, N., Fervenza, F. C., Zand, L. Successful treatment of patients with refractory PLA2R-associated membranous nephropathy with Obinutuzumab: A report of 3 cases. Am J Kidney Dis. 76 (6), 883-888 (2020).
- Podestà, M. A., Ruggiero, B., Remuzzi, G., Ruggenenti, P. Ofatumumab for multirelapsing membranous nephropathy complicated by rituximab-induced serum-sickness. BMJ Case Rep. 13 (1), e232890-e232896 (2020).
- Stehlé, T., et al. Anti-CD38 therapy for PLA2R-positive membranous nephropathy resistant to conventional immunosuppression. Kidney Int. 101 (2), 416-418 (2022).
- Trimarchi, H., Coppo, R. Podocytopathy in the mesangial proliferative immunoglobulin A nephropathy: new insights into the mechanisms of damage and progression. Nephrol Dial Transplant. 34 (8), 1280-1285 (2019).
- Kopp, J. B., et al. Podocytopathies. Nat Rev Dis Primers. 6 (1), 68-72 (2020).
- Hoxha, E., Reinhard, L., Stahl, R. A. K. Membranous nephropathy: new pathogenic mechanisms and their clinical implications. Nat Rev Nephrol. 18 (7), 466-478 (2022).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (8), 112349-112356 (2021).
- Chen, J., et al. Danshen injection induces autophagy in podocytes to alleviate nephrotic syndrome via the PI3K/AKT/mTOR pathway. Phytomedicine. 107 (7), 154477-154489 (2022).
- Wang, Y., et al. Fangji Huangqi decoction ameliorates membranous nephropathy through the upregulation of BNIP3-mediated mitophagy. J Ethnopharmacol. 324 (13), 117734-117743 (2024).
- Wei, L., et al. Shenqi granule upregulates CD2AP and α-actinin4 and activates autophagy through regulation of mTOR/ULK1 pathway in MPC5 cells. J Ethnopharmacol. 303 (16), 115942-115954 (2023).
- Wang, P., et al. A review of the botany, phytochemistry, traditional uses, pharmacology, toxicology, and quality control of the Astragalus memeranaceus. Front Pharmacol. 14 (2), 1242318-1242325 (2023).
- Wang, Q., et al. Traditional Chinese medicine method of tonifying kidney for hypertension: Clinical evidence and molecular mechanisms. Front Cardiovasc Med. 20229 (16), 1038480-1038487 (2022).
- Tang, X., et al. Experimental models for elderly patients with membranous nephropathy: Application and advancements. Exp Gerontol. 185 (8), 112341-112353 (2024).
- Zhang, J. J., et al. Murine membranous nephropathy: immunization with α3(IV) collagen fragment induces subepithelial immune complexes and FcγR-independent nephrotic syndrome. J Immunol. 188 (7), 3268-3277 (2012).
- Hopfer, H., et al. The importance of cell-mediated immunity in the course and severity of autoimmune anti-glomerular basement membrane disease in mice. FASEB J. 17 (8), 860-868 (2003).
- Fleuren, G., Grond, J., Hoedemaeker, P. J. In situ formation of subepithelial glomerular immune complexes in passive serum sickness. Kidney Int. 17 (5), 631-637 (1980).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Border, W. A., Ward, H. J., Kamil, E. S., Cohen, A. H. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest. 69 (2), 451-461 (1982).
- Rubio-Navarro, A., et al. Phenotypic characterization of macrophages from rat kidney by flow cytometry. J Vis Exp. (116), e54599 (2016).
- Hou, Y., et al. Longzhibu disease and its therapeutic effects by traditional Tibetan medicine: Ershi-wei Chenxiang pills. J Ethnopharmacol. 249, 112426 (2020).
- Sethi, S., et al. Hematopoietic stem cell transplant-membranous nephropathy is associated with protocadherin FAT1. J Am Soc Nephrol. 33 (5), 1033-1044 (2022).
- Gong, Q., Lai, T., Liang, L., Jiang, Y., Liu, F. Targeted inhibition of CX3CL1 limits podocytes ferroptosis to ameliorate cisplatin-induced acute kidney injury. Mol Med. 29 (1), 140-148 (2023).
- Li, H., et al. IL-23 reshapes kidney resident cell metabolism and promotes local kidney inflammation. J Clin Invest. 131 (12), e142428-e142441 (2021).
- Wang, C., et al. Artificially cultivated Ophiocordyceps sinensis alleviates diabetic nephropathy and its podocyte injury via inhibiting P2X7R expression and NLRP3 inflammasome activation. J Diabetes Res. 356 (11), 1390418-1390431 (2018).
- Cheng, H., et al. PI3K/Akt signaling pathway and Hsp70 activate in hippocampus of rats with chronic manganese sulfate exposure. J Trace Elem Med Biol. 50 (12), 332-338 (2018).
- Ji, K., et al. The immunoreaction and antioxidant capacity of juvenile blunt snout bream (Megalobrama amblycephala) involves the PI3K/Akt/Nrf2 and NF-κB signal pathways in response to dietary methionine levels. Fish Shellfish Immunol. 105 (10), 126-134 (2020).
- Chiou, T. T., et al. Rapamycin attenuates PLA2R activation-mediated podocyte apoptosis via the PI3K/AKT/mTOR pathway. Biomed Pharmacother. 144 (3), 112349-112357 (2021).
- Lv, Q., Yang, F., Chen, K., Zhang, Y. Autophagy protects podocytes from sublytic complement induced injury. Exp Cell Res. 341 (2), 132-138 (2016).
- Mundel, P., Shankland, S. J. Podocyte biology and response to injury. J Am Soc Nephrol. 13 (12), 3005-3015 (2002).
- Sun, Z., Xu, Q., Ma, Y., Yang, S., Shi, J. Circ_0000524/miR-500a-5p/CXCL16 axis promotes podocyte apoptosis in membranous nephropathy. Eur J Clin Invest. 51 (3), e13414-e13422 (2021).
- Huber, T. B., et al. Nephrin and CD2AP associate with phosphoinositide 3-OH kinase and stimulate AKT-dependent signaling. Mol Cell Biol. 23 (14), 4917-4928 (2003).
- Ai, Z., et al. Deciphering the pharmacological mechanisms of Rostellularia procumbens (L) Nees. Extract alleviates adriamycin-induced nephropathy in vivo and in vitro. Phytomedicine. 113 (6), 154736-154742 (2023).
- Wang, X., et al. Nicorandil alleviates apoptosis in diabetic cardiomyopathy through PI3K/Akt pathway. J Cell Mol Med. 23 (8), 5349-5359 (2019).
- Fox, M., Mott, H. R., Owen, D. Class IA PI3K regulatory subunits: p110-independent roles and structures. Biochem Soc Trans. 48 (4), 1397-1417 (2020).
- Miricescu, D., et al. PI3K/AKT/mTOR signaling pathway in breast cancer: From molecular landscape to clinical aspects. Int J Mol Sci. 22 (1), 173-179 (2020).
- Feng, C., et al. Neuroprotective effect of Danhong injection on cerebral ischemia-reperfusion injury in rats by activation of the PI3K-Akt pathway. Front Pharmacol. 11 (4), 298-312 (2020).
- Zhou, Y., et al. 1,3-Dicaffeoylquinic acid targeting 14-3-3 tau suppresses human breast cancer cell proliferation and metastasis through IL6/JAK2/PI3K pathway. Biochem Pharmacol. 172 (12), 113752-113761 (2020).
- Li, J., et al. Tetrandrine inhibits colon carcinoma HT-29 cells growth via the Bcl-2/Caspase 3/PARP pathway and G1/S phase. Biosci Rep. 39 (5), (2019).
- Downward, J. How BAD phosphorylation is good for survival. Nat Cell Biol. 1 (2), E33-E35 (1999).
- Fan, J., et al. A model of ischemia and reperfusion increases JNK activity, inhibits the association of BAD and 14-3-3, and induces apoptosis of rabbit spinal neurocytes. Neurosci Lett. 473 (3), 196-201 (2010).
- Chipuk, J. E., Green, D. R. How do BCL-2 proteins induce mitochondrial outer membrane permeabilization. Trends Cell Biol. 18 (4), 157-164 (2008).
- Yin, L., Yu, L., He, J. C., Chen, A. Controversies in podocyte loss: Death or detachment. Front Cell Dev Biol. 9 (11), 771931-771942 (2021).
- Yang, C., et al. Research progress on multiple cell death pathways of podocytes in diabetic kidney disease. Mol Med. 29 (1), 135-143 (2023).
- Calvier, L., et al. PPARγ links BMP2 and TGFβ1 pathways in vascular smooth muscle cells, regulating cell proliferation and glucose metabolism. Cell Metab. 25 (5), 1118-1134 (2017).
- Dai, Z. W., Cai, K. D., Xu, L. C., Wang, L. L. Perilipin2 inhibits diabetic nephropathy-induced podocyte apoptosis by activating the PPARγ signaling pathway. Mol Cell Probes. 53 (3), 101584-101596 (2020).
- Kota, B. P., Huang, T. H., Roufogalis, B. D. An overview on biological mechanisms of PPARs. Pharmacol Res. 51 (2), 85-94 (2005).
- Wahli, W. Peroxisome proliferator-activated receptors (PPARs): from metabolic control to epidermal wound healing. Swiss Med Wkly. 132 (7-8), 83-91 (2002).
- Agrawal, S., He, J. C., Tharaux, P. L. Nuclear receptors in podocyte biology and glomerular disease. Nat Rev Nephrol. 17 (3), 185-204 (2021).
- Miglio, G., et al. Protective effects of peroxisome proliferator-activated receptor agonists on human podocytes: proposed mechanisms of action. Br J Pharmacol. 167 (3), 641-653 (2012).
- Miglio, G., et al. The subtypes of peroxisome proliferator-activated receptors expressed by human podocytes and their role in decreasing podocyte injury. Br J Pharmacol. 162 (1), 111-125 (2011).
- Agrawal, S., Guess, A. J., Benndorf, R., Smoyer, W. E. Comparison of direct action of thiazolidinediones and glucocorticoids on renal podocytes: protection from injury and molecular effects. Mol Pharmacol. 80 (3), 389-399 (2011).
- Sonneveld, R., et al. Sildenafil prevents podocyte injury via PPAR-γ-mediated TRPC6 inhibition. J Am Soc Nephrol. 28 (5), 1491-1505 (2017).
- Agrawal, S., et al. Pioglitazone enhances the beneficial effects of glucocorticoids in experimental nephrotic syndrome. Sci Rep. 6 (3), 24392-24404 (2016).
- Kanjanabuch, T., et al. PPAR-gamma agonist protects podocytes from injury. Kidney Int. 71 (12), 1232-1239 (2007).
- Bryant, C., et al. Selective modulator of nuclear receptor PPARγ with reduced adipogenic potential ameliorates experimental nephrotic syndrome. iScience. 25 (4), 104001 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados