É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
O Modelo de encefalopatia hipóxico isquêmica Perinatal da Isquemia
Neste Artigo
Resumo
O modelo de ratos pós-natal para hipóxico-isquêmica lesão cerebral é um modelo bem estabelecido de humanos encefalopatia hipóxico isquêmica neonatal (HIE). Neste artigo, descrevemos o modelo de HIE em filhotes de ratos pós-natal.
Resumo
Encefalopatia hipóxico-isquêmica (EHI) é a conseqüência de asfixia sistêmica que ocorre no nascimento. Vinte e cinco por cento dos recém-nascidos com EHI desenvolver seqüelas graves e permanentes neuropsicológicos, incluindo retardo mental, paralisia cerebral e epilepsia. Os resultados da HIE são devastadores e permanentes, tornando-se fundamental para identificar e desenvolver estratégias terapêuticas para reduzir a lesão cerebral em recém-nascidos com EHI. Para o efeito, o modelo de rato neonatal para hipóxico-isquêmica lesão cerebral foi desenvolvido para este modelo condição humana. O modelo HIE foi validado por Vannucci et al 1 e desde então tem sido amplamente utilizado para identificar mecanismos de lesão cerebral resultante da isquemia perinatal hypoxia-2 e para testar potenciais intervenções terapêuticas 3,4. O modelo HIE é um processo em duas etapas e envolve a ligadura da artéria carótida comum esquerda, seguida da exposição a um ambiente hipóxico. Fluxo sangüíneo cerebral (CBF) no hemisfério ipsilateral à artéria carótida ligada não diminui por causa do fluxo sanguíneo colateral através do polígono de Willis, no entanto com a tensão mais baixa de oxigênio, a CBF no hemisfério ipsilateral diminui significativamente e resulta em lesão isquêmica unilateral . O uso de cloreto de 2,3,5-trifeniltetrazólio (TTC) a mancha e identificar o tecido cerebral isquêmico foi originalmente desenvolvida para modelos adultos de isquemia cerebral de roedores 5, e é usado para avaliar a extensão da infarctin cerebral em momentos iniciais até 72 horas após o evento isquêmico 6. Neste vídeo, demonstramos o modelo de lesão hipóxico-isquêmica no cérebro de ratos pós-natal ea avaliação do tamanho do infarto usando coloração TTC.
Protocolo
Este protocolo foi aprovado pelo Institutional Animal Care e do Comitê Use na Universidade de Stanford e age de acordo com os Institutos Nacionais de Saúde diretrizes para o uso de animais experimentais.
Modelo de HIE neonatal Rat
- Dia pós natal (PND) 7 filhotes de ratos Sprague-Dawley (Charles River Laboratories, Inc., Wilmington, MA) estão totalmente anestesiados com isoflurano (Aerrane, Baxter, Deerfield, IL; 3-4% para a indução e 1-2% para manutenção).
- Uma pequena incisão é feita no pescoço (Extra Fino Tesoura Iris # 14088-10, Fine Ciência Tools Inc, Foster City, CA) para expor a artéria carótida comum esquerda (CCA).
- O CCA é ligada com um fio de seda 5-0 (5-0 seda, Ethicon, Somer, NJ).
- A incisão é fechada com cola de cianoacrilato (Elmers Products Inc, Columbus, OH). A incisão é coberta com fita adesiva e anestesia é interrompida. Os filhotes são devolvidos aos seus barragem e permitiu a recuperação de 1-2 horas.
- Filhotes são então colocados em uma câmara hipóxica que contém oxigênio de 8% balanceada com nitrogênio 92% para 100 minutos a 37 ° C. 8% de gás nitrogênio oxygen/92% (Airgas, Sacramento, CA) do fluxo através de um tubo na gaiola do mouse equipado com uma cobertura de plástico. A capa é feita para se ajustar à gaiola e tem dois furos de 2 cm de diâmetro, um dos quais para receber o tubo ligado ao tanque de oxigênio de 8% do gás e outra permite que o gás flowout. A câmara é colocada em um banho de água e é aquecido antes do uso e um termômetro dentro dele deve registrar 37 ° C antes do início da hipóxia.
- No final de 100 minutos de hipóxia, os filhotes são devolvidos de novo à sua barragem para a recuperação.
- 24 horas após o fim da hipóxia, os filhotes são sacrificados por anestesia profunda com isoflurano. Tecido cerebral é perfundido com solução salina fria, seguido de uma solução de frio TTC 1% em tampão fosfato pH, solução salina 7,4 (Sigma Chemical Co, St Louis, MO). TTC devem ser mantidos ao abrigo da luz.
- Cérebros são removidos e resfriados por 1-2 minutos no gelo, e quatro cortes coronais 3 milímetros de distância (níveis 1-4) são cortados, começando rostralmente ao nível do opticchiasm e infundíbulo, correspondente ao bregma 1,8 ~ 2,0 mm de nível o cérebro do rato adulto.
- Fatias de cérebro são imersos numa solução TTC e incubados a 37 ° C por 8 minutos, seguido de fixação em paraformaldeído a 4% / PBS durante a noite. TTC porque é sensível à luz, manter fatias longe da luz durante este tempo.
- Os cortes corados TTC são escaneados e digitalizados. Usando Image J (NIH, Bethesda, MD), os seguintes são medidos para cada nível: área de infarto (área imaculada), a área do hemisfério ipsilateral, ea área do hemisfério contralateral. O percentual de infarto área por fatia é calculado como: (área de infarto / área do hemisfério ipsilateral) ou A 1, A 2, A 3 e A 4. Por cento do volume de infarto é calculada como a soma (A 1 + A 2 + A 3 + A 4) * 3mm. Áreas de lesão cortical ou estriado também pode ser quantificado separadamente de forma semelhante.
Resultados representante
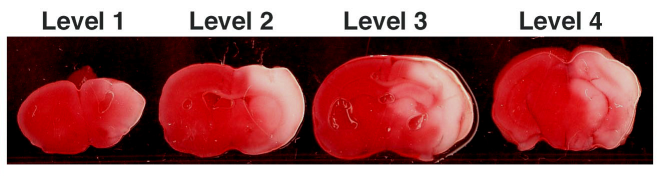
Figura 1. HIE representativo níveis coronal 04/01 corados com TTC.
TTC manchada secções coronal demonstram área de infarto (em branco).
Access restricted. Please log in or start a trial to view this content.
Discussão
O roedor modelo HIE pós-natal é um modelo estabelecido que recapitula hipóxia cerebral que ocorrem no período peri-natal em recém-nascidos. Extensos estudos de caracterização histológica e imunocitoquímica têm demonstrado que o roedor 7 dias de idade tem a maturidade do cérebro análogo ao modelo um terceiro trimestre 7 feto humano. O modelo HIE roedor foi muito informativo para a compreensão dos mecanismos da lesão cerebral de peri-natal hipóxia 2, onde as intervenções, tais como hipotermia foram valid...
Access restricted. Please log in or start a trial to view this content.
Agradecimentos
Financiado pela American Heart Association e March of Dimes.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments | |
| Sprague-Dawley Rat Pups | Animal | Charles River Laboratories | ||
| Isoflurane | Surgery | Baxter Internationl Inc. | ||
| 8% Oxygen/ 92% Nitrogen Gas | Surgery | Airgas | ||
| 2,3,5-triphenyl tetrazolium chloride | Reagent | Sigma-Aldrich | T8877 | |
| Phosphate buffered saline (PBS) pH 7.4 | Reagent | GIBCO, by Life Technologies | ||
| Paraformaldehyde | Reagent | Sigma-Aldrich | P6148 |
Referências
- Rice, J. E. 3rd, Vannucci, R. C., Brierley, J. B. The influence of immaturity on hypoxic-ischemic brain damage in the rat. Annals of neurology. 9 (2), 131-141 (1981).
- Vannucci, R. C., Vannucci, S. J. Perinatal Hypoxic-Ischemic Brain Damage: Evolution of an Animal Model. Dev Neurosci. 27 (2-4), 81-86 (2005).
- Bona, E., Hagberg, H., Loberg, E. M. Protective effects of moderate hypothermia after neonatal hypoxia-ischemia: short- and long-term outcome. Pediatric research. 43 (6), 738-738 (1998).
- Trescher, W. H., Ishiwa, S., Johnston, M. V. Effects of hypothermia and hyperthermia on attentional and spatial learning deficits following neonatal hypoxia-ischemic insult in rats. Behavioural brain research. 151 (1-2), 209-209 (2004).
- Mishima, K., Ikeda, T., Yoshikawa, T. Brief post-hypoxic-ischemic hypothermia markedly delays neonatal brain injury. Brain development. 19 (5), 326-326 (1997).
- Young, R. S., Olenginski, T. P., Yagel, S. K. The effect of graded hypothermia on hypoxic-ischemic brain damage: a neuropathologic study in the neonatal rat. Stroke; a journal of cerebral circulation. 14 (6), 929-929 (1983).
- Bederson, J. B., Pitts, L. H., Germano, S. M., et al. Evaluation of 2,3,5-triphenyltetrazolium chloride as a stain for detection and quantification of experimental cerebral infarction in rats. Stroke; a journal of cerebral circulation. 17 (6), 1304-1304 (1986).
- Cai, J., Kang, Z., Liu, W. W. Hydrogen therapy reduces apoptosis in neonatal hypoxia-ischemia rat model. Neuroscience letters. 441 (2), 167-167 (2008).
- Grow, J., Barks, J. D. Pathogenesis of hypoxic-ischemic cerebral injury in the term infant: current concepts. Clinics in perinatology. 29 (4), 585-585 (2002).
- Aden, U., Halldner, L., Lagercrantz , H., et al. Aggravated brain damage after hypoxic ischemia in immature adenosine A2A knockout mice. Stroke; a journal of cerebral circulation. 34 (3), 739-739 (2003).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados