É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A técnica de coleta de líquido cefalorraquidiano Serial da Cisterna Magna em rato
Resumo
Modelos transgênicos (Tg) do mouse do AD uma excelente oportunidade para investigar como e por que níveis Aâ ou tau na mudança CSF como a doença progride em pacientes humanos. Aqui, nós demonstramos uma refinada técnica de punção da cisterna magna para amostragem CSF serial do mouse.
Resumo
Doença de Alzheimer (AD) é uma doença neurodegenerativa progressiva que é patologicamente caracterizada pela deposição extracelular de β-amilóide peptídeo (Aâ) e acúmulo de proteína tau intraneuronais hiperfosforilada. Porque líquido cefalorraquidiano (LCR) está em contato direto com o espaço extracelular do cérebro, que proporciona um reflexo das mudanças bioquímicas no cérebro em resposta a processos patológicos. CSF de pacientes com DA mostra uma diminuição na forma de 42 aminoácidos de Aâ (Aβ42), e aumenta em tau tau total e hiperfosforilada, embora os mecanismos responsáveis por essas alterações ainda não são totalmente compreendidos. Modelos transgênicos (Tg) do mouse do AD uma excelente oportunidade para investigar como e por que níveis Aâ ou tau na mudança CSF como a doença progride. Aqui, nós demonstramos uma refinada técnica de punção da cisterna magna para a CSF de amostragem a partir do mouse. Esta técnica de amostragem extremamente suave permite que as amostras de série CSF a serem obtidos com o mouse mesmo em intervalos de 2-3 meses, que minimiza bastante o efeito de confusão entre mouse-variabilidade nos níveis Aâ ou tau, tornando possível detectar alterações sutis ao longo do tempo. Em combinação com Aâ ELISA e tau, esta técnica será útil para estudos destinados a investigar a relação entre os níveis de CSF Aβ42 e tau, e seu metabolismo no cérebro em modelos de ratos AD. Estudos em camundongos Tg poderia fornecer validação importante quanto ao potencial da CSF Aâ ou níveis de tau para serem utilizados como marcadores biológicos para a progressão da doença, monitorização e para monitorar o efeito de intervenções terapêuticas. Como os ratos podem ser sacrificados e os cérebros podem ser examinados por alterações bioquímicas ou histológicas, os mecanismos subjacentes à alterações do LCR pode ser melhor avaliada. Estes dados são susceptíveis de ser informativo para a interpretação de alterações do LCR humano AD.
Protocolo
Puxando o tubo de vidro capilar
- O tubo de vidro capilar é comprado de Instrumento Sutter Inc (vidro borosilicato, B100-75-10).
- Puxe a tubos capilares em um Sutter P-87 Flaming micropipeta extrator, com o índice de calor fixado em 300 eo índice de pressão fixado em 330.
- Apare a ponta do tubo capilar de vidro com uma tesoura, de modo que a ponta cônica tem um diâmetro interno de cerca de 0,5 mm.
Cisterna magna técnica de punção de LCR
Amostras de LCR são retirados da cisterna magna (Figura 1) usando um método que foi publicado anteriormente 1. 
Figura 1
1. Os ratos são anestesiados pela quetamina (100mg/kg) e (10mg/kg) xilazina por via intraperitoneal, administrada. Durante o tempo de indução da anestesia, os ratos são mantidos em um 37 º C incubadora.
2. A pele do pescoço é raspada, eo mouse é então colocado de bruços no instrumento estereotáxico com o contato direto de uma almofada de aquecimento. Uma sonda de temperatura retal é inserido no reto de modo que o calor produzido pela almofada de aquecimento é ajustada em resposta às mudanças de temperatura do corpo. A cabeça é presa com os adaptadores de cabeça. O sítio cirúrgico é limpo com iodopovidona 10%, seguido pelo etanol 7% 0 (repetir 3 vezes), e uma incisão sagital da pele é composta inferior ao occipital.
3. Sob o microscópio de dissecção, o tecido subcutâneo e os músculos (m. biventer cervicis e m. rectus capitis dorsalis major) são separados por dissecção romba com uma pinça. Um par de microretractors é usada para manter os músculos separados.
4. O mouse está previsto para que a cabeça forma um ângulo de quase 135 o com o corpo.
5. Sob o microscópio de dissecação, a dura-máter da cisterna magna aparece como um triângulo brilhante e clara reverter através do qual o bulbo e um grande vaso sanguíneo (artéria spinalis dorsalis), eo espaço CSF são visíveis (Figura 2). 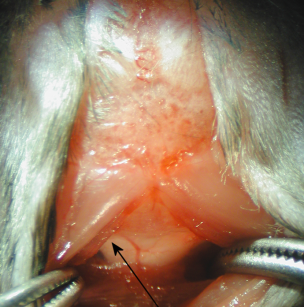
Figura 2
6. A dura-máter é seco com papel absorvente com cotonete estéril. Penetrar no tubo capilar no Citerna magna através da dura-máter, lateral ao spinalis dorsalis artéria (Figura 2). Após uma mudança notável na resistência à inserção do tubo capilar, o líquor flui para dentro do tubo capilar.
7. Remova cuidadosamente o tubo capilar, e conectá-lo a uma seringa de 3 ml por meio de um tubo de polietileno que tem um diâmetro interno de 1 mm. Injetar o CSF em um 0,5 ml pré-marcada tubo eppendorf, e congelar imediatamente o tubo em gelo seco e depois transferi-lo para um freezer -80 C °.
8. Após a amostragem CSF, os músculos são re-alinhados, ea pele é suturada (4-0, Ethicon, Johnson & Johnson). Cerca de 1 ml de NaCl 0,9% é administrado por via subcutânea para evitar a desidratação. O mouse é mantido na incubadora para manter a temperatura corporal até que ele se recupera, o peso do mouse é monitorado um dia e uma semana após a cirurgia.
Resultados e Discussão
Nós descrevemos um protocolo altamente confiável para a amostragem de série do CSF de ratos sem contaminação plasma detectável.
1. Todo o procedimento geralmente leva de 10 min por mouse (incluindo anestesia). O volume de LCR obtido é dependente da linhagens de camundongos. No PS / APP dupla camundongos Tg usamos 2, o volume médio é de cerca de 5 mL (3-7 mL), enquanto o P301L (JNPL3) ratos 3 dão um rendimento de cerca de 10 ml mL-15. Para a amostragem de série, um máximo de 7-8 mL podem ser tomadas com segurança a cada vez em um intervalo de 2-3 meses.
2. Durante a cirurgia, é importante a posição da cabeça e do corpo do rato de modo adequado no quadro estereotáxico para que a dura-máter da cisterna magna podem ser expostos de forma suficiente. Evitar cuidadosamente os vasos sanguíneos ao penetrar a dura-máter com o tubo capilar para evitar a contaminação das proteínas plasmáticas, que podem ser monitorados na amostra CSF por immunoblotting para ApoB 4.
3. Minimizar o dano tecidual durante cada cirurgia é importante, pois conglutinação tecido pode aumentar a dificuldade de sangramento predisponentes para a amostragem seguinte.
4. A temperatura do corpo precisa ser bem mantido durante a cirurgia porque a hipotermia causada pela anestesia podem afetar significativamente os níveis de tau fosforilada no cérebro muito rapidamente 5.
5. O Ab ELISA protocolo e anticorpos que usamos foram descritos em detalhe no Refolo et al. 6. Dois mL de LCR dos ratos PS / APP dará resultados satisfatórios quando diluído 1:50-1:60. Para o ELISA tau, 4-5 mL de P301L CSF (JNPL3) ratos serão suficientes para odetecção de tau total, ou tau fósforo ylated em treonina 231 (Os kits são comprados de Bio-Source).
6. Esta técnica pode ser aplicada a outros modelos de mouse de doenças neurológicas, para o qual um pequeno volume de LCR é satisfatória para os ensaios desejados.
Discussão
Nós descrevemos um protocolo altamente confiável para a amostragem de série do CSF de ratos sem contaminação plasma detectável.
1. Todo o procedimento geralmente leva de 10 min por mouse (incluindo anestesia). O volume de LCR obtido é dependente da linhagens de camundongos. No PS / APP dupla camundongos Tg nós used2, o volume médio é de cerca de 5 mL (3-7 mL), enquanto o P301L (JNPL3) ratos 3 dão um rendimento de cerca de 10 ml-15 mL. Para a amostragem de série, um máximo de 7-8 mL podem ser tomadas com segurança...
Agradecimentos
Nosso trabalho é apoiado pelo NIH concede NS048447 e KD AG017216to. Li Liu gostaria de agradecer ao Dr. Heikki Tanila (Universidade de Kuopio, Kuopio, na Finlândia), por sua supervisão e apoio durante o desenvolvimento do protocolo original.
Referências
- Liu, L., et al. Longitudinal observation on CSF Abeta42 levels in young to middle-aged amyloid precursor protein/presenilin-1 doubly transgenic mice. Neurobiol Dis. 17, 516 (2004).
- Holcomb, L., et al. Accelerated Alzheimer-type phenotype in transgenic mice carrying both mutant amyloid precursor protein and presenilin 1 transgenes. Nat Med. 4, 97 (1998).
- Lewis, J., et al. Neurofibrillary tangles, amyotrophy and progressive motor disturbance in mice expressing mutant (P301L) tau protein. Nat Genet. 25, 402 (2000).
- DeMattos, R. B., et al. Plaque-associated disruption of CSF and plasma amyloid-beta (Abeta) equilibrium in a mouse model of Alzheimer's disease. J Neurochem. 81, 229 (2002).
- Planel, E., et al. Anesthesia leads to tau hyperphosphorylation through inhibition of phosphatase activity by hypothermia. J Neurosci. 27, 3090 (2007).
- Refolo, L. M., et al. A cholesterol-lowering drug reduces beta-amyloid pathology in a transgenic mouse model of Alzheimer's disease. Neurobiol Dis. 8, 890 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados