Химические реакции часто происходят поэтапно, включая две или более отдельных реакции, происходящих в последовательности. Сбалансированное уравнение указывает на участники реакции и вид продукта, но не показывает подробностей о том, как происходит реакция на молекулярном уровне. Механизм реакции (или путь реакции) предоставляет подробные сведения о точном пошаговом процессе, при котором происходит реакция.
Например, распад озона, как представляется, происходит в рамках механизма, который состоит из двух этапов:
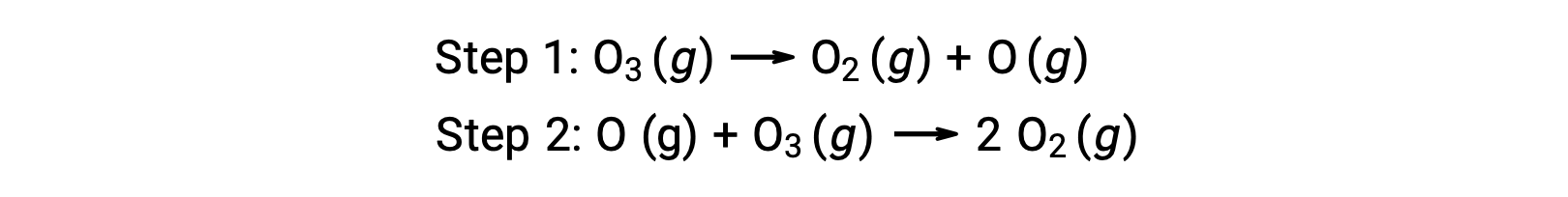
Каждый из шагов в механизме реакции называется элементарной реакцией. Эти элементарные реакции происходят последовательно, как показано в уравнениях шага, и они суммируют, чтобы получить сбалансированное химическое уравнение, описывающее общую реакцию:
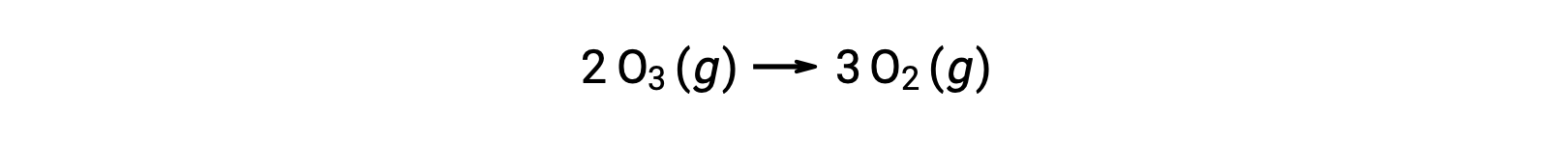
Обратите внимание, что атом кислорода, производимый на первом этапе, потребляется во втором и не появляется как продукт в общей реакции. Такие виды, которые производятся за один шаг и потребляются в последующем, называются промежуточными реакциях.
В то время как общее уравнение реакции указывает на то, что две молекулы озона реагируют на три молекулы кислорода, механизм фактической реакции не предполагает прямого столкновения и реакции двух молекул озона. Вместо этого, один O3 разлагается для получения O2 и атома кислорода, а вторая молекула O3 впоследствии вступает в реакцию с атомом кислорода, чтобы получить две дополнительные молекулы O2.
В отличие от сбалансированных уравнений, представляющих общую реакцию, уравнения для элементарных реакций являются явными представлениями химического изменения. Элементарное реактивное уравнение показывает фактическую реактант (ы), которые подвергаются разрыву/изготовление связей, и сформированные продукты. Таким образом, закон нормы для элементарной реакции может быть получен непосредственно из его сбалансированного химического уравнения. Однако это не относится к типичным химическим реакциям, для которых законы о норме могут быть достоверно определены только путем экспериментов.
Элементарные реакции Unimolecular
Молекулярная структура элементарной реакции — это количество видов реагент (атомов, молекул или ионов). Например, одномолекулярная реакция включает в себя реакцию одного реагент на создание одной или нескольких молекул продукта:

Закон нормы для неимолеккулярной реакции — первый порядок; Rate = k [A].
Одномолекулярная реакция может быть одной из нескольких элементарных реакций в сложном механизме реакции. Например, реакция (O3 (g) → O2 (g) + O) иллюстрирует одномолекулярную элементарную реакцию, которая происходит как часть двухступенчатого механизма реакции. Однако некоторые одномолекулярные реакции могут быть единственным шагом одношагового механизма реакции. (Другими словами, в некоторых случаях «общая» реакция также может быть элементарной.) Например, газфазное разложение циклобутана, C4H8, на этилен, C2H4, представлено химическим уравнением:
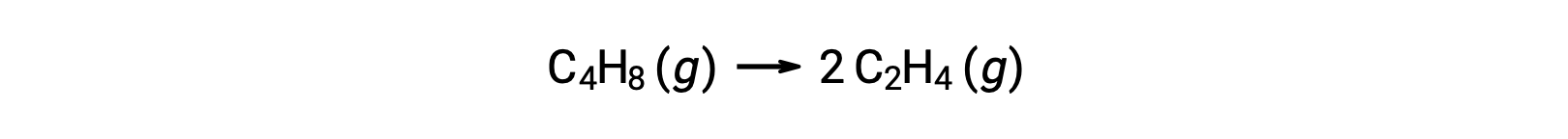
Это уравнение представляет собой общую реакцию, описывающую неимимолекулярный элементарный процесс. Закон ставок, предсказанный из этого уравнения, предполагая, что это элементарная реакция, оказывается таким же, как закон ставок, полученный экспериментально для общей реакции, показывающий поведение первого порядка:
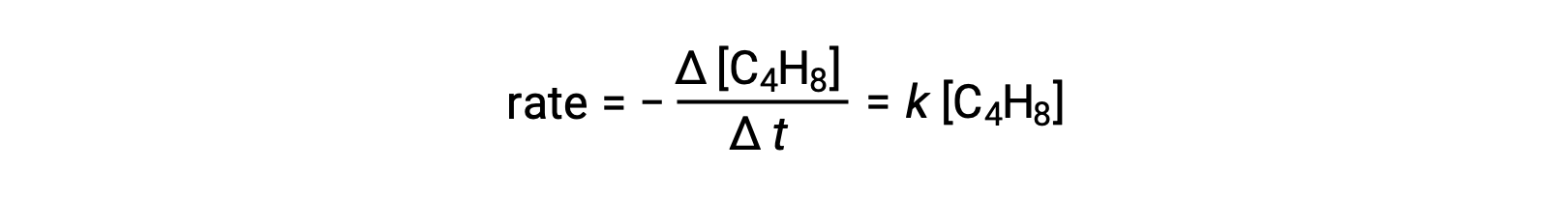
Это соглашение между наблюдаемыми и прогнозируемыми законами о норме ставок указывает на то, что предлагаемый одноэтапный одноэтапный процесс является разумным механизмом для реакции бутадиена.
Элементарные реакции на бимолекулярные
Биметокулярная реакция включает два вида реагент. Например:
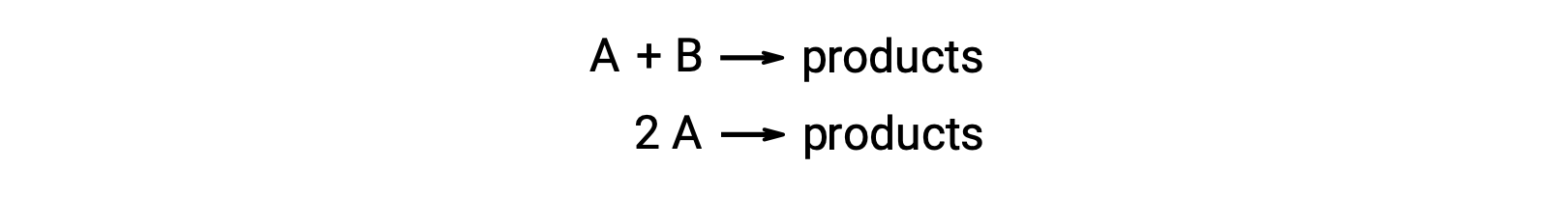
В первом типе, где две молекулы реагент различаются, закон скорости является первым в A и первым в B (общий второй порядок)
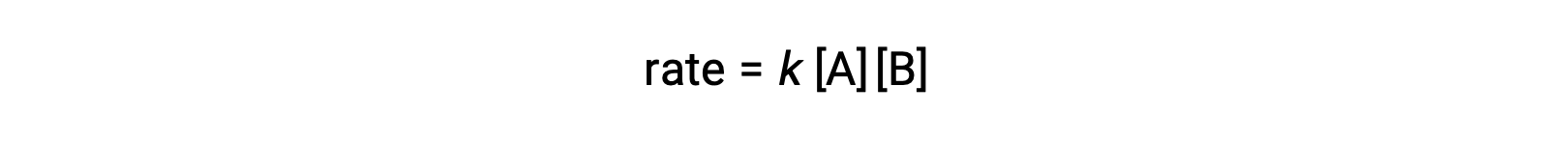
Во втором типе, в котором сталкиваются и реагируют две идентичные молекулы, закон скорости является вторым порядком в:
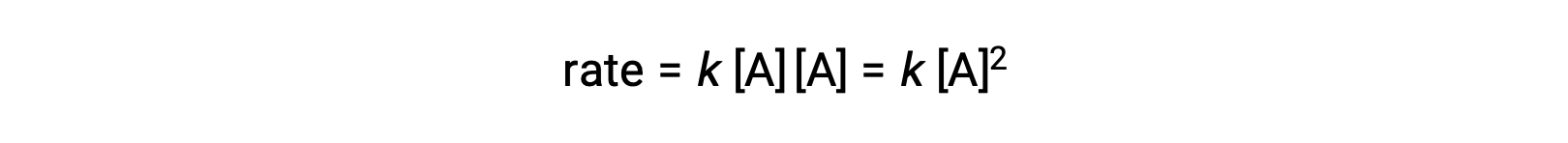
Некоторые химические реакции возникают механизмами, состоящим из одной биметолеккулярной элементарной реакции. Одним из примеров является реакция диоксида азота с угарным газом:
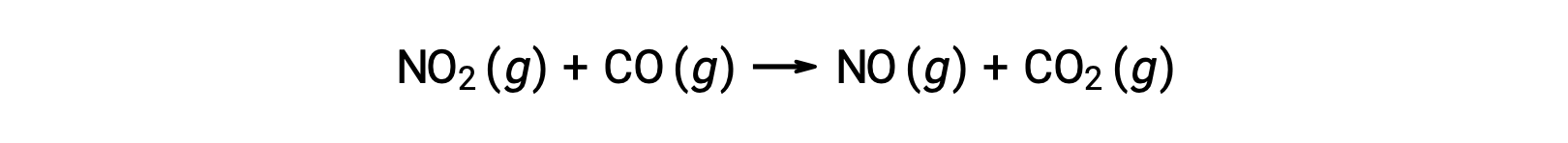
Биметолеккулярные элементарные реакции также могут быть задействованы в качестве шагов в многошаговом механизме реакции. Реакция атомного кислорода с озоном является вторым шагом двухступенчатого механизма разложения озона:
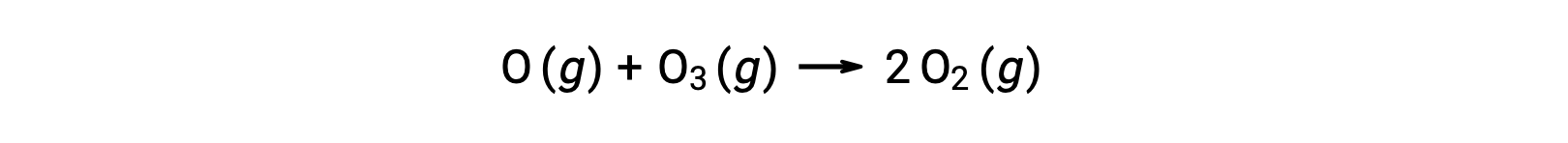
Термолекулярные элементарные реакции
Элементарная термолекулярная реакция включает одновременное столкновение трех атомов, молекул или ионов. Термолекулярные элементарные реакции редки, потому что вероятность одновременного столкновения трех частиц очень редка. Однако, есть несколько устоявшихся термолекулярных элементарных реакций. Реакция оксида азота с кислородом, как представляется, включает в себя термолекулярные шаги:
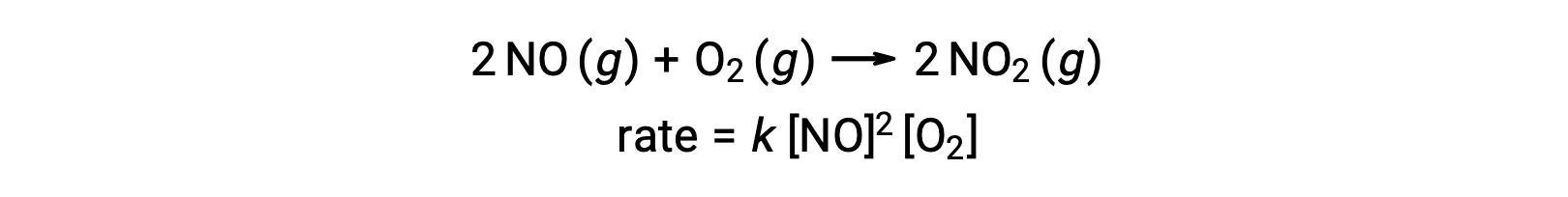
Аналогично, реакция оксида азота с хлором, как представляется, включает в себя термолекулярные шаги:
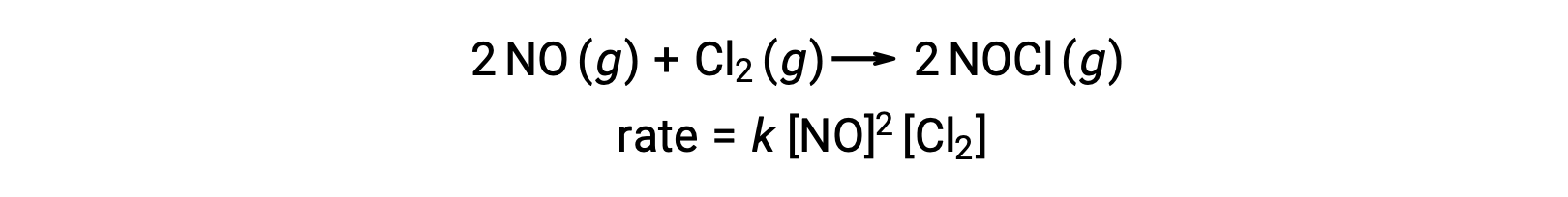
Часто один из элементарных шагов в многошаговом механизме реакции значительно медленнее, чем другие. Поскольку реакция не может быть более быстрой, чем ее самый медленный шаг, этот шаг ограничит скорость, с которой происходит общая реакция. Таким образом, самый медленный элементарный шаг называется шагом ограничения скорости (или шагом определения скорости) реакции.
Этот текст адаптирован из Openstax, Химия 2е изд., 12.6: Механизмы реакции.
Теги
Из главы 13:

Now Playing
13.9 : Механизмы реакции
Химическая кинетика
24.6K Просмотры

13.1 : Скорость реакции
Химическая кинетика
49.9K Просмотры

13.2 : Измерение скорости реакции
Химическая кинетика
23.7K Просмотры

13.3 : Закон о концентрации и скорости
Химическая кинетика
29.2K Просмотры

13.4 : Определение порядка реакции
Химическая кинетика
54.1K Просмотры

13.5 : Закон интегрированной скорости: зависимость концентрации от времени
Химическая кинетика
33.5K Просмотры

13.6 : Период полураспада реакции
Химическая кинетика
33.4K Просмотры

13.7 : Зависимость температуры от скорости реакции
Химическая кинетика
80.2K Просмотры

13.8 : Графики Аррениуса
Химическая кинетика
37.2K Просмотры

13.10 : Шаги, определяющие скорость
Химическая кинетика
30.9K Просмотры

13.11 : Катализ
Химическая кинетика
26.0K Просмотры

13.12 : Ферменты
Химическая кинетика
79.8K Просмотры
Авторские права © 2025 MyJoVE Corporation. Все права защищены