Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Эмбриональных стволовых клеток-производных эндотелиальных клеток для лечения ишемии задней конечности
Резюме
Хирургические процедуры на поставку эмбриональных стволовых клеток эндотелиальных клеток ишемического задних конечностей свидетельствует, с неинвазивным путем отслеживания биолюминесценции изображений.
Аннотация
Заболевания периферических артерий (PAD) обусловлено сужением периферических артерий, которые снабжают кислородом кровь и питательные вещества для ног и ступней, Эта патология вызывает симптомы, такие как перемежающаяся хромота (боль при ходьбе), болезненные язвы ишемический, или даже опасным для конечностей гангрены. Считается, что эндотелий сосудов, монослой эндотелиальных клеток, которые инвестирует просвета поверхность всех кровеносных и лимфатических сосудов, играет доминирующую роль в сосудистой гомеостаза и сосудистой регенерации. В результате, на основе стволовых клеток регенерации эндотелия может быть перспективным для лечения PAD.
В этом видео, мы демонстрируем трансплантации эмбриональных стволовых клеток (ЭСК)-производные эндотелиальных клеток для лечения одностороннего hindimb ишемии как модель PAD, а затем неинвазивного отслеживания клеточных самонаведения и выживание биолюминесценции изображений. Конкретные материалы и процедуры для доставки клеток и изображения будут описаны. Этот протокол следует за другой публикации в описании индукции задних конечностей ишемии Niiyama и др. 1.
протокол
1. Дифференциация мышиных ЭСК в клетки эндотелия
- Протокол для дифференциации стволовых клеток в клетки эндотелия описана в другом месте и не является предметом этого протокола 2,3. Короче говоря, ячейки могут дифференцироваться, и клетки, которые являются положительными для эндотелиальных маркеров, таких как CD31 или эндотелия сосудов кадгерина (VE-кадгерина) затем очищают флуоресценции активирован сортировки клеток (FACS).
2. Строительство Дважды Гена Reporter Fusion и лентивирусов трансдукция
- Биолюминесценция может быть использована для отслеживания клетки, которые были изменены, чтобы выразить репортер генов, таких как люциферазы светляков (флуктуации). Для этого приложения, наши клетки содержат как флуктуации и более зеленая флуоресценция белка (EGFP) слияние генов под контролем внутренних убиквитин промоутера. Для изменения клеток, трансгенов лентивирусов вектор, содержащий ключевые генетические элементы оптимизированы для выполнения биологической безопасности критериев, а также увеличить эффективность трансдукции, PFU-ФГ вектор разработанный в нашей лаборатории проведения флуктуации EGFP слияние репортер ген может быть использован для стабильно трансдукции клеток после дифференциации. Это слияние позволяет построить как биолюминесценции и флуоресценции отслеживание пересаженных клеток. Процедура для создания вирусных частиц, трансдукция и производства меченых клеток, что гены выразить репортер описана в другом месте 4.
3. Трансплантация ESC полученных эндотелиальных клеток ишемического задних конечностей
- Начните процедуру подготовки мышь, которая претерпела задних конечностей ишемии для клеточной трансплантации. Для этого поместите мышь в камере анестезии индукции содержащие 1-3% изофлуран в 100% кислорода при скорости потока 1L/min.
- Оставьте мышь в индукции камере, пока он не реагирует на внешние раздражители. Затем удалите животное от индукции камеры.
- Затем поместите животное в положении лежа на операционном столе и подключить его к непрерывным потоком 1-3% изофлуран в 100% кислорода при скорости потока 1L/min.
- Протрите кожу задней конечности с тремя переменного бетадин и алкоголя скрабов.
- После того как кожа очищена, получить один миллион ESC полученных эндотелиальных клеток в 30 мкл фосфатно-солевым буфером (PBS). Нагрузка этих клеток в 28 иглы.
- Когда клетки готовы, осторожно поднимите и расширить задние конечности, чтобы лучше представить себе расположение икроножной мышцы. Хотя нога расширяется, вставить иглу через кожу в основные мышцы. Будьте осторожны, не приближаться к кости. Аккуратно и медленно вводят 30 мкл смеси клетки в икроножных. Для внутримышечных инъекций, 30 мкл близок к пределу объем, который может быть введен. Таким образом, 28-калибровочного шприца инсулина являются предпочтительными, поскольку, по нашему опыту, они устраняют потерю объема в шприц иглой.
- После инъекции завершения возвращения мыши восстановления клетки и наблюдать за ним непрерывно, пока не проснулись. Разрешить животных восстановить в течение нескольких часов, а затем продолжить в естественных изображений биолюминесценции пересаженных клеток.
4. Биолюминесценция изображений ESC полученных эндотелиальных клеток в естественных условиях
- Трансплантированных ЭСК полученных endothelials клетки были изменены, чтобы выразить как флуктуации и ген EGFP слияния под контроль внутренний убиквитин промоутера. Таким образом, биолюминесценции может быть использована для отслеживания клеток в ишемического задних конечностей.
- Чтобы начать этот шаг, включения системы биолюминесценции изображений и живой образ приобретение программного обеспечения. Затем инициализации системы сбора и указать размеры поля зрения.
- Далее, поместите черную матовой бумаге на окне изображения для поглощения фонового излучения.
- После визуализации окно будет готово, место мышь в камере анестезии индукции содержащие 1-3% изофлуран в кислороде при выходе 1L/min. Оставьте мышь в индукции камере, пока он не реагирует на внешние раздражители. Затем удалите животное от индукции камеры.
- Удаление волос с обеих задних конечностей использованием электробритвы по мере необходимости.
- Inject 10 мкл D-люциферин на грамм массы тела в брюшной полости. D-люциферин готовится заранее в фильтруются растворы 15 мг / мл в PBS.
- После люциферин вводится, место животного в окне изображения на черной бумаге, в положении лежа на спине, связанные с непрерывным потоком изофлуран.
- Размещение животных в окне изображения и подключение к изофлуран.
- Начните получать изображения в течение 10-60 секунд, чтобы определить оптимальное время воздействия, для которых изображение не насыщен. Если изображение становится насыщенным, уменьшить время экспозиции. Если биолюминесценции сигнал очень слабый, увеличение времени экспозиции.
- Усинг Оптимальное время экспозиции, продолжим приобретать фотографии каждые 1-3 минут, пока сигнал достигает максимума, а затем исчезает. При приобретении завершена, сохраните файл.
- Для анализа данных, выберите регионах, представляющих интерес (трансформирования), которые охватывают месте инъекции. В качестве отрицательного контроля, аналогичные ROI может быть выбран для неоперированных ногу. Использование программного обеспечения, измерения общего сияние, которое выражается в единицах фотонов / сек / см 2 / стерадиан (р / с / см 2 / ср), для трансформирования для каждого timepoint. Максимальное значение должно использоваться в окончательные данные. Данные также могут быть экспортированы в таблицы Excel для дальнейшего использования.
- После того как все данные приобретается, вернуть животное восстановления клетки и контролировать непрерывно, пока животное просыпается.
- Повторите эту процедуру для отслеживания клетки с течением времени.
- В нужное время точки, животное может быть умерщвлены для оценки функции ткани.
5. Представитель Результаты
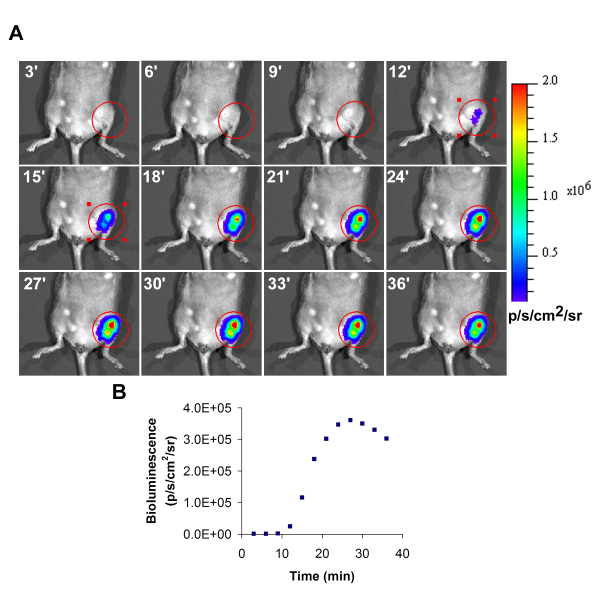
Изображение представитель биолюминесценции трансплантированных клеток в левой задней конечности ишемической показано на рисунке 1. Во время приобретения биолюминесценции, интенсивность будет возрастать со временем, а максимальное значение полученные во время курса должны быть представлены в качестве окончательного значения.
Обсуждение
ЭСК являются перспективным источником ячейки для лечения ишемии тканей из-за своей пластичности дифференциации и их способность вызывать ячейки линий включающий все три зародышевых листков, в том числе эндотелиальных клеток. Чтобы преодолеть этические проблемы, связанные с стволовых клеток, ин...
Благодарности
Авторы выражают благодарность Андреа Акстелл, Сатоши Ито, доктор медицинских наук, Джефф Velotta, доктор медицинских наук, Грант Хойт, Роберт С. Роббинс, доктор медицинских наук, Цзинь Юй, доктор медицинских наук, Тим Дойл, кандидат наук, и Стэнфордского небольшое ядро изображениями животных для оказания технической помощи. Авторы также выражают благодарность А. М. Бикфорд, Inc для поддержки ветеринарное оборудование. Это исследование было поддержано исследовательских грантов от Национального института здоровья (R01 HL-75774, R01 CA098303, R21 HL085743, 1K12 HL087746), Табак Калифорнии соответствующей программы исследований Заболевание Калифорнийского университета (15IT-0257 и 1514RT-0169) , и Калифорнийского института регенеративной медицины (RS1-00183).
NH поддерживает общение с Американской ассоциации сердца. может кардиологической ассоциации.
Материалы
| Name | Company | Catalog Number | Comments | |
| Surgical tools | Tool | Fine Science Tools | ||
| Syringe needle | Tool | BD Biosciences | 28G insulin syringe is preferred | |
| Phosphate Buffered Saline | Reagent | Invitrogen | ||
| D-luciferin | Reagent | Biosynth International, Inc | Prepare D-luciferin in advance into filtered stock solutions of 15 mg/mL in PBS | |
| IVIS 200 Bioluminescence imaging system and acquisition software | Equipment |  Xenogen Corporation Xenogen Corporation |
Ссылки
- Niiyama, H., Huang, N. F., Rollins, M., Cooke, J. P. Murine model of hindlimb ischemia. JoVE. , (2008).
- Levenberg, S., Golub, J. S., Amit, M., Itsakovitz-Eldor, J., Langer, R. Endothelial cells derived from human embryonic stem cells. Proc. Natl. Acad. Sci. U.S.A. 99, 4391-4396 (2002).
- Yamashita, J., Itoh, H., Hirashima, M., Ogawa, M., Nishikawa, S., Yurugi, T., Naito, M., Nakao, K., Nishikawa, S. Flk1-positive cells derived from embryonic stem cells serve as vascular progenitors. Nature. 408, 926-926 (2000).
- De, A., Yaghoubi, S. S., Gambhir, S. S. Applications of lentiviral vectors in noninvasive molecular imaging. Methods Mol Biol. 433, 177-202 (2008).
- Niiyama, H., Kai, H., Yamamoto, T., Shimada, T., Sasaki, K., Murohara, T., Egashira, K., Imaizumi, T. Roles of endogenous monocyte chemoattractant protein-1 in ischemia-induced neovascularization. J. Am. Coll. Cardiol. 44, 661-666 (2004).
- Cook, M. J. The anatomy of the laboratory mouse. , (1976).
- Contag, P. R., Olomu, I. N., Stevenson, D. K., Contag, C. H. Bioluminescent indicators in living mammals. Nature Med. 4, 245-247 (1998).
- Ray, P., De, A., Min, J. J., Tsien, R. Y., Gambhir, S. S. Imaging tri-fusion multimodality reporter gene expression in living subjects. Cancer Res. 64, 1323-1330 (2004).
- Huang, N. F., Lee, R. J., Li, S. Chemical and physical regulation of stem cells and progenitor cells: potential for cardiovascular tissue engineering. Tissue Eng. 13, 1809-1823 (2007).
- Cao, F., Lin, S., Xie, X., Ray, P., Patel, M., Zhang, X., Drukker, M., Dylla, S. J., Connolly, A. J., Chen, X., Weissman, I. L., Gambhir, S. S., Wu, J. C. In vivo visualization of embryonic stem cell survival, proliferation, and migration after cardiac delivery. Circulation. 113, 1005-1114 (2006).
- Wilson, K., Yu, J., Lee, A., Wu, J. C. In vitro and in vivo bioluminescence reporter gene imaging of human embryonic stem cells. J Vis Exp. , (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены